Method Article
Lymphadénectomie inguinale laparoscopique modifiée par voie sous-cutanée abdominale
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
L’efficacité du curage ganglionnaire inguinal laparoscopique est comparable à celle de la chirurgie ouverte. Il diminue également considérablement l’incidence des complications. Dans cette étude, une méthode laparoscopique modifiée a été utilisée pour le curage ganglionnaire inguinal par voie sous-cutanée abdominale pour le traitement du cancer du pénis.
Résumé
Les métastases ganglionnaires inguinales ont un impact significatif sur le pronostic des patients atteints d’un cancer du pénis. Par conséquent, le curage ganglionnaire inguinal en temps opportun est essentiel pour le traitement complet du cancer du pénis. Par rapport à la lymphadénectomie inguinale ouverte traditionnelle, la lymphadénectomie inguinale laparoscopique offre un contrôle tumoral similaire avec moins de complications. Les techniques actuelles d’approche chirurgicale laparoscopique comprennent la séquence de clairance lymphoïde L et la préservation de la grande veine saphène. Dans cette étude, une approche antérograde sous-cutanée transabdominale a été utilisée pour améliorer la dissection laparoscopique des ganglions lymphatiques inguinaux et conserver la grande veine saphène, ce qui a donné des résultats favorables. De plus, seulement 2 patients sur 21 ont présenté des infections de la plaie et seulement 1 a présenté une fuite lymphatique de l’orifice de drainage. Ces résultats indiquent que l’utilisation d’une approche rétrograde transpéritonéale sous-cutanée innovante est sans danger pour la dissection endoscopique abdominale du plexus iliaque commun, avec moins de complications chez les patients atteints d’un cancer du pénis par rapport à la chirurgie ouverte traditionnelle. Notamment, le taux de survie postopératoire des patients atteints d’un cancer du pénis est significativement influencé par la présence ou l’absence de métastases ganglionnaires inguinales et l’étendue des métastases. Un curage ganglionnaire inguinal en temps opportun est essentiel car il a un impact significatif sur le traitement du cancer du pénis. En outre, la lymphadénectomie inguinale laparoscopique offre un contrôle tumoral comparable à la chirurgie ouverte avec des complications considérablement réduites. Notamment, les approches standardisées pour la chirurgie laparoscopique, les procédures de nettoyage et la préservation de la veine saphène sont cruciales pour le curage ganglionnaire inguinal. La technique de lymphadénectomie inguinale laparoscopique peut être améliorée en utilisant l’approche antérograde sous-cutanée abdominale. Cet article fournit un compte rendu complet des procédures et des améliorations techniques associées à la lymphadénectomie inguinale laparoscopique modifiée à l’aide de l’approche sous-cutanée abdominale.
Introduction
Le cancer du pénis est une tumeur maligne du système génito-urinaire relativement rare, le carcinome épidermoïde représentant environ 95 % des cas. Le cancer du pénis se propage principalement par le système lymphatique, le site initial de dissémination étant les ganglions lymphatiques inguinaux1. Les ganglions lymphatiques inguinaux superficiels et profonds sont les principaux sites régionaux de propagation du cancer du pénis, suivis des ganglions lymphatiques pelviens, qui comprennent les ganglions lymphatiques iliaques externes et internes, avec des métastases rares. Outre le grade et le stade de la tumeur primitive, la présence et l’étendue des métastases ganglionnaires inguinales affectent le pronostic du cancer du pénis2. Par conséquent, le curage ganglionnaire radical en temps opportun est essentiel pour améliorer les taux de survie.
Un curage ganglionnaire inguinal en temps opportun peut améliorer le taux de survie à 5 ans des patients atteints d’un cancer du pénis de 30 % à 40 % à 80 % à 90 % après la métastase. Les directives actuelles de traitement du cancer du pénis recommandent une lymphadénectomie inguinale, l’ablation des ganglions inguinaux palpables ou l’ablation des ganglions inguinaux inaccessibles. Bien que le curage ganglionnaire inguinal ouvert soit efficace, il est significativement associé à un taux élevé d’infection par incision postopératoire, de retard de guérison, de nécrose cutanée, de lymphœdème, d’œdème des membres inférieurs et d’autres complications 3,4. En outre, il n’est pas clair si le curage ganglionnaire inguinal prophylactique prophylactique en temps opportun est bénéfique en raison de nombreuses complications causées par le curage ganglionnaire inguinal5.
Une étude antérieure a rapporté que le curage ganglionnaire inguinal prophylactique devrait être envisagé pour les patients atteints de ganglions lymphatiques impalpables, car 25 % d’entre eux peuvent être porteurs d’une maladie micrométastatique. Une stadification ganglionnaire invasive est nécessaire chez les patients atteints d’une maladie cliniquement sans envahissement ganglionnaire (cN0). La stadification invasive des ganglions lymphatiques peut être réalisée par biopsie dynamique du ganglion sentinelle ou lymphadénectomie inguinale modifiée pour les tumeurs pT1 et T2-T4 à risque intermédiaire6.
Les techniques mini-invasives laparoscopique ont été largement utilisées ces dernières années pour le curage ganglionnaire inguinal, ce qui a permis un contrôle tumoral comparable à celui de la chirurgie ouverte7 et une réduction significative des complications 8,9,10. Notamment, les approches standardisées pour la chirurgie laparoscopique, les procédures de nettoyage et la préservation de la grande veine saphène sont cruciales pour le curage ganglionnaire inguinal 11,12,13.
L’approche antérograde sous-cutanée transabdominale peut améliorer le curage ganglionnaire inguinal laparoscopique et préserver la veine saphène. Ce manuscrit fournit une explication détaillée de la procédure et des avancées techniques associées à l’approche sous-cutanée transabdominale laparoscopique modifiée pour le curage ganglionnaire inguinal antérograde. L’objectif est de présenter une approche chirurgicale améliorée pour réduire l’incidence des complications postopératoires telles que la nécrose cutanée, le retard de cicatrisation des plaies, le lymphœdème et l’œdème des membres inférieurs.
Protocole
Cette étude a été approuvée par le Conseil d’examen institutionnel de l’Hôpital populaire provincial de Hainan, et tous les participants ont fourni un consentement éclairé écrit.
1. Évaluation du patient
- Recrutez pour l’étude des patients qui ont reçu un curage ganglionnaire inguinal pour un cancer du pénis entre 1994 et 2022 en utilisant les critères suivants. Au total, 21 patients ont été inclus, et leurs détails clinicopathologiques et démographiques sont présentés dans le tableau 1. Assurez-vous que les chirurgies sont effectuées par la même équipe chirurgicale par laparoscopie.
- Utilisez les critères d’inclusion suivants :(1) Diagnostic pathologique confirmé de cancer du pénis ; (2) Présence d’une lésion locale à haut risque avec des ganglions lymphatiques actifs palpables dans la région de l’aine ou pas de ganglions lymphatiques palpables dans la région de l’aine mais une biopsie dynamique positive du ganglion sentinelle ; (3) Lésion locale à risque moyen ou faible avec des ganglions lymphatiques actifs palpables dans la région de l’aine. Les métastases ganglionnaires sont confirmées par l’excision des ganglions lymphatiques inguinaux ou la biopsie par aspiration à l’aiguille fine.
- Utilisez les critères d’exclusion suivants : (1) Comorbidité de troubles cardiovasculaires ou de coagulation avec contre-indications à la chirurgie ; (2) Infection ulcéreuse dans les ganglions lymphatiques inguinaux ; (3) Radiothérapie locale préopératoire dans la région de l’aine ; (4) Métastases à distance ; (5) Évaluation échographique préopératoire des vaisseaux sanguins des membres inférieurs révélant des maladies veineuses profondes telles que la thrombose ou l’insuffisance valvulaire veineuse ; (6) Ganglions lymphatiques inguinaux fixes.
- Effectuer une biopsie ou une résection avant la chirurgie pour confirmer la présence d’un cancer du pénis chez tous les patients inscrits. Utilisez la mise à jour 2023 de la directive collaborative EAU (European Association of Urology)-American Society of Clinical Oncology sur la classification du cancer du pénis pour classer le patient6.
- Dans la présente étude, 1 des 21 patients a été classé au stade I, 4 cas au stade IIA, 2 cas au stade IIB, 4 cas au stade IIIB, 2 cas au stade IIIA et 8 cas au stade IV. Parmi eux, 1 patient souffrait de diabète et 1 patient souffrait d’hypertension et d’un infarctus cérébral antérieur.
- Effectuer des examens physiques et urinaires, un électrocardiogramme (ECG), une radiographie thoracique et des tests de laboratoire. Considérez comme contre-indications les maladies non résécables, qui comprennent les métastases au-delà des ganglions lymphatiques pelviens, et les patients atteints de maladies systémiques graves telles que le dysfonctionnement de la coagulation et les maladies cardiaques graves qui ne tolèrent pas la chirurgie.
2. Positionnement, placement de l’orifice du trocart et marquage des limites anatomiques
- Positionnement
- Avant la chirurgie, placez un cathéter à double lumière dans l’urètre. Administrer une anesthésie générale et positionner le patient en position couchée, la tête baissée et les hanches surélevées à un angle de 10°-20°. Fléchissez le genou sur leurs côtés et abductez les hanches.
- Placement de l’orifice du trocart
- Après la désinfection du site chirurgical et la mise en place d’une serviette stérile, faites une incision longitudinale à 1 cm sous l’ombilic à l’aide d’un scalpel pour couper la peau et les tissus sous-cutanés, y compris le fascia de Camper, le fascia de Scarpa, en confirmant la gaine du droit antérieur.
- Créez un long tunnel le long de la surface d’aponévrose de l’oblique externe vers le ligament inguinal à l’aide de l’index. Utilisez un ballon conçu sur mesure dans le but de dilater et de créer un espace sous-cutané. Conservez un port métallique de 12 mm à cette incision pour servir de trou de lentille.
- Procédez à la dissection des ganglions lymphatiques inguinaux droits à l’aide d’un scalpel à ultrasons et insufflez l’espace sous-cutané du pneumopéritoine avec du CO2 à 12-15 mmHg pour distendre rapidement l’espace. Placez un port de 5 mm au milieu de la ligne pubienne de l’ombilic et un port de 10 mm au milieu entre l’ombilic et l’épine iliaque droite antérieure supérieure.
- Placez un port de 5 mm au milieu de l’épine iliaque antéro-supérieure gauche de l’ombilic. Établissez et maintenez quatre trous de perforation des deux côtés. Répétez l’étape 2.2.3 et dégagez les ganglions lymphatiques de la région inguinale gauche (Figure 1A, B).
- Délimitez les limites anatomiques pour le curage ganglionnaire inguinal, respectez les directives suivantes : positionnez la limite supérieure à 1 cm au-dessus du ligament inguinal, alignez la limite interne avec le bord latéral du muscle long adducteur, correspondant à la limite externe du bord médial du muscle sartorius, et localisez la limite inférieure à l’apex du triangle fémoral. Marquez la zone de clairance inguinale bilatérale (figure 1C).
3. Interventions chirurgicales
- Identifiez le ligament inguinal : Localisez et disséquez le ligament inguinal vers le bas, en le séparant entre la surface aponévrotique de l’oblique externe et le fascia de Scarpa. Localisez la position du ligament inguinal en appliquant une pression à l’aide d’un assistant, dissociez-vous complètement et exposez le ligament inguinal (Figure 2A).
- Recherche de la racine de la veine saphène : Avec l’aide de l’assistant, tirez sur le cordon spermatique, suivez le chemin le long de la surface du ligament inguinal, puis relâchez-le vers le bas pour localiser, confirmer et libérer la racine de la grande veine saphène, là où elle rejoint la veine fémorale (Figure 2B).
- Établir et élargir la fosse médiale et latérale : Établir et élargir l’aire de répartition sur les côtés interne et externe le long de la racine de la grande veine saphène en adhérant étroitement au fascia lata de la cuisse. L’assistant doit appuyer sur les marques d’origine et s’assurer que la plage de dégagement sur les côtés intérieur et extérieur est suffisamment grande (Figure 2 C,D).
- Disséquer les ganglions lymphatiques profonds : Procéder le long de la racine de la veine saphène pour confirmer l’emplacement du vaisseau fémoral. Coupez la gaine antérieure du vaisseau sanguin fémoral, libérez la racine de la grande veine saphène, la veine fémorale, le canal fémoral et la surface de l’artère fémorale. Nettoyez la face interne de la veine fémorale et les ganglions lymphatiques à l’intérieur du canal fémoral (ganglions lymphatiques de Cloquet) et prélevez les ganglions lymphatiques du groupe profond dégagés pour un examen pathologique rapide. S’il est positif, dégagez les ganglions lymphatiques pelviens (Figure 2 E,F).
- Disséquer les ganglions lymphatiques superficiels et préserver le tronc principal de la grande veine saphène :
Libérer la grande veine saphène de sa racine et libérer complètement toute sa longueur, y compris ses cinq affluents.- En partant de la racine de la grande veine saphène, descendez et libérez toute la grande veine saphène et ses cinq affluents. Tout d’abord, libérez et coupez la veine circonflexe iliaque superficielle et la veine pudendale interne. Nettoyez les ganglions lymphatiques superficiels de l’espace fascial de Camper de la peau, identifiez, libérez et ligaturez la veine épigastrique superficielle, la veine saphène du côté médial de la cuisse et la veine saphène du côté latéral de la cuisse tout en préservant le tronc principal de la grande veine saphène.
- Identifier, libérer et ligaturer les veines superficielles de la paroi abdominale, de la cuisse médiale et de la cuisse latérale tout en préservant le tronc principal de la grande veine saphène.
- En cas de gros vaisseaux lymphatiques, reportez la cautérisation pour minimiser les fuites lymphatiques postopératoires. Divisez le groupe superficiel nettoyé de ganglions lymphatiques en deux sections, en utilisant la grande veine saphène comme limite, et extrayez chaque section dans des sacs d’échantillons séparés (figure 2G-I).
- Traitement postopératoire : Traitez la plaie pour obtenir une hémostase complète et placez une bille de drainage à pression négative au point le plus bas de l’incision pour faciliter l’aspiration du liquide par pression négative. Appliquez une pression et des pansements appropriés sur la région inguinale. Administrer des médicaments pour prévenir l’infection et soulager la douleur pendant le séjour à l’hôpital du patient.
Résultats
L’âge moyen des patients inclus était de 55 ans (extrême : 31-79 ans). La sonde urinaire a été retirée entre le 7et le 8e jour après l’opération. La durée moyenne du séjour à l’hôpital après l’opération était de 14 jours. Après l’opération, 3 patients ont présenté une nécrose des lésions génitales externes et 4 patients ont présenté des fuites lymphatiques. Les fuites lymphatiques ont été résolues avec succès grâce à un drainage continu, ce qui a entraîné une durée moyenne prolongée. Tous les participants ont subi un curage ganglionnaire de l’aine par laparoscopie. Les détails et les résultats chirurgicaux spécifiques sont présentés dans le tableau 2. La durée moyenne des chirurgies laparoscopique unilatérale et bilatérale était de 146 min (90-180 min) et 182 min (115-220 min), respectivement. Les chirurgies unilatérales et bilatérales ont entraîné une perte de sang moyenne de 10 ml (5,0 à 20 ml) et de 22 ml (5,0 à 100 ml), respectivement.
Dans cette analyse statistique, en raison du nombre limité de cas, certains patients présentant des fuites lymphatiques et des infections d’incision combinées ont également été inclus dans la cohorte de l’étude, ce qui a entraîné un déséquilibre dans la durée moyenne d’hospitalisation. Par exemple, dans le tableau 2, parmi les patients qui ont subi un curage ganglionnaire bilatéral, le séjour à l’hôpital le plus court était de 6 jours, tandis que les séjours à l’hôpital pour les patients présentant des fuites lymphatiques postopératoires et des infections par incision étaient de 18 jours, 17 jours et 22 jours, respectivement. Cela a prolongé la durée moyenne d’hospitalisation et a entraîné un déséquilibre dans les données.
En moyenne, 12 ganglions (2-39) ont été enlevés lors du curage ganglionnaire (figure 3C). L’analyse histologique a permis de vérifier la présence de ganglions inguinaux positifs chez 7 patients. Sur 21 cas, 14 ont été classés comme carcinomes épidermoïdes bien différenciés (figures 3A, B), 3 comme modérément différenciés (figure 3D), 1 comme carcinome verruqueux et 1 comme carcinome épidermoïde kératinisant.
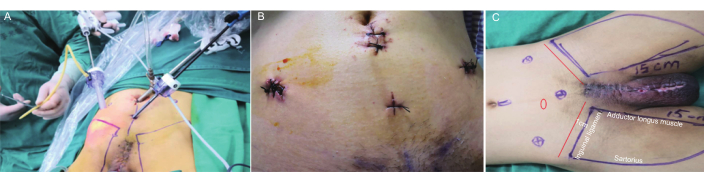
Figure 1 : Placement du trocart et marquage des limites anatomiques. (A) Placement peropératoire du trocart. (B) Placement postopératoire du trocart. (C) Marquage des limites anatomiques. Limite supérieure à 1 cm au-dessus du ligament inguinal, limite interne au bord latéral du muscle long adducteur, limite externe au bord médial du sartorius et limite inférieure à l’apex du triangle fémoral. Veuillez cliquer ici pour voir une version agrandie de cette figure.
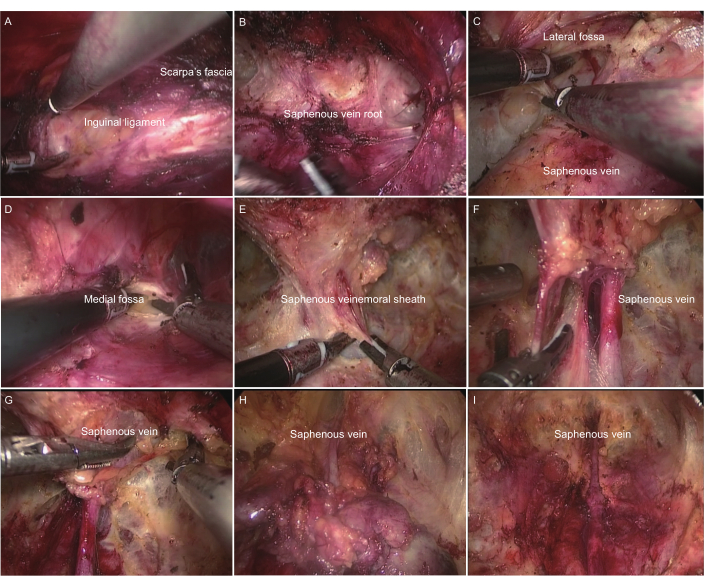
Figure 2 : Procédure de curage ganglionnaire inguinal transabdominal modifié. (A) Identification du ligament inguinal. (B) Identification de la racine de la veine saphène. (C) Établissement et expansion de la fosse latérale. (D) Établissement et expansion de la fosse médiale. (E) Couper la gaine fémorale. (F) Dissection des ganglions lymphatiques profonds : veine saphène et veine de l’artère fémorale. (G) Dissection des ganglions lymphatiques superficiels : la racine de la veine saphène. (H) Dissection des ganglions lymphatiques superficiels : l’extrémité distale de la veine saphène. (I) Aspect général après un curage ganglionnaire inguinal. Veuillez cliquer ici pour voir une version agrandie de cette figure.
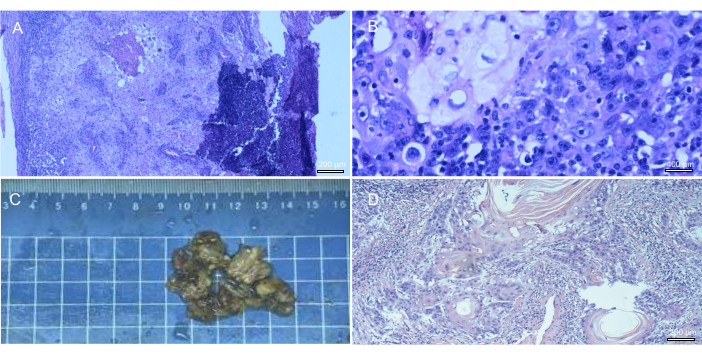
Figure 3 : Ganglions lymphatiques inguinaux excisés lors d’une intervention chirurgicale, avec classification pathologique ultérieure. (A-B) Carcinome épidermoïde métastatique bien différencié dans le ganglion lymphatique inguinal droit. (C) Ganglion lymphatique inguinal gauche excisé lors de la chirurgie. (D) Carcinome épidermoïde métastatique modérément à bien différencié dans le ganglion lymphatique inguinal gauche. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Variable | Valeur |
| Âge, médiane (plage), année | 55 (31,79) |
| Scène EAU | |
| Je | 1(4.76%) |
| IIA | 4(19.05%) |
| IIB | 2(9.52%) |
| IIIA | 3(14.29%) |
| IIIB | 6(28.57%) |
| IV | 12(57.14%) |
| Carcinome épidermoïde | |
| Bien différencié | 12 (57.14%) |
| Modérément différencié | 7 (33.3%) |
| Kératinisation | 1(4.76%) |
| Compliqué avec le diabète | 1(4.76%) |
| Compliqué avec l’hypertension | 2(0.08%) |
Tableau 1 : Données démographiques et clinicopathologiques de 21 patients.
| Variable | Valeur |
| Temps opératoire, médian (plage), min | |
| Unilatéral | 146(90-180) |
| Bilatéral | 182(115-220) |
| Perte de sang opératoire, médiane (plage), mL | |
| Unilatéral | 10(5-20) |
| Bilatéral | 22(5-100) |
| Nombre de nœuds, médiane (plage) | |
| Inguinal | 12(2,39) |
| Pelvien | 0.00 |
| Patients avec ganglion positif | 7(33.3%) |
| Durée de la vidange, médiane (plage) jour | |
| Unilatéral | 28(7.0,50) |
| Bilatéral | 33(7.0,60) |
| Durée du séjour, médiane (plage), jour | |
| Unilatéral | 19(8.0,30) |
| Bilatéral | 29(13,45) |
| Complications | 3(14.29%) |
| Infection de la plaie | 2(9.52%) |
| Lymphorrhée | 1(476%) |
Tableau 2 : Données opératoires et pathologiques de 21 patients.
Discussion
Le développement et l’amélioration continus du curage ganglionnaire ont amélioré le traitement du cancer du pénis. Dans cette étude, l’approche chirurgicale a été modifiée pour obtenir la séquence de dissection ganglionnaire superficielle et profonde et la préservation de la grande veine saphène, ce qui a donné des résultats positifs.
Choix de l’approche chirurgicale
Le meilleur choix entre l’approche sous-cutanée à travers le triangle fémoral des membres inférieurs et l’approche abdominale sous-cutanée pour la lymphadénectomie inguinale laparoscopique est controversé. Bien que l’approche sous-cutanée soit techniquement plus simple, elle est associée à un traumatisme plus important et est moins pratique pour le curage ganglionnaire profond. L’approche sous-cutanée abdominale a été largement acceptée ces dernières années en raison des progrès des techniques chirurgicales. Des études cliniques ont indiqué que cette méthode est associée à une réduction des incisions et à une diminution du risque de complications postopératoires, telles que le lymphœdème des membres inférieurs. De plus, l’approche sous-cutanée permet un curage ganglionnaire pelvienplus complet 11.
En 2011, des chercheurs ont effectué un curage antérograde des ganglions lymphatiques inguinaux en utilisant l’approche sous-cutanée abdominale. Les points de ponction ont été identifiés comme étant le bord inférieur du nombril, le point médian entre l’ombilic et la symphyse pubienne, et la face médiale de l’épine iliaque antéro-supérieure14. Yuan et al.11 ont également évalué l’efficacité thérapeutique et les complications postopératoires du curage ganglionnaire inguinal laparoscopique.
Amélioration de la séquence de curage ganglionnaire dans les groupes peu profonds et profonds et technique de préservation du tronc de la veine saphène
Pour l’identification des repères anatomiques, le chirurgien doit bien connaître la gaine du droit antérieur, l’aponévrose oblique externe, le fascia lata, le ligament inguinal et l’origine de la grande veine saphène. Ces repères fournissent des indications anatomiques claires pendant la procédure et améliorent également considérablement l’efficacité et la sécurité de l’opération. En particulier, l’identification de la grande veine saphène est cruciale pour la dissection des ganglions lymphatiques profonds et superficiels. Le curage ganglionnaire peut minimiser le risque de troubles du reflux veineux et diminuer l’apparition d’œdème postopératoire des membres inférieurs. Catalona et al. ont montré que la technique de préservation de la veine saphène dans la lymphadénectomie inguinale minimise les complications et réduit l’incidence du lymphœdème15. De plus, plusieurs études ont démontré que la préservation de la veine saphène lors du curage ganglionnaire inguinal peut réduire efficacement l’apparition d’œdème postopératoire des membres inférieurs13,16.
Le curage ganglionnaire doit d’abord s’adresser aux ganglions lymphatiques profonds, puis aux ganglions superficiels. Cette stratégie améliore le déroulement de la chirurgie, réduit le risque de lésion de la grande veine saphène et facilite la prise de décision plus rapide pour l’analyse pathologique congelée peropératoire. En outre, la préservation de la grande veine saphène et de ses branches diminue l’incidence de l’œdème postopératoire des membres inférieurs et améliore la qualité de la récupération postopératoire.
Conclusion
Les résultats ont indiqué que les techniques laparoscopique modifiées peuvent réaliser en toute sécurité et efficacement le curage ganglionnaire pénien et inguinal avec des taux de complications acceptables et un taux de réussite élevé. Cette méthode est simple et adaptée à l’enseignement et à l’apprentissage. Cependant, il s’agissait d’une étude monocentrique avec un nombre limité de cas cliniques, ce qui peut conduire à des résultats déséquilibrés. Par conséquent, une étude multicentrique à long terme avec de grands échantillons et une longue période de suivi est nécessaire pour vérifier ces résultats.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts.
Remerciements
Aucun
matériels
| Name | Company | Catalog Number | Comments |
| Laparoscopic system | STORZ | 20172226846 | The system provides high-definition images. |
| Laproscopic trocar | Anhui Aofo Medical Equipment Tech Corporation | 20202020172 | Disposable laproscopic trocar. |
| Negative pressure drainage device | Futababra | 20150003 | This disposable material is suitable for negative pressure suction of patients. |
| Ultrasonic scalpel | Ethicon Endo-Surgery, LLC | V94A5C | It is used in endoscopic surgery to control bleeding and minimize thermal damage during soft tissue incision. |
Références
- Sharma, P., Zargar, H., Spiess, P. E. Surgical advances in inguinal lymph node dissection: optimizing treatment outcomes. Urol Clin North Am. 43 (4), 457-468 (2016).
- Leijte, J. A., Kirrander, P., Antonini, N., Windahl, T., Horenblas, S. Recurrence patterns of squamous cell carcinoma of the penis: recommendations for follow-up based on a two-centre analysis of 700 patients. Eur Urol. 54 (1), 161-168 (2008).
- Singh, A., et al. Comparing outcomes of robotic and open inguinal lymph node dissection in patients with carcinoma of the penis. J Urol. 199 (6), 1518-1525 (2018).
- Leone, A., Diorio, G. J., Pettaway, C., Master, V., Spiess, P. E. Contemporary management of patients with penile cancer and lymph node metastasis. Nat Rev Urol. 14 (6), 335-347 (2017).
- Niyogi, D., Noronha, J., Pal, M., Bakshi, G., Prakash, G. Management of clinically node-negative groin in patients with penile cancer. Indian J Urol. 36 (1), 8-15 (2020).
- Brouwer, O. R., et al. European Association of urology-American society of clinical oncology collaborative guideline on penile cancer:2023 Update. Eur Urol. 83 (6), 548-560 (2023).
- Tobias-Machado, M., et al. Can video endoscopic inguinal lymphadenectomy achieve a lower morbidity than open lymph node dissection in penile cancer patients. J Endourol. 22 (8), 1687-1691 (2008).
- Nabavizadeh, R., Master, V. Minimally invasive approaches to the inguinal nodes in cN0 patients. Curr Opin Urol. 29 (2), 165-172 (2019).
- Tobias-Machado, M., et al. Video endoscopic inguinal lymphadenectomy (VEIL): minimally invasive resection of inguinal lymph nodes. Int Braz J Urol. 32 (3), 316-321 (2006).
- Tobias-Machado, M., et al. Video endoscopic inguinal lymphadenectomy: a new minimally invasive procedure for radical management of inguinal nodes in patients with penile squamous cell carcinoma. J Urol. 177 (3), 953-957 (2007).
- Yuan, P., et al. Comparative study of video endoscopic inguinal lymphadenectomy through a hypogastric vs leg subcutaneous approach for penile cancer. J Endourol. 32 (1), 66-72 (2018).
- Chiapparrone, G., et al. Saphenous-sparing laparoscopic inguinal lymphadenectomy. Int Braz J Urol. 44 (3), 645-646 (2018).
- Yuan, J. B., et al. Preservation of the saphenous vein during laparoendoscopic single-site inguinal lymphadenectomy: comparison with the conventional laparoscopic technique. BJU Int. 115 (4), 613-618 (2015).
- Xu, H., et al. Endoscopic inguinal lymphadenectomy with a novel abdominal approach to vulvar cancer: description of technique and surgical outcome. J Minim Invasive Gynecol. 18 (5), 644-650 (2011).
- Catalona, W. J. Modified inguinal lymphadenectomy for carcinoma of the penis with preservation of saphenous veins: technique and preliminary results. J Urol. 140 (2), 306-310 (1988).
- Yao, K., et al. Modified technique of radical inguinal lymphadenectomy for penile carcinoma: morbidity and outcome. J Urol. 184 (2), 546-552 (2010).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon