Method Article
Dépistage des phytoestrogènes à l’aide d’un récepteur d’œstrogènes à base β de Reporter Assay
Dans cet article
Résumé
Nous avons optimisé un récepteur d’oestrogène disponible dans le commerce β test de journaliste pour le criblage des nourritures humaines et non humaines de primate pour l’activité oestrogène. Nous avons validé cet essai en montrant que le soy humain oestrogène connu enregistre haut, alors que d’autres nourritures ne montrent aucune activité.
Résumé
Les plantes sont une source de nourriture pour de nombreux animaux, et elles peuvent produire des milliers de produits chimiques. Certains de ces composés affectent les processus physiologiques chez les vertébrés qui les consomment, comme la fonction endocrinienne. Les phytoestrogènes, les phytochimiques endocriniens actifs les plus étudiés, interagissent directement avec l’axe gonadal hypothalamo-pituitaire du système endocrinien vertébré. Ici nous présentons l’utilisation nouvelle d’un essai à base de cellules pour examiner des extraits de plante pour la présence des composés qui ont l’activité biologique oestrogène. Cet essai utilise des cellules mammifères conçues pour exprimer fortement la bêta des récepteurs d’oestrogène (ERβ) et qui ont été transfectées avec un gène de luciferase. L’exposition à des composés avec l’activité oestrogène a comme résultat les cellules produisant la lumière. Cet essai est un moyen fiable et simple de tester l’activité œstrogène biologique. Il a plusieurs améliorations sur les analyses transitoires de transfection, notamment, la facilité d’utilisation, la stabilité des cellules, et la sensibilité de l’analyse.
Introduction
Les plantes sont une source nécessaire de nourriture pour de nombreux animaux, fournissant des calories et des nutriments essentiels à la survie, la reproduction, la croissance, le développement et lecomportement 1. Les plantes produisent des milliers de produits chimiques, dont beaucoup sont des adaptations pour leur propre croissance, leur entretien stomatique et leur reproduction. D’autres composés, réputés métabolites secondaires végétaux (MSP), ont des fonctions moins claires, bien que certaines soient toxiques et probablement utilisées comme défense contre l’herbivorie et le parasitisme (p. ex., alcaloïdes, tanins)2,3. Certains de ces produits chimiques ont la capacité d’affecter les processus physiologiques à long terme chez les animaux, tels que le fonctionnement endocrinien, bien que pourquoi ces phytochimiques endocriniens actifs interagissent avec le système endocrinien vertébré n’est toujours pasclair 2,4.
Les phytoestrogènes, les phytochimiques endocriniens actifs les plus étudiés, sont des MSP polyphénoliques qui imitent structurellement et fonctionnellement les œstrogènes, interagissant directement avec l’axe gonadal hypothalomo-pituitaire du système endocrinien vertébré5. L’ingestion de phytoestrogènes dans l’alimentation humaine est associée à la protection contre certains cancers, maladies cardiaques et symptômes ménopausiques, bien que d’autres effets incluent des problèmes de fertilité. En fait, les effets physiologiques de ces composés ont été découverts dans les années 1940 lorsque l’infertilité chez les moutons a été attribuée à leur pâturage sur le trèfle riche en phytoestrogènes (Trifolium subterrareum)6. Lorsqu’ils sont ingérés, les phytoestrogènes peuvent passer dans les cellules et imiter les effets de l’œstrogène. Alors que les phytoestrogènes ont eu des effets négatifs sur la fertilité des moutons, la relation entre les phytoestrogènes et la physiologie n’est pas simple. Comme les moutons, les rhinocéros blancs du sud présentent une sensibilité aux composés oestrogènes dans les aliments dérivés de grandes quantités de sy et de luzerne. Les filles de femelles nourries à ce régime pendant la grossesse sont moins susceptibles de se reproduire7. Cependant, d’autres études ont prouvé que les phytoestrogens peuvent avoir des effets positifs aussi bien, y compris la maturation des follicules ovariens chez les sourisplus âgées 8,la prévention de certains cancers, activité antioxydante, et effets antiproliferatives9.
L’ampleur des effets des phytoestrogènes ne sont pas surprenants étant donné que les oestrogènes affectent un large éventail de fonctions biologiques, y compris la croissance, le développement et la régulation des systèmes nerveux reproducteur et central10. Bien qu’il existe de nombreux mécanismes d’action, les phytoestrogènes ont souvent la capacité de modifier, d’améliorer ou de perturber la signalisation des œstrogènes grâce à leur capacité d’agir comme ligands pour les récepteurs intranucléaires d’œstrogènes alpha et bêta (ERα et ERβ). Beaucoup de phytoestrogènes ont une structure phénolique d’anneau semblable aux oestrogènes qui leur permet de lier des récepteurs d’oestrogène. Ceux avec la fonction agoniste d’activité oestrogène comme l’oestrogène, formant un complexe activé d’ER-ligand qui peut dimerize et lier à un élément de réponse d’oestrogène (ERE) et déclencher la transcriptionde gène 11. Ainsi, les oestrogènes et les phytoestrogènes régulent l’activité cellulaire et le système fonctionne par leurs actions comme facteurs de transcription.
Ici nous présentons l’utilisation nouvelle d’un essai à base de cellules pour examiner des extraits de plante pour la présence des composés qui ont l’activité biologique oestrogène. Cet essai utilise des cellules cho d’ovaire de hamster chinois conçues pour exprimer fortement ERβ, qui ont été transfectées avec le gènede luciferase de luciferase de Photinus ( Photinus pyralis) lié à un promoteur d’ERE12. Quand les composés oestrogènes sont présents, ils se lient aux ER, dimerize, et se lient à l’ERE, menant à la transcription du gène de luciferase. Lors de l’ajout d’une solution de substrat, la luciferase catalyse une réaction conduisant à l’émission de photons. Par conséquent, les échantillons positifs produisent des échantillons légers et négatifs ne produisent pas.
Cet essai disponible dans le commerce élimine la nécessité pour les laboratoires de transfecter les cellules mammifères avec le gène reporter et le récepteur d’oestrogène13,14, qui était instable et variable dans l’efficacité. L’essai fournit une plate-forme stable de transfection qui permet de déterminer rapidement et simplement si une plante a l’activité oestrogène par l’intermédiaire de liaison de récepteur.
Nous testons l’hypothèse que le soja a une activité oestrogène plus élevée que tous les autres aliments étant donné leurs concentrations connues d’isoflavones oestrogènes15 en utilisant des aliments humains provenant d’épiciers locaux.
Protocole
1. Préparation des matériaux végétaux
- Congeler les aliments secs qui ont été ramassés frais à l’aide d’un lyophilisateur.
- Pour protéger les échantillons de la lumière, couvrir les chambres de papier d’aluminium pendant le séchage.
- Pour s’assurer que les échantillons sont complètement secs, lyophiliser jusqu’à ce que les chambres ne se sentent plus froides au toucher et que les matières végétales ne perdent plus de masse lorsqu’elles sont pesées.
- Conserver les plantes séchées dans des sacs stériles à faible teneur en résidus en l’absence de lumière jusqu’à ce qu’elles soient broyées.
- Moudre finement les échantillons à l’aide d’un broyeur avec un écran en maille de 0,85 mm.
- Conserver les échantillons au sol dans les sacs en l’absence de lumière jusqu’à l’extraction.
2. Extraction de métabolites secondaires végétaux
- Pour extraire les métabolites des plantes secondaires, utilisez un rapport de 1 g d’échantillon séché à 10 mL de méthanol de qualité HPLC.
- Pesez l’échantillon sur un équilibre analytique et ajoutez-le à un flacon Erlenmeyer de taille appropriée (125 à 250 mL). Ajouter ensuite le volume approprié de méthanol. Enregistrez la masse de l’échantillon extrait.
- Couvrir la solution plante-méthanol de papier d’aluminium, puis régler pour tourner à 100 tr/min à température ambiante (RT) pendant 3 jours sur un shaker orbital, permettant aux composés potentiellement œstrogènes de se dissoudre dans le méthanol.
- Décanter le supernatant dans un système de filtration goutte à goutte à l’aide de papier filtre (125 mm).
- À l’aide d’un évaporateur rotatif, sécher l’extrait de la plante jusqu’à ce que l’échantillon soit épaissi, mais versable, dans un flacon à fond rond de 300 mL. Verser l’échantillon dans un flacon à fond rond de 50 mL, en rinçant le grand flacon avec une petite quantité de méthanol. Continuer à sécher l’échantillon dans le petit flacon jusqu’à ce que le méthanol soit complètement évaporé.
- Pesez les résidus de l’échantillon à l’aide d’un équilibre analytique. Enregistrer la masse des résidus.
- Dissoudre l’extrait de plante dans le sulfure de diméthyle (DMSO) à une concentration de 0,1 g d’extrait à 2 mL de DMSO. Vortex jusqu’à homogénéisé.
- Conserver la solution extrait-DMSO de la plante à 4 °C dans des flacons de verre ambré jusqu’à l’essai.
MISE EN GARDE : Les plantes peuvent produire des produits chimiques biologiquement actifs inconnus, et le DMSO est un véhicule qui peut les transporter à travers les membranes cellulaires. Utilisez l’équipement et les soins de protection individuelle appropriés lors de la manipulation de ces échantillons.
3. Récepteur humain d’oestrogène β’essai de transfection12
REMARQUE : Une technique aseptique et une hotte d’écoulement laminaire sont nécessaires pour le jour 1 du protocole d’analyse.
- Préparer des dilutions de 17β-Estradiol pour la courbe standard.
- Transférer le milieu de récupération cellulaire et le milieu de criblage composé (CSM) du stockage du congélateur et décongeler dans un bain d’eau de 37 °C.
- Étiquettes tubes de microcentrifugeuse Intermédiaires 1 et 2 (INT1, INT2) et 1-8.
- Remplissez INT1 de 995 μL de CSM, d’INT2 de 615 μL de CSM, de tube 1 avec 900 μL de CSM et de tubes 2-8 avec 600 μL de CSM. Réserver le tube 8.
- Transférer 5 μL de 100 μM 17β-Estradiol Stock en INT1. Jetez la pointe. Vortex.
- Avant chaque transfert, rincer la pipette 3 fois, puis transférer 10 μL de l’INT1 à l’INT2. Jetez la pointe.
- Rincer la pipette 3 fois, puis transférer 100 μL de l’INT2 dans le tube 1. Jeter la pointe. Transférer 300 μL du tube 1 dans le tube 2. Répéter l’répéter pour les tubes 3 à 7. Jeter 300 μL du tube 7 dans le conteneur à déchets. Tube 8 est un Zéro et ne reçoit pas d’estradiol. Les concentrations finales de normes plaquées sont les suivantes : 400, 133,3, 44,44, 14 815, 4 938, 1,646, 0,5487 et 0 pM estradiol.
- Préparer des composés d’échantillons.
- Échantillons de vortex.
- Prenez 4 μL de chaque échantillon de plante dans DMSO et ajoutez à 496 μL de CSM pour donner une solution DMSO de 0,8 %.
- Décongeler rapidement les cellules reporter.
- Récupérer le tube de Cell Recovery Medium dans le bain d’eau de 37 °C. Désinfecter la surface extérieure à l’aide de 70 % d’éthanol.
- Récupérer les cellules Reporter à partir de -80 °C de stockage et de dégel en transférant 10 mL du CRM préchauffé dans le tube des cellules gelées.
- Fermez le tube de Reporter Cells et transférez-le dans un bain d’eau à 37°C pendant 5-10 min.
- Récupérez le tube de la suspension de la cellule Reporter du bain d’eau. Inverser le tube des cellules plusieurs fois doucement pour briser les agrégats des cellules et produire une suspension homogène. Nettoyez la surface du tube avec 70% d’éthanol.
- Placage d’essai
- Distribuez 100 μL de la suspension reporter dans chaque puits à l’aide d’une pipette multicanal.
- Distribuez 100 μL d’échantillons en triplicate dans des puits d’analyse appropriés.
- Transférer la plaque dans un incubateur de CO2 humidifié à 37 °C pendant 22 à 24 h.
- Substrat de détection de dégel et tampon de détection dans un réfrigérateur sombre pendant la nuit pour préparer le jour 2.
- Juste avant la fin de l’incubation de la plaque, retirez le substrat de détection et le tampon de détection du réfrigérateur et placez-le dans une zone de faible lumière jusqu’à ce qu’il soit calibré en RT. Une fois à RT, inverser doucement chaque tube plusieurs fois pour bien mélanger les solutions.
- Immédiatement avant la fin de l’incubation, versez l’intégralité du contenu du tampon de détection dans le tube du substrat de détection pour créer le réaccente de détection de luciferase. Mélanger délicatement afin de ne pas produire de mousse.
- Une fois l’incubation terminée, inverser la plaque pour jeter le contenu dans un contenant de déchets approprié. Appuyez doucement sur la plaque sur une serviette en papier absorbante propre pour enlever les dernières gouttelettes des puits.
- Ajouter 100 μL du reagent de détection luciferase à chaque puits. Laisser reposer la plaque d’essai à RT pendant 15 min. Ne secouez pas la plaque.
- Quantifier la luminescence à l’aide d’un luminomètre à lecture de plaques de 96 puits.
Résultats
Vingt-deux extraits de fruits et légumes couramment trouvés dans les régimes humains ont été examinés pour la présence de composés oestrogènes. Une variété d’aliments ont été testés, y compris les légumineuses, comme le soja, les pois mange-tout et les pois cassés, car la famille des pois est une source connue de phytoestrogènes16, ainsi que les figues, dattes, maïs, carottes, pommes, bananes, fraises, tomates, chou frisé et chou. On trouve des composés perturbateurs endocriniens dans des substances courantes (p. ex., plastiques et pesticides) et certains sont biologiquement actifs par le biais desurgences 17. Dans la mesure du possible, les articles biologiques et non organiquement cultivés ont été apaisés pour expliquer la possibilité que les pesticides avec l’activité oestrogène aient pu avoir affecté les résultats.
Chaque aliment végétal était plaqué en triplicate et le luminomètre rapportait l’activité de chaque puits dans les unités de lumière relative (RL). Les niveaux d’arrière-plan des RLUs sont déterminés dans la courbe standard avec la norme 8, la concentration zéro, et utilisés pour la référence. La valeur d’activation du pli, qui est le multiplicateur au-dessus du RLU pour le point Zéro sur la courbe, est calculée par l’équation :
Activation du pli = Inconnu (RLU) ÷ Standard 8 (RLU)
À des fins d’interprétation, l’activité œstrogène est présentée d’une manière ordinale et qualitative de haute, med, faible, ou pas d’activité. Les niveaux élevés d’activité s’enregistrent au-dessus de la valeur d’activation standard 4 fois. Les chutes moyennes entre standard 5 et standard 4, et les valeurs basses se situent entre standard 6 et standard 5. Tous les échantillons dont les valeurs d’activation de pli sont inférieures à la norme 7 sont considérés comme sans activité. Se référant au tableau 1, le soja, biologique et non biologique, a fait l’objet d’un dépistage à des niveaux élevés d’activité, tandis que tous les autres fruits et légumes n’ont enregistré aucune activité. La comparaison des résultats du soja avec la courbe standard (figure 1) montre que, qu’ils soient cultivés biologiquement ou non, ils obtiennent des résultats élevés par rapport à la courbe pour les niveaux d’activité de l’estradiol à cette concentration. L’extrait de soja, une source puissante connue des isoflavones daidzein et genistein9, a été utilisé pour déterminer la dilution donnant un signal de 50% au maximum (Figure 2). Cet extrait nécessite 422 fois plus de dilution pour produire la moitié du signal de notre protocole de dilution standard.
| Produire l’article | Biologique/ Non biologique | Unités de lumière relative (Lum) | Activation du pli | Activation du pli (moyenne) | Activité phytoestrogène |
| Soja | Organique | 1687 | 29.016 | 31.06 | Haute |
| 2023 | 34.796 | ||||
| 1706 | 29.353 | ||||
| Soja | Non organique | 2041 | 35.106 | 32.05 | Haute |
| 1956 | 33.647 | ||||
| 1593 | 27.399 | ||||
| Pois mange-tout | Non organique | 53 | 0.919 | 0.92 | Pas d’activité |
| 59 | 1.015 | ||||
| 49 | 0.836 | ||||
| Pois cassés | Non organique | 66 | 1.142 | 1.21 | Pas d’activité |
| 60 | 1.032 | ||||
| 85 | 1.462 | ||||
| Maïs | Non organique | 29 | 0.502 | 0.53 | Pas d’activité |
| 30 | 0.513 | ||||
| 33 | 0.575 | ||||
| Fraise | Non organique | 35 | 0.609 | 0.77 | Pas d’activité |
| 47 | 0.808 | ||||
| 51 | 0.884 | ||||
| Fraise | Organique | 56 | 0.956 | 0.88 | Pas d’activité |
| 59 | 1.015 | ||||
| 39 | 0.678 | ||||
| Banane | Organique | 32 | 0.544 | 0.52 | Pas d’activité |
| 28 | 0.489 | ||||
| 31 | 0.533 | ||||
| Banane | Non organique | 33 | 0.564 | 0.60 | Pas d’activité |
| 41 | 0.712 | ||||
| 31 | 0.533 | ||||
| Plantain | Non organique | 37 | 0.64 | 0.70 | Pas d’activité |
| 39 | 0.667 | ||||
| 47 | 0.805 | ||||
| Kale | Organique | 26 | 0.447 | 0.47 | Pas d’activité |
| 26 | 0.444 | ||||
| 30 | 0.519 | ||||
| Kale | Non organique | 40 | 0.685 | 0.63 | Pas d’activité |
| 28 | 0.485 | ||||
| 42 | 0.719 | ||||
| Chou | Organique | 33 | 0.568 | 0.54 | Pas d’activité |
| 27 | 0.468 | ||||
| 34 | 0.588 | ||||
| Chou | Non organique | 44 | 0.757 | 0.66 | Pas d’activité |
| 34 | 0.585 | ||||
| 36 | 0.626 | ||||
| pomme | Organique | 30 | 0.523 | 0.49 | Pas d’activité |
| 25 | 0.437 | ||||
| 30 | 0.509 | ||||
| pomme | Non organique | 41 | 0.705 | 0.62 | Pas d’activité |
| 31 | 0.53 | ||||
| 37 | 0.63 | ||||
| Tomate | Organique | 51 | 0.874 | 0.87 | Pas d’activité |
| 57 | 0.974 | ||||
| 44 | 0.76 | ||||
| Tomate | Non organique | 61 | 1.056 | 1.19 | Pas d’activité |
| 81 | 1.386 | ||||
| 66 | 1.128 | ||||
| Carotte | Organique | 33 | 0.575 | 0.51 | Pas d’activité |
| 33 | 0.561 | ||||
| 22 | 0.382 | ||||
| Carotte | Non organique | 31 | 0.53 | 0.52 | Pas d’activité |
| 21 | 0.365 | ||||
| 38 | 0.657 | ||||
| Fig | Non organique | 29 | 0.506 | 0.61 | Pas d’activité |
| 42 | 0.716 | ||||
| 36 | 0.619 | ||||
| Dates | Non organique | 29 | 0.495 | 0.59 | Pas d’activité |
| 39 | 0.667 | ||||
| 35 | 0.602 |
Tableau 1. Résultats représentatifs du système eRβ Reporter Assay pour le dépistage des fruits et légumes pour l’activité phytoestrogène. L’activité positive est indiquée par High, Med, Low, or No Activity.
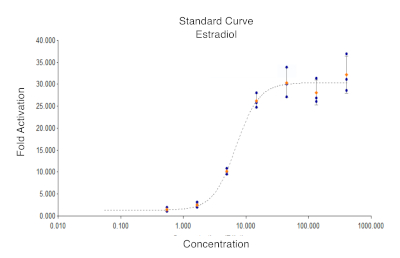
Figure 1. Dilution en série de lanorme 17β-Estradiol(standard 1 à 8 concentrations = 400, 133.3, 44.44, 14.815, 4.938, 1.646, 0.5487 et 0 pM, respectivement) en utilisant le système d’analyse ERβ Reporter. Veuillez cliquer ici pour voir une version plus large de ce chiffre.

Figure 2. L’essai ERβ Reporter à l’aide d’une dilution en série de l’extrait de soja pour déterminer la dilution qui a donné un rapport signal-arrière-plan qui est de 50% du signal maximal. De la méthode d’extraction standard dissolvant l’extrait végétal dans le sulfure de diméthyle (DMSO) à une concentration de 0,1 g d’extrait à 2 mL de DMSO, le soja doit être dilué 422 fois pour obtenir un signal 50% de la réponse maximale. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
Discussion
L’essai de reporter ERβ développé pour filtrer individuellement les agents pharmaceutiques est également adapté pour le dépistage des aliments végétaux pour les phytoestrogènes biologiquement actifs par l’intermédiaire de l’ERβ. Les considérations importantes dans le protocole incluent le traitement des échantillons de plantes avec soin : le matériel végétal frais doit être séché rapidement pour empêcher le moulage ou toute autre dégradation biologique, et il doit être tenu à l’écart de la lumière pour empêcher la photolyse des composés18. Le protocole d’analyse12 fourni par le fabricant est clair et nécessite très peu de modifications à des fins de dépistage. La courbe standard suggérée par le fabricant a été modifiée dans ce protocole pour augmenter le nombre de points qui tombent dans la plage exponentielle de la courbe (figure 1), tout en préservant les plateaux supérieur et inférieur. Il est possible d’utiliser cet essai pour l’analyse quantitative, mais notre but est d’associer des plantes avec l’activité élevée aux effets biologiques, au choix de nourriture, et à d’autres comportements chez les animaux qui les consomment.
Pour illustrer davantage l’efficacité de l’extraction et de l’analyse, nous avons inclus une courbe de réponse à la dose avec de l’extrait de soja (figure 2) et déterminé que, compte tenu de la puissance du protocole d’extraction normal, le soja doit être dilué abondamment avant que le signal tombe à 50 % maximum. Ceci accentue le fait qu’à des concentrations élevées de phytoestrogènes les plateaux de signal à un signal maximum stable. À des concentrations très faibles, le signal peut ne pas être assez fort pour être distingué de l’arrière-plan. Il est important de travailler avec des concentrations élevées d’extraits, afin de détecter les phytoestrogènes présents en faibles quantités dans un échantillon, en minimisant les faux négatifs. Initialement, le laboratoire a utilisé un plus grand volume de DMSO par rapport aux résidus végétaux provenant de l’extraction du méthanol (c.-à-d. 10 mL de DMSO à 0,1 g de résidus végétaux). Les échantillons étaient trop dilués pour induire une forte luminescence dans les échantillons positifs. En raison d’un pourcentage maximum de DMSO pour la viabilité des cellules de reporter et les contraintes de volume dans les puits de la plaque, la concentration d’extrait d’échantillon doit être optimisée lors de l’ajout de DMSO aux résidus végétaux. Un contrôle positif tel que le sy devrait être inclus sur chaque plaque, pour confirmer que les cellules sont viables et capables de luminescence, et que la concentration d’extrait est suffisante pour obtenir une réponse.
Cet essai détecte les composés qui se lient à ERβ, mais tous les phytoestrogènes n’ont pas le même mécanisme d’action. Ce protocole d’analyse peut être modifié en incubant les cellules avec une combinaison d’estradiol et les composés végétaux pour détecter s’il ya une activité anti-œstrogènes dans unéchantillon 9,12. L’estradiol a une grande affinité avec les urgences, de sorte que la présence de phytoestrogènes peut avoir une activité biologique antiestrogénique en présence d’estradiol en bloquant les récepteurs, ce qui réduit la réponse aux œstrogènes. L’activité antiestrogénique serait détectée par une réduction de l’activation totale avec une concentration croissante d’extrait de plante. Cet essai ne détectera pas d’autres méthodes d’action, telles que la liaison aux urgences membranaires19. En outre, certains phytoestrogènes ne sont pas biologiquement actifs jusqu’à ce qu’ils aient été métabolisés par les microbesintestinaux 20. Il est possible que certaines plantes qui n’ont pas ou faible activité œstrogène dans leur état non métabolisé ont une activité œstrogène plus élevée post-métabolisation que cet essai ne détecterait pas.
L’essai de reporter ERβ a été choisi pour illustrer le criblage des phytoestrogènes pour l’activité dans les usines parce que les phytoestrogens concurrencent pour lier avec l’estradiol plus fortement à ERβ qu’ils font à ERα21. Le dépistage de l’activité eRα est possible par un essai similaire, dans lequel les cellules sont transfectées avec le gène ERα plutôt qu’ERβ.
Après un dépistage positif des phytoestrogènes actifs, les composés actifs peuvent être identifiés avec des méthodes de chromatographie. En effet, à ce stade, les composés isolés peuvent être testés à l’aide de cet essai et les concentrations effectives demi-maximales (EC50) peuvent être déterminées à l’aide d’une série de dilution comme mesure de la puissance du composé.
Cet essai est un moyen fiable et simple de tester l’activité œstrogène biologique, en gardant à l’esprit ses limites dans l’étendue des mécanismes de l’activité œstrogène. Il a plusieurs améliorations sur les analyses transitoires de transfection, notamment la facilité d’utilisation, la stabilité des cellules, et la sensibilité de l’essai.
On sait peu de choses sur la prévalence des phytoestrogènes dans les aliments végétaux sauvages consommés par les humains ou lesanimaux sauvages 22, mais des études montrent que l’exposition aux MSP oestrogènes dans l’alimentation peut avoir des effets durables23. Avoir un simple test robuste qui détecte ces composés, en conjonction avec des études évaluant les quantités consommées et quand ils sont consommés, est une étape puissante dans la détermination de la fonction d’inclure les aliments oestrogènes dans l’alimentation et les effets de ces composés sur les systèmes physiologiques.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Les auteurs sont reconnaissants à Dale Leitman pour la formation initiale dans l’utilisation des analyses transitoires de transfection pour déterminer l’activité oestrogène des nourritures végétales de primate. Merci à Bradford Westrich et C. Eric Johnson d’avoir aidé à mettre en place de l’équipement de laboratoire et de former les étudiants aux méthodes d’extraction. Enfin, merci à l’Université de l’Indiana pour le financement de cette recherche.
matériels
| Name | Company | Catalog Number | Comments |
| 1000 µL pipette | |||
| 20 µL pipette | |||
| 200 µL pipette | |||
| 37 ° water bath | |||
| 37 °, humidified 5% CO2 incubator | |||
| 70% ethanol | |||
| analytical balance | |||
| cell culture-rated laminar flow hood | |||
| dimethyl sulfoxide | |||
| disposable media basin, sterile | |||
| drip filtration system | |||
| Erlenmeyer flasks | 125 mL and 250 mL | ||
| HPLC grade methanol | |||
| Human ERβ Reporter Assay System, 1 x 96-well format assays | Indigo Biosciences | IB00411 | Assay kit - analyzes 24 samples plus standard curve |
| lyophilizer | |||
| multi-channel pipette | |||
| orbital shaker | |||
| plate-reading luminometer | ex. Bioteck Synergy HTX | ||
| rotory evaporator | |||
| round bottom flasks | 50 mL and 300 mL | ||
| sterile microcentrifuge tubes or sterile multi-channel media basins | |||
| sterile tips | 200 µL and 1000 µL | ||
| Whatman grade 1 paper | |||
| whirl-pak bags | sterile polyethylene bags |
Références
- Wasserman, M. D., et al. Estrogenic plant consumption predicts red colobus monkey (Procolobus rufomitratus) hormonal state and behavior. Hormones and Behavior. 62 (5), 553-562 (2012).
- Wasserman, M. D., Milton, K., Chapman, C. A. The roles of phytoestrogens in primate ecology and evolution. International Journal of Primatology. 34 (5), 861-878 (2013).
- DeGabriel, J. L., Moore, B. D., Foley, W. J., Johnson, C. N. The effects of plant defensive chemistry on nutrient availability predict reproductive success in a mammal. Ecology. 90 (3), 711-719 (2009).
- Wasserman, M. D., Steiniche, T., Després-Einspenner, M. -L. Primate Diet & Nutrition. Lambert, J. E., Rothman, J. M. , University of Chicago Press. (2020).
- Benavidez, K. M., Chapman, C. A., Leitman, D. C., Harris, T. R., Wasserman, M. D. Intergroup variation in oestrogenic plant consumption by black-and-white colobus monkeys. African Journal of Ecology. , (2019).
- Bennetts, H. W., Underwood, E. J., Shier, F. L. A specific breeding problem of sheep on subterranean clover pastures in Western Australia. Australian Veterinary Journal. 22 (1), 2-12 (1946).
- Tubbs, C. W., et al. Estrogenicity of captive southern white rhinoceros diets and their association with fertility. General and Comparative Endocrinology. 238, 32-38 (2016).
- Shen, M., et al. Observation of the influences of diosgenin on aging ovarian reserve and function in a mouse model. European Journal of Medical Research. 22 (1), 42(2017).
- Boué, S. M., et al. Evaluation of the estrogenic effects of legume extracts containing phytoestrogens. Journal of Agricultural and Food Chemistry. 51 (8), 2193-2199 (2003).
- Klinge, C. M. Estrogen receptor interaction with estrogen response elements. Nucleic Acids Research. 29 (14), 2905-2919 (2001).
- Nishikawa, J. -i, et al. New screening methods for chemicals with hormonal activities using interaction of nuclear hormone receptor with coactivator. Toxicology and Applied Pharmacology. 154 (1), 76-83 (1999).
- Human Estrogen Receptor Beta (ERb; ESR2; NR3A2) Reporter Assay System. , Indigo Biosciences. State College, PA. (2020).
- Wasserman, M. D., et al. Estrogenic plant foods of red colobus monkeys and mountain gorillas in uganda. American Journal of Physical Anthropology. 148 (1), 88-97 (2012).
- Vivar, O. I., Saunier, E. F., Leitman, D. C., Firestone, G. L., Bjeldanes, L. F. Selective activation of estrogen receptor-β target genes by 3, 3'-diindolylmethane. Endocrinology. 151 (4), 1662-1667 (2010).
- Whitten, P. L., Patisaul, H. B. Cross-species and interassay comparisons of phytoestrogen action. Environmental Health Perspectives. 109, suppl 1 5-20 (2001).
- Di Gioia, F., Petropoulos, S. A. Advances in Food and Nutrition Research. , Academic Press Inc. (2019).
- Lutz, I., Kloas, W. Amphibians as a model to study endocrine disruptors: I. Environmental pollution and estrogen receptor binding. Science of The Total Environment. 225 (1), 49-57 (1999).
- Felcyn, J. R., Davis, J. C. C., Tran, L. H., Berude, J. C., Latch, D. E. Aquatic Photochemistry of Isoflavone Phytoestrogens: Degradation Kinetics and Pathways. Environmental Science & Technology. 46 (12), 6698-6704 (2012).
- Jeng, Y. -J., Kochukov, M. Y., Watson, C. S. Membrane estrogen receptor-alpha-mediated nongenomic actions of phytoestrogens in GH3/B6/F10 pituitary tumor cells. Journal of Molecular Signaling. 4, 2-2 (2009).
- Dixon, R. A. Phytoestrogens. Annual Review of Plant Biology. 55, (2004).
- Kuiper, G. G. J. M., et al. Interaction of Estrogenic Chemicals and Phytoestrogens with Estrogen Receptor β. Endocrinology. 139 (10), 4252-4263 (1998).
- Wasserman, M. D. Feeding on Phytoestrogens: Implications of Estrogenic Plants for Primate Ecology. , UC Berkeley. (2011).
- Jefferson, W. N., Patisaul, H. B., Williams, C. J. Reproductive consequences of developmental phytoestrogen exposure. Reproduction. 143 (3), Cambridge, England. 247-260 (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon