Method Article
Dithranol en tant que matrice pour Matrix Assisted Laser Désorption / Ionisation imagerie sur une transformée de Fourier Ion Cyclotron Resonance Mass Spectrometer
Dans cet article
Résumé
Dithranol (DT; la 1,8-dihydroxy-9 ,10-dihydroanthracen-9-one) a été précédemment rapporté comme une matrice MALDI pour l'imagerie des tissus de petites molécules, des protocoles pour l'utilisation de DT pour l'imagerie MALDI des lipides endogènes sur l' surface des coupes de tissus par ions positifs MALDI-MS sur un ultra-résolution quadripolaire FTICR instrument sont fournies ici.
Résumé
Spectrométrie de masse imagerie (MSI) détermine la localisation et de la distribution spatiale des motifs de composés sur la surface d'une coupe de tissu, en utilisant principalement MALDI (laser assistée par matrice de désorption / ionisation) à base de techniques analytiques. Nouvelles matrices pour petite molécule MSI, ce qui peut améliorer l'analyse de bas poids moléculaire (MW) composés, sont nécessaires. Ces matrices doivent fournir des signaux accrus d'analyte tout en diminuant les signaux de fond MALDI. En outre, l'utilisation d'instruments très haute résolution, telles que la transformée de Fourier à résonance cyclotronique ionique (FTICR) des spectromètres de masse, a la capacité de résoudre des signaux d'analyte à partir des signaux de la matrice, ce qui peut partiellement surmonter de nombreux problèmes associés à l'arrière-plan provenant de la MALDI matrice. La réduction de l'intensité des métastables grappes de matrice par FTICR MS peut également aider à surmonter certains des interférences associées aux pics de la matrice sur d'autres instruments. Haute résolutioninstruments tels que les spectromètres de masse FTICR sont avantageux car ils peuvent produire des modèles de distribution de nombreux composés simultanément tout en offrant la confiance dans les identifications chimiques. Dithranol (DT; 1,8-dihydroxy-9 ,10-dihydroanthracen-9-one) a déjà été rapporté comme une matrice MALDI pour l'imagerie des tissus. Dans ce travail, un protocole pour l'utilisation de MALDI DT pour l'imagerie des lipides endogènes à partir des surfaces des sections de tissus de mammifères, par-ion positif MALDI-MS, sur un hybride quadripolaire à ultra-haute résolution FTICR instrument a été fournie.
Introduction
Spectrométrie de masse imagerie (MSI) est une technique d'analyse pour déterminer la localisation et de distribution la répartition spatiale des composés sur la surface d'une coupe de tissu 1,2. Laser assistée par matrice de désorption / ionisation (MALDI) MSI pour l'analyse des peptides et des protéines a été utilisé pour plus d'une décennie et il ya eu de grandes améliorations dans les méthodes de préparation des échantillons, la sensibilité de détection, la résolution spatiale, la reproductibilité et le traitement des données de 3,4. En combinant les informations des sections histologiques colorées et expériences MSI, les médecins sont en mesure de corréler les distributions de composés spécifiques avec des caractéristiques intéressantes sur le plan physiopathologique 5.
Les modes de distribution de petites molécules, y compris les médicaments exogènes 6,7 et de leurs métabolites 8-10 ont également été interrogés par MALDI-MS imagerie des tissus 11. Les lipides sont peut-être le cla plus largement étudiéart de composés avec l'imagerie MALDI, à la fois dans les MS 12-17 et MS / MS 18 modes. L'utilisation de MALDI MSI pour l'imagerie du petit molécule a été limitée par plusieurs facteurs: 1) des matrices MALDI sont eux-mêmes de petites molécules (typiquement m / z <500), qui génèrent des signaux d'ions abondantes. Ces signaux abondantes peuvent supprimer l'ionisation des analytes à petites molécules et interférer avec leur 19,20 de détection. Sans solvant matrice revêtement 21, matrice sublimation 22, et de la matrice MALDI prérevêtue MS 23, entre autres, ont été développées pour améliorer MSI de petites molécules.
Nouvelles matrices qui peuvent améliorer l'analyse des composés de faible poids moléculaire sont d'un grand intérêt dans une petite molécule MSI. Ces matrices doivent fournir des signaux accrus d'analyte avec les signaux de la matrice diminué. Dans le mode ions positifs, le 2,5-dihydroxybenzoïque acide (DHB) et-4-hydroxycinnamique α-cyano acide (ACSSD) sont les deux matrices MALDI MS couramment utilisés pour MSI 24 . L'idéal serait de former une matrice de petits cristaux, de façon à préserver la localisation spatiale des analytes. DHB a tendance à former des cristaux plus grands, par conséquent, l'application de la matrice à l'aide de sublimation a été développé pour surmonter partiellement ce problème, et a permis l'utilisation de cette matrice pour l'imagerie sensible de phospholipides 22,25. 9-aminoacridine a été utilisé pour des analytes MSI protiques dans le mode ions positifs, et 26 pour les nucleotides et les phospholipides dans la négative, le mode ions 26 à 29. 2-mercaptobenzothiazole a été trouvée pour donner détection de MALDI efficace des lipides 30, et a été utilisée pour l'imagerie du cerveau de souris 31 gangliosides. La très haute résolution de la transformée de Fourier ion résonance cyclotron (FTICR) spectromètres de masse peuvent quelque peu atténuer ce problème en réglant les signaux d'analyte à partir des signaux de la matrice 32. Un autre avantage de l'utilisation de MS-FTICR est que les intensités des pôles de la matrice sont métastables réductioned 33, ce qui réduit également ces interférences 27.
L'utilisation de dithranol (DT; la 1,8-dihydroxy-9 ,10-dihydroanthracen-9-one) sous forme de matrice MALDI pour l'imagerie des tissus a été précédemment rapporté 34. Dans ce travail en cours, un protocole détaillé est fourni pour l'utilisation de DT pour la MSI des lipides endogènes sur les surfaces des sections de tissu de lentille bovine, dans le mode ions positifs.
Protocole
Une. sectionnement des tissus
- Flash geler les spécimens d'émission, une fois récoltés, en utilisant de l'azote liquide, les expédier sur de la glace sèche (si l'expédition est requise), et de les stocker à -80 ° C jusqu'à ce que le sectionnement de tissu. (Si les échantillons commerciaux sont utilisés, veiller à ce que les échantillons sont préparés de cette manière.)
- Couper les organes à une taille gérable pour s'adapter à la cible MALDI. Coupez les parties non désirées de l'organe. Pour cette étude décrit ici, les lentilles de veau bovins ont été décapsulés en utilisant une procédure décrite précédemment 35 avant découpe de tissu.
- Retirer des organes entiers de -80 ° C congélateur et fixez-les sur une scène de coupe de tissu cryogénique. Pour fixer un objectif de veau, placer une ou deux gouttes d'eau sur la scène d'un cryostat tissu coupe. Placez rapidement la lentille dans l'eau avant qu'elle se solidifie. Sinon, la température de coupe optimale (OCT) composés peuvent également être utilisés pour fixer un tissu sur la scène de coupe. Si les composés de l'OPO se servir, un minimal quantité d'octobre doit être appliqué et il faut prendre soin de s'assurer que les sections de tissu coupées ne sont pas contaminés par des composés octobre qui peut interférer avec l'ionisation et la détection des analytes 5,36,37.
- Laisser la température à l'intérieur du cryostat à s'équilibrer à 18 ° C. Les températures plus froides ou plus chaudes peuvent être utilisés pour les tissus plus doux ou plus durs, respectivement. Ensuite, couper le tissu équatoriale en 20 um tranches épaisses. Utilisez 10-15 um tranches épaisses pour la plupart des tissus, mais, en raison de la nature fragile du tissu de verre de bovins, 20 um tranches épaisses ont été utilisés. Pour le tissu de verre de bovin, jeter les premières sections de tissus et de n'utiliser que des tranches qui sont proches ou au plan équatorial.
- Si un tissu lentille oculaire est imagé, utiliser 1,5 ul d'acide formique (98% de pureté, LC-MS grade) à pré-imbibé la surface d'un oxyde d'indium-étain (ITO) revêtu lame de verre.
- Transférer délicatement les coupes de tissus à la surface de l'ITO-coverre ATED lame de microscope à l'intérieur du cryostat. La coupe de tissu se décongeler rapidement et deviendra hermétiquement fixé à la surface de glissement. Habituellement, des coupes de tissus multiples peuvent être montés sur une même lame d'ITO revêtue de cette façon.
- Lyophiliser la lame pendant 15 min avant l'application de la matrice MALDI.
- Pour le test de la matrice, dissoudre les matrices individuelles dans des solvants appropriés. Repérer manuellement 1 ul de chaque solution de matrice sur la coupe de tissu. De plus, repérer un standard d'étalonnage de petite molécule sur le tissu pour la vérification de la sensibilité MALDI.
- Ajouter trois points d'enseignement de la lame de verre revêtue d'ITO par écrit sur la surface non conductrice de la lame de verre revêtue d'ITO avec un stylo correction fluide. Prendre une image optique de la lame de tissu à l'aide d'un scanner à plat et l'enregistrer dans un format approprié comme tiff ou jpg.
2. Revêtement Matrix
2.1. Matrice revêtement automatisé
- Apsolutions de matrice de nappe, qui contiennent de l'acétonitrile ou un mélange acétonitrile / eau comme solvant mixte, automatiquement à la surface des coupes de tissu en utilisant un Bruker ImagePrep ou une matrice électronique pulvérisateur similaire.
- Couvrir les bords de la surface avant de la lame de verre revêtu d'ITO avec un ruban de telle sorte que la matrice ne pas recouvrir les bords de la diapositive. Cela garantit que les marques d'enseignement sur la surface opposée peuvent être utilisées pour l'alignement de glissement des tissus. Ne pas recouvrir les bords de la glissière avec la matrice car ils sont utilisés en tant que points de contact pour maintenir la conductivité électrique de la lame revêtu d'ITO.
- Manteau de la lame de verre à l'aide d'une vingtaine de cycles de matrice revêtement (2-sec pulvérisation, 30 sec d'incubation, et 60 secondes de temps de séchage pour chaque cycle).
2.2. Manuel Matrice revêtement
- Si des solvants organiques (par exemple le chloroforme et l'acétate d'éthyle) qui sont incompatibles avec les matériaux de fabrication de la matrice pulvérisateur électronique sont exirouge, utiliser un aérographe pulvérisateur pneumatique assisté à appliquer la matrice. Ajouter la solution de matrice préparée dans le réservoir de solvant de l'aérographe et appliquer un léger flux d'azote gazeux sous pression pour amorcer la pulvérisation.
- Couvrir les bords de la surface avant des lames de verre ITO revêtus avec de la bande de sorte que la matrice ne pas recouvrir les bords de la diapositive. Cela garantit que les marques d'enseignement sur la surface opposée peuvent être utilisées pour l'alignement de glissement des tissus. Ne pas recouvrir les bords de la glissière avec la matrice car ils sont utilisés en tant que points de contact pour maintenir la conductivité électrique de la lame revêtu d'ITO.
- Après sprays stables et fines ont été observées, pulvériser manuellement la matrice de sorte qu'il enrobe complètement la section de tissu. Appliquer le montant minimum de la solution de matrice nécessaire pour à peine mouiller la surface lors de chaque cycle pour éviter tout risque de délocalisation de l'analyte. En général, utiliser environ 10 cycles de matrice pulvérisation pour enduire une section de tissu, le nombre de cycles esten fonction du type de tissu et la composition de la matrice.
3. MALDI MS
- Préparer une solution d'étalonnage de masse par dilution de la "Tuning ES Mix" solution standard d'un facteur 1:200 dans 60:40 isopropanol: eau (contenant de l'acide formique à 0,1% dans le mélange final).
- Introduire 2 ul / min de la solution diluée "Tuning ES Mix" dans le bi-mode ionisation électrospray (ESI) de source / MALDI d'ions sur le spectromètre de masse FTICR, à partir du côté ESI.
- Utilisez l'instrument FTICR en mode ESI positif-ion, avec détection à large bande et une taille d'acquisition de données de 1024 kb / s. Paramètres ESI typiques sont tension électrospray capillaire, 3900 V; pulvériser tension de bouclier, 3600 V, le gaz de nébulisation (N 2) flux, 2 L / min; gaz sec (N 2) débit et de température, 4 L / min et 200 ° C; skimmer 1 tension, 15 V, le temps de vol (TOF), 0.009 sec; gaz de collision (Ar) flux, 0,4 L / s; la source d'ions temps d'accumulation, 0,1 sec;et cellule de collision ion temps d'accumulation, 0,2 sec. Régler les paramètres de fonctionnement FTICR afin de maximiser la sensibilité analytique sur la gamme de masse de m / z 200 à 1400, tout en maintenant le bon moment domaine d'induction libre décroissance des signaux (FID). En règle générale, les paramètres de fonctionnement de l'IC sont tension acolyte, 8 V; Sidekick tension de décalage, 8 V; excitation amplification de 10; excitation temps d'impulsion, de 0,01 à 0,015 sec; avant tension de plaque de piège, de 1,5 V; dos piège tension de plaque, 1,6 V et analyseur tension d'entrée, -4 V. Après un ensemble de paramètres de fonctionnement FTICR a été déterminé, d'acquérir les spectres de masse ESI et calibrer l'appareil en utilisant les masses des composés standards de référence dans la solution "ES Tuning Mix".
- Pour accorder l'instrument pour un fonctionnement MALDI, dissoudre plusieurs fractions de 1 ul d'une terfénadine mixte et la solution étalon de réserpine dans la solution de matrice à une concentration de 1 uM chacun, et repérer ces solutions directement sur l'un des tissudes sections de e (c'est à dire une section de tissu d'essai) qui a été monté sur un coulisseau revêtu d'ITO. Placer la lame revêtu d'ITO dans un adaptateur de lame de tissu (c'est à dire une cible MALDI spéciale) et de charger l'adaptateur du côté MALDI dans la source d'ions double ESI / MALDI. Optimiser les paramètres de fonctionnement MALDI appropriées pour la puissance du laser et le nombre de tirs laser pour MALDI accumulation de signal pour chaque balayage de masse, etc paramètres de fonctionnement MALDI typiques sont: des tirs laser, 50, et une tension de plaque MALDI de 300 V.
- Après réglage, l'étalonnage et l'optimisation de l'instrument pour des expériences MALDI-MSI, aligner l'emplacement physique d'une section de tissu à imager avec son image optique enregistrée dans le logiciel d'imagerie. Utiliser les trois marques "de correction"-fluide, qui avaient été précédemment mis sur le côté opposé de la surface de glissement revêtue d'ITO (étape 1.9), pour cet alignement en utilisant une méthode de triangulation à trois points.
- Effectuez une ESI et MAL simultanéeOpération DI sorte que chaque spectre de masse contient les pics de masse de référence de la solution "ES Tuning Mix" post-acquisition étalonnage de masse interne. Cela se traduira par la mesure de la masse la plus précise au cours de MALDI MS. Pour ce faire, la première atténuer le signal ESI en diminuant la tension capillaire jusqu'à ce que les signaux dominent les spectres MALDI tandis que les signaux de calibrant ESI sont encore suffisamment élevée pour l'étalonnage de masse interne.
- Ensuite, mettre en place une méthode de tramage automatisé pour l'irradiation laser. Définir les zones de tissu à imager et définir la taille de l'étape de trame laser approprié. Notez que les tailles de pas plus petit raster fournissent des images de tissus de la résolution, mais nécessitent un temps significativement plus long du spectre de masse d'acquisition et plus d'espace de stockage de données. Le nombre de pixels de l'image dépend de la taille de pas de trame de laser à mettre en place et de la taille des tissus. Pour une lentille bovine typique qui a une taille de 1 cm 2 de tissu, une image de tissu est typiquement composée de ca. 5000 pixels si une taille de pas de trame de laser de 200 um est utilisé sur un instrument FTICR. Utiliser une analyse «point aléatoire", car cela empêche la polarisation basé sur la localisation progressive en raison de l'atténuation du signal pendant l'expérience.
4. Analyse des données
- Calibrer les spectres de masse MALDI utilisant le calibrage interne pour la comparaison initiale et pour sélectionner pics pour MS / MS. De-isotope et sélectionnez les sommets monoisotopiques comme décrit précédemment, en utilisant un script VBA personnalisée 38.
- Export de la liste résultant de pointe monoisotopiques et saisir les valeurs m / z mesurées dans le METLIN 39 et / ou les BDMH 40 bases de données métabolome pour la masse correspondant avec les entrées de la bibliothèque. Prenons l'(M + H) +, (M + Na) +, et (M + K) + ions pendant les recherches de base de données, avec une erreur de masse admissible de ± 1 ppm.
- Générer des images MALDI pour l'ensemble des entités de lipides détectés à travers l'ensemble de coupe de tissu en utilisant imagun logiciel de courrier analyse, avec une largeur de filtre de masse de 1 ppm au sommet du pic.
- Une fois les images ont été générées pour toutes les valeurs m / z qui correspondent à des entrées de base de données, générer des images pour tous les autres sommets ainsi à rechercher des modèles de distribution uniques qui peuvent être étudiés plus tard.
5. Confirmation de l'identité des lipides imagés
- Confirmer l'identité des lipides d'abondance élevée, qui ont des ions fragments caractéristiques qui peuvent être détectées en utilisant l'instrument FTICR (par exemple 184,073 pour les phospholipides), par MALDI-MS/MS. Effectuer MALDI-MS/MS utilisant dissociation induite par collision (CID) directement sur le tissu.
- Pour les espèces lipidiques qui ne peuvent être directement confirmée par MALDI-MS/MS, utiliser un système UPLC couplé à un spectromètre de masse Q-TOF 34.
- Disséquer manuellement aliquotes contenant ~ 10 mg de tissu dans la zone où l'espèce d'intérêt ont été localisés. Placez ces aliquotes de tissu en 2des tubes de centrifugation ml.
- Homogénéiser chaque aliquote de tissu dans 250 ul d'eau, en utilisant un broyeur mélangeur avec deux billes métalliques en acier inoxydable de 5 mm.
- Ajouter 1 ml d'une solution chloroforme-méthanol (1:3, v / v), et les tubes vortex. Ensuite, centrifuger les tubes à l'aide d'une microcentrifugeuse à 12 000 xg pendant 10 min.
- Recueillir les surnageants et les sécher dans un concentrateur de vitesse rotatif sous vide.
- Dissoudre les résidus dans 100 pi de 30:70 isopropanol: eau. Injecter une portion aliquote de 10 ul sur la colonne UPLC pour la séparation en utilisant un gradient d'élution.
- Utiliser les conditions chromatographiques en ligne pour LC-MS/MS lipidiques, qui ont été publiées antérieurement 34.
- Générer un courant ionique extrait (XIC) chromatogrammes en utilisant les valeurs théoriques m / z, avec une fenêtre de ± 50 ppm environ les masses théoriques.
- Si les composés authentiques de ces lipides sont disponibles, faites correspondre les temps de rétention des composés authentiques avec ceux du corpondant pics de XIC à partir des échantillons de tissus. Si les composés sont les mêmes, les durées de rétention et les spectres MS / MS doivent correspondre.
- Si un composé authentique n'est pas disponible, utiliser le schéma de fragmentation du lipide détecté pour correspondre à un spectre standard MS / MS à partir d'une base de données métabolome comme METLIN ou BDMH. Utilisez de novo interprétation des spectres de masse pour déterminer une structure possible pour le lipide.
Résultats
Des échantillons de tissus qui sont sectionnés et dégel monté sur les lames de verre recouvertes d'ITO doivent être intacts, sans déchirure visible. Pour de nombreux tissus, dégel des tissus montage direct sur une lame de verre recouverte d'ITO est acceptable. Pour certains tissus spécifiques comme objectif de bovin, vaste déchirure des tissus est souvent observé lorsque dégel montage direct est utilisé (figure 1a). Pré-revêtement de la lame de verre ITO avec de l'éthanol ou de l'acide formique (Figure 1b) contribue à maintenir l'intégrité des coupes de tissus au cours de tissu de montage.
À la fois le choix de la matrice et le choix du solvant sont des facteurs importants qui influent sur la qualité des spectres MALDI. Quand un spectre MALDI MS approprié est acquise à partir de la coupe de tissu, le spectre de masse est généralement dense avec des signaux lipidiques au sein de la plage de détection de masse (figure 2a). Une matrice et un solvant doit être choisi de sorte qu'ils ont des polaritésOnt-size: 14.399999618530273px; line-height:. 28px; "> semblable à les analytes d'intérêt, parce que le processus MALDI nécessite une solution en phase solide de l'analyte dans les cristaux de la matrice générale, les meilleurs intensités de signal de l'analyte proviennent de l'utilisation des matrices MALDI avec des solubilités semblables à celle des analytes recherchés 41,42. figure 2a montre un exemple de spectre produit par un solvant efficace de la matrice (70% ACN avec 0,01% de TFA), et la figure 2b montre un mauvais choix de la matrice et solvant (70% de MeOH avec 0,01% de TFA) pour dithranol.
L'un des avantages d'un double mode ionisation électrospray (ESI) / source d'ions MALDI est qu'il permet l'addition de signaux de calibrant ESI pendant l'acquisition des spectres MALDI simultanément sans interférer avec le processus d'ablation. Ces signaux de calibrant ESI permettent interne étalonnage en masse pour fournir une haute précision de masse avec l'erreur de masse <0,5 ppm 38. Comme l'Signal de ESI de la solution "ES Tuning Mix" standard peut être un ordre de grandeur plus forte que les signaux MALDI des analytes du tissu, les signaux calibrant ESI dérivés doivent être atténués. Signaux de calibration doivent être visibles et d'une intensité suffisante pour l'étalonnage des spectres, mais ne doivent pas dominer les spectres.
Une fois que le jeu de spectres de masse provenant d'une expérience MALDI-MSI a été acquise, l'image de chacun des ions détectés peut être généré, avec chaque pixel représentant une tache d'irradiation par laser à partir de la surface d'une coupe de tissu. La combinaison de tous les pixels individuels avec des intensités différentes d'ions à travers la section de tissu provenant d'une expérience MALDI MSI reflète l'ionisation des analytes cibles dans le tissu 1. Cela peut, à son tour, fournir des informations sur les concentrations relatives des analytes dans des parties différentes de la section de tissu (Figure 3b). Il faut prendre soin dans le traitement de l'données depuis de nombreux facteurs peuvent influer sur ce qui est vu et comment les données sont interprétées. Dans la plupart des expériences, les données sont normalisées pour le courant ionique total (CIT) à l'intérieur de chaque spectre. Sans cette normalisation, les zones avec une meilleure co-cristallisation analyte-matrice (c.-à-soi-disant «points chauds») peuvent provoquer des signaux plus forts pour les analytes et ce serait fausser les données en fournissant des informations qui ne sont pas bien corrélés avec les concentrations relatives réelles les analytes (figures 3c-3d).
Préparation des tissus peut également changer radicalement l'image qui est générée. Si l'échantillon est «trop humide» (c'est à dire trop solvant a été appliquée), les analytes délocalisent sur le tissu et beaucoup de l'information spatiale seront perdues (figure 3f). La méthode d'acquisition de données est également importante dans l'image finale obtenue. Comme les expériences MALDI sur des coupes de tissus non traités sont intrinsèquement «sale & #34;, la sensibilité de l'instrument peut diminuer avec le temps. Pour de courtes expériences cette diminution peut être pas évident, mais il peut être un problème pour des expériences plus ou échantillons particulièrement sales. Si les données sont acquises de façon linéaire à travers l'échantillon ce qui peut conduire à une polarisation en tant que localisation des régions spécifiques de la coupe de tissu seront analysés après la sensibilité de l'appareil est diminué. Par conséquent, en utilisant des endroits aléatoires pour toutes les acquisitions de données est recommandée. Bien que cette méthode prend plus de temps, il aide à éliminer ou minimiser ce biais dans les données.
Comme indiqué dans notre précédent article 34, par rapport aux services à domicile et DHB, DT a permis la détection d'espèces de lipides supplémentaires, tandis que les lipides détectés avec CHCA et DBH peuvent encore être détectés.
 >
>
Figure 1. Tissue de montage et de découpe. Images optiques comparatifs des deux sections de tissu de lentille de veau bovin (20 um d'épaisseur), sans pré-mouillage de l'acide formique (a), et avec prémouillage de l'acide formique (b), montées sur les lames de verre revêtu d'ITO.
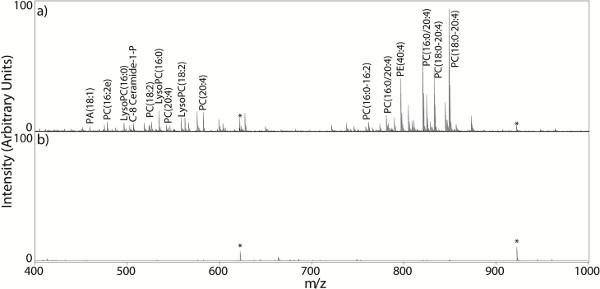
Figure 2. . Spectres de masse MS spectres MALDI acquis directement à partir d'une coupe de tissu: a) un idéal densément peuplée de spectre de masse avec des signaux de lipides (70% ACN avec 0,01% de TFA), b) un spectre de masse généré à partir d'une coupe de tissu revêtu d'un mauvais choix de solvant (70% de MeOH avec 0,01% de TFA). Cliquez ici pour agrandir la figure .
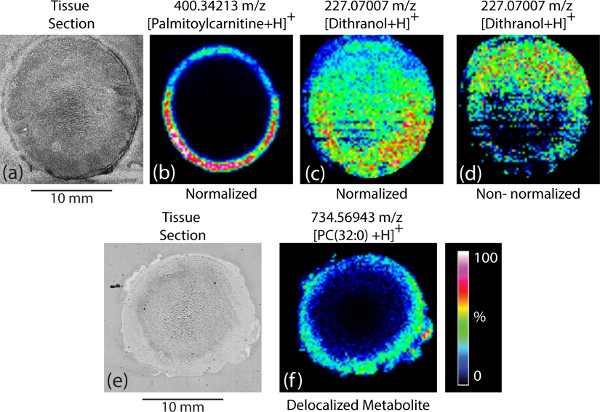
Figure 3. Images MALDI MSI images représentant MALDI MSI: a) une section de lentille bovine de tissus; b) une image MSI de la même coupe de tissu; c) une image MSI montrant un ion de fond, d) une carte d'ions non normalisée de la même ion e). une coupe de tissu de verre de bovin, et f) une carte d'ions montrant un analyte partiellement délocalisée en raison de overwetting.
Discussion
Les considérations les plus importants pour la réussite MALDI MSI sont: 1) la préparation des tissus, 2) le choix de la matrice; 3) l'application de la matrice, et 4) l'interprétation et l'analyse des données. Lorsque l'échantillon et la matrice sont préparées de manière appropriée, l'acquisition des données est automatisée MS. L'analyse des données de ce type d'expérience est assez de main-d'œuvre.
Préparation de tissu approprié est crucial pour expériences réussies MALDI MSI. La source du tissu et le traitement peuvent avoir un impact important sur l'analyse finale. Les échantillons doivent être immédiatement clignoter congelés dans l'azote liquide et conservés à -80 ° C, et ils ne doivent pas être stockés pendant une longue période de temps, comme certains métabolites peuvent être instables, même à -80 ° C.
Pour de nombreux tissus de mammifères, 10-15 um tranches de tissu épais ont été recommandés pour MALDI MSI. Dans ces expériences, les lentilles de veaux de l'espèce bovine ont été découpés dans equatoriale 20 um d'épaisseur s de tissulices suivants objectif decapsulation en utilisant une procédure décrite précédemment 35. Les sections plus épaisses de tissu du cristallin de veau bovin ont été utilisés car il a été trouvé difficile de maintenir l'intégrité d'une section de tissu de lentille à la fois lors de la coupe de tissu et le tissu pendant le montage. L'objectif est un tissu de symétrie sphérique le long de son plan équatorial, de sorte que seules les tranches qui étaient proches, ou à, le plan équatorial ont été recueillies.
En raison de la difficulté de maintenir l'intégrité des tissus lors de la coupe de tissu et de montage, de pré-mouillage à l'aide d'un solvant tel que l'éthanol (pour les protéines et les peptides 35) ou de l'acide formique (pour les lipides) peuvent être utilisés. Il convient également de noter que, pour les protéines et l'imagerie par peptide, les échantillons sont souvent lavés avec un solvant organique pour éliminer les petites molécules, y compris des lipides et des octobre utilisés pour le montage, mais une étape de lavage ne doit être effectuée avec des solvants qui ne dissolvent pas l' analytes d'intérêt, et doit être évitée pour smaanalyse de molécule de ll.
Le choix de la matrice est également crucial pour toutes les expériences MALDI, cependant, les performances en tissu matrice peut ne pas être le même que le rendement de la matrice avec un écart-purifiée. Par exemple, à la puissance de laser minimum, DT généré abondantes signaux de fond DT-semblables à des taches de matrice libre tissus et ces signaux ont été assignés comme les oligomères de DT et de leurs produits d'addition de sodium et de potassium correspondants, cependant, sur le tissu, plusieurs de ces signaux étaient pas observée, ce qui indique que l'essai de différentes matrices de l'échantillon spécifique de choix peut être important dans le choix de la matrice appropriée pour une analyse MALDI MSI donnée. DT est rarement utilisé pour l'analyse des lipides due à la forte fond rapporté générée par la matrice, mais, en comparaison avec DHB et services à domicile pour le profilage sur tissulaire des lipides par MALDI-MS FTICR, DT a produit des résultats favorables. Ainsi, cette matrice peut être une matrice potentiellement utiles pour l'imagerie des tissus MALDI utilisant cet instrument 34.
Efficace co-cristallisation de la matrice et l'analyte est une condition préalable à haute sensibilité analyse MALDI-MS. Ainsi, la solubilité en phase solide d'un analyte dans la matrice est importante dans le processus de 41,42 MALDI. Matrices MALDI avec des solubilités semblables à celles des analytes recherchés ont été rapportés pour produire les plus fortes intensités de signal de l'analyte. Parce que DT est un acide faible organique, ainsi que d'un composé organique très hydrophobe, sur la base de la théorie de Bronsted-Lowry neutralisation acide-base classique 43 et la théorie de la solubilité, il est prévu de favoriser l'ionisation de charge positive et moins polaire composés. En fait, nous avons constaté que les lipides polaires ont dominé les composés détectés dans le mode ions positifs lorsque DT a été utilisé comme matrice.
Les solvants utilisés pour la préparation d'une solution de matrice jouent également un rôle important dans l'analyse directe du tissu par MALDI-MS. Le pH a été impliquée en tant quefacteur important dans l'efficacité d'une matrice, et le TFA est un additif couramment utilisé avec CHCA et DHB. Cependant, avec DT, l'addition d'un modificateur de l'acide ou de la base a eu peu d'effet sur les données obtenues. En raison de l'hydrophobie de DT et de sa solubilité limitée dans les solvants polaires, il est recommandé un solvant organique lipophile. Lors de l'analyse des lipides, un mélange de chloroforme-méthanol (2:1, v: v) avec de l'acide formique à 1%, ce qui est typique d'un solvant organique pour l'extraction des lipides, a été utilisé. Nous avons postulé que cette offre une meilleure co-cristallisation des lipides avec DT. La nature du solvant lipophile peut également empêcher la solubilisation d'autres composés tels que des protéines et des sels, comme le montre la précédente surface liquide d'extraction analyse par spectrométrie de masse (MS) LESA-44 expériences. Cela conduirait à une meilleure cristallisation de la matrice et de lipides avec moins de contaminants. Le système de solvant qui est choisi pour une analyse devrait maximiser la solubilité de la matrice et le desianalytes rouges (lipides), tout en minimisant la solubilité des contaminants indésirables (sels et des protéines / peptides).
Le revêtement de la matrice sur la surface du tissu doit être aussi uniforme que possible. Afin d'optimiser la résolution spatiale de l'image, la taille des cristaux doit être aussi faible que possible 45. L'utilisation d'une matrice pulvérisateur électronique, la matrice peut être revêtue de manière uniforme et reproductible avec une petite taille de cristaux. C'est la méthode la plus pratique dans notre laboratoire. Il est bien préférable à l'application manuelle, car elle réduit la taille du spot, l'homogénéité et la reproductibilité. Cependant, un grand nombre de solvants qui sont utiles pour MSI de petites molécules ne sont pas compatibles avec les matériaux utilisés dans la fabrication de la matrice de pulvérisateur automatisé. Bien que n'étant pas encore mis en œuvre dans notre laboratoire, sublimation basée sur l'application de la matrice a été recommandée pour l'analyse des lipides 22. Cette méthode permet d'améliorer (c'est à dire réduit) la taille du spot, l'homogénéité et la reproductionbilité et ce devrait probablement être la méthode de choix lorsque la matrice choisie est aimable à cette méthode.
Pour le revêtement des matrices à base de solvants incompatibles avec le pulvérisateur automatisé de matrice (y compris le chloroforme), un autre procédé de revêtement de la matrice consiste à utiliser un pistolet aérographe. Pour ces solutions de matrice, nous avons utilisé un pulvérisateur aérographe assistance pneumatique. Bien que l'utilisation du pistolet aérographe n'est pas une méthode idéale, il peut être la seule méthode qui peut être utilisé pour les solvants et les matrices qui sont incompatibles avec les autres méthodes, et-avec la formation et l'expérience, il peut générer revêtement de matrice très uniforme. Lors de l'application de la solution de matrice manuellement, seule la quantité minimale de liquide doit être appliqué au cours de chaque cycle à peine mouiller la surface du tissu. Trop de liquide pourrait délocaliser analytes dues aux solvants organiques. Il ya des problèmes de reproductibilité avec application manuelle et d'expérience dans le revêtement de la lame avec cette méthode is essentiel pour le succès. En raison de la nature manuel de la brosse à l'air l'application de la matrice de pistolet, il faut veiller à faire en sorte qu'un revêtement uniforme est réalisé, un revêtement non-homogène peut conduire à des données asymétriques, qui est représentatif de la couche de matrice et non pas la localisation de l'analyte.
Lorsque la réalisation d'expériences MSI MALDI, l'identification initiale des analytes détectés est généralement basée sur la recherche métabolome des masses précises mesurées qui sont en général que lorsque un instrument à haute résolution est utilisé 38 de base de données. La source d'ions ESI / MALDI double sur le spectromètre de masse Apex-Qe de 12 Tesla hybride quadripolaire-FTICR permet l'ajout de signaux ESI-générés pour une utilisation comme les internes pics de calibrant de masse à chaque spectre de masse MALDI, sans affecter la désorption MALDI / processus d'ionisation. L'utilisation de l'étalonnage de masse interne est essentiel pour la précision de mesure de masse MALDI-haut dans FTICR. Étalonnage externe ne peut pas prendre pleinement en compte laeffets de charge d'espace dans la cellule ICR 46-48. Le réglage et l'étalonnage de la FTICR est crucial pour le succès. Sur ce type d'instrument un paramètre appelé le "temps de vol" (TOF), qui est le temps nécessaire pour qu'un ion de voyager dans la cellule de collision à l'analyseur (la cellule ICR) est l'une des plus importantes défini par l'utilisateur paramètres qui influencent la sensibilité de détection d'un instrument FTICR. Dans une plage de masse donnée (c'est à dire m / z 200-1,400), une TOF inférieure favorise la détection des ions m / z inférieurs et une TOF élevée favorise la détection de l'augmentation des ions m / z. Ainsi, pour la détection à haute sensibilité de deux m / z des ions faibles et élevées au sein de la plage de masse de détection, une valeur de TOF de 9 ms est souhaitable.
Pour une expérience pratique, un compromis doit être faite entre la taille raisonnable d'acquisition de données, la résolution en masse, et le temps consacré à l'acquisition de données d'imagerie MS. Pour une expérience MS FTICR, la taille du fichier de données acquis et la masse resolutisur dépendent de la taille de l'acquisition de données de la décroissance d'induction libre de signal (FID). Une taille plus élevé d'acquisition de données se traduira par une résolution de masse plus élevée et une plus grande taille de fichier de données. Cependant, une plus grande taille d'acquisition de données provoque également un taux de MS de balayage lent. Comme un compromis, il est recommandé que la taille de l'acquisition de données de 1024 kb / s être utilisé sur la FTICR. Une taille inférieure d'acquisition de données et une résolution plus faible masse correspondant ne permettent pas la séparation de certaines espèces d'ions isobares.
La trame taille d'étape de laser doit également être choisi de sorte qu'il est assez petit pour fournir une bonne résolution en pixels pour les images des analytes d'intérêt MS, mais une très petite taille de pas de trame peut faire les fichiers de données ingérable compte tenu d'un fichier de données MS d'imagerie est composée de milliers de spectres de masse MALDI. Compte tenu de la taille relativement importante de cristallins de boeufs, ca. -1,5 1,2 cm de diamètre, on a utilisé une taille de pas de trame de 250 um. L'utilisation d'un acqu données 1024 kb / staille de isition et un pm raster taille 250 étape, notre jeu de données de l'échantillon était d'environ 60 Gb. Lors de l'acquisition de données, une analyse de la place au hasard doit être utilisé, car cela empêche la polarisation basé sur la localisation progressive en raison de l'atténuation du signal, mais endroit aléatoire nécessite beaucoup plus de temps pour acquérir les données.
Parce que les jeux de données MALDI MSI acquises sur notre instrument FTICR MS comprennent des données de masse précises, le m / z extrait peut être recherché dans les bases de données métabolome tels que METLIN et / ou BDMH. En utilisant une fenêtre de ± 1 ppm les affectations initiales de nombreux signaux d'ions à métabolites sont de grande confiance. Toutefois, en raison de nombreuses espèces ont la même formule chimique, la confirmation de l'ID doit souvent être fait en utilisant d'autres moyens. Ainsi, des expériences MS / MS, et la comparaison des spectres MS / MS à celles déjà publiées doivent être effectués pour une identification confiant. Spectres MALDI-MS/MS peut parfois être acquis directement sur l'instrument FTICR, mais pour mamolécules lipidiques ny, leur abondance et / ou l'efficacité d'ionisation sont insuffisantes pour obtenir des données MS / MS utiles, et à l'enrichissement et de purification avant LC-MS/MS sont nécessaires. Dans ces analyses, la plupart des lipides observées étaient phospholipides polaires, et ont été affectés que les PC, PES, SMS, PS, PG, AP, et les phosphates de céramide (CERP), d'autres molécules lipidiques identifiés comprennent des lipides de stérol, camitines acyle et de glycérides. Sur la base des propriétés du solvant et de la matrice, c'est à prévoir. Les spectres de PC MS / MS contient un pic important à m / z 184,073, qui a été attribué au groupe polaire de tête PC, phosphocholine, ainsi que des informations supplémentaires importantes structurellement, ce qui peut donner une identification sans ambiguïté des molécules. En outre, en utilisant cette méthode, de nombreux lipides de stérols sont détectés, mais la plupart ne peuvent pas être clairement attribué à une identité unique, même avec des données MS / MS. Des produits d'addition de potassium solides prédominent généralement les spectres, mais protonée et sodiated adduits peuvent également être détectés.
Parce que le processus MS MALDI est seulement en mesure de fournir des informations de l'abondance relative basée sur le rendement d'ionisation locale au sein de chaque pixel, il faut prendre soin lors de l'interprétation des données MALDI MSI sans isotope stable de normes internes marqués 49. En outre, la confiance dans les résultats de la localisation, la confirmation de tous les motifs de distribution détectés doit être fait en utilisant des méthodes alternatives. LC-MS/MS spectacle sur des échantillons de tissus disséqués pour confirmation est recommandé.
Sur la base des masses précises mesurées dans les formules faible plage de masse de produits chimiques peut être généré pour un m / z donné, à l'intérieur d'une erreur de masse de 1 ppm et en permettant un nombre illimité de C, H, O et N, et d'un maximum de 2 S et 2 P souvent une composition élémentaire unique est possible. Cette m / z peut également être consulté sur le BDMH et les bases de données METLIN, ce qui peut donner des composés candidats potentiels. Malheureusement,sur la FTICR MS le seuil de faible masse est ca. 130 Da, ce qui peut rendre difficile l'exécution directement MS / MS. Ainsi, la confirmation en utilisant un autre système est souvent nécessaire.
Q-TOF expériences LC-MS/MS sont couramment effectués sur les échantillons de tissus qui ont été disséqués manuellement des zones spécifiques des tissus d'intérêt. En utilisant le procédé d'extraction des lipides décrits, Xics peuvent être générés pour les composés cibles et MS / MS peut être acquis pour confirmation. Soit par rapport à une norme authentique ou de novo élucidation de la structure est nécessaire avant qu'il puisse être une affectation chimique confiant.
Dithranol a été utilisée pour explorer les modes de distribution des lipides dans la lentille de veau bovin et également testée sur le foie de rat, de coeur, de rein et les tissus 34. MALDI MSI peut être utilisé pour le diagnostic d'états pathologiques chez l'homme et il est déjà utilisée pour l'analyse histopathologique de 50. Avec le développement de plus robuste et plus rapide technologies pour MALDI MSI, la localisation spatiale de composés spécifiques peuvent être des informations utiles pour un pathologiste. Une fois que l'analyte peut être imagé en routine en utilisant un procédé basé sur MSI MALDI, il peut être utilisé à des fins diagnostiques. En effet, l'imagerie des tissus peut être effectuée dans un milieu hospitalier, avec un instrument situé à proximité de la salle d'opération, où, comme on l'a déjà démontré 51, elle pourrait être utilisée pour déterminer précisément les marges de tumeurs.
Déclarations de divulgation
Nous n'avons rien à communiquer.
Remerciements
Les auteurs tiennent à remercier Génome Canada et Génome Colombie-Britannique pour le financement de la plate-forme, et de soutien. Nous remercions également le Dr Carol E. Parker pour un examen critique du manuscrit et l'édition assistance. CHL remercie également le Britannique protéomique réseau britannique de soutien.
matériels
| Name | Company | Catalog Number | Comments |
| Rat Liver | Pel-Freez Biologicals | 56023-2 | |
| Bovine Calf Lens | Pel-Freez Biologicals | 57114-2 | Sample should be decapsulated29 before use |
| Dithranol (DT) | Sigma-Aldrich | 10608 | MALDI Matrix |
| α-Cyano-4-hydroxy-cinnamic Acid (CHCA) | Sigma-Aldrich | 70990 | MALDI Matrix |
| 2,5-Dihydroxybenzoic Acid (DHB) | Sigma-Aldrich | 85707 | MALDI Matrix |
| Reserpine | Sigma-Aldrich | 83580 | |
| Terfenadine | Sigma-Aldrich | T9652 | |
| Formic Acid | Sigma-Aldrich | 14265 | |
| Ammonium Formate | Sigma-Aldrich | 14266 | |
| Ammonium Hydroxide | Sigma-Aldrich | 320145 | |
| Trifluoroacetic Acid (TFA) | Sigma-Aldrich | 302031 | |
| Water | Sigma-Aldrich | 39253 | |
| Methanol | Sigma-Aldrich | 34860 | |
| Acetonitrile | Sigma-Aldrich | 34967 | |
| Ethyl Acetate | Sigma-Aldrich | 34972 | |
| Isopropanol | Sigma-Aldrich | 34965 | |
| Chloroform | Sigma-Aldrich | 366927 | |
| Acetone | Sigma-Aldrich | 34850 | |
| Ethanol | Commercial Alcohols | 95% | |
| ES Tuning Mix | Agilent Technologies | G2431A | |
| ITO Coated Glass Slides | Hudson Surface Technology | PSI1207000 | Ensure that samples are placed on the electrically conductive side |
| Wite-Out Shake-N-Squeeze Correction Pen | Bic | WOSQP11 | |
| Airbrush Sprayer | Iwata | Eclipse HP-CS | |
| ImagePrep | Bruker | 249500-LS | |
| MALDI adapter | Bruker | 235380 |
Références
- Chaurand, P., Stoeckli, M., Caprioli, R. M. Direct Profiling of Proteins in Biological Tissue Sections by MALDI Mass Spectrometry. Anal. Chem. 71, 5263-5270 (1999).
- Caprioli, R. M., Farmer, T. B., Gile, J. Molecular Imaging of Biological Samples. Localization of Peptides and Proteins Using MALDI-TOF MS. Anal. Chem. 69, 4751-4760 (1997).
- Amstalden van Hove, E. R., Smith, D. F., Heeren, R. M. A. A concise review of mass spectrometry imaging. J. Chromatogr. A. 1217, 3946-3954 (2010).
- Norris, J. L., Caprioli, R. M. Analysis of Tissue Specimens by Matrix-Assisted Laser Desorption/Ionization Imaging Mass Spectrometry in Biological and Clinical Research. Chem. Rev. Feb 11, (2013).
- Walch, A., Rauser, S., Deininger, S. -. O., Höfler, H. MALDI imaging mass spectrometry for direct tissue analysis: a new frontier for molecular histology. Histochem. Cell Biol. 130, 421-434 (2008).
- Hsieh, Y., et al. Matrix-assisted laser desorption/ionization imaging mass spectrometry for direct measurement of clozapine in rat brain tissue. Rapid Commun. Mass Spectrom. 20, 965-972 (2006).
- Trim, P. J., et al. Matrix-assisted laser desorption/ionization-ion mobility separation-mass spectrometry imaging of vinblastine in whole body tissue sections. Anal. Chem. 80, 8628-8634 (2008).
- Khatib-Shahidi, S., Andersson, M., Herman, J. L., Gillespie, T. A., Caprioli, R. M. Direct molecular analysis of whole-body animal tissue sections by imaging MALDI mass spectrometry. Anal. Chem. 78, 6448-6456 (2006).
- Atkinson, S. J., Loadman, P. M., Sutton, C., Patterson, L. H., Clench, M. R. Examination of the distribution of the bioreductive drug AQ4N and its active metabolite AQ4 in solid tumours by imaging matrix-assisted laser desorption/ionisation mass spectrometry. Rapid Commun. Mass Spectrom. 21, 1271-1276 (2007).
- Drexler, D. M., et al. Utility of imaging mass spectrometry (IMS) by matrix-assisted laser desorption ionization (MALDI) on an ion trap mass spectrometer in the analysis of drugs and metabolites in biological tissues. J. Pharmacol. Toxicol. Methods. 55, 279-288 (2007).
- Prideaux, B., Stoeckli, M. Mass spectrometry imaging for drug distribution studies. J. Proteomics. 75, 4999-5013 (2012).
- Sugiura, Y., Setou, M. Imaging Mass Spectrometry for Visualization of Drug and Endogenous Metabolite Distribution: Toward In Situ Pharmacometabolomes. J. Neuroimmune Pharmacol. 5, 31-43 (2009).
- Garrett, T. J., Yost, R. A. Analysis of intact tissue by intermediate-pressure MALDI on a linear ion trap mass spectrometer. Anal. Chem. 78, 2465-2469 (2006).
- Woods, A. S., Jackson, S. N. Brain tissue lipidomics: direct probing using matrix-assisted laser desorption/ionization mass spectrometry. AAPS J. 8, 391-395 (2006).
- Cha, S., Yeung, E. S. Colloidal graphite-assisted laser desorption/ionization mass spectrometry and MSn of small molecules. 1. Imaging of cerebrosides directly from rat brain tissue. Anal. Chem. 79, 2373-2385 (2007).
- Burnum, K. E., et al. Spatial and temporal alterations of phospholipids determined by mass spectrometry during mouse embryo implantation. J. Lipid Res. 50, 2290-2298 (2009).
- Veloso, A., et al. Anatomical distribution of lipids in human brain cortex by imaging mass spectrometry. J. Am. Soc. Mass Spectrom. 22, 329-338 (2011).
- Tanaka, H., et al. Distribution of phospholipid molecular species in autogenous access grafts for hemodialysis analyzed using imaging mass spectrometry. Anal. Bioanalyt. Chem. 400, 1873-1880 (2011).
- Lou, X., van Dongen, J. L., Vekemans, J. A., Meijer, E. W. Matrix suppression and analyte suppression effects of quaternary ammonium salts in matrix-assisted laser desorption/ionization time-of-flight mass spectrometry: an investigation of suppression mechanism. Rapid Comm. Mass Spectrom. 23, 3077-3082 (2009).
- Knochenmuss, R., Karbach, V., Wiesli, U., Breuker, K., Zenobi, R. The matrix suppression effect in matrix-assisted laser desorption/ionization: application to negative ions and further characteristics. Rapid Commun. Mass Spectrom. 12, 529-534 (1998).
- Puolitaival, S. M., Burnum, K. E., Cornett, D. S., Caprioli, R. M. Solvent-free matrix dry-coating for MALDI imaging of phospholipids. J. Am. Soc. Mass Spectrom. 19, 882-886 (2008).
- Hankin, J. A., Barkley, R. M., Murphy, R. C. Sublimation as a Method of Matrix Application for Mass Spectrometric Imaging. J. Am. Soc. Mass Spectrom. 19, 1646-1652 (2007).
- Grove, K. J., Frappier, S. L., Caprioli, R. M. Matrix pre-coated MALDI MS targets for small molecule imaging in tissues. J. Am. Soc. Mass Spectrom. 22, 192-195 (2011).
- Fuchs, B., Süss, R., Schiller, J. An update of MALDI-TOF mass spectrometry in lipid research. Prog. Lipid Res. 49, 450-475 (2010).
- Murphy, R. C., Hankin, J. A., Barkley, R. M., Zemski Berry, K. A. MALDI imaging of lipids after matrix sublimation/deposition. Biochim. Biophys. Acta. 1811, 970-975 (2011).
- Vermillion-Salsbury, R. L., Hercules, D. M. 9-Aminoacridine as a matrix for negative mode matrix-assisted laser desorption/ionization. Rapid Commun. Mass Spectrom. 16, 1575-1581 (2002).
- Hu, C., et al. Analytical strategies in lipidomics and applications in disease biomarker discovery. J. Chromatogr. B Analyt. Technol. Biomed. Life Sci. 877, 2836-2846 (2009).
- Miura, D., et al. Ultrahighly sensitive in situ metabolomic imaging for visualizing spatiotemporal metabolic behaviors. Anal. Chem. 82, 9789-9796 (2010).
- Cerruti, C. D., Benabdellah, F., Laprevote, O., Touboul, D., Brunelle, A. MALDI Imaging and Structural Analysis of Rat Brain Lipid Negative Ions with 9-Aminoacridine Matrix. Anal. Chem. 84, 2164-2171 (2012).
- Astigarraga, E., et al. Profiling and Imaging of Lipids on Brain and Liver Tissue by Matrix-Assisted Laser Desorption/Ionization Mass Spectrometry Using 2-Mercaptobenzothiazole as a Matrix. Anal. Chem. 80, 9105-9114 (2008).
- Whitehead, S. N., et al. Imaging mass spectrometry detection of gangliosides species in the mouse brain following transient focal cerebral ischemia and long-term recovery. PloS one. 6, e20808 (2011).
- Cornett, D. S., Frappier, S. L., Caprioli, R. M. MALDI-FTICR imaging mass spectrometry of drugs and metabolites in tissue. Anal. Chem. 80, 5648-5653 (2008).
- Deininger, S. O., et al. Normalization in MALDI-TOF imaging datasets of proteins: practical considerations. Anal. Bioanalyt. Chem. 401, 167-181 (2011).
- Le, C. H., Han, J., Borchers, C. H. Dithranol as a MALDI matrix for tissue imaging of lipids by Fourier transform ion cyclotron resonance mass spectrometry. Anal. Chem. 84, 8391-8398 (2012).
- Han, J., Schey, K. L. MALDI Tissue Imaging of Ocular Lens α-Crystallin. Invest. Ophthalmol. Vis. Sci. 47, 2990-2996 (2006).
- Schwartz, S. A., Reyzer, M. L., Caprioli, R. M. Direct tissue analysis using matrix-assisted laser desorption/ionization mass spectrometry: practical aspects of sample preparation. J. Mass Spectrom. 38, 699-708 (2003).
- Chen, Y., et al. Imaging MALDI mass spectrometry of sphingolipids using an oscillating capillary nebulizer matrix application system. Meth. Mol. Biology. 656, 131-146 (2010).
- Han, J., et al. Towards high throughput metabolomics using ultrahigh field Fourier transform ion cyclotron resonance mass spectrometry. Metabolomics. 4, 128-140 (2008).
- Smith, C. A., et al. METLIN: a metabolite mass spectral database. Ther. Drug Monit. 27, 747-751 (2005).
- Wishart, D. S., et al. HMDB: a knowledgebase for the human metabolome. Nucleic Acids Res. 37, D603-D610 (2009).
- Hoteling, A. J., Erb, W. J., Tyson, R. J., Owens, K. G. Exploring the importance of the relative solubility of matrix and analyte in MALDI sample preparation using HPLC. Anal. Chem. 76, 5157-5164 (2004).
- Hoteling, A. J., Mourey, T. H., Owens, K. G. Importance of solubility in the sample preparation of poly(ethylene terephthalate. for MALDI TOFMS. Anal. Chem. 77, 750-756 (2005).
- Shroff, R., Rulísek, L., Doubsky, J., Svatos, A. Acid-base-driven matrix-assisted mass spectrometry for targeted metabolomics. Proc. Nat. Acad. Sci. U.S.A. 106, 10092-10096 (2009).
- Eikel, D., et al. Liquid extraction surface analysis mass spectrometry (LESA-MS) as a novel profiling tool for drug distribution and metabolism analysis: the terfenadine example. Rapid Comm. Mass Spectrom. 25, 3587-3596 (2011).
- Sadeghi, M., Vertes, A. Crystallite size dependence of volatilization in matrix-assisted laser desorption ionization. Appl. Surf. Sci. 127 - 129, 226-234 (1998).
- O'Connor, P. B., Costello, C. E. Internal Calibration on Adjacent Samples (InCAS) with Fourier Transform Mass Spectrometry. Anal. Chem. 72, 5881-5885 (2000).
- Jing, L., Amster, I. J. An improved calibration method for the matrix-assisted laser desorption/ionization-Fourier transform ion cyclotron resononance analysis of 15N-metabolically- labeled proteome digests using a mass difference approach. Eur. J. Mass Spectrom. 18, 269-277 (2012).
- Zhang, L. -. K., Rempel, D., Pramanik, B. N., Gross, M. L. Accurate mass measurements by Fourier transform mass spectrometry. Mass Spectrom. Rev. 24, 286-309 (2005).
- Clemis, E. J., et al. Quantitation of spatially-localized proteins in tissue samples using MALDI-MRM imaging. Anal. Chem. 84, 3514-3522 (2012).
- Schwamborn, K., Caprioli, R. M. Molecular imaging by mass spectrometry--looking beyond classical histology. Nat. Rev. Cancer. 10, 639-646 (2010).
- Oppenheimer, S. R., Mi, D., Sanders, M. E., Caprioli, R. M. Molecular analysis of tumor margins by MALDI mass spectrometry in renal carcinoma. J. Proteome Res. 9, 2182-2190 (2010).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon