Method Article
El ditranol como una matriz para láser asistida por matriz de desorción / ionización de imágenes en una transformada de Fourier de iones de resonancia de ciclotrón Espectrómetro de Masas
En este artículo
Resumen
El ditranol (DT; 1,8-dihidroxi-9 ,10-dihydroanthracen-9-ona) ha sido reportado anteriormente como una matriz de MALDI para obtener imágenes de tejido de pequeñas moléculas; protocolos para el uso de DT para la formación de imágenes de MALDI de los lípidos endógenos en la superficie de secciones de tejido por-ion positivo MALDI-MS en un instrumento cuadrupolar-FTICR ultra alta resolución se proporcionan aquí.
Resumen
De formación de imágenes Espectrometría de masas (MSI) determina los patrones de localización y la distribución espacial de los compuestos sobre la superficie de una sección de tejido, usando principalmente de MALDI (matriz asistida por láser de desorción / ionización) basado en técnicas analíticas. Se necesitan nuevas matrices de molécula pequeña MSI, que pueden mejorar el análisis de bajo peso molecular (MW) los compuestos. Estas matrices deberán ofrecer mayores señales de analitos mientras que disminuye las señales de fondo MALDI. Además, el uso de instrumentos de ultra-alta resolución, tales como iones de transformada de Fourier de resonancia ciclotrón (FTICR) espectrómetros de masas, tiene la capacidad de resolver señales de analito a partir de señales de la matriz, y esto puede superar parcialmente muchos problemas asociados con el fondo procedente de la MALDI matriz. La reducción de las intensidades de los grupos de matriz metaestables por FTICR MS también puede ayudar a superar algunas de las interferencias de la matriz asociados con picos de otros instrumentos. De alta resolucióninstrumentos tales como los espectrómetros de masas FTICR son ventajosas, ya que pueden producir patrones de distribución de muchos compuestos simultáneamente mientras que todavía proporciona confianza en las identificaciones químicos. Ditranol (DT; 1,8-dihidroxi-9 ,10-dihydroanthracen-9-ona) ha sido reportado anteriormente como una matriz MALDI para obtener imágenes de los tejidos. En este trabajo, un protocolo para el uso de DT para MALDI imágenes de lípidos endógenos de las superficies de las secciones de tejidos de mamíferos, por-ion positivo MALDI-MS, en un cuadrupolo híbrido ultra alta resolución ha sido proporcionada instrumento FTICR.
Introducción
De formación de imágenes Espectrometría de masas (MSI) es una técnica analítica para la determinación de los patrones de localización y la distribución espacial de los compuestos sobre la superficie de una sección de tejido 1,2. Matrix asistida por láser de desorción / ionización (MALDI) MSI para el análisis de péptidos y proteínas se ha utilizado durante más de una década y ha habido grandes mejoras en los métodos de preparación de muestras, la sensibilidad de detección, resolución espacial, la reproducibilidad y procesamiento de datos 3,4. Mediante la combinación de información de las secciones teñidas histológicamente y experimentos MSI, patólogos son capaces de correlacionar las distribuciones de compuestos específicos con características interesantes patofisiológicamente 5.
Los patrones de distribución de pequeñas moléculas, incluyendo fármacos exógenos 6,7 y sus metabolitos 8-10 también han sido interrogados por MALDI-MS de formación de imágenes de tejido 11. Los lípidos son quizás el más estudiado cla-ampliamentess de compuestos con imágenes MALDI, tanto en los MS 12-17 y MS / MS de 18 modos. El uso de MALDI MSI para la imagen pequeña molécula ha sido limitada por varios factores: 1) matrices de MALDI son ellos mismos moléculas pequeñas (típicamente m / z <500), que generan señales de iones abundantes. Estas señales abundantes pueden suprimir la ionización de analitos de moléculas pequeñas e interferir con su 19,20 detección. Recubrimiento libre de disolventes matriz 21, la sublimación de la matriz 22, y la matriz de MALDI MS prerrecubierto 23, entre otros, se han desarrollado para mejorar la MSI de pequeñas moléculas.
Las nuevas matrices que pueden mejorar el análisis de compuestos de bajo MW son de gran interés en la pequeña molécula de MSI. Estas matrices deberán ofrecer mayores señales de analitos con las señales de la matriz disminuido. En el modo de ion positivo, 2,5-dihidroxibenzoico (DHB) y-4-hidroxicinámico α-ciano ácido (CHCA) son las dos matrices MALDI MS comúnmente utilizados para MSI 24 . La matriz ideal sería formar cristales pequeños, a fin de preservar la localización espacial de los analitos. DHB tiende a formar cristales más grandes, por lo tanto, la aplicación de la matriz usando la sublimación se ha desarrollado para superar parcialmente este problema, y ha permitido el uso de esta matriz para formación de imágenes sensibles de los fosfolípidos de 22,25. 9-amino-acridina se ha usado para MSI de analitos próticos en el modo de ion positivo 26 y para los nucleótidos y fosfolípidos en el modo de 26-29-ion negativo. 2-mercaptobenzotiazol se ha encontrado para dar la detección de MALDI eficiente de lípidos 30, y se ha utilizado para la formación de imágenes de cerebro de ratón gangliósidos 31. La resolución ultra alta de iones de transformada de Fourier de resonancia ciclotrón (FTICR) espectrómetros de masas algo pueden aliviar este problema mediante la resolución de las señales de analito a partir de señales de la matriz 32. Otra ventaja de la utilización de FTICR-MS es que las intensidades de los grupos de matriz son metaestables reduccióned 33, lo que también reduce estas interferencias 27.
El uso de ditranol (DT; 1,8-dihidroxi-9 ,10-dihydroanthracen-9-ona) como una matriz de MALDI para obtener imágenes de tejido ha sido previamente reportado 34. En este trabajo actual, se proporciona un protocolo detallado para el uso de DT para el MSI de los lípidos endógenos en las superficies de las secciones de tejido de la lente de la especie bovina, en el modo de ion positivo.
Protocolo
1. Seccionar los tejidos
- Flash congelar las muestras temáticas, una vez cosechados, con nitrógeno líquido, enviarlos en hielo seco (si se requiere el envío), y almacenar a -80 ° C hasta seccionar los tejidos. (Si se utilizan muestras comerciales, asegúrese de que las muestras se prepararon de esta manera.)
- Cortar los órganos a un tamaño manejable para adaptarse a la diana MALDI. Recorte los partes no deseadas del órgano. Para este estudio se describe aquí, las lentes de ternera fueron decapsulated usando un procedimiento descrito previamente-35 antes de seccionar los tejidos.
- Retire órganos enteros desde -80 ° C congelador y fijarlos a un escenario de corte de tejido criogénico. Para corregir una lente de ternera, coloque una o dos gotas de agua en la etapa de corte de tejido de un criostato. Coloque rápidamente la lente en el agua antes de que se solidifique. Alternativamente, la temperatura óptima de corte (OCT) compuestos también se pueden usar para fijar un tejido en la etapa de corte. Si se usan compuestos octubre, un miniMal cantidad de la OCT se debe aplicar y se debe tener cuidado para asegurar que las secciones de tejido cortada no estar contaminados con compuestos PTU que pueden interferir con la ionización y la detección de los analitos 5,36,37.
- Deje que la temperatura en el interior del criostato se equilibre a -18 ° C. Las temperaturas más frías o más calientes se pueden utilizar para los tejidos más blandos o más duros, respectivamente. A continuación, cortar el tejido ecuatorial en 20 micras rodajas gruesas. Utilice 10-15 micras rodajas gruesas para la mayoría de los tejidos, sin embargo, debido a la naturaleza frágil del tejido del cristalino bovino, se utilizaron 20 micras rodajas gruesas. Para el tejido cristalino bovino, deseche los primeros cortes de tejido y sólo usar sectores que están cerca o en el plano ecuatorial.
- Si se forma la imagen de un tejido de la lente ocular, utilizar 1,5 l de ácido fórmico (98% en pureza, CL-EM grado) a prehumedecido la superficie de un óxido de indio y estaño (ITO) recubiertos con portaobjetos de vidrio.
- Transferir cuidadosamente las secciones de tejido de la superficie de la ITO-coportaobjetos de vidrio ATED dentro del criostato. La sección de tejido se descongelará rápidamente y se convertirá firmemente fijado a la superficie de deslizamiento. Por lo general, múltiples secciones de tejido se pueden montar en un mismo portaobjetos recubiertos de ITO de esta manera.
- Liofilizar la corredera durante 15 min antes de la aplicación de la matriz de MALDI.
- Para la prueba de matriz, disolver las matrices individuales en disolventes apropiados. Detectar manualmente 1 l de cada solución de matriz en la sección de tejido. Además, detectar un patrón de calibración de molécula pequeña sobre el tejido para la verificación de la sensibilidad de MALDI.
- Añadir tres marcas de enseñanza para el portaobjetos de vidrio recubierto de ITO por la escritura en la superficie no conductora de la placa de vidrio recubierto de ITO con un lápiz corrector-fluido. Tome una imagen óptica de la diapositiva tejido utilizando un escáner de superficie plana y guardarlo en un formato adecuado, como tiff o jpg.
2. Revestimiento de matriz
2.1. Automatizado matriz de revestimiento
- Apsoluciones de matriz de capas, que contienen acetonitrilo o acetonitrilo / agua mezclada como disolventes, automáticamente a las superficies de las secciones de tejido utilizando un ImagePrep Bruker o un pulverizador de matriz electrónico similar.
- Cubrir los bordes de la superficie frontal de la corredera de vidrio recubierta con ITO con cinta de modo que la matriz no hace recubrir los bordes de la diapositiva. Esto asegura que las marcas de enseñanza sobre la superficie opuesta se pueden utilizar para la alineación de diapositivas tejido. No cubra los bordes de la corredera con la matriz a medida que se utilizan como puntos de contacto para mantener la conductividad eléctrica de la corredera recubierto con ITO.
- Cubra el portaobjetos de vidrio utilizando veinte ciclos de revestimiento de matriz (spray de 2 segundos, la incubación de 30 segundos y 60 segundos el tiempo de secado para cada ciclo).
2.2. Revestimiento de matriz Manual
- Si disolventes orgánicos (por ejemplo, cloroformo y acetato de etilo) que son incompatibles con los materiales de fabricación de la matriz de pulverizador electrónica necesarias para evirojo, utilice un pulverizador aerógrafo neumáticamente asistida para aplicar la matriz. Añadir la solución de matriz preparados para el depósito de disolvente de la pistola de aerógrafo y aplicar un ligero flujo de gas nitrógeno presurizado para cebar el pulverizador.
- Cubrir los bordes de la superficie frontal de los portaobjetos de vidrio recubiertos con ITO con cinta de modo que la matriz no hace recubrir los bordes de la diapositiva. Esto asegura que las marcas de enseñanza sobre la superficie opuesta se pueden utilizar para la alineación de diapositivas tejido. No cubra los bordes de la corredera con la matriz a medida que se utilizan como puntos de contacto para mantener la conductividad eléctrica de la corredera recubierto con ITO.
- Después de que se han observado los aerosoles estables y finos, rocíe manualmente la matriz de manera que haya finalizado la fase cubre la sección de tejido. Aplicar la cantidad mínima de solución de matriz requerido para mojar apenas la superficie durante cada ciclo para evitar la posible deslocalización analito. En general, utilizar aproximadamente 10 ciclos de pulverización de matriz para revestir una sección de tejido; el número de ciclos esdepende del tipo de tejido y la composición de la matriz.
3. MALDI MS
- Preparar una solución de calibración de masas por dilución de la solución "ES ajuste Mix" estándar por un factor de 1:200 en 60:40 de isopropanol: agua (que contiene ácido fórmico al 0,1% en la mezcla final).
- Introducir 2 l / min de la solución diluida "ES ajuste Mix" en el modo dual de ionización por electrospray (ESI) / fuente de iones MALDI en el espectrómetro de masas FTICR, desde el lado de ESI.
- Utilice el instrumento FTICR en el modo ESI-iones positivos, con detección de banda ancha y un tamaño de adquisición de datos de 1.024 kb / s. ESI parámetros típicos son la tensión de electrospray capilar, 3900 V; rociar tensión escudo, 3600 V; de gas nebulizador (2 N) de flujo, 2 L / min; gas seco (N 2) de flujo y la temperatura, 4 L / min y 200 º C; skimmer 1 tensión, 15 V, el tiempo de vuelo (TOF), 0,009 segundos; gas de colisión (Ar) de flujo, 0,4 l / s; fuente de iones tiempo de acumulación, 0,1 seg;y celda de colisión de iones tiempo de acumulación, 0,2 seg. Ajustar los parámetros de operación FTICR con el fin de maximizar la sensibilidad analítica sobre el rango de masas de m / z 200 a 1400, mientras se mantiene buena de dominio de tiempo-libre de la inducción de la caries señales (FID). Por lo general, los parámetros de funcionamiento de ICR son tensión sidekick, 8 V; Sidekick tensión de offset, 8 V; amplificación de excitación de 10; excitación tiempo de impulso, 0,01 hasta 0,015 seg; tensión trampa placa frontal, 1.5 V, trampa de nuevo la tensión de placa, 1,6 V y tensión de entrada del analizador, -4 V. Después de que se ha determinado un conjunto de parámetros de funcionamiento FTICR, adquirir los espectros de masas ESI y calibrar el instrumento usando las masas de referencia de los compuestos estándar en la solución "ES ajuste Mix".
- Para afinar el instrumento para el funcionamiento de MALDI, disolver varias alícuotas de 1 l de una mezcla de terfenadina y solución estándar reserpina en la solución de matriz a una concentración de 1 M cada uno, y en el clavo estas soluciones directamente sobre uno de los tissusecciones E (es decir, una sección de tejido de prueba) que ha sido montado en una corredera recubierto con ITO. Colocar el portaobjetos recubierto con ITO en un adaptador de diapositivas de tejido (es decir, una diana de MALDI especial) y cargar el adaptador desde el lado de MALDI en la fuente de iones ESI / MALDI doble. Optimizar los parámetros de funcionamiento de MALDI adecuados para la potencia del láser y el número de disparos de láser para la acumulación de señales MALDI para cada exploración de masas, etc parámetros de operación MALDI típicos son: disparos láser, 50, y una tensión de la placa de MALDI de 300 V.
- Después de la sintonización, la calibración, y optimizando el instrumento para experimentos de MALDI-MSI, alinear la ubicación física de una sección de tejido a ser fotografiado con su óptica de la imagen registrada en el software de imágenes. Utilice las tres marcas de "corrección"-de fluido, que se habían puesto previamente en el lado opuesto de la superficie de deslizamiento recubierto con ITO (paso 1.9), para esta alineación utilizando un método de triangulación de tres puntos.
- Realice una ESI y MAL simultáneaOperación DI para que cada espectro de masas contiene los picos de masa de referencia de la solución "ES Sintonía Mix" de post-adquisición calibración de masa interna. Esto dará como resultado en la medición de la masa más precisa durante MALDI MS. Para hacer esto, primero atenuar la señal ESI por la disminución de la tensión capilar hasta que las señales de MALDI dominan los espectros mientras que las señales calibrantes ESI son todavía lo suficientemente alta para la calibración de masa interno.
- A continuación, configure un método rastering automatizado para la irradiación láser. Definir las regiones de tejido para formar imágenes y establecer el tamaño adecuado paso raster láser. Tenga en cuenta que los tamaños de paso más pequeña trama proporcionan imágenes de tejidos de mayor resolución, sino que requieren un tiempo significativamente mayor masa espectral adquisición y más espacio de almacenamiento de datos. El número de los píxeles de la imagen depende del tamaño de paso de trama láser para configurar y el tamaño del tejido. Para una lente bovina típica que tiene un tamaño de 1 cm 2 de tejido, una imagen de tejido se compone típicamente de CA. 5000 píxeles si un tamaño de paso de trama láser de 200 micras se utiliza en un instrumento FTICR. Utilizar un análisis "in situ al azar", ya que esto evita el sesgo basado en la ubicación debido a la atenuación de la señal progresiva durante el experimento.
4. Análisis de Datos
- Calibrar los espectros de masas MALDI usando calibración interna para la comparación inicial y para seleccionar picos de MS / MS. De-isótopo y seleccione los picos monoisotopic como se describió anteriormente, utilizando una secuencia de comandos de VBA personalizado 38.
- Exportar el resultado pico listas monoisotopic y introducir los valores de m / z medido en el METLIN 39 y / o las bases de datos HMDB 40 metabolome para la coincidencia de masa con las entradas de biblioteca. Considere la (M + H) +, (M + Na) +, y (M + K) + iones durante las búsquedas de bases de datos, con un error de masa permisible de ± 1 ppm.
- Generar imágenes MALDI para todas las entidades de lípidos detectados a través de toda la sección de tejido usando imagsoftware de e-análisis, con una anchura filtro de masa de 1 ppm en el vértice del pico.
- Una vez que las imágenes han sido generados para todos los valores de m / z que coinciden con las entradas de la base de datos, generación de imágenes para todos los demás picos y buscar patrones de distribución únicas que pueden ser investigados más tarde.
5. La confirmación de la identidad de los Lípidos Imaged
- Confirmar las identidades de los lípidos de alta abundancia, que tienen iones fragmentados característicos que se pueden detectar usando el instrumento FTICR (por ejemplo, 184.073 para fosfolípidos), por MALDI-MS/MS. Realizar MALDI-MS/MS usando disociación inducida por colisión (CID) directamente sobre el tejido.
- Para las especies de lípidos que no pueden ser confirmadas directamente por MALDI-MS/MS, utilizar un sistema de UPLC acoplado a un espectrómetro de masas Q-TOF 34.
- Diseccionar manualmente alícuotas que contienen ~ 10 mg de tejido de la zona donde se localizan las especies de interés. Coloque estas alícuotas de tejidos en 2tubos de centrífuga ml.
- Homogeneizar cada alícuota de tejido en 250 l de agua, utilizando un molino mezclador con dos bolas de metal de acero inoxidable de 5 mm.
- Añadir 1 ml de solución de cloroformo-metanol (1:3, v / v), y agitar los tubos. A continuación, centrifugar los tubos utilizando una microcentrífuga a 12.000 xg durante 10 min.
- Reunir los sobrenadantes y secarlos en un concentrador de velocidad rotatorio al vacío.
- Disolver el residuo en 100 l de isopropanol: agua 30:70. Inyectar una alícuota de 10 l en la columna de la UPLC para la separación usando un gradiente de elución.
- Utilice las condiciones cromatográficas para LC-MS/MS lípidos en línea, que han sido previamente publicados 34.
- Generar corriente de iones extraídos (XIC) los cromatogramas con los valores teóricos m / z, con una ventana de ± 50 ppm alrededor de las masas teóricas.
- Si están disponibles compuestos auténticos para los lípidos, que coincida con los tiempos de retención de los compuestos auténticos con los de la correspondiente picos XIC de las muestras de tejido. Si los compuestos son los mismos, los tiempos de retención y los espectros de MS / MS deben coincidir.
- Si un compuesto auténtico no está disponible, utilice el patrón de fragmentación de los lípidos detectado para que coincida con un espectro estándar de MS / MS de una base de datos metabolome como METLIN o HMDB. Utilice la interpretación de espectros de masas de novo para determinar una posible estructura de los lípidos.
Resultados
Las muestras de tejido que se seccionan y se montaron deshielo en los portaobjetos de vidrio recubiertos de ITO deben estar intactos, sin rotura visible. Para muchos tejidos, montaje sobre un portaobjetos de vidrio recubierto de ITO deshielo tisular directa es aceptable. Para algunos tejidos específicos, tales como lente bovina, extensa desgarro del tejido se ve a menudo cuando se usa un montaje deshielo directa (Figura 1a). Prerrecubrimiento del portaobjetos de vidrio de ITO con etanol o ácido fórmico (Figura 1b) ayuda a mantener la integridad de las secciones de tejido durante el montaje tejido.
Tanto la elección de la matriz y la selección de disolvente son factores importantes que influyen en la calidad de los espectros de MALDI. Cuando un espectro de MALDI MS apropiada se adquiere desde la sección de tejido, el espectro de masas es por lo general densa con señales de lípidos dentro del intervalo de detección de masas (Figura 2a). Una matriz y un disolvente debe ser elegido de manera que tengan polaridadesont-size: 14.399999618530273px; line-height:. 28px; "> similar a los analitos de interés, debido a que el proceso de MALDI requiere una solución en fase sólida de la sustancia analizada en los cristales de la matriz general, los mejores intensidades de señal analito provienen de la utilización de matrices MALDI con solubilidades similares a la de los analitos deseados 41,42. Figura 2a muestra un ejemplo de un espectro producido con un disolvente eficiente matriz (70% de ACN con TFA al 0,01%), y la Figura 2b muestra una mala elección de la matriz y disolvente (70% de MeOH con 0,01% de TFA) para ditranol.
Uno de los beneficios de un doble modo de ionización por electrospray (ESI) / fuente de iones MALDI es que permite la adición de señales de calibrantes ESI mientras que la adquisición de espectros de MALDI simultáneamente sin interferir con el proceso de ablación. Estas señales calibrantes ESI permiten la calibración masa interna para proporcionar una alta precisión en masa con masa de error <0.5 ppm 38. A medida que elESI señal de la solución estándar "ES ajuste Mix" puede ser un orden de magnitud más fuerte que las señales de MALDI de los analitos de los tejidos, las señales derivadas calibrantes-ESI deben ser atenuadas. Señales de calibrador deben ser visibles y de intensidad suficiente para la calibración de los espectros, pero no deben dominar los espectros.
Una vez que el conjunto de espectros de masas a partir de un experimento de MALDI-MSI ha sido adquirida, la imagen para cada uno de los iones detectados se puede generar, con cada píxel representa un punto de la irradiación con láser de la superficie de una sección de tejido. La combinación de todos los píxeles individuales con diferentes intensidades de iones a través de la sección de tejido a partir de un experimento de MALDI MSI refleja la ionización de analitos diana dentro del tejido 1. Esto puede, a su vez, proporcionar información acerca de las concentraciones relativas de los analitos en diferentes porciones de la sección de tejido (Figura 3b). Se debe tener cuidado en la tramitación de ladatos desde muchos factores pueden afectar a lo que se ve y cómo se interpreta los datos. En la mayoría de los experimentos, los datos se normalizaron a la corriente de iones totales (TIC) dentro de cada espectro. Sin esta normalización, las zonas con mejor analito-matriz de co-cristalización (es decir, los llamados "puntos calientes") pueden causar señales más fuertes para los analitos y esto sería sesgar los datos al proporcionar información que puede que no se correlacionan bien con las concentraciones relativas reales de los analitos (Figuras 3c-3d).
Preparación de tejidos también puede cambiar dramáticamente la imagen que se genera. Si la muestra es "demasiado húmedo" (es decir, se aplicó demasiado disolvente), a continuación, los analitos se deslocalizan sobre el tejido y gran parte de la información espacial se perderán (Figura 3f). El método de adquisición de datos también es importante en la imagen final obtenida. Como los experimentos de MALDI sobre secciones de tejidos no tratados son inherentemente "sucio y #34;, la sensibilidad del instrumento puede disminuir con el tiempo. Para los experimentos cortos esta disminución puede no ser evidente, sin embargo, puede ser un problema para los experimentos más largos o muestras particularmente sucias. Si los datos son adquiridos de forma lineal a través de la muestra de esto puede dar lugar a un sesgo de localización como se analizarán las regiones específicas de la sección de tejido después de la sensibilidad del instrumento ha disminuido. Por lo tanto, se recomienda el uso de puntos al azar para todas las adquisiciones de datos. Aunque este método requiere más tiempo, que ayuda a eliminar o minimizar este sesgo en los datos.
Como se muestra en nuestro anterior documento 34, cuando se compara con CHCA y DHB, DT activar la detección de especies de lípidos adicionales, mientras que los lípidos detectaron con CHCA y DAP todavía podrían ser detectados.
 >
>
Figura 1. Tejido de montaje y de corte. Imágenes ópticos comparativos de dos secciones de tejido de lentes de ternera bovina (20-m de espesor), sin prehumectación ácido fórmico (A), y con prehumectación ácido fórmico (B), montado en los portaobjetos de vidrio recubiertas con ITO.
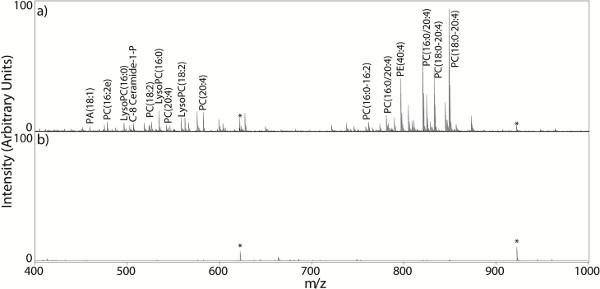
Figura 2. . Los espectros de masas de MALDI MS espectros adquirió directamente de una sección de tejido: a) un ideal espectro densamente poblada de masa con señales de lípidos (70% de ACN con 0,01% de TFA), b) un espectro de masas generado a partir de una sección de tejido revestido con una mala elección de solvente (70% MeOH con un 0,01% de TFA). Haga clic aquí para ver más grande la figura .
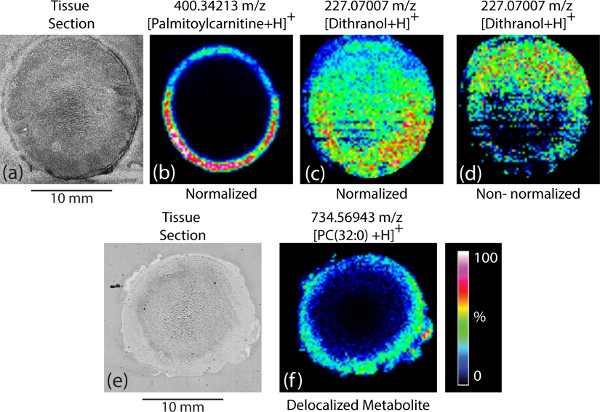
Figura 3. Imágenes MALDI MSI imágenes representativas de MALDI MSI: a) una sección de la lente bovina tejido, b) una imagen de MSI de la misma sección de tejido; c) una imagen de MSI que muestra un ion de fondo; d) un mapa de iones no normalizada de la misma de iones e). una sección de tejido cristalino bovino, y f) un mapa que muestra un ion analito parcialmente deslocalizados debido al mojado excesivo.
Discusión
Las consideraciones más importantes para el éxito de MALDI MSI son: 1) la preparación del tejido, 2) la elección de la matriz, y 3) la aplicación de la matriz, y 4) la interpretación de datos y análisis. Cuando la muestra y la matriz se preparan adecuadamente, la adquisición de datos de MS está automatizado. El análisis de los datos de este tipo de experimento es bastante mano de obra intensiva.
La preparación del tejido adecuado es crucial para el éxito de los experimentos de MALDI MSI. La fuente del tejido y la manipulación pueden tener un gran impacto en el análisis final. Las muestras deben ser inmediatamente se congelaron rápidamente en nitrógeno líquido y se almacenan a -80 ° C, y que no deben almacenarse durante un período prolongado de tiempo, ya que algunos metabolitos pueden ser inestables, incluso a -80 ° C.
Para muchos tejidos de mamíferos, 10 a 15 m de espesor secciones de tejido se han recomendado para MALDI MSI. En estos experimentos, las lentes de ternera fueron cortadas ecuatorial en 20 m de espesor s del tejidolices siguientes decapsulation lente usando un procedimiento descrito previamente 35. Se utilizaron las secciones de tejido de lentes de ternera más gruesas, ya que se encontró difícil mantener la integridad de una sección de tejido de la lente, tanto durante el corte del tejido y durante el montaje de tejido. La lente es un tejido esféricamente simétrica a lo largo de su plano ecuatorial, por lo que sólo las rebanadas que estaban cerca de, o en, se recogieron al plano ecuatorial.
Debido a la dificultad en el mantenimiento de la integridad de los tejidos durante el corte de tejido y de montaje, humectación preliminar usando un disolvente tal como etanol (para proteínas y péptidos 35) o de ácido fórmico (por lípidos) se puede utilizar. Cabe también señalar que, para la proteína y de formación de imágenes péptido, las muestras se lavaron a menudo con un disolvente orgánico para eliminar las moléculas pequeñas incluyendo lípidos y OCT utilizados para el montaje, sin embargo, una etapa de lavado se debe hacer solamente con disolventes que no disuelven el analitos de interés, y se debe evitar para smaanálisis LL molécula.
La elección de matriz también es crucial para todos MALDI experimentos, sin embargo, el rendimiento de matriz sobre de tejido puede no ser el mismo que desempeño matriz con un estándar purificado. Por ejemplo, a la mínima potencia de láser, DT generado abundantes señales de fondo relacionados con la DT de las manchas libre de la matriz de tejidos y estas señales fueron asignados como los oligómeros de DT y sus correspondientes aductos de sodio y de potasio, sin embargo, en el tejido, muchas de estas señales se no observó, lo que indica que la prueba de diferentes matrices en la muestra específica de elección puede ser importante en la selección de la matriz adecuada para un análisis MALDI MSI dado. DT rara vez se utiliza para el análisis de lípidos debido a la alta informado fondo generada por la matriz, sin embargo, cuando se compara con DHB y CHCA para el perfilado en el tejido de los lípidos por MALDI-FTICR MS, DT produjo resultados favorables. Por lo tanto esta matriz puede ser una matriz potencialmente útiles para MALDI imágenes de tejidos usando este instrumento 34.
Eficiente de co-cristalización de la matriz y el analito es un requisito previo para alta sensibilidad análisis de MALDI-MS. Por lo tanto la solubilidad en fase sólida de un analito en la matriz es importante en el proceso de 41,42 MALDI. Matrices de MALDI con solubilidades similares a las de los analitos deseados se han reportado para producir los más fuertes intensidades de señal analito. Debido a que DT es un ácido débil orgánica, así como un compuesto orgánico muy hidrófobo, basado en la teoría clásica de Brønsted-Lowry neutralización ácido-base 43 y la teoría de la solubilidad, se espera para favorecer la ionización de positivamente cargado y menos polar compuestos. De hecho, encontramos que los lípidos polares dominados los compuestos detectados en el modo de ion positivo cuando se utilizó DT como la matriz.
Los disolventes utilizados para la preparación de una solución de matriz también juegan un papel importante en el análisis directo del tejido mediante MALDI-MS. El pH ha sido implicado como unfactor importante en la eficacia de una matriz, y TFA es un aditivo común usado con CHCA y DHB. Sin embargo, con DT, la adición de un modificador de ácido o base tuvo poco efecto en los datos resultantes. Debido a la hidrofobicidad de DT y su solubilidad limitada en disolventes polares, se recomienda un disolvente orgánico lipófilo. Cuando el análisis de los lípidos, (02:01, v: v) una mezcla de cloroformo-metanol con ácido fórmico 1%, que es un disolvente orgánico típico para la extracción de lípidos, se utilizó. Hemos postulado que esto proporciona una mejor co-cristalización de lípidos con DT. La naturaleza lipofílica del disolvente también puede prevenir la solubilización de otros compuestos tales como proteínas y sales, como se demuestra en la superficie de extracción anterior espectrometría de masas de análisis de líquidos (LESA-MS) experimentos 44. Esto llevaría a una mejor cristalización de la matriz y los lípidos con menos contaminantes. El sistema disolvente que se selecciona para el análisis debe maximizar la solubilidad de la matriz y la desianalitos rojos (lípidos) y reducir al mínimo la solubilidad de los contaminantes no deseados (sales y proteínas / péptidos).
El recubrimiento de la matriz en la superficie del tejido debe ser lo más uniforme posible. Para maximizar la resolución espacial de la imagen, el tamaño del cristal debería ser tan pequeño como sea posible 45. El uso de un pulverizador de matriz electrónica, la matriz se puede recubrir de manera uniforme y reproducible con un tamaño de cristal pequeño. Este es el método preferido en nuestro laboratorio. Se prefiere mucho más a la aplicación manual, ya que reduce el tamaño del punto, la homogeneidad, y la reproducibilidad. Sin embargo, muchos de los disolventes que son útiles para MSI de moléculas pequeñas no son compatibles con los materiales utilizados en la fabricación de la matriz de pulverizador automatizado. Aunque no se han aplicado todavía en nuestro laboratorio, la aplicación de la matriz de sublimación con base ha sido recomendado para el análisis de lípidos 22. Este método proporciona una mejor (es decir, reducido) tamaño del punto, la homogeneidad y la reproducciónbilidad y esto probablemente debe ser el método de elección cuando la matriz seleccionada es amable con este método.
Para el recubrimiento de matrices que contienen disolventes incompatibles con el pulverizador matriz automatizado (incluyendo cloroformo), un método alternativo de revestimiento de matriz es el uso de una pistola de cepillo de aire. Para estas soluciones de matriz, hemos utilizado un pulverizador aerógrafo asistida neumáticamente. Aunque el uso de la pistola de cepillo de aire no es un método ideal, puede ser el único método que se puede utilizar para disolventes y matrices que son incompatibles con los otros métodos, y-con formación y experiencia-que puede generar revestimiento de matriz muy uniforme. Cuando la aplicación de la solución de matriz de forma manual, sólo la cantidad mínima de líquido debe ser aplicado durante cada ciclo para mojar apenas la superficie del tejido. El exceso de líquido potencialmente podría deslocalizar analitos debido a los disolventes orgánicos. Hay problemas de reproducibilidad con la aplicación manual y experiencia en el recubrimiento de la corredera con este método is esencial para el éxito. Debido a la naturaleza manual de la aplicación de la matriz arma cepillo de aire, se debe tener cuidado para asegurar que un recubrimiento uniforme está hecho; un recubrimiento no homogéneo puede conducir a datos asimétricos, que es representativa de la capa de matriz y no la localización analito.
Al llevar a cabo experimentos de MALDI MSI, la identificación inicial de los analitos detectados generalmente se basa en la búsqueda de bases de datos metabolome de las masas precisas medidas que son por lo general sólo están disponibles cuando un instrumento de alta resolución se utiliza 38. La fuente de iones ESI / MALDI doble en el espectrómetro de masas Apex-Qe 12-Tesla híbrido cuadrupolo-FTICR permite la adición de las señales generadas-ESI para su uso como los picos calibrantes masa interna a cada espectro de masas MALDI, sin afectar a la desorción de MALDI / proceso de ionización. El uso de la calibración de masa interna es crucial para la precisión de la medición de masa elevada en MALDI-FTICR. Calibración externa no se tengan plenamente en cuenta laefectos de carga espacial dentro de la célula ICR 46-48. La puesta a punto y calibración de la FTICR es crucial para el éxito. En este tipo de instrumento de un parámetro llamado el "tiempo de vuelo" (TOF), que es el tiempo que toma para que un ion para viajar desde la celda de colisión para el analizador (la célula ICR) es uno de los más importantes-definido por el usuario parámetros que influyen en la sensibilidad de la detección de un instrumento FTICR. Dentro de un rango de masa dada (es decir, m / z 200-1,400), un TOF baja favorece la detección de los iones m / z inferiores y un TOF más favorece la detección de los iones m / z más elevados. Por lo tanto, para la detección de alta sensibilidad de ambos iones de baja y alta m / z dentro de la gama de detección de masa, un valor TOF de 9 mseg es deseable.
Para un experimento práctico, una compensación debe ser hecha entre tamaño razonable de adquisición de datos, resolución de masa, y el tiempo empleado en la adquisición de datos de imágenes de la EM. Para un experimento FTICR MS, el tamaño del archivo de datos adquirida y la masa resolutien dependen del tamaño de adquisición de datos de la decadencia de inducción libre de la señal (FID). Un tamaño mayor de adquisición de datos dará lugar a una mayor resolución de masa y un tamaño de archivo de datos mayor. Sin embargo, un tamaño mayor adquisición de datos también causa un MS más lenta velocidad de exploración. Como compensación, se recomienda que un tamaño de adquisición de datos de 1024 kb / seg puede utilizar en la FTICR. Un tamaño de la adquisición de datos más baja y una resolución de masa inferior correspondiente no permiten la separación de algunas especies de iones isobáricos.
La trama tamaño de paso láser también debe ser elegido de modo que sea lo suficientemente pequeño para proporcionar una buena resolución de píxeles para imágenes de EM de los analitos de interés, sin embargo, un muy pequeño tamaño de paso de trama puede hacer que los archivos de datos inmanejable considerando un archivo de datos de formación de imágenes MS está compuesta de miles de espectros de masas MALDI. Dado el tamaño relativamente grande de las lentes de la especie bovina, CA. 1,2 -1,5 cm de diámetro, se utilizó un tamaño de paso de trama de 250 micras. El uso de un acqu datos 1024 kb / segTamaño isition y micras de tamaño de trama de 250 pasos, nuestra base de datos de la muestra fue de aproximadamente 60 GB. Durante la adquisición de datos, un análisis de punto aleatorio se debe utilizar, ya que esto impide sesgo basada en la ubicación debido a la atenuación de la señal progresiva, sin embargo, lugar al azar requiere tiempo significativamente más largo para adquirir los datos.
Debido a que los conjuntos de datos de MALDI MSI adquiridos en nuestro instrumento FTICR MS incluyen datos de masa exacta, la m extraído / z se puede buscar en bases de datos tales como metabolome METLIN y / o HMDB. El uso de una ventana de ± 1 ppm las asignaciones iniciales de muchas señales de iones a metabolitos son de alta confianza. Sin embargo, debido a que muchas especies tienen la misma fórmula química, la confirmación de la identificación debe ser hecho a menudo el uso de medios alternativos. Por lo tanto, los experimentos de MS / MS, y la comparación de la MS / MS espectros con los datos publicados anteriormente deben realizarse para una identificación segura. Espectros MALDI-MS/MS a veces puede ser adquirida directamente en el instrumento FTICR, pero para MAmoléculas de lípidos ny, su abundancia y / o la eficiencia de ionización son insuficientes para la obtención de datos útiles MS / MS, y se requiere el enriquecimiento y purificación antes de LC-MS/MS. En estos análisis, la mayor parte de los lípidos observadas eran fosfolípidos polares, y se les asignó como PC, PES, SMS, EPs, PGs, AP, y los fosfatos de ceramida (CERP), otras moléculas de lípidos identificados incluyen lípidos, esteroles acilcarnitinas y glicéridos. Sobre la base de las propiedades del disolvente y de la matriz, esto es de esperar. El espectros MS / MS de PC contiene un pico prominente a m / z 184,073, que se ha atribuido a el grupo polar de cabeza de PC, fosfocolina, así como información adicional estructuralmente importante, que puede dar una identificación inequívoca de las moléculas. Además, utilizando este método, se detectan muchos lípidos de esterol, sin embargo, la mayoría puede no ser asignados de forma inequívoca a las identidades únicas, incluso con los datos de MS / MS. Aductos de potasio fuertes generalmente predominan los espectros, pero protonada y sodiated aductos también se pueden detectar.
Debido a que el proceso de MS MALDI sólo es capaz de proporcionar información relativa abundancia basado en la eficiencia de ionización local dentro de cada píxel, se debe tener cuidado al interpretar los datos de MALDI MSI sin isótopos estables estándares internos marcados 49. Por otra parte, para la confianza en los resultados de la localización, la confirmación de las pautas de distribución detectados se debe hacer uso de métodos alternativos. Se recomienda LC-MS/MS Escénicas en muestras de tejidos disecados para la confirmación.
Sobre la base de las masas exactas medidos en las fórmulas de baja masa gama químicos pueden ser generados para un determinado m / z; dentro de un error de masa 1 ppm y lo que permite un número ilimitado de C, H, O y N, y un máximo de 2 S y 2 P a menudo sólo una única composición elemental es posible. Esta m / z también puede buscarse frente a la HMDB y las bases de datos METLIN, lo que puede dar compuestos candidatos potenciales. Desafortunadamente,en el FTICR MS la poca masa de corte es de aprox. 130 Da, lo que puede hacer que sea difícil llevar a cabo directamente MS / MS. Por lo tanto, a menudo se requiere confirmación mediante otro sistema.
Experimentos LC-MS/MS Q-TOF se llevan a cabo comúnmente en muestras de tejido que han sido disecados manualmente de áreas específicas de los tejidos de interés. Utilizando el método de extracción de lípidos descrito, XICS pueden ser generados para los compuestos diana y MS / MS se pueden adquirir para la confirmación. Se requiere ninguna de las comparaciones a un nivel auténtico o de novo elucidación estructural antes que pueda haber una asignación química confiado.
El ditranol se ha utilizado para explorar patrones de distribución de los lípidos en la lente de ternera bovina y también probado en hígado de rata, corazón, y los tejidos renales 34. MALDI MSI se puede utilizar para el diagnóstico de estados de enfermedad humanos y ya se está utilizando para el análisis patológico 50. Con el desarrollo de más robusto y rápido technologies para MALDI MSI, la localización espacial de los compuestos específicos pueden ser información útil para que un patólogo. Una vez que un analito se pueden obtener imágenes de manera rutinaria utilizando un método basado en MSI MALDI, que puede ser utilizado para propósitos de diagnóstico. De hecho, el tejido de formación de imágenes se podría realizar en un entorno hospitalario, con un instrumento situado junto a la sala de operaciones, donde, como ya se ha demostrado 51, que podría ser utilizado para determinar con precisión los márgenes de los tumores.
Divulgaciones
No tenemos nada que revelar.
Agradecimientos
Los autores desean agradecer Genoma Canadá y Genoma de Columbia Británica para la financiación de plataforma y apoyo. También agradecemos a la Dra. Carol E. Parker para la revisión crítica de la asistencia manuscrito y edición. CHL también agradece a la Columbia Británica Proteómica red de apoyo.
Materiales
| Name | Company | Catalog Number | Comments |
| Rat Liver | Pel-Freez Biologicals | 56023-2 | |
| Bovine Calf Lens | Pel-Freez Biologicals | 57114-2 | Sample should be decapsulated29 before use |
| Dithranol (DT) | Sigma-Aldrich | 10608 | MALDI Matrix |
| α-Cyano-4-hydroxy-cinnamic Acid (CHCA) | Sigma-Aldrich | 70990 | MALDI Matrix |
| 2,5-Dihydroxybenzoic Acid (DHB) | Sigma-Aldrich | 85707 | MALDI Matrix |
| Reserpine | Sigma-Aldrich | 83580 | |
| Terfenadine | Sigma-Aldrich | T9652 | |
| Formic Acid | Sigma-Aldrich | 14265 | |
| Ammonium Formate | Sigma-Aldrich | 14266 | |
| Ammonium Hydroxide | Sigma-Aldrich | 320145 | |
| Trifluoroacetic Acid (TFA) | Sigma-Aldrich | 302031 | |
| Water | Sigma-Aldrich | 39253 | |
| Methanol | Sigma-Aldrich | 34860 | |
| Acetonitrile | Sigma-Aldrich | 34967 | |
| Ethyl Acetate | Sigma-Aldrich | 34972 | |
| Isopropanol | Sigma-Aldrich | 34965 | |
| Chloroform | Sigma-Aldrich | 366927 | |
| Acetone | Sigma-Aldrich | 34850 | |
| Ethanol | Commercial Alcohols | 95% | |
| ES Tuning Mix | Agilent Technologies | G2431A | |
| ITO Coated Glass Slides | Hudson Surface Technology | PSI1207000 | Ensure that samples are placed on the electrically conductive side |
| Wite-Out Shake-N-Squeeze Correction Pen | Bic | WOSQP11 | |
| Airbrush Sprayer | Iwata | Eclipse HP-CS | |
| ImagePrep | Bruker | 249500-LS | |
| MALDI adapter | Bruker | 235380 |
Referencias
- Chaurand, P., Stoeckli, M., Caprioli, R. M. Direct Profiling of Proteins in Biological Tissue Sections by MALDI Mass Spectrometry. Anal. Chem. 71, 5263-5270 (1999).
- Caprioli, R. M., Farmer, T. B., Gile, J. Molecular Imaging of Biological Samples. Localization of Peptides and Proteins Using MALDI-TOF MS. Anal. Chem. 69, 4751-4760 (1997).
- Amstalden van Hove, E. R., Smith, D. F., Heeren, R. M. A. A concise review of mass spectrometry imaging. J. Chromatogr. A. 1217, 3946-3954 (2010).
- Norris, J. L., Caprioli, R. M. Analysis of Tissue Specimens by Matrix-Assisted Laser Desorption/Ionization Imaging Mass Spectrometry in Biological and Clinical Research. Chem. Rev. Feb 11, (2013).
- Walch, A., Rauser, S., Deininger, S. -. O., Höfler, H. MALDI imaging mass spectrometry for direct tissue analysis: a new frontier for molecular histology. Histochem. Cell Biol. 130, 421-434 (2008).
- Hsieh, Y., et al. Matrix-assisted laser desorption/ionization imaging mass spectrometry for direct measurement of clozapine in rat brain tissue. Rapid Commun. Mass Spectrom. 20, 965-972 (2006).
- Trim, P. J., et al. Matrix-assisted laser desorption/ionization-ion mobility separation-mass spectrometry imaging of vinblastine in whole body tissue sections. Anal. Chem. 80, 8628-8634 (2008).
- Khatib-Shahidi, S., Andersson, M., Herman, J. L., Gillespie, T. A., Caprioli, R. M. Direct molecular analysis of whole-body animal tissue sections by imaging MALDI mass spectrometry. Anal. Chem. 78, 6448-6456 (2006).
- Atkinson, S. J., Loadman, P. M., Sutton, C., Patterson, L. H., Clench, M. R. Examination of the distribution of the bioreductive drug AQ4N and its active metabolite AQ4 in solid tumours by imaging matrix-assisted laser desorption/ionisation mass spectrometry. Rapid Commun. Mass Spectrom. 21, 1271-1276 (2007).
- Drexler, D. M., et al. Utility of imaging mass spectrometry (IMS) by matrix-assisted laser desorption ionization (MALDI) on an ion trap mass spectrometer in the analysis of drugs and metabolites in biological tissues. J. Pharmacol. Toxicol. Methods. 55, 279-288 (2007).
- Prideaux, B., Stoeckli, M. Mass spectrometry imaging for drug distribution studies. J. Proteomics. 75, 4999-5013 (2012).
- Sugiura, Y., Setou, M. Imaging Mass Spectrometry for Visualization of Drug and Endogenous Metabolite Distribution: Toward In Situ Pharmacometabolomes. J. Neuroimmune Pharmacol. 5, 31-43 (2009).
- Garrett, T. J., Yost, R. A. Analysis of intact tissue by intermediate-pressure MALDI on a linear ion trap mass spectrometer. Anal. Chem. 78, 2465-2469 (2006).
- Woods, A. S., Jackson, S. N. Brain tissue lipidomics: direct probing using matrix-assisted laser desorption/ionization mass spectrometry. AAPS J. 8, 391-395 (2006).
- Cha, S., Yeung, E. S. Colloidal graphite-assisted laser desorption/ionization mass spectrometry and MSn of small molecules. 1. Imaging of cerebrosides directly from rat brain tissue. Anal. Chem. 79, 2373-2385 (2007).
- Burnum, K. E., et al. Spatial and temporal alterations of phospholipids determined by mass spectrometry during mouse embryo implantation. J. Lipid Res. 50, 2290-2298 (2009).
- Veloso, A., et al. Anatomical distribution of lipids in human brain cortex by imaging mass spectrometry. J. Am. Soc. Mass Spectrom. 22, 329-338 (2011).
- Tanaka, H., et al. Distribution of phospholipid molecular species in autogenous access grafts for hemodialysis analyzed using imaging mass spectrometry. Anal. Bioanalyt. Chem. 400, 1873-1880 (2011).
- Lou, X., van Dongen, J. L., Vekemans, J. A., Meijer, E. W. Matrix suppression and analyte suppression effects of quaternary ammonium salts in matrix-assisted laser desorption/ionization time-of-flight mass spectrometry: an investigation of suppression mechanism. Rapid Comm. Mass Spectrom. 23, 3077-3082 (2009).
- Knochenmuss, R., Karbach, V., Wiesli, U., Breuker, K., Zenobi, R. The matrix suppression effect in matrix-assisted laser desorption/ionization: application to negative ions and further characteristics. Rapid Commun. Mass Spectrom. 12, 529-534 (1998).
- Puolitaival, S. M., Burnum, K. E., Cornett, D. S., Caprioli, R. M. Solvent-free matrix dry-coating for MALDI imaging of phospholipids. J. Am. Soc. Mass Spectrom. 19, 882-886 (2008).
- Hankin, J. A., Barkley, R. M., Murphy, R. C. Sublimation as a Method of Matrix Application for Mass Spectrometric Imaging. J. Am. Soc. Mass Spectrom. 19, 1646-1652 (2007).
- Grove, K. J., Frappier, S. L., Caprioli, R. M. Matrix pre-coated MALDI MS targets for small molecule imaging in tissues. J. Am. Soc. Mass Spectrom. 22, 192-195 (2011).
- Fuchs, B., Süss, R., Schiller, J. An update of MALDI-TOF mass spectrometry in lipid research. Prog. Lipid Res. 49, 450-475 (2010).
- Murphy, R. C., Hankin, J. A., Barkley, R. M., Zemski Berry, K. A. MALDI imaging of lipids after matrix sublimation/deposition. Biochim. Biophys. Acta. 1811, 970-975 (2011).
- Vermillion-Salsbury, R. L., Hercules, D. M. 9-Aminoacridine as a matrix for negative mode matrix-assisted laser desorption/ionization. Rapid Commun. Mass Spectrom. 16, 1575-1581 (2002).
- Hu, C., et al. Analytical strategies in lipidomics and applications in disease biomarker discovery. J. Chromatogr. B Analyt. Technol. Biomed. Life Sci. 877, 2836-2846 (2009).
- Miura, D., et al. Ultrahighly sensitive in situ metabolomic imaging for visualizing spatiotemporal metabolic behaviors. Anal. Chem. 82, 9789-9796 (2010).
- Cerruti, C. D., Benabdellah, F., Laprevote, O., Touboul, D., Brunelle, A. MALDI Imaging and Structural Analysis of Rat Brain Lipid Negative Ions with 9-Aminoacridine Matrix. Anal. Chem. 84, 2164-2171 (2012).
- Astigarraga, E., et al. Profiling and Imaging of Lipids on Brain and Liver Tissue by Matrix-Assisted Laser Desorption/Ionization Mass Spectrometry Using 2-Mercaptobenzothiazole as a Matrix. Anal. Chem. 80, 9105-9114 (2008).
- Whitehead, S. N., et al. Imaging mass spectrometry detection of gangliosides species in the mouse brain following transient focal cerebral ischemia and long-term recovery. PloS one. 6, e20808 (2011).
- Cornett, D. S., Frappier, S. L., Caprioli, R. M. MALDI-FTICR imaging mass spectrometry of drugs and metabolites in tissue. Anal. Chem. 80, 5648-5653 (2008).
- Deininger, S. O., et al. Normalization in MALDI-TOF imaging datasets of proteins: practical considerations. Anal. Bioanalyt. Chem. 401, 167-181 (2011).
- Le, C. H., Han, J., Borchers, C. H. Dithranol as a MALDI matrix for tissue imaging of lipids by Fourier transform ion cyclotron resonance mass spectrometry. Anal. Chem. 84, 8391-8398 (2012).
- Han, J., Schey, K. L. MALDI Tissue Imaging of Ocular Lens α-Crystallin. Invest. Ophthalmol. Vis. Sci. 47, 2990-2996 (2006).
- Schwartz, S. A., Reyzer, M. L., Caprioli, R. M. Direct tissue analysis using matrix-assisted laser desorption/ionization mass spectrometry: practical aspects of sample preparation. J. Mass Spectrom. 38, 699-708 (2003).
- Chen, Y., et al. Imaging MALDI mass spectrometry of sphingolipids using an oscillating capillary nebulizer matrix application system. Meth. Mol. Biology. 656, 131-146 (2010).
- Han, J., et al. Towards high throughput metabolomics using ultrahigh field Fourier transform ion cyclotron resonance mass spectrometry. Metabolomics. 4, 128-140 (2008).
- Smith, C. A., et al. METLIN: a metabolite mass spectral database. Ther. Drug Monit. 27, 747-751 (2005).
- Wishart, D. S., et al. HMDB: a knowledgebase for the human metabolome. Nucleic Acids Res. 37, D603-D610 (2009).
- Hoteling, A. J., Erb, W. J., Tyson, R. J., Owens, K. G. Exploring the importance of the relative solubility of matrix and analyte in MALDI sample preparation using HPLC. Anal. Chem. 76, 5157-5164 (2004).
- Hoteling, A. J., Mourey, T. H., Owens, K. G. Importance of solubility in the sample preparation of poly(ethylene terephthalate. for MALDI TOFMS. Anal. Chem. 77, 750-756 (2005).
- Shroff, R., Rulísek, L., Doubsky, J., Svatos, A. Acid-base-driven matrix-assisted mass spectrometry for targeted metabolomics. Proc. Nat. Acad. Sci. U.S.A. 106, 10092-10096 (2009).
- Eikel, D., et al. Liquid extraction surface analysis mass spectrometry (LESA-MS) as a novel profiling tool for drug distribution and metabolism analysis: the terfenadine example. Rapid Comm. Mass Spectrom. 25, 3587-3596 (2011).
- Sadeghi, M., Vertes, A. Crystallite size dependence of volatilization in matrix-assisted laser desorption ionization. Appl. Surf. Sci. 127 - 129, 226-234 (1998).
- O'Connor, P. B., Costello, C. E. Internal Calibration on Adjacent Samples (InCAS) with Fourier Transform Mass Spectrometry. Anal. Chem. 72, 5881-5885 (2000).
- Jing, L., Amster, I. J. An improved calibration method for the matrix-assisted laser desorption/ionization-Fourier transform ion cyclotron resononance analysis of 15N-metabolically- labeled proteome digests using a mass difference approach. Eur. J. Mass Spectrom. 18, 269-277 (2012).
- Zhang, L. -. K., Rempel, D., Pramanik, B. N., Gross, M. L. Accurate mass measurements by Fourier transform mass spectrometry. Mass Spectrom. Rev. 24, 286-309 (2005).
- Clemis, E. J., et al. Quantitation of spatially-localized proteins in tissue samples using MALDI-MRM imaging. Anal. Chem. 84, 3514-3522 (2012).
- Schwamborn, K., Caprioli, R. M. Molecular imaging by mass spectrometry--looking beyond classical histology. Nat. Rev. Cancer. 10, 639-646 (2010).
- Oppenheimer, S. R., Mi, D., Sanders, M. E., Caprioli, R. M. Molecular analysis of tumor margins by MALDI mass spectrometry in renal carcinoma. J. Proteome Res. 9, 2182-2190 (2010).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados