Administración de compuestos III
Fuente: Kay Stewart, RVT, RLATG, CMAR; Valerie A. Schroeder, RVT, RLATG. Universidad de Notre Dame, en
Hay muchas rutas utilizadas para la administración del compuesto en las ratas y ratones de laboratorio. Sin embargo, ciertos protocolos pueden requerir el uso de las rutas menos comunes, incluyendo inyecciones intradérmicas, intranasales e intracraneales. Formación especializada es esencial para estos procedimientos a realizarse con éxito. Justificación para estas rutas puede necesitar obtener la aprobación institucional cuidado Animal y el Comité uso (IACUC).
Intraderma linjections se entregan en las capas externas de la dermis, debajo de la capa superior de la piel (la epidermis). Esta ruta de inyección es generalmente reservada para la evaluación de la inflamación, diagnóstico del flujo de sangre cutáneo o reacciones alergénicas a un antígeno.
Aunque de uso frecuente para la entrega local de vacunas o spray descongestionante, administración intranasal puede utilizarse también para la entrega sistémica y central del sistema nervioso (SNC). La mucosa que recubre la cavidad nasal tiene una fuente rica de los vasos sanguíneos y nervios que permiten la absorción sistémica rápida y dirigen dirigida al CNS. Sustancias conformadas por pequeñas moléculas lipofílicas tienen una tasa de absorción mucho mayor que aquellos que contienen moléculas más grandes. 2
Aunque la anestesia no es necesaria para este procedimiento, que puede facilitar la colocación correcta del compuesto en las narinas, asegurando una dosificación exacta. Se ha demostrado que los animales anestesiados tienen entrega cinco veces mayor de un fármaco al cerebro en comparación con un animal consciente. 2 sin anestesiar ratas son muy resistentes a la administración intranasal. Sin embargo, hay un estudio que demostró técnicas eficaces para la administración intranasal de mover libremente las ratas. 3 además, alerta animales pueden intentar morder la punta de pipeta o aguja, dificultando la entrega de la sustancia.
Ventajas para administración intranasal son que esta técnica requiere habilidad y entrenamiento mínimo, y es no invasivo para el animal. Sin embargo, debido a la posibilidad de aerosolización, se recomienda el uso de un gabinete y ojo la protección de la seguridad de la biotecnología, especialmente cuando se trabaja con un animal consciente. Además, para evitar el ahogamiento de los animales, debe usarse la dosis más pequeña posible. Si en cualquier momento durante esta cianosis procedimiento, respiración bucal, u otros signos de sufrimiento se ven en el animal, el procedimiento debe ser interrumpido inmediatamente.
Las inyecciones intracraneales en ratones adultos y ratas emplean el uso de equipo estereotáctica para asegurar el correcto posicionamiento y la profundidad de la inyección. Sin embargo, en ratones de 3 a 28 días de edad, las ratas y hasta 14 días de edad, el cráneo es lo suficientemente delgado como para inyectar directamente a través de él; es demasiado frágil para soportar el dispositivo estereotáxicas. Las crías de ratón o rata deben dejarse con la madre hasta que el procedimiento y debe ser devuelto a ella tan pronto como sea posible una vez finalizado el procedimiento. Atención ClLi incluye monitoreo continuo sobre una fuente de calor hasta que el movimiento normal y conductas, incluyendo la enfermería, se observan. La razón principal de utilizar esta técnica es proporcionar a agentes farmacológicos para el sistema nervioso central que requieran la barrera blood - brain para ser cruzado, o para evitar los efectos involucrados en la ruta sistémica. 1
1. intradérmica administración
- Más inyecciones intradérmicas son compuestos de base acuosa. Las soluciones deben ser fisiológicamente tamponadas para tener un pH neutro, para evitar necrosis de los tejidos en el sitio de inyección.
- El rango de tamaño de la aguja es de calibre 25-30, lo más pequeño posible.
- La gama de dosis por punto de inyección es que 50-100 μl. inyectables excesivos volúmenes pueden resultar en necrosis en el sitio de la inyección o fuga del compuesto fuera del sitio debido a la presión.
- Para la colocación exacta de la aguja en el espacio intradérmico, es necesario anestesiar a ratones y ratas. Anestesia inhalatoria permite una rápida inducción y recuperación; sin embargo, la anestesia inyectable tiene la ventaja de proporcionar tiempo suficiente para la preparación de la zona y realizar la inyección. 1
- Eliminar el vello en el sitio de la inyección mediante el uso de una crema depilatoria o afeitar el área.
- Eliminar completamente cualquier crema depilatoria residual o residuo de pelo.
- Aplicar un antiséptico tópico, como una solución de yodo, clorhexidina o alcohol.
- Procedimientos de administración
- Estire la piel tensa entre los dedos pulgar e índice. Esto proporciona estabilidad a la piel cuando se coloca la aguja.
- Coloque el bisel de la aguja hacia arriba en la piel.
- Insertar suavemente la aguja en la piel entre la epidermis y la dermis. Avanzar la aguja más allá del bisel.
- Inyectar lentamente la sustancia. Inyección del compuesto creará una ampolla o ampolla pequeña, en la piel.
- Pausa después de la inyección para permitir que la piel estirar y ajustar antes de retirar la aguja.
- PRECAUCIONES
- No es necesario tirar hacia atrás del émbolo.
- Si la aguja se inserta en el espacio subcutáneo, no se forma ninguna ampolla. Inyección demasiado profunda se traduce en una inyección subcutánea.
- Evitar borrar o limpiar la zona, ya puede causar el compuesto a perder el sitio de inyección.
- Al realizar múltiples inyecciones, los espacio para que las ampollas no se superponen.
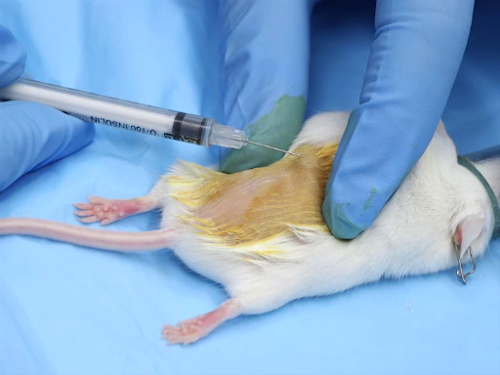
Figura 1. Inyección intradérmica en ratones.
2. intranasal administración
- Equipo
- Utilice una pipeta de unidad de micropipetting que puede ser calibrada para proporcionar un volumen exacto.
- Puntas de pipeta desechables deben usarse para evitar la contaminación cruzada. TB las jeringas, agujas embotadas y tubería flexible pueden utilizarse también para la dosificación.
- Volúmenes de inyección total para las ratas no deben exceder 40-100 μl y deben ser administrados en gotas de 6-10 μl. Para los ratones, el volumen total máximo es 24 μl, en gotas de 3-4 μL.
- Administración en animales conscientes
- Manual seguridad en animales conscientes requiere que la cabeza sea relativamente inmóvil para que la punta de la pipeta o aguja embotada puede colocarse lo suficientemente cerca de las narinas para entregar el compuesto, pero no tan cerca como para meter o lacerar el tejido nasal.
- Refrenar el animal y manténgalo en posición vertical.
- Coloque una pequeña gota de un líquido compuesto en la abertura nasal. El animal debe inhalar la gota.
- Administrar un volumen adicional, alternando nares hasta que le ha dado todo el volumen.
- Al administrar grandes volúmenes, es importante no constrict el pecho durante la contención. Compresión de pecho impide la capacidad del animal para tomar respiraciones suficientemente profundas para extraer el líquido en los bronquios y los pulmones.
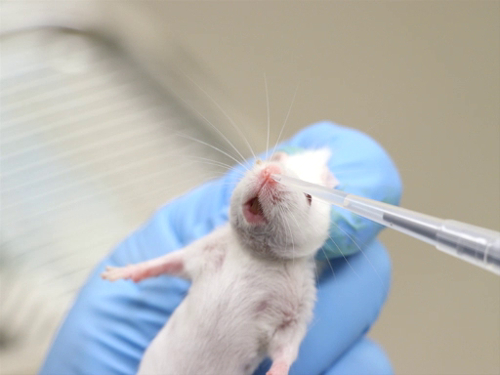
Figura 2. Administración intranasal en ratones conscientes.
- Administración en animales inconscientes
- Uso de anestésicos de inhalación permite un animal inmovilizado durante el planteamiento y la entrega del compuesto. Esto elimina la posibilidad del animal morder el equipo de dosificación, la pérdida del compuesto debido a movimientos bruscos de la cabeza y lesión al tejido nasal, los ojos o piel de la cara del animal. El animal también es menos probable que snort y el compuesto de las narinas a la administración del aerosol.
- Coloque el animal en la posición supina. La posición de la cabeza influye en la colocación de la solución en las narinas. Se ha demostrado que la posición ideal para entrega de CNS es con el animal decúbito supino; Esto permite una mejor absorción. 2
- Administrar la mitad del compuesto directamente en un lado de la abertura nasal, sincronización con la inhalación. Girar el animal.
- Como el anterior, administrar la otra mitad del volumen en el otro orificio nasal.

Figura 3. Administración intranasal en ratones inconscientes.
3.Administración intracraneal en ratones neonatales y ratas
- Ratones o ratas se deben anestesiar para inyección intracraneal.
| Ratón | Rata | ||
| Edad (días) | Aguja de calibre (g) | Edad (días) | Aguja de calibre (g) |
| 0-7 | 29-30 | 0-5 | 27-29 |
| 7-14 | 27 | 5-10 | 25-27 |
| 14-28 | 25 | 10-14 | 25 |
| Edad (días) | Longitud de la aguja (mm) | Edad (días) | Longitud de la aguja (mm) |
| 0-7 | 2 | 0-4 | 2-3 |
| 7-14 | 3 | 4-7 | 3 |
| 14-21 | 4 | 7-10 | 4 |
| 21-28 | 5 | 10-14 | 5 |
| Edad (días) | Volumen (μL) | Edad (días) | Volumen (μL) |
| 0-5 | < 20 | 1-3 | < 20 |
| 6-20 | < 60 | 4-10 | < 60 |
| 20-28 | < 100 | 11-14 | < 100 |
Tabla 1. Aguja de calibre, longitud de la aguja y el volumen máximo de administración intracraneal según la edad de los ratones y las ratas. 4
- Equipo
- Determinar la correcta de la aguja de calibre y volumen máximo de la administración según la tabla 1.
- Preparar un protector de la aguja antes de anestesiar al animal.
Nota: La profundidad de la inyección de la aguja es controlada mediante el uso de un protector que se crea con la tapa de la aguja.- Para crear la guardia, una aguja se mide contra la tapa de la aguja y se coloca una marca en la tapa para indicar dónde cortar. El corte debe hacerse para que 2 a 5 mm de la aguja queden expuestos cuando se reemplaza la tapa de la aguja.
- La longitud de la aguja expuesta debe ser lo suficientemente largos para penetrar la piel y el cráneo y llegar a la profundidad deseada en el cerebro.
- Las longitudes de aguja para ratones y ratas se enumeran en la tabla 1.
- Una fuente de calor es necesaria para prevenir la hipotermia en los cachorros. Hay varios tipos: una almohadilla de calefacción eléctrica establece en baja, una manta de agua circulante o una bolsa de calor de la reacción química reutilizable.
- Sistema de seguridad para
- Crías de ratón y rata 10 días de edad no requieren de anestesia para este procedimiento. Refrenarlos manualmente sosteniendo justo detrás de la cabeza y tirando la piel caudalmente para ejercer ligera presión sobre los hombros.
- Anestesiar a los cachorros durante 10 días de edad con inhalación isoflurane. Conecte una cámara de inducción a un vaporizador de precisión o una campana con una bola de algodón empapada con isoflurano. Una vez que el cachorro se inmoviliza, la anestesia es eficaz durante unos 40 segundos, que proporciona tiempo suficiente para la inyección.
- Técnica de inyección
- Dibujar la sustancia en la jeringa y coloque a la guía de la tapa de la aguja sobre la aguja.
- El volumen de inyección recomendado como el volumen máximo por neonatal ratón o rata es 100 μl, y que para el destete o los ratones mayores hasta 300 μl.
- Para inyectar en la corteza cerebral de los recién nacidos, inserte la aguja 5 mm detrás del ojo, aproximadamente 3 mm de la línea media del cráneo.
- El sitio de la inyección de ratón destete es aproximadamente mitad de camino entre el ojo y el oído y justo al lado de la línea media.

Figura 4. Administración intracraneal en una cría de ratón.
La administración de compuestos en animales puede tener un efecto significativo tanto el bienestar de los animales y el resultado de los datos experimentales y valor científico. El método apropiado de suministro es esencial para el éxito del experimento. Muchos factores deben ser considerados para determinar la mejor ruta, incluyendo el objetivo científico del estudio, el pH de la sustancia, el volumen de la dosificación requerida, la viscosidad de la sustancia y el bienestar de los animales. Conocimientos técnicos también es un requisito para todos los métodos de inyección.
- Turner, P.V., Pekow, C., Vasbinder, M. A., and Brabb, T. 2011. Administration of substances to laboratory animals: equipment and considerations, vehicle selection, and solution preparation. JAALAS. 50: 614-627.
- Dhuria, S.V., Hanson, L.R., and Frey II, W.H. 2010. Intranasal delivery to the central nervous system: mechanisms and experimental considerations. Journal of Pharmaceutical Sciences. 99: 1654-1673.
- Stevens, J., Suidgeest, E, Van der Graaf, P.H., Danhof, M., and De Lange, E.C. 2008. Development and evaluation of a new, minimal-stress animal model for intranasal administration in freely moving rats. Poster presentation at American Association of Pharmaceutical Scientists Annual Meeting, Atlanta, Georgia.
- Morton, D.A., Jennings, M., Buckwell, A., Ewbank, R., Godfrey, C., Holgate, B., Inglis, I., James, R., Page, C., Sharman, I., Verschoyle, R., Westall, L., and Wilson, A.B. 2001. Refining procedures for the administration of substances Report of the BVAAWF/FRAME/RSPCA/UFAW Joint Working Group on Refinement. Members of the Joint Working Group on Refinement. Laboratory Animals. 35: 1-41.
Saltar a...
Vídeos de esta colección:

Now Playing
Administración de compuestos III
Lab Animal Research
31.2K Vistas

Técnicas de manipulación y sujeción de roedores
Lab Animal Research
173.2K Vistas

Procedimientos de atención básica
Lab Animal Research
27.6K Vistas

Fundamentos de la crianza y destete
Lab Animal Research
35.5K Vistas

Identificación de roedores I
Lab Animal Research
54.4K Vistas

Identificación de roedores II
Lab Animal Research
25.5K Vistas

Administración de compuestos I
Lab Animal Research
99.9K Vistas

Administración de compuestos II
Lab Animal Research
34.6K Vistas

Administración de compuestos IV
Lab Animal Research
51.2K Vistas

Extracción de sangre I
Lab Animal Research
170.7K Vistas

Extracción de sangre II
Lab Animal Research
72.7K Vistas

Mantenimiento e inducción de la anestesia
Lab Animal Research
50.0K Vistas

Consideraciones para la cirugía de roedores
Lab Animal Research
22.3K Vistas

Necropsia diagnóstica y recolección de tejidos
Lab Animal Research
57.8K Vistas

Recolección de tejidos estériles
Lab Animal Research
34.7K Vistas
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados