Method Article
Uso de la sola molécula fluorescente en Situ del hibridación (SM-pescado) para cuantificar y Localize mRNAs en oocitos murinos
En este artículo
Resumen
Reproducible, contar los números de los mRNAs de los ovocitos, in situ de la fluorescencia de una molécula de RNA hibridación (RNA-pescado) fue optimizado para las células no adherentes. Ovocitos se recolectaron, cruzado por hibridación con las sondas específicas de transcripción y cuantificaron utilizando un software de cuantificación de la imagen.
Resumen
Métodos actuales que utiliza habitualmente para cuantificar el mRNA en ovocitos y embriones incluyen la reacción en cadena de polimerasa de transcripción inversa digital (dPCR), cuantitativo, en tiempo real RT-PCR (RT-qPCR) y la secuencia de RNA. Cuando estas técnicas se realizan con un solo óvulo o embrión, copia baja mRNAs no se detectan confiablemente. Para superar este problema, ovocitos o embriones pueden se agruparon para el análisis; sin embargo, esto conduce a menudo a la alta variabilidad entre las muestras. En este protocolo, describimos el uso de hibridación fluorescente in situ (FISH) usando química de DNA ramificado. Esta técnica identifica el patrón espacial de mRNAs en células individuales. Cuando la técnica es encontrar lugar y seguimiento informático, también puede cuantificar la abundancia de mRNAs en la célula. Usando esta técnica, hay menor variabilidad dentro de un grupo experimental y se requieren menos ovocitos y embriones para detectar diferencias significativas entre los grupos experimentales. Comercialmente disponible DNA ramificado SM-kits de peces han sido optimizados para detectar mRNAs en tejidos seccionados o células adherentes en diapositivas. Sin embargo, ovocitos no eficazmente a diapositivas y algunos reactivos en el kit eran demasiado duros, resultando en lisis de ovocitos. Para evitar esta lisis, se hicieron varias modificaciones al kit de pescado. Específicamente, buffers de permeabilización y lavado de ovocitos diseñadas para la inmunofluorescencia de oocitos y embriones reemplazados los almacenadores intermediarios del propietarios. La permeabilización, lavados e incubaciones con amplificador y puntas de prueba fueron realizadas en placas de 6 pocillos y ovocitos fueron colocados en portaobjetos en el extremo del protocolo utilizando medios de montaje. Estas modificaciones fueron capaces de superar las limitaciones del kit disponible comercialmente, en particular, la lisis de ovocitos. Precisa y reproducible, contar el número de los mRNAs de los ovocitos, se utilizó el software de computadora. Juntos, este protocolo representa una alternativa a la PCR y secuenciación para comparar la expresión de las transcripciones específicas en las células.
Introducción
Reacción en cadena reversa-transcriptase de polimerasa (PCR) ha sido el estándar de oro para la cuantificación del mRNA. Actualmente se utilizan dos ensayos PCR (dPCR) digital1 y cuantitativa, real time PCR (qPCR)2 . De las dos técnicas PCR, dPCR tiene mayor sensibilidad que la qPCR sugiriendo que podría ser utilizado para medir la abundancia de ARNm en células individuales. Sin embargo, en nuestras manos, análisis de dPCR de mRNAs de baja abundancia en grupos de 5 a 10 ovocitos por cada muestra experimental ha producido datos con baja reproducibilidad y alta variación3. Esto es probablemente debido al error experimental asociado a la extracción de RNA y transcripción reversa eficiencia. La secuencia de RNA también se ha realizado utilizando un único ratón y ovocitos humanos4,5. Esta técnica requiere pasos de amplificación de cDNA para la generación de biblioteca que probablemente aumenta la variabilidad dentro de un grupo experimental. Además, las transcripciones de baja abundancia no pueden ser detectables. Aunque los precios de la secuencia han bajado en los últimos años, todavía puede ser prohibitivo debido al costo alto de Bioinformática análisis de costo. Por último, la localización de mRNA es un proceso dinámico con cambios espaciales que contribuyen a la función de la proteína6. Por lo tanto, nos propusimos adoptar una técnica que produciría medidas cuantitativas precisas y reproducibles y localización de los mRNAs individuales en ovocitos solo.
DNA ramificado juntada a hibridación fluorescente in situ amplifica la señal de fluorescencia en lugar de amplificar RNA/cDNA que permite detección de mRNAs individuales en células individuales 7,8,9. El ensayo se realiza a través de una serie de hibridación, amplificación (usando ADN ramificado) y fluorescencia de etiquetado pasos para amplificar la señal de la fluorescencia del7. La técnica comienza con el atascamiento de pares de sonda de 18 - 25 base de oligonucleótidos que son complementarias a un ARNm específico3,8,10. Quince a veinte pares de sonda están diseñados para cada especificidad asegurando de transcripción para la transcripción de destino. La hibridación específica del mRNA es seguida por sondas de preamplificador y amplificador que forman una configuración ramificada. Aproximadamente, 400 etiqueta fluoróforos se unen a cada amplificador, resultando en un 8000-fold incremento de fluorescencia que permite la detección de mRNAs individuales (figura 1)11.
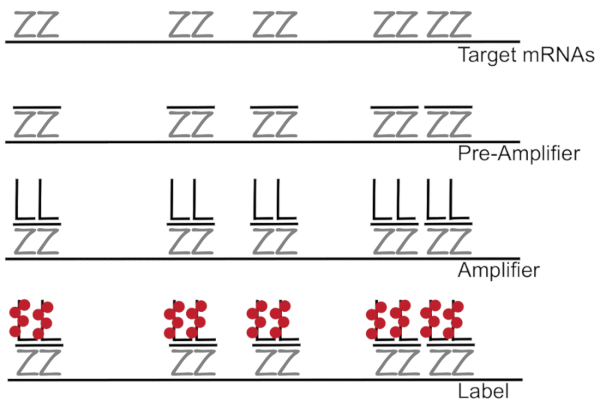
Figura 1: esquema del protocolo SM-pescado. Hibridación secuencial de sonda específica de la transcripción, ramificado ADN amplificador y fluoróforo a un mRNA se muestra de destino. Haga clic aquí para ver una versión más grande de esta figura.
Estudios previos usando in situ hibridación (SM-pescado) localizado β-actina mRNAs en neuronas individuales12 y papillomavirus humano DNA en cáncer de cuello uterino fluorescencia sola molécula célula líneas7. El software de computadora encontrar lugar y programa de seguimiento identifica la señal fluorescente punteada individual y se ha utilizado con éxito para cuantificar el número de mRNAs en cada célula3,13.
Basado en los resultados de la detección de mRNA en las neuronas12, presumimos que SM-pez sería una herramienta útil para cuantificar los niveles de transcripción en murinos ovocitos y embriones incluyendo mRNAs de baja abundancia. Sin embargo, la técnica está optimizada para el uso con las células fijas adherentes y formaldehído fijada parafina incorporado secciones de tejido (FFPE). Ovocitos no se adhieren a un portaobjetos, incluso cuando están recubiertos con poli-l-lisina. Además, son más frágiles que las células somáticas y las secciones de tejido que resulta en lisis celular cuando se someten a algunos de los buffers propietarios en kits disponibles en el mercado3. Para superar estos desafíos, ovocitos fueron fijos y transferidos manualmente entre las gotas de los amortiguadores. Además, buffers de permeabilización y lavado en los kits fueron substituidos para reducir la lisis celular. Sondas prediseñadas se compran junto con el kit de peces o pueden solicitar transcripciones específicas. Cada conjunto de sonda patentada está disponible en uno de los tres canales de fluorescencia (C1, C2 y C3) para permitir la multiplexación. En el experimento actual, oocitos murinos fueron cuantificados utilizando una sonda C2 Nanog y una sonda de C3 Pou5f1 y doble tinción. Estas sondas se seleccionaron con base en la expresión divulgada de Nanog y Pou5f1 en ovocitos y embriones. En la conclusión de los pasos de hibridación, ovocitos fueron colocados en gotas anti-fade del medio de montaje para aplicación a las diapositivas histológicas. Imágenes confocales fueron utilizados para cuantificar el número de señales fluorescentes punteadas que representan los mRNAs. Además de cuantificar los mRNAs, proyección de imagen demostró también la distribución espacial de los mRNA específicas en la célula, que otros métodos de cuantificación de RNA son incapaces de lograr. Esta técnica demostró para tener poca variabilidad dentro de un grupo experimental que permite el uso de un número menor de ovocitos en cada grupo experimental para identificar diferencias significativas entre grupos experimentales3.
Protocolo
Procedimientos animales fueron revisados y aprobados por el cuidado institucional de Animal y uso de la Universidad de Nebraska-Lincoln y todos los métodos fueron realizados conforme a las normas y directrices pertinentes. Para este estudio, CD-1 marginado ratones tuvieron acceso ad libitum a chow roedor normal y agua; se mantuvieron en un 12:12 oscuras: ciclo de luz.
1. preparación de medios necesarios
- Para los medios de base (OMM), añadir 100 mM NaCl, KCl de 5 mM, 0,5 mM KH2PO4y 1,7 mM CaCl2-2 H2O a 100 mL de agua estéril.
Nota: Medio OMM puede almacenarse hasta por 1 mes. - Por completo los medios de comunicación (OMOPS), añadir 20 mM ácido 3-morpholinopropane-1-sulfónico (MOPS), 1,2 mM MgSO4-7 H2O, 0,5 mM de glucosa, L-lactato, de 6 mM 1 mM ala-gln, taurina, 0,1 mM 1 x aminoácidos no esenciales (AANE), (ácido etilendiaminotetracético) 0,01 mM EDTA), el ácido alfa lipoico de 10 μm, gentamicina de 10 μg/mL sin diluir, 21 mM 1 M NaOH, 5 mM NaHCO3, 0,2 mM piruvato, 0,5 mM citrato de FAF de 4 mg/mL BSA a un 1:10 dilución de OMM en agua estéril para un volumen total de 100 mL. Esterilizar el medio con un filtro de 0,22 μm.
Nota: OMOPS se pueden almacenar hasta 1 semana. - Para el medio de sujeción (HM) Añadir 5% de suero fetal bovino a OMOPS. Hacer 2 mL HM por ratón.
- Para hialuronidasa solución agregar 0,1 mg/mL de hialuronidasa derivada de testículos bovinos, 1 ml HM.
- Para el búfer de fijación combinan paraformaldehído al 4% en 10 mL de 1 x PBS y 0,1% embriones grado polivinilpirrolidona (PVP)14.
- Para preparar 50 mL de tampón de lavado (WB), agregar surfactante no iónico 0.1% y 0.1% PVP de 1 x PBS14.
- Para preparar 10 mL de tampón de permeabilización, añadir 1% de tensioactivo no - iónico a 1 x PBS14.
Nota: Los buffers lavado y permeabilización descritos anteriormente cambie los propiedad búferes en los kits disponibles en el mercado.
2. colección de ovuladas ovocitos de ratones femeninos
- Preparación:
- Estimular ratones hembra en 5 a 8 semanas de edad por inyección intraperitoneal (IP) de 5 UI gonadotropina coriónica equina (eCG) seguida de 5 UI de gonadotropina coriónica (hCG) 44-48 h después de15,16.
- Mantener platos de Petri de 35 mm que contiene 2 mL de HM en una placa calentadora de 37 ° C. Tomar con pipeta una gota de 100 μl de HM que contiene hialuronidasa diluida seguida por tres gotas de 50 μl de HM sin hialuronidasa en caja Petri de 60 mm. Coloque las placas de la placa de gotas que contienen en el calentamiento de 37 ° C antes de usar.
Nota: Las gotas de hialuronidasa deben hacerse justo antes de la disección de cada par de oviducto para prevenir la evaporación y concentración de los componentes de HM con o sin hialuronidasa.
- Eutanasia a ratones, 16 h después de la inyección del IP de hCG, uso de sobredosis de isoflurano seguido por dislocación cervical.
- Limpiar el ratón utilizando etanol al 70%. Exponer la cavidad abdominal y visualizar el tracto reproductor femenino. Sostenga el ovario con pinzas y retire los ligamentos uterinos y exceso de tejido adiposo de alrededor del ovario. Corte el oviducto del útero y el par de ovario oviducto en el HM caliente en el plato de 35 mm.
- Quitar el ovario y cualquier tejido adiposo circundante. Romper la ampolla inflamación del oviducto utilizando una aguja de calibre 27 1/2 pulgada. Empuje el oviducto en el sitio de la lágrima y los complejos de la célula ovocito cumulus (AOC) serán expulsados. Transfiera los ovocitos ovulados, que se presumen que en metafase II (MII) de la meiosis, a la caída de 100 μL que contiene medios HM con hialuronidasa con una pipeta de boca (figura 2).

Figura 2 : Partes de la pipeta de boca utilizado para transferencia de ovocitos. (A) boca pieza (B) 0.22 um, 4 mm filtro (C) aspirador tubería (D) 1000 μL Punta de la pipeta (E) 9" pipeta Pasteur. Haga clic aquí para ver una versión más grande de esta figura.
- Pipetear los complejos de la célula ovocito-cumulus MII hacia arriba y hacia abajo en la hialuronidasa con HM con la pipeta de boca para desalojar células del cúmulo. Transferir cada ovocito, una vez que están desprovistas de células del cúmulo a un lavado gota HM contiene solamente usando la pipeta de boca. Repita esto para cada gotita de lavado. No transferencia de ovocitos fragmentadas o transparente15.
Nota: Es importante transferir los ovocitos de cada gota en el plato de 35 mm con como poco HM como sea posible. Esto es cierto para cada transferencia en el protocolo. Los ovocitos MII no deben permanecer en la hialuronidasa que contiene medio de HM para más de un minuto.
3. SM-pescado coloración de ovocitos
- Fijar los ovocitos en un pozo individual de una placa de 6 pozos conteniendo 500 μl de tampón de fijación. Sumergir 20 ovocitos o menos en el pozo. Incubar por 20 min a temperatura ambiente.
Nota: Cada paso de tinción SM-pescado ocurre dentro de un pozo individual en una placa de 6 pozos cónico. Asegúrese de que los ovocitos son totalmente sumergidas en tampones y no flotante en la parte superior del búfer. Cada paso debe ser realizado con 20 oocitos o menos en cada pozo. - Transferencia de ovocitos fijadas a 500 μL de tampón de lavado (descrito en el paso 1.6 WB) durante 10 minutos. Repetir 2 veces más.
- Incubar ovocitos en buffer de permeabilización durante 30 min a temperatura ambiente.
Nota: El buffer de permeabilización se describe en el paso 1.7 reemplaza el buffer de permeabilización de la propiedad.- Se reúnen conjuntos de sonda y girar rápidamente hacia abajo en una microcentrífuga. Caliente cada sonda de 10 min en un baño de agua de 40 ° C o incubadora. Enfríe a la temperatura ambiente.
Nota: Este paso debe realizarse durante la incubación de permeabilización
- Se reúnen conjuntos de sonda y girar rápidamente hacia abajo en una microcentrífuga. Caliente cada sonda de 10 min en un baño de agua de 40 ° C o incubadora. Enfríe a la temperatura ambiente.
- Lavado de ovocitos en 500 μl de WB por 10 min a temperatura ambiente.
- Transfiera los ovocitos a 80 μL de proteasa III tampón (disponible en el kit), que es diluida 1:8 en 1 PBS X durante 30 min a temperatura ambiente.
Nota: El volumen 80 μl cubre adecuadamente el fondo de un pozo individual en una placa de 6 pozos. - Lavado de ovocitos en 500 μl de WB por 10 min a temperatura ambiente.
- Diluir los sonda calentada conjuntos de Nanog, Pou5f1 y DapB (un gen de control negativo), 1:50 en diluyente de sonda. Incubar ovocitos en 80 μL de la sonda de transcripción específicos durante 2 horas a 40° C.
Nota: Cada conjunto de sonda patentada está disponible en uno de los tres canales de fluorescencia (C1, C2 y C3). Las sondas de Nanog y Pou5f1 fueron marcadas con C2 y C3, respectivamente. - Caliente el propietario, 1 amplificador (1 AMP), amplificador 2 (AMP2), amplificador 3 (AMP3) y amplificador 4-fluorescencia (FL 4 AMP) a temperatura ambiente.
Nota: Este paso debe realizarse durante la incubación de 2 horas transcripción-específico sonda. - Transfiera los ovocitos a 500 μL de WB e incubar 10 min a temperatura ambiente.
- Incubar ovocitos secuencialmente en buffers de amplificación.
- Incubar ovocitos en 80 μl de AMP1 durante 30 min a ovocitos de transferencia de 40° C. a 500 μl de WB por 10 min a temperatura ambiente.
- Incubar ovocitos en 80 μl de AMP2 por 15 min a 40 ° C. Transfiera los ovocitos a 500 μl de WB por 10 min a temperatura ambiente.
- Incubar los ovocitos en 80 μl de AMP3 durante 30 min a 40 ° C. Transfiera los ovocitos a 500 μl de WB por 10 min a temperatura ambiente.
Nota: El resto del Protocolo se realiza en la oscuridad porque AMP-FL contiene el fluoróforo. Cuando se trabaja con el microscopio de disección, reduce la luz tanto como sea posible. - Añadir ovocitos a 80 μL de AMP4-FL durante 15 min a 40° C.
Nota: AMP4-FL se ofrece como alternativa buffer-A Alt-B (Alt-A), o Alt-C. Seleccione AMP4-FL búfer dependiente sobre qué emisión de longitud de onda es deseado.
- Lavado de ovocitos en 500 μl de WB por 10 min a temperatura ambiente. Incubar ovocitos en 80 μl de DAPI por 20 min a temperatura ambiente. Lavado de ovocitos en 500 μl de WB por 5 min a temperatura ambiente.
- Pipeta 12 μl antidecoloración del medio de montaje en el centro de un portaobjetos sin añadir burbujas al reactivo. Transferencia de ovocitos con como poco WB como sea posible en los medios de montaje y se aplica un cubreobjetos.
- El cubreobjetos en un ángulo de inclinación y lenta y suavemente sobre el líquido en la diapositiva. Evite presionar demasiado evitar la distorsión de los ovocitos y la introducción de burbujas el cubreobjetos.
- Almacenar las diapositivas en una oscura caja seca durante la noche a temperatura ambiente. Cubra los bordes de las diapositivas en pulimento de clavo claro para sellar el cubreobjetos.
- Utilizar un microscopio estándar para encontrar ovocitos en la diapositiva y el círculo con un marcador permanente.
Nota: Este paso no es necesario pero mejora localizar ovocitos en la diapositiva. Para mejores resultados, diapositivas de imagen dentro de 1 a 5 días como la señal fluorescente comenzará a desvanecerse.
4. tratamiento de la imagen
- Imagen de los ovocitos 3 dimensiones, usando microscopia confocal de paso z.
Nota: Para analizar con precisión las imágenes, cada paso de z debe ser 1,0 μm/rebanada. - Guardar imágenes confocales como un nd2 comprimido o individuales. Archivos TIFF para cada ovocito. Ambos tipos de imagen son compatibles con el programa de procesamiento de imágenes de código abierto, Fiji.
- Descargar e instalar el software de Fiji de acceso abierto (https://imagej.net/Fiji/Downloads).
- Arrastre archivos de nd2 en Fiji y elija hyperstack. Si imágenes confocales fueron guardados como. Archivos TIFF salte al paso 4.4.
Nota: Cuando se cae el archivo nd2 en Fiji el desplegable hyperstack aparecerá automáticamente. - Haga clic en la ficha imagen , seleccione Colory haga clic en Dividir canales para separar los canales fluorescentes del archivo nd2.
- Generar individuales. Archivos TIFF para cada rodaja z de los ovocitos en cada canal fluorescente. Haga clic en la ficha imagen , seleccione pilasy pila de imágenes, haga clic en. Click en la imagen , seleccione tipoy haga clic en Color RGB para convertir cada rodaja z en una imagen de color RGB individual.
Nota: El color RGB es artificial y puede ser elegido como deseado para cada longitud de onda de emisión. - Guarda cada imagen se puede convertir como. Archivo TIFF. Colocar imágenes de un ovocito único para cada canal fluorescente en una nueva carpeta para evitar confusiones durante la costura (paso 4.3).
- Arrastre archivos de nd2 en Fiji y elija hyperstack. Si imágenes confocales fueron guardados como. Archivos TIFF salte al paso 4.4.
- Normalizar cada uno. Imagen TIFF de Pou5f1 y Nanog utilizando imágenes de control negativo (DapB).
Nota: La normalización se realiza mediante un programa de retoque fotográfico. Asegúrese de eliminar los mismos niveles de fluorescencia del fondo de cada imagen de control. - Abierto cada uno normalizado. Archivo TIFF en Fiji para unir todos los z-sectores para cada ovocito en cada longitud de onda.
- Haga clic en la pestaña de Plugins , seleccione costuray haga clic en Colección de rejilla (Figura 3A). Seleccione Imágenes secuenciales en el menú desplegable y haga clic en aceptar (figura 3B).
- Navegar por el directorio y seleccione la carpeta que contiene todas las imágenes de rodaja z para un ovocito individual en una longitud de onda (ver paso 4.3.4). Haga clic en Aceptar.
- Mueva el control deslizante en la parte inferior de la imagen cosida en el canal de color apropiado para la longitud de onda utilizada y crear la imagen final de cosido de RGB haciendo clic en la imagen, seleccionando el tipo, haga clic en Color RGB.
Nota: Esta imagen se utilizará para la cuantificación de la fluorescencia que se describe en el paso 4.6 abajo.
- Convertir la imagen cosida a la imagen proyectada máxima de 32-bit. Haga clic en la imagen, seleccione el tipoy haga clic en 32 bits (figura 3). Guardar esta imagen como una nueva. Archivo TIFF.
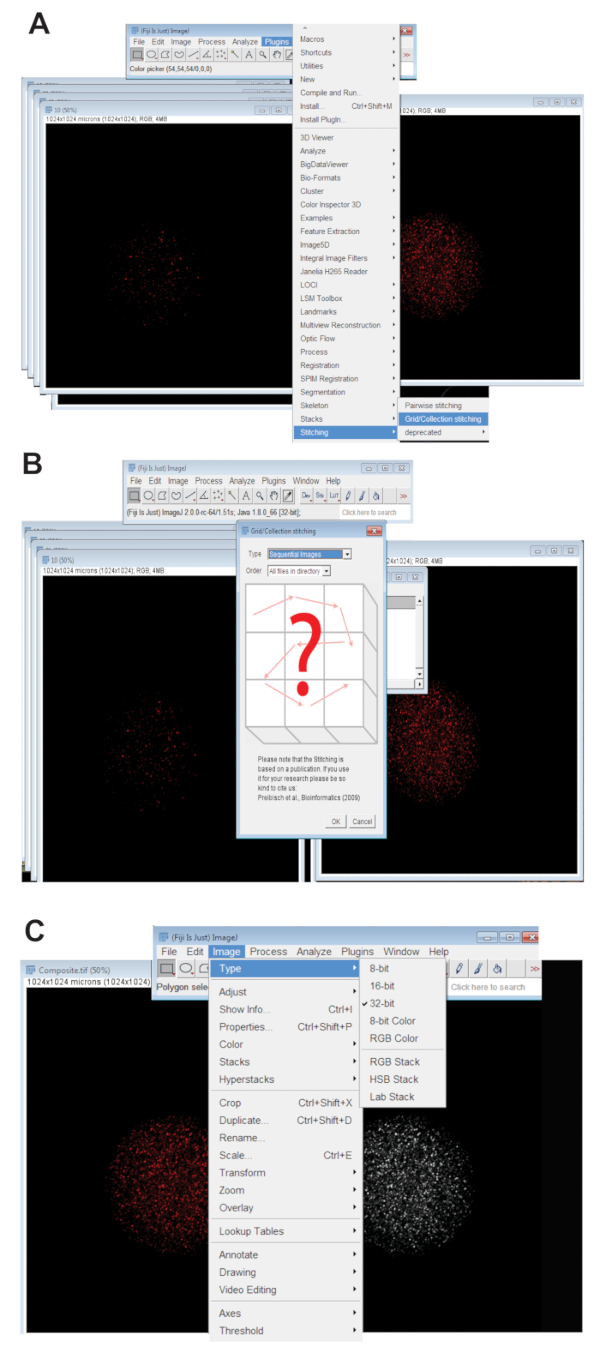
Figura 3 : Sutura de imágenes confocales de serie z de los ovocitos. (A) captura de pantalla que muestra la herramienta de plug-in red/colección de Fiji que se usó para producir las imágenes compuestas de los ovocitos. (B) imágenes secuenciales utiliza fluorescencia se solapan alternativamente. Archivos TIFF para generar una imagen compuesta. (C) la imagen compuesta fue guarda como un 32-bit. Archivo TIFF. Haga clic aquí para ver una versión más grande de esta figura.
- Descargar e instalar el programa seguimiento y encontrar punto13, que está disponible en el sitio web D.R. Larson, un investigador en el nacional institutos de Salud Instituto Nacional del cáncer (https://ccr.cancer.gov/Laboratory-of-Receptor-Biology-and-Gene-Expression/daniel-r-larson). Descargar e instalar la máquina virtual de libre acceso para el sistema de operativo de lenguaje (IDL) de datos interactivo que es necesaria para ejecutar el encontrar lugar y programa de seguimiento (http://www.spacewx.com/pdf/idlvm.pdf).
- Abre la imagen de 32 bits, cosida, que se generó en el paso 4.6 (Figura 4A), en el programa de seguimiento y encontrar lugar. Seleccione el desplegable Localize y Localize (Figura 4B), que a calcular el número puntos encontrados la imagen, haga clic en.
Nota: Cada punto contado representa un mRNA individuales. Ajustes de banda paso y fotón umbral se muestran en la pantalla (Figura 4B). De este protocolo, fue utilizado por defecto para cada ajuste de umbral. Representante de positivo y los puntos de fondo se muestran (figura 4).

Figura 4 : Cuantificación de los mRNAs con buscador de Spot y seguimiento. (A) serie z Individual imágenes suturan como se describe en la figura 3 y guardados como un máximo de 32-bit proyectado. Archivo TIFF. (B) imagen compuesta fue inaugurada en buscador Spot y seguimiento. Localizar fue utilizado para contar las manchas fluorescentes (caja roja). Band pass y fotón umbral están indicadas por la caja azul. (C) la flecha azul señala una señal positiva (por encima del umbral). La flecha blanca muestra un fluorescente punto por debajo del umbral y, por lo tanto, no cuenta. Haga clic aquí para ver una versión más grande de esta figura.
Resultados
Al finalizar el protocolo, el resultado es imágenes individuales de la serie z confocal (Figura 4A y figura 5), cosido de imágenes (figura 4), y mRNA cuenta (Figura 4B). Cuando se realiza la multiplexación, también habrá combinados imágenes que muestran la etiqueta de dos mRNAs diferentes (figura 5). Las cuentas de mRNA se generan mediante cosido imágenes generadas por Fiji (figura 3) y los puntos de fluorescencia punteado contados con encontrar lugar y programa de seguimiento (Figura 4B).
Las cuentas de mRNA son analizadas posteriormente mediante una herramienta de análisis de datos estándar. En este protocolo, etiquetamos n = 12 ovocitos con Pou5f1 y Nanog. Los resultados de cada mRNA se calcula el promedio y el error estándar de la media calculada. Los datos recogidos en este protocolo demostrada 775 ± 26 SEM Pou5f1 transcripciones y 113 ± 5 SEM Nanog transcripciones en ovocitos MII (figura 5). Prueba t de student se determinó que una diferencia estadísticamente significativa en el mRNA cuenta entre Pou5f1 y Nanog. Importante, había ningunos puntos en n = 5 ovocitos que están marcados con la sonda DapB (es decir, control negativo). Tenga en cuenta el pequeño error de estándar usando solo 12 ovocitos individuales. La sensibilidad del ensayo también se acentúa por la positiva detección reproducible de Nanog(figura 5). Experimentos anteriores de dPCR reproducible no detectaron Nanog, que indica que el número de mRNAs de Nanog en un ovocito individual está por debajo de la detección de umbral con dPCR 3.
En experiencias piloto, se detectó fluorescencia reducida si hay un retraso entre la fijación de los ovocitos y la iniciación del protocolo SM-pescado. Además, si no se utilizan los búferes de la hibridación propia, la sonda y la amplificación de DNA ramificado no entrar en la célula dando por resultado la fluorescencia anillos alrededor de la membrana plasmática de los ovocitos. Esto es probablemente debido a la agregación de la DNA ramificada. Fluorescencia anillos alrededor de la membrana del ovocito también se producirá si hay pobre permeabilización de la membrana plasmática. También se requiere óptima degradación de proteína a mRNAs. El búfer de proteasa proporcionado en el kit de SM-pescado está en una concentración óptima para el tratamiento de las secciones de tejido y de células adherentes. Sin embargo, cuando se utilizan células no adherente, es importante identificar empíricamente la mejor dilución de la proteasa. Insuficiente búfer de proteasa podría resultar en artículos de mRNAs debido a la mala accesibilidad de la sonda en el mRNA. Además, demasiada proteasa puede resultar en la degradación de proteínas no sólo a la ARNm sino también la desestabilización de los mRNAs. En este protocolo, probamos detección de mRNA usando una curva de titulación de no diluido (1:1), 1:4, 1:8 y 1:12 tampón de proteasa diluido en PBS 1 x (n = 2 a 3 ovocitos por dilución). El promedio fue de fluorescente expresión de mRNA de Pou5f1 en ovocitos MII 169 ± 42 SEM (sin diluir), 176 ± 36 SEM (1:4), 308 ± 18 SEM (1:8) y 445 ± 24 SEM (1:12) (figura 6). Dilución de la proteasa utilizado en el presente Protocolo fue 1:8 como lo mostró la variación más baja.

Figura 5 : Pou5f1 y Nanog mRNA en ovocito MII. (A). imágenes representativas de la imagen de la serie z medio se muestran a la izquierda. Pou5f1 se detecta en la red (647 nm) longitud de onda mientras que Nanog es detectada en el verde (488 nm) longitud de onda. La coloración de DAPI de los cromosomas alineados en el eje II de metafase, característico de los ovocitos MII, se muestra en blanco. No hubo ninguna coloración para DapB en cualquiera el 647 nm o la longitud de onda de emisión nm 488. (B) el número de mRNAs Pou5f1 y Nanog se muestra como media SEM (n = 12 ovocitos); no había ninguna detección (N.D) de DapB. * indica P < 0.05, barra de escala es 10 μm. haga clic aquí para ver una versión más grande de esta figura.

Figura 6 : Valoración empírica del búfer de la proteasa para optimizar la cuenta exacta de los mRNAs de. Imágenes representativas de SM-peces de Pou5f1 en ovocitos MII. Tinción DAPI muestra los cromosomas alineados en el huso MII. Ovocitos se incubaron con no diluido (1:1), 1:4, 1:8 o 1:12 diluciones de tampón de proteasa III. El número de los mRNAs de Pou5f1 (n = 2-3 ovocitos) fueron contados y la media SEM se muestra. Barra de escala es 10 μm. haga clic aquí para ver una versión más grande de esta figura.

Figura 7 : Transferencia de ovocitos MII a través de buffers de fijación, proteasa y de la hibridación en los pocillos de una placa de 6 pozos. Se muestra la forma de cada pozo. (A) las células flotan cuando primero agrega a búferes de sumersión (B) de los ovocitos en tampones. (C) ovocitos settle al fondo del pozo durante el período de incubación. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Una serie de pasos pequeños durante el protocolo asegurará de fluorescencia exitosa y precisa de mRNAs. En primer lugar, el protocolo debe realizarse inmediatamente después de recogida y fijación de los ovocitos. Tenga en cuenta que PVP se ha agregado el buffer de fijación de paraformaldehído al 4% para evitar que los ovocitos se pegue uno al otro. Encontramos que es necesario realizar el experimento inmediatamente después de la recogida y fijación de los ovocitos. Cualquier retraso se traduce en una mucho menor fluorescencia señal que daría lugar a descuentos de las transcripciones. Esto es debido en parte a la degradación de RNA. No más de 20 ovocitos deben ser transferidas a un pocillo de la placa de la pozo 6 simultáneamente y cada bien debe ser utilizado una vez. Tiempos de incubación deben seguirse con precisión sin acortamiento o alargamiento de cada paso. La excepción es los pasos de tampón de lavado; ovocitos pueden dejarse en el tampón de lavado durante un tiempo prolongado sin alterar los resultados experimentales. Las sondas de SM-peces están disponibles en tres canales de fluorescencia C1, C2 y C3. Para multiplexación, no mezcle las puntas de prueba que tienen la misma etiqueta de canal. Esto resultará en ambas puntas de prueba fluorescentes en el mismo emite longitud de onda representación análisis imposible como no habrá ninguna manera de distinguir entre los sistemas de la sonda. Sondas de control positivo diseñadas contra genes housekeeping están disponibles en cada uno de los tres canales. Sondas de control negativo (p. ej., DapB) también están disponibles en sets premezcladas que contienen una etiqueta para los tres canales. El experimento debe realizarse en iluminación tenue como ovocitos son sensibles a la luz después del retiro de la oviducto17,18. Después de la adición de los fluoróforos a AMP4, los pasos se deben realizar con como poca luz como sea posible para evitar un blanqueamiento del fluoróforo. Por último, montaje de ovocitos en diapositivas histológicas, coloque con cuidado el cubreobjetos para evitar la distorsión de los ovocitos y la formación de burbujas que pueden interferir con la proyección de imagen. Si le resulta difícil evitar la distorsión de la célula, se deben utilizar separadores de diapositiva para mantener la forma esférica de los ovocitos.
Una modificación fundamental del protocolo es el reemplazo de permeabilización y tampones de lavado sumistrados en el kit disponible comercialmente. Los buffers de proteasa e hibridación patentados proporcionados son entornos para los ovocitos pero son necesarios para el éxito del protocolo. Si no se utiliza, los amplificadores son incapaces de entrar en la célula que es probablemente debido a la agregación de la DNA ramificada. Hacia los ovocitos de estos entornos la permeabilización relativamente suave y tampones de lavado, diseñados para inmunofluorescencia14, resultado adecuado para el éxito del protocolo y al mismo tiempo previene la lisis de los ovocitos. Porque los ovocitos y embriones preimplantación no se adhiere a un portaobjetos histológico, otra modificación esencial fue colocar los ovocitos en los buffers dentro de un pozo de una placa de cultivo. Se utilizó una placa de cultivo de embrión de 6-bien. Cada pocillo de la placa ha afilado y lados inclinadas y una plana de 8 mm inferior (figura 7), que mejora la recuperación de oocitos. Esto es particularmente importante como ovocitos pierden sus propiedades refractarias y casi transparentes en los buffers de hibridación.
Cuando transferencia de ovocitos de bien a bien, es importante asegurarse de que los ovocitos son totalmente sumergidos en las soluciones en cada pozo como células flotará cuando primero transferido a cada pozo (Figura 7A). Una vez que mecánicamente están sumergidas en el búfer (figura 7B), se hundirá hasta el fondo del pozo por el final de la incubación (figura 7). La excepción es AMP 1 y 3 AMP; Cuando mecánicamente sumergida la do de ovocitos no totalmente settle al fondo del pozo. Para encontrar estos ovocitos, puede que necesite cambiar el plano de enfoque. Pipetee cuidadosamente y cuente el número de células que se transfieren para evitar la pérdida.
Múltiples técnicas de los pescados sola molécula, que amplifican la señal fluorescente en lugar de cDNA, incluyendo químicas del ADN ramificados, ha sido desarrollaron 9,19. Kits disponibles en el mercado han optimizado el método de DNA SM-FISH ramificado de detección reproducible de mRNAs individuales en las secciones de tejido o células adherentes en una diapositiva histológica. El protocolo descrito aquí ha sido modificado para su uso con células no adherente (por ejemplo, ovocitos y embriones preimplantación)3. Esto permite no sólo la cuantificación específica y reproducible, sino también localización de mRNA en el ovocito. Mientras que esto es una ventaja del ensayo, por supuesto existen limitaciones. Por ejemplo, a diferencia de la secuenciación del RNA, no puede identificar mRNAs novela. Una limitación adicional del protocolo es la disponibilidad de sondas específicas de transcripción. Sondas de propiedad son comercialmente disponibles de las compañías que venden los kits de SM-pescado. Hay varias sondas que son prefabricadas. Otros pueden ser diseñados por la empresa para cualquier anotación mRNA utilizando un algoritmo objetivo10. Sin embargo, si un ARNm es mal secuenciado que sería difícil para las sondas de diseño con alta especificidad. Para las transcripciones corto también puede ser difícil identificar suficientes pares de sonda que no reacción cruzada con otras transcripciones reducir la especificidad del ensayo. Asimismo, un número menor de sistemas de la sonda puede ser insuficiente para producir la señal de fluorescencia por encima del umbral de detección como positivos en el programa de seguimiento y encontrar lugar. En este mismo sentido, variantes de la transcripción no pueden ser detectadas con este método.
A pesar de las limitaciones descritas anteriormente, existen varias aplicaciones para SM-pescado. Por ejemplo, los datos de secuenciación del RNA de la célula solo se pudieran validar especialmente cuando números de celular son pequeños y difíciles de conseguir (por ejemplo, óvulos y embriones). Amplificación de cDNA para los ensayos de PCR presenta un error experimental que por lo general se reduce a un paso de normalización utilizando los datos de los genes housekeeping estable expresado. Sin embargo, cambios temporales en el oocito a través de embriones de preimplantación también cambia la expresión de los genes housekeeping. El protocolo SM-peces amplifica fluorescencia en lugar de cDNA. Por lo tanto, no hay ningún requisito para la normalización de los niveles de mRNA transcripción específica para obtener resultados reproducibles, con poca variabilidad. Debido a la variabilidad de la eficiencia de la cartilla PCR, las diferencias en las cifras absolutas de diferentes especies de ARNm no se puede comparar con precisión dentro de o entre tipos de células. SM se localiza y cuantifica mRNA. Por lo tanto, puede utilizarse para identificar qué células expresan mRNA en una población celular mixta. Por ejemplo, cuando los ovocitos están creciendo dentro de los folículos primarios o secundarios, el folículo puede ser aislado y cultivado en perlas de alginato20 pero es difícil la separación del ovocito de las células somáticas. Por lo tanto, estudios PCR y secuenciación se han realizado con poblaciones de mezclado de la célula. El uso de SM-FISH para determinar si mRNAs se detectan en las células somáticas o el ovocito del folículo. Por último, SM-pescado tiene alta sensibilidad y especificidad para la detección de las transcripciones de baja abundancia; por ejemplo, detección de Nanog en ovocitos MII (figura 5).
Almacenamiento y degradación de los mRNAs son importantes mecanismos de expresión de la proteína. Regulación postranscripcional de la traducción, almacenamiento y degradación están mediadas por proteínas que se unen a mRNAs21. En la actualidad, inmunoprecipitación de RNA-proteína (RIP) puede realizarse rutinariamente cuando una gran cantidad de células disponibles22. Debido al gran número de huevos de Xenopus, que se pueden recoger en un solo animal, el RIP se ha realizado con éxito en este modelo animal. Sin embargo, es difícil obtener suficientes ovocitos mamíferos y previo a la implantación embriones para realizar RIP. Acoplamiento de SM-peces e inmunofluorescencia (immunoFISH) 23 de las secciones de tejido tienen el potencial para visualizar proteínas relacionadas con mRNAs específicos incluyendo la maquinaria traduccional24,25. Medir la genómica variantes genéticas (p. ej., polimorfismos de un nucleótido pequeño, SNPs) relacionadas con la salud y la enfermedad26. Fenómica identifica cambios en respuestas celulares debido a las presiones ambientales27,28. La investigación actual tiene como objetivo encontrar el mecanismo que conecta los cambios en el genoma con fenotipos específicos. El uso de immunoFISH tiene el potencial de vincular SNP dependen los cambios en la expresión del mRNA y la expresión de proteínas que contribuyen a los fenotipos celulares. Como la tecnología evoluciona, es probable que hay otras aplicaciones de SM-peces que identificarán los mecanismos importantes en varios sistemas biológicos.
Divulgaciones
Los autores no tienen nada que declarar
Agradecimientos
Agradecemos a Dr. Daniel R. Larson por su generosa ayuda con la instalación y uso del programa de seguimiento y encontrar lugar 13 y el apoyo técnico de la Universidad de Nebraska Lincoln microscopia base para la proyección de imagen de microscopía confocal. Este estudio representa una contribución de la Universidad de la división de investigación agrícola de Nebraska, Lincoln, Nebraska y fue apoyado por fondos de la portilla de UNL (NEB-26-206/número de-232435 y NEB-26-231/número de-1013511).
Materiales
| Name | Company | Catalog Number | Comments |
| (±)-α-Lipoic acid | Sigma-Aldrich | T1395 | Alpha Lipoic Acid |
| Albumin, Bovine Serum, Low Fatty Acid | MP Biomedicals, LLC | 199899 | FAF BSA |
| BD 10mL TB Syringe | Becton, Dickinson and Company | 309659 | 10 mL syringe |
| BD PrecisionGlide Needle | Becton, Dickinson and Company | 305109 | 27 1/2 gauge needle |
| Calcium chloride dihydrate | Sigma-Aldrich | C7902 | CaCl2-2H2O |
| Citric acid | Sigma-Aldrich | C2404 | Citrate |
| D-(+)-Glucose | Sigma-Aldrich | G6152 | Glucose |
| Disodium phosphate | Na2HPO4 | ||
| Easy Grip Petri Dish | Falcon Corning | 351008 | 35 mm dish |
| Edetate Disodium | Avantor | 8994-01 | EDTA |
| Extra Fine Bonn Scissors | Fine Science Tools | 14084-08 | Straight, Sharp/Sharp, non-serrated, 13mm cutting edge scissors |
| Fetal Bovine Serum | Atlanta biologicals | S10250 | FBS |
| Gentamicin Reagent Solution | gibco | 15710-064 | Gentamicin |
| GlutaMAX-I (100X) | gibco | 35050-061 | Glutamax |
| Gold Seal Micro Slides | Gold Seal | 3039 | 25 x 75mm slides |
| Gonadotropin, From Pregnant Mares' Serum | Sigma | G4877 | eCG |
| hCG recombinant | NHPP | AFP8456A | hCG |
| Hyaluronidase, Type IV-S: From Bovine Testes | Sigma-Aldrich | H3884 | Hyaluronidase |
| Jewelers Style Forceps | Integra | 17-305X | Forceps 4-3/8", Style 5F, Straight, Micro Fine Jaw |
| L-(+)-Lactic Acid, free acid | MP Biomedicals, LLC | 190228 | L-Lactate |
| Magnesium sulfate heptahydrate | Sigma-Aldrich | M2773 | MgSO4-7H2O |
| MEM Nonessential Amino Acids | Corning | 25-025-Cl | NEAA |
| Microscope Cover Glass | Fisher Scientific | 12-542-C | 25 x 25x 0.15 mm cover slips |
| Mm-Nanog-O2-C2 RNAscope Probe | Advanced Cell Diagnostics | 501891-C2 | Nanog Probe |
| Mm-Pou5f1-O1-C3 RNAscope Probe | Advanced Cell Diagnostics | 501611-C3 | Pou5f1 Probe |
| MOPS | Sigma-Aldrich | M3183 | |
| Paraformaldehyde | Sigma-Aldrich | P6148 | Paraformaldehyde |
| PES 0.22 um Membrane -sterile | Millex-GP | SLGP033RS | 0.22 um filters |
| Polyvinylpyrrolidone | Sigma-Aldrich | P0930 | PVP |
| Potassium chloride | Sigma-Aldrich | 60128 | KCl |
| Potassium phosphate monobasic | Sigma-Aldrich | 60218 | KH2PO4 |
| Prolong Gold antifade reagent | invitrogen | P36934 | Antifade reagent without DAPI |
| RNAscope DAPI | Advanced Cell Diagnostics | 320858 | DAPI |
| RNAscope FL AMP 1 | Advanced Cell Diagnostics | 320852 | Amplifier 1 |
| RNAscope FL AMP 2 | Advanced Cell Diagnostics | 320853 | Amplifier 2 |
| RNAscope FL AMP 3 | Advanced Cell Diagnostics | 320854 | Amplifier 3 |
| RNAscope FL AMP 4 ALT A | Advanced Cell Diagnostics | 320855 | Amplifier 4 ALT A |
| RNAscope FL AMP 4 ALT B | Advanced Cell Diagnostics | 320856 | Amplifier 4 ALT B |
| RNAscope FL AMP 4 ALT C | Advanced Cell Diagnostics | 320857 | Amplifier 4 ALT C |
| RNAscope Fluorescent Multiplex Detection Reagents Kit | Advanced Cell Diagnostics | 320851 | FISH Reagent Kit |
| RNAscope Probe 3-plex Negative Control Probe | Advanced Cell Diagnostics | 320871 | Negative Control |
| RNAscope Probe 3-plex Positive Control | Advanced Cell Diagnostics | 320881 | Positive Control |
| RNAscope Probe Diluent | Advanced Cell Diagnostics | 300041 | Probe Diluent |
| RNAscope Protease III | Advanced Cell Diagnositics | 322337 | Protease III |
| RNAscope Protease III & IV Reagent Kit | Advanced Cell Diagnostics | 322340 | FISH Protease Kit |
| RNAscope Protease IV | Advanced Cell Diagnostics | 322336 | Protease IV |
| S/S Needle with Luer Hub 30G | Component Supply Co. | NE-301PL-50 | blunt 30 gauge needle |
| Sodium bicarbonate | Sigma-Aldrich | S6297 | NaHCO3 |
| Sodium chloride | Sigma-Aldrich | S6191 | NaCl |
| Sodium hydroxide | Sigma-Aldrich | 306576 | NaOH |
| Sodium pyruvate, >= 99% | Sigma-Aldrich | P5280 | Pyruvate |
| Solution 6 Well Dish | Agtechinc | D18 | 6 well dish |
| Taurine | Sigma-Aldrich | T8691 | Taurine |
| Tissue Culture Dish | Falcon Corning | 353002 | 60 mm dish |
| Triton X-100 | Sigma-Aldrich | X100 | Triton X-100 |
Referencias
- Vogelstein, B., Kinzler, K. W. Digital PCR. Proceedings of the National Academy of Sciences. 96 (16), 9236-9241 (1999).
- MacK, E. M., Smith, J. E., Kurz, S. G., Wood, J. R. CAMP-dependent regulation of ovulatory response genes is amplified by IGF1 due to synergistic effects on Akt phosphorylation and NF-kB transcription factors. Reproduction. 144 (5), 595-602 (2012).
- Xie, F., Timme, K. A., Wood, J. R. Using Single Molecule mRNA Fluorescent in Situ Hybridization (RNA-FISH) to Quantify mRNAs in Individual Murine Oocytes and Embryos. Scientific Reports. 8 (1), 7930 (2018).
- Ruebel, M. L., et al. Obesity modulates inflammation and lipidmetabolism oocyte gene expression: A single-cell transcriptome perspective. Journal of Clinical Endocrinology and Metabolism. 102 (6), 2029-2038 (2017).
- Borensztein, M., Syx, L., Servant, N., Heard, E. . Mouse Oocyte Development. 1818, 51-65 (2018).
- Jansova, D., Tetkova, A., Koncicka, M., Kubelka, M., Susor, A. Localization of RNA and translation in the mammalian oocyte and embryo. PLoS ONE. 13 (3), 1-25 (2018).
- Player, A. N., Shen, L. P., Kenny, D., Antao, V. P., Kolberg, J. A. Single-copy gene detection using branched DNA (bDNA) in situ hybridization. Journal of Histochemistry and Cytochemistry. 49 (5), 603-611 (2001).
- Wang, F., et al. RNAscope: A novel in situ RNA analysis platform for formalin-fixed, paraffin-embedded tissues. Journal of Molecular Diagnostics. 14 (1), 22-29 (2012).
- Itzkovitz, S., van Oudenaarden, A. Validating transcripts with probes and imaging technology. Nature Methods. 8 (4), S12-S19 (2011).
- Derti, A., et al. ProbeDesigner: for the design of probesets for branched DNA (bDNA) signal amplification assays. Bioinformatics. 15 (5), 348-355 (1999).
- Larson, B., Malayter, D., Shure, M. Multiplexed Detection of Cytokine Cancer Biomarkers using Fluorescence RNA In Situ Hybridization and Cellular Imaging. BioTek Application Notes. , 1-5 (2016).
- Buxbaum, A. R., Wu, B., Singer, R. H. Single β-Actin mRNA Detection in Neurons Reveals a Mechanism for Regulating Its Translatability. Science. 343 (6169), 419-422 (2014).
- Thompson, R. E., Larson, D. R., Webb, W. W. Precise nanometer localization analysis for individual fluorescent probes. Biophysical Journal. 82 (5), 2775-2783 (2002).
- Herrick, J. R., Paik, T., Strauss, K. J., Schoolcraft, W. B., Krisher, R. L. Building a better mouse embryo assay: effects of mouse strain and in vitro maturation on sensitivity to contaminants of the culture environment. Journal of Assisted Reproduction and Genetics. 33 (2), 237-245 (2016).
- Pohlmeier, W. E., Xie, F., Kurz, S. G., Lu, N., Wood, J. R. Progressive obesity alters the steroidogenic response to ovulatory stimulation and increases the abundance of mRNAs stored in the ovulated oocyte. Molecular Reproduction and Development. 81 (8), 735-747 (2014).
- Xie, F., Anderson, C. L., Timme, K. R., Kurz, S. G., Fernando, S. C., Wood, J. R. Obesity-dependent increases in oocyte mRNAs are associated with increases in proinflammatory signaling and gut microbial abundance of lachnospiraceae in female mice. Endocrinology. 157 (4), 1630-1643 (2016).
- Hirao, Y., Yanagimachi, R. Detrimental effect of visible light on meiosis of mammalian eggs in vitro. Journal of Experimental Zoology. , (1978).
- Takenaka, M., Horiuchi, T., Yanagimachi, R. Effects of light on development of mammalian zygotes. Proceedings of the National Academy of Sciences. 104 (36), 14293-14293 (2007).
- Komminoth, P., Werner, M. Target and signal amplification: Approaches to increase the sensitivity of in situ hybridization. Histochemistry and Cell Biology. 108 (4-5), 325-333 (1997).
- Hornick, J. E., Duncan, F. E., Shea, L. D., Woodruff, T. K. Multiple follicle culture supports primary follicle growth through paracrine-acting signals. Reproduction. 145 (1), 19-32 (2013).
- Vlasova-St. Louis, I., Bohjanen, P. Feedback Regulation of Kinase Signaling Pathways by AREs and GREs. Cells. 5 (1), 4 (2016).
- Gilbert, C., Svejstrup, J. Q. RNA Immunoprecipitation for Determining RNA-Protein Associations In Vivo. Current Protocols in Molecular Biology. 75 (1), 27.4.1-27.4.11 (2006).
- Kwon, S., Chin, K., Nederlof, M., Gray, J. W. Quantitative, in situ analysis of mRNAs and proteins with subcellular resolution. Scientific Reports. 7 (1), 16459 (2017).
- Voigt, F., et al. Single-Molecule Quantification of Translation-Dependent Association of mRNAs with the Endoplasmic Reticulum. Cell Reports. 21 (13), 3740-3753 (2017).
- Halstead, J. M., Wilbertz, J. H., Wippich, F., Lionnet, T., Ephrussi, A., Chao, J. A. TRICK: A Single-Molecule Method for Imaging the First Round of Translation in Living Cells and Animals. Methods in Enzymology. 572, (2016).
- Cookson, W., Liang, L., Abecasis, G., Moffatt, M., Lathrop, M. Mapping complex disease traits with global gene expression. Nature Reviews Genetics. 10 (3), 184-194 (2009).
- Houle, D., Govindaraju, D. R., Omholt, S. Phenomics: the next challenge. Nature Reviews Genetics. 11, 855 (2010).
- Freimer, N., Sabatti, C. The Human Phenome Project. Nature Genetics. 34, 15 (2003).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados