Method Article
Simplificado Humanos neutrófilos extracelular Trampas (TNE) Aislamiento y manipulación
* Estos autores han contribuido por igual
En este artículo
Resumen
En el siguiente protocolo, se describe una manera muy simple para aislar las trampas de neutrófilos extracelular (TNE) a partir de sangre humana entera utilizando reactivos fácilmente disponibles. A continuación, demostramos cómo las redes aisladas se pueden utilizar en un ensayo de adhesión in vitro con células cancerosas.
Resumen
Neutrófilos extracelular Trampas (TNE) se han identificado recientemente como parte del arsenal antimicrobiano de los neutrófilos. Aparte de su papel en la lucha contra las infecciones, la investigación reciente ha demostrado que pueden estar implicados en muchos otros procesos de enfermedad, incluyendo la progresión del cáncer. El aislamiento de los TNE purificadas es un elemento crucial para permitir el estudio de estas funciones.
En este vídeo, se demuestra un método simplificado de celda de aislamiento NET libre de sangre humana utilizando reactivos fácilmente disponibles. TNE aisladas se pueden utilizar para la tinción de inmunofluorescencia, secante o varios ensayos funcionales. Esto permite una evaluación de sus propiedades biológicas en ausencia de los posibles efectos de confusión de los propios neutrófilos.
Una técnica de separación por gradiente de densidad se emplea para aislar los neutrófilos de donante sano de sangre entera. Neutrófilos aislados se estimularon por forbol 12-myriState 13-acetato (PMA) para inducir NETosis. Los neutrófilos activados se descartan, y se obtiene una acción NET libre de células.
A continuación, demostramos cómo TNE aislado se puede utilizar en un ensayo de adhesión con células de cáncer de pulmón humano A549. El stock de NET se utiliza para recubrir los pocillos de una de 96 pocillos de cultivo celular placa de O / células A549 N, y después de asegurar la formación de una monocapa NET adecuada sobre el fondo de los pocillos, CFSE marcadas se añadidas. Las células adherentes se cuantificaron utilizando un microscopio de fluorescencia Nikon TE300. En algunos pozos, 1000U Dnase1 se añade 10 min antes de contar para degradar los TNE
Introducción
Trampas extracelulares de neutrófilos (TNE) han sido recientemente descubiertos elementos derivadas de neutrófilos compuestas de cadenas de ADN extracelular decorados por cientos de proteínas y las histonas. Ellos son secretadas por los neutrófilos en el contexto de la infección y la inflamación siguientes estímulos específicos y se registran inicialmente a formar parte de los mecanismos de defensa de los neutrófilos frente a las infecciones. Se les mostró primero en promover la captura de varios invasores microbianos incluyendo bacterias, virus y hongos 1-3. Atrapar del microbio entonces conducir a su destrucción, tanto directamente por las proteínas NET asociada 3,4 e indirectamente a través de la contratación local de las células fagocíticas 5,6. El papel de las redes sin embargo no parece limitarse a la defensa del huésped. Más recientemente, se ha demostrado jugar un papel importante en las enfermedades autoinmunes 7,8, trombosis 9, trastornos relacionados con el embarazo 10 y hasta la progresión del cáncer11,12. En consecuencia, parece que las redes juegan un papel importante en un gran número de diversos procesos fisiológicos. Sin embargo, dado el carácter novedoso de esta investigación, aún queda mucho por aclarar con respecto a los mecanismos por los cuales los TNE ejercen sus efectos. Aquí, presentamos un método simplificado para el aislamiento de los TNE en ausencia de neutrófilos.
En el siguiente vídeo, se demuestra una técnica simplificada y fácil de aislar los TNE de sangre humana. TNE libres de células se pueden utilizar en una serie de experimentos in vitro que incluyen la tinción, imuunofluorescence, borrando así como un número de ensayos tales como la adhesión, la proliferación y la migración. Existen 13, 19 Otros protocolos, sin embargo, son generalmente largo, complejo, costoso, y, a menudo, bajo rendimiento 13. Este protocolo simplificado utiliza reactivos básicos y disminuye el número de pasos necesarios para aislar los neutrófilos, por lo tanto, minimizar la longitud de la procedire al tiempo que maximiza el rendimiento.
El siguiente método combina diferentes técnicas para el aislamiento de neutrófilos se han descrito previamente en la literatura para obtener un protocolo simple dando una muestra muy pura de neutrófilos vivos. Como se sugiere en la literatura, la sangre venosa se recoge en tubos con EDTA y usado dentro de 10 minutos para evitar la activación de neutrófilos 14. Utilizamos medios de separación de linfocitos (LSM) centrifugación en gradiente de densidad para aislar los granulocitos y las células rojas de la sangre a partir de sangre entera heparinizada, un método adaptado de la técnica de centrifugación de densidad Ficoll descrito inicialmente por Boyum et al 15. LSM es una modificación de la formulación Boyum que sustituye diatrizoato de sodio para la metrizoato de sodio y se ha utilizado con éxito en muchos estudios para aislar los neutrófilos 16-18.
Después de la centrifugación de densidad diferencial, monocitos y linfocitos se descartan; los glóbulos rojos se sedimentaronutilizando una solución de dextrano 6% 14 y los glóbulos rojos restantes se lisan para obtener una población de neutrófilos puros, que se verifica con azul Trypan y tinción con azul de metileno.
Numerosos agentes se han utilizado para inducir NETosis tanto in vitro como in vivo, incluyendo lipopolisacárido (LPS), y acetato de forbol miristato (PMA) y las interleucinas (IL-8) 3,5,6. En el siguiente protocolo, los neutrófilos aislados se estimularon con 500 nM PMA durante 4 h, que se ha demostrado que es una concentración adecuada para permitir la formación NET consistente y fiable sin promover apoptosis 19,20.
Después del aislamiento, nos demuestran cómo los TNE libres de células obtenidas a partir de este protocolo se puede utilizar en un ensayo de adhesión. Dnase1 se utiliza para digerir y degradar TNE como se describió anteriormente y por lo tanto sirve como un control 2,3,11. Otras opciones incluyen el uso de inhibidor de la elastasa de los neutrófilos (NE) para inhibir NET formati, lo cual es una alternativa aceptable cuando el objetivo es inhibir la formación NET en lugar de efectuar su degradación 11. Aunque NE _ tiene un número de funciones variadas, se ha demostrado previamente que NET deposición puede ser inhibida por NEi a través del bloqueo de descondensación de la cromatina, la desgranulación nuclear y la muerte de neutrófilos 12
Protocolo
NOTA: Todos los experimentos se llevaron a cabo de conformidad con las directrices éticas institucionales locales.
Dibujo 1. Sangre
- A través venipucture antecubital, recoger 14 tubos de sangre de un voluntario sano en top verde tubos heparinizados () e invertir cada tubo antes de decidirse por el hielo. Recoger la sangre dentro de 10 - 15 minutos de experimento para garantizar un rendimiento óptimo de los neutrófilos.
2. Aislamiento de neutrófilos de sangre entera
- Lave cada tubo superior verde de la sangre con 5 ml de PBS sin Ca y Mg para diluir la sangre. En cada uno de 4 x 50 ml tubos cónicos, añadir 15 ml de medios de separación de linfocitos (LSM) a TA. Usando una aguja 18 G montado en una jeringa de 60 ml, la capa cuidadosamente la sangre diluida sobre el LSM, la creación de una interfaz de LSM-arterial agudo.
NOTA: Evitar la mezcla de las capas tanto como sea posible. - Centrifugar a 800 xg durante 30 minutos a 21 ° C sin descanso.
NOTA: Sudden descansos puedecausar la mezcla de las diferentes capas. - Observe la eritrocitos y neutrófilos sedimento en el fondo. Aspirar y desechar las 2 capas superiores (plasma y LSM), asegurándose de deshacerse de la interfaz entre estas capas que contiene linfocitos y células mononucleares, dejando sólo la capa roja de fondo.
- A cada tubo, añadir 20 ml de tampón fosfato salino (PBS) y solución de dextrano 20 ml de 6%. Invertir suavemente cada tubo para mezclar con la capa de eritrocitos y neutrófilos y dejar reposar a temperatura ambiente durante 30 min.
NOTA: Esto permitirá que los glóbulos rojos (GR) para sedimentar en el fondo. - Después de 30 min, transferir el sobrenadante rico en neutrófilos en tubos nuevos y desechar los pellets de RBC. Sobrenadantes centrifugar a 450 xg a 4 ° C durante 5 min. Después de la centrifugación, desechar el sobrenadante. El sedimento se contienen principalmente neutrófilos y pocos glóbulos rojos.
- Preparar una solución de lisis mediante la adición de 0,5 ml de tampón de lisis a 4,5 ml de agua estéril. De Lyse restante RBC con tse preparaba 5 ml de solución de lisis, la transferencia de todos los precipitados resuspendidos en un solo tubo. Permitir la lisis a temperatura ambiente en la oscuridad durante 10 min.
- Centrifugar a 450 xg a 4 ° C durante 5 min. Desechar el sobrenadante y lavar pellet con 5 ml de PBS sin Ca y Mg y centrifugar de nuevo a 450 xg a 4 ° C para deshacerse de cualquier solución de lisis restante. El sedimento obtenido en este punto contiene los neutrófilos. Resuspender el precipitado en 30 ml de frío 3% RPMI y poner en hielo.
NOTA: 3% RPMI se realiza complementando medio RPMI con 3% de suero bovino fetal (FBS) - Verificar la pureza de la muestra usando tinción con azul de metileno. > 95% de las células debería ser granulocitos con núcleos múltiples lobulares. Utilice tinción con azul tripán para verificar> 95% de viabilidad de las células y contar el rendimiento de neutrófilos final. Diluir neutrófilos en frío de hielo 3% RPMI para obtener una concentración final de 5 x 10 6 neutrófilos / ml.
3. TNE Generación
- Estimular neutrófilos con 500 nM de PMA (por 30 ml de solución de neutrófilos) y se incuba en un tejido plano plato 150 x 25 mm de cultivo con 20 mm rejilla durante 4 horas a 37 ° C 5% de CO 2. Esto permitirá NETosis.
- Después de 4 h de estimulación, aspirar suavemente y descartar los medios de comunicación, dejando la capa de los TNE y neutrófilos adheridos en la parte inferior. No interrumpir esta capa.
- Usando un total de 15 ml de PBS frío sin Ca y Mg por placa, lavar la parte inferior de cada plato con la pipeta 15 ml de PBS en la parte inferior del plato con el fin de levantar todo el material adherente de la parte inferior.
- Recoger solución obtenida a partir de lavar cada plato (paso 3,3) en un tubo cónico de 15 ml y centrifugar durante 10 min a 450 xg a 4 ° C. Los neutrófilos y las células restantes se sedimenten en la parte inferior, dejando un NET-rica sobrenadante libre de células.
- Divide sobrenadante en tubos de 1,5 ml de microcentrífuga y centrifugado durante 10 minutos a 18.000 xga 4 ° C. Esto permitirá que todo el ADN para sedimentar.
NOTA: La centrifugación en grande tubes es más fácil y menos tiempo si tan altas velocidades son alcanzables en la centrífuga regular, de lo contrario tendrá que dividir sobrenadantes en tubos más pequeños con el fin de utilizar de alta velocidad micro-centrífuga. - Desechar el sobrenadante y resuspender todos los pellets obtenidos juntos en hielo frío PBS a una concentración correspondiente a 2 x 10 7 neutrófilos por 100 l de PBS. Esto dará lugar a la población de NET libre de células que puede ser utilizado para los experimentos posteriores.
- Medir la concentración de ADN en la muestra obtenida mediante espectrofotometría o herramienta cuantificación de ADN alternativo. Una concentración adecuada en la muestra debería oscilar entre 140 a 180 ng / l.
4. Cell NET-estática cáncer de ensayo de adhesión
- Añadir 100 l de stock neto obtenido previamente por pocillo en una placa de fondo plano de 96 pocillos y permitir a los pozos de la capa O / N a 4 ° C en la oscuridad.
- Entre 12 y 20 horas más tarde, verificar formación de una monocapa uniforme de célulasTNE gratis en el fondo de los pocillos bajo el microscopio (Figura 1). En este punto, aspirar con cuidado todo el material no adherente de las fuentes, asegurándose de no perturbar la monocapa NET en la parte inferior.
- Añadir 100 l de 1% albúmina de suero bovino solución de bloqueo (BSA) a cada pocillo y se deja durante 1 h a TA.
- Separar las células cancerosas A549 a partir de un matraz T-75 de la utilización de 2 ml de solución de tripsina 0,25%. Una vez extraído, añadir 10 ml de medio de A549 a las células tratadas con tripsina y centrifugar a 450 xg a 4 ° C durante 5 min. Descartar sobrenadante y resuspender las células en medios de comunicación para obtener una concentración de 2 x 10 4 células cancerosas por los medios de comunicación 100 microlitros.
NOTA: Las células A549 se cultivaron por separado. Brevemente, las células se cultivaron y mantuvieron en medio F12 DMEM que contiene 10% de FBS y 1% de penicilina estreptomicina y se incubaron a 37 ° C 5% de CO 2. Una vez que 70 - se alcanzó 80% de confluencia celular, que se separaron usando 0,25% de tripsina-EDTA y se resuspendieron en el mismo mediodescrito arriba. - Células de cáncer de manchas utilizando CFSE mediante la adición de 1 l de CFSE por ml de los medios de comunicación y dejar manchar a TA durante 10 min. Después de la tinción, centrífuga hacia abajo a 450 xga 4 ° C durante 5 min y luego desechar sobrenadante y resuspender las células en el volumen inicial de los medios de comunicación para obtener una concentración de 2 x 10 4 células cancerosas por los medios de comunicación 100 microlitros.
- Después de 1 hr de los TNE de bloqueo, suavemente aspirado de solución de bloqueo y añadir 2 x10 4 células de cáncer en los medios de comunicación, que es equivalente a 100 l, por pocillo sobre la monocapa de NET y permitir que se adhieran durante 90 min a 37 ° C 5% de CO 2. Se aspira suavemente las células y añadir 100 l de PBS a cada pocillo para lavar las células no adherentes.
- En algunos pozos, añadir 1000U de Dnase1 por pocillo durante 10 min antes de lavar para degradar los TNE. Esto servirá como control negativo. En otros pocillos, añadir 100 l de agua estéril por pocillo durante 10 min, que servirá como el control de vehículo (VC).
NOTA: 3 repeticiones por condition usualmente se realizan para aumentar el tamaño de la muestra. - Aspirar y desechar toda la solución en los pozos dejando sólo los TNE y las células cancerosas adheridas en la parte inferior. Añadir 100 l de solución de formaldehído al 4% por pocillo para fijar las células cancerosas adherentes a NETS y leer ensayo bajo el microscopio de fluorescencia (Figura 1). Parcela y analizar los resultados (Figura 3).
Resultados
Logro de un ensayo de adhesión estática con redes requiere recubrimiento adecuado de los pocillos con una monocapa de TNE antes de la adición de las células cancerosas (Figura 1). Todos los pasos posteriores deben hacerse con cuidado para no perturbar la capa. Cuando se forma una capa adecuada de los TNE, se espera para ver significativa la adhesión a las redes de células cancerosas como se ve en la Figura 2A y 2C. Este efecto es abrogada por la adición de Dnase1, que degrada los TNE como se ve en las Figuras 2B y 2D. Por el contrario, no debería haber ninguna disminución significativa en la adhesión a las redes de A549 en presencia del control del vehículo (Figura 3). Para obtener una buena estimación de la adhesión celular del cáncer de media por campo de alta potencia (HPF), se recomienda para contar al menos 4 hpfs al azar por pocillo. Los campos que no están bien recubiertos de TNE debido a problemas técnicos no deben ser tomados en consideración para Counting ya que podría falsear los resultados.

Figura 1. NET monocapa. Imágenes de microscopía de luz de los pozos de 96 pocillos de la placa recubiertas con redes que muestra (A) monocapa uniforme a lo largo de los TNE así como frente a (B) de recubrimiento inadecuado de la bien con una capa interrumpida de NET. Las barras de escala representan 40 micras. Por favor, haga clic aquí para ver una versión más grande de esta figura.

Figura 2. A549 Cancer Cell Adhesión a redes en Vitro. Células (A) de cáncer de A549 (flechas) se adhieren a monocapa de TNE in vitro. (B) additien de Dnase1 disminuye significativamente el nivel de adhesión de células de cáncer; (C) muestra una imagen representativa de la adhesión de células de cáncer en los TNE bajo luz fluorescente bajo microscopía de fluorescencia (Nikon TE300) antes (C) y después (D) Además de Dnase1. Las barras de escala representan 40 micras. Por favor, haga clic aquí para ver una versión más grande de esta figura.
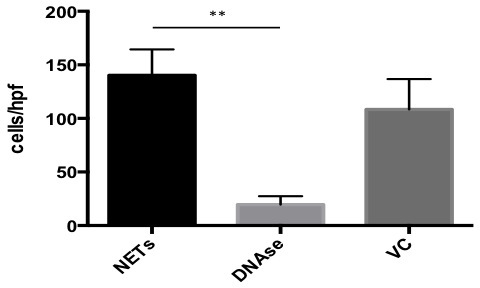
Figura 3. Resultados de software in vitro de ensayo de adhesión. GraphPad se utilizó para graficar y analizar los resultados del cáncer A549 ensayo de adhesión celular a las redes. En presencia de DNAsa, la adhesión fue 13,90% en comparación con los mosquiteros no tratados. En presencia del control del vehículo (VC), la adhesión fue 77,26% en comparación con los mosquiteros no tratados. Los datos se presentan como media +/-SEM. Importancia se determinó mediante la prueba de Kruskall Wallis con ** p <0,001.
Discusión
El protocolo de aislamiento de Trampa neutrófilos extracelular se demuestra en este vídeo combina diferentes técnicas utilizadas en la literatura para el aislamiento de neutrófilos y la formación de NET. Simplifica un proceso bastante complejo y variable y ofrece una forma muy fiable y reproducible para aislar los TNE libres de células purificadas con menos pasos que otros protocolos. Por otra parte, los reactivos fácilmente disponibles se emplean agregando a la simplicidad protocolos y reducir significativamente su costo. La aplicación de los TNE hacia un ensayo de adhesión estática sirve para demostrar la flexibilidad ofrecida por esta técnica de aislamiento, como NET concentración puede ser fácilmente manipulada para adaptarse a un objetivo particular (17). En consecuencia, las redes aisladas por la técnica demostrada se pueden utilizar para diversos tipos de ensayos que incluyen ensayos de adhesión dinámica, ensayos de migración, proliferación ensayos de inmunofluorescencia y microscopía confocal, microscopía electrónica, citometría de flujo, así como la transferencia Western tradicional.
Hay una serie de pasos en este protocolo que son críticos para su éxito. En primer lugar, los neutrófilos pueden ser activados accidentalmente durante el proceso de aislamiento que conduce a la apoptosis. Por tanto, es importante realizar todos los pasos de aislamiento bajo condiciones estériles en la campana de humos, evitar la mezcla agresiva de tubos, mantenga todas las muestras en hielo después de la etapa de lisis RBC, y evitar largos tiempos de espera entre los pasos. En segundo lugar, si el objetivo del ensayo es de cubrir los pocillos con el propósito de evaluar la adhesión, es importante respetar la concentración NET sugerido por pozo, así como la concentración de ADN final propuesto en la "población NET" ya que esto garantizará una aún y monocapa consistente de los TNE. Baja concentración puede producir sólo recubrimiento desigual del pozo y los resultados por lo tanto menos fiables. Finalmente, también es importante para manejar la monocapa NET muy cuidadosamente mientras se realiza el ensayo para evitar su interrupción. Esto se puede facilitar mediante el ajuste dela intensidad de la succión y de pipeteo en los lados de los pocillos.
Limitaciones de esta técnica incluyen el hecho de que aún requiere una cantidad significativa de tiempo para producir redes, principalmente causados por el paso de la estimulación PMA 4 hr. Además, se requiere una cantidad significativa de sangre para aislar un número suficiente de neutrófilos necesarios para un experimento. Hay sin duda es la pérdida de una cantidad significativa de redes en la primera etapa de centrifugación (etapa 3.4.) Al desechar los neutrófilos. Modificaciones para reducir al mínimo la pérdida de NET en este punto podría aumentar significativamente el rendimiento neto final. Además, los TNE aislados deben utilizarse dentro de 12 - 24 horas de su aislamiento, lo que requiere una planificación cuidadosa y experimento la gestión del tiempo.
Divulgaciones
Los autores no tienen nada que revelar
Agradecimientos
The authors would like to acknowledge Dr. Paul Kubes for his guidance and mentoring that were central in the construction of this work.
Materiales
| Name | Company | Catalog Number | Comments |
| Dulbecco’s Phosphate Buffered Saline (PBS), Modified, without calcium chloride and magnesium chloride | Wisent | 311-425-CL | |
| Lymphocyte Separation Medium (LSM) | Wisent | 305-010-CL | |
| Dextran hydrochloride (powder) | Spectrum | DE130 | 6% Dextran solution is made by supplementing PBS with Ca and Mg with 6% Dextran powder |
| RPMI-1640 Medium with L-glutamine | Wisent | 350-000-CL | 3% RPMI solution is made by supplementing RPMI with 3% Fetal Bovine serum |
| BD Pharm Lyse Lysing buffer | BD Biosciences | 555899 | |
| Phorbol 12-myristate 13-acetate (PMA) | Sigma-Alrdrich | P8139 | |
| DNAse1 | Roche | 11284932001 | |
| F12 DMEM | Wisent | 319-075-CL | |
| Fetal Bovine Serum (FBS) | Wisent | 080-150 | |
| Penicillin/Streptomycin | Gibco | 15140-122 | |
| CFSE | Invitrogen | C1157 | |
| 0.25% Trypsin-EDTA | Gibco | 25200-056 | |
| Integrid tissue culture dish with 20 mm grid (150 x 25 mm) | Falcon | 353025 |
Referencias
- Saitoh, T., et al. Neutrophil extracellular traps mediate a host defense response to human immunodeficiency virus-1. Cell Host Microbe. 12 (1), 109-116 (2012).
- Bruns, S., et al. Production of extracellular traps against Aspergillus fumigatus in vitro and in infected lung tissue is dependent on invading neutrophils and influenced by hydrophobin RodA. PLoS Pathog. 6 (4), e1000873 (2010).
- Brinkmann, V., et al. Neutrophil extracellular traps kill bacteria. Science. 303 (5663), 1532-1535 (2004).
- Papayannopoulos, V., Zychlinsky, A. NETs: a new strategy for using old weapons. Trends Immunol. 30 (11), 513-521 (2009).
- McDonald, B., Urrutia, R., Yipp, B. G., Jenne, C. N., Kubes, P. Intravascular neutrophil extracellular traps capture bacteria from the bloodstream during sepsis. Cell Host Microbe. 12 (3), 324-333 (2012).
- Pilsczek, F. H., et al. A novel mechanism of rapid nuclear neutrophil extracellular trap formation in response to Staphylococcus aureus. J Immunol. 185 (12), 7413-7425 (2010).
- Villanueva, E., et al. Netting neutrophils induce endothelial damage, infiltrate tissues, and expose immunostimulatory molecules in systemic lupus erythematosus. J Immunol. 187 (1), 538-552 (2011).
- Khandpur, R., et al. NETs are a source of citrullinated autoantigens and stimulate inflammatory responses in rheumatoid arthritis. Sci Transl Med. 5 (178), 178ra140 (2013).
- Demers, M., et al. Cancers predispose neutrophils to release extracellular DNA traps that contribute to cancer-associated thrombosis. Proc Natl Acad Sci U S A. 109 (32), 13076-13081 (2012).
- Hahn, S., Giaglis, S., Hoesli, I., Hasler, P. Neutrophil NETs in reproduction: from infertility to preeclampsia and the possibility of fetal loss. Front Immunol. 3, 362 (2012).
- Cools-Lartigue, J., et al. Neutrophil extracellular traps sequester circulating tumor cells and promote metastasis. J Clin Invest. , (2013).
- Cools-Lartigue, J., Spicer, J., Najmeh, S., Ferri, L. Neutrophil extracellular traps in cancer progression. Cell Mol Life Sci. , (2014).
- Brinkmann, V., Laube, B., Abu Abed, U., Goosmann, C., Zychlinsky, A. Neutrophil extracellular traps: how to generate and visualize them. J Vis Exp. (36), (2010).
- Maqbool, M., Vidyadaran, S., George, E., Ramasamy, R. Optimisation of laboratory procedures for isolating human peripheral blood derived neutrophils. Med J Malaysia. 66 (4), 296-299 (2011).
- Boyum, A. Isolation of lymphocytes, granulocytes and macrophages. Scand J Immunol. Suppl. 5, 9-15 (1976).
- Calado, R. T., et al. Sex hormones, acting on the TERT gene, increase telomerase activity in human primary hematopoietic cells. Blood. 114 (11), 2236-2243 (2009).
- Zhong, C., Qu, X., Tan, M., Meng, Y. G., Ferrara, N. Characterization and regulation of bv8 in human blood cells. Clin Cancer Res. 15 (8), 2675-2684 (2009).
- Wu, Y. J., et al. In vivo leukocyte labeling with intravenous ferumoxides/protamine sulfate complex and in vitro characterization for cellular magnetic resonance imaging. Am J Physiol Cell Physiol. 293 (5), C1698-C1708 (2007).
- Saffarzadeh, M., et al. Neutrophil extracellular traps directly induce epithelial and endothelial cell death: a predominant role of histones. PLoS One. 7 (2), e32366 (2012).
- Fuchs, T. A., et al. Novel cell death program leads to neutrophil extracellular traps. J Cell Biol. 176 (2), 231-241 (2007).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados