Zyklische Voltammetrie (CV)
Überblick
Quelle: Labor Dr. Kayla grün – Texas Christian University
Eine zyklischer Voltammetrie (CV) Experiment beinhaltet den Scan von einer Reihe von möglichen Spannungen während der Messung aktuelle. Das CV-Experiment wird das Potenzial einer eingetaucht, stationären Elektrode aus einem vorgegebenen Anfang Potential bis zu einem Endwert untersucht (genannt die Umschaltung potenzielle) und dann ergibt sich die reverse-Scan. Dadurch einen "zyklischen" Sweep von Potentialen und die aktuelle vs. potenzielle Kurve abgeleitet aus den Daten wird eine zyklische Voltammogram genannt. Der erste Schwung heißt "vorwärts-Scan" und die Rückkehr Welle nennt man "reverse-Scan". Die möglichen extremen sind das "Scanfenster" bezeichnet. Das Ausmaß der Reduktion und Oxidation Strömungen und die Form der Voltammograms sind stark abhängig von der Konzentration des Analyten, Abtastraten und experimentellen Bedingungen. Durch diese Faktoren variieren, kann zyklische Voltammetrie Informationen über die Stabilität von Übergangsmetall Oxidationsstufe in komplexierter Form, Reversibilität der Elektronen Transferreaktionen und Informationen bezüglich Reaktivität ergeben. Dieses Video erklärt das Basis-Setup für eine zyklische Voltammetrie Experiment einschließlich Analyten Vorbereitung und Einrichtung der elektrochemischen Zelle. Eine einfache zyklische Voltammetrie Experiment werden vorgestellt.
Grundsätze
In eine Experiment zyklischer Voltammetrie das Potential zwischen der Referenzelektrode und Arbeitselektrode erhöht sich linear mit der Zeit (Scan-Rate (V/s)). Begleitend wird der Strom gemessen, zwischen Arbeits- und Zähler (oder AUX) Elektrode was zu Daten, die als Strom (i) geplottet werden vs. Potenzial (E). Reduktion und Oxidation Ereignisse beobachtet und in den daraus resultierenden Parzellen zugewiesen. Reduzierung der Ereignisse bei Analyt spezifischen möglichen Spannungen wo die Reaktion M+ n + e– → M+ n-1 (M = Metall) ist energetisch begünstigt (bekannt als Reduktionspotenzial) und durch eine Erhöhung der aktuellen Werte gemessen. Der Strom wird mit zunehmender Spannung Potenzial erreicht das Potential zur Reduzierung des Analyten, aber dann fällt ab, da der Höchstsatz der Stoffaustausch erreicht wurde. Der Strom sinkt nur auf um Gleichgewicht bei einem stetigen Wert zu erreichen. Oxidationsreaktionen (M+ n → M+ n + 1 + e–) lässt sich auch beobachten als eine Abnahme der Stromwerte an Potenziale, die den Verlust der seine energetisch zu begünstigen.
Die sich daraus ergebenden Voltammograms werden dann analysiert und das Potential (Ep) und aktuelle (Ichp) Daten für Reduktion und Oxidation Veranstaltungen unter jedem Setup Versuchsbedingungen festgestellt. Diese Informationen kann genutzt werden, um die Reversibilität der gekoppelten Reduktion und Oxidation Veranstaltungen zu bewerten. Wie bereits erwähnt Spitze Potentiale (EPa und Epc) und die Spitzenströme (ichpc und ichPa) sind die grundlegenden Parameter verwendet, um eine Redox-paar oder ein Ereignis zu charakterisieren. Während eine reversible Redox-Prozess sind die oxidierten und reduzierten Formen einer Verbindung an der Elektrodenoberfläche im Gleichgewicht. Die Nernst-Gleichung beschreibt die Beziehung zwischen Potential und das Gleichgewicht-Verhältnis ([R] / [O])X = 0.
 (1)
(1)
Wo 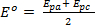 nennt man das formale Potenzial der Reaktion und die Tätigkeit Koeffizienten und andere experimentelle Faktoren berücksichtigt.
nennt man das formale Potenzial der Reaktion und die Tätigkeit Koeffizienten und andere experimentelle Faktoren berücksichtigt.
Insbesondere ist der Spitzenstrom von eine reversible Reaktion gegeben durch:
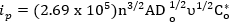 (2)
(2)
wo ichp ist Peak Strom in Ampere, n ist die Anzahl der beteiligten Elektronen, A ist die Fläche der Elektrode in cm2, Do ist die Diffusion-Konstante (cm2/s), V ist die Abtastrate (V/s) und Co* ist die größte Konzentration (Mol/cm3). Die konstante Diffusion mit umfangreicher Experimente ausführlich an anderer Stelle gemessen werden und stehen nicht im Mittelpunkt dieses video1. Jedoch können mehr grundlegende Richtlinien für die Bewertung der Reversibilität von System1verwendet werden. Kriterien für eine völlig reversibel System1:
 bei verschiedenen Scan Rate n = Anzahl der Elektronen
bei verschiedenen Scan Rate n = Anzahl der Elektronen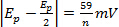 bei verschiedenen scan-Preise
bei verschiedenen scan-Preise- | ichPa/ichpc| = 1 bei verschiedenen scan-Preise
- Ep ist unabhängig von V V = Scan-Rate
- auf Potenziale jenseits Ep ich-2
 t
t
Einfache diagnostische Tests für die Definition einer völlig unumkehrbar System bei 25 ° C sind:
- Keine umgekehrte Spitze (Dies bezieht sich chemische Irreversibilität, aber nicht unbedingt Electron Transfer Irreversibilität)
- Epc verschiebt
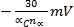 für jedes Jahrzehnt zu erhöhen, in V (elektrochemische Irreversibilität)
für jedes Jahrzehnt zu erhöhen, in V (elektrochemische Irreversibilität) 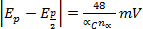
Schließlich sind diagnostische Tests für die Definition einer quasi-reversibel-System:


- Epc verschiebt sich mit zunehmender v negativ
Die Position der Reduktion bzw. Oxidation Ereignisse kann verwendet werden, um Informationen über die elektronische Natur der Übergang Metall komplexe und die Auswirkungen auf die Liganden als Spender abgeleitet. Zum Beispiel die Fe+ 3 / + 2 Reduktionspotenzial von Ferrocen-Derivate ist sehr empfindlich gegenüber der elektronischen Umgebung von eingestellten Cyclopentadienyl (Cp) Liganden zur Verfügung gestellt. Elektron Spenden (zurückziehen) Cp-Substituenten erhöhen (Abnahme) der Elektron-Dichte auf der Eisen-Mitte und das Redoxpotential zu negativen (positiven) Werte im Vergleich zu Fc zu verlagern.
In diesem Protokoll wird Ferrocen als Beispiel verwendet werden. Experimentelle Bedingungen wie z. B. Lösungsmittel, Elektrolyt-Wahl und den Potentialbereich studierte (Scan-Fenster) sind weitgehend von Analyten Löslichkeit und experimentellen Bedingungen diktiert. Benutzer werden ermutigt, die relevanten Texte z. B. Barde und Faulkner1 um mehr zu erfahren.
Verfahren
1. Vorbereitung der Elektrolyt-Lösung
- Bereiten Sie eine Elektrolyt-Stammlösung (10 mL) bestehend aus 0,1 M [Bu4N] [BF4] CH3CN.
- Platzieren Sie der Elektrolyt-Lösung in der elektrochemischen Durchstechflasche zu, fügen Sie eine kleine Stir Bar und setzen Sie die Kappe auf das Fläschchen, wie in Abbildung 1dargestellt.
- Stellen Sie sicher, dass der Stickstoff in die Elektrolytlösung ist. Umrühren und Entgasen der Elektrolyt-Lösung mit einem sanften Strom von N2 Trockengas (~ 10 min), Redox-aktivem molekularen Sauerstoff zu entfernen.
- Während Schritt 1.3 legen Sie die Arbeitselektrode (z.B. glassy Carbon), Zähler (Pt) und Referenzelektroden (Ag/AgNO3) in die Teflon-Zelle-Top. Schließen Sie die Zelle Stand Leitungen an die entsprechenden Elektrode.

Abbildung 1. Einrichtung einer elektrochemischen Zelle.
2. erhalten einen Hintergrund-Scan
- Definieren Sie die experimentellen Bedingungen für das Lösungsmittel. Für Acetonitril, das Scanfenster ist in der Regel +2,000 mV – -2.000 mV.
- Führen und Voltammograms der Elektrolyt-Lösung bei einer Reihe von Abtastraten (z.B. 20 mV/s, 100 mV/s bzw. 300 mV/s) speichern.
- Überprüfen Sie die resultierenden Scan, um sicherzustellen, dass keine Verunreinigungen in die Elektrolytlösung oder verbleibenden Sie Sauerstoff. Ein sauberes System haben keine Redox-Veranstaltungen. Wenn das Setup verunreinigt ist, die Elektroden und Glaswaren müssen gereinigt werden und die Elektrolytlösung remade saubere Bauteile verwenden.
3. Vorbereitung des Analyten Lösung
- Kombinieren Sie den Analyten (~ 2-5 mM, Endkonzentration) von Interesse mit der Elektrolytlösung oben vorbereitet.
- Stellen Sie sicher, dass der Stickstoff in die Elektrolytlösung ist. Umrühren und Entgasen der Analyt/Elektrolyt-Lösung mit einem sanften Strom von N2 Trockengas (~ 10 min), Redox-aktivem molekularen Sauerstoff zu entfernen.
4. zyklische Voltammetrie des Analyten
- Führen Sie mehrere zyklische Voltammogram Experimente mit Scan-Rate von 20 mV – 1.000 mV (abhängig von der Zelle Stand Fähigkeiten). Beginnen Sie jeder Scan mit der berechneten offenen Schaltkreis potenzielle.
- Methodisch variieren die Scan-Richtung [(+ to –) und (– +)] und Scan-Fenster, Redox-Veranstaltungen von Interesse zu isolieren. Die Voltammogram sollten immer von Null Strom (offener Stromkreis) beginnen. Ferrocen (Fc) erfährt eine Oxidationsreaktion zu Ferrocenium (Fc+).
- Viele Gruppen standardisieren Daten des Fc/Fc+ -Redox-Paares. In dieser Übung ~ 2 mg des Fc werden hinzugefügt, um die Lösung des Analyten und Schritt 4.2 wird für die Referenzierung Zwecke wiederholt. Bei der Datenanalyse werden alle Spektren der Fc/Fc+ paar auf 0.00 V gesetzt normalisiert. Eine Tabelle des normalisierten Minderungspotenzials ist vorhanden2.
5. Reinigung der Elektroden und die elektrochemische Zelle
- Sorgfältig muss und jede Elektrode aus der elektrochemischen Zelle zu entfernen.
- Die Bezugselektrode mit Acetonitril spülen und trocknen mit einem Wischtuch. Referenz-Elektrode-Storage-Lösung zu speichern.
- SANFT reinigen die Arbeits- und Ablagefläche Elektrode nach Vorgaben von Herstellern (z.B. BASi: http://www.basinc.com/mans/pguide.pdf), die Redox-Reaktionsprodukte zu entfernen, die bei einigen Experimenten anfallen.
Ergebnisse
Ein CV-Scan von Ferrocen bei 300 mV/s in Acetonitril wurde durchgeführt und die entsprechenden Voltammogram ist in Abbildung 2dargestellt.

Die ΔE kann aus den Daten in Abbildung 2 auf Basis der Differenz zwischen EPa und Epcabgeleitet werden.
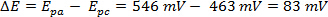
Die zyklischen Voltammograms in Abbildung 3 überlagert darstellen aufeinander folgenden Experimenten auf dem gleichen System an verschiedenen Abtastraten. Wie in oben erwähnt eine lineare Handlung ichp vs. V1/2 (kleines Foto in Abbildung 3) zeigt, dass die Reaktion wird Diffusion gesteuert.
Die Position des E1/2 oder Redox (EPa oder E-pc) kann verwendet werden, um die Auswirkungen zu bestimmen, die Liganden auf die Redox-aktiven Metallzentrum bietet die elektrochemische Reaktion hat. Abbildung 4 zeigt eine Reihe von Ferrocen-basierte Kongenere mit unterschiedlichem Substitutionen auf dem Cp-Ring. Wie in Abbildung 5dargestellt, ergibt sich das Elektron Aberkennung Halogenid in der E-1/2 -Wert dieses Komplexes zu positiveren Potentialen verschoben werden, weil die oxidierte Form durch das Elektron Aberkennung der Liganden destabilisiert wird. Das Elektron Spenden Methylgruppen von zusammengesetzten C Ergebnis in der E-1/2 um zu verschieben um mehr negative Potentiale wie der oxidierten Spezies stabilisiert wird.

Abbildung 2: Ein CV-Scan von Ferrocen bei 150 mV/s in Acetonitril. Klicken Sie bitte hier, um eine größere Version dieser Figur.

Abbildung 3. Eine Kobalt-haltige Verbindung, die Anlass zu einer Verringerung der Veranstaltung. Der Ausschnitt zeigt eine lineare Korrelation zwischen ip und V1/2. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 4. Eine Reihe von Ferrocen-basierte Verbindungen. Bitte klicken Sie hier für eine größere Version dieser Figur.
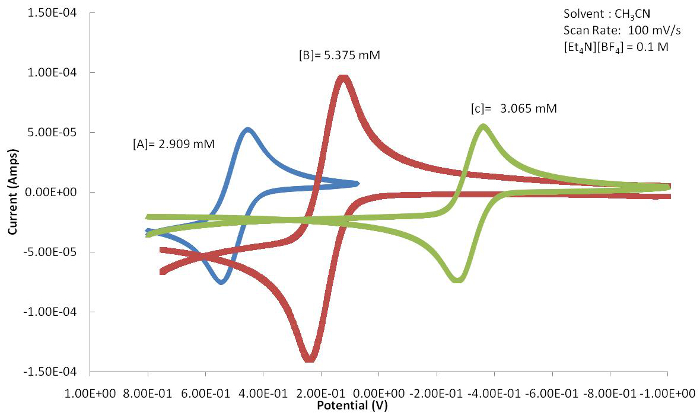
Abbildung 5. Die daraus resultierenden zyklischen Voltammograms A-c (Abbildung 4) zeigen eine deutliche Verlagerung in E1/2 aufgrund der elektronischen Liganden Effekte angeschlossen an das Metallzentrum. Bitte klicken Sie hier für eine größere Version dieser Figur.
Referenzen
- Bard, A. J., Faulkner, L. A. Electrochemical methods: Fundamentals and Applications. 2nd ed. New York: Wiley; 833 p. (2001).
- Geiger, W. E., Connelly, N. G. Chemical Redox Agents for Organometallic Chemistry. Chem Rev. 96 (2), 877-910, (1996).
Tags
pringen zu...
Videos aus dieser Sammlung:

Now Playing
Zyklische Voltammetrie (CV)
Analytical Chemistry
125.0K Ansichten

Probenvorbereitung für die analytische Charakterisierung
Analytical Chemistry
84.6K Ansichten

Interne Standards
Analytical Chemistry
204.7K Ansichten

Standard-Additionsverfahren
Analytical Chemistry
319.9K Ansichten

Kalibrierkurven
Analytical Chemistry
796.3K Ansichten

UV/Vis-Spektroskopie
Analytical Chemistry
623.1K Ansichten

Raman-Spektroskopie für die chemische Analyse
Analytical Chemistry
51.2K Ansichten

Röntgen-Fluoreszenz (XRF)
Analytical Chemistry
25.4K Ansichten

Gaschromatographie (GC) mit Flammen-Ionisations-Detektion
Analytical Chemistry
281.9K Ansichten

Hochleistungs-Flüssigkeitschromatographie (HPLC)
Analytical Chemistry
384.2K Ansichten

Ionenaustausch-Chromatographie
Analytical Chemistry
264.4K Ansichten

Kapillarelektrophorese (CE)
Analytical Chemistry
93.8K Ansichten

Einführung in die Massenspektrometrie
Analytical Chemistry
112.2K Ansichten

Rasterelektronenmikroskopie (SEM)
Analytical Chemistry
87.1K Ansichten

Elektrochemische Messungen von Trägerkatalysatoren mit einem Potentiostat / Galvanostat
Analytical Chemistry
51.4K Ansichten
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten