Ideale Gasgleichung
Überblick
Quelle: Labor von Dr. Andreas Züttel - schweizerischen Eidgenössischen Laboratorien für Werkstoffwissenschaft und Werkstofftechnologie
Das ideale Gasgesetz beschreibt das Verhalten der am häufigsten verwendeten Gase bei in der Nähe-Umgebungsbedingungen und die Tendenz aller chemischen Materie in der verdünnten zu begrenzen. Es ist eine grundlegende Beziehung zwischen drei messbare makroskopischen Systemvariablen (Druck, Temperatur und Volumen) und die Anzahl der Moleküle des Gases in das System und ist somit ein wichtiges Bindeglied zwischen der mikroskopischen und makroskopischen Universen.
Die Geschichte des idealen Gases Gesetzes reicht bis zur Mitte des17. Jahrhunderts als das Verhältnis zwischen Druck und Volumen der Luft gefunden wurde, umgekehrt proportional, ein Ausdruck von Robert Boyle und die wir jetzt als Boyles Gesetz (Gleichung 1) bezeichnen bestätigt .
P  V-1 (Gleichung 1)
V-1 (Gleichung 1)
Unveröffentlichte Arbeit von Jacques Charles in den 1780er Jahren, das wurde erweitert, um zahlreiche Gase und Dämpfe von Joseph Louis Gay-Lussac und berichtet im Jahre 1802, gegründet direkt proportionale Beziehung zwischen der absoluten Temperatur und Volumen eines Gases. Diese Beziehung ist Karls Gesetz (Gleichung 2) genannt.
V  T (Gleichung 2)
T (Gleichung 2)
Guillaume Amontons ist in der Regel mit der ersten Entdeckung der Beziehung zwischen der Temperatur und der Druck der Luft in einem festen Volumen an der Wende des18. Jahrhunderts gutgeschrieben. Dieses Gesetz wurde auch auf zahlreiche andere Gase durch Joseph Louis Gay-Lussac zu Beginn des19. Jahrhunderts erweitert und ist somit entweder als entweder Amontonss oder Gay-Lussac-Gesetz, erklärt wie in Gleichung 3bezeichnet.
P  T (Gleichung 3)
T (Gleichung 3)
Gemeinsam können diese drei Beziehungen kombiniert werden, um die Beziehung in Gleichung 4geben.
V  T (Gleichung 4)
T (Gleichung 4)
Schließlich wurde im Jahr 1811 von Amedeo Avogadro vorgeschlagen, dass keine zwei Gase, gehalten in der gleichen Lautstärke und bei der gleichen Temperatur und Druck, die gleiche Anzahl von Molekülen enthalten. Dies führte zu dem Schluss, dass alle Gase durch eine gemeinsame Konstante, die ideale Gaskonstante R, beschrieben werden können, die unabhängig von der Beschaffenheit des Gases ist. Dies nennt man das ideale Gasgesetz (Gleichung 5). 1,2
PV  T (Gleichung 5)
T (Gleichung 5)
Grundsätze
Das ideale Gasgesetz und damit seine charakteristische konstante R auch eloquent aus ersten Prinzipien Theorie auf vielfältige Weise ableiten wo die wichtigen vereinfachenden Annahmen sind, dass die Moleküle keine inhärente Volumen haben und nicht interagieren. Diese Annahmen gelten in der verdünnten Angelegenheit zu begrenzen, wo das Volumen der leere Raum für jedes Molekül (z. B. ~ 10-23 L bei Umgebungsbedingungen) ist viel größer als das Molekül selbst (~ 10-26 L) und Wechselwirkungen unwahrscheinlich sind. Es kann daher leicht in eine Reihe von Möglichkeiten, mit gemeinsamen Laborgeräte bei Raumtemperatur nachgewiesen werden, und kann mit einer Vielzahl von Gasen bei Drücken bis zu sogar 10 genau gemessen werden (Abbildung 1). Allerdings kann nicht das ideale Gasgesetz genau ausmachen, für die Eigenschaften der Dichter Gase bei in der Nähe-Umgebungsbedingungen (z.B. Propan) oder für die Kondensation, Phänomene, die durch intermolekulare Wechselwirkungen entstehen. Aus diesem Grund gelungen, zahlreiche detaillierte Zustandsgleichungen das ideale Gasgesetz in den Jahren seit seiner Entdeckung, in der Regel auf das ideale Gasgesetz in der verdünnten Angelegenheit zu begrenzen zu reduzieren. 1,2

Abbildung 1. Vergleich der idealen Gases Recht Dichte zu verschiedenen anderen gemeinsamen Gasen bei 25 ° C und zwischen 0-100 Bar.
In diesem Tutorial, messen wir sorgfältig die Dichte von Wasserstoffgas bei erhöhten Drücken und Temperaturen in einem festen Volumen durch wiegen einer schwebenden festen Probe von bekanntem Volumen: eine präzise gefräste Aluminium-Block. Die Änderung im Gewicht der Probe bezieht sich direkt auf die Änderung in Flüssigkeitsdichte, in der er schwebt, von Archimedes Prinzip. Wir zeigen auch die Mängel der Verwendung einer weniger idealen Gases (z.B. Kohlendioxid) bei hohen drücken. Zu guter Letzt wir visuell demonstrieren und qualitativ bestätigen das ideale Gasgesetz durch Ausführen einer einfachen Benchtop-Experiments wo wird die Änderung im Volumen des Systems durch Wasserstoff-Freisetzung durch eine Wasserstoff-Speichermaterial gemessen. Unter Verwendung einer dieser Experimente, können wir die Naturkonstante bestimmen, die die Beziehung zwischen Druck, Temperatur und Volumen für eine gegebene Menge von Gas – die ideale Gaskonstante R. beschreibt
Verfahren
1. Messung des Volumens der Probe
- Die Probe sorgfältig reinigen und trocknen.
- Füllen Sie eine hochauflösende Messzylinder mit genug destilliertes Wasser auf die Probe zu decken. Beachten Sie die Ausgangsmenge
- Ziehen Sie das Sample in das Wasser, und beachten Sie die Volumenänderung. Dies ist das Volumen der Probe, V.
- Entfernen Sie die Probe und trocknen. Hinweis: Alternativ Seite Länge(n) der Probe gemessen und sein Volumen mit Geometrie zu berechnen.
2. Legen Sie die Probe in der Schwebe
- Hängen Sie die Probe in der Schwebe magnetischer Aufhängung.
- Die Druck/Temperatur-Kammer um die Probe zu installieren.
- Evakuieren Sie die Probenumgebung zu und füllen Sie mit Wasserstoffgas, bis 1 Bar.
- Messen Sie das Gewicht der Probe auf 1 Bar und Raumtemperatur, w00.
(3) Maßnahme Probengewicht als Funktion des Drucks bei Raumtemperatur
- Erhöhen Sie oder verringern Sie den Druck in der Probenumgebung um Pi0.
- Die Probenumgebung zu equilibrate zu ermöglichen.
- Messen Sie das Gewicht der Probe, wi0.
- 3.1-3.3 mehrmals zu wiederholen.
4. Messen Sie Probengewicht als Funktion des Drucks bei verschiedenen Temperaturen
- Stellen Sie die Temperatur Tj und lassen Sie ihn equilibrate.
- Stellen Sie den Druck des Wasserstoffgases bis 1 Bar.
- Messen Sie das Gewicht der Probe auf 1 Bar und Tj, w0j.
- Erhöhen Sie oder verringern Sie den Druck auf PIj und lassen Sie ihn equilibrate.
- Messen Sie das Gewicht der Probe, wIj.
- 4,4-4,5 mehrmals zu wiederholen.
- Wiederholen Sie 4.1-4.6 wie gewünscht.
5. berechnen Sie die ideale Gaskonstante
- Tabellieren Sie die gemessenen Werte {Tj, PIjund wIj} wo P0j ist immer 1 Bar und T0 ist die gemessene Raumtemperatur.
- Berechnen Sie und Tabellieren Sie die Unterschiede ΔwIj und ΔPIj bei jeder Temperatur Tj mit Gleichung 6 und 7 der Gleichung.
ΔwIj = wIj - w0j (Gleichung 6)
ΔwIj = PIj - P0j = PIj - 1 bar (Gleichung 7) - Berechnen Sie RIj für jede Messung und Durchschnitt aller Werte zu bestimmen, die ideale Gaskonstante, R. Alternativ zeichnen das Produkt aus ΔPIj und V als Funktion des Produkts ΔwIj (dividiert durch das Molekulargewicht MW) und T-j, und führen Sie eine lineare Regression-Analyse zur Ermittlung der Steigung, R. (Gleichungen 8 und 9) für Wasserstoff , MW = 2.016 g/Mol.
ΔP V = Δn RT (Gleichung 8)
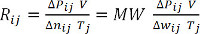 (Gleichung 9)
(Gleichung 9)
Ergebnisse
Das ideale Gasgesetz ist eine gültige Beschreibung der tatsächlichen Gas Eigenschaften der zahlreichen gemeinsamen Gase zu Konditionen in der Nähe von ambient (Abbildung 1 Einschub) und eignet sich daher im Zusammenhang mit vielen Anwendungen. Die Grenzen des idealen Gases Gesetzes beschreibt Systeme unter den Bedingungen der hohen Drücke oder niedrigen Temperaturen lässt sich durch die zunehmende Bedeutung der molekularen Wechselwirkungen und/oder die endliche Größe der Gasmoleküle, die einen Beitrag zu den Systemeigenschaften. Daher werden Gase mit starken, attraktiven intermolekularen Wechselwirkungen (aufgrund von Dipol-Dipol-Wechselwirkungen, einschließlich Wasserstoff-Bindung, Ion-Dipol-Wechselwirkungen oder van der Waals Wechselwirkungen) höhere dichten als ideales Gas aufweisen. Alle Gase haben auch eine abstoßende Komponente bei hohen dichten, da mehr als ein Molekül kann nicht am ursprünglichen Speicherort, Kreditvergabe eine Abnahme der Dichte über den idealen Gases zu besetzen. Gase wie Wasserstoff und Helium mehr maßgeblich von den abstoßend zeigen aufgrund der endlichen Molekülgröße erzwingen, und haben daher etwas niedriger Dichte bei hohen drücken. Methan und Kohlendioxid weitaus größere Beiträge anzeigen, deren Eigenschaften von attraktiven Interaktionen, verleihen ihnen höhere dichten als ideales Gas bis sehr hohe Drücke, wo der abstoßende Begriff dominiert (bei sehr viel höher als 100 Bar bei 25 ° C).

Abbildung 2. Gleichgewicht Adsorption Aufnahme Isotherme CO2 auf hohe Fläche, superactivated Kohlenstoff MSC-30, bei 25 ° C.
Anwendung und Zusammenfassung
Das ideale Gasgesetz ist solch eine Fundamentalgleichung der chemischen Wissenschaften, dass es eine Fülle von Anwendungen sowohl in Berechnungen als auch im täglichen Labortätigkeiten und Modellierung selbst hochkomplexe Systeme, zumindest in erster Näherung. Ihre Anwendbarkeit ist nur durch die inhärente Annäherungen an das Gesetz selbst beschränkt; in der Nähe von ambient Drücke und Temperaturen, wo das ideale Gasgesetz gut für viele gemeinsame Gase gilt, ist es weit verbreitet in der Interpretation von Gas-basierten Systemen und Prozessen eingesetzt. Zwei Beispiele für Geräte, die auf Prinzipien, die versöhnt werden können durch das ideale Gasgesetz nutzen, sind die Gas-Thermometer und der Stirlingmotor.
Eine bestimmte Anwendung ist bei der Messung der Menge an Gas Adsorption (Physisorption) auf der Oberfläche eines festen Materials. Adsorption ist das physikalische Phänomen, wobei Gasmoleküle die Gasphase zu verlassen und betreten Sie eine verdichtete Phase nahe der Oberfläche von festem Untergrund (oder vielleicht eine Flüssigkeit) aufgrund der attraktiven intermolekularen Wechselwirkungen (Zerstreuung Kräfte) zwischen der festen und das Gas. Die Rolle der Adsorption kann für viele lose Materialien (wie z.B. Glas und Edelstahl) Stahl bei Umgebungsbedingungen vernachlässigt werden, sondern wird sehr wichtig für poröse Materialien mit einer großen zugängliche Fläche, besonders bei niedrigen Temperaturen. 3 die volumetrische Sieverts Methode und die gravimetrische Methode zur Quantifizierung der physikalischen Adsorption Vertrauen auf wissen die Zustandsgleichung des Gases in das System. Bei niedrigem Druck und Umgebungstemperatur das ideale Gasgesetz gilt für viele Gase, und kann verwendet werden, um genau die adsorbierten Menge des Gases in ähnlicher Weise zu bestimmen, wie im Protokoll zur Ermittlung R oben beschrieben. Beispielsweise kann bei gravimetrischen Messungen dem Auftriebskörper aus einem hoch-Oberfläche-sorbent unter Bedingungen, wo die idealen Gases Gesetz tatsächlich gültig ist, die Differenz zwischen dertatsächlichen Δw gemessen, und Δwideale berechnet unter Verwendung der ideale Zustandsgleichung die Änderung im Gewicht der adsorbierten Phase zugeschrieben werden. (Gleichung 10) Gas Adsorption isothermen Gleichgewicht können somit durch Tabellieren dieser Abweichungen, ΔwAnzeigen, als Funktion des Drucks bei einer festen Temperatur gemessen werden (siehe Abbildung 2), ein Standardverfahren in der Charakterisierung von porösen Materialien.
ΔwAnzeigen = Δwtatsächliche - Δwideal (Gleichung 10)
pringen zu...
Videos aus dieser Sammlung:

Now Playing
Ideale Gasgleichung
General Chemistry
79.5K Ansichten

Labor-Glaswaren und deren Verwendung
General Chemistry
659.5K Ansichten

Lösungen und Konzentrationen
General Chemistry
275.6K Ansichten

Bestimmung der Dichte von Fest- und Flüssigstoffen
General Chemistry
557.1K Ansichten

Bestimmung der prozentualen Massenanteile in einer wässrigen Lösung
General Chemistry
383.9K Ansichten

Ermittlung der Summenformel
General Chemistry
183.9K Ansichten

Bestimmung der Löslichkeit von ionischen Verbindungen
General Chemistry
141.6K Ansichten

Verwendung eines pH-Meters
General Chemistry
347.0K Ansichten

Einführung in die Titration
General Chemistry
425.8K Ansichten

Spektrophotometrische Bestimmung der Gleichgewichtskonstante
General Chemistry
158.9K Ansichten

Das Prinzip von Le Chatelier
General Chemistry
265.9K Ansichten

Gefrierpunktserniedrigung zur Bestimmung einer unbekannten Substanz
General Chemistry
160.9K Ansichten

Bestimmung der Ratengleichung und der Reaktionsreihenfolge
General Chemistry
196.5K Ansichten

Verwendung der dynamischen Differenzkalorimetrie zur Messung von Enthalpieänderungen
General Chemistry
44.8K Ansichten

Komplexchemie
General Chemistry
91.8K Ansichten
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten