Lösungen und Konzentrationen
Überblick
Quelle: Labor von Dr. Michael Evans, Georgia Institute of Technology
Eine Lösung ist eine homogene Mischung, einige Komponenten in kleinen Mengen, genannt Solute und eine Komponente in einer großen Menge, genannt das Lösungsmittel enthält. Fest-flüssig-Lösungen enthalten eine oder mehrere feste gelöste Stoffe in einem flüssigen Lösungsmittel aufgelöst. Lösungen sind allgegenwärtig in der Chemie: sie dienen zum Speichern und verarbeiten kleine Mengen von Material, chemische Reaktionen durchführen und Materialien mit kontrollierbaren Eigenschaften zu entwickeln.
Die Dichte eines gelösten Stoffes in einer Lösung ist bekannt als die Konzentration des gelösten Stoffes. Konzentration kann auf verschiedene Arten unterscheiden sich in den Einheiten verwendet, um die Mengen an gelösten, Lösungsmittel und Lösung vermitteln ausgedrückt werden.
In dieser Demo wird veranschaulicht, wie eine Zuckerlösung mit einer Zielkonzentration mit präzisen analytischen Techniken vorzubereiten. Darüber hinaus sind verschiedene Maßnahmen der Konzentration dieser Lösung vorgestellt und erläutert.
Grundsätze
Wenn im Wasser eingetaucht, zerfallen viele Feststoffe in Teilchen (Moleküle oder Ionen) von Wassermolekülen umgeben. Dieser Prozess der Auflösung konvertiert eine heterogene Mischung aus festen und flüssigen in einer einzigen homogenen Mischung bestehend aus flüssigem Wasser und gelöste Partikel aufgelöst. Der Auflösungsprozess für Saccharose kann als eine chemische Gleichung mit festen und wässrigen Phase Bezeichnungen geschrieben werden. Nach einer Spezies (Aq)-Bezeichner impliziert, dass Wasser, den Molekülen umgeben sind und Oberflächenladungen dieser Tierart.

Unterschiedliche Lösungen enthalten unterschiedliche Anzahl der gelösten Teilchen, und Konzentration ist eine Maßnahme, die die Dichte der gelösten Teilchen in einer Lösung quantifiziert. Eine grundlegende Maßnahme der Konzentration ist der Maulwurf-Anteil (X) des gelösten Stoffes: die Anzahl der Mole von gelösten Teilchen (ngelösten) geteilt durch die Gesamtzahl der Maulwürfe von Lösungskomponenten (alle gelösten Stoffen und Lösungsmittel).

Multiplikation dem Maulwurf Bruch mit 106 gibt die Teile pro million (ppm) Konzentration, die Anzahl der gelösten Teilchen pro Millionen Teilchen der Lösung. Die Anzahl der Mole des gelösten Stoffes pro Liter Lösung oder Molarity (M), ist eine zweite gemeinsame Maßnahme der Konzentration.
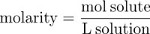
Konzentration kann auch ausgedrückt werden, als Teile von Masse, der Anteil der Lösung durch die gelösten Masse.
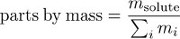
Die Teile von Massenkonzentration mit 100 % multipliziert gibt die Masse Prozent.
Zu guter Letzt ist Einheitensymbol ein Maß für die Konzentration, die die Masse des Lösungsmittels und nicht das Volumen der Lösung, als Maß für die "Größe" der Lösung verwendet. Einheitensymbol ist das Verhältnis der Zahl der Molen des gelösten Stoffes auf die Masse des Lösungsmittels in Kilogramm.
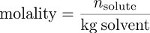
Präzise und genaue Vorbereitung einer Lösung mit einem Ziel Molarity erfordert sorgfältige analytische Technik. Die festere gelösten muss sorgfältig abgewogen und quantitativ übertragen (vollständig) zu einem volumetrischen Kolben. Das Lösungsmittel kann dann vorsichtig hinzugefügt werden, bis die Lösung die Markierung auf das Glas erreicht. Um beste Ergebnisse zu erzielen der gelöste Stoff darf vollständig in weniger als das Gesamtvolumen der Lösungsmittel auflösen und verbleibende Lösungsmittel sollte hinzugefügt werden, wenn keine festen gelösten sichtbar ist.
Verfahren
1. Vorbereitung von 100 mL einer 0,0100 M Saccharose-Lösung
- Bestimmen Sie die Anzahl der Muttermale und Masse von Saccharose (C12H22O11) in 100 mL Lösung aufgelöst werden.
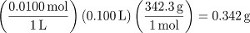
- Die Masse von Saccharose auf der Waage abwiegen. Zuerst legen ein wiegen-Boot auf die Waage und legen Sie das "Leergewicht". Dann mit einem Scoopula sorgfältig transfer festen gelösten Stoffes aus der Reagenzienflasche zum Wiegen Boot bis die gewünschte Menge erreicht ist.
- Setzen Sie einen Pulver Trichter in einem sauberen und trockenen 100 mL volumetrischen Kolben. Gießen Sie der Feststoff aus dem Wiegen-Boot durch den Trichter in die Flasche.
- Mit Hilfe einer Waschflasche mit destilliertem Wasser (Lösungsmittel), spülen Sie alle verbleibenden festen vom wiegen Boot durch den Trichter in die Flasche.
- Fügen Sie Lösungsmittel mit destilliertem Wasser Wasserhahn, bis der Füllstand den Hals des Kolbens (aber nicht die Marke erreicht). Kappe und wirbeln den Kolben vorsichtig, um die gelösten auflösen.
- Sobald alle des gelösten Stoffes hat sich aufgelöst, verwenden einer Waschflasche sorgfältig Lösungsmittel hinzugefügt, bis der Flüssigkeitsstand die Marke erreicht.
- Kappe und invertieren des volumetrischen Kolbens mehrmals um gute Durchmischung der Lösung zu gewährleisten.
2. Herstellung einer übersättigten Zuckerlösung
- Ein 600-mL-Becherglas 100 mL destilliertem Wasser hinzufügen.
- Den Becher 220 g Saccharose hinzufügen.
- Legen Sie eine magnetische Stir Bar in den Becher geben und lassen Sie die Mischung für 15 min gerührt.
- Untersuchen Sie die Mischung: nicht alle Saccharose hat sich aufgelöst. Erhitzen Sie die Mischung 50 º c und rühren für eine zusätzliche 10 Minuten.
- Untersuchen Sie die Mischung: alle Saccharose bei 50 º c aufgelöst hat.
- Lassen Sie die Lösung auf Raumtemperatur abkühlen. Prüfen Sie die Lösung: die zusätzliche Saccharose, die bei 50 º c gelöst bleibt bei Zimmertemperatur aufgelöst. Die Lösung bei Raumtemperatur ist übersättigt.
Ergebnisse
Schritt 1 schafft 100 mL einer 0,0100 M Saccharose-Lösung. Bestimmen Sie in Maßnahmen der Konzentration als Molarity konvertieren möchten die Masse des Wassers benutzt, um die Lösung vorzubereiten. Obwohl dies genau gemessen werden kann, in Ermangelung einer Messung ist davon auszugehen, dass das Volumen der gelösten gelöste Teilchen vernachlässigbar ist (d. h. das Volumen des Wassers verwendet wurde 100 mL). Mit der Dichte des Wassers...

Das Einheitensymbol von Saccharose in dieser Lösung ist also:
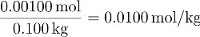
Die Teile von Masse von Saccharose ist gleich:
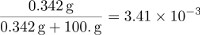
Der Maulwurf-Anteil der Saccharose kann durch Bestimmung der Anzahl der Maulwürfe in 100 g Wasser und geteilt durch die Gesamtmenge der Partikel in der Lösung von Saccharose berechnet werden.

Schritt 2 zeigt, dass die Löslichkeit von Saccharose in Wasser temperaturabhängig ist. Bei Erhitzung löst unaufgelöste Saccharose ruht in einer gesättigten Lösung, Bildung einer gesättigten Lösung der höheren Konzentration bei höheren Temperaturen. Kühlt diese Lösung wird Saccharose nicht aus der Lösung ausgefällt. Die resultierende gekühlte Lösung ist übersättigt mit Saccharose. Sogar eine kleine Menge zusätzliche Saccharose Pulver in dieser Lösung hinzufügen kann schnelle Rekristallisation gelöste Saccharose auslösen.
Anwendung und Zusammenfassung
Fest-flüssig-Lösungen sind allgegenwärtig in der Chemie. Die meisten chemische Reaktionen laufen in Lösung weil aufgelöst, dass gelöste Stoffe sind mobil genug, um schnell zu mischen und aufeinander stoßen. Lösungen können auch verwendet werden, um kleine Mengen von gelösten Stoffen in makroskopischen und leicht zu handhaben-Bänden zu speichern. Lösungen zeigen einige interessanteren physikalischen Eigenschaften namens colligative Eigenschaften, die die entropische Wirkung der Auflösung eines gelösten Stoffes in einem Lösungsmittel zugeschrieben werden kann.
Man kann sich Fragen, warum gibt es so viele verschiedene Maßnahmen der Lösungskonzentration. Die Antwort liegt in den vielen Anwendungen, Lösungen und die viele Größenordnungen über die Konzentrationen erstrecken. In Proben von Wasser aus der Umgebung, z. B. Konzentrationen an Metallionen kann im Bereich von wenigen Teilen pro million — es ist unpraktisch und möglicherweise irreführend, dieses winzige Konzentration als Bruchzahl Molarity oder Maulwurf auszudrücken. Obgleich Molarity Konzentration für Stöchiometrie Berechnungen mit chemischen Reaktionen praktisch gemessen wird, ist Einheitensymbol in Studien bestimmter colligative Eigenschaften besser geeignet.
Perfektionierung der Technik der Vorbereitung der Lösung ist wichtig, weil in vielen Kontexten, genaue Kenntnis der Konzentration unerlässlich ist. Wenn eine chemische Reaktion ausgeführt, z. B. führen Verwendung von zu viel oder zu wenig gelösten verschwendet Edukte oder niedrigen Produktausbeuten. Studium der empirischen Beziehungen mit Konzentration, z. B. Biergesetzes, hängen genau bekannten Konzentrationen. Oftmals führt Ungenauigkeit in Lösungskonzentrationen direkt zu Unsicherheit in den berechneten Werten, z. B. Reaktionsenthalpien. Obwohl es unmöglich ist, vollständig Ungenauigkeit zu beseitigen, sorgt für die analytische Techniken für die Herstellung der Lösung, dass Unsicherheit minimiert wird.
pringen zu...
Videos aus dieser Sammlung:

Now Playing
Lösungen und Konzentrationen
General Chemistry
275.7K Ansichten

Labor-Glaswaren und deren Verwendung
General Chemistry
659.6K Ansichten

Bestimmung der Dichte von Fest- und Flüssigstoffen
General Chemistry
557.2K Ansichten

Bestimmung der prozentualen Massenanteile in einer wässrigen Lösung
General Chemistry
384.0K Ansichten

Ermittlung der Summenformel
General Chemistry
183.9K Ansichten

Bestimmung der Löslichkeit von ionischen Verbindungen
General Chemistry
141.6K Ansichten

Verwendung eines pH-Meters
General Chemistry
347.1K Ansichten

Einführung in die Titration
General Chemistry
425.8K Ansichten

Ideale Gasgleichung
General Chemistry
79.5K Ansichten

Spektrophotometrische Bestimmung der Gleichgewichtskonstante
General Chemistry
158.9K Ansichten

Das Prinzip von Le Chatelier
General Chemistry
266.0K Ansichten

Gefrierpunktserniedrigung zur Bestimmung einer unbekannten Substanz
General Chemistry
161.0K Ansichten

Bestimmung der Ratengleichung und der Reaktionsreihenfolge
General Chemistry
196.5K Ansichten

Verwendung der dynamischen Differenzkalorimetrie zur Messung von Enthalpieänderungen
General Chemistry
44.8K Ansichten

Komplexchemie
General Chemistry
91.8K Ansichten
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten