Method Article
揭开看不见的玩家在海洋 - 一个领域指南水化学和海洋微生物
摘要
Here, we present a comprehensive protocol to assess the organic and inorganic nutrient availability and the abundance and structure of microbial and viral communities in remote marine environments.
摘要
在这里,我们介绍了一系列全面测试,以及标准化的适合在偏远的海洋环境中使用的研究方案。采样协议包括资源的评估提供给微生物群落(溶解的有机碳,颗粒有机物质,无机营养物),以及病毒和细菌群落的全面描述(通过直接的病毒和微生物计数,自身荧光微生物的计数,并施工病毒和微生物宏基因组)。我们使用的方法,其代表包括已经建立的方案和一些发达的最新技术,科学学科的分散字段的组合。用于病毒和细菌群落表征尤其宏基因组测序技术,已经建立了只在最近几年,并且因此仍受到不断改进。这已经导致了各种取样和样品处理过程货币兑换。TLY使用。该组的方法这里介绍提供一个最新的方法来收集并处理环境样品。这些协议涉及的参数产生的信息的最低限度的基本表征和理解病毒和微生物群落动态的基本机制。它提供了易于遵循的准则进行全面的调查和讨论的关键步骤和潜在的注意事项相关的各个技术。
引言
海洋生态系统受到了广泛的导致从养分供应到顶级食肉动物的生物量变化扰动。在过去的十年中,多项研究已经证明了微生物群落的海洋生态系统1-4的重要性。显而易见的是,改变在细菌和病毒群落都与海洋环境5的总体降解有关。这些变化可通过在水体中改变的地球化学可以促进诸如氧气供应或碳再矿化6,7。作为大生物,水化学和微生物活性的反馈回路之间的相互依赖性的结果,可能会加速生态系统退化8的速度。
在20世纪70年代和80年代多次尝试作了解开生物地球化学循环的海洋生态系统9-11。其中这些早期研究的主要挑战是缺乏标准化的方法来测量评估生物地球化学参数。虽然有可用的协议,主要是海水营养盐12,13,碳动态的评估和微生物群落结构受可用的工具和方法进行了限制。与JGOFS EqPac方法相比,夏普等人 14表明第一次的可靠和标准化协议,用于溶解的有机碳(DOC)的浓度评估。到了21世纪初的分析挑战,确定了由此得到很大程度的解决提供给微生物群落的资源和方法已经建立了控制养殖环境微生物群落的特征(见德隆15)。传统的测序方法,当时主要是依靠耕地克隆培养。然而,天然样本的早期环境基因测序发现,大多数微生物的生物多样性已经错过了cultivATION为基础的方法16。在2002年,布赖特巴特等人 17使用鸟枪法测序,首次描述了病毒社区环境海水样品建立的方法进行测序未培养海洋的病毒群体的整个基因组中。
在现有微生物的评估,病毒仍然特别是在深入研究的,因为大多数都难以培养,缺乏普遍保守的标记,如16S核糖体RNA(rRNA)的基因通常用于评估的多样性和社会分析。宏基因组测序方法提供了一种替代的文化依赖性和基因靶向方法分析复杂的病毒性社区。而从海水中产生的第一病毒宏基因组采用Sanger测序17进行测序,下一代测序技术和改进的分子生物学技术的发展导致了在宏基因组研究18快速增加。当前的实验室工作流程病毒宏基因组学涉及分离,富集和/或浓度的病毒颗粒中,接着核酸(DNA或RNA)提取,文库制备和测序19-21。
为了进一步对病毒,微生物和生化功能的水生生态系统的现有知识,在各种系统中的比较数据集周围的世界是必不可少的。然而,建立协议已经很大程度上被用于近岸环境与发展容易获得实验设施。因此,缺乏规范场方法阻碍这些跨生态系统的比较。这里我们主要介绍全面测试,以及从标准化的艺术研究的协议状态为适应偏远外地地点使用。这些方法已被证明是成功的在多个研究跨越过去十年5,22和目前使用的各种海洋实验室以及对诺阿珊瑚礁评估和监测计划(RAMP)在整个太平洋4。采样协议包括水化学参数(无机和有机碳含量,无机营养浓度),病毒和微生物丰(直销细菌数,直接的病毒数量,和流式细胞术,以评估自养VS异养比率),以及病毒和微生物群落结构和通过宏基因组分析的代谢潜力(对于综述参见图1)。从此处描述的方法所获得的结果是必需的,以便阐明需要全面表征水生生态系统关键生物地球化学背景参数。
研究方案
1.准备仪器
- 过滤设置的制备
- 制备5%的盐酸(HCl)溶液(0.5-0.6米;添加250毫升32-36%的HCl,以4.75升蒸馏水中,以使5升的最终溶液)。存储该溶液中的高密度聚乙烯容器(HDPE)长达2周。
- 留在将要与样品(除了过滤器)接触的所有部件放置24小时,在5%的HCl溶液水蛭出潜在溶解的有机碳(DOC)的污染物。每个采样活动结束后冲洗所有部件和冲洗线约30ml 5%HCl溶液,以防止碳污染( 例如 ,从油烟气,石油,船舶,蚊虫喷雾)。
- 保持包裹在预燃烧铝箔或封端,直至到使用前的所有采样的项目。
- Precombust25毫米GF /铝箔包裹在马弗炉中在550℃下进行12小时˚F滤波器以挥发掉所有的碳,并将它们存储在一个干净,干燥的放置直至使用。用酸洗涤镊子和无菌,无粉手套处理precombusted过滤器在任何时候。
- 病毒宏基因组取样材料的制备
- 彻底清洗4 20升可折叠低密度聚乙烯细口大玻璃瓶和四个20升的高密度聚乙烯桶和盖子,用10%的漂白剂。
- 随后冲洗所有项目的3倍,用蒸馏水,然后水样,并重新密封,这些瓶子用插口。
- 洗切向流过滤(TFF)每次使用后,根据以下方案,清洁抢先如果过滤器尚未在过去的5天使用的。
- 溶解50克NaOH颗粒在5升的水在洗涤桶中。
- 附加一个湿的TFF到该管道和组装按照图3。
- 运行蠕动泵以约30转每分钟与无背压,通过该系统,以将部分的NaOH洗涤溶液。洗净后从回油管流向,将转移到洗桶完成的溶液的循环。
- 通过将夹具上的TFF下游的返回管线施加背压的系统。这将迫使洗涤溶液中出来的滤液线。过多的时间(5分钟)至淹没TFF的外侧,并产生滤液指示降级的TFF。
- 运行该系统,直到所有的NaOH溶液中的行。然后取出背压运行的解决方案从系统中并丢弃。
- 由下背压流水直到从回液和滤液线流动的水的pH为7-8冲洗TFF。
- 从蠕动泵和TFF除去管材。 TFF重新密封储存。确保该TFF保持湿润,直到下一次使用。
2.样品采集
注:在运输过程中的所有收集的样品应存放阴凉(如果可能的话4℃)和不暴露于直射阳光,直到进一步处理。
- 采样碳,养分,显微镜,流式细胞仪和微生物宏基因组学
- 以每个采样的事件(导致4升的水样)2哈塔伊Niskin单位。刚刚淹没(否则受困的空气会阻止降序)之前打开取样容器。
- 在各部位,通过打开的两端,并通过水运动沿着极轴的气缸冲洗水与试样取样器的内部。
- 采取样本,并仔细地关闭取样容器。确保抽样点的上游从船和潜水员以避免污染。
- 抽样病毒宏基因组学
- 在目标站点安装在20升大玻璃瓶舱底泵。
- 填写坛瞄准舱底泵的入口在每个目标区域和密封的瓶子与相应的插口。
- 收集4大玻璃瓶未经过滤的海水(一起80 L),每个采样点。
3.桑普文件准备
注:处理样本此处呈现的顺序,首先从DOC,以减少污染的机会。使用无粉手套整个过程。
- 溶解有机碳(DOC)
- 山两等份哈塔伊Niskin单位在过滤集合各自的插槽之一。连接出口管从而导致相应的过滤器保持器。连接的加压空气(0.2巴)管连接到哈塔伊Niskin单元(参见图2)。
- 在过滤器支架插入过滤器之前,冲洗用100毫升水样中的所有行。使用酸洗钳将25毫米预燃烧GF / F滤膜过滤的过滤器支架。冲洗每个DOC的瓶和盖3次,用约20ml过滤采样水。
- 填写采样水约40ml(〜2月3日已满)一瓶。聚集在DOC样本至少重复拥有的情况下潜在的污染或损失的备份传输过程中。
- ˚Freeze取样瓶直立在-20°C,直到分析。
- 颗粒有机物(POM)
- 后的DOC样品已收集继续过滤直至总共为500毫升已通过GF / F滤膜过滤,包括同时收集DOC样品出通过。
- 拧下在线过滤器支架。
- 删除使用预燃烧铝箔正方形内钳和地点过滤器的过滤器POM分析,折顶侧转身对自身和包装。
- 冷冻过滤,在-20℃下贮存直至进行元素和同位素分析。
- 无机营养
- 放置一个0.2微米的径迹蚀刻过滤器进入每个过滤器支架。重新装上过滤器盒中。
- 冲洗各20ml塑料闪烁瓶三次取样的水。填充每个瓶子的肩部(〜18ml)中。
- 冷冻在-20°C,直到以后的分析。
- MicroscopY(SYBR黄金和DAPI)
- 取下过滤器支架。
- 收集1ml水在每两个离心管中。
- 加入66微升32%多聚甲醛的等分(供以后SYBR金染色)之一。加入12μl的25%戊二醛到相应的其他(购买DAPI染色)。
- 轻轻混匀,并允许样本"修理"在室温下至少15分钟,在黑暗中。
- 流式细胞仪
- 放置一个8.0微米的聚碳酸酯过滤器中的过滤器托架中的一个,以排除碎片和大的真核细胞。
- 通采样的水通过填写每个采样点2离心管1毫升样品。
- 添加5μl的25%戊二醛到每个离心管(终浓度= 0.125%)。
- 倒置小瓶混合。
- 使样品固定在室温15-30分钟。不要超过30分钟。
- 闪光灯冷冻样品在液氮中。
- 店内的样品在-80℃或LIQUIð氮干托运人,直到分析流式细胞仪。
- 微生物宏基因组样品
- 在路过滤器支架取出。
- 直接安装0.22μm的圆筒形过滤器上的各行中。
- 剩下的两个哈塔伊Niskin单位从每个站点的水样过滤器(总数过滤器每3-4升),通过一个过滤器。
- 在过滤后,通过使用干净10毫升注射器填充有空气推动余下的水从每个滤波器。
- 将过滤器放回原包装并密封包装用胶带实验室。
- 存储独立包装的过滤器在-20℃。
- 病毒宏基因组样品
- 转让病毒宏基因组样品立即放入洗净的桶,以确保没有样品丢失或受到污染的环境中。
- 使用大孔径尼龙网(25-100微米),以在浓缩前19除去碎片和细胞材料预过滤器。
- 设置了TFF 如图3,放置运送管线中的样品桶,并留下运行到水槽的返回和滤液线。
- 打开蠕动泵和平齐线1-2 L取样水。
- 将样品桶回线来完成循环,增加背压0.7巴。
- 而浓缩的海水,顶起来样品水库的水位下降。当水位低于所述进气路径中的桶,转印浓缩成一种漂白剂洗涤,三重漂洗的Tripour烧杯中,并继续浓缩。
- 如果贮存器烧杯是空的,除去背压,提高泵速率和通过线推动整个样品,回收它在的Tripour。
- 通过0.45微米的圆柱形过滤器通过浓缩除去大部分细菌,而不是歧视任何病毒谱系。
- 每150毫升后更改0.45微米的圆柱形过滤器。收集了0.45微米-FIL羊羔病毒浓缩液50毫升试管。
- 加入250μl氯仿至每次50毫升等量病毒过滤,浓缩,以消除残留的细菌。颠倒混合,并存储,直立在4°C,直到后续处理。
- 擦干0.45微米的过滤器和按照步骤3.6.5和3.6.6中所述存储它们。
4.加工显微镜样品
注意:冲洗过滤塔用10%漂白粉其次是95%的乙醇,以防止潜在色斑或运行之间的生物残留物。 1小时内,避免暴露污渍和彩色滤光片工艺显微镜的样品如果有可能点亮。
- 安装
- 加入100μl的10%抗坏血酸4.9毫升1X PBS中,调匀。
- 加入5 ml 100%甘油,调匀。
- 过滤器安装用0.02微米的氧化铝基质的一次性注射器过滤,分装并储存于-20℃。
- SYBR金染色
- 吸管固定在微量离心管中2%的最终浓度的多聚甲醛的每个样品的500微升等分试样。
- 加入0.5微升的1000倍的SYBR金溶液于每个等分的。
- 轻轻混匀样品,并把它在黑暗中10分钟。
- 放置一个0.02微米的氧化铝基体过滤器与环形聚丙烯支撑环上的每一个过滤器支架上的真空泵系统,而将过滤器塔( 图4)。确保0.02微米过滤器放置在过滤器支架塑料的一面朝上,因为这些过滤器具有双重孔隙率。
- 用真空泵关闭时,添加500微升的SYBR染色标本的,沿与2ml的0.02微米的过滤病毒的游离水,以确保样品被均匀地分布在过滤器。
- 开启真空泵上创建的不超过1巴的负压,以避免损坏的病毒和微生物被过滤。
- 允许整个样本去通过。
- 使用镊子(而不是用于DOC同一对),小心地取下过滤塔的每一个过滤器,并通过了一项棘手的任务擦拭,以确保过滤器是干的。
- 移取10微升安装在显微镜载玻片,把含有山的下降染色标本的干燥过滤器。
- 加10微升安装到每个过滤器的顶部加入盖玻片之前。
- 轻压盖玻片下来。尽量消除气泡如果可能的话,避免横盘盖玻片的运动。
- 在slidebox并储存在-20℃的地方滑。
- DAPI染色
- 放置一个0.2微米的氧化铝基过滤器环形聚丙烯支撑环上的每个过滤器支架和安装过滤塔。
- 用真空泵关闭时,加入2毫升0.02微米的过滤病毒的游离水,以用于每一个塔。
- 移液管将1ml戊二醛固定样品到每个塔架,导致总体积öF 3毫升每个过滤塔。
- 开启真空泵以创建不超过1巴的负压。
- 整个样品过滤到0.2微米的氧化铝基体过滤器。
- 小心使用镊子(而不是用于DOC同一对)从过滤塔去除过滤器。
- 上放置一个加入100μl滴的DAPI溶液〔25微克/毫升]在培养皿中保持过滤器中的过滤器右边朝上,并让样品染色15分钟。在染色过程中避免光线。
- 15分钟后,从污渍去除过滤器,将它传递一个棘手的任务擦拭干燥并转移到0.02μm的过滤病毒游离水的100微升丢弃,再次保持滤波器右边朝上,以洗掉残留的DAPI染色1分钟。重复此洗一次。
- 如所描述的SYBR金样品上显微镜摩滤波器滑动相同的方式。
5. DNA提取
- 微生物宏基因组DNA
- 解冻的圆筒形过滤器进行至少20分钟,在RT。
- 使用10毫升注射器,在过滤除去任何残留的海水。帽用漂白和蒸压盖的圆柱形过滤器的底端。
- 对于每一个过滤器,混合360微升T1"预溶解"缓冲器和50微升蛋白酶K,然后吸取混合物进入过滤器。盖的开口端。
- 孵育在55℃下在旋转炉中的O / N(或至少2小时)的裂解反应。
- 取下帽之一,并添加200μl的B3"裂解"缓冲到过滤到预裂解样品。重新帽滤波器和在旋转炉孵育混合物10-20分钟,在70℃。
- 提取使用3毫升注射器通过抽吸液用的过滤器倒置的圆筒形过滤器的整个体积。
- 排出裂解的样品到一个新的离心管中,并加入200微升的100%乙醇。
- 拌匀,整个样品装载到旋列,并按照指示制造商的方案。
- 使用荧光为基础的检测量化的DNA。
- 海洋宏基因组学病毒
- 纯化和浓缩的噬菌体颗粒(修改自瑟伯等人。19)
- 溶解氯化铯在海水中以制备为1.7g / ml的溶液,1.5克/毫升,1.35克/毫升,1.2微克/毫升(由称量出将1ml溶液校准)。筛选的每种级分在使用前0.02微米的过滤器。
注:确保每个部分的密度使用的解决方案之前,精确到3显著数字和过滤所有的解决方案在使用前用0.02微米的过滤器。使用海水或海水饱和氯化铯,以降低或增加密度。 - 使从1毫升结合试剂的载玻片在4.2节中描述,确保所有试剂都缺乏病毒,然后再继续。
- 添加9克氯化铯至45中的病毒的TFF浓缩物毫升到为1.12克/ ml的终密度。冷藏而设立的氯化铯梯度步骤。
- 1.7克/毫升的溶液中先后开始慢慢加入1 ml每个顺序的密度较小的部分为使用血清移液器每管。标记每个个体弯月面的水平,并确保馏分之间的pycnoclines不受到干扰。欲了解更多详细信息请参见配套文件(Lim 等,2014年)。
- 用血清吸液管负载7.5毫升样品到各6管和离心〜83000×g离心,4℃下进行2小时。
- 而不破坏密度梯度卸载转子和刺穿管只是先前标记为1.5g / ml的密度层( 图5)与用3毫升注射器18G的针下面。抽出1.5纯化的VLP中并转移到新的离心管中。重复所有的样品。
- 加0.2倍体积的氯仿至纯化的VLP,剧烈混合,在室温下孵育10分钟。
- 加入150#181;升10×DNA酶缓冲液至各离心管中。
- 旋在16000×g离心5分钟,并收集水相。如果氯仿不聚集在离心管的底部,添加更多的DNA酶缓冲液中,混合,然后重复。
- 加入DNA酶I(终浓度= 2.5单位/微升),37℃下搅拌2小时,然后通过在65℃下温育15分钟灭活脱氧核糖核酸酶的活性。
- 溶解氯化铯在海水中以制备为1.7g / ml的溶液,1.5克/毫升,1.35克/毫升,1.2微克/毫升(由称量出将1ml溶液校准)。筛选的每种级分在使用前0.02微米的过滤器。
- DNA的提取病毒样颗粒(VLP)
- 均匀地从每个样品池的纯化的VLP成两个清洗和灭菌橡树岭管。
- 加入0.1体积的2M的Tris-HCl(pH为8.5)的0.2M的EDTA,0.01体积的0.5M的EDTA,1体积的甲酰胺,10微升糖原(10毫克/毫升)。搅拌均匀,在室温下孵育30分钟。
- 谈到新卷,加2体积RT 100%的乙醇。混合并孵育在4℃下超过30分钟。
- 通过纺丝橡树岭管在17200×g离心60分钟,在4#沉淀的DNA176℃。
- 除去上清液。使用血清移液器冰冷的70%乙醇洗两次DNA沉淀。
- 除去所有的乙醇(简要地在必要时重新纺),盖,并允许沉淀风干在RT> 15分钟。
- 重悬DNA沉淀在567微升1×TE缓冲液(pH为8.0)> 15分钟。转移567微升重悬DNA进入一个新的1.5 ml微量离心管中。
- 添加10%的30微升的SDS(预暖在65℃下在使用前),蛋白酶K和3微升(20微克/毫升),充分混合并孵育1小时,在56℃下。
- 加入100微升的5M NaCl和调匀。添加预热的CTAB的NaCl溶液中,涡旋80微升,并孵育10分钟,在65℃下。
- 加0.2份的氯仿中,涡旋和旋转量在16000×g离心2分钟。转移上清液至新的1.5 ml微量离心管中。
- 加入酚氯仿异戊25等体积:24:1解决方案,旋涡混匀,和自旋在16000×g离心2分钟。将上清转移到一个新的1.5 ml离心管。
- 添加氯仿,涡旋和旋转等体积在16000×g离心2分钟。将上清转移到一个新的1.5 ml离心管。
- 加入0.7体积的异丙醇以上清液部分和孵化在-20℃至少30分钟以沉淀DNA。
- 通过在16000×g离心在4℃下旋转20分钟,沉淀的DNA。吸取上清,用500μl冰冷的70%乙醇洗涤沉淀两次。
- 旋在16000×g离心,然后从管除去剩余的乙醇。空气干燥沉淀15分钟。
- 重悬DNA沉淀用50μl洗脱缓冲液(5毫摩尔Tris,pH7.5)中或的Tris-EDTA的pH为8.0,至少5分钟,在室温。
- 量化使用高灵敏度的基于荧光的测定中的DNA。
- 纯化和浓缩的噬菌体颗粒(修改自瑟伯等人。19)
结果
显微镜
显微镜的样品可以与应立即进行分析以确保它们是所希望的质量的。以测量的丰度和细菌群落的粒度分布,DAPI的幻灯片将通过荧光显微镜检查(激发/发射:四百六十一分之三百五十八纳米,见McDole 等人2012)( 图6A)。细胞计数和尺寸可以使用图像处理软件( 例如 ,ImagePro或ImageJ的)来收集。从长度和宽度的测量细胞体积(V)通过使所有的细胞具有气瓶使用以下等式半球形帽的形状的假设导出:
V =π/ 4×W 2(L - W / 3)
其中L是长度,w是宽度各小区23,4的。微生物生物量然后可以使用FO先前建立的与尺寸相关的关系估计ř海洋微生物群落24。一般的海洋细菌的长度范围从0.1-4微米,但上升到〜8微米的一些地方。
而用DAPI染色的过滤器(0.2微米),将只显示细菌,用于SYBR金染色(0.02微米)过滤器包含细菌和病毒。测量病毒的丰度遵循相同的协议,作为微生物,然而的325-375纳米的激励将用于与所述发射最大值是在537纳米( 图6B)。
为了生成量化数据的采样量,可能需要根据不同的病毒丰度在原始样品中进行调整。正确的量高效过滤器是最好的经验的水给定机构确定。含具有不同的病毒浓度的样品的显微照片的例子示于图7。
结果,从以往的研究表明,病毒以微生物比(VMR)通常在水生系统25-29的范围从1到50,并在3至20中,与在珊瑚礁系统平均约6(诺尔斯未发表数据)。
流式细胞仪
除了 直接计数和微生物群落的大小估计,自养的异养微生物通过流式细胞仪的比例进行评估,可以进一步从收集的样本中提取(实施流式细胞术在图8中给出的输出)。来确定总的细菌细胞的数量,将样品染色,用SYBR Green I的和一个光电倍增管具有三十分之五百三十〇带通滤波器被用于检测。通道。叶绿素(回导致一系列的675-735纳米的背面唱片反射镜)和藻红蛋白(42分之585带通滤波器),用于计数未染色的样品中的自养生物的丰度。以确定的丰度异养微生物,从非自养计数染色的部分,然后从SYBR染色的总计数(McDole 等人提交)中减去。
病毒宏基因组学
病毒宏基因组学利用区域性的独立分子的方法对病毒生态学,使用总基因组序列信息来确定群落结构和功能。宏基因组学已经推动我们的复杂性和病毒性的社区,在当地17多样性的认识到全球规模的30。生物信息学工具,各种各样的病毒宏基因组数据分析的最新发展减少了计算的瓶颈,允许通过宏基因组学的镜头更全面的看法的virosphere的。
这里介绍的方法,使用预过滤的大孔径尼龙的组合网孔以除去碎片和细胞物质的浓度突出的分离和病毒颗粒的浓缩海水用TFF( 图3)和一个后续的0.45微米过滤样品以除去较大的细胞。这种方法可以产生大约100倍的浓缩样品( 图5B-5E),它使我们能够在更小的体积进行下游流程。为了防止任何残留的微生物细胞的生长中的病毒裂解物,因此在野外站和实验室之间的长渡越时间的变化在病毒丰度的样品,氯仿常常加入到2%用于存储的最终浓度。下面的隔离和VLP的纯化,落射荧光显微镜用核酸染料如SYBR金用于验证病毒颗粒的存在和纯度( 图5B-5E)。
在这里,我们提出了两种病毒宏基因组从南线岛珊瑚礁,具体而言,星巴克(STAR7)和Millennium(CAR9;以前称为卡罗琳)的岛屿。的120升三桠总量的PLE水从每个站点在10米的深度收集和处理如第3.7和5.2中描述。从氯化铯密度梯度离心纯化的VLP的分别为3.3×10 8个粒子/ ml为CAR9( 图5D)和每毫升2.9×10 9个颗粒STAR7如根据第4段( 图5B)中描述的方法验证。的DNA从这些样品中分离的总量是大约400毫微克的基础上的NanoDrop测量。使用Phi29聚合酶的DNA扩增并通过在2011年的环境基因组学的核心设施测序的序列数据的特性列于表1。基于使用现有的数据库相似性搜索时,序列的大部分(> 70%),经常结束了未鉴定的, 即未知的起源和功能。类似地,这里提出的两个viromes呈现未知序列的97%以上。其结果是,非数据库相关分析的方法进行分析,开辟了研究的机会,一个新的手臂上的"暗物质"在病毒宏基因组学(Seguritan 等 。 在印刷中)。
微生物宏基因组学
微生物宏基因组的分析,可以对微生物群落存在的表征和这些社区的功能描述。例子包括致病菌和致病力5,22或比较丰富的物种在macrobial群落结构改变或速效养分和及其主要代谢途径( 图9,凯利等人 2014年)之间存在的估计。
水化学
水化学参数一般采取广泛的分析处理,以产生所期望的数据;样本进行分析,DOC将通过高温催化氧化31,3来衡量2,通过同位素比质谱联元素分析仪33-35,和无机营养物质的流动注射分析36,12,37颗粒有机物(POM)。在成功地完成所有的分析后,在表1中所示的信息将是可用的,以补充微生物和病毒群体的表征。这些信息可与有机碳和氮的样品稳定同位素比率进行补充(见Haas 等。35)和自养生物和异养之间的比率(McDole 等人提交的)。
在协议部分描述的方法图1.概述, 请点击这里查看此figu的放大版本。重。

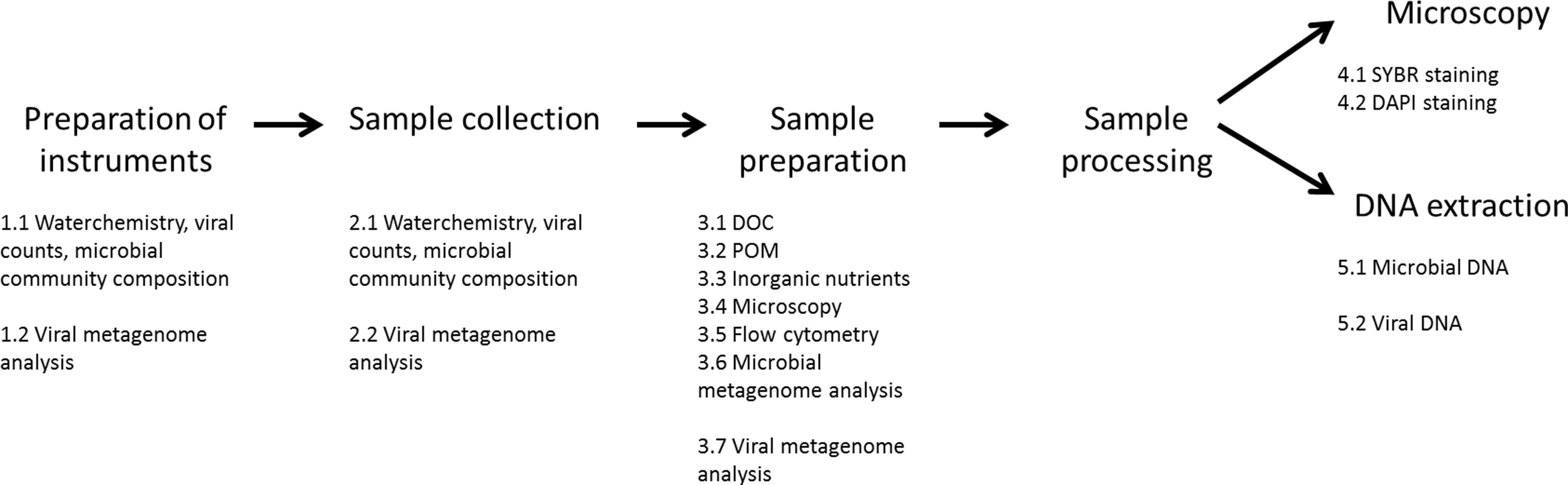
图2.示例处理钻机设置。这里介绍的过滤设置(示意图左,实际图象右图)并不一定需要,以产生样本,但将显著加快进程。该设置包括一背板,在其上哈塔伊Niskin单元(1)被安装的。上朝下的出口,哈塔伊Niskin单元通过硅胶管连接到所述串联过滤器固定器(2)。这些让采样水通过各个过滤器进入的HDPE取样小瓶(3)安装在右侧下方。在过滤过程中,通过加压空气(4),其与调节通过压力计(5)加速。溢出盆防止HDPE瓶或POM过滤的变化过程中溢出的水。 请点击这里查看该图的放大版本。

图3切向流过滤器的阵容。尼龙(从瑟伯等 19修改)网眼过滤的样品的水从储存器(1)通过蠕动泵(2)泵送至切向流过滤器(3)。样品水返回到储存器(1)沿着在无背压的返回线(4)。当背压是通过一个管夹(5)上的返回线施加,水通过过滤器而被丢弃或递送至滤液贮存器(6)。试料水被替换,因为它是浓缩了的滤液线,直到所有的样品水集中在管道线。
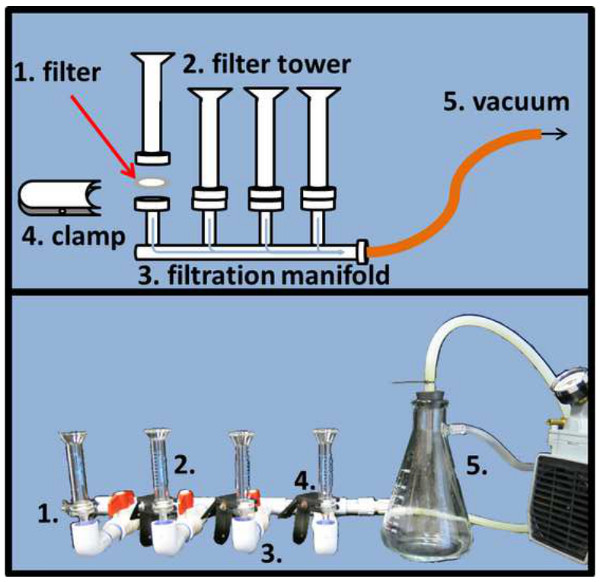
图4.显微镜载玻片过滤设置。均匀分布的DAPI和SYBR金染色的样品在相应的氧化铝基体过滤器(1),过滤器需要被放置在过滤塔的过滤歧管(2)和杆之间并固定用夹具(4)。压力调节真空度(5)将加速过滤过程(示意图前,实际画面底部面板)。 请点击这里查看该图的放大版本。
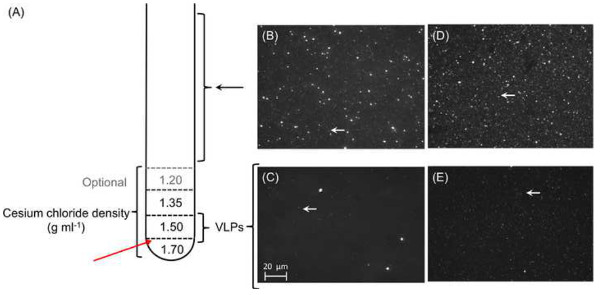
图5.纯化和噬菌体颗粒的浓度,共有各1ml氯化铯密度梯度的层叠在彼此之前主导经预处理的样品(A) 的顶部。每层应标明管外,以方便超速离心后提取。其中管会刺穿到前红色箭头标志道的VLP部分。 (BE)的病毒浓缩物的显微照片:落射荧光显微照片的STAR7(B)和CAR9(D)的0.45微米过滤的代表病毒浓缩液。大的颗粒,包括细菌细胞,从0.45微米的滤液从两个STAR7(B)和CAR9(D)的样品可见的,而只有病毒样颗粒(白色箭头)保持氯化铯梯度超速离心后;星7(C)和CAR9(E)。 请点击这里查看该图的放大版本。
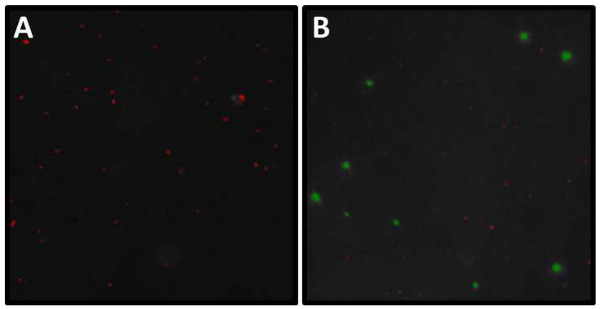
图DAPI和SYBR金显微分析。截图6.从(A)和DAPI(B)SYBR金染色幻灯片的例子分析为例 。 (A)长度和所有的宽度(微米)的颗粒突出(=微生物)可以与成像程序的帮助下进行评估。请注意,在图像的中心聚集。这些集群将需要被排除在随后的分析。(B)在分析的病毒和细菌需要由大小阈值进行像素合并成VLP和蜂窝尺寸范围(VLP红色,蜂窝绿色)。请注意,通常是由各自的成像程序未分类隐隐有些病毒样颗粒。这些病毒样颗粒出现清晰的白色圆点必须手动计数,并添加到病毒自动计数, 请点击这里查看该图的放大版本。

图7.浓度SYBR金染色样品含有不同数量的SYBR染病毒样本的0.02氧化铝基过滤器的显微照片。图A显示了自动对焦含ILTER海水过滤适量,而在B显示在过滤的浓度过高,在C中太低可靠的罪名。 请点击这里查看该图的放大版本。
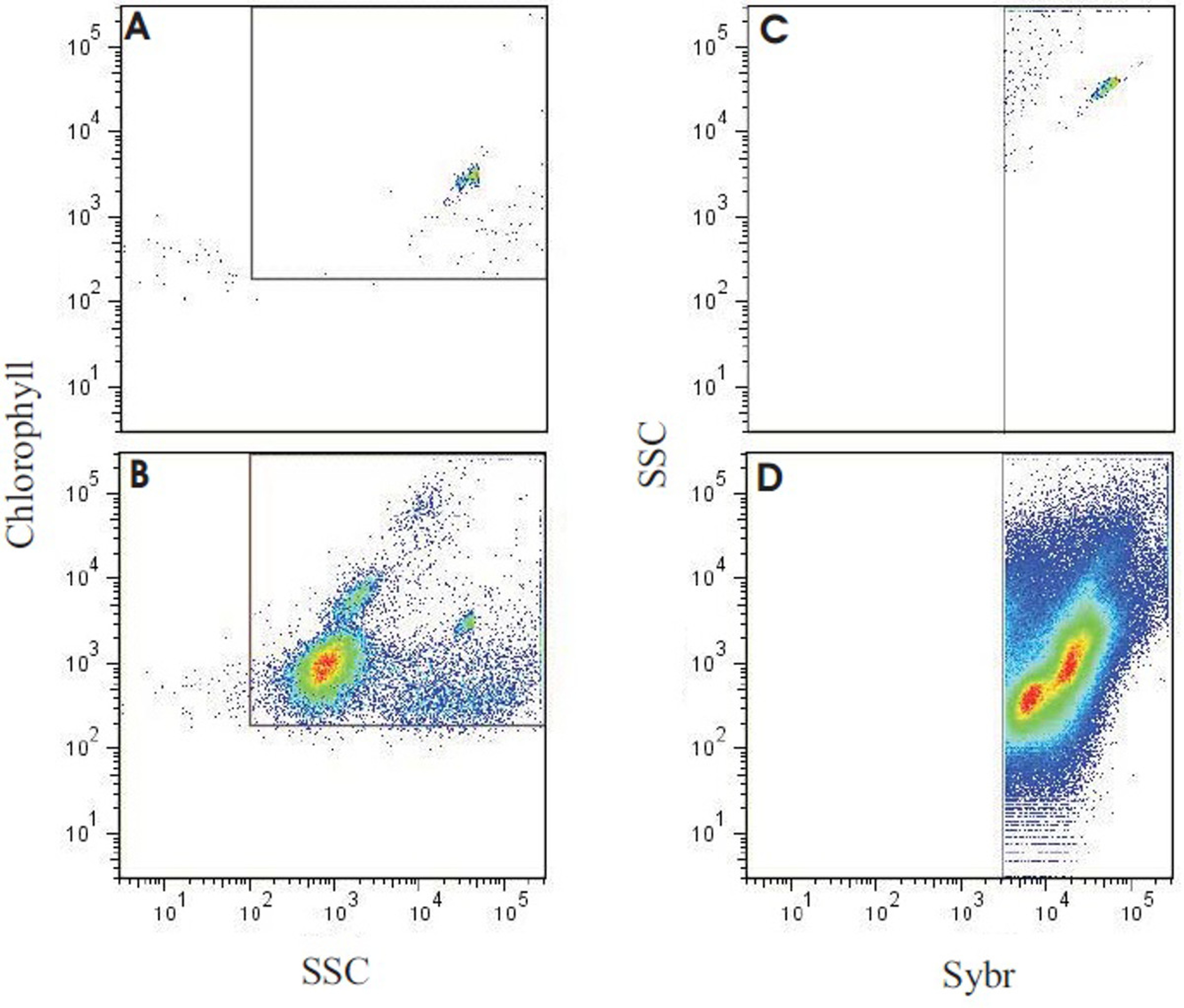
图流式细胞仪礁石,水样的分析输出的8结果。小组(A)仅显示有黄绿色荧光微球(0.75微米),用于验证仪器设置最小的背景分子级水。面板(B)中示出了具有相同设置和布局,在A.注意珠粒仍然可以看出在相同的位置,随着自养生物的几个群体的珊瑚礁水样品运行的输出。(C)的 的同一个样品在(B),用于背栅流式细胞仪,针对SYBR积极事件(自养+异数),并最大限度地减少背景。(D)代表礁水样用SYBR Green I.使用成立于(C)的选通,产生微生物总数量,并通过叶绿素自发荧光划分异养和自养微生物(见McDole 等。4)。 请点击这里查看该图的放大版本。
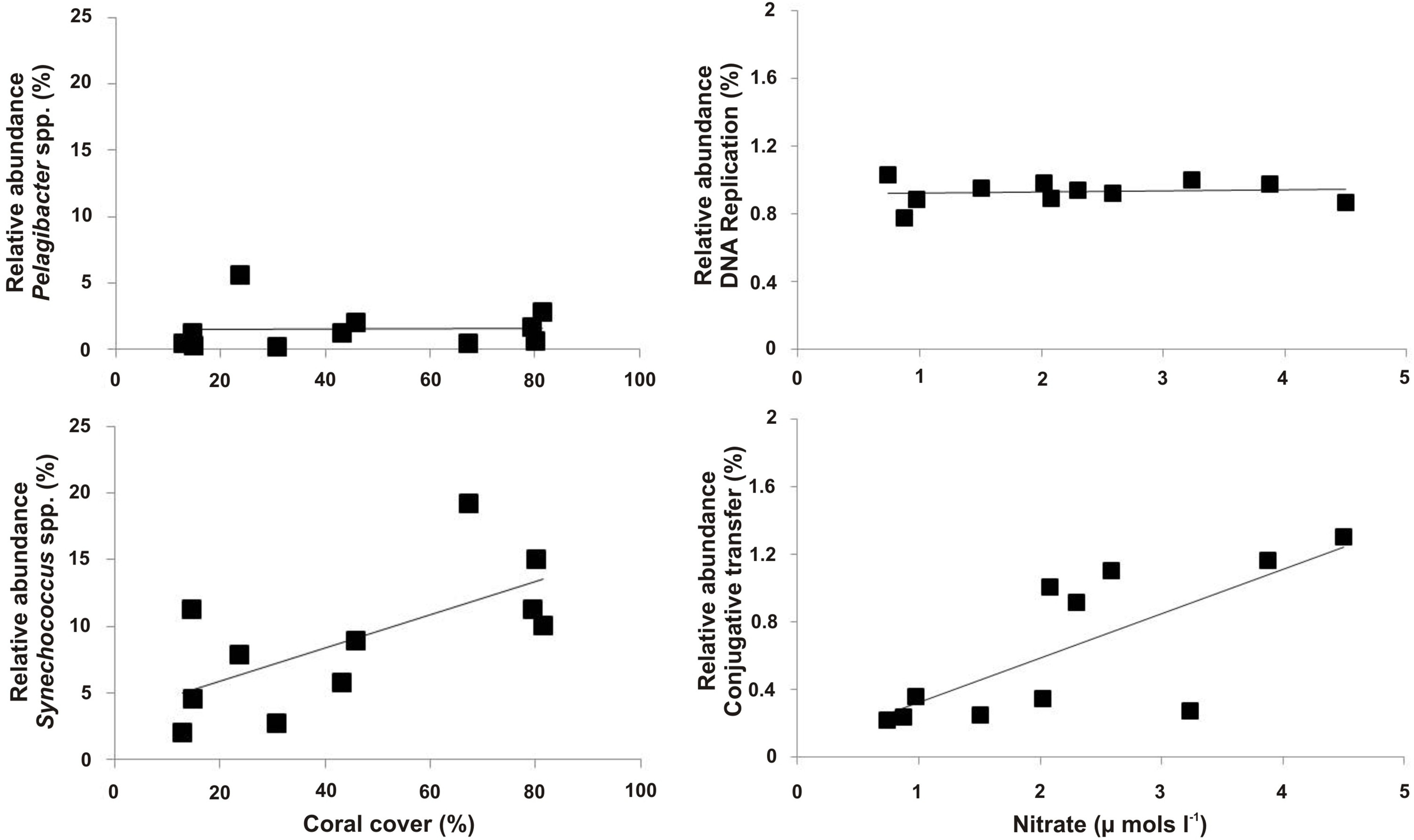
图微生物宏基因组数据的9例,微生物宏基因组序列数据和站点因变量之间的模式。这里, 聚球蓝细菌的相对丰度属。珊瑚的覆盖比例呈正相关,而Pelagibacter属。没有(左图)。代谢途径的接合转移呈正硝酸盐浓度相关,而代谢途径的DNA修复是所有的宏基因组(右图)之间是一致的。 请点击这里查看该图的放大版本。
| 7星 | CAR9 | |
| 总数的读取 | 939311 | 591600 |
| 预处理的读取数 | 579664 | 360246 |
| 意思是序列长度(BP) | 395±131 | 451±159 |
| 注释序列(%) | 42218(7.3%) | 9117(2.5%) |
| 未知(%) | 537446(92.7%) | 351129(97.5%) |
从南线群岛,星巴克和千年生成二viromes表1.数据特性。注释的程度使用在MG-RAST服务器基于BLAT。
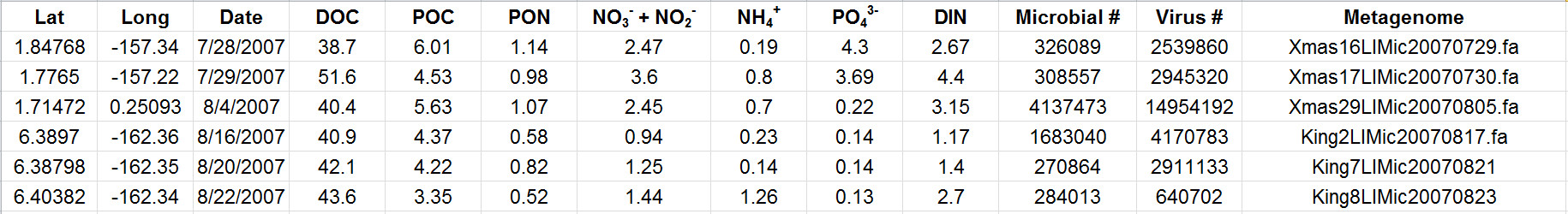
在一次探险表2代表结果显示,从不同的网站数据,在此评估参数包括搭配微生物和病毒丰度的水化学测量。该表还包含文件名指的是相应的宏基因组数据的每个采样位置。碳和无机营养浓度给出了微摩尔/升。 请点击这里查看此表的放大版本。
讨论
这里介绍的方法将提供一个工具来生成的水生生态系统的病毒和微生物的动态进行了全面评估。它们的目标,量化的可供微生物群落的有机和无机资源的现存量,并以表征所述病毒和微生物群落存在的化妆。下一步量化病毒数量和微生物数量和生物量,基因组序列信息,揭示了他们的群落结构和功能。所有的方法都已经制定或修改,以允许在远程现场位置的应用程序。然而,缺乏控制的实验室设置,本质上创建了一些潜在的错误。在这里,我们讨论每个评估参数相关的一些注意事项。旁边的潜在的污染样品时的操作的一些参数在分析过程中也产生潜在的错误。
溶解有机碳
碳污染可能发生在采样过程(采样下游,或在船上或潜水员的附近),在样品制备过程中(设备或无意操作的污染),而且,即使在存储的样本(其它样品在冷冻含有有机溶剂/挥发物)。以避免污染行为尽可能少的处理步骤可能的各种来源,因为每个样品迁移造成污染的额外来源。样品不应该在没有酸洗或燃烧任何物品接触。最后,指定的存储冷冻专门为不含有挥发性有机物质的样品将确保在较长的贮存期样品的完整性。如果样本不DOC样本的长途旅行期间酸化用浓盐酸中保持冷冻(如描述38-41)可能是适用的替代品。以验证测量精度的DOC共识参考材料,应使用章商务部测量过程中ularly运行。尤其是深层水(> 2,000 m)以下参考文献是在评估的分析机器的性能有价值的,因为它是在其DOC含量42很稳定。
颗粒有机物
除了避免有机碳污染,聚甲醛采样需要特别注意以确保过滤体积的准确性。如果为500毫升的有针对性的体积应偏离任何潜在原因此需要特别指出的来涉及聚甲醛捕获在过滤器将其导出,其中滤液的量。
无机营养
与有机碳的采样,必须注意以各种来源,如船只或废水排放12可能产生的营养物质样品污染。用于有机碳采样为0.8微米的标称孔尺寸的过滤器,可以不排除所有微生物生物量和sh乌尔德因此改变为0.2微米的过滤器对这个过滤步骤。此外,检测限造成养分的样品有问题;特别是在各地的许多珊瑚礁的位置( 例如 ,Cotner 等人 43)的贫营养的地表水。检测限约为0.1左右,0.2和0.1微摩尔/升铵,硝酸盐,亚硝酸盐,和正磷酸盐(参照36,12,37)
显微镜
除了变化的样本图像分析,从显微镜载玻片的集中度进一步得到潜在的错误。例如,图像可能无法聚焦在视场中的一些区域,并且在聚焦于他人。作为高纯度的氧化铝基质过滤器是一个非常严格的过滤器的类型,过滤器下的任何碎屑可能会导致整个滤波器坐在一角度滑动。其结果,图像可以持续聚焦在视场中的各个部分的一个给定的过滤器,再gardless显微镜对准。重新安装过滤器,以确保过滤器的下侧是干净的,可以改善这一点,如果它被观察到。另外,在某些情况下,可能有两个焦平面中的病毒和微生物都可以找到。这是染色的物体在安装时成为从过滤器分离,并上浮到盖玻片,可以使计数不可靠的下面的结果。因此,它总是建议的过程中,检查样品的质量。
流式细胞仪
如用显微镜的样品,也有可能是天然存在的细胞计数需要分析过程的调整样本流之间的差异。例如,这取决于仪器的灵敏度,依稀荧光绿球藻细胞可以低于噪声电平,不会被量化。珠作为内部控制的样品( 例如 ,以确认仪器的RESP账户ONSE到荧光信号是一致的一天又一天(和运行本身的过程中保持稳定)。如果加入到样品中,在已知浓度下,它们也可以作为内部对照,以验证该样品的体积运行。然而,建议始终运行一个先前冷冻的"标准"海水被解冻,并沿与感兴趣的样品染色,以提供额外的生物控制样品的96孔板运行之间处理样品的等分试样。根据位置,海水样品的外观可能彼此非常不同。排序"代表"群体,然后啶显微镜(EM)下观察可以是一个很好的方式,以快速验证浮游植物种群的任一聚球藻或光合真核生物。 绿球藻细胞通常是不可见的电磁下,因为它们消失得太快。除了 叶绿素a, 聚球藻还包含pH值otopigment phycoeurythrin(PE),其在较短波长(540-630纳米)比叶绿素A(660-700 nm)的发射光。当聚球藻细胞兴奋与蓝色/绿色光(470-490纳米),如果在去除光在510纳米波长的所有发射滤光片观看时,就会出现金色的。通过比较,在真核分数看起来红色,当用相同的光波长激发。
病毒宏基因组学
需要注意的是VLP浓度和存储的过程中影响了社会的回收是很重要的。可以发生在过程中的每一步骤的病毒颗粒损失,因此,病毒的纯化和浓缩的协议的选择可以最终影响所得病毒宏基因组44,45,18的观察分类组成和多样性。可以使用TFF 19或化学为基础的絮凝20进行样品浓度。在化学为基础的方法,断定结构延续带电的铁离子结合的天然带负电荷的病毒颗粒形成大的(> 8微米)铁 - 病毒复合物絮凝出来的溶液,并且可以使用8微米的过滤器来回收。随后,铁螯合掉病毒颗粒,并使用镁,抗坏血酸和EDTA,留下浓缩的病毒颗粒用于核酸提取20再溶解。比较这两个电流的方法之后,我们的结论是,氯化铁的方法是耗时少比TFF病毒浓度,但可能会产生一些注意事项。我们发现的铁-病毒即离解和溶解需要2倍,以便使之溶解于抗坏血酸降解之前进行更浓缩镁抗坏血酸-EDTA溶液比报道20。除了这个问题,该协议按大小分级分离纯化病毒颗粒独自一人,用去除0.2微米的过滤微生物污染物。大病毒不通过FILT器( 例如 ,Yang 等人 46),并因此不能在宏基因组进行检测,而另一些细菌活动(McDole,未发表的数据)。这导致细菌污染而歧视大病毒。
但是具体问题也是相关的与TFF集中连接去除微生物。作为氯仿治疗已经显示出以除去氯仿敏感的病毒具有外部脂膜47的一些研究表明,0.22微米的过滤可用于除去大部分的细菌。还应当注意的是,所提出的方法主要针对噬菌体的遗传物质在海洋环境中最丰富的载体。由于噬菌体一般认为不普遍含有脂质48他们对氯仿处理更有抵抗力。据我们所知,一个"包罗万象"的方法并不存在至今。这里介绍的方法是改编自欧在过去10年中R场经验横跨热带到寒带的各种系统的海洋环境。
微生物宏基因组学
宏基因组文库用于微生物( 例如 ,细菌和古细菌)的结构比病毒宏基因组更简单,因为它是更方便地生成所需的文库制备的最低DNA浓度。接头扩增鸟枪文库(LASLs)17,49,50和全基因组扩增基于多重置换扩增(MDA)是两种最常用的方法,以产生足够的DNA测序。使用MDA的微生物宏基因组,以获得更高的DNA浓度有时是必要的。然而,这可能会导致工件中的序列数据,如甲藻minicircles的音量过分放大。 MDA的方法是已知的,以优先扩增单链和环状DNA,产生非定量结果51,52。优化LASLs因此接近50可作为在放大这两个微生物和测序的病毒宏基因组DNA的一个更好的选择。需要注意的是LASLs方法具有多个步骤,需要复杂的设备,并且被限制为双链DNA模板是很重要的。另外,在组织DNA提取试剂盒已经显示从革兰氏阳性和革兰氏阴性生物门提取的DNA,但它并没有被验证为有效的裂解顽固的微生物类群或与其相关的结构( 例如 ,某些古细菌,孢子或真菌孢子) 。因此,一个珠击步骤可能是必要的,从某些微生物获得的DNA。
这些全面的评估,将导致更好地了解病毒和微生物生态系统功能。尽管很少有研究开展的工作,以评估建议的所有参数,许多一直在研究选定的。尼尔森等人 53表明一个连接betwEEN具体的珊瑚礁栖息地和枯竭相对于近海水域既DOC和浮游细菌的浓度。这些浓度的变化是伴随着浮游细菌群落不同的分化。 Dinsdale 等 5表明,增加的人为影响,伴随着微生物细胞和病毒样颗粒的10倍的更高的丰度。周围有人居住的岛屿海域的微生物群落也有较大的异和潜在的病原体5的分数。最后McDole 等 4表明,通过引入microbialization得分,人类活动正在转移能量至所述微生物,在macrobes为代价的。这些研究侧重于特定的微生物和水化学参数,提供了新的见解海洋生态系统的生化结构。结合生态系统监测工作的传统的数据 - 如温度和pH值,鱼类生物量和diversiTY,底栖盖,或接触人体的影响 - 以水化学和微生物的评估,很可能会导致更敏感的环境监测工作,这可能会导致更多的专门针对保护工作。
披露声明
The authors have nothing to disclose.
致谢
We thank Elisha Wood-Charlson, Jackie Mueller, Karen Weynberg, and Kathy Morrow for their help and constructive input on this manuscript. We also thank the crew and captain of the Hanse explorer which provided us with a perfect working environment to conduct large parts of this research. Further we would like to thank the three anonymous reviewers for their time and helpful comments to improve the manuscript. This work was funded by the NSF Dimensions of Biodiversity and PIRE awards DEB-1046413 and OISE/IIA-1243541, respectively, the Gordon and Betty Moore Foundation, Investigator Award 3781, and the CIFAR Integrated Microbial Diversity Fellowship IMB-ROHW-141679, all to FR.
材料
| Name | Company | Catalog Number | Comments |
| Niskin collection and processing units (Hatay Niskins) | Figure 1 | ||
| Filtration setup | Figure 1 | ||
| 32-36% Hydrochloric acid (HCl) | Fisher Sci | A508-212 | |
| High-density polyethylene (HDPE) container | e.g., 5 Gallon HDPE UN Certified Pail with Snap-On Lid | ||
| Combustion oven (550 °C) | |||
| 60 ml HDPE vials | Fisher Sci | 02-896-2B | |
| 25 mm GF/F filter | Fisher Sci | 09-874-64 | |
| Forceps | Fisher Sci | XX62-000-06 | |
| Sterile, non-powdered gloves | Fisher Sci | 19-170-010B | |
| Bilge pump | e.g., Thirsty Mate 124PF | ||
| 20 L collapsible low-density polyethylene carboy | e.g., Reliance Fold A Carrier II | ||
| Tangential flow filter (TFF) ultrafiltration hollow fiber cartridges | Amersham | CFP-2-E-9A | |
| Platinum-cured silicon tubing for TFF | Cole Parmer | 96440-82 | |
| Hose clamps | Cole Parmer | P-68007-23 | |
| Peristaltic pump | Cole Parmer | EW-77410-10 | |
| Sodium hydroxide (NaOH) solution | Electron Microscopy Sciences | 21162 | |
| 0.2 µm Polycarbonate track-etched membrane filter | Fisher Sci | 09-300-61 | |
| 8.0 µm Polycarbonate track-etched membrane filter | Fisher Sci | 09-300-57 | |
| 0.22 µm Polyvinylidene difluoride cylindrical filter | Fisher Sci | SVGP01050 | |
| 0.45 µm Polyvinylidene difluoride cylindrical filter | Fisher Sci | SVHV010RS | |
| Synthetic nylon mesh | Sefar | 03-125-37 | |
| 20 ml Plastic scintillation bottle | Fisher Sci | 03-341-72C | |
| Clean bucket (10-20 L) | |||
| 32% Paraformaldehyde | Electron Microscopy Science | 15714 | |
| 25% Glutaraldehyde | Electron Microscopy Science | 16220 | |
| Liquid nitrogen | |||
| 0.02 µm High-purity alumina matrix filter with annular polypropylene support ring | Fisher Sci | 6809-6002 | |
| 0.2 µm High-purity alumina matrix filter with annular polypropylene support ring | Fisher Sci | 6809-6022 | |
| 10,000x SYBR Gold nucleic acid stain | Invitrogen | S11494 | |
| DAPI solution 25 µg/ml | Invitrogen | D1306 | |
| Molecular grade water | sigma aldrich | W-4502 | |
| Ascorbic acid | Fisher Sci | BP351-500 | |
| Phosphate Buffered Saline (PBS) | Fisher Sci | BP399-500 | |
| Glycerol | Fisher Sci | G31-500 | |
| Microscope slide | Fisher Sci | 12-550-123 | |
| Coverslip | Fisher Sci | 12-548-5M | |
| Delicate task wipe | Fisher Sci | 06-666A | |
| Slide station with vacuum pump | Figure 3 | ||
| DNA extraction kit | Macherey-Nagel | 740952.1 | Nucleospin tissue kit |
| Proteinase K (20 mg/ml) | Lifetechnologies | AM2546 | |
| 200-proof Ethanol | Electron Microscopy Sciences | 15058 | |
| Red cap: Male Luer with Lock Ring x Female Luer Coupler | Cole Parmer | EW-45503-88 | |
| Cesium chloride (CsCl) | Fisher Sci | bp1595-500 | |
| 60 ml Syringe | Fisher Sci | 13-6898 | |
| 0.02 µm Alumina matrix disposable syringe filter | Fisher Sci | O992613 | |
| Ultra-clear centrifuge tubes | Beckman Coulter | 344059 | |
| Ultra-swinging bucket rotor | Beckman Coulter | 333790 | SW41 Ti Rotor |
| DNase I (100 units/µl) | Calbiochem | 260913 | |
| 0.5 M EDTA | Fisher Sci | BP2482-500 | |
| Formamide | Fisher Sci | BP228-100 | |
| Glycogen | sigma aldrich | G-1767 | |
| 1x Tris-EDTA (TE) pH 8.0 | Fisher Sci | BP2473-500 | |
| Sodium Dodecyl Sulfate (SDS) | Fisher Sci | 02674-25 | |
| 20 μg/ml Proteinase K | Fisher Sci | BP1700-500 | |
| Chloroform | Fisher Sci | BP1145-1 | |
| Phenol:Chloroform:Isoamyl alcohol 25:24:1 | sigma aldrich | p3803 | |
| Isopropanol | Fisher Sci | BP2618-500 | |
| 50 ml Oak Ridge tube | Fisher Sci | 05-562-16B |
参考文献
- Fuhrman, J. A. Marine viruses and their biogeochemical and ecological effects. Nature. 399 (6736), 541-548 (1999).
- Azam, F., Malfatti, F. Microbial structuring of marine ecosystems. Nature Reviews Microbiology. 5 (10), 782-791 (2007).
- Huber, J. A., et al. Microbial population structures in the deep marine biosphere. Science. 318 (5847), 97-100 (2007).
- McDole, T., et al. Assessing coral reefs on a Pacific-wide scale using the microbialization score. PloS ONE. 7 (9), (2012).
- Dinsdale, E. A., et al. Microbial ecology of four coral atolls in the Northern Line Islands. PloS ONE. 3 (2), (2008).
- Nelson, C. E., et al. Coral and macroalgal exudates vary in neutral sugar composition and differentially enrich reef bacterioplankton lineages. The ISME Journal. 7 (5), 962-979 (2013).
- Haas, A. F., et al. Influence of coral and algal exudates on microbially mediated reef metabolism. PeerJ. 1, (2013).
- Smith, J. E., et al. Indirect effects of algae on coral: algae‐mediated, microbe‐induced coral mortality. Ecology Letters. 9 (7), 835-845 (2006).
- Burdige, D. J., Martens, C. S. Biogeochemical cycling in an organic-rich coastal marine basin: 10. The role of amino acids in sedimentary carbon and nitrogen cycling. Geochimica et Cosmochimica Acta. 52 (6), 1571-1584 (1988).
- Capone, D. G., Kiene, R. P. Comparison of microbial dynamics in marine and freshwater sediments: Contrasts in anaerobic carbon catabolism. Limnology and Oceanography. 33 (4), 725-749 (1988).
- Krom, M. D., Sholkovitz, E. R. Nature and reactions of dissolved organic matter in the interstitial waters of marine sediments. Geochimica et Cosmochimica Acta. 41 (11), 1565-1574 (1977).
- Grasshoff, K. Methods of sea-water analysis. Verlag Chemie. , Weinheim and New York. (1976).
- Strickland, J. D. Practical handbook of seawater analysis. Bulletin Fisheries Research Board of Canada. 167, (1968).
- Sharp, J. H., et al. Analyses of dissolved organic carbon in seawater: the JGOFS EqPac methods comparison. Marine Chemistry. 48 (2), 91-108 (1995).
- DeLong, E. F. Microbial population genomics and ecology. Current Opinion in Microbiology. 5 (5), 520-524 (2002).
- Hugenholz, P., Goebel, B. M., Pace, N. R. Impact of Culture-Independent Studies on the Emerging Phylogenetic View of Bacterial Diversity. Journal of Bacteriology. 180 (18), 4765-4774 (1998).
- Breitbart, M., et al. Genomic analysis of uncultured marine viral communities. Proceedings of the National Academy of Sciences. 99 (22), 14250-14255 (2002).
- Willner, D., Hugenholtz, P. From deep sequencing to viral tagging: Recent advances in viral metagenomics. BioEssays. 35, 436-442 (2013).
- Thurber, R. V., Haynes, M., Breitbart, M., Wegley, L., Rohwer, F. Laboratory procedures to generate viral metagenomes. Nature Protocols. 4, 470-483 (2009).
- John, S. G., et al. A simple and efficient method for concentration of ocean viruses by chemical flocculation. Environmental Microbiology Reports. 3, 195-202 (2011).
- Lim, Y. W., et al. The Microbiome and Virome of CF. Pediatric Pulmonology. 47, 321-322 (2012).
- Kelly, L. W., et al. Black reefs: iron-induced phase shifts on coral reefs. The ISME Journal. 6 (3), 638-649 (2012).
- Bjornsen, P. K. Automatic determination of bacterioplankton biomass by image analysis. Applied Environmental Microbiology. 51, 1199 (1986).
- Simon, M., Azam, F. Protein content and protein synthesis rates of planktonic marine bacteria. Marine Ecology Progress Series. 51 (3), 201-213 (1989).
- Hara, S., Koike, I., Terauchi, K., Kamiya, H., Tanoue, E. Abundance of viruses in deep oceanic waters. Marine Ecology Progress Series. 145 (1), 269-277 (1996).
- Wommack, K. E., Colwell, R. R. Virioplankton: viruses in aquatic ecosystems. Microbiology and Molecular Biology Reviews. 64 (1), 69-114 (2000).
- Weinbauer, M. G., Brettar, I., Hofle, M. G. Lysogeny and virus-induced mortality of bacterioplankton in surface, deep, and anoxic marine waters. Limnology and Oceanography. 48 (4), 1457-1465 (2003).
- Clasen, J. L., Brigden, S. M., Payet, J. P., Suttle, C. A. Evidence that viral abundance across oceans and lakes is driven by different biological factors. Freshwater Biology. 53 (6), 1090-1100 (2008).
- Parada, V., Baudoux, A. C., Sintes, E., Weinbauer, M. G., Herndl, G. J. Dynamics and diversity of newly produced virioplankton in the North Sea. The ISME Journal. 2 (9), 924-936 (2008).
- Angly, F. E., et al. The marine viromes of four oceanic regions. PLoS Biology. 4 (11), (2006).
- Hansell, D. A., Carlson, C. A. Deep ocean gradients in dissolved organic carbon concentrations. Nature. 263 (266), (1998).
- Carlson, C. A., et al. Dissolved organic carbon export and subsequent remineralization in the mesopelagic and bathypelagic realms of the North Atlantic basin. Deep Sea Research Part II: Topical Studies in Oceanography. 57 (16), 1433-1445 (2010).
- Sharp, J. H. Improved analysis for particulate organic carbon and nitrogen from seawater. Limnology and Oceanography. 19 (6), 984-989 (1974).
- Ehrhardt, M., Koeve, W. Determination of particulate organic carbon and nitrogen. Methods of Seawater Analysis. Third Edition, 437-444 (2007).
- Haas, A. F., et al. Organic matter release by coral reef associated benthic algae in the Northern Red Sea. Journal of Experimental Marine Biology and Ecology. 389 (1), 53-60 (2010).
- Guildford, S. J., Hecky, R. E. Total nitrogen, total phosphorus, and nutrient limitation in lakes and oceans: Is there a common relationship. Limnology and Oceanography. 45 (6), 1213-1223 (2000).
- Allison, S. D., Chao, Y., Farrara, J. D., Hatosy, S., Martiny, A. C. Fine-scale temporal variation in marine extracellular enzymes of coastal southern California. Frontiers in Microbiology. 3, (2012).
- Van Duyl, F. C., Gast, G. J. Linkage of small-scale spatial variations in DOC, inorganic nutrients and bacterioplankton growth with different coral reef water types. Aquatic Microbial Ecology. 24 (1), 17-26 (2001).
- De Goeij, J. M., Van Duyl, F. C. Coral cavities are sinks of dissolved organic carbon (DOC). Limnology and Oceanography. 52 (6), 2608-2617 (2007).
- De Goeij, J. M., et al. Major bulk dissolved organic carbon (DOC) removal by encrusting coral reef cavity sponges. Marine Ecology Progress Series. 357, 139-151 (2008).
- Mueller, B., et al. Natural diet of coral-excavating sponges consists mainly of dissolved organic carbon (DOC). PLoS ONE. 9 (2), (2014).
- Carlson, C. A., Ducklow, H. W., Hansel, D. A. Organic carbon partitioning during spring phytoplankton blooms in the Ross Sea polynya and the Sargasso Sea. Oceanography. 43 (3), 375-386 (1998).
- Cotner, J. B., et al. Nutrient limitation of heterotrophic bacteria in Florida Bay. Estuaries. 23 (5), 611-620 (2000).
- Willner, D., et al. Metagenomic detection of phage-encoded platelet-binding factors in the human oral cavity. Proceedings of the National Academy of Science USA. 108 (1), 4547-4553 (2011).
- Hall, R. J., et al. Evaluation of rapid and simple techniques for the enrichment of viruses prior to metagenomic virus discovery. Journal of Virological Methods. 195, 194-204 (2013).
- Yang, S. Y., et al. Nanoporous membranes with ultrahigh selectivity and flux for the filtration of viruses. Advanced Materials. 18 (6), 709-712 (2006).
- Feldman, H. A., Wang, S. S. Sensitivity of various viruses to chloroform. Proceedings of the Society for Experimental Biology and Medicine. 106 (4), 736-738 (1961).
- Ackermann, H. W. The Bacteriophages., Second Edition. Calendar, R. , Oxford University Press. New York. 8-16 (2006).
- Henn, M. R., et al. Analysis of High-Throughput Sequencing and Annotation Strategies for Phage Genomes. PLoS ONE. 5 (2), (2010).
- Duhaime, M. B., Deng, L., Poulos, B. T., Sullivan, M. B. Towards quantitative metagenomics of wild viruses and other ultra-low concentration DNA samples: a rigorous assessment and optimization of the linker amplification method. Environmental Microbiology. 14 (9), 2526-2537 (2012).
- Yilmaz, S., Allgaier, M., Hugenholtz, P. Multiple displacement amplification compromises quantitative analysis of metagenomes. Nature Methods. 7 (12), 943-944 (2010).
- Kim, K. H., Bae, J. W. Amplification Methods Bias Metagenomic Libraries of Uncultured Single-Stranded and Double-Stranded DNA Viruses. Applied Environmental Microbiology. 77 (21), 7663-7668 (2011).
- Nelson, C. E., Alldredge, A. L., McCliment, E. A., Amaral-Zettler, L. A., Carlson, C. A. Depleted dissolved organic carbon and distinct bacterial communities in the water column of a rapid-flushing coral reef ecosystem. The ISME Journal. 5 (8), 1374-1387 (2011).
- Kelly, L. W., et al. Local genomic adaptation of coral reef-associated microbiomes to gradients of natural variability and anthropogenic stressors. Proceedings of the National Academy of Sciences. 111 (28), 10227-10232 (2014).
- Lim, Y. W., Haynes, M., Furlan, M., Robertson, C. E., Harris, J. K., Rohwer, F. Purifying the Impure: Sequencing Metagenomes and Metatranscriptomes from Complex Animal-associated Samples. J. Vis. Exp. , (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。