Method Article
Radyosensitif ve radyodirençli genleri ortaya çıkarmak için genom çapında CRISPR ekranı
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Genom çapında bir CRISPR / Cas9 tarama yönteminin uygulanması yoluyla dirençli ve hassas radyasyon genlerini seçmek için titiz ve yapılandırılmış bir yaklaşım verilmiştir. Bu protokol aynı zamanda klinik olarak uygulanan kimyasal ilaçlara direnç mekanizmalarını araştıran diğer araştırma çabaları için çok yönlü bir çerçeve olarak hizmet etme potansiyeline sahiptir.
Özet
CRISPR-Cas9 sistemi kullanıldı ve güçlü bir genom düzenleme aracı olarak yeniden tasarlandı. Araştırmacılar bu teknolojiden yararlanarak, canlı hücrelerdeki DNA dizilerini hassas bir şekilde kesebilir, yapıştırabilir ve hatta yeniden yazabilirler. Bununla birlikte, CRISPR ekran teknolojisinin uygulanması sadece deneylerin çok ötesine geçmektedir. Genetik hastalıklara karşı mücadelede çok önemli bir araç olarak hizmet eder, karmaşık genetik manzaraları sistematik olarak inceler, araştırmacıları biyolojik olayların altında yatan moleküler mekanizmaları çözme konusunda güçlendirir ve bilim adamlarının kanser, kistik fibroz ve orak hücreli anemi gibi hastalıkların temel nedenlerini belirlemelerini ve hedeflemelerini sağlar. Hepsinden önemlisi, kanser tıp için zorlu bir zorluk teşkil etmekte ve eradikasyon çabalarını teşvik etmektedir. Radyoterapi, geleneksel bir tedavi olarak, sonuç verir ancak sınırlamaları vardır. Kanser hücrelerini yok eder, aynı zamanda sağlıklı dokulara da zarar vererek yaşam kalitesini düşüren olumsuz etkilere neden olur. Ek olarak, tüm kanser hücreleri radyoterapiye yanıt vermez ve bazıları direnç geliştirerek durumu kötüleştirebilir. Bunu ele almak için, radyosensitif ve radyodirençli genlerin verimli bir şekilde tanımlanmasını sağladığı ve böylece kanser araştırma ve tedavisi alanını ilerlettiği için kapsamlı bir tam genom CRISPR ekran teknolojisi tanıtıldı. Açıklanan protokolü takiben ışınlamaya maruz kalan akciğer adenokarsinom hücrelerinde genom çapında bir CRISPR taraması yapıldı ve bu sayede hem radyorezistans hem de radyosensitivite ile ilişkili genler tanımlandı.
Giriş
Biyolojik olayların araştırılması, doğal olarak hücresel davranışların incelenmesi ile iç içedir ve sırayla, hücresel davranışların incelenmesi temel olarak genomunun araştırılmasıyla bağlantılıdır. Modern teknoloji gelişmeye devam ettikçe, tıp araştırmacıları, çeşitli hastalıkların tedavi sonuçlarını iyileştirmek için dikkatlerini gen düzenleme yoluyla hücresel davranışları değiştirmeye doğru giderek daha fazla yönlendiriyorlar. Bu bağlamda, kümelenmiş düzenli aralıklı kısa palindromik tekrarlar (CRISPR) teknolojisi, nispeten basit uygulaması nedeniyle genom düzenleme için devrim niteliğinde bir araç olarak ortaya çıkmıştır1. CRISPR-Cas9 sistemi, hedef DNA dizisini spesifik olarak tanıyan ve ona bağlanan, Cas9 nükleazını bu konumda kesmeye yönlendiren ve genom DNA'sında çift sarmallı bir kırılma (DSB) ile sonuçlananCas9 nükleaz ve tek kılavuzlu RNA'dan (sgRNA) oluşur 2,3,4. Ek olarak, diğer maddelerin eklenmesi, genomda spesifik eklemelere, silmelere veya mutasyonlara yol açarak hedeflenen gen düzenlemesini mümkün kılabilir.
Fonksiyonel genomik araştırmalarda, RNA interferans (RNAi) taraması, bir zamanlar kanserdeki gen rollerini araştırmak için büyük ölçekli fonksiyon kaybı deneyleri yürütmek için yaygın olarak kullanılan bir yöntemdi. RNAi teknolojisi, hedef genleri spesifik olarak susturarak gen fonksiyonunu inceler ve araştırmacıların kritik onkojenik faktörleri belirlemesine yardımcı olur. Bununla birlikte, hedef dışı etkiler ve eksik gen yıkım verimliliği ile sınırlıdır. Hedef dışı etkiler, hedef olmayan diğer genlerin susturulmasına yol açabilir, böylece deneysel sonuçların doğruluğunu ve güvenilirliğini tehlikeye atabilir 1,2. Ek olarak, RNAi, belirli genler için düşük yıkım verimliliği sergiler ve potansiyel olarak hedef gen ekspresyonunu tamamen bastıramaz. Geleneksel RNAi ekranlarının aksine, CRISPR ekranı daha yüksek özgüllük ve verimlilik gösterir3. Bu teknoloji sadece belirli genlerin hassas bir şekilde düzenlenmesini sağlamakla kalmaz, aynı zamanda genom çapında büyük ölçekli taramaya izin vererek gen fonksiyonu araştırmaları için sağlam destek sağlar. CRISPR-Cas9 sistemine dayalı güçlü bir gen düzenleme aracı olan CRISPR ekran teknolojisi, 5,6,7,8 hücrelerindeki belirli genlerin bilinmeyen işlevlerini verimli bir şekilde taramak ve ortaya çıkarmak için kullanılır. Araştırmacılar, belirli genler veya gen bölgeleri için gruplar halinde sgRNA'lar tasarlarlar ve karşılık gelen sgRNA kütüphanelerini hassasiyet ve titizlikle hazırlayarak bütünlüklerini ve işlevselliklerini sağlarlar9. Bu sgRNA kütüphaneleri daha sonra konakçı hücreleri verimli bir şekilde enfekte etmek için kullanılan lentiviral partiküller halinde kapsüllenir. Başarılı bir enfeksiyonun ardından, enfekte olmuş hücreler kişisel olarak tanımlanmış tarama koşulları altında yetiştirilir. Taramanın ardından, taranan hücrelerin genomik DNA'sı, yüksek saflık ve miktar standartları korunarak ekstrakte edilir. Daha sonra, sgRNA'nın ilgilendiği hedeflenen bölgeler, istenen nükleik asitsegmentlerini 3,9 doğru bir şekilde kopyalayan bir işlem olan PCR amplifikasyonuna tabi tutulur. Son olarak, amplifiye edilmiş DNA fragmanları üzerinde yüksek verimli dizileme gerçekleştirilir, bu da hedeflenen bölgelerin kapsamlı ve verimli bir şekilde analiz edilmesini sağlar, böylece incelenen genlerin işlevi ve davranışı hakkında değerli bilgiler sağlar4.
Kanser, karmaşık bir hastalık olarak insan sağlığı için büyük bir tehdit oluşturmaktadır. Dünya çapında, araştırmacılar ve klinisyenler, karsinogenezin moleküler mekanizmalarını çözmek ve yeni terapötik stratejiler geliştirmek için ortak çaba sarf etmektedirler. Temel araştırma bulgularının klinik uygulamalara dönüştürülmesini hızlandırmak için uluslararası işbirlikleri kurulmuş olup, nihai hedefi hasta sonuçlarını iyileştirmektir. Sasmal ve ark. metastatik kanser hücrelerinin hassas bir şekilde hedeflenmesi için sentetik bir konak-konuk sistemine dayanan bir biyoortogonal montaj stratejisi önerdi ve bu, düzinelerce bilim insanına tıbbi teknolojilerin ilerlemesinde önemli ölçüde yardımcı oldu. Olağanüstü araştırma çalışmaları, bilim camiasına anlamlı katkılar sağlayan yüksek inovasyon ve benzersiz içgörülere sahiptir10. Kanser, DNA hasar yanıtlarının11-14 düzensiz düzenlenmesinden kaynaklanan çalkantılı genomik kararsızlık durumu ile karakterizedir. DNA hasarı, tek nükleotid kusurlarını, tek iplikli kırılmaları ve DSB'leri içerir. Homolog rekombinasyon (HR) ve homolog olmayan uç birleştirme (NHEJ), farklı aşamalarda DSB'lerin onarımına katılır 15,16,17. Bu temelde, radyoterapi, tümör dokusunu ışınlamak için yüksek enerjili ışınları (X-ışınları ve γ-ışınları gibi) kullanan, tümör hücrelerinde DNA hasarına neden olan ve böylece büyümelerini ve çoğalmalarını bozan uygun bir tedavi seçeneği olarak ortaya çıkmıştır18. Bununla birlikte, radyoterapi, kanser hastalarının önemli bir kısmında, potansiyel olarak parakanseröz dokulara verilen hasarlardan ve radyoterapiye düşük duyarlılık gibi tümörün doğal özelliklerinin getirdiği sınırlamalardan kaynaklanan istenen etkileri her zaman vermemektedir 19,20,21.
Teorik olarak, herhangi bir hücre tipi bir CRISPR ekranı için kullanılabilir. Bununla birlikte, mutasyona uğramış popülasyonlarda yeterli temsili sürdürmek, çok sayıda başlangıç hücresi gerektirir. Düşük bolluğa sahip hücre tipleri, genom çapında tarama için özellikle uygun değildir. Kütüphane seçimine gelince, çoğu kütüphane hedef gen başına 3-6 gRNA içerir ve her gRNA'nın popülasyon içindeki dağılımını korumak kritik öneme sahiptir18. Spesifik gRNA'ların zenginleşmesi veya tükenmesi nedeniyle temsil kaybı, eşit olmayan sonuç dağılımına yol açabilir. Bu sorunu çözmek için, piyasada test edilmiş, ticari olarak mevcut CRISPR kütüphanelerini tercih etmek tercih edilen bir seçim olabilir20. Laboratuvar ortamında Homojen kanser hücre dizileri kullanan CRISPR taraması, in vivo tümörlerin genetik ve epigenetik heterojenliğini tam olarak yakalayamayabilir. İn vitro tarama, DNA hasarı onarımı ve radyasyona bağlı otokrin sinyallemede yer alan anahtar genleri ortaya çıkarırken, hipoksi ile indüklenen radyodirenç (ROS, metabolik adaptasyon ve otofaji yoluyla ), bağışıklık aracılı parakrin etkiler ve ECM'ye bağlı sitokin modülasyonu dahil olmak üzere tümör mikro çevresini tam olarak kopyalamadı. Radyasyon duyarlılığı veya direnci ile ilişkili genleri keşfetmek için CRISPR ekranını kullanmadan önce, bu faktörler dikkatlice düşünülmelidir. Mevcut tedavi ortamı ışığında, radyoterapi etkinliğini etkili bir şekilde artırmak için radyorezistans ve radyosensitivite ile ilişkili faktörleri belirlemek ve derinlemesine incelemek acildir22. CRISPR ekranının bilinmeyen genlerin işlevlerini incelemedeki temel avantajı göz önüne alındığında, radyosensitif ve radyodirençli genleri verimli bir şekilde tanımlamak için sistematik olarak ayrıntılı bir tüm genom CRISPR ekran teknolojisi sağlanmıştır.
Protokol
Bu çalışmada kullanılan reaktifler ve ekipmanlar Malzeme Tablosunda listelenmiştir.
1. Uygun bir radyasyon dozunun seçilmesi
- Yapışık hücrelerin hazırlanması ve kaplanması
- Geçiş ve hücre büyümesi için %10 FBS içeren RPMI 1640 tam hücre kültürü ortamı ile hücre yoğunluğunu mL başına 5 x10 5 hücre olarak ayarlayın. Hücreleri farklı dozlarda radyasyon için 3,5 cm'lik kültür kaplarına dağıtın. Her yemeğe 2 mL (1 x 10,6 hücre) ekleyin ve gece boyunca 37 °C'de %5 CO2 ile inkübe edin.
- Farklı radyasyon dozlarının uygulanması
- 3,5 cm'lik kültür kaplarını 1'den 5'e kadar numaralandırın. Grup # 1'i kontrol grubu olarak kullanın, kalan 4 grup tedavi grupları olarak belirlenmiştir.
- 6 oyuklu plakaların kenarlarını tedavi grupları için bir sızdırmazlık membranı ile kapatın ve sırasıyla 2, 4, 6 ve 8 Gy'lik radyasyon dozları uygulayın. Tedaviden sonra, bulaşıkları inkübatöre geri koyun.
- Radyasyondan sonra hücre hatlarının kaplanması
- 6 oyuklu ve 96 oyuklu plakalar hazırlayın. 3,5 cm'lik kültür kaplarındaki hücreleri PBS ile bir kez yıkayın, logaritmik olarak büyüyen hücreleri %0,25 tripsin ile sindirin ve hücre yoğunluğunu %10 FBS içeren RPMI 1640 tam ortam ile mL başına1 x 10 5 hücre olarak ayarlayın.
- Her radyasyon dozu için 3 tekrarda 6 oyuklu plakalara 10 μL / kuyu (1.000 hücre / 100 μL) tohumlayın. Her oyuğa 2 mL tam ortam ekleyin ve 14 gün sonra sayın (her klon grubu yaklaşık 50 hücreye sahip olduğunda).
- Her radyasyon dozu için 5 kopyada 96 oyuklu plakalara 30 μL / kuyucuk (3.000 hücre / 100 μL) tohumlayın. Her oyuğa 70 μL tam ortam ekleyin ve 72 saat sonra hücre canlılığını ölçün.
- Hücre canlılığının ölçülmesi
NOT: Klonojenik inhibisyon oranı = 1 - (tedavi grubundaki klon sayısı / kontrol grubundaki klon sayısı) x% 100. CCK-8 testi, suda yüksek oranda çözünür bir sarı formazan ürünü11 oluşturmak için hücresel dehidrojenazlar tarafından indirgenebilen suda çözünür bir tetrazolyum tuzu (WST-8) kullanır. Üretilen formazan miktarı, canlı hücrelerin sayısı ile doğru orantılıdır ve optik yoğunluğu (450 nm dalga boyunda ölçülür) hücresel metabolik aktiviteyi ve proliferatif durumu doğru bir şekilde yansıtır11,13. Bu köklü prensibe dayanarak, CCK-8 testi, hücre proliferasyon testleri ve tümör ilaç duyarlılık testleri dahil olmak üzere çeşitli uygulamalar için yaygın olarak benimsenmiştir. Bu protokolde, CCK-8 testi, farklı radyasyon dozları altında hücresel canlılığı sistematik olarak değerlendirmek için kullanılır.- CCK8 reaktifini RPMI 1640 ortamı ile FBS olmadan 1:9 oranında karıştırın. Ortamı 96 oyuklu plakalara atın ve her oyuğa 100 μL CCK8 içeren ortam ekleyin.
- Karanlıkta 1 saat inkübe edin ve bir mikroplaka okuyucu kullanarak OD değerini 450 nm'de ölçün.
NOT: Hücre sağkalım oranı = [(tedavi grubunun OD değeri - boş kuyunun OD değeri) / (Kontrol grubunun OD değeri - boş kuyunun OD değeri)] x %100
- Radyasyon dozu seçimi
- Araştırma ihtiyaçlarına göre uygun bir radyasyon dozu seçmek için klonojenik inhibisyon oranını hücre sağkalım oranı ile entegre edin. Hem radyodirençli hem de radyosensitif genleri taramak için% 50 inhibisyon oranına sahip bir radyasyon dozu seçin.
2. Uygun MOI ve puromisin konsantrasyonunun seçilmesi
- Yapışık hücrelerin kaplanması
- Hücre yoğunluğunu mL başına 3 x 105 hücreye ayarlayın ve 12 oyuklu bir plakaya oyuk başına 1 mL (3 x 105 hücre) aşılayın. Plakayı gece boyunca 37 ° C'de% 5 CO2 ile inkübe edin.
- Lentiviral enfeksiyon
- Ortamı 12 oyuklu plakadan aspire etmek için bir pipet kullanın ve bunu %10 FBS içeren 1 mL RPMI 1640 tam ortamla değiştirin. Kalite kontrollü, tüm genomlu bir CRISPR lentiviral kütüphanesi hazırlayın (ticari olarak mevcut kütüphaneler önerilir) ve logaritmik bir konsantrasyon gradyanı ayarlayın (örneğin, 0-10-50-100-200-400-800)4,5,6,7,8.
- Karşılık gelen miktarda lentivirüsü 2 μL / tabak polibrene ekleyin ve oda sıcaklığında 5 dakika dengeleyin. Lentivirüs ve polibren karışımını her bir oyuğa yavaşça damlatın, iyice karıştırın ve gece boyunca 37 ° C'de% 5 CO2 ile inkübe edin.
- Hücre öldürme için minimum puromisin konsantrasyonunun belirlenmesi
- Ebeveyn hücre yoğunluğunu 3 x 105 hücre / mL'ye ayarlayın ve 12 oyuklu bir plakaya oyuk başına 1 mL (3 x 105 hücre) aşılayın. Plakayı gece boyunca 37 ° C'de% 5 CO2 ile inkübe edin.
- 0-0.1-0.2-0.5-1-2-4-8 μM'lik bir konsantrasyon gradyanında 12 oyuklu plakanın her bir oyuğuna puromisin ekleyin. 72 saat sonra hücreleri sayın. Kuyucuktaki tüm hücreleri öldüren minimum konsantrasyon, viral olarak enfekte olmuş hücrelerin daha sonra taranması için kullanılacak olan hücre öldürme için minimum puromisin konsantrasyonudur.
- Enfeksiyon sonrası puromisin seçimi
- Enfeksiyondan sonraki ikinci günde, ortamı her bir oyuktan aspire edin ve% 10 FBS içeren 1 mL RPMI 1640 tam ortam ile değiştirin. 48 saat boyunca kültürlemeye devam edin.
- Enfeksiyondan 72 saat sonra, mevcut ortamı hücre öldürmek için minimum puromisin konsantrasyonunu içeren tam ortamla değiştirin. Negatif ve pozitif kontroller olarak lentiviral enfeksiyon olmadan 12 oyuklu plakada 2 kuyu kurun. Negatif kontrolü puromisin ile tedavi edin ve pozitif kontrolü tedavi edilmeden bırakın. 72 saat boyunca kültürlemeye devam edin.
- 72 saatlik puromisin seçiminden sonra, negatif kontroldeki tüm ebeveyn hücreleri ölecek, pozitif kontroldeki ebeveyn hücreleri ise minimum ölüm gösterecektir. Her kuyu için MOI'yi hesaplayın.
NOT: MOI = (Virüs bulaşmış gruptaki hücre sayısı / Pozitif kontrol grubundaki hücre sayısı) x %100. Sonraki tarama için ~ 0.3 MOI ile virüs konsantrasyonunu kullanın.
3. Genom çapında CRISPR lentiviral kütüphane enfeksiyonu
- Yapışık hücre hatlarının tohumlanması
- Hücre yoğunluğunu, pasaging ve hücre büyümesi için% 10 FBS içeren RPMI 1 tam ortamında mL başına 1 x10 7 hücre olarak ayarlayın. Her 15 cm'lik kültür kabına 37 ° C'de 1 mL hücre (1 x10 7 hücre) 8 saat boyunca% 5 CO2 ile aşılayın. Hücreler yapıştığında ve% 70 -% 80'lik bir birleşime ulaştığında, viral enfeksiyon için hazırdılar (yaklaşık 500'lük bir kopya sayısı yapar).
- Lentiviral enfeksiyon
- Besiyerini 15 cm'lik kültür kaplarından aspire edin ve %10 FBS içeren 15 mL RPMI 1640 tam besiyeri ile değiştirin. Kalite kontrolünden geçirilmiş bir tüm genom CRISPR lentiviral kütüphanesi hazırlayın.
- MOI = 0.3 ila 30 μL / tabak polibren ile karşılık gelen miktarda lentivirüs ekleyin ve oda sıcaklığında 5 dakika dengeleyin, lentivirüs ve polibren karışımını 15 cm'lik kültür kaplarına yavaşça damlatın, iyice karıştırın ve gece boyunca% 5 CO2 ile 37 ° C'de inkübe edin. Eşzamanlı olarak, kontrast olarak ebeveyn hücresi ile 15 cm'lik bir kültür kabı hazırlayın.
- Enfeksiyon sonrası puromisin seçimi
- Viral enfeksiyondan sonraki ikinci günde, besiyerini 15 cm'lik kültür kaplarından aspire edin ve% 10 FBS içeren 15 mL RPMI 1640 tam besiyeri ile değiştirin. 48 saat boyunca kültürlemeye devam edin.
- Enfeksiyondan 72 saat sonra, ortamı minimum öldürücü puromisin konsantrasyonunu içeren tam ortamla değiştirin. Enfekte olmamış ebeveyn hücrelerine aynı şekilde negatif kontrol olarak davranın ve 72 saat boyunca kültürlemeye devam edin. 72 saatlik puromisin seçiminden sonra, negatif kontrol grubundaki ebeveyn hücrelerinin tümü öldürülür ve lentiviral enfeksiyondan hayatta kalan hücrelerin başarılı bir şekilde enfekte olduğu kabul edilir.
- 0. Gün genomunun çıkarılması
- Hücreleri% 0.25 tripsin kullanarak 15 cm'lik bir kültür kabından sindirin,% 10 FBS içeren RPMI 1640 tam ortamında yeniden süspanse edin ve hücre sayısını sayın. Bu örneği Gün 0 olarak etiketleyin.
- 300 x g'da 5 dakika (oda sıcaklığında) santrifüjleyin ve süpernatanı atın. 1 mL PBS'de tekrar süspanse edin, 5 dakika boyunca 300 x g'da santrifüjleyin ve süpernatanı atın. Gün 0 genomik DNA'yı çıkarın, bir nanodrop UV spektrofotometresi kullanarak DNA konsantrasyonunu ve saflığını ölçün.
- sgRNA bütünlüğünün tespiti için, amplifiye edilmiş sgRNA kitaplığını analiz etmek için agaroz jel elektroforezini kullanın, bantların net olduğundan ve önemli bir bozulma olmadığından emin olun, böylece kitaplığınbütünlüğünü koruyun 23. Lentiviral kütüphane kapsamı değerlendirmesi için, kütüphane24,25 içindeki sgRNA'lar üzerinde sıralama analizi yapmak için derin dizileme teknolojisi kullanın.
- CRISPR ekranında, PCR amplifikasyonu, sgRNA fragman bütünlüğünün ve kütüphane kalitesinin bir ön doğrulaması olarak hizmet eder6. Kütüphane kapsamını ve sgRNA dağılım modellerini daha kapsamlı bir şekilde analiz etmek ve tarama sırasında her bir hedef gen için sgRNA'ların yeterli temsilini sağlamak için, ekran9'un sağlamlığına ilişkin derinlemesine içgörüler için NGS gerçekleştirin.
NOT: Tarama öncesi ve sonrası sgRNA bolluğundaki değişiklikleri tespit ederek ve potansiyel sgRNA hedef dışı entegrasyonunu veya kütüphane kontaminasyonunu belirleyerek, CRISPR ekranının doğruluğu ve güvenilirliği daha da geliştirilebilir. Bu Gün 0 numuneleri, çok önemli negatif kontroller olarak hizmet eder ve 2 temel hedefe ulaşmak için PCR amplifikasyonu ve NGS yoluyla kapsamlı kalite değerlendirmesine tabi tutulur: (1) esansiyel gen tükenmesinin doğrulanması (yeterli kütüphane temsilini gösterir) ve (2) esansiyel olmayan genlerde kararlı ekspresyonun gösterilmesi (deneysel temel koşulların oluşturulması)9. - Kütüphanenin çeşitliliğini ve temsiliyetini sağlamak ve tarama sürecinde önyargılardan kaçınmak için kapsamın beklenen düzeye ulaştığından emin olun. Enfeksiyon verimliliği ölçümü için, enfeksiyon verimliliğini değerlendirmek için floresan görüntüleme kullanın ve deney gereksinimlerini karşıladığından emin olun.
4. Radyasyonun bir tarama koşulu olarak uygulanması
- Grup -landırma
- CRISPR ile enfekte olmuş hücrelerin yoğunluğunu mL başına 1 x 107 hücre olarak ayarlayın ve her 15 cm'lik Petri kabına 1 mL aşılayın. Gece boyunca 37 ° C'de% 5 CO2 ile inkübe edin.
- Radyasyon tedavisi
- Hücreleri rastgele 2 gruba ayırın: bir tedavi grubu ve bir kontrol grubu, grup başına 6 tabak. Tedavi grubundaki hücrelere uygun bir radyasyon dozu uygulayın, kontrol grubu hücrelerini normal şekilde çoğaltılması için tedavi edilmeden bırakın. Radyasyondan sonra, 7 gün boyunca% 5 CO2 ile 37 ° C'de inkübe etmeye devam edin.
- İkinci haftada, tedavi grubu hücrelerine uygun bir radyasyon dozu vermeyi tekrarlayın, kontrol grubu hücrelerini tedavi edilmeden bırakın ve normal şekilde çoğalmalarına izin verin. Radyoterapiden sonra, 7 gün daha% 5 CO2 ile 37 ° C'de inkübe etmeye devam edin.
5. Genom ekstraksiyonu ve dizileme
- 14. Günün Çıkarılması
- 14 günlük tedaviden sonra, tedavi ve kontrol gruplarındaki hücreleri %0.25 tripsin ile sindirin, %10 FBS içeren tam RPMI 1640 ortamı kullanarak yeniden süspanse edin ve bunları Gün 14-RT veya Gün 14-NC olarak etiketleyin.
- Hücreleri 5 dakika boyunca 300 x g'da santrifüjleyin ve süpernatanı atın. 1 mL PBS'de tekrar süspanse edin, 5 dakika boyunca 300 x g'da santrifüjleyin ve süpernatanı tekrar atın. 14. Günün genomik DNA'sını çıkarın ve nanodrop UV absorbans spektroskopisi kullanarak DNA'nın konsantrasyonunu ve saflığını tespit edin.
- PCR amplifikasyonu
- Dizinin karşılık gelen primerlerini hazırlayın (Malzeme Tablosuna bakınız) ve bunları 10 μM'ye seyreltin.Reaktifleri steril bir mikrosantrifüj tüpüne ekleyerek 20 μL'lik bir reaksiyon sistemi kurun, 300 x g'da 5 saniye santrifüjleyin ve iyice karıştırın. PCR ürünlerini elde etmek için PCR cihaz parametrelerini amplifikasyon durumuna göre ayarlayın.
- Agaroz jel elektroforezi tespiti
- Bir jel döküm plakası hazırlayın, kalıbın kenarlarını agaroz ile kapatın, tarağı yerleştirin ve numune DNA'sının uzunluğuna göre uygun konsantrasyonda bir agaroz jeli hazırlayın.
- Belirli bir miktarda agaroz tozunu doğru bir şekilde tartın, uygun miktarda elektroforez tamponu ekleyin, iyice karıştırın ve erimesi için bir mikrodalga fırında ısıtın. Hafifçe soğuduktan sonra uygun miktarda nükleik asit boyası ekleyin, hafifçe karıştırın ve yavaş yavaş jel döküm kalıbına dökün. Jelin 30 dakika katılaşmasına izin verin.
- Tarağı çıkarın ve jeli kaplayana kadar elektroforez tankına uygun miktarda elektroforez tamponu ekleyin. DNA örneğine uygun miktarda yükleme tamponu ekleyin, iyice karıştırın ve karışımı örnek kuyucuğuna yavaşça eklemek için bir pipet kullanın.
- DNA fragmanının boyutuna ve agaroz jelin konsantrasyonuna göre uygun voltajı ayarlayın. Elektroforezden sonra, sonuçları gözlemlemek ve PCR amplifikasyonunun başarılı olup olmadığını kontrol etmek için jeli dikkatlice çıkarın ve bir jel görüntüleyiciye yerleştirin.
- Illumina sıralaması
- Genomik DNA'yı üç gruptan (Gün 0 grubu, kontrol grubu ve tedavi grubu) toplayın ve kütüphane inşaatı ve Illumina dizilimi için bir şirkete gönderin. Radyoterapiye duyarlı ve radyoterapiye dirençli genler elde etmek için biyoinformatik analiz ve dizileme sonuçlarının görselleştirilmesini gerçekleştirin26.
- Veri analizi için birden fazla tekrarlanan deney kurun ve verilerin tutarlılığını ve tekrarlanabilirliğini sağlamak için deney sonuçları üzerinde istatistiksel analiz yapın27,28.
- Sıralama verilerinin kalite değerlendirmesi
- Sıralama bilgilerinin kesinliğini garanti etmek için ham verileri titiz filtreleme ve kalite kontrol mekanizmalarına tabi tutun5. Belirli bir dönüştürme algoritması ve temel çağrı28 sırasında meydana gelen bir hatanın olasılığını değerlendiren bir model kullanarak, sıralama hata oranına dayalı olarak her nükleotid için Phred skorunu (Qphred) hesaplayın.
- Her temel konum için sıralama hata oranını %1'in altında tutun (Q30 eşiğine eşdeğer) ve sonraki analitik prosedürleri desteklemek için sıralama verilerinin en az %80'inin bu Q30 standardına ulaştığından emin olun.
- Veri işleme ve numune düzeyinde kalite kontrol
NOT: Ayrıntılar için lütfen daha önce yayınlanmış raporlarabakın 29,30.- Sıralama verilerinden filtrelenmiş okumaları sgRNA kitaplık dizileriyle hizalayın. Mükemmel hizalama ile kütüphanedeki sgRNA'ların sayısı, sgRNA'ların ortalama bolluğu, tespit edilmeyen sgRNA'ların sayısı ve sgRNA kütüphanesine başarıyla eşlenen bireysel örneklerden elde edilen okumaların oranı dahil olmak üzere rapor istatistikleri. Daha geniş kapsama alanı belirtmek için daha yüksek bir eşleme oranı kullanın.
- Her numunedeki her gen (farklı sgRNA'lar tarafından hedeflenen) için okumaların zenginleştirilmesini sayın. MAGeCK'in "medyan" normalleştirme yöntemini kullanarak numuneler arasında her bir sgRNA için destekleyici okumaları normalleştirin. sgRNA okuma sayılarının dağılımını değerlendirerek, kutu grafikleri oluşturarak, temel bileşen analizi (PCA) yaparak ve korelasyon ısı haritaları oluşturarak numune düzeyinde kalite kontrolü gerçekleştirin.
- sgRNA okuma sayılarının bir Poisson dağılımını takip ettiğini varsayalım. Örnekler içindeki genel veri dağılımını görselleştirmek ve gruplar arasındaki dağılımları karşılaştırmak için farklı gruplardan normalleştirilmiş sgRNA sayımlarını kutu grafiklerinde tasvir edin.
- Temel bileşenler arasındaki farkları ve her bir bileşen içindeki varyasyon oranını yansıtarak veri analizini basitleştirmek için PCA'yı kullanın ve grup içi ve gruplar arası varyasyonların gözlemlenmesini kolaylaştırın. Örnekler arasındaki ilişkileri göstermek için bir korelasyon ısı haritası kullanın.
- Temel analiz
- Gruplar arasında diferansiyel sgRNA analizi yapın ve kalite kontrol ve ön veri işlemeden sonra temel genleri belirleyin. İlgili genlerin fonksiyonel zenginleştirme analizlerini yapar30. MAGeCK veya MLE gibi diğer istatistiksel yöntemlerle hesaplanan sağlam sıra toplama (RRA) puanına dayalı olarak temel genleri sıralayın ve daha düşük bir RRA puanı daha yüksek önemi gösterir.
- Sıralanan sonuçlar üzerinde biyoinformatik analiz yapmak için R dilini veya diğer programlama dillerini kullanın ve bulguları GO ve KEGG analiz diyagramlarını kullanarak görselleştirin30. Genleri veya proteinleri kimlik eşleme veya dizi açıklaması yoluyla karşılık gelen GO terimlerine (moleküler fonksiyon, biyolojik süreç ve hücresel bileşen) bağlayın.
- Tanımlanan gen kataloğunu hücresel, tür ve ekosistem düzeylerinde sistem işlevlerine bağlayarak üst düzey işlevleri ve biyolojik sistemleri anlamak için KEGG'i bir veritabanı olarak kullanın. Yol yönlerinin sezgisel bir şekilde görüntülenmesi için GO ve KEGG analizlerinden en iyi 10 veya 20 yolu seçin.
Sonuçlar
Önde gelen ölüm oranına sahip akciğer kanseri, oldukça agresif ve yaygın bir tıbbi hastalığı temsil eder. Tarama koşulu olarak radyasyon ile genom çapında bir CRISPR ekranı yürütmek için örnek olarak akciğer kanseri hücre hattı A549'u kullanarak, şematik iş akışı Şekil 1'de gösterilmektedir. İlk olarak, klon oluşumu ve CCK8 deneyleri yoluyla A549 hücrelerinin farklı radyasyon dozlarına duyarlılığını keşfedin (Şekil 2). Klonojenik tahlilde, koloni sayısı 2 Gy'de 140 ± 5.35 iken, 0 Gy'de 303 ± 31.63 iken, CCK-8 testinde optik yoğunluk (OD) değeri 2 Gy'de 0.65 ± 0.05'e karşı 0 Gy'de 1.35 ± 0.08 idi. Radyosensitivite ve radyorezistans için aday genleri araştırmak için, sonraki radyasyon dozu olarak 2 Gy (IC50) seçin. A549 hücreleri farklı dozlarda puromisin ile muamele edildi ve 72 saat sonra sayıldı. A549 hücreleri için minimum puromisin öldürme konsantrasyonu 1 μM olarak tespit edildi (Şekil 3). A549 hücreleri, farklı gradyan MOI'lerde lentivirüsler ile enfekte edildi. Enfeksiyondan 72 saat sonra, enfeksiyon etkinliği floresan mikroskobu ile gözlendi ve 72 saat puromisin tedavisinden önce ve sonra sayıldı. Enfeksiyon etkinliği ~0.3 olan MOI elde edildi (Tablo 1). İnsan genomu, her gene karşılık gelen 6 sgRNA ve 500 kopya sayısı (19.050 x 6 x 500 = 5.7 x 107 hücre) ile 19.050 gen içerir. MOI = 0.3 ile lentivirüslerin kullanılması ve buna göre 5.7 x 107 A549 hücrelerini enfekte eder. 72 saat sonra, hücreler 72 saat daha 1 μM puromisin ile muamele edildi. Day 0 genomu hasat edildi ve PCR amplifikasyonu yapıldı. CRISPR tüm genom kütüphanesindeki sgRNA dizileri, agaroz jel elektroforezi sonuçlarıyla desteklenen 231 baz çifti uzunluğunda bir uzunluk sergiler (Şekil 4).
PCR ürünleri daha sonra veri kalitesi kontrolü ve numune düzeyinde kalite kontrolü için Novogene'ye gönderildi. Haritalama oranı, tüm genomun işlenmesi sırasındaki katıksız karmaşıklık ve kaçınılmaz yıpranma göz önüne alındığında, tüm genom tarama prosedürleri için yeterli kabul edilen bir metrik olan yaklaşık %60'lık kapsamlı bir kapsama oranı verdi (Şekil 5). sgRNA okuma sayıları, teorik beklentilere uygun olarak bir Poisson dağılımına bağlı kaldı. PCA çizimi ve korelasyon ısı haritalaması yoluyla yapılan müteakip analiz, farklı gruplar arasındaki fark edilebilir eşitsizliği canlı bir şekilde tasvir etti ve gruplar arası varyasyon, grup içi tutarsızlıklardan belirgin şekilde daha ağır bastı. Ayrıca, gruplandırılmış numuneler içindeki varyasyon oranı, numune düzeyinde kalite kontrol önlemlerinin başarısını doğrulayarak kabul edilebilir sınırlar içinde kalmıştır. Daha sonra, MAGeCK tarafından tasarlanan RRA sıralamaları, R dilini kullanarak sıralama sonuçlarının temel bir biyoinformatik değerlendirmesine başlamak için kullanılacaktır. Özellikle, GO terimlerindeki ilk 15 yolak, deneyin altında yatan tarama kriterleriyle sorunsuz bir şekilde uyumlu olan DNA hasarına bağlı mekanizmaları belirgin bir şekilde içeriyordu.

Şekil 1: A549 akciğer kanseri hücrelerinde genom çapında radyoterapi CRISPR/Cas9 ekranının şeması. Genom çapında CRISPR/Cas9 ve radyoterapi kullanılarak A549 hücrelerinde tarama iş akışının şematik bir gösterimi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
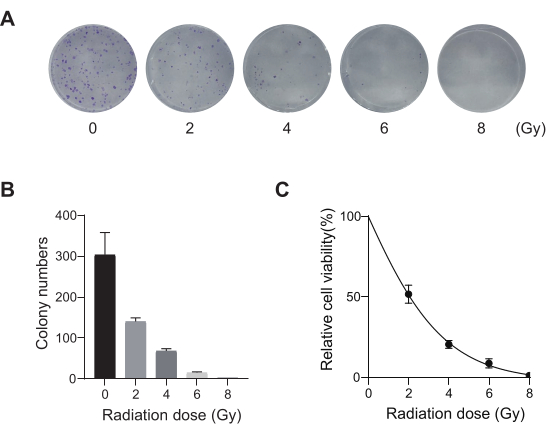
Şekil 2: A549 hücreleri için radyasyon dozu optimizasyonu. (A) A549 hücreleri artan dozlarda radyasyona (0 Gy, 2 Gy, 4 Gy, 6 Gy ve 8 Gy) maruz bırakıldı ve 14 gün boyunca büyümeye izin verildi. Koloni oluşumu tahlil görüntüleri gösterilmektedir. Sonuçlar iki bağımsız biyolojik deneyi temsil etmektedir. (B) Klonlanmış oluşum tahlil görüntülerinin miktar tayini sonuçları. Hata çubukları standart sapmayı temsil eder (n = 3). Tek yönlü varyans analizi P < 0.01 olarak bulunmuştur. Sonuçlar iki bağımsız biyolojik deneyi temsil etmektedir. (C) Farklı radyasyon dozlarına maruz kaldıktan sonra A549 hücrelerinin doz-yanıt sağkalım eğrileri. Hata çubukları standart sapmayı temsil eder (n = 3). Tek yönlü varyans analizi P < 0.01 olarak bulunmuştur. Sonuçlar iki bağımsız biyolojik deneyi temsil etmektedir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
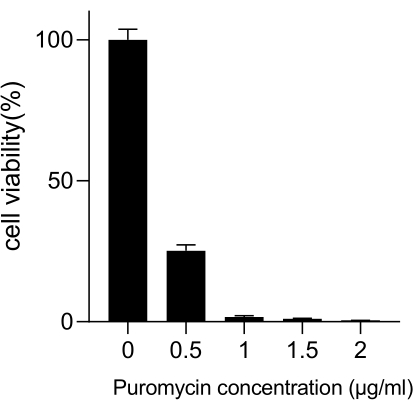
Şekil 3: A549 hücre seçimi için gerekli olan minimum puromisin konsantrasyonunun belirlenmesi. A549 hücreleri, artan puromisin konsantrasyonları ile muamele edildi ve 72 saat inkübe edildi. Hata çubukları standart sapmayı temsil eder (n = 3). Tek yönlü varyans analizi P < 0.01 olarak bulunmuştur. Sonuçlar iki bağımsız biyolojik deneyi temsil etmektedir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
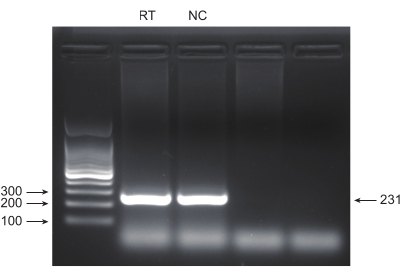
Şekil 4: Agaroz jel elektroforezi ile PCR ürün validasyonu. PCR ürün bantlarının varlığını ve kalitesini incelemek için agaroz jel elektroforezi kullanıldı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 5: PCR ile güçlendirilmiş ürünlerin kalite kontrolü ve temel analizi. (A) Haritalama oranı, referans genomun yaklaşık %60'ını kapsadığını gösterdi. (B) sgRNA'ların okuma sayısı dağılımı bir Poisson dağılımı izledi. (C) En iyi 10 Gen Ontolojisi (GO) teriminin çoğu DNA hasar tepkisi ile ilişkilendirildi. (D) Negatif olarak zenginleştirilmiş genler kırmızı, pozitif olarak zenginleştirilmiş genler mavi ve önemli olmayan genler gri renkte olan gen zenginleştirme modellerini gösteren yanardağ grafiği. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Virüs parçacığı Sayı (VP) | Sayı sayısı (puromisin tedavisinden önce) | Sayı sayısı (puromisin tedavisi sonrası) | Enfeksiyon randıman |
| 1.23 × 104 | 1.23 × 105 | 1.04 × 104 | 0.084552846 |
| 3,72 × 104 | 1,24 × 106 | 3,61 × 104 | 0.291129032 |
| 6,15 × 104 | 1.23 × 107 | 5.4 × 104 | 0.43902439 |
Tablo 1: A549 hücre sayımı, farklı virüs partikülleri altında puromisin seçiminden önce ve sonra yapılır. Değişen virüs partikülleri altında puromisin tedavisinden önce ve sonra kaydedilen A549 hücrelerinin sayısı.
Tartışmalar
Son teknoloji bir gen düzenleme teknolojisi olan CRISPR ekranı, bilimsel araştırma alanında derin değişikliklere yol açtı5. CRISPR-Cas9 sisteminden kaynaklanan bu teknoloji, yüksek verimliliği ve hassasiyeti nedeniyle gen fonksiyonlarını incelemek için önemli bir araç haline gelmiştir9. CRISPR/Cas9 mühendislik prensibi, Cas9 nükleazını hedef DNA dizilerini hassas bir şekilde bulmak ve kesmek için yönlendirmek için yaklaşık 20 nükleotidli spesifik sgRNA'ların tasarlanmasını ve tanıtılmasını içerir ve nakavt, aktivasyon veya baskılama gibi gen düzenlemeyi mümkün kılar6. Bu ilke, yüksek verimli ve özelleştirilebilir CRISPR ekranının geliştirilmesinin temelini oluşturur. Araştırmacılar, çok sayıda sgRNA içeren kütüphaneler oluşturarak, birden fazla geni aynı anda düzenleyebilir ve tarayabilir, belirli fenotipler veya hastalık durumlarıyla ilişkili olanları hızlı bir şekilde tanımlayabilir. Ayrıca, CRISPR ekranı, çeşitli hücre tiplerinde, dokularda ve hatta tüm organizmalarda deneylere izin vererek, gen işlevi ve etki mekanizmaları hakkında daha kapsamlı bir anlayış sağlar.
Hızlanan teknoloji gelişimi ile CRISPR ekranı, çeşitli alanlarda uygulama için muazzam bir potansiyel göstermiştir. Örneğin, CRISPR ekranı, bilim adamlarına yeni ilaç hedeflerini keşfetmede yardımcı olabilir, böylece ilaç keşfi ve geliştirme sürecini hızlandırabilir. Hastalık araştırmalarında bu teknoloji, hastalık patogenez mekanizmalarını ortaya çıkararak tanı ve tedavi için yeni içgörüler ve yaklaşımlar sunar. CRISPR ekranı, geleneksel tarama yöntemlerinden (RNAi ve küçük molekül inhibitörleri gibi) birkaç önemli açıdan temel olarak farklıdır: Mekanik olarak, CRISPR gen düzenleme yoluyla kalıcı genetik modifikasyonlar sağlarken, RNAi gen ekspresyonunu yalnızca geçici olarak baskılar ve küçük molekül inhibitörleri protein fonksiyonunu geri dönüşümlü olarak bloke eder28,29. Özgüllük açısından, CRISPR, doğru DNA hedeflemesi yoluyla üstün hassasiyet gösterirken, RNAi hedef dışı etkilereeğilimlidir 3,5. Etki süresi ile ilgili olarak, CRISPR, geleneksel yöntemlerin geçici müdahalelerine kıyasla kalıcı genetik değişiklikler yaratır. Ayrıca, CRISPR, genom çapında tarama yetenekleri sağlar ve çeşitli hücre tiplerinde yüksek verimliliği korurken aynı anda birden fazla geni/yolu araştırabilir9. Geleneksel yaklaşımlar tipik olarak spesifik yol analizi ile sınırlıdır ve genellikle belirli hücre hatlarında azaltılmış etkinlik gösterir3. Bu ayırt edici özellikler, CRISPR taramasını, özellikle geleneksel tarama metodolojilerine göre benzersiz avantajlar gösterdiği uzun süreli gözlem veya kesin genetik düzenleme gerektiren çalışmalarda, fonksiyonel genomik araştırma ve hedef keşfi için özellikle değerli kılmaktadır.
Bununla birlikte, bu işlemin özgüllüğü mutlak değildir ve Cas9 proteininin, amaçlanan hedef dizi5'e benzer ancak tamamen aynı olmayan DNA bölgelerini hatalı bir şekilde tanıması ve parçalaması mümkündür. Bu durum genellikle hedef dışı etkiler olarak adlandırılır. Bu istenmeyen DNA bölünmesi, özellikle insan terapisinde uygulandığında genomik kararsızlığa ve öngörülemeyen genetik sonuçlara yol açabilir. CRISPR teknolojisi, karmaşık genomik düzenleme görevleriyle uğraşırken de mücadele eder. Çok sayıda geni, gen kümesini veya karmaşık genetik ortamları kapsayan düzenleme talepleriyle karşı karşıya kaldığında, CRISPR sistemi, düzenleme işleminin sonuçlarını tam olarak tahmin etme ve yönlendirmede sınırlamalar yaşayabilir1.
CRISPR teknolojisini kullanarak genom çapında tarama yapmanın önündeki birincil teknik engel, on binlerce geni kapsayan genomun büyük karmaşıklığından kaynaklanmaktadır ve bu nedenle hedef dışı etki riskini önemli ölçüde artırmaktadır9. Sonraki dizileme sonuçlarının bütünlüğünü ve güvenilirliğini sağlamak için, her hücrenin tekil bir sgRNA23 ile transfekte edilmesi zorunludur. Bu, MOI'nin deneyci tarafından titiz bir şekilde kontrol edilmesini gerektirir ve aynı zamanda en az 500 veya daha büyük olması gereken yeterli bir kopya sayısı eşiğini korurken aynı zamanda 0,5'in altında kalmasını sağlar24. Tüm genomdaki on binlerce genin her birinin 4-6 sgRNA'nın kullanılmasını gerektirdiği gerçeği göz önüne alındığında, tüm tarama süreci geniş miktarda hücre gerektirir25. Deneyin uzun süresi, ilgili hücre sayısının önemli olması ve yüksek risk, deneycinin bu endişeleri hafifletmek için stratejiler geliştirmesini gerektirir26. Potansiyel genlerin, RNA-seq ile daha fazla doğrulanması ve ayrıca hem kazanç hem de fonksiyon kaybı tahlilleri ile doğrulanması gerekir. Aşağıdaki deneylerde, CRISPR düzenlemesi kullanılarak tanımlanan genlerin aşırı ekspresyon ve nakavt hücreleri elde edildikten sonra, özellikle spesifik olmayan Cas9 bölünmesine maruz kalabilen kısmi sgRNA tamamlayıcılığına sahip lokuslarda potansiyel hedef dışı değişikliklere erişmek için genom çapında genomik ve transkriptomik gerçekleştirildi. COSMID gibi biyoinformatik tahmin araçları, yüksek riskli hedef dışı sitelerin belirlenmesine yardımcı olabilir. Kurtarma tahlilleri, tanımlanan genlerin katılımının özgüllüğünü sağlamak için de kullanılabilir.
Sonraki analizde, diferansiyel olarak ifade edilen sgRNA'lar için kriterler, MAGeCK tarafından hesaplanan ve istatistiksel anlamlılık, kat değişimi ve replikasyon tutarlılığını içeren sağlam sıra toplama (RRA) puanına dayanıyordu31,32. Bir veri kümesi için, her gen, gen ekspresyon seviyelerini ve istatistiksel anlamlılığı birleştiren kapsamlı kriterlere göre sıralanır. RRA, tüm veri kümelerindeki her bir genin kapsamlı sıralamasının durumunu değerlendirmek için Spearman'ın sıralama için sıra korelasyon katsayısını kullanır ve çoklu gen ifadesi veri kümelerinin sıralama sonuçlarını entegre eder. Veri kümelerinin çoğunda nispeten yüksek bir dereceye sahip bir gen, diferansiyel olarak ifade edilen gerçek bir gen olarak kabul edilebilir33. RRA'nın p değerinin 0.05'ten küçük olması istatistiksel olarak anlamlı kabul edildi. En az 1,5 kat artış veya %33'lük bir azalma kat değişimi, farklı bir ifade olarak kabul edildi. Ek olarak, 3 bağımsız tekrarın tutarlılığının istatistiksel olarak farklı bir ifade olarak kabul edilmesi gerekiyordu. Temel genler için RRA sıralamasından sonra, daha düşük bir RRA puanı daha yüksek önemi ifade eder.
Genom düzenleme için güçlü bir araç olan CRISPR-Cas9 teknolojisi, radyodirenç alanını araştırmada benzersiz bir potansiyel ve doğruluk göstermektedir26,27. Bununla birlikte, uygulamasının hala sınırlamaları vardır. Hedef dışı etki riskinin yanı sıra, radyosensitivite ile ilişkili karmaşıklıklar tarama sürecine karmaşıklıklar getirmektedir27. Bu duyarlılık sadece tek bir gen tarafından yönetilmez, daha ziyade birden fazla gen ve onların düzenleyici ağları arasındaki karmaşık etkileşimin bir sonucu olarak ortaya çıkar26. Bu nedenle, radyosensitivite ile ilgili spesifik genlerin başarılı bir şekilde tanımlanmasına rağmen, bunlar daha geniş resmin yalnızca bir kısmını temsil edebilir ve altta yatan mekanizmaları kapsamlı bir şekilde aydınlatmak için önemli zorluklar ortaya çıkarabilir 34,35,36. Düşük enfeksiyon verimliliği, sgRNA bozulması ve sıralama hatası gibi CRISPR ekranındaki yaygın sorunların çözümleri şunlardır: CRISPR ekranı <0.5'lik bir MOI değeri gerektirdiğinden, hücre durumu ayarlaması, hücrelerin logaritmik bir büyüme fazında olmasını sağlamak veya floresan tahlilleri yoluyla enfeksiyon verimliliğini değerlendirmek için kritik öneme sahiptir; sgRNA bozunmasının potansiyel nedenleri arasında nükleaz kontaminasyonu veya vektör tasarım kusurları bulunur, bu nedenle sgRNA kitaplıklarının tekrarlanan donma-çözülme döngülerinden kaçınılmalıdır (alikotları -80 °C'de saklayın) ve sgRNA kitaplığı bütünlüğünü doğrulamak için NGS dizilimi kullanılmalıdır; dizileme hatası, yetersiz dizileme derinliğinden veya sgRNA primer tasarım sorunlarından kaynaklanabilir, önerilen dizileme derinliği >500× kapsamı 37,38,39,40,41,42 olan sgRNA dizi tanımlama doğruluğunu iyileştirmek için eşleştirilmiş uç dizilemesi önerilir.
Radyoterapi, kanser tedavisinde bir mihenk taşı olmaya devam etmektedir, ancak farklı tümör tiplerinde ve hatta aynı kansere sahip hastalar arasında terapötik etkinlikte dikkate değer bir değişkenlik göstermektedir9. Bu bireyler arası heterojenlik, optimal tümör eradikasyonunu sağlamak için sıklıkla kombinasyon tedavileri gerektirir11,12. Klinik uygulamada, radyoterapinin immünoterapi ile entegrasyonu - özellikle immün kontrol noktası inhibitörleri ve antikor-ilaç konjugatları - belirgin bir terapötik paradigma olarak ortaya çıkmıştır19. Bu protokol, in vivo tümörlerin genetik ve epigenetik heterojenliğini tam olarak yansıtamayan nispeten homojen bir kanser hücre hattı kullanan bir in vitro CRISPR ekranı sunar. Tarama için uygun radyasyon dozunu belirledikten sonra, sonuçlar hem in vitro hücresel deneylerde hem de in vivo hayvan modellerinde daha fazla doğrulanması gereken potansiyel radyosensitif veya radyodirençli genler sağlar. Ayrıca, in vivo CRISPR ekranı ve tek hücreli transkriptomik, tümör heterojenliğinin karmaşıklığını deşifre etmede yardımcı olabilir. İn vitro CRISPR ekranı, hücreler içindeki DNA hasar onarımında ve radyasyona yanıt olarak otokrin mekanizmalarda önemli genleri tanımladı, ancak aslında TME heterojenini tam olarak kopyalamadı. Örneğin, hipoksi ROS üretimini arttırır, metabolik adaptasyonu, antioksidan oluşumunu ve otofaji aktivasyonunu uyaran bir geri besleme döngüsünü tetikler ve sonuçta radyodirenci teşvik eder18. Radyasyondan sonra parakrin mekanizmada bağışıklık hücreleri aktive edilebilir ve bu da radyosensitiviteyi indükleyebilir14. ECM, büyüme faktörleri için bir rezervuar görevi görür ve sitokinlerin radyosensitivite21 üzerinde hem olumlu hem de olumsuz etkileri vardır. İn vivo CRISPR ekranı, TME'nin heterojenliğini yansıtacak şekilde yapılmalıdır. Ayrıca, in vitro CRISPR taraması, yalnızca hücreler içindeki DNA hasarı onarımında ve ayrıca radyasyona yanıt olarak otokrin mekanizmalarda önemli genleri tanımlayabilir, ancak tümör vaskülatürü ve sistemik etkiler dahil olmak üzere radyosensitivite üzerindeki in vivo etkiyi tam olarak yakalayamadı20,21. İn vivo CRISPR ekranı, in vivo radyosensitivite ile ilgili potansiyel faktörleri belirlemek için yapılmalıdır.
Burada, radyoterapiye duyarlılık veya dirençte rol oynayan genleri belirlemek için CRISPR genom çapında taramayı kullanmayı amaçlayan kapsamlı bir protokol tasarlanmıştır. Bu metodoloji, yeni yolları çözerek, tümör radyoterapi araştırmalarındaki ilerlemelerin önünü açmayı amaçlamaktadır. Bu protokol aynı zamanda kemoterapide klinik kısıtlama mekanizmalarını ve alternatif terapötik ajanların ilerlemesini araştırmak için bir referans görevi görebilir. Özetle, CRISPR teknolojisi önemli bir potansiyel ve değer barındırmaktadır, ancak doğal kısıtlamaları, ayık tanımanın ve mantıklı bir yaklaşımın önemini vurgulamaktadır. Gelecekteki araştırma ve uygulamalar incelenirken, kısıtlamalarının üstesinden gelmek ve tam potansiyelinden yararlanmak için CRISPR teknolojisini keşfetmek ve optimize etmek için durmaksızın çaba sarf etmek zorunludur.
Açıklamalar
Hiç kimse.
Teşekkürler
Bu çalışma, Hubei Eyaleti Bölgesel Bilim ve Teknoloji İnovasyon Projesi (2024EIA001) ve Wuhan Üniversitesi Zhongnan Hastanesi (PTXM2025001) Tıp Bilimi ve Teknoloji İnovasyon Platformu İnşaat Desteği Projesi tarafından desteklenmiştir. Şekil 1 , Figdraw kullanılarak oluşturulmuştur.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 150 mm cell and tissue culture dish | Wuxi NEST Biotechnology Co., Ltd. | 715011 | Cell culture |
| 35 mm cell and tissue culture dish | Wuxi NEST Biotechnology Co., Ltd. | 706011 | Cell culture |
| A549 cell line | ATCC | - | - |
| Cell counting kit-8 | Shanghai Beyotime Biotech Inc | C0041 | For cell viability assay |
| CO2-independent medium | PHCbi | MCO-50AIC | Cell culture |
| Countess 3 FL automated cell counter | Themo Scientific | AMQAF2001 | For cell counting |
| EDTA | Gibco | 25200056 | Cell culture |
| Fetal bovine serum | Gibco | 10099141 | Cell culture |
| Fluorescence microscopy | LEICA | ebq 100-04 | For fluorescence microscope |
| Genome-wide CRISPR lentiviral library | Shanghai OBiO Technology Co., Ltd. | H5070 | For lentiviral infection |
| MiniAmp plus PCR | Themo Scientific | C37835 | For PCR amplification |
| NEST cell culture plates, 12-well | Wuxi NEST Biotechnology Co., Ltd. | 712002 | Cell culture |
| NEST cell culture plates, 6-well | Wuxi NEST Biotechnology Co., Ltd. | 703002 | Cell culture |
| NEST cell culture plates, 96-well | Wuxi NEST Biotechnology Co., Ltd. | 701001 | Cell culture |
| PBS | Gibco | C10010500BT | Cell culture |
| PCR forward primer (AATGGACTATCATATGCTTACCGTAACTTGAAAGTATTTCG) | Beijing AuGCT Biotech Co., Ltd. | - | For PCR amplification |
| PCR reverse primer (GATGTGCGCTCTGCCCACTGACGGGCA) | Beijing AuGCT Biotech Co., Ltd. | - | For PCR amplification |
| Polybrene | Shanghai Beyotime Biotech Inc | C0351 | For lentiviral infection |
| Puromycin | MCE | HY-K1057 | For seletion post lentiviral infection |
| RPMI 1640 cell culture medium | Gibco | 23400-021 | Cell culture |
| TIANGENamp genomic DNA kit | Beijing TIANGEN Biotech Co.,Ltd. | DP304 | For genomic DNA extraction |
| X-ray powder diffractometer | PerkinElmer | For radiotherapy |
Referanslar
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır