Method Article
شاشة كريسبر على مستوى الجينوم للكشف عن الجينات الحساسة للإشعاع والمقاومة للإشعاع
* These authors contributed equally
In This Article
Summary
يتم إعطاء نهج دقيق ومنظم لاختيار جينات الإشعاع المقاومة والحساسة من خلال تطبيق طريقة شاشة CRISPR / Cas9 على مستوى الجينوم. هذا البروتوكول لديه أيضا القدرة على العمل كإطار متعدد الاستخدامات للمساعي البحثية الأخرى التي تبحث في آليات مقاومة الأدوية الكيميائية التي يتم تناولها سريريا.
Abstract
تم تسخير نظام CRISPR-Cas9 وإعادة استخدامه في أداة قوية لتحرير الجينوم. من خلال الاستفادة من هذه التكنولوجيا ، يمكن للباحثين قص تسلسل الحمض النووي ولصقه وحتى إعادة كتابته بدقة داخل الخلايا الحية. ومع ذلك ، فإن تطبيق تقنية شاشة كريسبر يتجاوز مجرد التجريب. إنه بمثابة أداة محورية في مكافحة الأمراض الوراثية ، وتشريح المناظر الطبيعية الجينية المعقدة بشكل منهجي ، وتمكين الباحثين من كشف الآليات الجزيئية الكامنة وراء الظواهر البيولوجية ، وتمكين العلماء من تحديد واستهداف الأسباب الجذرية للأمراض مثل السرطان والتليف الكيسي وفقر الدم المنجلي. من بين كل شيء ، يشكل السرطان تحديا هائلا للطب ، مما يحفز جهود الاستئصال. العلاج الإشعاعي ، كعلاج تقليدي ، يحقق نتائج ولكن له قيود. يقضي على الخلايا السرطانية ولكنه يضر أيضا بالأنسجة السليمة ، مما يتسبب في آثار ضارة تقلل من جودة الحياة. بالإضافة إلى ذلك ، لا تستجيب جميع الخلايا السرطانية للعلاج الإشعاعي ، وقد يصاب بعضها بمقاومة ، مما يؤدي إلى تفاقم الحالة. لمعالجة هذا الأمر ، تم تقديم تقنية شاشة كريسبر الشاملة للجينوم الكامل ، لأنها تتيح التعرف الفعال على الجينات الحساسة للإشعاع والمقاومة للإشعاع ، وبالتالي تطوير مجال أبحاث السرطان وعلاجه. تم إجراء فحص كريسبر على مستوى الجينوم في خلايا سرطان الرئة المعرضة للإشعاع باتباع البروتوكول الموصوف ، والذي تم من خلاله تحديد الجينات المرتبطة بالمقاومة الإشعاعية والحساسية للإشعاع.
Introduction
يتشابك التحقيق في الظواهر البيولوجية بطبيعته مع دراسة السلوكيات الخلوية ، وبالتالي يرتبط فحص السلوكيات الخلوية بشكل أساسي باستكشاف جينومها. مع استمرار تطور التكنولوجيا الحديثة ، يعيد الباحثون الطبيون توجيه انتباههم تدريجيا نحو تغيير السلوكيات الخلوية عن طريق تحرير الجينات من أجل تعزيز نتائج علاج الأمراض المختلفة. في هذا الصدد ، ظهرت تقنية التكرارات المتجانسة القصيرة المتباعدة بانتظام (CRISPR) كأداة ثورية لتحرير الجينوم نظرا لتطبيقها البسيطنسبيا 1. يتكون نظام CRISPR-Cas9 من نوكلياز Cas9 والحمض النووي الريبي أحادي التوجيه (sgRNA) ، والذي يتعرف على وجه التحديد على تسلسل الحمض النووي المستهدف ويرتبط به ، ويوجه نوكلياز Cas9 للقطع في هذا الموقع ، مما يؤدي إلى كسر مزدوج الخيط (DSB) في الحمض النووي للجينوم2،3،4. بالإضافة إلى ذلك ، يمكن أن يؤدي إدخال مواد أخرى إلى عمليات إدخال أو حذف أو طفرات محددة في الجينوم ، مما يتيح تحرير الجينات المستهدف.
في أبحاث الجينوم الوظيفي ، كانت شاشة تداخل الحمض النووي الريبي (RNAi) في يوم من الأيام طريقة مستخدمة على نطاق واسع لإجراء تجارب فقدان الوظيفة على نطاق واسع للتحقيق في أدوار الجينات في السرطان. تدرس تقنية RNAi وظيفة الجينات عن طريق إسكات الجينات المستهدفة على وجه التحديد ، مما يساعد الباحثين على تحديد العوامل السرطانية الحرجة. ومع ذلك ، فهو محدود بالتأثيرات غير المستهدفة وكفاءة الضربة القاضية غير المكتملة للجينات. قد تؤدي التأثيرات غير المستهدفة إلى إسكات الجينات الأخرى غير المستهدفة ، مما يعرض دقة وموثوقية النتائج التجريبيةللخطر 1،2. بالإضافة إلى ذلك ، يظهر RNAi كفاءة ضربة قاضية منخفضة لجينات معينة ، مما قد يفشل في قمع التعبير الجيني المستهدف تماما. على عكس شاشات RNAi التقليدية ، تظهر شاشة CRISPR خصوصية وكفاءةأعلى 3. لا تتيح هذه التقنية التحرير الدقيق لجينات معينة فحسب ، بل تسمح أيضا بالفحص على نطاق واسع على مستوى الجينوم ، مما يوفر دعما قويا لأبحاث وظائف الجينات. تستخدم تقنية شاشة كريسبر ، وهي أداة قوية لتحرير الجينات تعتمد على نظام CRISPR-Cas9 ، للفحص الفعال والكشف عن وظائف غير معروفة لجينات معينة في الخلايا5،6،7،8. يقوم الباحثون بتصميم sgRNAs على دفعات لجينات أو مناطق جينية معينة ، وإعداد مكتبات sgRNA المقابلة بدقة ودقة ، مما يضمن سلامتهاووظائفها 9. ثم يتم تغليف مكتبات sgRNA هذه في جزيئات فيروسات ، والتي تستخدم لإصابة الخلايا المضيفة بكفاءة. بعد العدوى الناجحة ، تتم زراعة الخلايا المصابة في ظل ظروف فحص محددة شخصيا. عند الفحص ، يتم استخراج الحمض النووي الجيني للخلايا التي تم فحصها ، مع الحفاظ على معايير عالية من النقاء والكمية. بعد ذلك ، تخضع المناطق المستهدفة ذات الاهتمام ب sgRNA لتضخيم تفاعل البوليميراز المتسلسل ، وهي عملية تكرر بدقة الأجزاء المرغوبة من الأحماض النووية3،9. أخيرا ، يتم إجراء تسلسل عالي الإنتاجية على شظايا الحمض النووي المضخمة ، مما يتيح تحليلا شاملا وفعالا للمناطق المستهدفة ، وبالتالي توفير رؤى قيمة حول وظيفة وسلوك الجينات قيد الدراسة4.
يشكل السرطان تهديدا هائلا لصحة الإنسان باعتباره مرضا معقدا. في جميع أنحاء العالم ، يبذل الباحثون والأطباء جهودا متضافرة لكشف الآليات الجزيئية للتسرطن وتطوير استراتيجيات علاجية جديدة. تم إنشاء تعاون دولي لتسريع ترجمة نتائج البحوث الأساسية إلى تطبيقات سريرية ، بهدف نهائي هو تحسين نتائج المرضى. اقترح ساسمال وآخرون استراتيجية تجميع متعامدة حيوية تعتمد على نظام مضيف ضيف اصطناعي للاستهداف الدقيق للخلايا السرطانية النقيلية ، مما ساعد بشكل كبير عشرات العلماء في تطوير التقنيات الطبية. يتمتع عملهم البحثي المتميز بابتكار عال ورؤى فريدة ، مما يقدمون مساهمات ذات مغزى للمجتمع العلمي10. يتميز السرطان بالحالة المضطربة لعدم الاستقرار الجيني ، الناشئة عن التنظيم غير المنتظم لاستجابات تلف الحمض النووي 11-14. يشمل تلف الحمض النووي عيوب أحادية النيوكليوتيدات ، وفواصل أحادية الخيط ، و DSBs. يشارك إعادة التركيب المتماثل (HR) والانضمام النهائي غير المتماثل (NHEJ) في إصلاح DSBs في مراحل مختلفة15،16،17. على هذا الأساس ، برز العلاج الإشعاعي كخيار علاجي قابل للتطبيق ، والذي يستخدم أشعة عالية الطاقة (مثل الأشعة السينية والأشعة γ) لإشعاع أنسجة الورم ، مما يتسبب في تلف الحمض النووي في الخلايا السرطانية ، وبالتالي تعطيل نموهاوتكاثرها 18. ومع ذلك ، فإن العلاج الإشعاعي لا ينتج عنه دائما الآثار المرجوة في نسبة كبيرة من مرضى السرطان ، مما قد ينتج عن أضرار للأنسجة شبه سرطانية والقيود التي تفرضها الخصائص المتأصلة في الورم ، مثل انخفاض الحساسية للعلاج الإشعاعي19،20،21.
من الناحية النظرية ، يمكن استخدام أي نوع من الخلايا لشاشة كريسبر. ومع ذلك ، فإن الحفاظ على تمثيل كاف في المجموعات السكانية المتحولة يتطلب عددا كبيرا من خلايا البداية. أنواع الخلايا ذات الوفرة المنخفضة ليست مناسبة بشكل خاص للشاشة على مستوى الجينوم. بالنسبة لاختيار المكتبة ، تحتوي معظم المكتبات على 3-6 gRNAs لكل جين مستهدف ، والحفاظ على توزيع كل gRNA داخل السكان أمر بالغ الأهمية18. قد يؤدي فقدان التمثيل بسبب تخصيب أو استنفاد gRNAs معينة إلى توزيع غير متساو للنتائج. لمعالجة هذه المشكلة ، قد يكون اختيار مكتبات كريسبر المتاحة تجاريا والتي تم اختبارها في السوق خيارا مفضلا20. في المختبر قد لا تلتقط شاشة كريسبر التي تستخدم خطوط الخلايا السرطانية المتجانسة بشكل كامل عدم التجانس الجيني واللاجيني للأورام في الجسم الحي . بينما كشفت الشاشة في المختبر عن الجينات الرئيسية المشاركة في إصلاح تلف الحمض النووي والإشارات الأوتوكرينية الناجمة عن الإشعاع ، إلا أنها لم تكرر بشكل كامل البيئة المكروية للورم ، بما في ذلك المقاومة الإشعاعية الناجمة عن نقص الأكسجة (عبر ROS ، والتكيف الأيضي ، والالتهام الذاتي) ، وتأثيرات الباراكرين بوساطة المناعة ، وتعديل السيتوكين المعتمد على ECM. قبل استخدام شاشة كريسبر لاستكشاف الجينات المرتبطة بحساسية الإشعاع أو مقاومته ، يجب مراعاة هذه العوامل بعناية. في ضوء المشهد العلاجي الحالي ، من الضروري تحديد العوامل المرتبطة بالمقاومة الإشعاعية والحساسية الإشعاعية ودراستها بعمق لتعزيز فعالية العلاج الإشعاعيبشكل فعال 22. نظرا للميزة الرئيسية لشاشة كريسبر في دراسة وظائف الجينات غير المعروفة ، يتم توفير تقنية شاشة كريسبر كاملة الجينوم المفصلة بشكل منهجي لتحديد الجينات الحساسة للإشعاع والمقاومة للإشعاع بكفاءة.
Protocol
الكواشف والمعدات المستخدمة في هذه الدراسة مدرجة في جدول المواد.
1. اختيار جرعة مناسبة من الإشعاع
- تحضير وطلاء الخلايا الملتصقة
- اضبط كثافة الخلية على 5 × 105 خلايا لكل مل باستخدام وسط زراعة الخلايا الكامل RPMI 1640 الذي يحتوي على 10٪ FBS للمرور ونمو الخلايا. توزيع الخلايا في أطباق استزراع 3.5 سم للإشعاع بجرعات مختلفة. أضف 2 مل (1 × 106 خلايا) إلى كل طبق واحتضنه طوال الليل عند 37 درجة مئوية مع 5٪ ثاني أكسيدالكربون 2.
- تطبيق جرعات إشعاعية مختلفة
- قم بترقيم أطباق الثقافة مقاس 3.5 سم من 1 إلى 5. استخدم المجموعة #1 كمجموعة تحكم ، مع تعيين المجموعات الأربع المتبقية كمجموعات علاجية.
- أغلق حواف الألواح المكونة من 6 آبار بغشاء مانع للتسرب لمجموعات العلاج وقم بإعطاء جرعات إشعاعية من 2 و 4 و 6 و 8 Gy على التوالي. بعد العلاج ، أعد الأطباق إلى الحاضنة.
- طلاء خطوط الخلايا بعد الإشعاع
- تحضير أطباق 6 بئر و 96 بئر. اغسل الخلايا في أطباق الاستزراع مقاس 3.5 سم مرة واحدة باستخدام PBS ، وهضم الخلايا التي تنمو لوغاريتميا بنسبة 0.25٪ تربسين ، واضبط كثافة الخلية على 1 × 105 خلايا لكل مل مع وسط كامل RPMI 1640 يحتوي على 10٪ FBS.
- قم بزرع 10 ميكرولتر / بئر (1,000 خلية / 100 ميكرولتر) في الألواح المكونة من 6 آبار بمعدل 3 تكرارات لكل جرعة إشعاعية. أضف 2 مل من الوسط الكامل لكل بئر وعد بعد 14 يوما (عندما تحتوي كل مجموعة استنساخ على ما يقرب من 50 خلية).
- قم بزرع 30 ميكرولتر / بئر (3,000 خلية / 100 ميكرولتر) في ألواح 96 بئرا بمعدل 5 تكرارات لكل جرعة إشعاعية. أضف 70 ميكرولتر من الوسط الكامل إلى كل بئر وقم بقياس بقاء الخلية بعد 72 ساعة.
- قياس صلاحية الخلية
ملاحظة: معدل تثبيط الاستمغناء = 1 - (عدد المستنسخة في مجموعة العلاج / عدد المستنسخة في المجموعة الضابطة) × 100٪. يستخدم اختبار CCK-8 ملح التيترازوليوم القابل للذوبان في الماء (WST-8) الذي يمكن تقليله عن طريق نازعة الهيدروجين الخلوية لتوليد منتج فورمازان أصفر عالي الذوبان في الماء11. تتناسب كمية الفورمازان المنتجة طرديا مع عدد الخلايا القابلة للحياة ، وكثافته البصرية (المقاسة بطول موجي 450 نانومتر) تعكس بدقة نشاط التمثيل الغذائي الخلوي وحالة التكاثر11،13. بناء على هذا المبدأ الراسخ ، تم اعتماد اختبار CCK-8 على نطاق واسع لتطبيقات مختلفة ، بما في ذلك فحوصات تكاثر الخلايا واختبارات حساسية الأدوية للورم. في هذا البروتوكول ، يتم استخدام اختبار CCK-8 لتقييم الجدوى الخلوية بشكل منهجي تحت جرعات إشعاع مختلفة.- امزج كاشف CCK8 مع وسيط RPMI 1640 بدون FBS بنسبة 1: 9. تخلص من الوسط في الألواح المكونة من 96 بئرا وأضف 100 ميكرولتر من الوسط المحتوي على CCK8 إلى كل بئر.
- احتضن في الظلام لمدة 1 ساعة وقم بقياس قيمة OD عند 450 نانومتر باستخدام قارئ صفيحة دقيقة.
ملاحظة: معدل بقاء الخلية = [(قيمة OD لمجموعة المعالجة - قيمة OD للبئر الفارغ) / (قيمة OD لمجموعة التحكم - قيمة OD للبئر الفارغ)] × 100٪
- اختيار جرعة الإشعاع
- دمج معدل تثبيط الاستمراض مع معدل بقاء الخلية من أجل تحديد جرعة إشعاعية مناسبة بناء على احتياجات البحث. حدد جرعة إشعاعية بمعدل تثبيط 50٪ لفحص كل من الجينات المقاومة للإشعاع والحساسة للإشعاع.
2. اختيار وزارة الداخلية المناسبة وتركيز بورومايسين
- طلاء الخلايا الملتصقة
- اضبط كثافة الخلية على 3 × 105 خلايا لكل مل وتلقيح 1 مل (3 × 105 خلايا) لكل بئر في صفيحة 12 بئر. احتضان اللوحة طوال الليل عند 37 درجة مئوية مع 5٪ ثاني أكسيد الكربون2.
- عدوى العدسات
- استخدم ماصة لشفط الوسط من الصفيحة المكونة من 12 بئرا واستبدله ب 1 مل من الوسط الكامل RPMI 1640 الذي يحتوي على 10٪ FBS. قم بإعداد مكتبة CRISPR للفيروسات اللونسية كاملة الجينوم التي تم فحصها بالجودة (يوصى بالمكتبات المتاحة تجاريا) وقم بإعداد تدرج تركيز لوغاريتمي (على سبيل المثال ، 0-10-50-100-200-400-800) 4،5،6،7،8.
- أضف الكمية المقابلة من فيروس العدسات إلى 2 ميكرولتر / طبق من البوليبرين وتوازن في درجة حرارة الغرفة لمدة 5 دقائق. قم بتقطير خليط العدسات والبوليبرين ببطء في كل بئر ، واخلطه جيدا ، واحتضنه طوال الليل عند 37 درجة مئوية مع 5٪ ثاني أكسيد الكربون2.
- تحديد الحد الأدنى لتركيز البيرومايسين لقتل الخلايا
- اضبط كثافة الخلايا الأبوية على 3 × 105 خلايا / مل وتلقيح 1 مل (3 × 105 خلايا) لكل بئر في صفيحة 12 بئر. احتضان اللوحة طوال الليل عند 37 درجة مئوية مع 5٪ ثاني أكسيد الكربون2.
- أضف بورومايسين إلى كل بئر من الصفيحة المكونة من 12 بئرا في تدرج تركيز 0-0.1-0.2-0.5-1-2-4-8 ميكرومتر. عد الخلايا بعد 72 ساعة. الحد الأدنى للتركيز الذي يقتل جميع الخلايا في البئر هو الحد الأدنى لتركيز البيرومايسين لقتل الخلايا ، والذي سيتم استخدامه للفحص اللاحق للخلايا المصابة بالفيروس.
- اختيار بوروميسين بعد الإصابة
- في اليوم الثاني بعد الإصابة ، قم بشفط الوسط من كل بئر واستبدله ب 1 مل من وسط RPMI 1640 الكامل الذي يحتوي على 10٪ FBS. استمر في الاستزراع لمدة 48 ساعة.
- بعد 72 ساعة من الإصابة ، استبدل الوسط الموجود بوسط كامل يحتوي على الحد الأدنى من تركيز بورومايسين لقتل الخلايا. قم بإعداد 2 بئر في صفيحة 12 بئرا بدون عدوى فيروسية كضوابط سلبية وإيجابية. عالج السيطرة السلبية بالبورومايسين ، واترك السيطرة الإيجابية دون علاج. استمر في الاستزراع لمدة 72 ساعة.
- بعد 72 ساعة من اختيار بورومايسين ، ستموت جميع الخلايا الأبوية في التحكم السلبي ، بينما تظهر الخلايا الأبوية في التحكم الإيجابي الحد الأدنى من الموت. احسب سبل التنفيذ لكل بئر.
ملاحظة: وزارة الداخلية = (عدد الخلايا في المجموعة المصابة بالفيروس / عدد الخلايا في مجموعة التحكم الإيجابية) × 100٪. استخدم تركيز الفيروس مع وزارة الداخلية ~ 0.3 للفحص اللاحق.
3. عدوى مكتبة CRISPR الفيروسية على مستوى الجينوم
- بذر خطوط الخلايا الملتصقة
- اضبط كثافة الخلية على 1 × 107 خلايا لكل مل في وسط RPMI 1640 الكامل الذي يحتوي على 10٪ FBS للمرور ونمو الخلايا. تلقيح 1 مل من الخلايا (1 × 107 خلايا) في كل طبق استزراع 15 سم عند 37 درجة مئوية مع 5٪ ثاني أكسيد الكربون2 لمدة 8 ساعات. بمجرد أن تلتصق الخلايا وتصل إلى التقاء 70٪ -80٪ ، كانت جاهزة للعدوى الفيروسية (مما يجعل رقم النسخة حوالي 500).
- عدوى العدسات
- استنشق الوسط من أطباق الاستزراع مقاس 15 سم واستبدله ب 15 مل من الوسط الكامل RPMI 1640 الذي يحتوي على 10٪ FBS. قم بإعداد مكتبة فيروسات عدسية كاملة الجينوم CRISPR تم فحصها بالجودة.
- أضف الكمية المقابلة من فيروس العدسات مع وزارة الداخلية = 0.3 إلى 30 ميكرولتر / طبق من البوليبرين وتوازن في درجة حرارة الغرفة لمدة 5 دقائق ، وقم بتقطير خليط العدسات والبوليبرين ببطء في أطباق الاستزراع مقاس 15 سم ، واخلطها جيدا ، واحتضانها عند 37 درجة مئوية مع 5٪ ثاني أكسيدالكربون 2 بين عشية وضحاها. في نفس الوقت ، قم بإعداد طبق ثقافة بطول 15 سم مع الخلية الأبوية على النقيض من ذلك.
- اختيار بوروميسين بعد الإصابة
- في اليوم الثاني بعد الإصابة الفيروسية ، قم بشفط الوسط من أطباق الاستزراع مقاس 15 سم واستبدله ب 15 مل من الوسط الكامل RPMI 1640 الذي يحتوي على 10٪ FBS. استمر في الاستزراع لمدة 48 ساعة.
- بعد 72 ساعة من الإصابة، يستبدل الوسط بوسط كامل يحتوي على الحد الأدنى من تركيز البيرومايسين. تعامل مع الخلايا الأبوية غير المصابة كعنصر تحكم سلبي بنفس الطريقة واستمر في الزراعة لمدة 72 ساعة. بعد 72 ساعة من اختيار بورومايسين ، سيتم قتل جميع الخلايا الأبوية في مجموعة التحكم السلبية ، وتعتبر الخلايا الباقية من عدوى الفيروس الحجري مصابة بنجاح.
- استخراج جينوم اليوم 0
- قم بهضم الخلايا من طبق استزراع واحد مقاس 15 سم باستخدام 0.25٪ تربسين ، وأعد تعليقه في وسط RPMI 1640 الكامل الذي يحتوي على 10٪ FBS ، واحسب رقم الخلية. قم بتسمية هذه العينة على أنها اليوم 0.
- جهاز طرد مركزي عند 300 × جم لمدة 5 دقائق (في درجة حرارة الغرفة) وتخلص من المادة الطافية. قم بإعادة التعليق في 1 مل من PBS ، وجهاز الطرد المركزي عند 300 × جم لمدة 5 دقائق ، وتخلص من المادة الطافية. استخرج الحمض النووي الجيني لليوم 0 ، وقم بقياس تركيز الحمض النووي ونقاءه باستخدام مقياس الطيف الضوئي للأشعة فوق البنفسجية النانوية.
- للكشف عن سلامة sgRNA ، استخدم الرحلان الكهربائي لهلام الاغاروز لتحليل مكتبة sgRNA المضخمة ، مما يضمن أن النطاقات كانت واضحة ولا يوجد تدهور كبير ، وبالتالي الحفاظ على سلامة المكتبة23. لتقييم تغطية مكتبة العدسات الفيروسية ، استخدم تقنية التسلسل العميق لإجراء تحليل التسلسل على sgRNAs داخل المكتبة24،25.
- في شاشة CRISPR ، يعمل تضخيم PCR كتحقق أولي لسلامة جزء sgRNA وجودةالمكتبة 6. لتحليل تغطية المكتبة وأنماط توزيع sgRNA بشكل أكثر شمولا ، ولضمان التمثيل المناسب ل sgRNAs لكل جين مستهدف أثناء الفحص ، قم بإجراء NGS للحصول على رؤى متعمقة حول متانة الشاشة9.
ملاحظة: من خلال اكتشاف التغييرات في وفرة الحمض النووي الريبي الحمض النووي الريبي قبل وبعد الفحص ، وتحديد تكامل sgRNA المحتمل خارج الهدف أو تلوث المكتبة ، يمكن تحسين دقة وموثوقية شاشة كريسبر بشكل أكبر. تعمل عينات اليوم 0 هذه كضوابط سلبية حاسمة وتخضع لتقييم شامل للجودة من خلال تضخيم تفاعل البوليميراز المتسلسل و NGS لتحقيق هدفين رئيسيين: (1) تأكيد استنفاد الجينات الأساسية (مما يشير إلى تمثيل مناسب للمكتبة) ، و (2) إظهار التعبير المستقر في الجينات غير الأساسية (إنشاء ظروف خط الأساس التجريبية) 9. - التأكد من وصول التغطية إلى المستوى المتوقع لضمان تنوع المكتبة وتمثيلها وتجنب التحيز في عملية الفرز. لقياس كفاءة العدوى ، استخدم التصوير الفلوري لتقييم كفاءة العدوى ، والتأكد من أنه يلبي متطلبات التجربة.
4. تطبيق الإشعاع كشرط فحص
- تجميع
- اضبط كثافة الخلايا المصابة بكريسبر على 1 × 107 خلايا لكل مل وقم بتلقيح 1 مل في كل طبق بتري مقاس 15 سم. احتضان طوال الليل عند 37 درجة مئوية مع 5٪ ثاني أكسيد الكربون2.
- العلاج الإشعاعي
- قسم الخلايا بشكل عشوائي إلى مجموعتين: مجموعة علاج ومجموعة ضابطة ، مع 6 أطباق لكل مجموعة. إعطاء جرعة مناسبة من الإشعاع للخلايا في مجموعة العلاج ، مع ترك خلايا المجموعة الضابطة دون معالجة لتتكاثر بشكل طبيعي. بعد الإشعاع ، استمر في الحضانة عند 37 درجة مئوية مع 5٪ ثاني أكسيد الكربون2 لمدة 7 أيام.
- في الأسبوع الثاني ، كرر إعطاء جرعة مناسبة من الإشعاع لخلايا مجموعة العلاج ، مع ترك خلايا المجموعة الضابطة دون معالجة والسماح لها بالتكاثر بشكل طبيعي. بعد العلاج الإشعاعي ، استمر في الحضانة عند 37 درجة مئوية مع 5٪ ثاني أكسيد الكربون2 لمدة 7 أيام أخرى.
5. استخراج الجينوم وتسلسله
- استخراج اليوم 14
- بعد 14 يوما من العلاج ، قم بهضم الخلايا في مجموعات العلاج والضابط بنسبة 0.25٪ تربسين ، وأعد تعليقها باستخدام وسط RPMI 1640 الكامل الذي يحتوي على 10٪ FBS ، وقم بتسميته على أنه اليوم 14-RT أو اليوم 14-NC.
- قم بالطرد المركزي للخلايا عند 300 × جم لمدة 5 دقائق وتخلص من المادة الطافية. أعد التعليق في 1 مل من PBS ، وجهاز الطرد المركزي عند 300 × جم لمدة 5 دقائق ، وتخلص من المادة الطافية مرة أخرى. استخرج الحمض النووي الجيني لليوم 14 ، واكتشف تركيز ونقاء الحمض النووي باستخدام التحليل الطيفي لامتصاص الأشعة فوق البنفسجية النانوية.
- تضخيم تفاعل البوليميراز المتسلسل
- قم بإعداد البادئات المقابلة للتسلسل (انظر جدول المواد) وتخفيفها إلى 10 ميكرومتر ، وقم بإعداد نظام تفاعل 20 ميكرولتر عن طريق إضافة الكواشف إلى أنبوب طرد مركزي دقيق معقم ، وجهاز طرد مركزي لمدة 5 ثوان عند 300 × جم ، واخلطه جيدا. قم بتعيين معلمات أداة PCR وفقا لحالة التضخيم للحصول على منتجات PCR.
- الكشف عن الرحلان الكهربائي لهلام الاغاروز
- قم بإعداد لوحة صب هلام ، وأغلق حواف القالب بالأغروز ، وأدخل المشط ، وقم بإعداد هلام الاغاروز بتركيز مناسب وفقا لطول الحمض النووي للعينة.
- قم بوزن كمية معينة من مسحوق الاغاروز بدقة ، وأضف كمية مناسبة من محلول الرحلان الكهربائي ، واخلطه جيدا ، وقم بتسخينه في فرن الميكروويف حتى يذوب. بعد التبريد قليلا ، أضف كمية مناسبة من صبغة الحمض النووي ، واخلطها برفق ، واسكبها ببطء في قالب صب الجل. اترك الجل يتماسك لمدة 30 دقيقة.
- قم بإزالة المشط وأضف كمية مناسبة من مخزن الرحلان الكهربائي إلى خزان الرحلان الكهربائي حتى يغطي الجل. أضف كمية مناسبة من المخزن المؤقت للتحميل إلى عينة الحمض النووي ، واخلطها جيدا ، واستخدم ماصة لإضافة الخليط ببطء إلى العينة جيدا.
- اضبط الجهد المناسب بناء على حجم جزء الحمض النووي وتركيز هلام الاغاروز. بعد الرحلان الكهربائي ، قم بإزالة الجل بعناية وضعه في جهاز تصوير هلام لمراقبة النتائج والتحقق مما إذا كان تضخيم تفاعل البوليميراز المتسلسل ناجحا.
- تسلسل Illumina
- اجمع الحمض النووي الجيني من المجموعات الثلاث (مجموعة اليوم 0 ، والمجموعة الضابطة ، ومجموعة العلاج) ، وأرسله إلى شركة لبناء المكتبات وتسلسل Illumina. إجراء تحليل المعلوماتية الحيوية وتصور نتائج التسلسل للحصول على جينات حساسة للعلاج الإشعاعي ومقاومة للعلاجالإشعاعي 26.
- إعداد تجارب متكررة متعددة لتحليل البيانات ، وإجراء تحليل إحصائي على النتائج التجريبية لضمان اتساق البيانات وقابليتها للتكرار27،28.
- تقييم جودة بيانات التسلسل
- إخضاع البيانات الأولية لآليات تصفية ومراقبة الجودة الصارمة لضمان دقة معلومات التسلسل5. احسب درجة فريد (Qphred) لكل نيوكليوتيد بناء على معدل خطأ التسلسل ، باستخدام خوارزمية تحويل محددة ونموذج يقيم احتمالية حدوث خطأ أثناء استدعاء القاعدة28.
- حافظ على معدل خطأ التسلسل لكل موضع أساسي أقل من 1٪ (أي ما يعادل عتبة Q30)، وتأكد من أن 80٪ على الأقل من بيانات التسلسل تحقق معيار Q30 هذا لدعم الإجراءات التحليلية اللاحقة.
- معالجة البيانات ومراقبة الجودة على مستوى العينة
ملاحظة: للاطلاع على التفاصيل، يرجى الرجوع إلى التقارير المنشورة سابقا 29،30.- قم بمحاذاة القراءات التي تمت تصفيتها من بيانات التسلسل مع تسلسلات مكتبة sgRNA. إحصائيات التقرير ، بما في ذلك عدد sgRNAs في المكتبة مع محاذاة مثالية ، ومتوسط وفرة sgRNAs ، وعدد sgRNAs التي لم يتم اكتشافها ، ونسبة القراءات من العينات الفردية التي تم تعيينها بنجاح إلى مكتبة sgRNA. استخدم نسبة تعيين أعلى للإشارة إلى تغطية أكبر.
- احسب تخصيب القراءات لكل جين (مستهدفة بواسطة sgRNAs مختلفة) في كل عينة. تطبيع القراءات الداعمة لكل sgRNA عبر العينات باستخدام طريقة التطبيع "المتوسطة" الخاصة ب MAGeCK. قم بإجراء مراقبة الجودة على مستوى العينة من خلال تقييم توزيع عدد قراءة sgRNA ، وإنشاء مخططات صندوقية ، وإجراء تحليل المكونات الرئيسية (PCA) ، وإنشاء خرائط حرارية للارتباط.
- افترض أن عدد قراءة sgRNA يتبع توزيع بواسون. قم بتصوير أعداد sgRNA الطبيعية من مجموعات مختلفة في مخططات صندوقية لتصور التوزيع الكلي للبيانات داخل العينات ومقارنة التوزيعات بين المجموعات.
- استخدم PCA لتبسيط تحليل البيانات من خلال عكس الاختلافات بين المكونات الرئيسية ومعدل التباين داخل كل مكون ، مما يسهل ملاحظة الاختلافات داخل المجموعات وفيما بينها. استخدم خريطة تمثيلية للارتباط لتوضيح العلاقات بين العينات.
- التحليل الأساسي
- إجراء تحليل sgRNA التفاضلي بين المجموعات وتحديد الجينات الأساسية بعد مراقبة الجودة ومعالجة البيانات الأولية. إجراء تحليل التخصيب الوظيفي للجينات ذات الصلة30. رتب الجينات الأساسية بناء على درجة تجميع الرتبة القوية (RRA) المحسوبة بواسطة MAGeCK أو الطرق الإحصائية الأخرى مثل MLE ، مع درجة RRA أقل تشير إلى أهمية أعلى.
- استخدم لغة R أو لغات البرمجة الأخرى لإجراء تحليل المعلوماتية الحيوية على النتائج المصنفة ، وتصور النتائج باستخدام مخططات تحليل GO و KEGG30. اربط الجينات أو البروتينات بمصطلحات GO المقابلة (الوظيفة الجزيئية والعملية البيولوجية والمكون الخلوي) من خلال رسم خرائط الهوية أو التعليق التوضيحي للتسلسل.
- استخدم KEGG كقاعدة بيانات لفهم الوظائف عالية المستوى والأنظمة البيولوجية ، وربط كتالوج الجينات المحدد بوظائف النظام على المستويات الخلوية والأنواع والنظام البيئي. حدد أفضل 10 أو 20 مسارا من تحليلات GO و KEGG للحصول على عرض بديهي لاتجاهات المسار.
النتائج
يمثل سرطان الرئة ، مع معدل الوفيات الأكبر ، مرضا طبيا شديد العدوانية وانتشارا. باستخدام خط خلايا سرطان الرئة A549 كمثال لإجراء شاشة كريسبر على مستوى الجينوم مع الإشعاع كحالة فحص ، يظهر سير العمل التخطيطي في الشكل 1. أولا ، استكشف حساسية خلايا A549 لجرعات مختلفة من الإشعاع من خلال تكوين الاستنساخ وتجارب CCK8 (الشكل 2). في الفحص الاستمني ، كان عدد المستعمرات 140 ± 5.35 عند 2 غراي مقابل 303 ± 31.63 عند 0 غراي ، بينما في اختبار CCK-8 ، كانت قيمة الكثافة الضوئية (OD) 0.65 ± 0.05 عند 2 غراي مقابل 1.35 ± 0.08 عند 0 غراي. للتحقيق في الجينات المرشحة للحساسية الإشعاعية والمقاومة الإشعاعية ، حدد 2 Gy (IC50) كجرعة إشعاع لاحقة. عولجت خلايا A549 بجرعات مختلفة من بورومايسين وتم عدها بعد 72 ساعة. تم الكشف عن الحد الأدنى لتركيز قتل بورومايسين لخلايا A549 على أنه 1 ميكرومتر (الشكل 3). أصيبت خلايا A549 بفيروسات العدسات في MOIs متدرجة مختلفة. بعد 72 ساعة من الإصابة ، لوحظت كفاءة العدوى بواسطة المجهر الفلوري وتم عدها قبل وبعد 72 ساعة من علاج البيورومايسين. تم الحصول على وزارة الداخلية بكفاءة عدوى ~ 0.3 (الجدول 1). يحتوي الجينوم البشري على 19,050 جينا ، مع 6 sgRNAs تتوافق مع كل جين ورقم نسخة 500 (19,050 × 6 × 500 = 5.7 × 107 خلايا). استخدام فيروسات العدسات مع وزارة الداخلية = 0.3 ، وبالتالي ، يصيب 5.7 × 107 خلايا A549. بعد 72 ساعة ، عولجت الخلايا ب 1 ميكرومتر من بورومايسين لمدة 72 ساعة إضافية. تم حصاد جينوم اليوم 0 ، وتم إجراء تضخيم تفاعل البوليميراز المتسلسل (PCR). تظهر تسلسلات sgRNA داخل مكتبة الجينوم الكامل CRISPR طولا يبلغ 231 زوجا أساسيا ، وهو ما تؤكده نتائج الرحلان الكهربائي لهلام الاغاروز (الشكل 4).
وأرسلت منتجات تفاعل البوليميراز المتسلسل لاحقا إلى نوفوجين لمراقبة جودة البيانات ومراقبة الجودة على مستوى العينات. أسفرت نسبة رسم الخرائط عن معدل تغطية شامل يبلغ حوالي 60٪ ، وهو مقياس يعتبر مناسبا لإجراءات فحص الجينوم الكامل ، نظرا للتعقيد الهائل والاستنزاف الحتمي أثناء معالجة الجينوم بأكمله (الشكل 5). التزمت أعداد قراءة sgRNA بتوزيع بواسون ، بما يتوافق مع التوقعات النظرية. صور التحليل اللاحق من خلال تخطيط PCA ورسم الخرائط الحرارية للارتباط بوضوح التباين الملحوظ بين المجموعات المتميزة ، حيث يفوق التباين بين المجموعات بشكل ملحوظ التناقضات داخل المجموعة. علاوة على ذلك ، فإن معدل التباين داخل العينات المجمعة يقع ضمن الحدود المقبولة ، مما يثبت نجاح تدابير مراقبة الجودة على مستوى العينة. بعد ذلك ، سيتم تسخير تصنيفات RRA التي ابتكرتها MAGeCK للشروع في تقييم أساسي للمعلوماتية الحيوية لنتائج الترتيب باستخدام لغة R. والجدير بالذكر أن أفضل 15 مسارا في مصطلحات GO تتميز بشكل بارز بآليات مرتبطة بتلف الحمض النووي ، والتي تتوافق بسلاسة مع معايير الفحص الأساسية للتجربة.

الشكل 1: تخطيطي للعلاج الإشعاعي على مستوى الجينوم شاشة CRISPR / Cas9 في خلايا سرطان الرئة A549. تمثيل تخطيطي لسير عمل الفحص في خلايا A549 باستخدام CRISPR / Cas9 على مستوى الجينوم والعلاج الإشعاعي. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
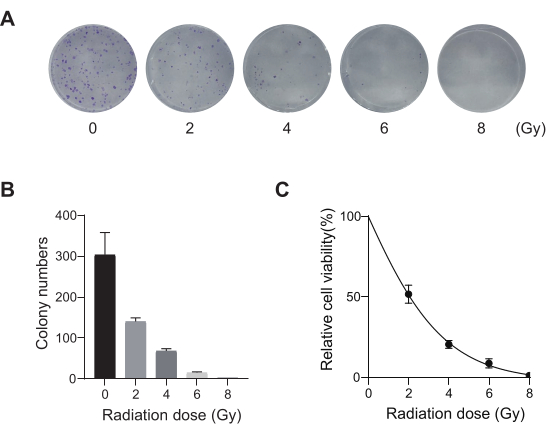
الشكل 2: تحسين جرعة الإشعاع لخلايا A549. (أ) تعرضت خلايا A549 لجرعات متزايدة من الإشعاع (0 Gy و 2 Gy و 4 Gy و 6 Gy و 8 Gy) وسمح لها بالنمو لمدة 14 يوما. يتم عرض صور فحص تكوين المستعمرة. تمثل النتائج تجربتين بيولوجيتين مستقلتين. (ب) نتائج القياس الكمي لصور فحص التكوين المستنسخة. تمثل أشرطة الخطأ الانحراف المعياري (ن = 3). أسفر ANOVA أحادي الاتجاه عن P < 0.01. تمثل النتائج تجربتين بيولوجيتين مستقلتين. (ج) منحنيات بقاء استجابة الجرعة لخلايا A549 بعد التعرض لجرعات إشعاعية مختلفة. تمثل أشرطة الخطأ الانحراف المعياري (ن = 3). أنتج ANOVA أحادي الاتجاه P < 0.01. تمثل النتائج تجربتين بيولوجيتين مستقلتين. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
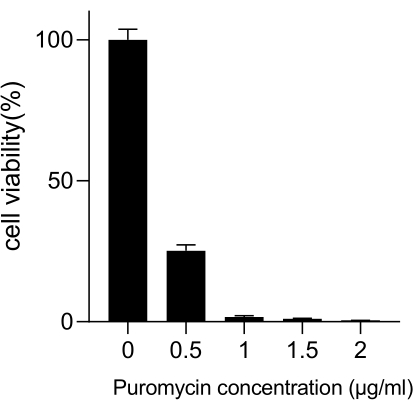
الشكل 3: تحديد الحد الأدنى لتركيز البيورومايسين المطلوب لاختيار خلية A549. عولجت خلايا A549 بتركيزات متزايدة من بورومايسين واحتضانها لمدة 72 ساعة. تمثل أشرطة الخطأ الانحراف المعياري (ن = 3). أسفر ANOVA أحادي الاتجاه عن P < 0.01. تمثل النتائج تجربتين بيولوجيتين مستقلتين. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
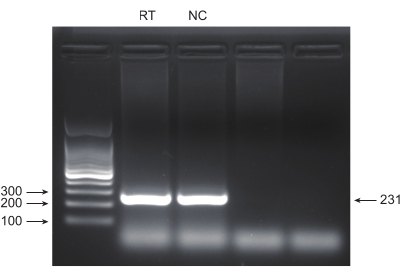
الشكل 4: التحقق من صحة منتج تفاعل البوليميراز المتسلسل عن طريق الرحلان الكهربائي لهلام الاغاروز. تم استخدام الرحلان الكهربائي لهلام الاغاروز لفحص وجود وجودة نطاقات منتجات PCR. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: مراقبة الجودة والتحليل الأساسي للمنتجات المضخمة بتفاعل البوليميراز المتسلسل (PCR). (أ) أشارت نسبة رسم الخرائط إلى تغطية حوالي 60٪ للجينوم المرجعي. (ب) يتبع توزيع عدد القراءة ل sgRNAs توزيع بواسون. (ج) ارتبطت معظم مصطلحات علم الأنطولوجيا الجينية (GO) بالاستجابة لتلف الحمض النووي. (د) مخطط بركان يظهر أنماط تخصيب الجينات ، مع جينات غنية سلبا باللون الأحمر ، وجينات غنية إيجابيا باللون الأزرق ، وجينات غير مهمة باللون الرمادي. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| جسيمات الفيروس الرقم (VP) | عدد العد (قبل علاج بورومايسين) | عدد العد (بعد علاج البيرومايسين) | عدوى كفاءة |
| 1.23 × 104 | 1.23 × 105 | 1.04 × 104 | 0.084552846 |
| 3.72 × 104 | 1.24 × 106 | 3.61 × 104 | 0.291129032 |
| 6.15 × 104 | 1.23 × 107 | 5.4 × 104 | 0.43902439 |
الجدول 1: تعداد خلايا A549 قبل وبعد اختيار البيورومايسين تحت جزيئات الفيروس المختلفة. تعداد خلايا A549 المسجلة قبل وبعد العلاج بالبورومايسين تحت جزيئات الفيروس المختلفة.
Discussion
كتقنية متطورة لتحرير الجينات ، أحدثت شاشة كريسبر تغييرات عميقة في مجال البحث العلمي5. نشأت هذه التقنية من نظام CRISPR-Cas9 ، وأصبحت أداة أساسية لدراسة وظائف الجينات نظرا لكفاءتها العالية ودقتها9. يتضمن المبدأ الهندسي CRISPR / Cas9 تصميم وإدخال sgRNAs محددة مع ما يقرب من 20 نيوكليوتيد لتوجيه نوكلياز Cas9 لتحديد تسلسل الحمض النووي المستهدف وقطعه بدقة ، مما يتيح تحرير الجينات مثل خروج المغلوب أو التنشيط أو القمع6. يكمن هذا المبدأ وراء تطوير شاشة كريسبر عالية الإنتاجية والقابلة للتخصيص. من خلال إنشاء مكتبات تحتوي على عدد كبير من sgRNAs ، يمكن للباحثين تحرير جينات متعددة وفحصها في وقت واحد ، وتحديد تلك المرتبطة بأنماط ظاهرية أو حالات مرضية معينة بسرعة. علاوة على ذلك ، تسمح شاشة كريسبر بالتجريب في أنواع مختلفة من الخلايا والأنسجة وحتى الكائنات الحية بأكملها ، مما يوفر فهما أكثر شمولا لوظيفة الجينات وآليات العمل.
مع تطور التكنولوجيا المتسارعة ، أظهرت شاشة كريسبر إمكانات هائلة للتطبيق في مختلف المجالات. على سبيل المثال ، يمكن أن تساعد شاشة كريسبر العلماء في اكتشاف أهداف جديدة للأدوية ، وبالتالي تسريع عملية اكتشاف الأدوية وتطويرها. في أبحاث الأمراض ، تكشف هذه التقنية عن آليات التسبب في المرض ، وتقدم رؤى وأساليب جديدة للتشخيص والعلاج. تختلف شاشة كريسبر اختلافا جوهريا عن طرق الفحص التقليدية (مثل الحمض النووي الريبي ومثبطات الجزيئات الصغيرة) في عدة جوانب رئيسية: ميكانيكيا ، تحقق كريسبر تعديلات جينية دائمة من خلال التحرير الجيني ، بينما يمنع الحمض النووي الريبي مؤقتا التعبير الجيني ومثبطات الجزيئات الصغيرة بشكل عكسي وظيفة البروتين28،29. من حيث الخصوصية ، يظهر كريسبر دقة فائقة من خلال استهداف الحمض النووي الدقيق ، في حين أن الحمض النووي الريبي عرضة للتأثيرات غير المستهدفة3،5. فيما يتعلق بمدة التأثير ، يخلق كريسبر تغييرات جينية دائمة ، مقارنة بالتدخلات العابرة للطرق التقليدية. علاوة على ذلك ، يتيح كريسبر إمكانات الفحص على مستوى الجينوم ويمكنه في وقت واحد التحقيق في جينات / مسارات متعددة ، مع الحفاظ على كفاءة عالية عبر أنواع الخلاياالمتنوعة 9. تقتصر الأساليب التقليدية عادة على تحليل مسار محدد وغالبا ما تظهر فعالية منخفضة في بعض خطوطالخلايا 3. هذه الخصائص المميزة تجعل شاشة كريسبر ذات قيمة خاصة لأبحاث الجينوم الوظيفي واكتشاف الهدف ، خاصة في الدراسات التي تتطلب مراقبة طويلة الأمد أو تنظيم جيني دقيق ، حيث تظهر مزايا فريدة من نوعها على منهجيات الفحص التقليدية.
ومع ذلك ، فإن خصوصية هذه العملية ليست مطلقة ، ومن الممكن لبروتين Cas9 أن يتعرف عن طريق الخطأ على مناطق الحمض النووي المتشابهة ولكنها ليست متطابقة تماما مع التسلسل المستهدفالمقصود 5. يشار إلى هذا الحدوث عادة باسم تأثيرات خارج الهدف. يمكن أن يؤدي انقسام الحمض النووي غير المقصود هذا إلى عدم الاستقرار الجيني والعواقب الوراثية التي لا يمكن التنبؤ بها ، خاصة عند تطبيقه في العلاج البشري. تكافح تقنية CRISPR أيضا عند التعامل مع مهام التحرير الجينومي المعقدة. عند مواجهة متطلبات التحرير التي تشمل العديد من الجينات أو مجموعات الجينات أو الإعدادات الجينية المعقدة ، قد يواجه نظام كريسبر قيودا في توقع وتوجيه نتائج عملية التحريربدقة 1.
تنبع العقبة التقنية الأساسية في إجراء الفحص على مستوى الجينوم باستخدام تقنية كريسبر من التعقيد الهائل للجينوم ، والذي يشمل عشرات الآلاف من الجينات ، مما يزيد بشكل كبير من خطر التأثيرات غير المستهدفة9. لضمان سلامة وموثوقية نتائج التسلسل اللاحقة ، من الضروري أن يتم نقل كل خلية باستخدام sgRNA23 الفردي. وهذا يستلزم التحكم الدقيق في وزارة الداخلية من قبل المجرب ، مما يضمن بقائها أقل من 0.5 مع الحفاظ في نفس الوقت على عتبة رقم نسخ كافية ، والتي يجب أن تكون على الأقل 500 أو أكثر24. بالنظر إلى حقيقة أن كل من عشرات الآلاف من الجينات في الجينوم بأكمله يتطلب استخدام 4-6 sgRNAs ، فإن عملية الفحص بأكملها تتطلب كمية كبيرة من الخلايا25. تتطلب المدة الطويلة للتجربة ، والعدد الكبير من الخلايا المعنية ، والمخاطر المرتفعة أن يبتكر المجرب استراتيجيات للتخفيف من هذهالمخاوف 26. يجب التحقق من صحة الجينات المحتملة بشكل أكبر باستخدام تسلسل الحمض النووي الريبي ، بالإضافة إلى فحوصات الكسب وفقدان الوظيفة. في التجارب التالية ، بعد الحصول على الخلايا المفرطة في التعبير والضربة القاضية للجينات المحددة باستخدام تحرير كريسبر ، تم إجراء علم الجينوم على مستوى الجينوم ، وعلم النسخ للوصول إلى التعديلات المحتملة خارج الهدف ، لا سيما في المواقع ذات التكامل الجزئي ل sgRNA التي قد تخضع لانقسام Cas9 غير المحدد. قد تساعد أدوات التنبؤ بالمعلوماتية الحيوية مثل COSMID في تحديد المواقع عالية الخطورة خارج الهدف. يمكن أيضا استخدام فحوصات الإنقاذ لضمان خصوصية تورط الجينات المحددة.
في التحليل اللاحق ، اعتمدت معايير sgRNAs المعبر عنها تفاضليا على درجة تجميع الرتبة القوية (RRA) المحسوبة بواسطة MAGeCK ، والتي تضمنت دلالة إحصائية ، وتغيير الطية ، وتكرار الاتساق31،32. بالنسبة لمجموعة البيانات ، يتم تصنيف كل جين وفقا لمعايير شاملة تجمع بين مستويات التعبير الجيني والدلالة الإحصائية. يستخدم RRA معامل ارتباط رتبة سبيرمان للرتبة لتقييم حالة الرتبة الشاملة لكل جين في جميع مجموعات البيانات ويدمج نتائج الفرز لمجموعات بيانات التعبير الجيني المتعددة. يمكن اعتبار الجين ذو المرتبة العالية نسبيا في معظم مجموعات البيانات بمثابة جين33 حقيقي معبر عنه تفاضليا. اعتبرت القيمة الاحتمالية لقيمة RRA أقل من 0.05 ذات دلالة إحصائية. تم اعتبار تغيير الطية بزيادة 1.5 ضعف على الأقل أو 33٪ تعبيرا تفاضليا. بالإضافة إلى ذلك ، كان من الضروري اعتبار اتساق 3 مكررات مستقلة تعبيرا مختلفا إحصائيا. بعد تصنيف RRA للجينات الأساسية ، تشير درجة RRA المنخفضة إلى أهمية أعلى.
كأداة قوية لتحرير الجينوم ، تظهر تقنية CRISPR-Cas9 إمكانات ودقة لا مثيل لها في التحقيق في مجال المقاومة الإشعاعية26،27. ومع ذلك ، لا يزال تطبيقه له قيود. بصرف النظر عن مخاطر التأثيرات غير المستهدفة ، فإن التعقيدات المرتبطة بالحساسية الإشعاعية تدخل تعقيدات في عملية الفرز27. لا يحكمها هذا الحساسية جين انفرادي فحسب ، بل تظهر نتيجة للتفاعل المعقد بين الجينات المتعددة وشبكاتهاالتنظيمية 26. ومن ثم ، على الرغم من التحديد الناجح لجينات معينة تتعلق بالحساسية الإشعاعية ، إلا أنها قد تمثل جزءا بسيطا فقط من الصورة الأوسع ، مما يشكل تحديات كبيرة لتوضيح الآليات الأساسية بشكل شامل34 ، 35 ، 36. فيما يلي حلول للمشكلات الشائعة في شاشة كريسبر ، مثل انخفاض كفاءة العدوى ، وتدهور sgRNA ، وفشل التسلسل: نظرا لأن شاشة كريسبر تتطلب قيمة وزارة الداخلية <0.5 ، فإن تعديل حالة الخلية أمر بالغ الأهمية لضمان أن تكون الخلايا في مرحلة نمو لوغاريتمي أو تقييم كفاءة العدوى عن طريق فحوصات التألق ؛ تشمل الأسباب المحتملة لتدهور الحمض النووي الريبي تلوث النوكلياز أو عيوب تصميم النواقل ، لذلك يجب تجنب دورات التجميد والذوبان المتكررة لمكتبات sgRNA (تخزين الحصص عند -80 درجة مئوية) ، ويجب استخدام تسلسل NGS للتحقق من سلامة مكتبة sgRNA ؛ قد ينتج فشل التسلسل عن عدم كفاية عمق التسلسل أو مشكلات تصميم التمهيدي sgRNA ، يوصى بالتسلسل المزدوج لتحسين دقة تحديد تسلسل sgRNA ، مع عمق تسلسل مقترح يبلغ >500× تغطية37،38،39،40،41،42.
لا يزال العلاج الإشعاعي حجر الزاوية في علاج السرطان ، ومع ذلك يظهر تباينا ملحوظا في الفعالية العلاجية عبر أنواع الأورام المختلفة وحتى بين المرضى الذين يعانون من نفس السرطان9. غالبا ما يتطلب هذا عدم التجانس بين الأفراد علاجات مركبة لتحقيق القضاء الأمثل على الورم11،12. في الممارسة السريرية ، ظهر دمج العلاج الإشعاعي مع العلاج المناعي - وخاصة مثبطات نقاط التفتيش المناعية واقترانات الأجسام المضادة للأدوية - كنموذج علاجي بارز19. يقدم هذا البروتوكول شاشة كريسبر في المختبر باستخدام خط خلايا سرطانية متجانسة نسبيا ، والتي لا يمكن أن تعكس تماما عدم التجانس الجيني واللاجيني للأورام في الجسم الحي. بعد تحديد الجرعة المناسبة من الإشعاع للفحص ، توفر النتائج جينات محتملة حساسة للإشعاع أو مقاومة للإشعاع ، والتي تحتاج إلى مزيد من التأكيد في كل من المقايسات الخلوية في المختبر والنماذج الحيوانية في الجسم الحي . علاوة على ذلك ، قد تكون شاشة CRISPR في الجسم الحي بالإضافة إلى النسخ أحادية الخلية مفيدة في فك تشفير تعقيد عدم تجانس الورم. حددت شاشة CRISPR في المختبر الجينات المهمة في إصلاح تلف الحمض النووي داخل الخلايا ، وكذلك في آليات الأوتوكرين استجابة للإشعاع ، ولكنها في الواقع لم تكرر TME غير المتجانسة بشكل كامل. على سبيل المثال ، يزيد نقص الأكسجة من إنتاج ROS ، مما يؤدي إلى حلقة تغذية مرتدة تحفز التكيف الأيضي ، وتوليد مضادات الأكسدة ، وتنشيط الالتهام الذاتي ، مما يعزز المقاومة الإشعاعيةفي النهاية 18. قد يتم تنشيط الخلايا المناعية في آلية الباراكرين بعد الإشعاع ، مما يؤدي إلى الحساسية الإشعاعية14. يعمل ECM كخزان لعوامل النمو ، والسيتوكينات لها تأثيرات إيجابية وسلبية على الحساسية الإشعاعية21. يجب إجراء شاشة CRISPR في الجسم الحي لتعكس عدم تجانس TME. إلى جانب ذلك ، يمكن لشاشة CRISPR في المختبر تحديد الجينات المهمة فقط في إصلاح تلف الحمض النووي داخل الخلايا ، وكذلك في آليات الأوتوكرين استجابة للإشعاع ، ولكنها لم تلتقط بشكل كامل التأثير في الجسم الحي على الحساسية الإشعاعية ، بما في ذلك الأوعية الدموية للورم والتأثيرات الجهازية20،21. يجب إجراء شاشة كريسبر في الجسم الحي لتحديد العوامل المحتملة المشاركة في الحساسية الإشعاعية في الجسم الحي.
هنا ، تم تصميم بروتوكول شامل يهدف إلى استخدام فحص جينوم كريسبر لتحديد الجينات المتورطة إما في حساسية أو مقاومة العلاج الإشعاعي. من خلال كشف مسارات جديدة ، تسعى هذه المنهجية إلى تمهيد الطريق للتقدم في أبحاث العلاج الإشعاعي للأورام. يمكن أن يكون هذا البروتوكول أيضا بمثابة مرجع لاستكشاف آليات القيود السريرية في العلاج الكيميائي وتطور العوامل العلاجية البديلة. باختصار ، تجسد تقنية كريسبر إمكانات وقيمة كبيرة ، ومع ذلك تؤكد قيودها المتأصلة على أهمية الاعتراف الرصين والنهج الحكيم. مع الخوض في الأبحاث والتطبيقات المستقبلية ، من الضروري السعي الدؤوب لاستكشاف تقنية كريسبر وتحسينها للتغلب على قيودها وتسخير أقصى إمكاناتها.
Disclosures
اي.
Acknowledgements
تم دعم هذه الدراسة من قبل المشروع الإقليمي للابتكار العلمي والتكنولوجي في مقاطعة هوبى (2024EIA001) ، ومشروع دعم بناء منصة الابتكار في العلوم الطبية والتكنولوجيا لمستشفى Zhongnan بجامعة ووهان (PTXM2025001). تم إنشاء الشكل 1 باستخدام Figdraw.
Materials
| Name | Company | Catalog Number | Comments |
| 150 mm cell and tissue culture dish | Wuxi NEST Biotechnology Co., Ltd. | 715011 | Cell culture |
| 35 mm cell and tissue culture dish | Wuxi NEST Biotechnology Co., Ltd. | 706011 | Cell culture |
| A549 cell line | ATCC | - | - |
| Cell counting kit-8 | Shanghai Beyotime Biotech Inc | C0041 | For cell viability assay |
| CO2-independent medium | PHCbi | MCO-50AIC | Cell culture |
| Countess 3 FL automated cell counter | Themo Scientific | AMQAF2001 | For cell counting |
| EDTA | Gibco | 25200056 | Cell culture |
| Fetal bovine serum | Gibco | 10099141 | Cell culture |
| Fluorescence microscopy | LEICA | ebq 100-04 | For fluorescence microscope |
| Genome-wide CRISPR lentiviral library | Shanghai OBiO Technology Co., Ltd. | H5070 | For lentiviral infection |
| MiniAmp plus PCR | Themo Scientific | C37835 | For PCR amplification |
| NEST cell culture plates, 12-well | Wuxi NEST Biotechnology Co., Ltd. | 712002 | Cell culture |
| NEST cell culture plates, 6-well | Wuxi NEST Biotechnology Co., Ltd. | 703002 | Cell culture |
| NEST cell culture plates, 96-well | Wuxi NEST Biotechnology Co., Ltd. | 701001 | Cell culture |
| PBS | Gibco | C10010500BT | Cell culture |
| PCR forward primer (AATGGACTATCATATGCTTACCGTAACTTGAAAGTATTTCG) | Beijing AuGCT Biotech Co., Ltd. | - | For PCR amplification |
| PCR reverse primer (GATGTGCGCTCTGCCCACTGACGGGCA) | Beijing AuGCT Biotech Co., Ltd. | - | For PCR amplification |
| Polybrene | Shanghai Beyotime Biotech Inc | C0351 | For lentiviral infection |
| Puromycin | MCE | HY-K1057 | For seletion post lentiviral infection |
| RPMI 1640 cell culture medium | Gibco | 23400-021 | Cell culture |
| TIANGENamp genomic DNA kit | Beijing TIANGEN Biotech Co.,Ltd. | DP304 | For genomic DNA extraction |
| X-ray powder diffractometer | PerkinElmer | For radiotherapy |
References
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved