Method Article
Fare Beyin-Omurilik Örneklerinin Ekstraksiyonu ve Doku Temizleme Hazırlanması
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu çalışma, korunmuş floresan sinyalleri ile temizlenmiş tüm beyin ve omurilik örneklerinin çıkarılması ve hazırlanması için bir protokol sunmakta, sinirbilim araştırmalarını ilerletmek için deneysel verimliliği ve veri bütünlüğünü artırmaktadır.
Özet
Merkezi sinir sistemine odaklanan sinirbilim araştırmaları, hücre dağılımı, nöronal bağlantı ve moleküler dinamikler dahil olmak üzere çeşitli faktörlerin kapsamlı bir şekilde anlaşılmasını gerektirir. Tüm beyin ve omuriliği araştırmak için geleneksel metodolojiler genellikle doku dilimlerini izole etmeyi, bölümlere ayırmayı ve taramayı ve ardından emek yoğun üç boyutlu görüntü rekonstrüksiyonu sürecini içerir. Bu geleneksel yaklaşım hem zaman alıcı hem de hantal olabilir. Doku temizleme ve tüm organ görüntüleme tekniklerindeki gelişmeler, tüm beyin ve omuriliğin analizinde devrim yaratmıştır. Bu yenilikçi yöntemlerin potansiyelini en üst düzeye çıkarmak için, omurilik ile bağlantılarını korurken beyin örneklerini çıkarmak ve temizlemek çok önemlidir. Bu protokol, omuriliğe bağlı beyin örneklerinin hazırlanması için ekstraksiyon ve temizleme prosedürlerinin ana hatlarını çizen ayrıntılı ve sistematik bir kılavuz sağlar. Bu yaklaşım, bu süreçleri kolaylaştırarak, deneysel verimliliği ve veri bütünlüğünü önemli ölçüde artırır, böylece sinirbilim araştırmalarındaki ilerlemeleri teşvik eder ve merkezi sinir sisteminin karmaşıklıklarına ilişkin daha kapsamlı araştırmalar yapılmasını sağlar.
Giriş
Sinir dağılımının doğru haritalanması ve analizi, merkezi sinir sisteminin yapısal ve işlevsel organizasyonu hakkında değerli bilgiler sağlar, yenilikçi terapötik stratejilerin önünü açar ve nöral mekanizmalara ilişkin genel anlayışımızı geliştirir. Şu anda, araştırmacılara omuriliğe bağlı beyin örneklerinin hazırlanması ve çıkarılması ve başarılı doku temizliğinin elde edilmesi konusunda rehberlik edecek kapsamlı video eğitimleri eksiktir.
Birkaç doku temizleme yaklaşımı mevcuttur: hidrofobik, hidrofilik, hidrojel bazlı ve doku genişleme temizleme yöntemleri 1,2,3. Doku temizleme tekniği, dalak4, akciğerler5, gastroknemius kası6, beyin7, omurilik8 ve böbrekler9 gibi organların çalışmasında yaygın olarak uygulanmaktadır. Protokolümüz, STOCK Tg (Thy1-EGFP) MJrs/J suş fareleri kullanılarak floresan işaretleyici ile etiketlenmiş omuriliğe bağlı tüm beyin örneklerinin nasıl hazırlanacağına dair ayrıntılı talimatlar sağlayacaktır. Numune ekstraksiyonu için adım adım rehberlik sunacak ve doku temizleme hidrofilik kitleri kullanarak temizleme protokolünü açıklayacaktır. Bu protokol, araştırmacıların beyin-omurilik örneğinin çıkarılmasından hazırlanmasına ve ardından taramaya kadar tüm süreçte ustalaşmalarına yardımcı olur. Bu, yalnızca deneysel verimliliği artırmakla kalmayacak, aynı zamanda numunelerin bütünlüğünü ve kalitesini de sağlayarak sinirbilim araştırmalarını desteklemek için daha doğru ve güvenilir veriler sağlayacaktır.
Konvansiyonel kesit alma, görüntüleme ve üç boyutlu rekonstrüksiyon yöntemleriylekarşılaştırıldığında 10,11, burada sunulan yaklaşım, (1) gelişmiş yapısal bütünlük: tüm organ yapısını koruyarak, bu yöntem kesitleme ile ortaya çıkabilecek kritik bilgileri kaybetme riskini azaltır12; (2) kapsamlı veri toplama: bir doku temizleme kitinin kullanılması, geleneksel tekniklerle elde edilmesi zor olan hücrelerin ayrıntılı haritalanmasına izin verir; (3) Verimlilik ve Doğruluk: Protokol, numune ekstraksiyonundan görüntülemeye kadar tüm süreci kolaylaştırır, immünohistokimya veya boyama prosedürlerinin gerektirdiği süreyi azaltır ve kesit alma ve montaj ile ilgili hataları en aza indirir13.
Protokol, genellikle eksik ve parçalanmış verilerle sonuçlanan geleneksel bölümleme yöntemlerinin sınırlamalarının üstesinden gelir. Bu protokol, sağlam beyin-omurilik bağlantısını koruyarak ve modern doku temizleme yöntemlerini kullanarak, karmaşık nöral mekanizmaları ve işlevleri anlamak için çok önemli olan merkezi sinir sisteminin daha bütünsel bir görünümünü sağlar. Bu yöntemin birincil amacı, floresan nöronal belirteçlerle işaretlenmiş omuriliğe bağlı tüm beyin örneklerini hazırlayarak merkezi sinir sisteminin kapsamlı bir şekilde görüntülenmesini sağlamaktır. Bu protokol, ileri anatomik yöntemler ve doku temizleme teknikleri kullanılarak nöral yapıların ve hücre dağılımlarının ayrıntılı olarak görüntülenmesini kolaylaştırmayı amaçlamaktadır.
Protokol
Tüm hayvan deneyleri, Hayvan Araştırmaları Raporlama In Vivo Deneyler (ARRIVE) kılavuzlarına ve Laboratuvar Hayvanlarının Bakımı ve Kullanımı için Ulusal Sağlık Enstitüleri Kılavuzu'na uygun olarak yürütülmüştür. Bu çalışma, Şanghay Jiaotong Üniversitesi Tıp Fakültesi, Renji Hastanesi Hayvan Bakım ve Kullanım Komitesi tarafından onaylanmıştır. Bu çalışmada 7-8 haftalık STOCK Tg (Thy1-EGFP) MJrs/J suşlu erkek fareler (C57BL/6J x CBA kökenli) kullanıldı. Hayvanlar ticari olarak elde edildi (Malzeme Tablosuna bakınız) ve standart kafeslerde (22 °C ± 2 °C, 12 saat / 12 saat aydınlık / karanlık döngüsü, yiyecek ve su ad libitum) barındırıldı.
1. Perfüzyon
- 1 mL'lik bir şırınga kullanılarak intraperitoneal enjeksiyon yoluyla uygulanan% 1.25 tribromoetanol (0.02 mL / kg, Malzeme Tablosuna bakınız) kullanarak yetişkin fareleri derinlemesine uyuşturun. Ayak parmağınızı sıkıştırma tepkisi ile anestezi derinliğini kontrol edin.
- Farenin uzuvlarını çelik kelepçeler kullanarak beyaz akrilik levhaya sabitleyin. Farenin iki uyluk kemiği arasındaki deriyi kesin ve diyaframa ulaşana kadar yukarı doğru kesmeye devam edin. Makas ve düz forseps kullanarak kalbi ortaya çıkarmak için göğüs kafesinin her iki tarafını diyaframdan açın.
- Sol ventriküle 0,7 mm'lik bir infüzyon iğnesi yerleştirin. Sağ atriyal apendikste 1-2 mm'lik bir kesi yapın.
- Kanı tamamen temizlemek için peristaltik bir pompa ile 10 mL/dk hızında 10 U/mL sodyum heparin içeren 1x PBS ile perfüz. Karaciğerin tamamen soluklaşması başarılı bir klerens olduğunu gösterir.
- 10 mL/dk hızında peristaltik pompa ile 50 mL önceden soğutulmuş %4 PFA içeren perfüz. Fare kuyruğu kıvrılması ve kas seğirmesi gibi belirtileri izleyin.
NOT: Başarısız perfüzyon, sonraki temizleme işlemlerini etkileyebilir.
2. Numune çıkarma
- Örneğe zarar vermemek için makas ve forseps kullanarak tüm beyni ve omuriliği dikkatlice inceleyin.
- Oftalmik makas kullanarak farenin arkasındaki ve başındaki cildi ayırın. Omurgayı, her iki uzvun üst arka kenarlarını birleştiren çizginin vertebral kolonla kesiştiği noktada kesin.
- Omurgayı ve kafatasını ortaya çıkarmak için farenin boynundan ve sırtından kas ve yağ dokusunu çıkarın. Omurganın sol ve sağ tarafları ile omurilik arasındaki orta hat boşluğunu venüs makası kullanarak vertebral kanalın alt ucundan kesin.
- Omuriliği ortaya çıkarmak için kopmuş omurganın üst kısmını ve iki taraflı taraflarını çıkarın. Beyin bağlantısına ulaşana kadar adımları tekrarlayın.
- Venüs makasının bir bıçağının ucunu foramen magnum ile beyin arasına yerleştirin. Kafatasını açmak için orta sagital sütür boyunca kaydırın ve kesin. Kafatasını çıkarmak ve beyni ortaya çıkarmak için forseps kullanın.
- Forseps ve venüs makası kullanarak fare beyin-omurilik dokusunu kraniyal uçtan çıkarın.
NOT: Kesikler veya yüzey hasarı, sonraki temizleme sırasında daha da kötüleşebilir ve potansiyel olarak öngörülemeyen numune hasarına neden olabilir. Numuneleri dikkatli kullanın. - Stereomikroskop altında omurilik zarını çıkarmak için diseksiyon forseps kullanın.
- Beyin-omurilik örneğini dikişler kullanarak sabitleme plakasına (Malzeme Tablosuna bakınız) sabitleyin. %20 PFA'lık numune hacminin en az 4 katını ekleyin ve yavaş çalkalamak için 4 °C'de bir çalkalayıcı üzerine yerleştirin. Gece boyunca 16-24 saat sabitleyin.
NOT: Aşırı fiksasyon, aşırı protein çapraz bağlanmasına yol açarak temizleme verimliliğiniazaltır 14. Yetersiz veya gecikmiş fiksasyon antijen yıkımına ve doku morfolojisi yıkımına neden olabilir. - PFA'yı atın ve numuneyi 3x 1x PBS ile yıkayın. PBS hacminin numune hacminin en az 10 katı olduğundan emin olun ve numuneyi tamamen suya batırın. Her yıkama, kalan PFA'yı tamamen gidermek için 60 rpm'den az olmayan bir hızda bir çalkalayıcı üzerinde çalkalama ile 2 saat sürer.
3. Doku temizleme
NOT: Burada bir doku temizleme kiti kullanılmaktadır (bkz. Malzeme Tablosu).
- Çözelti A ve Çözelti B'yi 9:1 kütle oranında karıştırarak lipit giderme çözeltisini hazırlayın.
NOT: Lipid giderme solüsyonunun hacminin, numunenin hacminin 20 katından fazla olması önerilir. - Sabit dokuyu 50 mL'lik bir santrifüj tüpüne yerleştirin ve 50 mL lipit giderme solüsyonu ekleyin. Santrifüj tüpünü 37 °C'de bir çalkalayıcıya yerleştirin ve lipidin çıkarılması için 60 rpm'de hafifçe çalkalayın. Lipid giderme solüsyonunu 3-5 gün boyunca günlük olarak değiştirin. Tamamlanmayı belirlemek için, santrifüj tüpünü ölçek çizgili bir ışık kutusuna yerleştirin. Siyah ölçek çizgisi numune boyunca net bir şekilde görülebiliyorsa ve bozulmamışsa, işlem tamamlanmıştır.
- Numuneyi, kırılma indisi eşleştirmesi için 20 rpm'den daha düşük bir hızda çalkalayarak 25 °C'de bir çalkalayıcı üzerinde 25 mL Çözelti C'ye yerleştirin. Çözüm C'yi 24 saat sonra değiştirin. Numune tamamen Çözelti C'ye daldırılmış olarak kültür kabını, ölçek çizgisine sahip bir ışık kutusu üzerine yerleştirin. Siyah ölçek çizgisi numune boyunca net bir şekilde görülebiliyorsa ve bozulmamışsa, eşleştirme işlemi tamamlanmıştır.
NOT: Yetişkin fare dokuları için, kırılma indisi eşleşmesi tipik olarak 2 gün içinde tamamlanır.
4. Doku gömme
- 200 mL'lik bir cam şişede 147 g Çözelti C ile Jel çözeltisini hazırlayın, 3.0 g agaroz ekleyin, girdaplama ile iyice karıştırın, ardından kaynayana kadar mikrodalgada pişirin ve hemen mikrodalgayı kapatın. Santrifüj tüpünü, agaroz eriyene kadar 37 °C'de bir inkübatöre aktarın.
NOT: Jel solüsyonunun gerektiği kadar taze olarak hazırlanması tavsiye edilir. - Temizlenmiş numuneyi 2 mm derinliğinde 37 °C jel solüsyonu tabakası ile kalıba gömün ve yarı katılaşana kadar 4 °C'lik bir buzdolabında 30 dakika soğutun. Kırılma indisi ile eşleşen numuneyi kalıba yerleştirin ve numunenin üst kısmının üst kısmının altında veya aynı seviyede olacak şekilde jel solüsyonu ekleyin.
- Kalıbı 4 °C'lik buzdolabında 2 saat bekletin. Kalıp yüzeyi ile aynı seviyeye gelene kadar jel çözeltisi ekleyin. Bir lamel ile örtün. 4 °C buzdolabındaki katılaşmayı 2 saat hızlandırın. Gömülü numuneyi gece boyunca 4 °C buzdolabında saklayın. Mümkün olan en kısa sürede görüntülemeye devam edin.
5. Tarama
- Lameli cımbızla çıkarın ve gömülü numuneyi çıkarın. Numuneyi 50 mL'lik bir tüpe yerleştirin ve numuneyi tamamen daldırmak için 30 mL görüntüleme solüsyonu ekleyin.
- Numuneyi numune tutucuya sıkıca yapıştırmak için 502 yapıştırıcı uygulayın. Tutucuyu görüntüleme cihazına sabitleyin.
- Tarama yazılımını açıklandığı gibi çalıştırın. Büyütme bölümünde 4x büyütme seviyesini seçin. Kalibrasyon modunu etkinleştirmek için Kalibrasyon düğmesine tıklayın.
- Önizleme moduna girmek için Önizleme düğmesine tıklayın. Oluşturulan ışık tabakası numuneden geçene kadar numuneyi numune odasının altından yavaşça yukarı doğru hareket ettirmek için Z yönü hareket düğmesine tıklayın.
- Uygun lazer kanalını ve aydınlatma modu seçeneğini seçin. Örnek için tarama yolu yönünü seçin. Örneği yakalamaya başlamak için Otomatik Tarama düğmesine tıklayın.
Sonuçlar
Bu protokol, STOCK Tg (Thy1-EGFP) MJrs/J suşu erkek farelerde omurilik ile bağlantılı tüm beyni başarıyla izole eder. Ayrıca, floresan sinyallerin tam olarak korunmasını ve yakalanmasını sağlayarak numuneleri şeffaf hale getirerek orijinal floresanın bütünlüğünü koruyan net ve ayrıntılı görüntüler sağlar.
Şekil 1, sağlam bir beyin-omuriliği gösterir ve bu protokolde belirtilen diseksiyon adımlarının kesin olduğunu gösterir. Ek olarak, doku temizleme yüksek doğrulukla gerçekleştirildi ve karmaşık nöral yapıların görselleştirilmesini sağlayan şeffaf örnekler üretildi. Ayrıca, Şekil 2 , floresan sinyal görüntülemeye sahip beyin-omurilik örneğinin oldukça iyi korunduğunu ve orijinal floresanın bütünlüğünü koruyan net ve ayrıntılı görüntüler sağladığını göstermektedir. Şekil 3 , Şekil 2'de gösterilen tek tek hücrelerin daha yüksek büyütmeli bir görüntüsünü sunar.
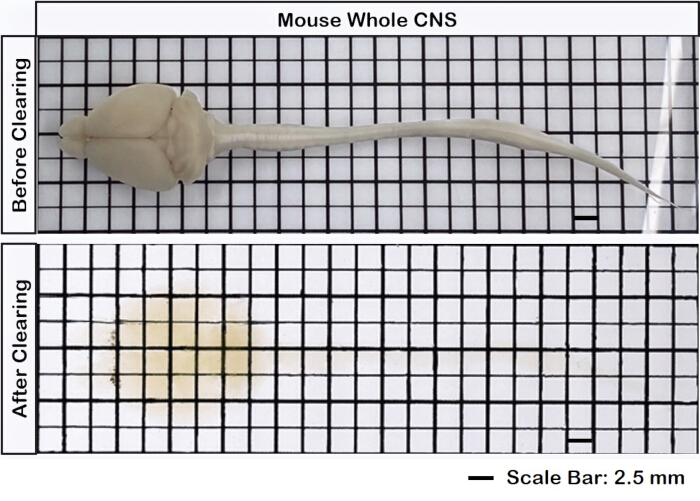
Şekil 1: Sağlam beyin omuriliği. Beyin dokusu, temizlenmeden önce ve sonra omuriliğe bağlanır. Ölçek çubuğu = 2 mm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
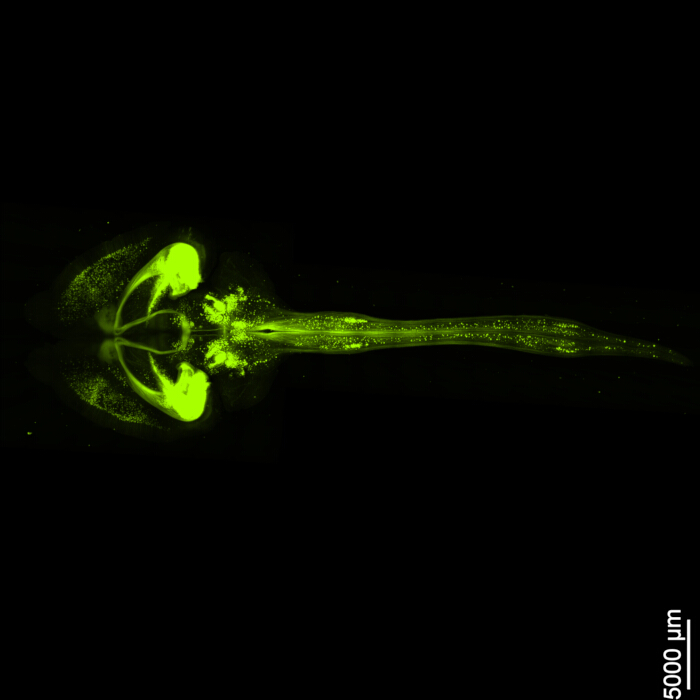
Şekil 2: Üç boyutlu floresan EGFP. Görüntü, omurilik ile olan bağlantısıyla birlikte tüm beyni göstermektedir. Ölçek çubuğu = 5000 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
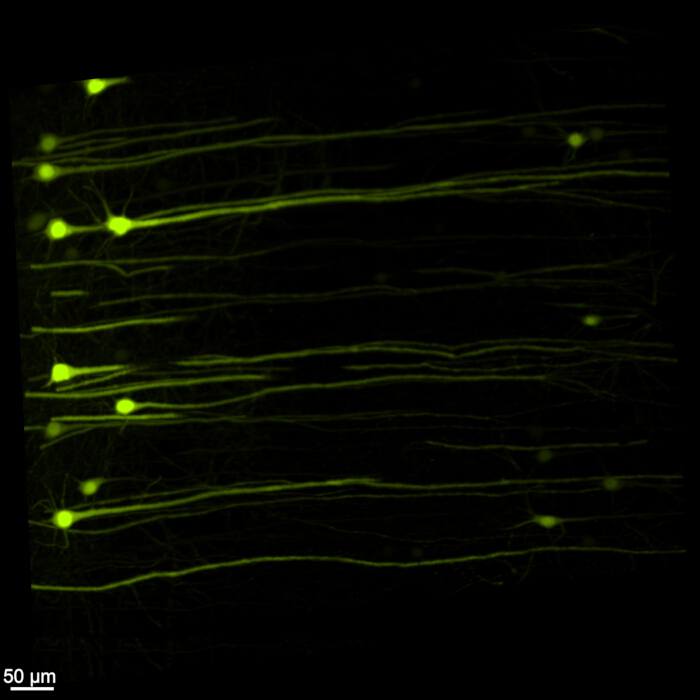
Resim 3: Yüksek büyütmeli üç boyutlu floresan EGFP. Beyin-omurilik örneği içindeki tek tek EGFP eksprese eden hücreleri vurgulayan daha yüksek büyütmeli bir görüntü. Ölçek çubuğu = 50 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Önerilen deneysel protokol, beyinleri floresan nöral izleme virüsleri ile etiketlenmiş omuriliklere bağlı farelerin kullanılmasını içerir. Bu protokol, omuriliğe bağlı kalan tüm beyin örneklerinin hazırlanması hakkında kapsamlı ve ayrıntılı talimatlar sağlar. Protokol, araştırmacıların süreci hassas bir şekilde tekrarlayabilmelerini sağlamak için her adımı titizlikle özetler.
Bu protokoldeki birkaç kritik adım, temizleme ve görüntüleme kalitesinin iyileştirilmesine katkıda bulunur. Omuriliğe bağlı olan tüm beyin örneklerinin tamamen çıkarılması önemli bir görevdir. Beynin ve omuriliğin bütünlüğünün korunması, doğru izleme ve sonraki analiz için çok önemlidir. Numune toplarken, kesikler veya yüzey hasarı, sonraki temizleme işlemi sırasında daha da kötüleşebilir ve potansiyel olarak öngörülemeyen hasara yol açabilir. Numunelerin bütünlüğünü sağlamak için, titiz numune alımı için malzemelerde belirtilen venüs makası ve diseksiyon cımbızının kullanılması çok önemlidir. Beyin-omurilik örneğinin dikişlerle sabitleme plakasına sabitlenmesi, sıvıya batırılmışken yerçekimi, basınç veya diğer faktörlerin neden olduğu deformasyonu önlemek için çok önemli bir adımdır.
Önceki araştırmalar genellikle yalnızca beyin veya omurilik8 yapısı ve işlevi üzerine odaklanmıştır. Bununla birlikte, merkezi sinir sistemi uyumlu bir birim olarak işlev görür. Beyinden gelen sinyallerin aşağıya doğru iletimi ve periferik sinyallerin omurilik yoluyla daha yüksek merkezlere yukarı doğru iletilmesi karmaşık bir süreçtir. Kapsamlı beyin-omurilik örneklerine erişim, bu sinyallerin entegrasyonunu araştırmak için avantajlıdır.
Birkaç birincil doku temizleme yaklaşımı mevcuttur: hidrofobik, hidrofilik, hidrojel bazlı ve doku genişleme temizleme yöntemleri 1,2,3. Temel ilkeler ve yöntemler aynıdır: ışığı kıran molekülleri (lipitler, pigmentler ve kalsiyum fosfat gibi) görüntüleme ortamının 2,15 kırılma indisiyle eşleşen diğer moleküllerle değiştirmek. Hidrofilik temizleme yöntemleri tipik olarak daha az toksisite sorunu oluşturur ve floresan proteinlerin ve boyalarınsinyallerini korumada daha etkilidir 1,2,3; Ancak, birkaç dezavantajları vardır. Doku şişmesine ve hacim dalgalanmalarına neden olarak numunelerin yapısal bütünlüğünü potansiyel olarak etkileyebilirler. Üre ve formamid gibi hiperhidrasyon bileşiklerinin kullanımı, dokuların biyolojik önemini etkileyen protein denatürasyonuna yol açabilir. Ek olarak, bu yöntemler genellikle basit ve floresan etiketleme ile uyumlu olsa da, daha büyük dokular için optimum temizleme elde etmek genellikle işlemi karmaşıklaştırabilecek çeşitli kimyasalları içeren karmaşık protokoller gerektirir. Ayrıca, belirli doku bölmelerini ayarlamak için hassas kimyasal karışımlara duyulan ihtiyaç, karmaşıklığı artırır ve belirli uygulamalar için dikkatli bir optimizasyon gerektirir.
Doku temizleme ve görüntüleme tekniklerindeki ilerlemeler, ışık tabakası floresan mikroskobu16 kullanarak, floresan proteinleri içsel olarak eksprese eden veya floresan etiketli antikorlarla işaretlenmiş farklı hücrelerin sinirlerinin ve hacminin dağılımını haritalamamızı sağlamıştır. Temizlenmiş dokularda çoğullanmış moleküler tespit tekniklerinin gelişimi hızla ilerlemektedir. Bu yöntemler, tümör mikro ortamları ve yoğun nöronal ağlar gibi karmaşık biyolojik sistemleri anlamak için çok önemli olan tek numunelerden çeşitli biyolojik analitlerin aynı anda profillenmesine izin verir. Ek olarak, FISH ve DNA Değişim Görüntüleme gibi yöntemler, DNA barkodlama ve hızlı görüntüleme yoluyla çoğullamayı geliştirmede umut vaat etmektedir. Yüksek oranda çoğullanmış protein görüntülemenin geleceği, karmaşık dokuların kapsamlı analizini mümkün kılan spesifik, hassas ve çoğullanmış tespit için nükleik asit konjuge antikorların kullanılmasında yatabilir17.
Sonuç olarak, temizlenmiş beyin-omurilik örneklerini çıkarmak ve hazırlamak için umut verici bir yol tarif ediyoruz. Çalışmamız, araştırmacıların ilgili araştırmaları yürütmelerine yardımcı olacaktır. Protokolümüz, PFA ile perfüze edilmiş farelerde şeffaflık dokusu elde etti. Bununla birlikte, yakın tarihli bir yayın, bilim adamlarının fare cildini geçici olarak şeffaf hale getirmek için uygulanabilecek toksik olmayan bir boya keşfettiklerini bildirmektedir18. Bu, araştırmacıların kan damarları ve iç organlar da dahil olmak üzere derinin altındaki fizyolojik yapıları gözlemlemelerini sağlar. Bu teknoloji, merkezi ve periferik sinir sistemleri, solunum sistemi ve dolaşım sistemi dahil olmak üzere çeşitli fare organlarının in vivo gözlemini mümkün kılan, kalınlık ve şeffaflık derecesindeki iyileştirmelerle yakın gelecekte daha gelişmiş hale gelebilir19.
Açıklamalar
Yazarlar hiçbir rekabet çıkarı beyan etmezler.
Teşekkürler
Çin Ulusal Doğa Bilimleri Vakfı (XY Sun'a 82101249 ve 82471204 NO'lu hibe verin). Çin Doktora Sonrası Araştırma Vakfı (XY Sun'a hibe NO. 2022M722125).
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1 ml syringe | Shandong Weigao Group Medical Polymer | ||
| 502 glue | Deli Group | ||
| BD insulin syringe | Becton,Dickinson and Company | 328421 | |
| Bend toothed dissecting forceps | Jinzhong | JD1050 | |
| Circular steel clamp | Weili | ||
| Fine scissors | Jinzhong | y00030 | |
| Hemostatic forceps bent with tooth | Jinzhong | J31020 | |
| Hemostatic forceps straight with tooth | Jinzhong | J31010 | |
| Infusion needle 0.7mm | Kindly Group | ||
| Light box scale line | Nuohai Life Science | NH210901 | |
| Microdissection straight forceps | Jinzhong | WA3020 | |
| NobeliumSoftware | Nuohai Life Science | Scanning software | |
| paraformaldehyde | Biosharp | BL539A | |
| Peristaltic pumps | Nuohai Life Science | NH1000 | |
| Peristaltic pumps head | Nuohai Life Science | NH-15 | |
| Phosphate buffered saline | Servicebio | G4202 | |
| Sodium heparin | Shanghai Pharma | H31022051 | |
| STOCK Tg (Thy1-EGFP) MJrs/J strain mice | Jackson Laboratory | 007788 | |
| Straight toothed dissecting forceps | Jinzhong | JD1060 | |
| Tissue clearing Kit(hyrophilic) | Nuohai Life Science | NH-CR-210701 | |
| Tissue culture treater 100mm x 20mm | NEST | 704001 | |
| Tissue scissors | Jinzhong | J21040 | |
| Tribromoethanol | Aibei Biotechnology | M2910 | |
| Venus scissors | Jinzhong | YBC010 |
Referanslar
- Ueda, H. R., et al. Tissue clearing and its applications in neuroscience. Nat Rev Neurosci. 21 (2), 61-79 (2020).
- Tainaka, K., Kuno, A., Kubota, S. I., Murakami, T., Ueda, H. R. Chemical principles in tissue clearing and staining protocols for whole-body cell profiling. Annu Rev Cell Dev Biol. 32, 713-741 (2016).
- Susaki, E. A., Ueda, H. R. Whole-body and whole-organ clearing and imaging techniques with single-cell resolution: Toward organism-level systems biology in mammals. Cell Chem Biol. 23 (1), 137-157 (2016).
- Wu, M., et al. Innervation of nociceptor neurons in the spleen promotes germinal center responses and humoral immunity. Cell. 187 (12), 2935-2951.e19 (2024).
- Liu, T., et al. Local sympathetic innervations modulate the lung innate immune responses. Sci Adv. 6 (20), eaay1497 (2020).
- Qi, Y., et al. FDISCO: Advanced solvent-based clearing method for imaging whole organs. Sci Adv. 5 (1), eaau8355 (2019).
- Bagnoli, S., Terzibasi Tozzini, E., Cellerino, A. Whole-Brain clearing and immunofluorescence in Nothobranchius furzeri. Cold Spring Harb Protoc. 2023 (9), 698-704 (2023).
- Lu, T., Shinozaki, M., Nagoshi, N., Nakamura, M., Okano, H. 3D imaging of supraspinal inputs to the thoracic and lumbar spinal cord mapped by retrograde tracing and light-sheet microscopy. J Neurochem. 162 (4), 352-370 (2022).
- Saritas, T., Puelles, V. G., Su, X. T., Ellison, D. H., Kramann, R. Optical clearing and imaging of immunolabeled kidney tissue. J Vis Exp. (149), e60002 (2019).
- Song, J. H., et al. Precise mapping of single neurons by calibrated 3D reconstruction of brain slices reveals topographic projection in mouse visual cortex. Cell Rep. 31 (8), 107682 (2020).
- Fournel, R., Veruki, M. L., Hartveit, E. Digital reconstruction and quantitative morphometric analysis of bipolar cells in live rat retinal slices. J Comp Neurol. 530 (10), 1700-1728 (2022).
- Lin, R., et al. Cell-type-specific and projection-specific brain-wide reconstruction of single neurons. Nat Methods. 15 (12), 1033-1036 (2018).
- Peng, Y. C., et al. Rapid histological assessment of prostate specimens in the three-dimensional space by hydrophilic tissue clearing and confocal microscopy. J Histochem Cytochem. 70 (8), 597-608 (2022).
- Singhal, P., et al. Evaluation of histomorphometric changes in tissue architecture in relation to alteration in fixation protocol - An in vitro study. J Clin Diagn Res. 10 (8), ZC28-ZC32 (2016).
- Tainaka, K., et al. Chemical landscape for tissue clearing based on hydrophilic reagents. Cell Rep. 24 (8), 2196-2210.e9 (2018).
- Lee, S. H., Son, H. J. Second wave, late-stage neuroinflammation in cleared brains of aged 5xFAD Alzheimer's mice detected by macrolaser light sheet microscopy imaging. Int J Mol Sci. 24 (23), 242317058 (2023).
- Zhao, J., Lai, H. M., Qi, Y., He, D., Sun, H. Current status of tissue clearing and the path forward in neuroscience. ACS Chem Neurosci. 12 (1), 5-29 (2021).
- Ou, Z., et al. Achieving optical transparency in live animals with absorbing molecules. Science. 385 (6713), eadm6869 (2024).
- Ou, Z., et al. Achieving optical transparency in live animals with absorbing molecules. Science. 385, eadm6869 (2024).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır