Method Article
Extracción y limpieza de tejidos: preparación de muestras de cerebro-médula espinal de ratón
* Estos autores han contribuido por igual
En este artículo
Resumen
Este estudio presenta un protocolo para extraer y preparar muestras claras de todo el cerebro y la médula espinal con señales fluorescentes conservadas, lo que mejora la eficiencia experimental y la integridad de los datos para avanzar en la investigación en neurociencia.
Resumen
La investigación en neurociencia centrada en el sistema nervioso central requiere una comprensión profunda de varios factores, incluida la distribución celular, la conectividad neuronal y la dinámica molecular. Las metodologías tradicionales para investigar todo el cerebro y la médula espinal a menudo implican aislar, seccionar y escanear cortes de tejido, seguidos por el laborioso proceso de reconstrucción de imágenes tridimensionales. Este enfoque convencional puede llevar mucho tiempo y ser engorroso. Los avances en la limpieza de tejidos y las técnicas de obtención de imágenes de órganos completos han revolucionado el análisis de todo el cerebro y la médula espinal. Para maximizar el potencial de estos métodos innovadores, es esencial extraer y limpiar muestras de cerebro mientras se mantiene su conexión con la médula espinal. Este protocolo proporciona una guía detallada y sistemática para preparar muestras del cerebro conectadas a la médula espinal, describiendo los procedimientos de extracción y limpieza. Al racionalizar estos procesos, este enfoque mejora significativamente la eficiencia experimental y la integridad de los datos, fomentando así los avances en la investigación en neurociencia y permitiendo investigaciones más exhaustivas sobre las complejidades del sistema nervioso central.
Introducción
El mapeo y el análisis precisos de la distribución nerviosa proporcionan información valiosa sobre la organización estructural y funcional del sistema nervioso central, allanando el camino para estrategias terapéuticas innovadoras y mejorando nuestra comprensión general de los mecanismos neuronales. En la actualidad, faltan tutoriales en vídeo completos para guiar a los investigadores en la preparación y extracción de muestras de cerebro conectadas a la médula espinal y lograr una limpieza exitosa del tejido.
Existen varios enfoques de limpieza de tejidos disponibles: métodos de limpieza hidrofóbicos, hidrófilos, basados en hidrogeles y de expansión de tejidos 1,2,3. La técnica de limpieza de tejidos se aplica ampliamente en el estudio de órganos como el bazo4, los pulmones5, el músculo gastrocnemio6, el cerebro7, la médula espinal8 y los riñones9. Nuestro protocolo proporcionará instrucciones detalladas sobre cómo preparar muestras de cerebro completo conectadas a la médula espinal que han sido marcadas con marcador fluorescente utilizando ratones de la cepa STOCK Tg (Thy1-EGFP) MJrs/J. Ofrecerá una guía paso a paso para la extracción de muestras y describirá el protocolo de limpieza utilizando kits hidrofílicos de limpieza de tejidos. Este protocolo ayuda a los investigadores a dominar todo el proceso, desde la extracción de muestras de cerebro y médula espinal hasta la preparación y el posterior escaneo. Esto no solo mejorará la eficiencia experimental, sino que también garantizará la integridad y la calidad de las muestras, proporcionando datos más precisos y confiables para respaldar la investigación en neurociencia.
En comparación con los métodos convencionales de seccionamiento, imágenes y reconstrucción tridimensional10,11, el enfoque presentado aquí ofrece varias ventajas clave, tales como (1) integridad estructural mejorada: al mantener la estructura de todo el órgano, este método reduce el riesgo de perder información crítica que puede ocurrir con el corte12; (2) adquisición completa de datos: el uso de un kit de limpieza de tejidos permite un mapeo detallado de las células que son difíciles de lograr con las técnicas tradicionales; (3) Eficiencia y precisión: el protocolo agiliza todo el proceso, desde la extracción de la muestra hasta la obtención de imágenes, reduciendo el tiempo requerido por los procedimientos de inmunohistoquímica o tinción y minimizando los errores asociados con el corte y el montaje13.
El protocolo supera las limitaciones de los métodos tradicionales de seccionamiento, que a menudo dan como resultado datos incompletos y fragmentados. Al preservar la conexión intacta entre el cerebro y la médula espinal y utilizar métodos modernos de limpieza de tejidos, este protocolo proporciona una visión más holística del sistema nervioso central, que es crucial para comprender los complejos mecanismos y funciones neuronales. El objetivo principal de este método es permitir la obtención de imágenes completas del sistema nervioso central mediante la preparación de muestras de cerebro completo conectadas a la médula espinal, que han sido marcadas con marcadores neuronales fluorescentes. Este protocolo tiene como objetivo facilitar la visualización detallada de las estructuras neuronales y las distribuciones celulares utilizando métodos anatómicos avanzados y técnicas de limpieza de tejidos.
Protocolo
Todos los experimentos con animales se llevaron a cabo de acuerdo con las pautas de Animal Research Reporting In Vivo Experiments (ARRIVE) y la Guía de los Institutos Nacionales de Salud para el Cuidado y Uso de Animales de Laboratorio. El presente estudio fue aprobado por el Comité de Cuidado y Uso de Animales del Hospital Renji de la Facultad de Medicina de la Universidad Jiaotong de Shanghai. Aquí, se utilizaron ratones machos de 7-8 semanas de edad STOCK Tg (Thy1-EGFP) de la cepa MJrs/J (origen C57BL/6J x CBA) para el presente estudio. Los animales fueron obtenidos comercialmente (ver Tabla de Materiales) y alojados en jaulas estándar (22 °C ± 2 °C, ciclo de luz/oscuridad de 12 h/12 h, alimento y agua ad libitum).
1. Perfusión
- Anestesiar profundamente ratones adultos con tribromoetanol al 1,25% (0,02 mL/kg, ver Tabla de Materiales) administrado por inyección intraperitoneal con una jeringa de 1 mL. Verifique la profundidad de la anestesia mediante la respuesta de pellizco de los dedos de los pies.
- Fije las extremidades del ratón a la placa acrílica blanca con abrazaderas de acero. Corta la piel entre los dos fémures del ratón y continúa cortando hacia arriba hasta llegar al diafragma. Abra ambos lados del tórax a través del diafragma para exponer el corazón con tijeras y pinzas rectas.
- Inserte una aguja de infusión de 0,7 mm en el ventrículo izquierdo. Hacer una incisión de 1-2 mm en la orejuela auricular derecha.
- Perfunde con 1x PBS que contenga 10 U/mL de heparina sódica a una tasa de 10 mL/min con una bomba peristáltica (ver Tabla de Materiales) para limpiar completamente la sangre. El hecho de que el hígado se vuelva completamente pálido indica un aclarado exitoso.
- Perfundir con 50 mL de PFA preenfriado al 4% con una bomba peristáltica a una velocidad de 10 mL/min. Esté atento a signos como la curvatura de la cola del ratón y los espasmos musculares.
NOTA: La perfusión fallida puede afectar los procesos de aclarado posteriores.
2. Extracción de muestras
- Diseccione cuidadosamente todo el cerebro y la médula espinal con tijeras y pinzas para evitar dañar la muestra.
- Separe la piel de la espalda y la cabeza del ratón con unas tijeras oftálmicas. Corta la columna vertebral en el punto donde la línea que conecta los bordes posteriores superiores de ambas extremidades se cruza con la columna vertebral.
- Retire el músculo y el tejido graso del cuello y la espalda del ratón para exponer la columna vertebral y el cráneo. Corte a lo largo del espacio de la línea media entre los lados izquierdo y derecho de la columna vertebral y la médula espinal desde el extremo inferior del canal vertebral con unas tijeras de venus.
- Retire la parte superior y los lados bilaterales de la columna vertebral cortada para exponer la médula espinal. Repite los pasos hasta llegar a la conexión cerebral.
- Coloque la punta de una hoja de las tijeras de Venus entre el foramen magnum y el cerebro. Desliza y corta a lo largo de la sutura sagital media para abrir el cráneo. Use fórceps para extirpar el cráneo y exponer el cerebro.
- Retire el tejido del cerebro y la médula espinal del ratón del extremo craneal con pinzas y tijeras de venus.
NOTA: Los cortes o daños en la superficie pueden exacerbarse durante el desbroce posterior, lo que puede causar daños impredecibles en la muestra. Manipule las muestras con cuidado. - Use pinzas de disección para extraer la membrana de la médula espinal bajo el microscopio estereoscópico.
- Fije la muestra de encéfalo y médula espinal a la placa de fijación (consulte la Tabla de materiales) mediante suturas. Agregue al menos 20 veces el volumen de muestra de PFA al 4% y colóquelo en un agitador a 4 °C para una agitación lenta. Fijar durante la noche durante 16-24 h.
NOTA: La fijación excesiva conduce a una reticulación excesiva de proteínas, lo que reduce la eficiencia de limpieza14. Una fijación insuficiente o tardía puede causar degradación del antígeno y destrucción de la morfología del tejido. - Deseche el PFA y lave la muestra 3 veces con 1x PBS. Asegúrese de que el volumen de PBS sea al menos 10 veces el volumen de la muestra, sumergiendo completamente la muestra. Cada lavado dura 2 h con agitación en un agitador a una velocidad no inferior a 60 rpm para eliminar completamente los PFA residuales.
3. Limpieza de tejidos
NOTA: Aquí, se utiliza un kit de limpieza de tejidos (ver Tabla de Materiales).
- Prepare la solución de eliminación de lípidos mezclando la solución A y la solución B en una proporción de masa de 9:1.
NOTA: Se recomienda que el volumen de la solución de eliminación de lípidos sea más de 20 veces el volumen de la muestra. - Coloque el tejido fijado en un tubo de centrífuga de 50 mL y agregue 50 mL de la solución de eliminación de lípidos. Coloque el tubo de centrífuga en un agitador a 37 °C, agitando suavemente a 60 rpm para la eliminación de lípidos. Cambie la solución de eliminación de lípidos diariamente durante 3-5 días. Para determinar la finalización, coloque el tubo de centrífuga en una caja de luz con una línea de escala. Si la línea de escala negra es claramente visible y no se distorsiona a través de la muestra, el proceso está completo.
- Coloque la muestra en 20 mL de solución C en un agitador a 25 °C, agitando a menos de 60 rpm para que coincida con el índice de refracción. Cambie la solución C después de 24 h. Coloque la placa de cultivo con la muestra completamente sumergida en la solución C en una caja de luz con una línea de escala. Si la línea de escala negra es claramente visible y no está distorsionada a través de la muestra, el proceso de coincidencia está completo.
NOTA: En el caso de los tejidos de ratón adultos, la coincidencia del índice de refracción suele completarse en 2 días.
4. Incrustación de tejidos
- Prepare la solución de gel con 147 g de solución C en una botella de vidrio de 200 ml, agregue 3,0 g de agarosa, mezcle bien por vórtice, luego cocine en el microondas hasta que hierva y apague inmediatamente el microondas. Transfiera el tubo de centrífuga a una incubadora a 37 °C hasta que la agarosa se disuelva.
NOTA: Se recomienda preparar la solución de gel fresca según sea necesario. - Incrustar la muestra aclarada con una capa de 2 mm de profundidad de solución de gel a 37 °C en el molde y enfriar en un refrigerador a 4 °C durante 30 minutos hasta que esté semisolidificada. Coloque la muestra del índice de refracción en el molde y agregue la solución de gel para que esté nivelada o ligeramente por debajo de la parte superior de la muestra.
- Vuelva a colocar el molde en el frigorífico a 4 °C durante 2 h. Agregue la solución de gel hasta que esté nivelada con la superficie del molde. Cubra con un cubreobjetos. Acelere la solidificación en el refrigerador a 4 °C durante 2 h. Guarde la muestra incrustada durante la noche en el refrigerador a 4 °C. Proceda con la toma de imágenes lo antes posible.
5. Escaneo
- Retire el cubreobjetos con unas pinzas y saque la muestra incrustada. Coloque la muestra en un tubo de 50 mL y agregue 30 mL de solución de imagen para sumergir completamente la muestra.
- Aplique el adhesivo 502 para fijar firmemente la muestra en el portamuestras. Fije el soporte en el dispositivo de imagen.
- Ejecute el software de escaneo como se describe. Seleccione el nivel de aumento de 4x en la sección de ampliación. Haga clic en el botón Calibración para activar el modo de calibración.
- Haga clic en el botón Vista previa para ingresar al modo de vista previa. Haga clic en el botón de movimiento en dirección Z para mover lentamente la muestra hacia arriba desde la parte inferior de la cámara de muestras hasta que la hoja de luz generada pase a través de la muestra.
- Seleccione el canal láser y la opción de modo de iluminación adecuados. Seleccione la dirección de la ruta de escaneo de la muestra. Haga clic en el botón Escaneo automático para comenzar a capturar la muestra.
Resultados
Este protocolo aísla con éxito todo el cerebro conectado con la médula espinal en ratones macho de la cepa STOCK Tg (Thy1-EGFP) MJrs/J. También hace que las muestras sean transparentes, asegurando que las señales fluorescentes se conserven y capturen por completo, proporcionando imágenes claras y detalladas que mantienen la integridad de la fluorescencia original.
La Figura 1 muestra un cerebro-médula espinal intacto, lo que demuestra que los pasos de disección descritos en este protocolo son precisos. Además, la limpieza de tejidos se realizó con alta precisión, produciendo muestras transparentes que permiten la visualización de estructuras neuronales intrincadas. Además, la Figura 2 muestra que la muestra de encéfalo y médula espinal con la imagen de señal fluorescente está notablemente bien conservada, proporcionando imágenes claras y detalladas que conservan la integridad de la fluorescencia original. La Figura 3 presenta una imagen de mayor aumento de las células individuales representadas en la Figura 2.
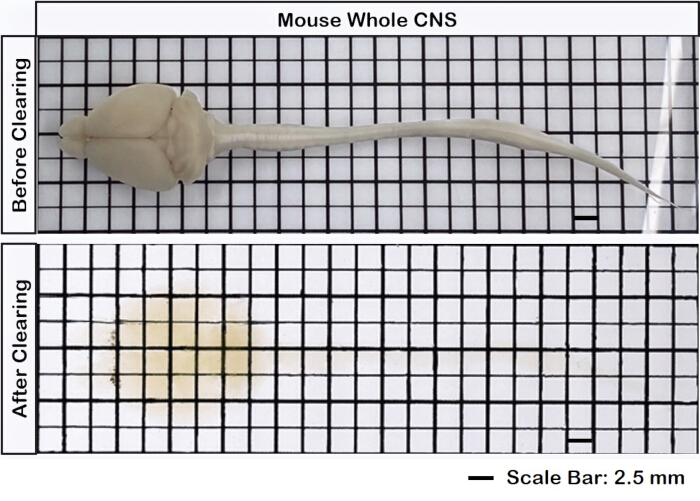
Figura 1: Médula espinal encefálica intacta. El tejido cerebral está conectado a la médula espinal, tanto antes como después de la depuración. Barra de escala = 2 mm. Haga clic aquí para ver una versión más grande de esta figura.
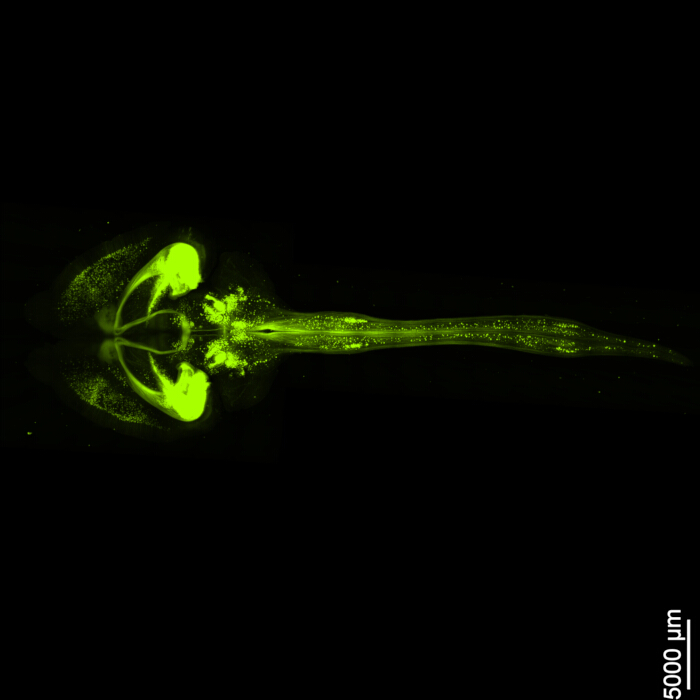
Figura 2: EGFP fluorescente tridimensional. La imagen muestra todo el cerebro junto con su conexión con la médula espinal. Barra de escala = 5000 μm. Haga clic aquí para ver una versión más grande de esta figura.
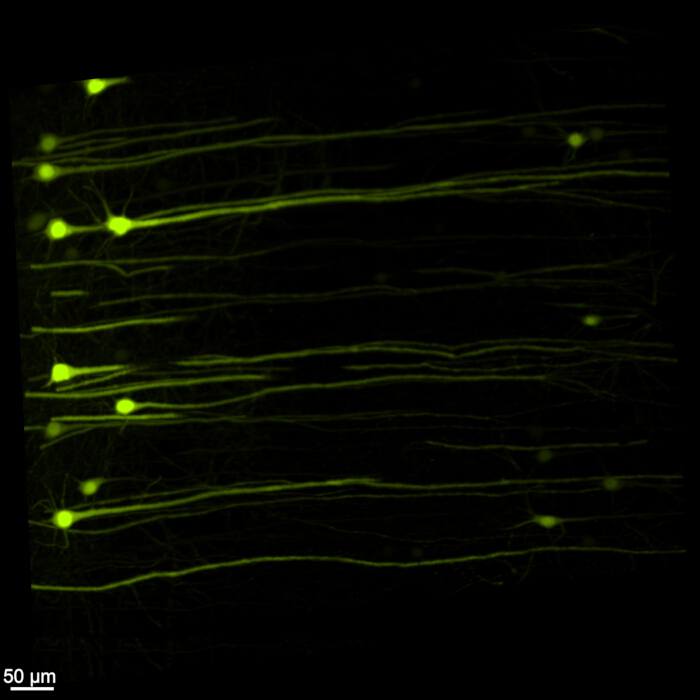
Figura 3: EGFP fluorescente tridimensional de gran aumento. Una imagen de mayor aumento que resalta las células individuales que expresan EGFP dentro de la muestra de encéfalo y médula espinal. Barra de escala = 50 μm. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El protocolo experimental propuesto implica el uso de ratones cuyos cerebros están conectados a la médula espinal marcada con virus fluorescentes de rastreo neuronal. Este protocolo proporciona instrucciones completas y detalladas sobre la preparación de muestras de todo el cerebro que permanecen conectadas a la médula espinal. El protocolo describe meticulosamente cada paso, asegurando que los investigadores puedan replicar el proceso con precisión.
Varios pasos críticos en este protocolo contribuyen a mejorar la calidad de la limpieza y la obtención de imágenes. La extracción completa de muestras de todo el cerebro que están conectadas a la médula espinal es una tarea importante. Mantener la integridad del cerebro y la médula espinal es crucial para un rastreo preciso y un análisis posterior. Al recolectar muestras, las incisiones o los daños en la superficie pueden exacerbarse durante el proceso de limpieza posterior, lo que puede provocar daños impredecibles. Para garantizar la integridad de las muestras, es crucial utilizar las tijeras de venus y las pinzas de disección especificadas en los materiales para un muestreo meticuloso. Asegurar la muestra de encéfalo y médula espinal a la placa de fijación con suturas es un paso crucial para evitar la deformación causada por la gravedad, la presión u otros factores mientras se sumerge en líquido.
Las investigaciones anteriores a menudo se han concentrado exclusivamente en la estructura y función del cerebro o la médula espinal8 . Sin embargo, el sistema nervioso central funciona como una unidad cohesiva. La transmisión de señales desde el cerebro hacia abajo y la transmisión hacia arriba de señales periféricas a través de la médula espinal a los centros superiores es un proceso complejo. El acceso a muestras completas de cerebro y médula espinal es ventajoso para investigar la integración de estas señales.
Existen varios enfoques primarios de limpieza de tejidos: métodos de limpieza hidrofóbicos, hidrófilos, basados en hidrogel y de expansión de tejidos 1,2,3. Los principios y métodos subyacentes son los mismos: sustituir moléculas que difractan la luz (como lípidos, pigmentos y fosfato de calcio) por otras moléculas que coincidan con el índice de refracción del medio de imagen 2,15. Los métodos de aclaramiento hidrofílico suelen plantear menos problemas de toxicidad y son más eficaces para preservar las señales de las proteínas fluorescentes y los colorantes 1,2,3; Sin embargo, tienen varios inconvenientes. Pueden causar hinchazón del tejido y fluctuaciones de volumen, lo que puede afectar la integridad estructural de las muestras. El uso de compuestos hiperhidratantes como la urea y la formamida puede conducir a la desnaturalización de las proteínas, lo que afecta la relevancia biológica de los tejidos. Además, si bien estos métodos son generalmente simples y compatibles con el etiquetado fluorescente, lograr una limpieza óptima para tejidos más grandes a menudo requiere protocolos complejos que involucran varios productos químicos, lo que puede complicar el proceso. Además, la necesidad de mezclas químicas precisas para ajustar compartimentos de tejido específicos se suma a la complejidad, lo que requiere una optimización cuidadosa para aplicaciones específicas.
Los avances en la limpieza de tejidos y las técnicas de imagen nos han permitido mapear la distribución de los nervios y el volumen de diferentes células que, o bien expresan intrínsecamente proteínas fluorescentes o bien están marcadas con anticuerpos marcados con fluorescencia, utilizando microscopía de fluorescencia de lámina de luz16. El desarrollo de técnicas de detección molecular multiplexada en tejidos aclarados está avanzando rápidamente. Estos métodos permiten el perfilado simultáneo de varios analitos biológicos a partir de muestras individuales, lo que es crucial para comprender sistemas biológicos complejos como los microambientes tumorales y las redes neuronales densas. Además, métodos como FISH y DNA Exchange Imaging son prometedores para mejorar la multiplexación a través de códigos de barras de ADN e imágenes rápidas. El futuro de la obtención de imágenes de proteínas altamente multiplexadas puede residir en el uso de anticuerpos conjugados con ácidos nucleicos para la detección específica, sensible y multiplexada, lo que permite un análisis exhaustivo de tejidos complejos17.
En conclusión, describimos una forma prometedora de extraer y preparar muestras claras de cerebro y médula espinal. Nuestro estudio ayudará a los investigadores a llevar a cabo investigaciones relevantes. Nuestro protocolo logró la transparencia del tejido en ratones perfundidos con PFA. Sin embargo, una publicación reciente informa que los científicos han descubierto un tinte no tóxico que se puede aplicar a la piel del ratón para hacerlatransparente temporalmente. Esto permite a los investigadores observar las estructuras fisiológicas debajo de la piel, incluidos los vasos sanguíneos y los órganos internos. Esta tecnología puede llegar a ser más avanzada en un futuro próximo, con mejoras en el grosor y el grado de transparencia, permitiendo la observación in vivo de varios órganos de ratón, incluyendo el sistema nervioso central y periférico, el sistema respiratorio y el sistema circulatorio19.
Divulgaciones
Los autores declaran no tener intereses contrapuestos.
Agradecimientos
Fundación Nacional de Ciencias Naturales de China (subvención Nº 82101249 y Nº 82471204 a XY Sun). Fundación de Investigación Postdoctoral de China (subvención Nº 2022M722125 a XY Sun).
Materiales
| Name | Company | Catalog Number | Comments |
| 1 ml syringe | Shandong Weigao Group Medical Polymer | ||
| 502 glue | Deli Group | ||
| BD insulin syringe | Becton,Dickinson and Company | 328421 | |
| Bend toothed dissecting forceps | Jinzhong | JD1050 | |
| Circular steel clamp | Weili | ||
| Fine scissors | Jinzhong | y00030 | |
| Hemostatic forceps bent with tooth | Jinzhong | J31020 | |
| Hemostatic forceps straight with tooth | Jinzhong | J31010 | |
| Infusion needle 0.7mm | Kindly Group | ||
| Light box scale line | Nuohai Life Science | NH210901 | |
| Microdissection straight forceps | Jinzhong | WA3020 | |
| NobeliumSoftware | Nuohai Life Science | Scanning software | |
| paraformaldehyde | Biosharp | BL539A | |
| Peristaltic pumps | Nuohai Life Science | NH1000 | |
| Peristaltic pumps head | Nuohai Life Science | NH-15 | |
| Phosphate buffered saline | Servicebio | G4202 | |
| Sodium heparin | Shanghai Pharma | H31022051 | |
| STOCK Tg (Thy1-EGFP) MJrs/J strain mice | Jackson Laboratory | 007788 | |
| Straight toothed dissecting forceps | Jinzhong | JD1060 | |
| Tissue clearing Kit(hyrophilic) | Nuohai Life Science | NH-CR-210701 | |
| Tissue culture treater 100mm x 20mm | NEST | 704001 | |
| Tissue scissors | Jinzhong | J21040 | |
| Tribromoethanol | Aibei Biotechnology | M2910 | |
| Venus scissors | Jinzhong | YBC010 |
Referencias
- Ueda, H. R., et al. Tissue clearing and its applications in neuroscience. Nat Rev Neurosci. 21 (2), 61-79 (2020).
- Tainaka, K., Kuno, A., Kubota, S. I., Murakami, T., Ueda, H. R. Chemical principles in tissue clearing and staining protocols for whole-body cell profiling. Annu Rev Cell Dev Biol. 32, 713-741 (2016).
- Susaki, E. A., Ueda, H. R. Whole-body and whole-organ clearing and imaging techniques with single-cell resolution: Toward organism-level systems biology in mammals. Cell Chem Biol. 23 (1), 137-157 (2016).
- Wu, M., et al. Innervation of nociceptor neurons in the spleen promotes germinal center responses and humoral immunity. Cell. 187 (12), 2935-2951.e19 (2024).
- Liu, T., et al. Local sympathetic innervations modulate the lung innate immune responses. Sci Adv. 6 (20), eaay1497 (2020).
- Qi, Y., et al. FDISCO: Advanced solvent-based clearing method for imaging whole organs. Sci Adv. 5 (1), eaau8355 (2019).
- Bagnoli, S., Terzibasi Tozzini, E., Cellerino, A. Whole-Brain clearing and immunofluorescence in Nothobranchius furzeri. Cold Spring Harb Protoc. 2023 (9), 698-704 (2023).
- Lu, T., Shinozaki, M., Nagoshi, N., Nakamura, M., Okano, H. 3D imaging of supraspinal inputs to the thoracic and lumbar spinal cord mapped by retrograde tracing and light-sheet microscopy. J Neurochem. 162 (4), 352-370 (2022).
- Saritas, T., Puelles, V. G., Su, X. T., Ellison, D. H., Kramann, R. Optical clearing and imaging of immunolabeled kidney tissue. J Vis Exp. (149), e60002 (2019).
- Song, J. H., et al. Precise mapping of single neurons by calibrated 3D reconstruction of brain slices reveals topographic projection in mouse visual cortex. Cell Rep. 31 (8), 107682 (2020).
- Fournel, R., Veruki, M. L., Hartveit, E. Digital reconstruction and quantitative morphometric analysis of bipolar cells in live rat retinal slices. J Comp Neurol. 530 (10), 1700-1728 (2022).
- Lin, R., et al. Cell-type-specific and projection-specific brain-wide reconstruction of single neurons. Nat Methods. 15 (12), 1033-1036 (2018).
- Peng, Y. C., et al. Rapid histological assessment of prostate specimens in the three-dimensional space by hydrophilic tissue clearing and confocal microscopy. J Histochem Cytochem. 70 (8), 597-608 (2022).
- Singhal, P., et al. Evaluation of histomorphometric changes in tissue architecture in relation to alteration in fixation protocol - An in vitro study. J Clin Diagn Res. 10 (8), ZC28-ZC32 (2016).
- Tainaka, K., et al. Chemical landscape for tissue clearing based on hydrophilic reagents. Cell Rep. 24 (8), 2196-2210.e9 (2018).
- Lee, S. H., Son, H. J. Second wave, late-stage neuroinflammation in cleared brains of aged 5xFAD Alzheimer's mice detected by macrolaser light sheet microscopy imaging. Int J Mol Sci. 24 (23), 242317058 (2023).
- Zhao, J., Lai, H. M., Qi, Y., He, D., Sun, H. Current status of tissue clearing and the path forward in neuroscience. ACS Chem Neurosci. 12 (1), 5-29 (2021).
- Ou, Z., et al. Achieving optical transparency in live animals with absorbing molecules. Science. 385 (6713), eadm6869 (2024).
- Ou, Z., et al. Achieving optical transparency in live animals with absorbing molecules. Science. 385, eadm6869 (2024).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados