Method Article
Extraction et clarification tissulaire Préparation d’échantillons de cerveau-moelle épinière de souris
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Cette étude présente un protocole pour l’extraction et la préparation d’échantillons clairs de cerveau entier et de moelle épinière avec des signaux fluorescents préservés, améliorant ainsi l’efficacité expérimentale et l’intégrité des données pour faire progresser la recherche en neurosciences.
Résumé
La recherche en neurosciences axée sur le système nerveux central nécessite une compréhension approfondie de divers facteurs, notamment la distribution cellulaire, la connectivité neuronale et la dynamique moléculaire. Les méthodologies traditionnelles d’étude de l’ensemble du cerveau et de la moelle épinière impliquent souvent l’isolement, la section et le balayage de coupes de tissus, suivis d’un processus laborieux de reconstruction d’images tridimensionnelles. Cette approche conventionnelle peut être à la fois chronophage et fastidieuse. Les progrès réalisés dans les techniques d’élimination des tissus et d’imagerie de l’organe entier ont révolutionné l’analyse de l’ensemble du cerveau et de la moelle épinière. Pour maximiser le potentiel de ces méthodes innovantes, il est essentiel d’extraire et d’effacer des échantillons de cerveau tout en maintenant leur connexion avec la moelle épinière. Ce protocole fournit un guide détaillé et systématique pour la préparation d’échantillons de cerveau relié à la moelle épinière, décrivant les procédures d’extraction et de nettoyage. En rationalisant ces processus, cette approche améliore considérablement l’efficacité expérimentale et l’intégrité des données, favorisant ainsi les progrès de la recherche en neurosciences et permettant des investigations plus complètes sur les complexités du système nerveux central.
Introduction
La cartographie et l’analyse précises de la distribution nerveuse fournissent des informations précieuses sur l’organisation structurelle et fonctionnelle du système nerveux central, ouvrant la voie à des stratégies thérapeutiques innovantes et améliorant notre compréhension globale des mécanismes neuronaux. À l’heure actuelle, il n’existe pas de tutoriels vidéo complets pour guider les chercheurs dans la préparation et l’extraction d’échantillons de cerveau reliés à la moelle épinière et dans la réussite du nettoyage des tissus.
Il existe plusieurs approches de nettoyage des tissus : hydrophobes, hydrophiles, à base d’hydrogel et méthodes de nettoyage par expansion tissulaire 1,2,3. La technique de nettoyage des tissus est largement appliquée dans l’étude d’organes tels que la rate4, les poumons5, le muscle gastrocnémien6, le cerveau7, la moelle épinière8 et les reins9. Notre protocole fournira des instructions détaillées sur la façon de préparer des échantillons de cerveau entier connectés à la moelle épinière qui ont été marqués avec un marqueur fluorescent à l’aide de souris de la souche STOCK Tg (Thy1-EGFP) MJrs/J. Il offrira des conseils étape par étape pour l’extraction d’échantillons et décrira le protocole de nettoyage à l’aide de kits hydrophiles de nettoyage des tissus. Ce protocole aide les chercheurs à maîtriser l’ensemble du processus, de l’extraction des échantillons de cerveau et de moelle épinière à la préparation et au balayage ultérieur. Cela permettra non seulement d’améliorer l’efficacité expérimentale, mais aussi de garantir l’intégrité et la qualité des échantillons, en fournissant des données plus précises et plus fiables pour soutenir la recherche en neurosciences.
Par rapport aux méthodes conventionnelles de coupe, d’imagerie et de reconstruction tridimensionnelle10,11, l’approche présentée ici offre plusieurs avantages clés, tels que (1) une intégrité structurelle améliorée : en maintenant la structure de l’organe entier, cette méthode réduit le risque de perte d’informations critiques qui peut survenir lors de la coupe12; (2) l’acquisition complète de données : l’utilisation d’un kit d’élimination des tissus permet une cartographie détaillée des cellules qui sont difficiles à réaliser avec les techniques traditionnelles ; (3) Efficacité et précision : Le protocole rationalise l’ensemble du processus, de l’extraction de l’échantillon à l’imagerie, réduisant le temps requis par les procédures d’immunohistochimie ou de coloration et minimisant les erreurs associées au sectionnement et au montage13.
Le protocole surmonte les limites des méthodes de coupe traditionnelles, qui aboutissent souvent à des données incomplètes et fragmentées. En préservant la connexion intacte entre le cerveau et la moelle épinière et en utilisant des méthodes modernes de nettoyage des tissus, ce protocole fournit une vue plus holistique du système nerveux central, ce qui est crucial pour comprendre les mécanismes et les fonctions neuronales complexes. L’objectif principal de cette méthode est de permettre une imagerie complète du système nerveux central en préparant des échantillons de cerveau entier connectés à la moelle épinière, qui ont été marqués avec des marqueurs neuronaux fluorescents. Ce protocole vise à faciliter la visualisation détaillée des structures neurales et des distributions cellulaires à l’aide de méthodes anatomiques avancées et de techniques de nettoyage des tissus.
Protocole
Toutes les expériences sur les animaux ont été menées conformément aux directives ARRIVE (Animal Research Reporting In Vivo Experiences) et au Guide des National Institutes of Health pour le soin et l’utilisation des animaux de laboratoire. La présente étude a été approuvée par le Comité de soin et d’utilisation des animaux de l’hôpital Renji de la faculté de médecine de l’Université Jiaotong de Shanghai. Ici, des souris mâles de la souche MJrs/J de STOCK Tg (Thy1-EGFP) âgées de 7 à 8 semaines (origine C57BL/6J x CBA) ont été utilisées pour la présente étude. Les animaux ont été obtenus commercialement (voir la table des matières) et logés dans des cages standard (22 °C ± 2 °C, 12 h/12 h cycle lumière/obscurité, nourriture et eau à volonté).
1. La perfusion
- Anesthésier profondément les souris adultes à l’aide de tribromoéthanol à 1,25 % (0,02 ml/kg, voir le tableau des matières) administré par injection intrapéritonéale à l’aide d’une seringue de 1 ml. Vérifiez la profondeur de l’anesthésie par pincement des orteils.
- Fixez les membres de la souris à la planche acrylique blanche à l’aide de pinces en acier. Coupez la peau entre les deux fémurs de la souris et continuez à couper vers le haut jusqu’à ce qu’elle atteigne le diaphragme. Ouvrez les deux côtés du thorax à travers le diaphragme pour exposer le cœur à l’aide de ciseaux et de pinces droites.
- Insérez une aiguille de perfusion de 0,7 mm dans le ventricule gauche. Faites une incision de 1 à 2 mm dans l’appendice auriculaire droit.
- Perfuser avec 1x PBS contenant 10 U/mL d’héparine sodique à un débit de 10 mL/min avec une pompe péristaltique (voir tableau des matériaux) pour éliminer complètement le sang. Le foie qui devient complètement pâle indique une clairance réussie.
- Perfuser avec 50 mL de PFA à 4 % prérefroidi avec une pompe péristaltique à un débit de 10 mL/min. Surveillez les signes tels que l’enroulement de la queue de souris et les contractions musculaires.
REMARQUE : Une perfusion infructueuse peut affecter les processus de nettoyage ultérieurs.
2. Extraction de l’échantillon
- Disséquez soigneusement l’ensemble du cerveau et de la moelle épinière à l’aide de ciseaux et de pinces pour éviter d’endommager l’échantillon.
- Séparez la peau du dos et de la tête de la souris à l’aide de ciseaux ophtalmiques. Sectionnez la colonne vertébrale à l’endroit où la ligne reliant les bords arrière supérieurs des deux membres croise la colonne vertébrale.
- Retirez les tissus musculaires et adipeux du cou et du dos de la souris pour exposer la colonne vertébrale et le crâne. Coupez le long de l’espace médian entre les côtés gauche et droit de la colonne vertébrale et de la moelle épinière à partir de l’extrémité inférieure du canal vertébral à l’aide de ciseaux de Vénus.
- Retirez la partie supérieure et les côtés bilatéraux de la colonne vertébrale sectionnée pour exposer la moelle épinière. Répétez les étapes jusqu’à ce que vous atteigniez la connexion cérébrale.
- Placez la pointe d’une lame des ciseaux de Vénus entre le foramen magnum et le cerveau. Faites glisser et coupez le long de la suture mi-sagittale pour ouvrir le crâne. Utilisez des pinces pour retirer le crâne et exposer le cerveau.
- Retirez le tissu du cerveau et de la moelle épinière de la souris de l’extrémité crânienne à l’aide d’une pince et de ciseaux de Vénus.
REMARQUE : Les coupures ou les dommages à la surface peuvent être exacerbés lors du déblaiement ultérieur, ce qui peut causer des dommages imprévisibles à l’échantillon. Manipulez les échantillons avec soin. - À l’aide d’une pince à dissection, vous pouvez retirer la membrane de la moelle épinière au microscope stéréoscopique.
- Fixez l’échantillon de cerveau-moelle épinière à la plaque de fixation (voir tableau des matériaux) à l’aide de sutures. Ajoutez au moins 20 fois le volume de l’échantillon de 4 % de PFA et placez-le sur un agitateur à 4 °C pour une agitation lente. Fixer pendant la nuit pendant 16-24 h.
REMARQUE : Une fixation excessive entraîne une réticulation excessive des protéines, réduisant l’efficacité de nettoyage14. Une fixation insuffisante ou retardée peut entraîner une dégradation de l’antigène et une destruction de la morphologie des tissus. - Jetez le PFA et lavez l’échantillon 3x avec 1x PBS. Assurez-vous que le volume de PBS est au moins 10 fois supérieur au volume de l’échantillon, en immergeant complètement l’échantillon. Chaque lavage dure 2 h avec agitation sur un agitateur à une vitesse d’au moins 60 tr/min pour éliminer en profondeur les résidus de PFA.
3. Nettoyage des tissus
REMARQUE : Ici, un kit de nettoyage des tissus est utilisé (voir tableau des matériaux).
- Préparez la solution d’élimination des lipides en mélangeant la solution A et la solution B dans un rapport massique de 9:1.
REMARQUE : Il est recommandé que le volume de la solution d’élimination des lipides soit supérieur à 20 fois le volume de l’échantillon. - Placez le tissu fixé dans un tube à centrifuger de 50 ml et ajoutez 50 ml de la solution d’élimination des lipides. Placez le tube à centrifuger dans un agitateur à 37 °C, en agitant doucement à 60 tr/min pour éliminer les lipides. Changez la solution d’élimination des lipides tous les jours pendant 3 à 5 jours. Pour déterminer l’achèvement, placez le tube de centrifugation sur une boîte lumineuse avec une ligne d’échelle. Si la ligne d’échelle noire est clairement visible et non déformée à travers l’échantillon, le processus est terminé.
- Placer l’échantillon dans 20 mL de la solution C sur un agitateur à 25 °C, en agitant à moins de 60 tr/min pour l’adaptation de l’indice de réfraction. Changez la solution C après 24 h. Placez la boîte de culture avec l’échantillon complètement immergé dans la solution C sur une boîte lumineuse avec une ligne d’échelle. Si la ligne d’échelle noire est clairement visible et non déformée à travers l’échantillon, le processus d’appariement est terminé.
REMARQUE : Pour les tissus de souris adultes, la correspondance de l’indice de réfraction se termine généralement en 2 jours.
4. Enrobage tissulaire
- Préparez une solution de gel avec 147 g de solution C dans une bouteille en verre de 200 ml, ajoutez 3,0 g d’agarose, mélangez bien par vortex, puis passez au micro-ondes jusqu’à ébullition et éteignez immédiatement le micro-ondes. Transférez le tube de centrifugation dans un incubateur à 37 °C jusqu’à ce que l’agarose se dissolve.
REMARQUE : Il est recommandé de préparer la solution de gel fraîche au besoin. - Incorporer l’échantillon clarifié avec une couche de 2 mm d’épaisseur de solution de gel à 37 °C dans le moule et laisser refroidir au réfrigérateur à 4 °C pendant 30 minutes jusqu’à ce qu’il soit semi-solidifié. Placez l’échantillon à indice de réfraction apparié dans le moule et ajoutez la solution de gel pour qu’il soit de niveau ou légèrement en dessous du haut de l’échantillon.
- Remettez le moule dans le réfrigérateur à 4 °C pendant 2 h. Ajouter la solution gélifiée jusqu’à ce qu’elle soit au niveau de la surface du moule. Couvrir avec une lamelle. Accélérer la solidification au réfrigérateur à 4 °C pendant 2 h. Conservez l’échantillon incorporé pendant la nuit au réfrigérateur à 4 °C. Procédez à l’imagerie dès que possible.
5. Numérisation
- Retirez la lamelle à l’aide d’une pince à épiler et retirez l’échantillon incrusté. Placez l’échantillon dans un tube de 50 ml et ajoutez 30 ml de solution d’imagerie pour immerger complètement l’échantillon.
- Appliquez de l’adhésif 502 pour fixer fermement l’échantillon sur le porte-échantillon. Fixez le support sur l’appareil d’imagerie.
- Exécutez le logiciel d’analyse comme décrit. Sélectionnez le niveau de grossissement de 4x dans la section d’agrandissement. Cliquez sur le bouton Étalonnage pour activer le mode d’étalonnage.
- Cliquez sur le bouton Aperçu pour passer en mode d’aperçu. Cliquez sur le bouton de mouvement dans la direction Z pour déplacer lentement l’échantillon vers le haut à partir du bas de la chambre d’échantillonnage jusqu’à ce que la feuille de lumière générée traverse l’échantillon.
- Sélectionnez le canal laser et l’option de mode d’éclairage appropriés. Sélectionnez la direction du chemin de balayage de l’échantillon. Cliquez sur le bouton Balayage automatique pour commencer à capturer l’échantillon.
Résultats
Ce protocole permet d’isoler avec succès l’ensemble du cerveau connecté à la moelle épinière chez les souris mâles de la souche MJrs/J de STOCK Tg (Thy1-EGFP). Il rend également les échantillons transparents, garantissant que les signaux fluorescents sont entièrement préservés et capturés, fournissant des images claires et détaillées qui maintiennent l’intégrité de la fluorescence d’origine.
La figure 1 montre un cerveau-moelle épinière intact, démontrant que les étapes de dissection décrites dans ce protocole sont précises. De plus, le nettoyage des tissus a été effectué avec une grande précision, produisant des échantillons transparents qui permettent de visualiser des structures neuronales complexes. De plus, la figure 2 montre que l’échantillon cerveau-moelle épinière avec l’imagerie du signal fluorescent est remarquablement bien conservé, fournissant des images claires et détaillées qui conservent l’intégrité de la fluorescence d’origine. La figure 3 présente une image à plus fort grossissement des cellules individuelles illustrées à la figure 2.
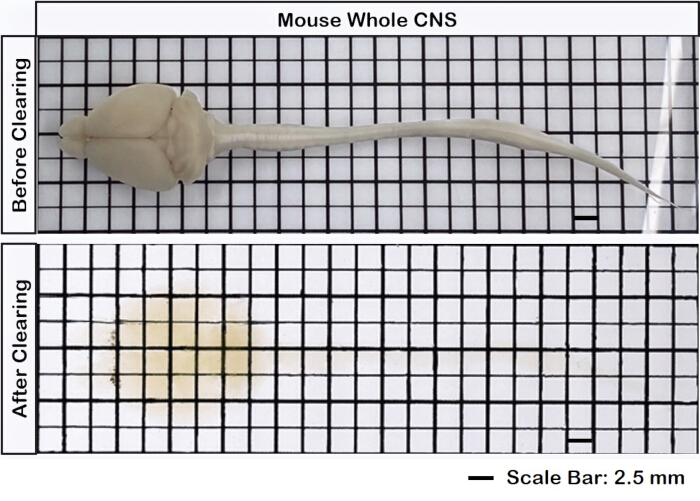
Figure 1 : Cerveau intact de la moelle épinière. Le tissu cérébral est connecté à la moelle épinière, avant et après le dégagement. Barre d’échelle = 2 mm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
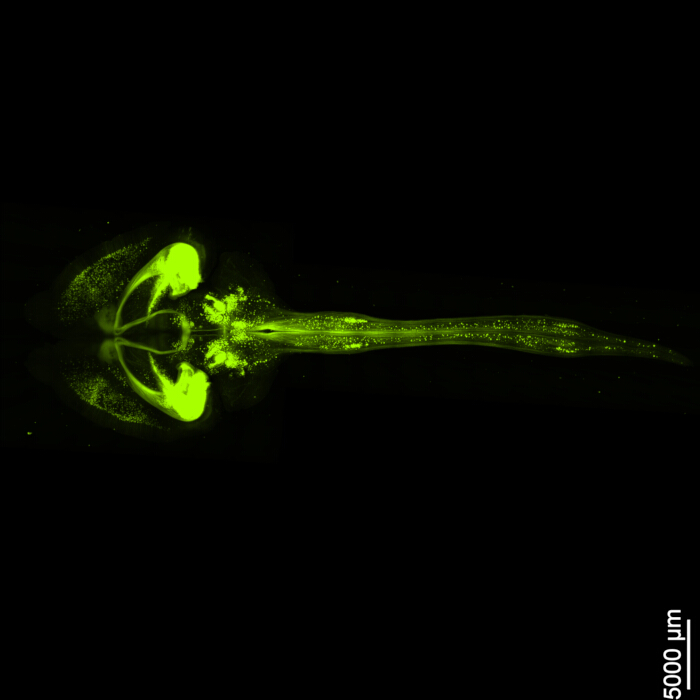
Figure 2 : EGFP fluorescent tridimensionnel. L’image montre l’ensemble du cerveau ainsi que sa connexion à la moelle épinière. Barre d’échelle = 5000 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
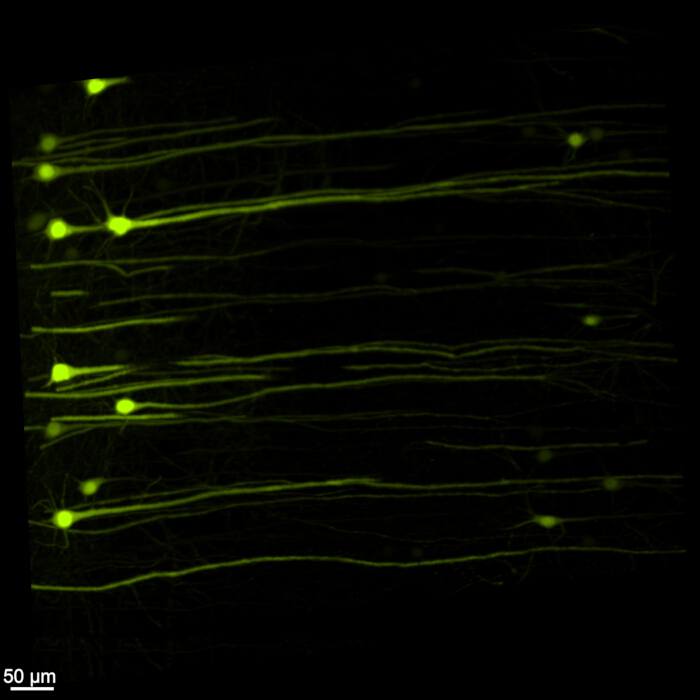
Figure 3 : EGFP fluorescent tridimensionnel à fort grossissement. Une image à plus fort grossissement mettant en évidence les cellules individuelles exprimant l’EGFP dans l’échantillon cerveau-moelle épinière. Barre d’échelle = 50 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Le protocole expérimental proposé consiste à utiliser des souris dont le cerveau est connecté à des moelles épinières marquées avec des virus de traçage neuronal fluorescents. Ce protocole fournit des instructions complètes et détaillées sur la préparation d’échantillons de cerveau entier qui restent connectés à la moelle épinière. Le protocole décrit méticuleusement chaque étape, garantissant que les chercheurs peuvent reproduire le processus avec précision.
Plusieurs étapes critiques de ce protocole contribuent à améliorer la qualité du dégagement et de l’imagerie. L’extraction complète d’échantillons de cerveau entier reliés à la moelle épinière est une tâche importante. Le maintien de l’intégrité du cerveau et de la moelle épinière est crucial pour un traçage précis et une analyse ultérieure. Lors de la collecte d’échantillons, les incisions ou les dommages de surface peuvent s’aggraver au cours du processus de nettoyage ultérieur, entraînant potentiellement des dommages imprévisibles. Pour garantir l’intégrité des échantillons, il est crucial d’utiliser les ciseaux de Vénus et la pince à épiler de dissection spécifiés dans les matériaux pour un échantillonnage méticuleux. La fixation de l’échantillon de moelle épinière à la plaque de fixation à l’aide de sutures est une étape cruciale pour prévenir la déformation causée par la gravité, la pression ou d’autres facteurs lorsqu’elle est immergée dans un liquide.
Les recherches antérieures se sont souvent concentrées exclusivement sur la structure et la fonction du cerveau ou de la moelle épinière8 . Cependant, le système nerveux central fonctionne comme une unité cohésive. La transmission de signaux du cerveau vers le bas et la transmission ascendante de signaux périphériques à travers la moelle épinière vers les centres supérieurs est un processus complexe. L’accès à des échantillons complets du cerveau et de la moelle épinière est avantageux pour étudier l’intégration de ces signaux.
Il existe plusieurs approches primaires de nettoyage des tissus : hydrophobe, hydrophile, à base d’hydrogel et méthodes de nettoyage par expansion tissulaire 1,2,3. Les principes et méthodes sous-jacents sont les mêmes : remplacer les molécules qui diffractent la lumière (telles que les lipides, les pigments et le phosphate de calcium) par d’autres molécules qui correspondent à l’indice de réfraction du milieu d’imagerie 2,15. Les méthodes de nettoyage hydrophile posent généralement moins de problèmes de toxicité et sont plus efficaces pour préserver les signaux des protéines fluorescentes et des colorants 1,2,3 ; Cependant, ils présentent plusieurs inconvénients. Ils peuvent provoquer un gonflement des tissus et des fluctuations de volume, ce qui peut affecter l’intégrité structurelle des échantillons. L’utilisation de composés hyperhydratants comme l’urée et le formamide peut entraîner une dénaturation des protéines, ce qui a un impact sur la pertinence biologique des tissus. De plus, bien que ces méthodes soient généralement simples et compatibles avec le marquage fluorescent, l’obtention d’une élimination optimale pour les tissus plus volumineux nécessite souvent des protocoles complexes impliquant divers produits chimiques, ce qui peut compliquer le processus. De plus, la nécessité de mélanges chimiques précis pour ajuster des compartiments tissulaires spécifiques ajoute à la complexité, nécessitant une optimisation minutieuse pour des applications spécifiques.
Les progrès réalisés dans les techniques de nettoyage des tissus et d’imagerie nous ont permis de cartographier la distribution des nerfs et le volume de différentes cellules qui expriment intrinsèquement des protéines fluorescentes ou sont marquées avec des anticorps marqués par fluorescence, à l’aide de la microscopie à fluorescence à feuillet de lumière16. Le développement de techniques de détection moléculaire multiplexée dans les tissus clairsemés progresse rapidement. Ces méthodes permettent le profilage simultané de divers analytes biologiques à partir d’échantillons uniques, ce qui est crucial pour comprendre des systèmes biologiques complexes tels que les microenvironnements tumoraux et les réseaux neuronaux denses. De plus, des méthodes telles que FISH et l’imagerie par échange d’ADN sont prometteuses pour améliorer le multiplexage grâce au codage à barres de l’ADN et à l’imagerie rapide. L’avenir de l’imagerie protéique hautement multiplexée pourrait résider dans l’utilisation d’anticorps conjugués aux acides nucléiques pour une détection spécifique, sensible et multiplexée, permettant une analyse complète des tissus complexes17.
En conclusion, nous décrivons une méthode prometteuse d’extraction et de préparation d’échantillons de cerveau et de moelle épinière clairs. Notre étude aidera les chercheurs à mener des recherches pertinentes. Notre protocole a permis d’obtenir des tissus transparents chez des souris perfusées de PFA. Cependant, une publication récente rapporte que les scientifiques ont découvert un colorant non toxique qui peut être appliqué sur la peau de souris pour la rendre temporairement transparente18. Cela permet aux chercheurs d’observer les structures physiologiques sous la peau, y compris les vaisseaux sanguins et les organes internes. Cette technologie pourrait devenir plus avancée dans un avenir proche, avec des améliorations de l’épaisseur et du degré de transparence, permettant l’observation in vivo de divers organes de souris, y compris les systèmes nerveux central et périphérique, le système respiratoire et le système circulatoire19.
Déclarations de divulgation
Les auteurs ne déclarent aucun intérêt concurrent.
Remerciements
Fondation nationale des sciences naturelles de Chine (subvention n° 82101249 et n° 82471204 à XY Sun). Fondation de recherche postdoctorale de Chine (subvention N° 2022M722125 à XY Sun).
matériels
| Name | Company | Catalog Number | Comments |
| 1 ml syringe | Shandong Weigao Group Medical Polymer | ||
| 502 glue | Deli Group | ||
| BD insulin syringe | Becton,Dickinson and Company | 328421 | |
| Bend toothed dissecting forceps | Jinzhong | JD1050 | |
| Circular steel clamp | Weili | ||
| Fine scissors | Jinzhong | y00030 | |
| Hemostatic forceps bent with tooth | Jinzhong | J31020 | |
| Hemostatic forceps straight with tooth | Jinzhong | J31010 | |
| Infusion needle 0.7mm | Kindly Group | ||
| Light box scale line | Nuohai Life Science | NH210901 | |
| Microdissection straight forceps | Jinzhong | WA3020 | |
| NobeliumSoftware | Nuohai Life Science | Scanning software | |
| paraformaldehyde | Biosharp | BL539A | |
| Peristaltic pumps | Nuohai Life Science | NH1000 | |
| Peristaltic pumps head | Nuohai Life Science | NH-15 | |
| Phosphate buffered saline | Servicebio | G4202 | |
| Sodium heparin | Shanghai Pharma | H31022051 | |
| STOCK Tg (Thy1-EGFP) MJrs/J strain mice | Jackson Laboratory | 007788 | |
| Straight toothed dissecting forceps | Jinzhong | JD1060 | |
| Tissue clearing Kit(hyrophilic) | Nuohai Life Science | NH-CR-210701 | |
| Tissue culture treater 100mm x 20mm | NEST | 704001 | |
| Tissue scissors | Jinzhong | J21040 | |
| Tribromoethanol | Aibei Biotechnology | M2910 | |
| Venus scissors | Jinzhong | YBC010 |
Références
- Ueda, H. R., et al. Tissue clearing and its applications in neuroscience. Nat Rev Neurosci. 21 (2), 61-79 (2020).
- Tainaka, K., Kuno, A., Kubota, S. I., Murakami, T., Ueda, H. R. Chemical principles in tissue clearing and staining protocols for whole-body cell profiling. Annu Rev Cell Dev Biol. 32, 713-741 (2016).
- Susaki, E. A., Ueda, H. R. Whole-body and whole-organ clearing and imaging techniques with single-cell resolution: Toward organism-level systems biology in mammals. Cell Chem Biol. 23 (1), 137-157 (2016).
- Wu, M., et al. Innervation of nociceptor neurons in the spleen promotes germinal center responses and humoral immunity. Cell. 187 (12), 2935-2951.e19 (2024).
- Liu, T., et al. Local sympathetic innervations modulate the lung innate immune responses. Sci Adv. 6 (20), eaay1497 (2020).
- Qi, Y., et al. FDISCO: Advanced solvent-based clearing method for imaging whole organs. Sci Adv. 5 (1), eaau8355 (2019).
- Bagnoli, S., Terzibasi Tozzini, E., Cellerino, A. Whole-Brain clearing and immunofluorescence in Nothobranchius furzeri. Cold Spring Harb Protoc. 2023 (9), 698-704 (2023).
- Lu, T., Shinozaki, M., Nagoshi, N., Nakamura, M., Okano, H. 3D imaging of supraspinal inputs to the thoracic and lumbar spinal cord mapped by retrograde tracing and light-sheet microscopy. J Neurochem. 162 (4), 352-370 (2022).
- Saritas, T., Puelles, V. G., Su, X. T., Ellison, D. H., Kramann, R. Optical clearing and imaging of immunolabeled kidney tissue. J Vis Exp. (149), e60002 (2019).
- Song, J. H., et al. Precise mapping of single neurons by calibrated 3D reconstruction of brain slices reveals topographic projection in mouse visual cortex. Cell Rep. 31 (8), 107682 (2020).
- Fournel, R., Veruki, M. L., Hartveit, E. Digital reconstruction and quantitative morphometric analysis of bipolar cells in live rat retinal slices. J Comp Neurol. 530 (10), 1700-1728 (2022).
- Lin, R., et al. Cell-type-specific and projection-specific brain-wide reconstruction of single neurons. Nat Methods. 15 (12), 1033-1036 (2018).
- Peng, Y. C., et al. Rapid histological assessment of prostate specimens in the three-dimensional space by hydrophilic tissue clearing and confocal microscopy. J Histochem Cytochem. 70 (8), 597-608 (2022).
- Singhal, P., et al. Evaluation of histomorphometric changes in tissue architecture in relation to alteration in fixation protocol - An in vitro study. J Clin Diagn Res. 10 (8), ZC28-ZC32 (2016).
- Tainaka, K., et al. Chemical landscape for tissue clearing based on hydrophilic reagents. Cell Rep. 24 (8), 2196-2210.e9 (2018).
- Lee, S. H., Son, H. J. Second wave, late-stage neuroinflammation in cleared brains of aged 5xFAD Alzheimer's mice detected by macrolaser light sheet microscopy imaging. Int J Mol Sci. 24 (23), 242317058 (2023).
- Zhao, J., Lai, H. M., Qi, Y., He, D., Sun, H. Current status of tissue clearing and the path forward in neuroscience. ACS Chem Neurosci. 12 (1), 5-29 (2021).
- Ou, Z., et al. Achieving optical transparency in live animals with absorbing molecules. Science. 385 (6713), eadm6869 (2024).
- Ou, Z., et al. Achieving optical transparency in live animals with absorbing molecules. Science. 385, eadm6869 (2024).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon