Method Article
Extração e Limpeza de Tecidos Preparação de Amostras de Cérebro-Medula Espinhal de Camundongos
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Este estudo apresenta um protocolo para extrair e preparar amostras limpas de todo o cérebro e medula espinhal com sinais fluorescentes preservados, aumentando a eficiência experimental e a integridade dos dados para avançar na pesquisa em neurociência.
Resumo
A pesquisa em neurociência focada no sistema nervoso central requer uma compreensão completa de vários fatores, incluindo distribuição celular, conectividade neuronal e dinâmica molecular. As metodologias tradicionais para investigar todo o cérebro e medula espinhal geralmente envolvem o isolamento, seccionamento e digitalização de cortes de tecido, seguidos pelo processo trabalhoso de reconstrução de imagens tridimensionais. Essa abordagem convencional pode ser demorada e complicada. Os avanços na limpeza de tecidos e nas técnicas de imagem de órgãos inteiros revolucionaram a análise de todo o cérebro e da medula espinhal. Para maximizar o potencial desses métodos inovadores, é essencial extrair e limpar amostras de cérebro, mantendo sua conexão com a medula espinhal. Este protocolo fornece um guia detalhado e sistemático para a preparação de amostras do cérebro conectadas à medula espinhal, descrevendo os procedimentos de extração e limpeza. Ao simplificar esses processos, essa abordagem aumenta significativamente a eficiência experimental e a integridade dos dados, promovendo avanços na pesquisa em neurociência e permitindo investigações mais abrangentes sobre as complexidades do sistema nervoso central.
Introdução
O mapeamento e a análise precisos da distribuição nervosa fornecem informações valiosas sobre a organização estrutural e funcional do sistema nervoso central, abrindo caminho para estratégias terapêuticas inovadoras e aprimorando nossa compreensão geral dos mecanismos neurais. Atualmente, faltam tutoriais em vídeo abrangentes para orientar os pesquisadores na preparação e extração de amostras cerebrais conectadas à medula espinhal e na obtenção de uma limpeza bem-sucedida do tecido.
Existem várias abordagens de limpeza de tecido disponíveis: métodos de limpeza hidrofóbicos, hidrofílicos, baseados em hidrogel e de expansão de tecido 1,2,3. A técnica de limpeza tecidual é amplamente aplicada no estudo de órgãos como baço4, pulmões5, músculo gastrocnêmio6, cérebro7, medula espinhal8 e rins9. Nosso protocolo fornecerá instruções detalhadas sobre como preparar amostras de cérebro inteiro conectadas à medula espinhal que foram marcadas com marcador fluorescente usando camundongos da cepa STOCK Tg (Thy1-EGFP) MJrs/J. Ele oferecerá orientação passo a passo para extração de amostras e descreverá o protocolo de limpeza usando kits hidrofílicos de limpeza de tecidos. Este protocolo ajuda os pesquisadores a dominar todo o processo, desde a extração da amostra da medula espinhal até a preparação e posterior digitalização. Isso não apenas aumentará a eficiência experimental, mas também garantirá a integridade e a qualidade das amostras, fornecendo dados mais precisos e confiáveis para apoiar a pesquisa em neurociência.
Em comparação com os métodos convencionais de seccionamento, imagem e reconstrução tridimensional 10,11, a abordagem apresentada aqui oferece várias vantagens importantes, como (1) integridade estrutural aprimorada: ao manter a estrutura de todo o órgão, esse método reduz o risco de perda de informações críticas que podem ocorrer com o seccionamento12; (2) aquisição abrangente de dados: o uso de um kit de limpeza de tecidos permite o mapeamento detalhado de células que são difíceis de obter com técnicas tradicionais; (3) eficiência e precisão: o protocolo agiliza todo o processo, desde a extração da amostra até a imagem, reduzindo o tempo necessário para os procedimentos de imuno-histoquímica ou coloração e minimizando os erros associados ao corte e montagem13.
O protocolo supera as limitações dos métodos tradicionais de seccionamento, que muitas vezes resultam em dados incompletos e fragmentados. Ao preservar a conexão cérebro-medula espinhal intacta e utilizar métodos modernos de limpeza de tecidos, este protocolo fornece uma visão mais holística do sistema nervoso central, o que é crucial para a compreensão de mecanismos e funções neurais complexas. O objetivo principal deste método é permitir imagens abrangentes do sistema nervoso central, preparando amostras de todo o cérebro conectadas à medula espinhal, que foram marcadas com marcadores neuronais fluorescentes. Este protocolo visa facilitar a visualização detalhada de estruturas neurais e distribuições celulares usando métodos anatômicos avançados e técnicas de limpeza de tecidos.
Protocolo
Todos os experimentos com animais foram conduzidos em conformidade com as diretrizes do Animal Research Reporting In Vivo Experiments (ARRIVE) e o Guia do National Institutes of Health para o Cuidado e Uso de Animais de Laboratório. O presente estudo foi aprovado pelo Comitê de Cuidados e Uso de Animais do Hospital Renji, Escola de Medicina da Universidade Jiaotong de Xangai. Aqui, camundongos machos da linhagem MJrs/J de 7-8 semanas de idade (origem C57BL/6J x CBA) foram usados para o presente estudo. Os animais foram obtidos comercialmente (ver Tabela de Materiais) e alojados em gaiolas padrão (22 °C ± 2 °C, ciclo claro/escuro de 12 h/12 h, alimentação e água ad libitum).
1. Perfusão
- Anestesiar profundamente camundongos adultos usando tribromoetanol a 1,25% (0,02 mL / kg, consulte a Tabela de Materiais) administrado por injeção intraperitoneal usando uma seringa de 1 mL. Verifique a profundidade da anestesia pela resposta ao pinçamento do dedo do pé.
- Fixe os membros do mouse na placa de acrílico branco usando grampos de aço. Corte a pele entre os dois fêmures do camundongo e continue cortando para cima até atingir o diafragma. Abra os dois lados do tórax através do diafragma para expor o coração usando uma tesoura e uma pinça reta.
- Insira uma agulha de perfusão de 0,7 mm no ventrículo esquerdo. Faça uma incisão de 1-2 mm no apêndice atrial direito.
- Perfunda com 1x PBS contendo 10 U/mL de heparina sódica a uma taxa de 10 mL/min com uma bomba peristáltica (ver Tabela de Materiais) para limpar completamente o sangue. O fígado ficando completamente pálido indica uma depuração bem-sucedida.
- Perfundir com 50 mL de PFA a 4% pré-resfriado com uma bomba peristáltica a uma taxa de 10 mL/min. Monitore sinais como curvatura da cauda do rato e espasmos musculares.
NOTA: A perfusão malsucedida pode afetar os processos de limpeza subsequentes.
2. Extração de amostras
- Disseque cuidadosamente todo o cérebro e a medula espinhal usando tesouras e fórceps para evitar danificar a amostra.
- Separe a pele nas costas e na cabeça do mouse usando uma tesoura oftálmica. Corte a coluna no ponto em que a linha que conecta as bordas traseiras superiores de ambos os membros se cruza com a coluna vertebral.
- Remova o músculo e o tecido adiposo do pescoço e das costas do mouse para expor a coluna e o crânio. Corte ao longo da lacuna da linha média entre os lados esquerdo e direito da coluna e da medula espinhal da extremidade inferior do canal vertebral usando uma tesoura de vênus.
- Remova a parte superior e os lados bilaterais da coluna cortada para expor a medula espinhal. Repita os passos até chegar à conexão com o cérebro.
- Coloque a ponta de uma lâmina da tesoura de vênus entre o forame magno e o cérebro. Deslize e corte ao longo da sutura sagital média para abrir o crânio. Use uma pinça para remover o crânio e expor o cérebro.
- Remova o tecido da medula espinhal do cérebro do camundongo da extremidade craniana usando uma pinça e uma tesoura de vênus.
NOTA: Cortes ou danos à superfície podem ser exacerbados durante a limpeza subsequente, potencialmente causando danos imprevisíveis à amostra. Manuseie as amostras com cuidado. - Use uma pinça de dissecação para remover a membrana da medula espinhal sob o estereomicroscópio.
- Prenda a amostra da medula espinhal cerebral à placa de fixação (consulte a Tabela de Materiais) usando suturas. Adicione pelo menos 20 vezes o volume da amostra de 4% de PFA e coloque-o em um shaker a 4 °C para agitação lenta. Fixe durante a noite por 16-24 h.
NOTA: A fixação excessiva leva à reticulação excessiva de proteínas, reduzindo a eficiência de limpeza14. A fixação insuficiente ou tardia pode causar degradação do antígeno e destruição da morfologia do tecido. - Descarte o PFA e lave a amostra 3x com 1x PBS. Certifique-se de que o volume de PBS seja pelo menos 10x o volume da amostra, submergindo totalmente a amostra. Cada lavagem dura 2 h com agitação em um agitador a uma velocidade não inferior a 60 rpm para remover completamente o PFA residual.
3. Limpeza de tecido
NOTA: Aqui, um kit de limpeza de tecido é usado (consulte a Tabela de Materiais).
- Preparar a solução de remoção de lípidos misturando a solução A e a solução B a uma proporção mássica de 9:1.
NOTA: Recomenda-se que o volume da solução de remoção de lipídios seja superior a 20x o volume da amostra. - Coloque o tecido fixo em um tubo de centrífuga de 50 mL e adicione 50 mL da solução de remoção de lipídios. Coloque o tubo da centrífuga em um agitador a 37 °C, agitando suavemente a 60 rpm para remoção de lipídios. Troque a solução de remoção de lipídios diariamente por 3-5 dias. Para determinar a conclusão, coloque o tubo da centrífuga em uma caixa de luz com uma linha de escala. Se a linha da escala preta estiver claramente visível e não distorcida através da amostra, o processo está concluído.
- Colocar a amostra em 20 ml de solução C num agitador a 25 °C, agitando a menos de 60 rpm para correspondência do índice de refração. Mudar a solução C após 24 h. Colocar a placa de cultura com a amostra totalmente imersa na solução C numa caixa de luz com uma linha de escala. Se a linha de escala preta estiver claramente visível e sem distorções através da amostra, o processo de correspondência estará concluído.
NOTA: Para tecidos de camundongos adultos, a correspondência do índice de refração normalmente é concluída em 2 dias.
4. Incorporação de tecidos
- Prepare a solução de gel com 147 g de solução C em um frasco de vidro de 200 mL, adicione 3,0 g de agarose, misture bem por vórtice, leve ao microondas até ferver e desligue imediatamente o microondas. Transferir o tubo de centrifugação para uma incubadora a 37 °C até que a agarose se dissolva.
NOTA: Recomenda-se preparar a solução de gel fresca conforme necessário. - Incorpore a amostra limpa com uma camada de 2 mm de profundidade de solução de gel a 37 °C no molde e deixe esfriar em uma geladeira a 4 °C por 30 min até semi-solidificar. Coloque a amostra correspondente ao índice de refração no molde e adicione a solução de gel para ficar nivelada ou ligeiramente abaixo do topo da amostra.
- Coloque o molde de volta na geladeira a 4 °C por 2 h. Adicione a solução de gel até o nível da superfície do molde. Cubra com uma lamínula. Acelere a solidificação no refrigerador a 4 °C por 2 h. Conservar a amostra incorporada durante a noite no frigorífico a 4 °C. Prossiga com a imagem o mais rápido possível.
5. Digitalização
- Remova a lamínula com uma pinça e retire a amostra incorporada. Coloque a amostra em um tubo de 50 mL e adicione 30 mL de solução de imagem para submergir totalmente a amostra.
- Aplique o adesivo 502 para fixar firmemente a amostra no porta-amostras. Fixe o suporte no dispositivo de imagem.
- Execute o software de digitalização conforme descrito. Selecione o nível de ampliação de 4x na seção de ampliação. Clique no botão Calibração para ativar o modo de calibração.
- Clique no botão Visualizar para entrar no modo de visualização. Clique no botão de movimento na direção Z para mover lentamente a amostra para cima a partir da parte inferior da câmara de amostra até que a folha de luz gerada passe pela amostra.
- Selecione o canal de laser apropriado e a opção de modo de iluminação. Selecione a direção do caminho de varredura para a amostra. Clique no botão Auto Scan para iniciar a captura da amostra.
Resultados
Este protocolo isola com sucesso todo o cérebro conectado à medula espinhal em camundongos machos da linhagem STOCK Tg (Thy1-EGFP) MJrs/J. Ele também torna as amostras transparentes, garantindo que os sinais fluorescentes sejam totalmente preservados e capturados, fornecendo imagens claras e detalhadas que mantêm a integridade da fluorescência original.
A Figura 1 mostra uma medula cérebro-espinhal intacta, demonstrando que as etapas de dissecção descritas neste protocolo são precisas. Além disso, a limpeza do tecido foi realizada com alta precisão, produzindo espécimes transparentes que permitem a visualização de estruturas neurais intrincadas. Além disso, a Figura 2 mostra que a amostra cérebro-medula espinhal com a imagem de sinal fluorescente está notavelmente bem preservada, fornecendo imagens claras e detalhadas que mantêm a integridade da fluorescência original. A Figura 3 apresenta uma imagem de maior ampliação das células individuais representadas na Figura 2.
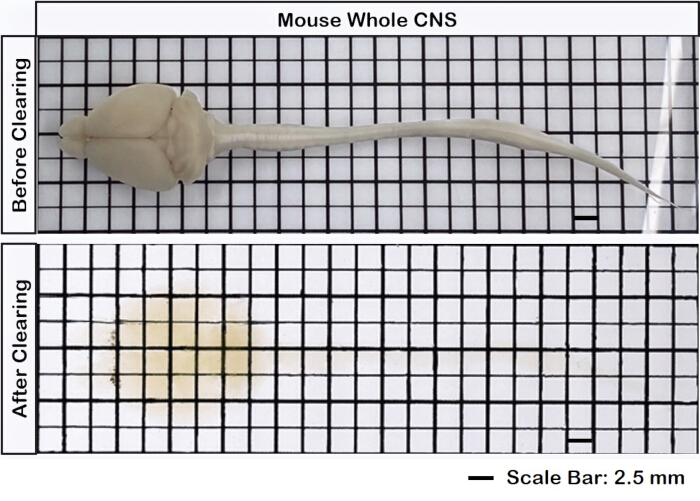
Figura 1: Medula espinhal cerebral intacta. O tecido cerebral está conectado à medula espinhal, antes e depois da limpeza. Barra de escala = 2 mm. Clique aqui para ver uma versão maior desta figura.
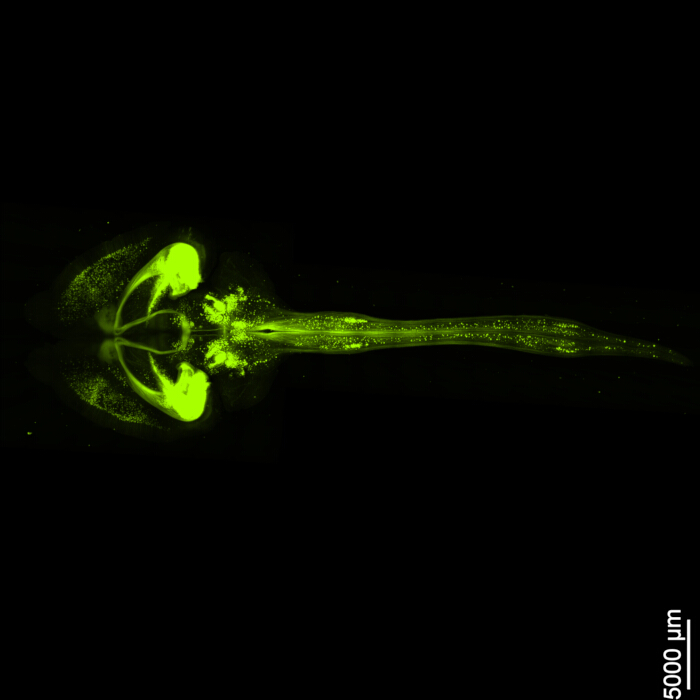
Figura 2: EGFP fluorescente tridimensional. A imagem mostra todo o cérebro junto com sua conexão com a medula espinhal. Barra de escala = 5000 μm. Clique aqui para ver uma versão maior desta figura.
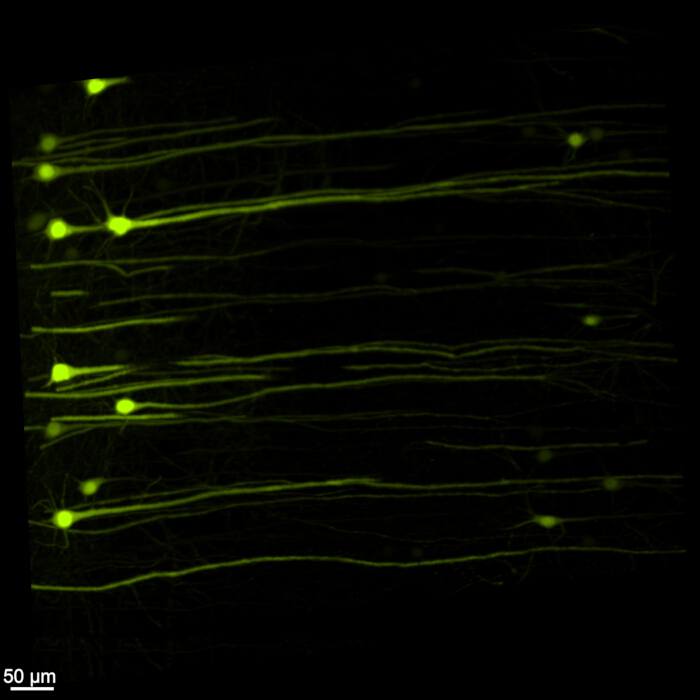
Figura 3: EGFP fluorescente tridimensional de alta ampliação. Uma imagem de maior ampliação destacando células individuais que expressam EGFP dentro da amostra de medula espinhal cerebral. Barra de escala = 50 μm. Clique aqui para ver uma versão ampliada desta figura.
Discussão
O protocolo experimental proposto envolve o uso de camundongos cujos cérebros estão conectados à medula espinhal marcada com vírus de rastreamento neural fluorescente. Este protocolo fornece instruções abrangentes e detalhadas sobre a preparação de amostras de cérebro inteiro que permanecem conectadas à medula espinhal. O protocolo descreve meticulosamente cada etapa, garantindo que os pesquisadores possam replicar o processo com precisão.
Várias etapas críticas neste protocolo contribuem para melhorar a qualidade da clareação e da imagem. Extrair completamente amostras de todo o cérebro que estão conectadas à medula espinhal é uma tarefa importante. Manter a integridade do cérebro e da medula espinhal é crucial para um rastreamento preciso e posterior análise. Ao coletar amostras, incisões ou danos à superfície podem exacerbar durante o processo de limpeza subsequente, potencialmente levando a danos imprevisíveis. Para garantir a integridade das amostras, é crucial usar a tesoura de vênus e as pinças de dissecção especificadas nos materiais para uma amostragem meticulosa. Prender a amostra da medula espinhal cerebral à placa de fixação com suturas é uma etapa crucial para evitar a deformação causada pela gravidade, pressão ou outros fatores enquanto submersa em líquido.
Pesquisas anteriores muitas vezes se concentraram exclusivamente na estrutura e função do cérebro ou da medula espinhal8 . No entanto, o sistema nervoso central funciona como uma unidade coesa. A transmissão de sinais do cérebro para baixo e a transmissão ascendente de sinais periféricos através da medula espinhal para centros superiores é um processo complexo. O acesso a amostras abrangentes de medula espinhal e cérebro é vantajoso para investigar a integração desses sinais.
Existem várias abordagens primárias de limpeza de tecidos disponíveis: métodos de limpeza hidrofóbicos, hidrofílicos, baseados em hidrogel e de expansão de tecido 1,2,3. Os princípios e métodos subjacentes são os mesmos: substituir moléculas que difratam a luz (como lipídios, pigmentos e fosfato de cálcio) por outras moléculas que correspondam ao índice de refração do meio de imagem 2,15. Os métodos de limpeza hidrofílica normalmente apresentam menos problemas de toxicidade e são mais eficazes na preservação dos sinais de proteínas fluorescentes e corantes 1,2,3; no entanto, eles têm várias desvantagens. Eles podem causar inchaço tecidual e flutuações de volume, afetando potencialmente a integridade estrutural das amostras. O uso de compostos hiperidratantes como uréia e formamida pode levar à desnaturação de proteínas, impactando a relevância biológica dos tecidos. Além disso, embora esses métodos sejam geralmente simples e compatíveis com a marcação fluorescente, alcançar a limpeza ideal para tecidos maiores geralmente requer protocolos complexos envolvendo vários produtos químicos, o que pode complicar o processo. Além disso, a necessidade de misturas químicas precisas para ajustar compartimentos específicos do tecido aumenta a complexidade, exigindo uma otimização cuidadosa para aplicações específicas.
Os avanços nas técnicas de limpeza e imagem de tecidos nos permitiram mapear a distribuição dos nervos e o volume de diferentes células que expressam intrinsecamente proteínas fluorescentes ou são marcadas com anticorpos marcados com fluorescência, usando microscopia de fluorescência de folha de luz16. O desenvolvimento de técnicas de detecção molecular multiplexada em tecidos limpos está avançando rapidamente. Esses métodos permitem o perfil simultâneo de vários analitos biológicos a partir de amostras únicas, o que é crucial para a compreensão de sistemas biológicos complexos, como microambientes tumorais e redes neuronais densas. Além disso, métodos como FISH e DNA Exchange Imaging mostram-se promissores no aprimoramento da multiplexação por meio de código de barras de DNA e imagens rápidas. O futuro da imagem de proteínas altamente multiplexadas pode estar no uso de anticorpos conjugados com ácido nucleico para detecção específica, sensível e multiplexada, permitindo uma análise abrangente de tecidos complexos17.
Em conclusão, descrevemos uma maneira promissora de extrair e preparar amostras limpas de cérebro-medula espinhal. Nosso estudo ajudará os pesquisadores a realizar pesquisas relevantes. Nosso protocolo alcançou tecido de transparência em camundongos perfundidos com PFA. No entanto, uma publicação recente relata que os cientistas descobriram um corante não tóxico que pode ser aplicado na pele de camundongos para torná-la temporariamente transparente18. Isso permite que os pesquisadores observem as estruturas fisiológicas sob a pele, incluindo vasos sanguíneos e órgãos internos. Essa tecnologia pode se tornar mais avançada em um futuro próximo, com melhorias na espessura e no grau de transparência, permitindo a observação in vivo de vários órgãos de camundongos, incluindo os sistemas nervoso central e periférico, sistema respiratório e sistema circulatório19.
Divulgações
Os autores declaram não haver interesses conflitantes.
Agradecimentos
Fundação Nacional de Ciências Naturais da China (concessão Nº 82101249 e Nº 82471204 a XY Sun). Fundação de Pesquisa de Pós-Doutorado da China (concessão nº 2022M722125 para XY Sun).
Materiais
| Name | Company | Catalog Number | Comments |
| 1 ml syringe | Shandong Weigao Group Medical Polymer | ||
| 502 glue | Deli Group | ||
| BD insulin syringe | Becton,Dickinson and Company | 328421 | |
| Bend toothed dissecting forceps | Jinzhong | JD1050 | |
| Circular steel clamp | Weili | ||
| Fine scissors | Jinzhong | y00030 | |
| Hemostatic forceps bent with tooth | Jinzhong | J31020 | |
| Hemostatic forceps straight with tooth | Jinzhong | J31010 | |
| Infusion needle 0.7mm | Kindly Group | ||
| Light box scale line | Nuohai Life Science | NH210901 | |
| Microdissection straight forceps | Jinzhong | WA3020 | |
| NobeliumSoftware | Nuohai Life Science | Scanning software | |
| paraformaldehyde | Biosharp | BL539A | |
| Peristaltic pumps | Nuohai Life Science | NH1000 | |
| Peristaltic pumps head | Nuohai Life Science | NH-15 | |
| Phosphate buffered saline | Servicebio | G4202 | |
| Sodium heparin | Shanghai Pharma | H31022051 | |
| STOCK Tg (Thy1-EGFP) MJrs/J strain mice | Jackson Laboratory | 007788 | |
| Straight toothed dissecting forceps | Jinzhong | JD1060 | |
| Tissue clearing Kit(hyrophilic) | Nuohai Life Science | NH-CR-210701 | |
| Tissue culture treater 100mm x 20mm | NEST | 704001 | |
| Tissue scissors | Jinzhong | J21040 | |
| Tribromoethanol | Aibei Biotechnology | M2910 | |
| Venus scissors | Jinzhong | YBC010 |
Referências
- Ueda, H. R., et al. Tissue clearing and its applications in neuroscience. Nat Rev Neurosci. 21 (2), 61-79 (2020).
- Tainaka, K., Kuno, A., Kubota, S. I., Murakami, T., Ueda, H. R. Chemical principles in tissue clearing and staining protocols for whole-body cell profiling. Annu Rev Cell Dev Biol. 32, 713-741 (2016).
- Susaki, E. A., Ueda, H. R. Whole-body and whole-organ clearing and imaging techniques with single-cell resolution: Toward organism-level systems biology in mammals. Cell Chem Biol. 23 (1), 137-157 (2016).
- Wu, M., et al. Innervation of nociceptor neurons in the spleen promotes germinal center responses and humoral immunity. Cell. 187 (12), 2935-2951.e19 (2024).
- Liu, T., et al. Local sympathetic innervations modulate the lung innate immune responses. Sci Adv. 6 (20), eaay1497 (2020).
- Qi, Y., et al. FDISCO: Advanced solvent-based clearing method for imaging whole organs. Sci Adv. 5 (1), eaau8355 (2019).
- Bagnoli, S., Terzibasi Tozzini, E., Cellerino, A. Whole-Brain clearing and immunofluorescence in Nothobranchius furzeri. Cold Spring Harb Protoc. 2023 (9), 698-704 (2023).
- Lu, T., Shinozaki, M., Nagoshi, N., Nakamura, M., Okano, H. 3D imaging of supraspinal inputs to the thoracic and lumbar spinal cord mapped by retrograde tracing and light-sheet microscopy. J Neurochem. 162 (4), 352-370 (2022).
- Saritas, T., Puelles, V. G., Su, X. T., Ellison, D. H., Kramann, R. Optical clearing and imaging of immunolabeled kidney tissue. J Vis Exp. (149), e60002 (2019).
- Song, J. H., et al. Precise mapping of single neurons by calibrated 3D reconstruction of brain slices reveals topographic projection in mouse visual cortex. Cell Rep. 31 (8), 107682 (2020).
- Fournel, R., Veruki, M. L., Hartveit, E. Digital reconstruction and quantitative morphometric analysis of bipolar cells in live rat retinal slices. J Comp Neurol. 530 (10), 1700-1728 (2022).
- Lin, R., et al. Cell-type-specific and projection-specific brain-wide reconstruction of single neurons. Nat Methods. 15 (12), 1033-1036 (2018).
- Peng, Y. C., et al. Rapid histological assessment of prostate specimens in the three-dimensional space by hydrophilic tissue clearing and confocal microscopy. J Histochem Cytochem. 70 (8), 597-608 (2022).
- Singhal, P., et al. Evaluation of histomorphometric changes in tissue architecture in relation to alteration in fixation protocol - An in vitro study. J Clin Diagn Res. 10 (8), ZC28-ZC32 (2016).
- Tainaka, K., et al. Chemical landscape for tissue clearing based on hydrophilic reagents. Cell Rep. 24 (8), 2196-2210.e9 (2018).
- Lee, S. H., Son, H. J. Second wave, late-stage neuroinflammation in cleared brains of aged 5xFAD Alzheimer's mice detected by macrolaser light sheet microscopy imaging. Int J Mol Sci. 24 (23), 242317058 (2023).
- Zhao, J., Lai, H. M., Qi, Y., He, D., Sun, H. Current status of tissue clearing and the path forward in neuroscience. ACS Chem Neurosci. 12 (1), 5-29 (2021).
- Ou, Z., et al. Achieving optical transparency in live animals with absorbing molecules. Science. 385 (6713), eadm6869 (2024).
- Ou, Z., et al. Achieving optical transparency in live animals with absorbing molecules. Science. 385, eadm6869 (2024).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados