Method Article
מיצוי וניקוי רקמות הכנת דגימות מוח-חוט שדרה של עכברים
* These authors contributed equally
In This Article
Summary
מחקר זה מציג פרוטוקול לחילוץ והכנה של דגימות מוח וחוט שדרה שלם עם אותות פלואורסצנטיים משומרים, המשפר את יעילות הניסוי ושלמות הנתונים כדי לקדם את המחקר במדעי המוח.
Abstract
מחקר במדעי המוח המתמקד במערכת העצבים המרכזית מחייב הבנה מעמיקה של גורמים שונים, כולל התפלגות תאים, קישוריות עצבית ודינמיקה מולקולרית. מתודולוגיות מסורתיות לחקירת כל המוח וחוט השדרה כוללות לעתים קרובות בידוד, חתך וסריקת פרוסות רקמה, ולאחר מכן תהליך עתיר עבודה של שחזור תמונה תלת מימדית. גישה קונבנציונלית זו יכולה להיות גם גוזלת זמן וגם מסורבלת. התקדמות בטכניקות ניקוי רקמות והדמיה של איברים שלמים חוללו מהפכה בניתוח של כל המוח וחוט השדרה. כדי למקסם את הפוטנציאל של שיטות חדשניות אלה, חיוני לחלץ ולנקות דגימות מוח תוך שמירה על חיבורן לחוט השדרה. פרוטוקול זה מספק מדריך מפורט ושיטתי להכנת דגימות מוח המחוברות לחוט השדרה, המתאר את הליכי המיצוי והניקוי. על ידי ייעול תהליכים אלה, גישה זו משפרת משמעותית את יעילות הניסוי ואת שלמות הנתונים, ובכך מטפחת התקדמות במחקר מדעי המוח ומאפשרת חקירות מקיפות יותר של המורכבות של מערכת העצבים המרכזית.
Introduction
מיפוי וניתוח מדויקים של התפלגות העצבים מספקים תובנות חשובות לגבי הארגון המבני והתפקודי של מערכת העצבים המרכזית, סוללים את הדרך לאסטרטגיות טיפוליות חדשניות ומשפרים את ההבנה הכוללת שלנו של מנגנונים עצביים. נכון לעכשיו, חסרים מדריכי וידאו מקיפים שידריכו את החוקרים בהכנה וחילוץ דגימות מוח המחוברות לחוט השדרה והשגת ניקוי רקמות מוצלח.
ישנן מספר גישות לניקוי רקמות זמינות: שיטות הידרופוביות, הידרופיליות, מבוססות הידרוג'ל וניקוי הרחבת רקמות 1,2,3. הטכניקה של ניקוי רקמות מיושמת באופן נרחב בחקר איברים כמו טחול4, ריאות5, שריר גסטרוקנמיוס6, מוח7, חוט שדרה8 וכליות9. הפרוטוקול שלנו יספק הוראות מפורטות כיצד להכין דגימות מוח שלמות המחוברות לחוט השדרה אשר סומנו בסמן פלואורסצנטי באמצעות עכברי זן STOCK Tg (Thy1-EGFP) MJrs/J. הוא יציע הדרכה שלב אחר שלב למיצוי דגימה ויתאר את פרוטוקול הפינוי באמצעות ערכות הידרופיליות לניקוי רקמות. פרוטוקול זה מסייע לחוקרים לשלוט בכל התהליך החל מהפקת דגימות מוח-חוט השדרה ועד להכנה, וסריקה לאחר מכן. זה לא רק ישפר את יעילות הניסוי אלא גם יבטיח את שלמות ואיכות הדגימות, ויספק נתונים מדויקים ואמינים יותר לתמיכה במחקר במדעי המוח.
בהשוואה לשיטות חתך, הדמיה ושחזור תלת מימדי קונבנציונליות10,11, הגישה המוצגת כאן מציעה מספר יתרונות מרכזיים, כגון (1) שלמות מבנית משופרת: על ידי שמירה על מבנה האיבר השלם, שיטה זו מפחיתה את הסיכון לאובדן מידע קריטי שיכול להתרחש עם חתך12; (2) איסוף נתונים מקיף: השימוש בערכת ניקוי רקמות מאפשר מיפוי מפורט של תאים שקשה להשיג בטכניקות מסורתיות; (3) יעילות ודיוק: הפרוטוקול מייעל את כל התהליך מהפקת הדגימה ועד להדמיה, מפחית את הזמן הנדרש על ידי הליכי אימונוהיסטוכימיה או צביעה וממזער שגיאות הקשורות לחיתוך והרכבה13.
הפרוטוקול מתגבר על המגבלות של שיטות חיתוך מסורתיות, שלעתים קרובות גורמות לנתונים לא שלמים ומקוטעים. על ידי שימור הקשר השלם בין המוח לחוט השדרה ושימוש בשיטות מודרניות לניקוי רקמות, פרוטוקול זה מספק מבט הוליסטי יותר על מערכת העצבים המרכזית, שהיא חיונית להבנת מנגנונים ותפקודים עצביים מורכבים. המטרה העיקרית של שיטה זו היא לאפשר הדמיה מקיפה של מערכת העצבים המרכזית על ידי הכנת דגימות מוח שלמות המחוברות לחוט השדרה, אשר סומנו בסמנים עצביים פלואורסצנטיים. פרוטוקול זה נועד להקל על הדמיה מפורטת של מבנים עצביים והתפלגות תאים באמצעות שיטות אנטומיות מתקדמות וטכניקות ניקוי רקמות.
Protocol
כל הניסויים בבעלי חיים נערכו בהתאם להנחיות Animal Research Reporting In Vivo Experiments (ARRIVE) ולמדריך המכונים הלאומיים לבריאות לטיפול ושימוש בחיות מעבדה. המחקר הנוכחי אושר על ידי הוועדה לטיפול ושימוש בבעלי חיים של בית החולים רנג'י, בית הספר לרפואה של אוניברסיטת שנחאי ג'יאוטונג. כאן, עכברים זכרים בני 7-8 שבועות מזן STOCK Tg (Thy1-EGFP) MJrs/J (מקור C57BL/6J x CBA) שימשו למחקר הנוכחי. בעלי החיים הושגו באופן מסחרי (ראו טבלת חומרים) ושוכנו בכלובים סטנדרטיים (22 מעלות צלזיוס ±-2 מעלות צלזיוס, 12 שעות/12 שעות מחזור אור/חושך, מזון ומים אד ליביטום).
1. זלוף
- הרדמה עמוקה של עכברים בוגרים באמצעות 1.25% טריברומו-אתנול (0.02 מ"ל/ק"ג, ראה טבלת חומרים) הניתנת בהזרקה תוך-צפקית באמצעות מזרק של 1 מ"ל. בדוק את עומק ההרדמה לפי תגובת צביטה בבוהן.
- קבע את גפי העכבר ללוח האקרילי הלבן באמצעות מהדקי פלדה. חותכים את העור בין שתי עצם הירך של העכבר וממשיכים לחתוך כלפי מעלה עד שמגיעים לסרעפת. פתח את שני צידי בית החזה דרך הסרעפת כדי לחשוף את הלב באמצעות מספריים ומלקחיים ישרים.
- הכנס מחט עירוי 0.7 מ"מ לחדר השמאלי. בצע חתך של 1-2 מ"מ בתוספת הפרוזדורים הימנית.
- החדרה עם 1x PBS המכיל 10 U/mL נתרן הפרין בקצב של 10 מ"ל/דקה עם משאבה פריסטלטית (ראה טבלת חומרים) לניקוי מלא של הדם. הכבד מחוויר לחלוטין מעיד על פינוי מוצלח.
- פרפיוז עם 50 מ"ל של 4% PFA מקורר מראש עם משאבה פריסטלטית בקצב של 10 מ"ל לדקה. יש לעקוב אחר סימנים כגון סלסול זנב עכבר ועוויתות שרירים.
הערה: זלוף לא מוצלח יכול להשפיע על תהליכי הסליקה הבאים.
2. מיצוי מדגם
- נתח בזהירות את כל המוח וחוט השדרה באמצעות מספריים ומלקחיים כדי למנוע נזק לדגימה.
- הפרד את העור בגב ובראש העכבר באמצעות מספריים עיניים. חתכו את עמוד השדרה בנקודה שבה הקו המחבר את הקצוות האחוריים העליונים של שתי הגפיים מצטלב עם עמוד השדרה
- הסר רקמת שריר ושומן מהצוואר והחלק האחורי של העכבר כדי לחשוף את עמוד השדרה והגולגולת. חותכים לאורך פער קו האמצע בין הצד השמאלי והימני של עמוד השדרה וחוט השדרה מהקצה התחתון של תעלת החוליות בעזרת מספריים ונוס.
- הסר את החלק העליון והצדדים הדו-צדדיים של עמוד השדרה הקטוע כדי לחשוף את חוט השדרה. חזור על השלבים עד שתגיע לחיבור המוח.
- הניחו את קצה הלהב האחד של המספריים של ונוס בין הנקב מגנום למוח. החלק וחתוך לאורך התפר האמצעי הסגיטלי כדי לפתוח את הגולגולת. השתמש במלקחיים כדי להסיר את הגולגולת ולחשוף את המוח.
- הסר את רקמת המוח-חוט השדרה של העכבר מקצה הגולגולת באמצעות מלקחיים ומספריים ונוס.
הערה: חתכים או נזק למשטח עלולים להחמיר במהלך הניקוי שלאחר מכן, מה שעלול לגרום לנזק בלתי צפוי לדוגמא. טפל בדוגמאות בזהירות. - השתמש במלקחיים מנתחים כדי להסיר את קרום חוט השדרה מתחת לסטריאומיקרוסקופ.
- אבטח את דגימת המוח-חוט השדרה ללוחית הקיבוע (ראה טבלת חומרים) באמצעות תפרים. הוסף לפחות פי 20 מנפח הדגימה של 4% PFA והנח אותו על שייקר בטמפרטורה של 4 מעלות צלזיוס לתסיסה איטית. יש לתקן למשך הלילה למשך 16-24 שעות.
הערה: קיבוע יתר מוביל לקישור צולב מוגזם של חלבון, מה שמפחית את יעילות הפינוי14. קיבוע לא מספיק או מושהה עלול לגרום לפירוק אנטיגן ולהרס מורפולוגיה של רקמות. - השלך את ה-PFA ושטוף את הדגימה 3x עם 1x PBS. ודא שנפח ה-PBS הוא לפחות פי 10 מנפח הדגימה, וטובל את הדגימה במלואה. כל שטיפה נמשכת שעתיים עם תסיסה על שייקר במהירות של לא פחות מ-60 סל"ד כדי להסיר ביסודיות שאריות PFA.
3. ניקוי רקמות
הערה: כאן משתמשים בערכת ניקוי רקמות (ראה טבלת חומרים).
- הכן את תמיסת הסרת השומנים על ידי ערבוב תמיסה A ותמיסה B ביחס מסה של 9:1.
הערה: מומלץ שנפח התמיסה להסרת שומנים יהיה יותר מפי 20 מנפח הדגימה. - הנח את הרקמה הקבועה לתוך צינור צנטריפוגה של 50 מ"ל והוסף 50 מ"ל מתמיסת הסרת השומנים. יש להניח את צינור הצנטריפוגה בשייקר בטמפרטורה של 37 מעלות צלזיוס, לנער בעדינות ב-60 סל"ד להסרת שומנים. יש להחליף את התמיסה להסרת שומנים מדי יום למשך 3-5 ימים. כדי לקבוע השלמה, הנח את צינור הצנטריפוגה על קופסת אור עם קו קנה מידה. אם קו הסולם השחור נראה בבירור ולא מעוות דרך הדגימה, התהליך הושלם.
- הנח את הדגימה ב-20 מ"ל של תמיסה C על שייקר ב-25 מעלות צלזיוס, תוך ניעור בפחות מ-60 סל"ד להתאמת מקדם שבירה. החלף את פתרון C לאחר 24 שעות. הניחו את צלחת התרבות עם הדגימה שקועה במלואה בתמיסה C על קופסה קלה עם קו קנה מידה. אם קו קנה המידה השחור נראה בבירור ואינו מעוות דרך הדגימה, תהליך ההתאמה הושלם.
הערה: עבור רקמות עכבר בוגרות, התאמת מקדם השבירה מסתיימת בדרך כלל תוך יומיים.
4. הטמעת רקמות
- הכינו תמיסת ג'ל עם 147 גרם תמיסה C בבקבוק זכוכית של 200 מ"ל, הוסיפו 3.0 גרם אגרוז, ערבבו היטב על ידי מערבולת, ואז מיקרוגל עד לרתיחה וכבו מיד את המיקרוגל. מעבירים את צינור הצנטריפוגה לאינקובטור בטמפרטורה של 37 מעלות צלזיוס עד שהאגרוז נמס.
הערה: מומלץ להכין את תמיסת הג'ל טרייה לפי הצורך. - הטמיעו את הדגימה המנוקה בשכבה בעומק 2 מ"מ של תמיסת ג'ל 37 מעלות צלזיוס בתבנית ומצננים במקרר של 4 מעלות צלזיוס למשך 30 דקות עד להתמצקות למחצה. הכניסו את הדגימה המותאמת למקדם השבירה לתוך התבנית והוסיפו תמיסת ג'ל כך שתהיה ברמה או מעט מתחת לחלק העליון של הדגימה.
- מחזירים את התבנית למקרר של 4 מעלות צלזיוס למשך שעתיים. הוסף תמיסת ג'ל עד ליישור עם משטח התבנית. מכסים בכיסוי. האיצו את ההתמצקות במקרר של 4 מעלות צלזיוס למשך שעתיים. אחסן את הדגימה המוטמעת למשך הלילה במקרר 4 מעלות צלזיוס. המשך בהדמיה בהקדם האפשרי.
5. סריקה
- הסר את הכיסוי בעזרת פינצטה והוציא את הדגימה המוטמעת. הנח את הדגימה בצינור של 50 מ"ל והוסף 30 מ"ל של תמיסת הדמיה כדי להטביע את הדגימה במלואה.
- מרחו דבק 502 כדי להדביק היטב את הדגימה על מחזיק הדגימה. קבע את המחזיק על התקן ההדמיה.
- הפעל את תוכנת הסריקה כמתואר. בחר את רמת ההגדלה של 4x במקטע ההגדלה. לחץ על כפתור הכיול כדי להפעיל את מצב הכיול.
- לחצו על הלחצן 'תצוגה מקדימה ' כדי להיכנס למצב תצוגה מקדימה. לחץ על כפתור התנועה בכיוון Z כדי להזיז לאט את הדגימה כלפי מעלה מתחתית תא הדגימה עד שיריעת האור שנוצרה תעבור דרך הדגימה.
- בחר את ערוץ הלייזר ואפשרות מצב התאורה המתאימים. בחר את כיוון נתיב הסריקה עבור הדגימה. לחץ על כפתור הסריקה האוטומטית כדי להתחיל ללכוד את הדגימה.
תוצאות
פרוטוקול זה מבודד בהצלחה את כל המוח המחובר לחוט השדרה בעכברים זכרים מזן STOCK Tg (Thy1-EGFP) MJrs/J. זה גם הופך את הדגימות לשקופות, ומבטיח שהאותות הפלואורסצנטיים נשמרים ונלכדים במלואם, ומספקים תמונות ברורות ומפורטות השומרות על שלמות הקרינה המקורית.
איור 1 מציג חוט מוח-עמוד שדרה שלם, מה שמדגים ששלבי הדיסקציה המתוארים בפרוטוקול הזה מדויקים. בנוסף, ניקוי הרקמות בוצע בדיוק גבוה, ויצר דגימות שקופות המאפשרות הדמיה של מבנים עצביים מורכבים. יתר על כן, איור 2 מראה כי דגימת המוח-חוט השדרה עם הדמיית האותות הפלואורסצנטיים נשמרת היטב, ומספקת תמונות ברורות ומפורטות השומרות על שלמות הקרינה המקורית. איור 3 מציג תמונת הגדלה גבוהה יותר של התאים הבודדים המתוארים באיור 2.
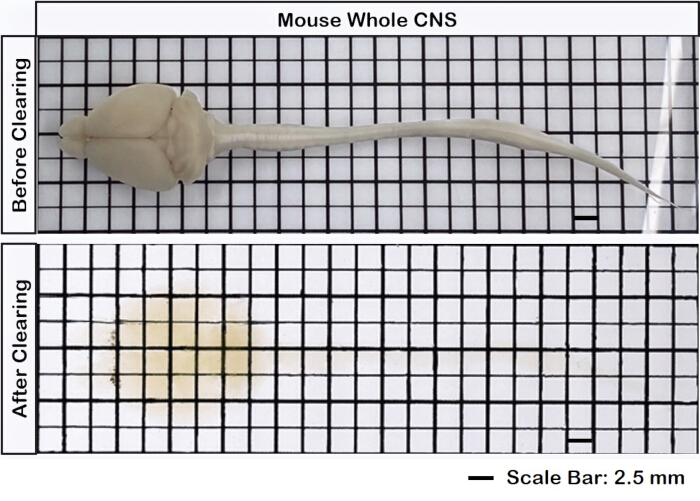
איור 1: חוט שדרה שלם במוח. רקמת המוח מחוברת לחוט השדרה, לפני ואחרי הניקוי. סרגל קנה מידה = 2 מ"מ. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
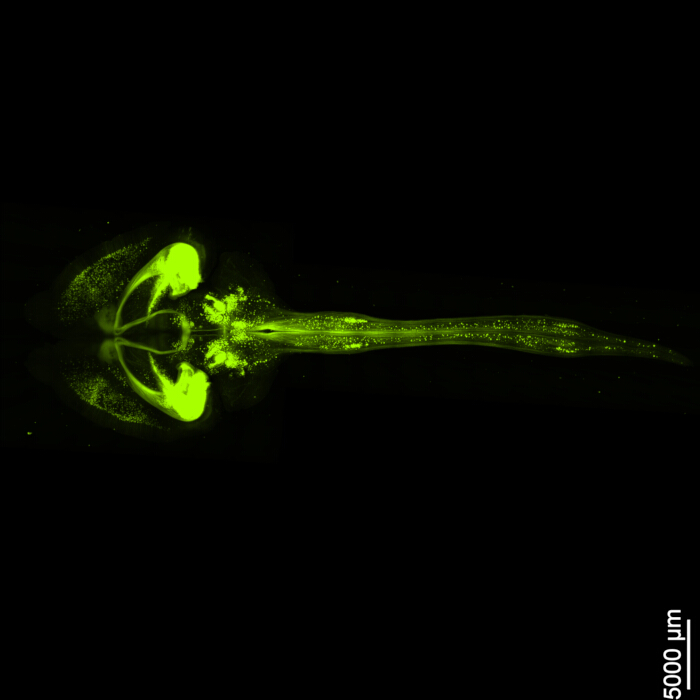
איור 2: EGFP פלואורסצנטי תלת-ממדי. התמונה מציגה את המוח כולו יחד עם החיבור שלו לחוט השדרה. סרגל קנה מידה = 5000 מיקרומטר. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
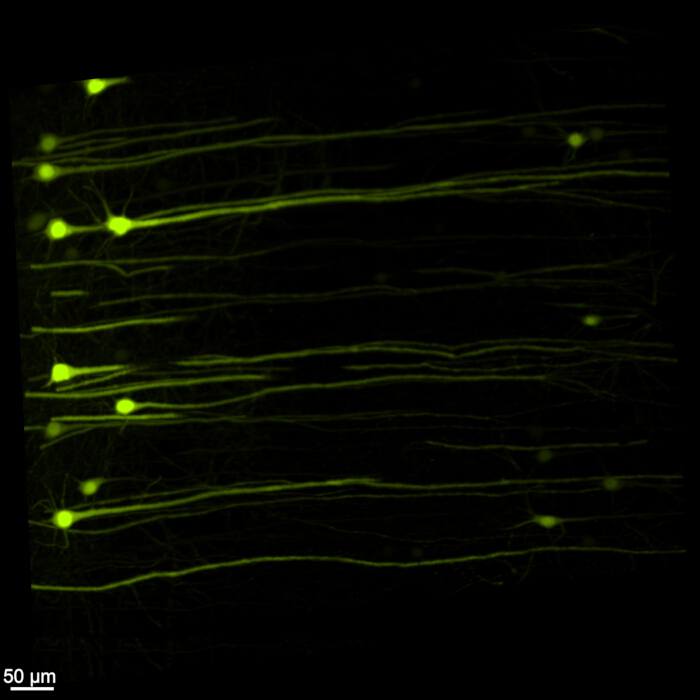
איור 3: EGFP פלואורסצנטי תלת-ממדי בהגדלה גבוהה. תמונת הגדלה גבוהה יותר המדגישה תאים בודדים המבטאים EGFP בתוך דגימת המוח-חוט השדרה. סרגל קנה מידה = 50 מיקרומטר. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
Discussion
פרוטוקול הניסוי המוצע כולל שימוש בעכברים שמוחם מחובר לחוט השדרה המסומן בנגיפי מעקב עצביים פלואורסצנטיים. פרוטוקול זה מספק הוראות מקיפות ומפורטות להכנת דגימות מוח שלמות שנשארות מחוברות לחוט השדרה. הפרוטוקול מתאר בקפידה כל שלב, ומבטיח שהחוקרים יוכלו לשכפל את התהליך בדיוק.
מספר שלבים קריטיים בפרוטוקול זה תורמים לשיפור איכות הסליקה וההדמיה. חילוץ מלא של דגימות מוח שלמות המחוברות לחוט השדרה הוא משימה חשובה. שמירה על שלמות המוח וחוט השדרה חיונית למעקב מדויק ולניתוח שלאחר מכן. בעת איסוף דגימות, חתכים או נזק לפני השטח עלולים להחמיר במהלך תהליך הפינוי שלאחר מכן, מה שעלול להוביל לנזק בלתי צפוי. כדי להבטיח את שלמות הדגימות, חיוני להשתמש במספריים של ונוס ובפינצטה המפורטים בחומרים לדגימה קפדנית. אבטחת דגימת המוח-חוט השדרה לצלחת הקיבוע באמצעות תפרים היא צעד מכריע למניעת עיוות הנגרם על ידי כוח הכבידה, לחץ או גורמים אחרים בזמן שהיא שקועה בנוזל.
מחקרים קודמים התמקדו לעתים קרובות אך ורקבמבנה ובתפקוד של המוח או חוט השדרה. עם זאת, מערכת העצבים המרכזית מתפקדת כיחידה מלוכדת. העברת אותות מהמוח כלפי מטה והעברה כלפי מעלה של אותות היקפיים דרך חוט השדרה למרכזים גבוהים יותר היא תהליך מורכב. גישה לדגימות מקיפות של חוט השדרה היא יתרון לחקירת האינטגרציה של אותות אלה.
ישנן מספר גישות ראשוניות לניקוי רקמות זמינות: שיטות הידרופוביות, הידרופיליות, מבוססות הידרוג'ל וניקוי הרחבת רקמות 1,2,3. העקרונות והשיטות הבסיסיים זהים: החלפת מולקולות המפזרות אור (כגון שומנים, פיגמנטים וסידן פוספט) במולקולות אחרות התואמות את מקדם השבירה של מדיום ההדמיה 2,15. שיטות ניקוי הידרופיליות מהוות בדרך כלל פחות בעיות רעילות והן יעילות יותר בשימור האותות של חלבונים וצבעים פלואורסצנטיים 1,2,3; עם זאת, יש להם כמה חסרונות. הם עלולים לגרום לנפיחות ברקמות ולתנודות בנפח, מה שעלול להשפיע על השלמות המבנית של הדגימות. שימוש בתרכובות היפר-לחות, כמו אוריאה ופורממיד, עלול להוביל לדנטורציה של חלבונים, מה שמשפיע על הרלוונטיות הביולוגית של הרקמות. בנוסף, בעוד ששיטות אלו הן בדרך כלל פשוטות ותואמות לתיוג פלואורסצנטי, השגת פינוי אופטימלי לרקמות גדולות יותר דורשת לעתים קרובות פרוטוקולים מורכבים הכוללים כימיקלים שונים, מה שעלול לסבך את התהליך. יתר על כן, הצורך בתערובות כימיות מדויקות להתאמת תאי רקמה ספציפיים מוסיף למורכבות, ודורש אופטימיזציה קפדנית ליישומים ספציפיים.
התקדמות בטכניקות ניקוי רקמות והדמיה אפשרה לנו למפות את התפלגות העצבים והנפח של תאים שונים המבטאים באופן מהותי חלבונים פלואורסצנטיים או מסומנים בנוגדנים מתויגים פלואורסצנטיים, באמצעות מיקרוסקופ פלואורסצנטי16. הפיתוח של טכניקות זיהוי מולקולרי מרובות ברקמות מנוקות מתקדם במהירות. שיטות אלו מאפשרות פרופיל סימולטני של אנליטים ביולוגיים שונים מדגימות בודדות, דבר חיוני להבנת מערכות ביולוגיות מורכבות כמו מיקרו-סביבות גידול ורשתות עצביות צפופות. בנוסף, שיטות כמו FISH והדמיית חילופי DNA מראות הבטחה בשיפור ריבוב באמצעות ברקוד DNA והדמיה מהירה. העתיד של הדמיית חלבונים מרובבים מאוד עשוי להיות טמון בשימוש בנוגדנים מצומדים לחומצות גרעין לזיהוי ספציפי, רגיש ומרובה, המאפשר ניתוח מקיף של רקמות מורכבות17.
לסיכום, אנו מתארים דרך מבטיחה לחלץ ולהכין דגימות מוח-חוט שדרה נקיות. המחקר שלנו יסייע לחוקרים לבצע מחקר רלוונטי. הפרוטוקול שלנו השיג רקמת שקיפות בעכברים שעברו PFA. עם זאת, פרסום שפורסם לאחרונה מדווח כי מדענים גילו צבע לא רעיל שניתן למרוח על עור העכבר כדי להפוך אותו לשקוף באופן זמני18. זה מאפשר לחוקרים להתבונן במבנים הפיזיולוגיים מתחת לעור, כולל כלי דם ואיברים פנימיים. טכנולוגיה זו עשויה להתקדם בעתיד הקרוב, עם שיפורים בעובי ובמידת השקיפות, המאפשרים תצפית in vivo על איברי עכבר שונים, כולל מערכת העצבים המרכזית וההיקפית, מערכת הנשימה ומערכת הדם19.
Disclosures
המחברים מצהירים שאין ניגודי אינטרסים.
Acknowledgements
הקרן הלאומית למדעי הטבע של סין (מענק מס' 82101249 ומס' 82471204 ל-XY Sun). קרן המחקר לפוסט-דוקטורט של סין (מענק מס' 2022M722125 ל-XY Sun).
Materials
| Name | Company | Catalog Number | Comments |
| 1 ml syringe | Shandong Weigao Group Medical Polymer | ||
| 502 glue | Deli Group | ||
| BD insulin syringe | Becton,Dickinson and Company | 328421 | |
| Bend toothed dissecting forceps | Jinzhong | JD1050 | |
| Circular steel clamp | Weili | ||
| Fine scissors | Jinzhong | y00030 | |
| Hemostatic forceps bent with tooth | Jinzhong | J31020 | |
| Hemostatic forceps straight with tooth | Jinzhong | J31010 | |
| Infusion needle 0.7mm | Kindly Group | ||
| Light box scale line | Nuohai Life Science | NH210901 | |
| Microdissection straight forceps | Jinzhong | WA3020 | |
| NobeliumSoftware | Nuohai Life Science | Scanning software | |
| paraformaldehyde | Biosharp | BL539A | |
| Peristaltic pumps | Nuohai Life Science | NH1000 | |
| Peristaltic pumps head | Nuohai Life Science | NH-15 | |
| Phosphate buffered saline | Servicebio | G4202 | |
| Sodium heparin | Shanghai Pharma | H31022051 | |
| STOCK Tg (Thy1-EGFP) MJrs/J strain mice | Jackson Laboratory | 007788 | |
| Straight toothed dissecting forceps | Jinzhong | JD1060 | |
| Tissue clearing Kit(hyrophilic) | Nuohai Life Science | NH-CR-210701 | |
| Tissue culture treater 100mm x 20mm | NEST | 704001 | |
| Tissue scissors | Jinzhong | J21040 | |
| Tribromoethanol | Aibei Biotechnology | M2910 | |
| Venus scissors | Jinzhong | YBC010 |
References
- Ueda, H. R., et al. Tissue clearing and its applications in neuroscience. Nat Rev Neurosci. 21 (2), 61-79 (2020).
- Tainaka, K., Kuno, A., Kubota, S. I., Murakami, T., Ueda, H. R. Chemical principles in tissue clearing and staining protocols for whole-body cell profiling. Annu Rev Cell Dev Biol. 32, 713-741 (2016).
- Susaki, E. A., Ueda, H. R. Whole-body and whole-organ clearing and imaging techniques with single-cell resolution: Toward organism-level systems biology in mammals. Cell Chem Biol. 23 (1), 137-157 (2016).
- Wu, M., et al. Innervation of nociceptor neurons in the spleen promotes germinal center responses and humoral immunity. Cell. 187 (12), 2935-2951.e19 (2024).
- Liu, T., et al. Local sympathetic innervations modulate the lung innate immune responses. Sci Adv. 6 (20), eaay1497 (2020).
- Qi, Y., et al. FDISCO: Advanced solvent-based clearing method for imaging whole organs. Sci Adv. 5 (1), eaau8355 (2019).
- Bagnoli, S., Terzibasi Tozzini, E., Cellerino, A. Whole-Brain clearing and immunofluorescence in Nothobranchius furzeri. Cold Spring Harb Protoc. 2023 (9), 698-704 (2023).
- Lu, T., Shinozaki, M., Nagoshi, N., Nakamura, M., Okano, H. 3D imaging of supraspinal inputs to the thoracic and lumbar spinal cord mapped by retrograde tracing and light-sheet microscopy. J Neurochem. 162 (4), 352-370 (2022).
- Saritas, T., Puelles, V. G., Su, X. T., Ellison, D. H., Kramann, R. Optical clearing and imaging of immunolabeled kidney tissue. J Vis Exp. (149), e60002 (2019).
- Song, J. H., et al. Precise mapping of single neurons by calibrated 3D reconstruction of brain slices reveals topographic projection in mouse visual cortex. Cell Rep. 31 (8), 107682 (2020).
- Fournel, R., Veruki, M. L., Hartveit, E. Digital reconstruction and quantitative morphometric analysis of bipolar cells in live rat retinal slices. J Comp Neurol. 530 (10), 1700-1728 (2022).
- Lin, R., et al. Cell-type-specific and projection-specific brain-wide reconstruction of single neurons. Nat Methods. 15 (12), 1033-1036 (2018).
- Peng, Y. C., et al. Rapid histological assessment of prostate specimens in the three-dimensional space by hydrophilic tissue clearing and confocal microscopy. J Histochem Cytochem. 70 (8), 597-608 (2022).
- Singhal, P., et al. Evaluation of histomorphometric changes in tissue architecture in relation to alteration in fixation protocol - An in vitro study. J Clin Diagn Res. 10 (8), ZC28-ZC32 (2016).
- Tainaka, K., et al. Chemical landscape for tissue clearing based on hydrophilic reagents. Cell Rep. 24 (8), 2196-2210.e9 (2018).
- Lee, S. H., Son, H. J. Second wave, late-stage neuroinflammation in cleared brains of aged 5xFAD Alzheimer's mice detected by macrolaser light sheet microscopy imaging. Int J Mol Sci. 24 (23), 242317058 (2023).
- Zhao, J., Lai, H. M., Qi, Y., He, D., Sun, H. Current status of tissue clearing and the path forward in neuroscience. ACS Chem Neurosci. 12 (1), 5-29 (2021).
- Ou, Z., et al. Achieving optical transparency in live animals with absorbing molecules. Science. 385 (6713), eadm6869 (2024).
- Ou, Z., et al. Achieving optical transparency in live animals with absorbing molecules. Science. 385, eadm6869 (2024).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved