Method Article
OVARİLEKTİMİ İLE OSTEOSARKOPENİ İÇİN FARELİ MODEL OLUŞTURULMASI
Bu Makalede
Özet
Bu mevcut protokol, ovariektomi kullanılarak bir sıçan osteosarkopeni modeli oluşturmak için bir prosedürü özetlemektedir.
Özet
Kompleks dejeneratif bir hastalık olan osteosarkopeni (OS), iskelet kası kütlesi ve kemik mineral yoğunluğunda (KMY) eşzamanlı azalma ile karakterizedir ve yaşlı nüfus için çok büyük bir sağlık tehlikesi oluşturur. Klinik önemine rağmen, OS'nin altında yatan patofizyolojik mekanizmalar tam olarak anlaşılamamıştır ve bu da etkili tedavi stratejilerini kolaylaştırmak için etiyolojisinin daha derin bir şekilde anlaşılması gerekliliğinin altını çizmektedir. Güvenilir bir hayvan modelinin geliştirilmesi bu çabada çok önemlidir. Bu çalışma, yaşa bağlı kas ve kemik kaybının başlangıcını hızlandırdığı bilinen bir yöntem olan bilateral overektomi yoluyla sıçanlarda postmenopozal osteosarkopeni indüksiyonu için rafine bir protokol sunmaktadır. Bu çalışmada, 12 haftalık sıçanlar vücut ağırlığına göre tabakalandırıldı ve rastgele bir sahte operasyon grubuna veya bir yumurtalık (OVX) grubuna atandı. Sol arka ekstremitenin kuadriseps ve triseps kaslarının yanı sıra sol uyluk kemiğinden doku örnekleri ameliyattan 4, 8 ve 12. haftalarda sistematik olarak toplandı. Bu metodik yaklaşım, overektominin kas ve kemik sağlığı üzerindeki etkilerinin kapsamlı bir şekilde değerlendirilmesini sağlar. Kas lifi atrofisi ve femoral morfolojinin histolojik değerlendirmesi hematoksilen ve eozin (HE) boyaması kullanılarak yapılırken, kemik mineral yoğunluğu çift enerjili X-ışını absorpsiyometrisi (DXA) kullanılarak ölçüldü. OS'nin zamansal ilerlemesi, yukarıda belirtilen aralıklarla titizlikle izlendi ve kas ve kemik dejenerasyonu arasındaki dinamik etkileşime dair içgörüler sağladı. Bu model sadece OS'nin klinik belirtilerini doğru bir şekilde yansıtmakla kalmaz, aynı zamanda yeni terapötik yaklaşımları ve bunların altında yatan mekanizmaları araştırmak için sağlam bir platform görevi görür.
Giriş
Osteosarkopeni, hem osteoporoz hem de sarkopeninin klinik belirtilerini kapsayan çok yönlü dejeneratif bir durumdur 1,2,3,4. Yaygın bir iskelet bozukluğu olan osteoporoz, azalmış kemik kütlesi, bozulmuş mikromimari ve kırıklara karşı artan duyarlılık ile karakterizedir. Genellikle kas kaybı sendromu olarak adlandırılan sarkopeni, kas gücü ve kütlesinde bir azalma ile karakterize edilir 5,6. Maryam'ın7 bulgusu, osteosarkopeninin ölüm riskini tek başına sarkopeniye göre %30 ve tek başına düşük KMY'ye göre %8 artırdığını ortaya koydu. Araştırmalar, 60 yaş ve üstü toplumda yaşayan bireylerin %16,4'ünün osteosarkopeniden etkilendiğini göstermiştir8. Güney Kore'de kalça kırığı geçirmiş 60 yaş ve üzeri yaşlı bireylerde osteosarkopeni insidansı %27,2 olarak bildirilmektedir9. OS'li bireyler daha yüksek düşme, kırık, hastaneye yatış ve kurumsallaşma riskleriyle karşı karşıya kalmakta, bu da sağlık sistemine ve topluma yük getirmektedir10,11. Bu sonuçların ciddiyeti göz önüne alındığında, OS'nin önlenmesi ve tedavisi için etkili önlemler geliştirmek ve uygulamak çok önemlidir. Aciliyete rağmen, bu alandaki araştırmalar, tanı kriterleri ve çeşitli tedavi yöntemlerinin etkinliği ile ilgili devam eden tartışmalarla birlikte yeni ortaya çıkmaktadır. Bu nedenle, güvenilir hayvan modellerinin geliştirilmesi, OS'nin patogenezini incelemek ve daha etkili tedavi yaklaşımlarını bilgilendirebilecek moleküler temelleri ortaya çıkarmak için gereklidir.
Şu anda, osteosarkopeni ile ilgili klinik öncesi çalışmalar için yaygın olarak kullanılan modeller, ilaç müdahalesi olmadan insan yaşlanma sürecini simüle eden yaşlanma modelini içerir. Bu yaklaşım doğal sürece daha yakındır ve uygun maliyetlidir; ancak olgunlaşma için önemli bir zaman yatırımı gerektirir12. Kimyasal ilaç enjeksiyon yöntemi, kısa bir modelleme döngüsü, kararlı sonuçlar ve düşük maliyet gibi belirli faydalar sunar. Bununla birlikte, hormon dozajının kesin olarak belirlenmesi, enjeksiyon için gereken teknik beceri ve hormonal müdahalelerin değişken etkileri de dahil olmak üzere zorluklar da ortaya çıkarmaktadır13,14. Genetik mühendisliği modelleri, hem genetik olarak kusurlu hem de maliyetli olabilen genetik olarak değiştirilmiş organizmaları içerebilir. Bu modeller oldukça spesifik olmalarına rağmen, üretilmesi önemli ölçüde daha karmaşık ve pahalıdır15. Kullanılmama modelleri, uzun süreli yatak istirahatinin klinik hastalar üzerindeki etkilerini simüle eder16. Kullanılmama modelleri, kas kaybını ele almak için etkili ve uygun maliyetlidir, ancak kan pıhtıları ve bası yaraları gibi komplikasyonlarla ilişkilidir. Bu modeller, ekstremite nekrozunu önlemek için rutin olarak izlenir17,18 ve hormon eksikliği olan modeller; Bilimsel toplulukta, bilateral overektominin bir hayvan osteoporoz modeli oluşturmak için etkili bir yöntem olarak hizmet ettiği konusunda hakim bir fikir birliği vardır19,20.
Araştırmalar, kemik ve kas dokularının otokrin, endokrin ve parakrin mekanizmalar yoluyla da birbirleriyle etkileşime girebileceğini göstermektedir21. Kas ve kemik iliğinde yağ dokusu birikimi, osteosarkopeni2 bağlamında azalmış kemik ve kas kütlesinin bir göstergesi olarak hizmet eder. Yaşlı erişkinlerde sarkopeni, kemik yoğunluğunda bir azalma ve kemik mikro mimarisinin bozulması ile doğrudan ilişkilidir. Ek olarak, azalmış kas kütlesi, kemik mikro yapısının bozulması için bağımsız bir risk faktörü olarak hizmet eder22. Bu metodoloji, sarkopenininmodellenmesi için uygun bir strateji olarak kabul edilmiştir 23,24, bu da potansiyel olarak her iki koşul için birleşik bir model olarak hizmet edebilir25. Osteosarkopeniyi indüklemek için bir araç olarak ovariektominin uygulanmasına ilişkin sınırlı sayıda araştırmaya rağmen, bu yaklaşım potansiyel etkinliği göstermektedir. Klinik öncesi çalışmalarda ovariektomi kullanmanın faydaları, hızlı bir modelleme sürecini, farmakolojik müdahalelerin ortadan kaldırılmasını, stabil bir deneysel modelin oluşturulmasını, basit uygulamayı ve maliyet etkinliğini kapsar.
Bu çalışma, gebe olmayan bireylerde hem fallop tüplerinin hem de yumurtalıkların bir segmentinin çıkarılması yoluyla dişi sıçanlarda klinik öncesi bir model oluşturma prosedürünü tanımlamayı amaçlamaktadır. Bu yaklaşım, OS'nin moleküler temellerini araştırmak ve kontrollü bir deneysel ortamda müdahalelerin terapötik faydalarını değerlendirmek için değerli bir araç olarak hizmet eder.
Protokol
12 haftalık ve yaklaşık 200-240 g ağırlığındaki dişi Sprague Dawley sıçanları (n = 36), 12 saatlik aydınlık / karanlık döngüsüne sahip spesifik-patojen içermeyen (SPF) bir hayvan odasında havalandırmalı kafeslerde ayrı ayrı barındırıldı. SPF yemine ve steril suya ücretsiz erişimleri vardı. Sıçanların deneylerden önce bir hafta boyunca çevreye alışmalarına izin verildi. Rastgele tahsis kullanılarak, sıçanlar ameliyattan 4, 8 ve 12 hafta sonra yumurtalıklı (OVX) gruplara (her biri 6 sıçanlı) ve sahte gruplara (her biri 6 sıçanlı) ayrıldı. Tüm hayvan prosedürleri, Liaoning Geleneksel Çin Tıbbı Üniversitesi'ndeki (No. 21000042021040) hayvan refahı komitesinin onaylanmış yönergelerine göre gerçekleştirildi.
1. Sıçanlarda yumurtalık ameliyatı
NOT: Bu protokolde kullanılan cerrahi aparat Şekil 1'de yer almaktadır.
- Fareleri SPF hayvan odasında tutun ve steril bir ortamda sterilize edilmiş ekipman kullanarak gerekli tüm prosedürleri izleyin.
- Anestezik bir çözelti oluşturmak için beyaz bir toz olan sodyum pentobarbitali damıtılmış su veya% 0.9 normal tuzlu su çözeltisi ile karıştırın. Standart doz 30 mg / kg'dır; Şırıngayı buna göre doldurun.
NOT: Çözümün kararsız olduğunu ve hemen kullanılması gerektiğini unutmamak önemlidir. Her seferinde bir deney için gerekli miktarı hazırlayın. - İç organları üst karın bölgesine kaydırmak için farenin karnını başının üzerine kaldırın. Baskın eli kullanarak, karnın orta hattının sol (veya sağ) tarafından 1-1,5 cm uzağa bir şırınga yerleştirin ve farenin vücuduna 45 ° 'lik bir açıyla yerleştirin. İlaç çözeltisi uygulandıktan sonra, iğneyi döndürün ve ardından geri çekin.
- Anestezi uygulandıktan sonra, farenin solunumunu dikkatlice izleyin ve tamamen anestezi uygulandığını doğrulamak için ayak parmaklarını sıkın.
NOT: Herhangi bir spazm veya konvülsiyon belirtisi varsa, devam etmeden önce daha uzun süre beklemeniz önerilir. - Fareyi ameliyat masasına yerleştirin, uzuvlarını sabitleyin ve bir düzeltici kullanarak sırtının her iki yanındaki tüyleri alın (Şekil 2A).
NOT: Epilasyon etkisi ideal değilse, epilasyon için epilasyon kremi kullanılabilir. - İyota batırılmış pamuk topları kullanarak saçın çıkarıldığı alanı dezenfekte edin.
NOT: Cerrahi dezenfeksiyon işlemi, merkezden başlamayı ve tipik olarak üç kez tekrarlanan dairesel bir düzende dışa doğru hareket etmeyi içerir. - Sırtta, merkez çizgisinden yaklaşık 1.0 cm uzakta bir kesi yapın. Kesi, göğüs kafesi eğriliği ile omurga sınırı arasındaki birleşim noktasına yakın, 0,5-1 cm biraz daha aşağıda, her iki taraftaki cilt, fasya ve kası ayırarak yapın (Şekil 2B).
NOT: Arka karın duvarının daha zayıf kas tabakasından karın boşluğuna erişmek için, kesi mümkün olduğu kadar minimal tutulur. - Yumurtalığı bulmak ilk başta zor olabilir. Yumurta kanalını bularak ve onu gevşek bir yağ dokusu tabakasıyla kaplı olan yumurtalığın terminal ucuna kadar takip ederek başlayın.
NOT: Sağ yumurtalık, 4. ila 5. bel omurlarının yan tarafında, böbreğin 7-12 mm arkasında ve merkez hattından 15 mm uzakta konumlandırılır. Sol yumurtalık, 5. ila 6. bel omurlarının yan tarafında, böbreğin 3-5 mm arkasında ve merkez çizgisinden 11 mm uzakta yer alır. - Yumurtalığı ve yumurta kanalının ucunu dikkatlice vücuttan kaldırın (Şekil 2C). Hemostatik forsepsleri rahim ucu ile yumurtalık arasındaki en dar bölgeye uygulayın. Bağlamak için cerrahi bir iplik kullanın ve ardından yumurtalığı makasla tamamen çıkarın.
NOT: İşlem sırasında yumurta kanalını ve uterusu tutarken nazik olmak ve aşırı çekmekten kaçınmak çok önemlidir. Yumurtalık ameliyatından önce kullanılan bağ, yumurtalık etrafındaki yumuşak lipit dokusunun kolayca gevşemesine neden olabileceğinden sıkıca sabitlenmelidir. Bu önlem, sıçanların ölümüyle sonuçlanabilecek ameliyat sonrası kanamayı önlemek için gereklidir. Sham grubunda yumurtalığa komşu eşit hacim ve büyüklükte yağ dokusu eksize edildi, ardından kas ve cilt dikildi. - Hemostatik forsepsleri serbest bırakın ve uterusu yavaşça karın boşluğuna geri koyun.
- Enfeksiyonu önlemek için yumurtalıkların ve fallop tüplerinin bağlandığı karın yaralarına penisilin uygulayın.
NOT: Penisilini 80.000 birim / sıçan art arda 3 gün boyunca günde bir kez uygulayın. - Deri ve kas katmanlarını tek tek dikin (boyut 3-0) (Şekil 2D).
NOT: Sterilizasyon ameliyattan 24-48 saat sonra 1-2 gün arayla yapılmalıdır. - Fareyi sterilize edilmiş bir kafese geri koyun ve anesteziden tamamen bilincini geri kazanana kadar izleyin.
NOT: Hayvan anesteziden tamamen iyileşene kadar işlem sırasında ısı desteği sağlamaya devam edin. - Yara enfeksiyonunu önlemek için, her gruptaki sıçanları art arda 3 gün boyunca günde bir kez 80.000 birim / sıçan intramüsküler penisilin sodyum enjeksiyonu ile uygulayın26.
2. Kemik dokusu ve kas dokularının toplanması
NOT: Sıçanlar, modelleme ameliyatından 4, 8 ve 12 hafta sonra aşırı dozda sodyum pentobarbital (100-200 mg / kg) ile ötenazi yapıldı. Toplam 36 örnek toplandı.
- Sol baldırın triceps brachii ve quadriceps kaslarını açığa çıkarın. Bütünlüklerini korumak için bu kasları başlangıç ve bitiş noktalarında dikkatlice tanımlayın ve inceleyin. Bunu takiben, kasların ıslak ağırlık katsayılarını belirlemek için kasların ıslak ağırlıklarının ortalamasını kaydedin ve hesaplayın.
NOT: Hayvan vücut ağırlığı ve iskelet kası ıslak ağırlık katsayısı = sıçan kası ıslak ağırlığı/vücut ağırlığı. - Eklem kapsülünü uyluk kemiği boyunca yukarı doğru dilimleyerek uyluk kemiğini tamamen çıkarın. Ardından, yakındaki kas ve bağ dokusunu ortadan kaldırın.
3. Patolojik inceleme
- Kas dokularını 24 saatlik bir süre boyunca% 10 nötr tamponlu formalin çözeltisi içeren bir kaba daldırın. Bunu takiben, fiksatifi çıkarmak için kas dokularını akan su altında yoğun bir şekilde durulayın.
- Sol uyluk kemiğini 1 hafta boyunca% 4'lük bir paraformaldehit çözeltisine koyun, ardından kalsiyum birikintilerini gidermek için yeterli miktarda etilendiamintetraasetik asit (EDTA) dekalsifikasyon çözeltisine batırın ve tampon günlük olarak değiştirilmelidir.
- Çift enerjili bir X-ışını absorbsiyometrisi (DXA) kemik dansitometresi kullanarak kemik mineral yoğunluğu değerlerini ölçün. Femuru çift enerjili bir röntgene yerleştirin. Ölçüm doğruluğunu İnce olarak ayarlayın, modu Küçük Hayvana Özel Mod olarak ayarlayın ve beraberindeki BMD analiz yazılımını kullanarak sıçan uyluk kemiğinin KMY'sini analiz edin.
- Numuneyi parafin mumuna yerleştirin. Rutin histolojik inceleme için örneklerin kesitalınması 27.
4. İstatistiksel analiz
- Sürekli değişkenleri ortalama ±± standart sapma (SD) olarak sunun ve bağımsız örneklem t-testini kullanarak iki grup arasında karşılaştırma yapın. Tüm istatistiksel analizler iki taraflı bir yaklaşım izledi ve istatistiksel anlamlılık P < 0.05 olarak belirlendi. Veri analizlerini gerçekleştirmek için uygun veri analizi yazılımını kullanın.
Sonuçlar
Bu protokol, Osteosarkopeninin bir sıçan modelini oluşturmak için bilateral overektomi prosedürünün ayrıntılı bir tanımını sağlar. Şekil 3 , OVX grubundaki kuadriseps kasının ıslak ağırlık katsayısında sahte gruba kıyasla bir azalma olduğunu göstermektedir. Ameliyattan 4 hafta sonra iki grup arasında KMY'de istatistiksel olarak anlamlı bir fark olmamasına rağmen, OVX grubundaki KMY ameliyatlı gruptan ameliyattan 8 ve 12 hafta sonra anlamlı olarak daha düşüktü.
Şekil 4'te, modellemeden 12 hafta sonra sahte gruba kıyasla daha geniş bir kas lifi boşluğu ile OVX grubunda triceps brachii kasının önemli atrofisi gözlenmiştir. Şekil 5, ameliyattan 4 hafta sonra, hem OVX hem de sahte operasyon gruplarında femur başının trabeküler yoğunluğunun benzer olduğunu ve iyi bağlantıya sahip düzenli ve yoğun bir düzenleme gösterdiğini göstermektedir. Bununla birlikte, ameliyattan 8 hafta sonra, OVX grubundaki trabeküllerin sayısı azalmaya başladı ve kemik iliği boşluğu alanı artarak seyrek olarak düzenlendi. Kemik iliği boşluğundaki adiposit miktarı, sahte gruba göre daha yüksekti. Ameliyat sonrası 12 haftada, OV'deki trabeküller, eksik ara bağlantılar, kemik iliği boşluğu alanında belirgin bir genişleme ve sahte gruba kıyasla önemli ölçüde yüksek adiposit sayısı gösteren belirgin bir azalma sergiledi.

Şekil 1: Cerrahi aletler. (A) Düz iğne tutucu. (B) Düz Mayonez makası. (C) Tek kullanımlık ilaç değiştirme tepsisi. (D) Steril pamuk topu (E) Şırıngalar. (f) İyot. (G) Dikiş iğnesi. (H) Sütür hattı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
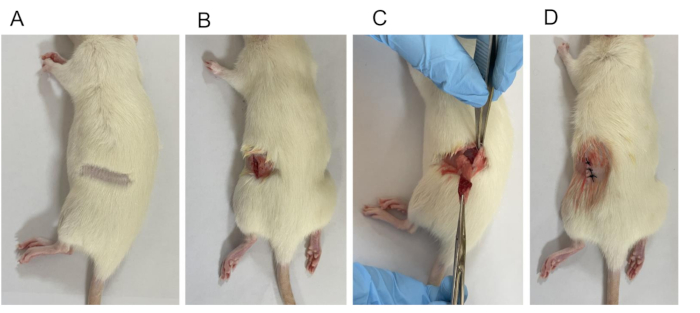
Şekil 2: OVX modelinin kurulması. (A) Epilasyon. (B) Ciltten cilt altı tabakasına 1 cm uzunluğunda cerrahi açıklık açıldı. (C) Yumurtalıkların ve fallop tüplerinin bir kısmının çıkarılmasını içeren ligasyon. (D) Kapalı yara. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
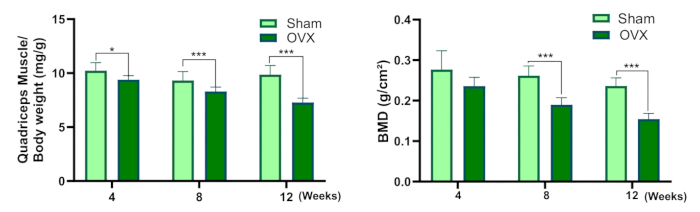
Şekil 3: Kuadriseps kas/vücut ağırlığı ve kemik mineral yoğunluğu. (A) Kuadriseps kasları ıslak ağırlık katsayısı. (B) Kemik mineral yoğunluğu (Sahte grupla karşılaştırıldığında, * P<0.05, ** P<0.01, *** P<0.001). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
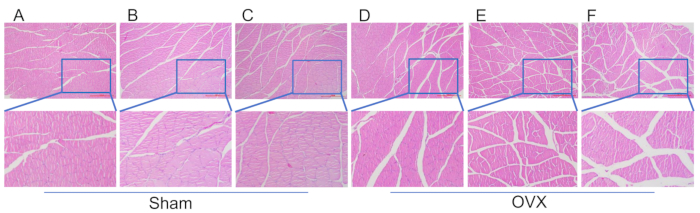
Şekil 4: Baldır triceps kasının kas liflerinden alınan doku kesitlerinin HE boyanması. (A) Sahte grupta modelleme prosedürünü takip eden 4 hafta sonra kas morfolojisi. (B) Sham grubunda modelleme prosedürünü 8 hafta takip eden kas morfolojisi. (C) Kas morfolojisi 12 sahte grupta modelleme prosedürünü takiben. (D) OVX grubunda modellemeden 4 hafta sonra kas morfolojisi. (E) OVX grubunda modellemeden 8 hafta sonra kas morfolojisi. (F) OVX grubunda modellemeden 12 hafta sonra kas morfolojisi. Ölçek çubukları: 1000 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 5: Femur başından alınan doku kesitlerinin HE boyanması. (A) Femoral morfoloji, sahte grupta modellemeyi 4 hafta takip ediyor. (B) Sahte grupta modellemeden 8 hafta sonra femoral morfoloji. (C) Sahte grupta modellemeden 12 hafta sonra femoral. (D) OVX grubunda modellemeden 4 hafta sonra femoral morfoloji. (E) OVX grubunda modellemeden 8 hafta sonra femoral morfoloji. (F) OVX grubunda modellemeden 12 hafta sonra femoral morfoloji. Ölçek çubukları: 1000 μm. (G) Kantitatif yağ alanı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Bilateral overektomize hayvan modeli, osteosarkopeninin altında yatan mekanizmaların aydınlatılmasında ve potansiyel terapötik müdahalelerin değerlendirilmesinde etkilidir. Postmenopozal kadınlarda görülen östrojen seviyelerindeki ani düşüşü yansıtan sıçanlarda ovariektomiye bağlı osteoporoz, osteoporoz araştırmaları için yaygın olarak kullanılmaktadır. Ayrıca, araştırmalar yaşlı bireylerde osteoporoz ve sarkopeni arasında önemli bir ilişki olduğunu ve aynı anda kas ve kemik kaybının sıklıkla gözlendiğini vurgulamıştır. Sonuç olarak, sarkopeniyi araştırmak için çok sayıda çalışma bu modeli kullanmıştır28,29. Sonuç olarak, bu çalışma Osteosarkopeni'nin bir hayvan modelini başarıyla ortaya koymaktadır.
Güvenilir bir model oluştururken birkaç önemli faktör dikkate alınmalıdır. Uygun bir hayvan modeli, kolaylık, uygunluk ve özgüllük ile karakterize edilmelidir30. SD sıçanlar, osteoporoz modellemesinde en sık kullanılan hayvanlardır. Yumurtalıkların çıkarılmasından sonra, sıçanların kemiklerinde meydana gelen bu dönüşüm mekanizması, insanlarda gözlenen menopoz sonrası kemik kaybı sürecine çok benzer31,32. Araştırmalar, 11 hafta ile 36 hafta arasındaki sıçanların osteoporoz veya sarkopeni modellerini 33,34,35,36 tekrarlamak için en uygun olduğunu göstermektedir. Cinsiyet açısından, kadınlar arasında osteosarkopeni prevalansı %28 ile erkeklere göre %14 ile daha yüksekti21; Bu nedenle dişi sıçanları seçtik. Sıçanlar37 yaşında yaklaşık 6 haftada cinsel olarak olgunlaşır, bu yüzden 12 haftalık sıçanları seçtik. Bir araştırma çalışması, kuadriseps kaslarının hacimlerinin yaşlı erişkinlerde genç bireylere kıyasla önemli ölçüde azaldığını buldu, bu da yaşlanmanın kuadriseps hacmi38 üzerinde daha zararlı bir etkiye sahip olduğunu düşündürdü. Osteoporozda femur kemik mineral yoğunluğu altın standartolarak 32 olarak kullanılır. Bu yüzden kuadriseps kasını ve femur kemiğini seçtik.
Cerrahi teknikte tutarlılık çok önemlidir, insizyon lokalizasyonu ve boyutunda tekdüzeliği sağlamak için aynı kişinin tüm prosedürleri gerçekleştirmesi önerilir. Tüm prosedür birkaç önemli adımdan oluşur. İlk olarak, intraperitoneal anestezik enjeksiyonu iç organların delinmesinden kaçınmalıdır. İlaç uygulamasından önce, iğnenin bir kan damarına girmediğinden emin olmak, şırınga pistonunu doğru bir şekilde itmek ve işlem boyunca stabilite ve hızı korumak için aspirat yapmak önemlidir. İkincisi, peritonu kestikten sonra yumurtalığı hızlı bir şekilde tanımlamak zor olabilir ve operatör tarafından sıçan anatomisinin kapsamlı bir şekilde anlaşılmasını gerektirir. Yumurtalık yerleştirildikten sonra, yumurta kanalının ve yumurtalığın bir kısmının bağlanması ve çıkarılması, sıçanın ameliyat sonrası hayatta kalması için hayati bir adımdır. Yumurtalık yakınındaki yumuşak yağ dokusu nedeniyle, dikiş bağlandıktan sonra kolayca gevşeyebilir, bu da ameliyat sonrası kanamaya ve potansiyel olarak ölüme neden olabilir. Son olarak, dikiş atılmadan önce, cerrahi bölgeye penisilin uygulanması önerilir ve enfeksiyona karşı önleyici bir önlem olarak ameliyattan 3 gün sonra ek kas içi uygulama yapılır.
Cerrahi prosedürlerin ve anestezi uygulamasının bir sonucu olarak, sıçanlar şiddetli ağrı ve hatta ölüm yaşayabilir ve bu da bilinçlerini geri kazanana kadar sıcak, hijyenik ve iyi havalandırılan bir ortama yerleştirilmelerini gerektirir. Ameliyat sonrası ilk hafta boyunca, çalışma boyunca sıçanların davranışsal aktivitelerine dikkat edilerek dikkatli izleme zorunludur.
Bu modelin faydaları arasında kullanıcı dostu yapısı, verimli modelleme yetenekleri, maliyet etkinliği ve osteoporoz ve kas kaybının doğal gelişimini taklit etme yeteneği yer alır. Bununla birlikte, bu modelle ilişkili, yumurtalıkların çıkarılması ameliyatı sonrası östrojen seviyelerindeki hızlı düşüş gibi bazı kısıtlamalar vardır ve östrojen sarkopeniye doğrudan bir katkıda bulunan olarak kabul edilmemektedir. Bu deney dişi sıçanlar üzerinde yapıldı ve erkek sıçanları içermedi. Bu sınırlamalara rağmen, bilateral overektomi hayvan modeli, OS'yi araştırmak ve hastalığın ilerlemesi için yolları keşfetmek için değerli bir kaynak olarak ortaya çıkmıştır.
Açıklamalar
Her yazar, rekabet eden hiçbir finansal çıkar beyan etmemektedir.
Teşekkürler
Bu çalışma (1) Ulusal Doğa Bilimleri Vakfı (82305275) tarafından sağlanan hibelerle desteklenmektedir. (2) Liaoning İl Doğa Bilimleri Vakfı programı (2022-YGJC-80 ve 2022-YGJC-79). (3) TCM Ulusal İdaresi'nin Üst Düzey Çin Tıbbı Anahtar Disiplin İnşaat Projesi (zyyzdxk-2023040).
Malzemeler
| Name | Company | Catalog Number | Comments |
| Double lion Irradiated Rodent Diet | Suzhou Shuangshi Experimental Animal Feed Technology Co., Ltd. | GB 14924.3 | Animal feed |
| Disposable medication changing tray | Yangzhou Chenglin Medical Technology Co., Ltd. | RVnpFXLc | |
| Dual Energy X-ray Bone Densitometer | Xuzhou PinyuanElectronic Technology Co., Ltd. | DXA-800E | |
| Iodine | Shanghai Likang Sterilization Hi-Tech Co., Ltd. | LK-310512 | |
| IVCs rat cage | Suzhou Monkey King Animal Experimental Equipment Technology Co., Ltd. | HH-MMB-2 | Animal barrier |
| Penicillin sodium | North China Pharmaceutical Group Limited Liability Co., Ltd. | H13020654 | |
| sodium pentobarbital | Sigma-Aldrich, St. Louis, MO | P3761-5G | |
| Sterile cotton ball | Henan Piaoan Group Co., Ltd | 20140017 | |
| Straight Mayo scissors | Shenzhen Huayang Biotechnology Co., Ltd. | 18-0410 | |
| Straight needle holder | Shanghai Simplicity Biotechnology Co., Ltd. | 32100-14 | |
| Suture line | Shenzhen Huayang Biotechnology Co., Ltd. | 18-5902 | |
| Suture needle | Shenzhen Huayang Biotechnology Co., Ltd. | 18-5036 | |
| Syringes | Shenzhen Huayang Biotechnology Co., Ltd. | 21-3021 |
Referanslar
- Binkley, N., Buehring, B. Beyond FRAX®: It's time to consider "Sarco-Osteopenia. J Clin Densitom. 12 (4), 413-416 (2009).
- Hirschfeld, H. P., Kinsella, R., Duque, G. Osteosarcopenia: where bone, muscle, and fat collide. Osteoporos Int. 28 (10), 2781-2790 (2017).
- Kaplan, S. J., et al. Association of radiologic indicators of frailty with 1-year mortality in older trauma patients. JAMA Surg. 152 (2), e164604 (2017).
- Nielsen, B. R., Abdulla, J., Andersen, H. E., Schwarz, P., Suetta, C. Sarcopenia and osteoporosis in older people: a systematic review and meta-analysis. Eur Geriatr Med. 9 (4), 419-434 (2018).
- Cruz-Jentoft, A. J., et al. Sarcopenia: European consensus on definition and diagnosis: Report of the European Working Group on sarcopenia in older people. Age Ageing. 39 (4), 412-423 (2010).
- Polito, A., Barnaba, L., Ciarapica, D., Azzini, E. Osteosarcopenia: A narrative review on clinical studies. Int J Mol Sci. 23 (10), 5591 (2022).
- Pourhassan, M., et al. Three-year mortality of older hospitalized patients with osteosarcopenia: Data from the OsteoSys study. Nutrients. 16 (9), 1328 (2024).
- Salech, F., et al. Osteosarcopenia predicts falls, fractures, and mortality in Chilean community-dwelling older adults. J Am Med Dir Assoc. 22 (4), 853-858 (2021).
- Yoo, J. I., Ha, Y. C. Review of epidemiology, diagnosis, and treatment of osteosarcopenia in Korea. J Bone Metab. 25 (1), 1-7 (2018).
- Inoue, T., et al. Related factors and clinical outcomes of osteosarcopenia: A narrative review. Nutrients. 13 (2), 291 (2021).
- Teng, Z., et al. The analysis of osteosarcopenia as a risk factor for fractures, mortality, and falls. Osteoporos Int. 32 (11), 2173-2183 (2021).
- Scheuren, A. C., et al. Hallmarks of frailty and osteosarcopenia in prematurely aged PolgA(D257A/D257A) mice. J Cachexia Sarcopenia Muscle. 11 (4), 1121-1140 (2020).
- Gasparini, S. J., et al. Continuous corticosterone delivery via the drinking water or pellet implantation: A comparative study in mice. Steroids. 116, 76-82 (2016).
- Pal, S., et al. A butanolic fraction from the standardized stem extract of Cassia occidentalis L delivered by a self-emulsifying drug delivery system protects rats from glucocorticoid-induced osteopenia and muscle atrophy. Sci Rep. 10 (1), 195 (2020).
- Mito, T., et al. Mitochondrial DNA mutations in mutator mice confer respiration defects and B-cell lymphoma development. PLoS One. 8 (2), e55789 (2013).
- Thomsen, J. S., et al. Cancellous bone structure of iliac crest biopsies following 370 days of head-down bed rest. Aviat Space Environ Med. 76 (10), 915-922 (2005).
- Papadopoulou, S. K., et al. Exercise and nutrition impact on osteoporosis and sarcopenia-The incidence of osteosarcopenia: A narrative review. Nutrients. 13 (12), 4499 (2021).
- Du, F., et al. A hind limb disuse model inducing extensor digitorum longus atrophy in rats: tail suspension-immobilization. Aviat Space Environ Med. 82 (7), 689-693 (2011).
- Gomes, R. M., et al. Strength training reverses ovariectomy-induced bone loss and improve metabolic parameters in female Wistar rats. Life Sci. 213, 134-141 (2018).
- Ma, J., et al. Establishment of a rat model of osteosarcopenia. Chin J Osteoporos. 28 (1), 1-5 (2022).
- Huang, T., et al. Prevalence and risk factors of osteosarcopenia: a systematic review and meta-analysis. BMC Geriatr. 23 (1), 369 (2023).
- Qi, H., et al. mineral density and trabecular bone score in Chinese subjects with sarcopenia. Aging Clin Exp Res. 31 (11), 1549-1556 (2019).
- Shu, H., et al. An integrated study of hormone-related sarcopenia for modeling and comparative transcriptome in rats. Front Endocrinol. 14, 1073587 (2023).
- Nakaoka, K., Yamada, A., Noda, S., Goseki-Sone, M. Influence of dietary vitamin D deficiency on bone strength, body composition, and muscle in ovariectomized rats fed a high-fat diet. Nutrition. 60, 87-93 (2019).
- Chong, L., Xiaonan, Q., Hao, Z., Xiaosheng, Y. Castration method was used to construct a rat model of kidney-yang deficiency sarcopeniaosteoporosis and explore the mechanism. Chin Arch Tradit Chin Med. , (2024).
- Ma, X., et al. (S)-10-hydroxycamptothecin inhibits EMT-evoked osteosarcoma cell growth and metastasis by activating the HIPPO signaling pathway. Combin Chem High Throughput Screen. 27 (15), 2239-2248 (2024).
- Yamazaki, I., Yamaguchi, H. Characteristics of an ovariectomized osteopenic rat model. J Bone Miner Res. 4 (4), 13-22 (1989).
- Lee, H., et al. MiR-141-3p promotes mitochondrial dysfunction in ovariectomy-induced sarcopenia via targeting Fkbp5 and Fibin. Aging (Albany NY). 13 (4), 4881-4894 (2021).
- China, S. P., et al. Globular adiponectin reverses osteo-sarcopenia and altered body composition in ovariectomized rats. Bone. 105, 75-86 (2017).
- Rodgers, J. B., Monier-Faugere, M. C., Malluche, H. Animal models for the study of bone loss after cessation of ovarian function. Bone. 14 (3), 369-377 (1993).
- Matsushita, M., et al. Age-related changes in bone mass in the senescence-accelerated mouse (SAM). SAM-R/3 and SAM-P/6 as new murine models for senile osteoporosis. Am J Pathol. 125 (2), 276-283 (1986).
- Cheng, M., et al. A traditional Chinese herbal preparation, Er-Zhi-Wan, prevent ovariectomy-induced osteoporosis in rats. J Ethnopharmacol. 138 (2), 279-285 (2011).
- Roch, P. J., et al. Ostarine and ligandrol improve muscle tissue in an ovariectomized rat model. Front Endocrinol. 11, 556581 (2020).
- Bei, M. J., et al. Raloxifene retards cartilage degradation and improves subchondral bone microarchitecture in ovariectomized rats with patella baja-induced - patellofemoral joint osteoarthritis. Osteoarthritis Cartilage. 28 (3), 344-355 (2020).
- Wen, K., et al. Fecal and serum metabolomic signatures and microbial community profiling of postmenopausal osteoporosis mice model. Front Cell Infect Microbiol. 10, 535310 (2020).
- Shah, F. A., Stoica, A., Cardemil, C., Palmquist, A. Multiscale characterization of cortical bone composition, microstructure, and nanomechanical properties in experimentally induced osteoporosis. J Biomed Mater Res A. 106 (4), 997-1007 (2018).
- Andreollo, N. A., Santos, E. F., Araújo, M. R., Lopes, L. R. Rat's age versus human's age: what is the relationship. Arq Bras Cir Dig. 25 (1), 49-51 (2012).
- Fuchs, C. J., et al. Thigh muscles are more susceptible to age-related muscle loss when compared to lower leg and pelvic muscles. Exp Gerontol. 175, 112159 (2023).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır