Method Article
Die Erstellung eines Rattenmodells für Osteosarkopenie mittels Ovariektomie
In diesem Artikel
Zusammenfassung
Dieses aktuelle Protokoll beschreibt ein Verfahren zur Erstellung eines Rattenmodells für Osteosarkopenie mittels Ovariektomie.
Zusammenfassung
Die Osteosarkopenie (OS), eine komplexe degenerative Erkrankung, ist durch den gleichzeitigen Rückgang der Skelettmuskelmasse und der Knochenmineraldichte (BMD) gekennzeichnet und stellt eine enorme Gesundheitsgefahr für die ältere Bevölkerung dar. Trotz seiner klinischen Relevanz sind die pathophysiologischen Mechanismen, die dem OS zugrunde liegen, nicht vollständig verstanden, was die Notwendigkeit eines tieferen Verständnisses seiner Ätiologie unterstreicht, um effektive Behandlungsstrategien zu ermöglichen. Die Entwicklung eines zuverlässigen Tiermodells ist dabei von zentraler Bedeutung. Diese Studie stellt ein verfeinertes Protokoll für die Induktion von postmenopausaler Osteosarkopenie bei Ratten durch bilaterale Ovariektomie vor, eine Methode, von der bekannt ist, dass sie das Auftreten von altersbedingtem Muskel- und Knochenverlust beschleunigt. In dieser Studie wurden Ratten im Alter von 12 Wochen nach Körpergewicht stratifiziert und nach dem Zufallsprinzip entweder einer Scheinoperationsgruppe oder einer ovariektomierten (OVX) Gruppe zugeteilt. Gewebeproben aus den Quadrizeps- und Trizepsmuskeln der linken Hintergliedmaße sowie des linken Oberschenkelknochens wurden 4, 8 und 12 Wochen nach der Operation systematisch entnommen. Dieser methodische Ansatz gewährleistet eine umfassende Bewertung der Auswirkungen der Ovariektomie auf die Muskel- und Knochengesundheit. Die histologische Beurteilung der Muskelfaseratrophie und der Femurmorphologie erfolgte mittels Hämatoxylin- und Eosin (HE)-Färbung, während die Knochenmineraldichte mittels Dual-Energie-Röntgenabsorptiometrie (DXA) quantifiziert wurde. Der zeitliche Verlauf des OS wurde in den oben genannten Intervallen akribisch überwacht und gab Einblicke in das dynamische Zusammenspiel zwischen Muskel- und Knochendegeneration. Dieses Modell spiegelt nicht nur die klinischen Manifestationen des OS genau wider, sondern dient auch als robuste Plattform für die Untersuchung neuartiger Therapieansätze und der ihnen zugrunde liegenden Mechanismen.
Einleitung
Osteosarkopenie ist eine vielschichtige degenerative Erkrankung, die die klinischen Manifestationen sowohl der Osteoporose als auch der Sarkopenie umfasst 1,2,3,4. Osteoporose, eine weit verbreitete Skeletterkrankung, ist gekennzeichnet durch eine verminderte Knochenmasse, eine beeinträchtigte Mikroarchitektur und eine erhöhte Anfälligkeit für Frakturen. Sarkopenie, oft auch als Muskelschwundsyndrom bezeichnet, ist gekennzeichnet durch eine Verringerung der Muskelkraft und -masse 5,6. Maryams7 Ergebnisse zeigten, dass Osteosarkopenie das Sterberisiko bei Sarkopenie allein um 30 % und bei niedriger BMD allein um 8 % erhöhte. Untersuchungen haben gezeigt, dass 16,4 % der in einer Gemeinschaft lebenden Personen ab 60 Jahren von Osteosarkopenie betroffen sind8. In Südkorea wird die Inzidenz von Osteosarkopenie bei älteren Menschen ab 60 Jahren, die Hüftfrakturen erlitten haben, mit 27,2 % angegeben9. Personen mit OS sind einem höheren Risiko für Stürze, Frakturen, Krankenhausaufenthalte und Institutionalisierungen ausgesetzt, was das Gesundheitssystem und die Gesellschaft belastet10,11. Angesichts der Schwere dieser Folgen ist es von entscheidender Bedeutung, effiziente Maßnahmen zur Prävention und Behandlung von OS zu entwickeln und umzusetzen. Trotz der Dringlichkeit ist die Forschung auf diesem Gebiet noch im Entstehen, und es gibt anhaltende Debatten über diagnostische Kriterien und die Wirksamkeit verschiedener Behandlungsmethoden. Die Entwicklung zuverlässiger Tiermodelle ist daher unerlässlich, um die Pathogenese des OS zu entschlüsseln und die molekularen Grundlagen aufzudecken, die zu wirksameren Behandlungsansätzen führen könnten.
Zu den derzeit häufig verwendeten Modellen für präklinische Studien zur Osteosarkopenie gehört das Alterungsmodell, das den menschlichen Alterungsprozess ohne medikamentöse Eingriffe simuliert. Dieser Ansatz ist näher am natürlichen Prozess und kostengünstig; Sie erfordert jedoch einen erheblichen Zeitaufwand für die Reifung12. Die Methode der Injektion chemischer Medikamente bietet bestimmte Vorteile, wie z. B. einen kurzen Modellierungszyklus, stabile Ergebnisse und niedrige Kosten. Sie bringt jedoch auch Herausforderungen mit sich, darunter die genaue Bestimmung der Hormondosis, die für die Injektion erforderliche technische Fertigkeit und die variablen Wirkungen hormoneller Interventionen13,14. Gentechnische Modelle können gentechnisch veränderte Organismen beinhalten, die sowohl genetisch defekt als auch kostspielig sein können. Obwohl diese Modelle sehr spezifisch sind, sind sie deutlich komplexer und teurer in der Herstellung15. Nichtgebrauchsmodelle simulieren die Auswirkungen längerer Bettruhe auf klinische Patienten16. Nichtgebrauchsmodelle sind effektiv und kosteneffizient, um Muskelabbau zu bekämpfen, sind aber mit Komplikationen wie Blutgerinnseln und Druckgeschwüren verbunden. Diese Modelle werden routinemäßig überwacht, um Gliedmaßennekrosen17,18 und Modelle mit Hormonmangel zu verhindern; In der wissenschaftlichen Gemeinschaft herrscht Einigkeit darüber, dass die bilaterale Ovariektomie eine wirksame Methode zur Etablierung eines Tiermodells für Osteoporose darstellt19,20.
Die Forschung deutet darauf hin, dass Knochen- und Muskelgewebe auch durch autokrine, endokrine und parakrine Mechanismen miteinander interagieren können21. Die Ansammlung von Fettgewebe in Muskeln und Knochenmark dient als Indikator für eine verminderte Knochen- und Muskelmasse im Rahmen der Osteosarkopenie2. Sarkopenie bei älteren Erwachsenen ist direkt mit einer Verringerung der Knochendichte und der Verschlechterung der Knochenmikroarchitektur verbunden. Darüber hinaus stellt eine verminderte Muskelmasse einen unabhängigen Risikofaktor für den Abbau der Knochenmikrostrukturdar 22. Diese Methodik wurde als praktikable Strategie für die Modellierung der Sarkopenie anerkannt 23,24, die möglicherweise als kombiniertes Modell für beide Zustände dienen könnte25. Trotz des begrenzten Forschungsergebnisses über die Anwendung der Ovariektomie als Mittel zur Induktion von Osteosarkopenie zeigt dieser Ansatz eine potenzielle Wirksamkeit. Zu den Vorteilen des Einsatzes der Ovariektomie in präklinischen Studien gehören ein schneller Modellierungsprozess, der Wegfall pharmakologischer Eingriffe, die Erstellung eines stabilen experimentellen Modells, eine einfache Implementierung und Kosteneffizienz.
Die vorliegende Studie zielt darauf ab, das Verfahren zur Erstellung eines präklinischen Modells bei weiblichen Ratten durch die Entfernung eines Segments sowohl der Eileiter als auch der Eierstöcke bei nicht schwangeren Personen zu beschreiben. Dieser Ansatz dient als wertvolles Instrument, um die molekularen Grundlagen des OS zu untersuchen und den therapeutischen Nutzen von Interventionen in einem kontrollierten experimentellen Setting zu bewerten.
Protokoll
Weibliche Sprague-Dawley-Ratten (n = 36) im Alter von 12 Wochen und mit einem Gewicht von etwa 200-240 g wurden einzeln in beatmeten Käfigen in einem spezifisch pathogenfreien (SPF) Tierraum mit einem 12-stündigen Hell-Dunkel-Zyklus untergebracht. Sie hatten freien Zugang zu SPF-Futter und sterilem Wasser. Die Ratten durften sich vor den Experimenten eine Woche lang an die Umwelt gewöhnen. Mittels Zufallszuteilung wurden die Ratten 4, 8 und 12 Wochen nach der Operation in ovariektomierte (OVX) Gruppen (jeweils mit 6 Ratten) und Scheingruppen (mit je 6 Ratten) eingeteilt. Alle tierischen Eingriffe wurden nach den genehmigten Richtlinien des Tierschutzkomitees der Liaoning Universität für Traditionelle Chinesische Medizin (Nr. 21000042021040) durchgeführt.
1. Ovariektomie bei Ratten
HINWEIS: Das in diesem Protokoll verwendete chirurgische Gerät ist in Abbildung 1 zu sehen.
- Halten Sie die Ratten im SPF-Tierraum und befolgen Sie alle notwendigen Verfahren mit sterilisierten Geräten in einer sterilen Umgebung.
- Mischen Sie Natrium-Pentobarbital, ein weißes Pulver, mit destilliertem Wasser oder einer 0,9%igen normalen Kochsalzlösung, um eine Anästhesielösung herzustellen. Die Standarddosis beträgt 30 mg/kg; Füllen Sie die Spritze entsprechend.
HINWEIS: Es ist wichtig zu beachten, dass die Lösung instabil ist und sofort verwendet werden sollte. Bereiten Sie die erforderliche Menge für jeweils ein Experiment vor. - Hebe den Hinterleib der Ratte über ihren Kopf, um die Eingeweide in den Oberbauch zu verlagern. Positionieren Sie mit der dominanten Hand eine Spritze 1-1,5 cm von der linken (oder rechten) Seite der Mittellinie des Bauches entfernt und führen Sie sie in einem Winkel von 45° in den Körper der Ratte ein. Nachdem die Arzneimittellösung verabreicht wurde, drehen Sie die Nadel und ziehen Sie sie dann zurück.
- Überwachen Sie nach der Verabreichung der Narkose sorgfältig die Atmung der Ratte und kneifen Sie ihre Zehen zusammen, um zu bestätigen, dass sie vollständig betäubt ist.
HINWEIS: Wenn es Anzeichen von Krämpfen oder Krämpfen gibt, ist es ratsam, länger zu warten, bevor Sie fortfahren. - Positionieren Sie die Ratte auf dem Operationstisch, sichern Sie ihre Gliedmaßen und entfernen Sie die Haare auf beiden Seiten ihres Rückens mit einem Trimmer (Abbildung 2A).
HINWEIS: Wenn der Haarentfernungseffekt nicht ideal ist, kann Haarentfernungscreme zur Haarentfernung verwendet werden. - Desinfizieren Sie den Bereich, an dem die Haare entfernt wurden, mit Wattebällchen, die in Jod getränkt sind.
HINWEIS: Der Prozess der chirurgischen Desinfektion besteht darin, von der Mitte aus zu beginnen und sich in einem kreisförmigen Muster nach außen zu bewegen, das in der Regel dreimal wiederholt wird. - Machen Sie einen Schnitt auf dem Rücken, etwa 1,0 cm von der Mittellinie entfernt. Machen Sie den Schnitt nahe der Verbindungsstelle zwischen der Krümmung des Brustkorbs und dem Rand der Wirbelsäule, etwas tiefer um 0,5-1 cm, indem Sie Haut, Faszie und Muskeln auf beiden Seiten trennen (Abbildung 2B).
HINWEIS: Für den Zugang in die Bauchhöhle durch die schwächere Muskelschicht der hinteren Bauchdecke wird der Schnitt so gering wie möglich gehalten. - Den Eierstock zu finden, kann anfangs eine Herausforderung sein. Beginnen Sie damit, den Eileiter zu lokalisieren und ihn bis zum Ende des Eierstocks zu verfolgen, der von einer Schicht aus losem Fettgewebe umhüllt ist.
HINWEIS: Der rechte Eierstock befindet sich an der Seite des 4. bis 5. Lendenwirbels, 7-12 mm hinter der Niere und 15 mm von der Mittellinie entfernt. Der linke Eierstock befindet sich seitlich des 5. bis 6. Lendenwirbels, 3-5 mm hinter der Niere und 11 mm von der Mittellinie entfernt. - Heben Sie den Eierstock und das Ende des Eileiters vorsichtig aus dem Körper (Abbildung 2C). Legen Sie die hämostatische Pinzette an der engsten Stelle zwischen dem Gebärmutterende und dem Eierstock an. Binden Sie ihn mit einem chirurgischen Faden ab und schneiden Sie dann den Eierstock mit einer Schere vollständig heraus.
HINWEIS: Es ist wichtig, während des Eingriffs vorsichtig mit dem Eileiter und der Gebärmutter umzugehen und übermäßiges Ziehen zu vermeiden. Die Ligatur, die vor der Ovariektomie verwendet wird, muss fest befestigt sein, da das weiche Lipidgewebe um den Eierstock herum leicht dazu führen kann, dass sie sich löst. Diese Vorsichtsmaßnahme ist notwendig, um postoperative Blutungen zu verhindern, die zum Tod der Ratten führen könnten. In der Scheingruppe wurde Fettgewebe gleichen Volumens und gleicher Größe in der Nähe des Eierstocks exzidiert, gefolgt von der Naht des Muskels und der Haut. - Lösen Sie die hämostatische Pinzette und führen Sie die Gebärmutter sanft in die Bauchhöhle zurück.
- Verabreichen Sie Penicillin auf die Bauchwunden, an denen die Eierstöcke und Eileiter ligaturiert sind, um Infektionen zu vermeiden.
HINWEIS: Verabreichen Sie 80.000 Einheiten/Ratte Penicillin einmal täglich an 3 aufeinanderfolgenden Tagen. - Vernähen Sie die Haut- und Muskelschichten einzeln (Größe 3-0) (Abbildung 2D).
HINWEIS: Die Sterilisation sollte 24-48 Stunden nach der Operation im Abstand von 1-2 Tagen durchgeführt werden. - Setzen Sie die Ratte wieder in einen desinfizierten Käfig und überwachen Sie sie, bis sie nach der Narkose wieder vollständig zu Bewusstsein kommt.
HINWEIS: Setzen Sie die Wärmeunterstützung während des Eingriffs fort, bis sich das Tier vollständig von der Narkose erholt hat. - Um eine Wundinfektion zu vermeiden, verabreichen Sie den Ratten in jeder Gruppe an 3 aufeinanderfolgenden Tagen einmal täglich eine intramuskuläre Injektion von Penicillin-Natrium 80.000 Einheiten/Ratte26.
2. Entnahme von Knochengewebe und Muskelgewebe
HINWEIS: Ratten wurden mit einer Überdosis Natrium-Pentobarbital (100-200 mg/kg) 4, 8 und 12 Wochen nach der Modellierungsoperation euthanasiert. Insgesamt wurden 36 Proben entnommen.
- Legen Sie den Trizeps brachii und die Quadrizepsmuskulatur der linken Wade frei. Identifizieren und präparieren Sie diese Muskeln sorgfältig an ihren Ursprungs- und Endpunkten, um ihre Integrität zu erhalten. Erfassen und berechnen Sie anschließend den Durchschnitt der Nassgewichte der Muskeln, um die Nassgewichtskoeffizienten der Muskeln zu bestimmen.
HINWEIS: Körpergewicht des Tieres und Nassgewichtskoeffizient der Skelettmuskulatur = Nassgewicht der Rattenmuskulatur/Körpergewicht. - Löse den Femur vollständig, indem du die Gelenkkapsel entlang des Femurs nach oben schneidest. Beseitigen Sie dann das nahe gelegene Muskel- und Bändergewebe.
3. Pathologische Untersuchung
- Tauchen Sie das Muskelgewebe für eine Dauer von 24 Stunden in ein Gefäß mit einer 10%igen neutralen gepufferten Formalinlösung. Spülen Sie anschließend das Muskelgewebe ausgiebig unter fließendem Wasser ab, um das Fixiermittel zu entfernen.
- Legen Sie den linken Oberschenkelknochen 1 Woche lang in eine 4%ige Paraformaldehydlösung und weichen Sie ihn dann in einer ausreichenden Menge Ethylendiamintetraessigsäure (EDTA) Entkalkungslösung ein, um Kalziumablagerungen zu entfernen, wobei der Puffer täglich gewechselt wird.
- Messen Sie die Knochenmineraldichtewerte mit einem Dual-Energie-Röntgen-Absorptiometrie (DXA) Knochendichtemessgerät. Platzieren Sie den Oberschenkelknochen in einer Röntgenaufnahme mit zwei Energien. Stellen Sie die Messgenauigkeit auf Fein ein, stellen Sie den Modus auf den kleintierspezifischen Modus ein und analysieren Sie die BMD von Rattenfemuren mit der mitgelieferten BMD-Analysesoftware.
- Legen Sie die Probe in Paraffinwachs. Schnitte der Proben für die histologische Routineuntersuchung27.
4. Statistische Auswertung
- Stellen Sie die kontinuierlichen Variablen als Mittelwert ±± Standardabweichung (SD) dar und vergleichen Sie die beiden Gruppen mit dem unabhängigen Stichproben-t-Test. Alle statistischen Analysen folgten einem zweiseitigen Ansatz, wobei die statistische Signifikanz auf P < 0,05 festgelegt wurde. Verwenden Sie eine geeignete Datenanalysesoftware, um Datenanalysen durchzuführen.
Ergebnisse
Dieses Protokoll enthält eine detaillierte Beschreibung des bilateralen Ovariektomieverfahrens zur Etablierung eines Rattenmodells für Osteosarkopenie. Abbildung 3 zeigt eine Abnahme des Nassgewichtskoeffizienten des Quadrizepsmuskels in der OVX-Gruppe im Vergleich zur Scheingruppe. Obwohl es 4 Wochen nach der Operation keine statistisch signifikante Varianz in der BMD zwischen den beiden Gruppen gab, war die BMD in der OVX-Gruppe 8 und 12 Wochen nach der Operation signifikant niedriger als in der scheinoperierten Gruppe.
In Abbildung 4 wird in der OVX-Gruppe eine signifikante Atrophie des Musculus triceps brachii beobachtet, mit einer größeren Muskelfaserlücke im Vergleich zur Scheingruppe 12 Wochen nach der Modellierung. Abbildung 5 zeigt, dass 4 Wochen nach der Operation die trabekuläre Dichte des Femurkopfes sowohl in der OVX- als auch in der Scheinoperationsgruppe ähnlich war, was eine regelmäßige und dichte Anordnung mit guter Konnektivität zeigt. 8 Wochen nach der Operation begann die Anzahl der Trabekel in der OVX-Gruppe jedoch abzunehmen und wurde spärlich angeordnet mit einer vergrößerten Knochenmarkhöhlenfläche. Die Menge an Adipozyten in der Knochenmarkhöhle war höher als in der Scheingruppe. In der 12. Woche postoperativ zeigten die Trabekel in der OVX eine deutliche Reduktion mit unvollständigen Verbindungen, einer deutlichen Ausdehnung im Bereich der Knochenmarkhöhle und einer signifikant erhöhten Adipozytenzahl im Vergleich zur Scheingruppe.

Abbildung 1: Chirurgische Instrumente. (A) Gerader Nadelhalter. (B) Gerade Mayo-Schere. (C) Einweg-Wickeltablett für Medikamente. (D) Sterile Wattebausch-Spritzen (E). (F) Jod. (G) Nahtnadel. (H) Nahtlinie. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
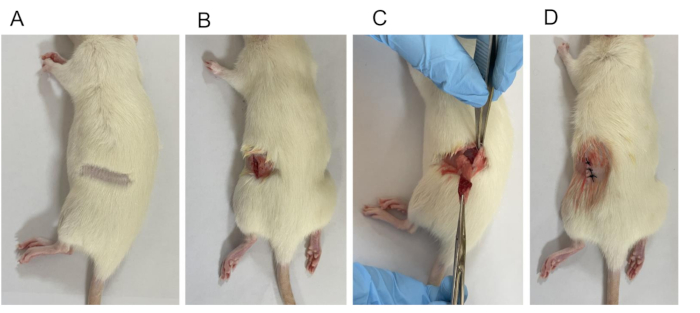
Abbildung 2: Etablierung des OVX-Modells. (A) Haarentfernung. (B) Es wurde eine 1 cm lange chirurgische Öffnung von der Haut zur Unterhautschicht hergestellt. (C) Ligatur, bei der die Eierstöcke und ein Teil der Eileiter entfernt werden. (D) Geschlossene Wunde. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
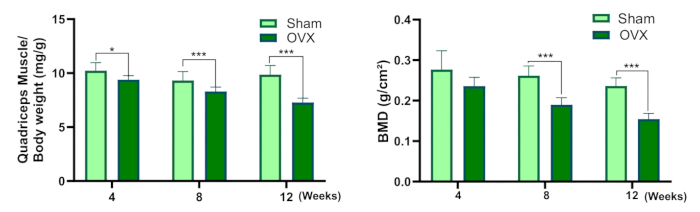
Abbildung 3: Quadrizeps Muskel-/Körpergewicht und Knochenmineraldichte. (A) Nassgewichtskoeffizient der Quadrizepsmuskulatur. (B) Knochenmineraldichte (Im Vergleich zur Scheingruppe, * P<0,05, ** P<0,01, *** P<0,001). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
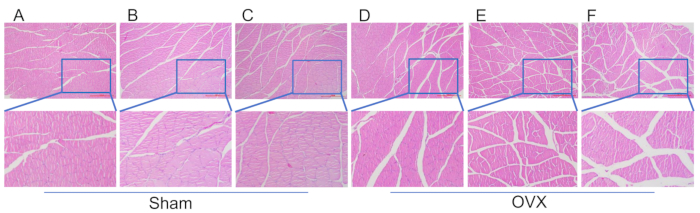
Abbildung 4: HE-Färbung von Gewebeschnitten aus den Muskelfasern des Trizepsmuskels in der Wade. (A) Muskelmorphologie 4 Wochen nach dem Modellierungsverfahren in der Scheingruppe. (B) Muskelmorphologie 8 Wochen nach dem Modellierungsverfahren in der Scheingruppe. (C) Muskelmorphologie 12 nach dem Modellierungsverfahren in der Scheingruppe. (D) Muskelmorphologie 4 Wochen nach der Modellierung in der OVX-Gruppe. (E) Muskelmorphologie 8 Wochen nach der Modellierung in der OVX-Gruppe. (F) Muskelmorphologie 12 Wochen nach der Modellierung in der OVX-Gruppe. Maßstabsbalken: 1000 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5: HE-Färbung von Gewebeschnitten aus dem Hüftkopf. (A) Femurmorphologie 4 Wochen nach der Modellierung in der Scheingruppe. (B) Femurmorphologie 8 Wochen nach der Modellierung in der Scheingruppe. (C) Femur 12 Wochen nach der Modellierung in der Scheingruppe. (D) Femurmorphologie 4 Wochen nach der Modellierung in der OVX-Gruppe. (E) Femurmorphologie 8 Wochen nach der Modellierung in der OVX-Gruppe. (F) Femurmorphologie 12 Wochen nach der Modellierung in der OVX-Gruppe. Maßstabsbalken: 1000 μm. (G) Quantifizierte Adipositasfläche. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Das bilaterale ovariektomierte Tiermodell ist entscheidend für die Aufklärung der Mechanismen, die der Osteosarkopenie zugrunde liegen, und die Bewertung möglicher therapeutischer Interventionen. Ovariektomie-induzierte Osteoporose bei Ratten, die den abrupten Abfall des Östrogenspiegels bei postmenopausalen Frauen widerspiegelt, wird häufig als Modell für die Osteoporoseforschung verwendet. Darüber hinaus hat die Forschung einen signifikanten Zusammenhang zwischen Osteoporose und Sarkopenie bei älteren Menschen aufgezeigt, wobei häufig gleichzeitiger Muskel- und Knochenverlust beobachtet wird. Folglich wurde dieses Modell in zahlreichen Studien zur Untersuchung der Sarkopenie verwendet28,29. Als Ergebnis ist es in der vorliegenden Studie gelungen, ein Tiermodell für Osteosarkopenie zu etablieren.
Bei der Erstellung eines zuverlässigen Modells müssen mehrere wichtige Faktoren berücksichtigt werden. Ein geeignetes Tiermodell muss sich durch Bequemlichkeit, Relevanz und Spezifität auszeichnen30. SD-Ratten sind die am häufigsten verwendeten Tiere bei der Osteoporose-Modellierung. Nach der Entfernung der Eierstöcke ähnelt dieser Umwandlungsmechanismus in den Knochen von Ratten stark dem Prozess des postmenopausalen Knochenverlusts, der beim Menschen beobachtet wurde31,32. Untersuchungen zeigen, dass Ratten im Alter zwischen 11 Wochen und 36 Wochen optimal für die Replikation der Osteoporose- oder Sarkopenie-Modellesind 33,34,35,36. In Bezug auf das Geschlecht war die Prävalenz von Osteosarkopenie bei Frauen mit 28 % höher als bei Männern mit 14 %21; Daher wählten wir weibliche Ratten aus. Ratten werden im Alter von etwa 6 Wochen im Alter von37 Jahren geschlechtsreif, daher wählten wir 12 Wochen alte Ratten aus. Eine Forschungsstudie ergab, dass das Volumen der Quadrizepsmuskulatur bei älteren Erwachsenen im Vergleich zu jüngeren Personen signifikant reduziert war, was darauf hindeutet, dass das Altern einen nachteiligeren Einfluss auf das Quadrizepsvolumen hat38. Bei Osteoporose wird die Mineraldichte des Oberschenkelknochens als Goldstandardverwendet 32. Also wählten wir den Quadrizepsmuskel und den Oberschenkelknochen aus.
Die Konsistenz der Operationstechnik ist von entscheidender Bedeutung, wobei empfohlen wird, dass dieselbe Person alle Eingriffe durchführt, um eine Einheitlichkeit der Inzisionslokalisation und -größe zu gewährleisten. Das gesamte Verfahren besteht aus mehreren entscheidenden Schritten. Erstens sollte die intraperitoneale Injektion eines Anästhetikums eine Punktion der inneren Organe vermeiden. Vor der Verabreichung des Arzneimittels ist es wichtig, zu aspirieren, um sicherzustellen, dass die Nadel nicht in ein Blutgefäß eingedrungen ist, um den Spritzenkolben genau zu drücken und um Stabilität und Geschwindigkeit während des gesamten Prozesses aufrechtzuerhalten. Zweitens kann die schnelle Identifizierung des Eierstocks nach dem Durchtrennen des Peritoneums eine Herausforderung darstellen und erfordert ein umfassendes Verständnis der Rattenanatomie durch den Bediener. Sobald der Eierstock lokalisiert ist, ist das Liligieren und Entfernen eines Teils des Eileiters und des Eierstocks ein wichtiger Schritt für das postoperative Überleben der Ratte. Aufgrund des weichen Fettgewebes in der Nähe des Eierstocks kann sich die Naht nach dem Binden leicht lösen, was zu Blutungen und möglicherweise zum Tod nach der Operation führt. Schließlich wird vor dem Nähen die Anwendung von Penicillin auf die Operationsstelle empfohlen, mit zusätzlicher intramuskulärer Verabreichung 3 Tage nach der Operation als vorbeugende Maßnahme gegen Infektionen.
Infolge chirurgischer Eingriffe und der Verabreichung von Anästhesie können Ratten starke Schmerzen oder sogar den Tod erleiden, so dass sie in einer warmen, hygienischen und gut belüfteten Umgebung untergebracht werden müssen, bis sie das Bewusstsein wiedererlangen. In der ersten postoperativen Woche ist eine aufmerksame Überwachung unerlässlich, wobei während der gesamten Studie auf die Verhaltensaktivität der Ratten geachtet werden muss.
Zu den Vorteilen dieses Modells gehören seine Benutzerfreundlichkeit, seine effizienten Modellierungsmöglichkeiten, seine Kosteneffizienz und die Fähigkeit, die natürliche Entwicklung von Osteoporose und Muskelschwund nachzuahmen. Nichtsdestotrotz gibt es bestimmte Einschränkungen, die mit diesem Modell verbunden sind, wie z. B. der rasche Rückgang des Östrogenspiegels nach einer Operation zur Entfernung der Eierstöcke, wobei Östrogen nicht als direkter Faktor für Sarkopenie anerkannt wird. Das vorliegende Experiment wurde an weiblichen Ratten durchgeführt und umfasste keine männlichen Ratten. Trotz dieser Einschränkungen hat sich das bilaterale Ovariektomie-Tiermodell als wertvolle Ressource für die Erforschung des OS und die Erforschung von Wegen zur Krankheitsfortentwicklung erwiesen.
Offenlegungen
Jeder Autor erklärt, dass keine konkurrierenden finanziellen Interessen bestehen.
Danksagungen
Diese Arbeit wird durch Zuschüsse von (1) der National Nature Science Foundation (82305275) unterstützt. (2) Programm der Naturwissenschaftlichen Stiftung der Provinz Liaoning (2022-YGJC-80 und 2022-YGJC-79). (3) Aufbauprojekt für die Schlüsseldisziplin der Chinesischen Medizin auf hohem Niveau der Nationalen Verwaltung der TCM (zyyzdxk-2023040).
Materialien
| Name | Company | Catalog Number | Comments |
| Double lion Irradiated Rodent Diet | Suzhou Shuangshi Experimental Animal Feed Technology Co., Ltd. | GB 14924.3 | Animal feed |
| Disposable medication changing tray | Yangzhou Chenglin Medical Technology Co., Ltd. | RVnpFXLc | |
| Dual Energy X-ray Bone Densitometer | Xuzhou PinyuanElectronic Technology Co., Ltd. | DXA-800E | |
| Iodine | Shanghai Likang Sterilization Hi-Tech Co., Ltd. | LK-310512 | |
| IVCs rat cage | Suzhou Monkey King Animal Experimental Equipment Technology Co., Ltd. | HH-MMB-2 | Animal barrier |
| Penicillin sodium | North China Pharmaceutical Group Limited Liability Co., Ltd. | H13020654 | |
| sodium pentobarbital | Sigma-Aldrich, St. Louis, MO | P3761-5G | |
| Sterile cotton ball | Henan Piaoan Group Co., Ltd | 20140017 | |
| Straight Mayo scissors | Shenzhen Huayang Biotechnology Co., Ltd. | 18-0410 | |
| Straight needle holder | Shanghai Simplicity Biotechnology Co., Ltd. | 32100-14 | |
| Suture line | Shenzhen Huayang Biotechnology Co., Ltd. | 18-5902 | |
| Suture needle | Shenzhen Huayang Biotechnology Co., Ltd. | 18-5036 | |
| Syringes | Shenzhen Huayang Biotechnology Co., Ltd. | 21-3021 |
Referenzen
- Binkley, N., Buehring, B. Beyond FRAX®: It's time to consider "Sarco-Osteopenia. J Clin Densitom. 12 (4), 413-416 (2009).
- Hirschfeld, H. P., Kinsella, R., Duque, G. Osteosarcopenia: where bone, muscle, and fat collide. Osteoporos Int. 28 (10), 2781-2790 (2017).
- Kaplan, S. J., et al. Association of radiologic indicators of frailty with 1-year mortality in older trauma patients. JAMA Surg. 152 (2), e164604 (2017).
- Nielsen, B. R., Abdulla, J., Andersen, H. E., Schwarz, P., Suetta, C. Sarcopenia and osteoporosis in older people: a systematic review and meta-analysis. Eur Geriatr Med. 9 (4), 419-434 (2018).
- Cruz-Jentoft, A. J., et al. Sarcopenia: European consensus on definition and diagnosis: Report of the European Working Group on sarcopenia in older people. Age Ageing. 39 (4), 412-423 (2010).
- Polito, A., Barnaba, L., Ciarapica, D., Azzini, E. Osteosarcopenia: A narrative review on clinical studies. Int J Mol Sci. 23 (10), 5591 (2022).
- Pourhassan, M., et al. Three-year mortality of older hospitalized patients with osteosarcopenia: Data from the OsteoSys study. Nutrients. 16 (9), 1328 (2024).
- Salech, F., et al. Osteosarcopenia predicts falls, fractures, and mortality in Chilean community-dwelling older adults. J Am Med Dir Assoc. 22 (4), 853-858 (2021).
- Yoo, J. I., Ha, Y. C. Review of epidemiology, diagnosis, and treatment of osteosarcopenia in Korea. J Bone Metab. 25 (1), 1-7 (2018).
- Inoue, T., et al. Related factors and clinical outcomes of osteosarcopenia: A narrative review. Nutrients. 13 (2), 291 (2021).
- Teng, Z., et al. The analysis of osteosarcopenia as a risk factor for fractures, mortality, and falls. Osteoporos Int. 32 (11), 2173-2183 (2021).
- Scheuren, A. C., et al. Hallmarks of frailty and osteosarcopenia in prematurely aged PolgA(D257A/D257A) mice. J Cachexia Sarcopenia Muscle. 11 (4), 1121-1140 (2020).
- Gasparini, S. J., et al. Continuous corticosterone delivery via the drinking water or pellet implantation: A comparative study in mice. Steroids. 116, 76-82 (2016).
- Pal, S., et al. A butanolic fraction from the standardized stem extract of Cassia occidentalis L delivered by a self-emulsifying drug delivery system protects rats from glucocorticoid-induced osteopenia and muscle atrophy. Sci Rep. 10 (1), 195 (2020).
- Mito, T., et al. Mitochondrial DNA mutations in mutator mice confer respiration defects and B-cell lymphoma development. PLoS One. 8 (2), e55789 (2013).
- Thomsen, J. S., et al. Cancellous bone structure of iliac crest biopsies following 370 days of head-down bed rest. Aviat Space Environ Med. 76 (10), 915-922 (2005).
- Papadopoulou, S. K., et al. Exercise and nutrition impact on osteoporosis and sarcopenia-The incidence of osteosarcopenia: A narrative review. Nutrients. 13 (12), 4499 (2021).
- Du, F., et al. A hind limb disuse model inducing extensor digitorum longus atrophy in rats: tail suspension-immobilization. Aviat Space Environ Med. 82 (7), 689-693 (2011).
- Gomes, R. M., et al. Strength training reverses ovariectomy-induced bone loss and improve metabolic parameters in female Wistar rats. Life Sci. 213, 134-141 (2018).
- Ma, J., et al. Establishment of a rat model of osteosarcopenia. Chin J Osteoporos. 28 (1), 1-5 (2022).
- Huang, T., et al. Prevalence and risk factors of osteosarcopenia: a systematic review and meta-analysis. BMC Geriatr. 23 (1), 369 (2023).
- Qi, H., et al. mineral density and trabecular bone score in Chinese subjects with sarcopenia. Aging Clin Exp Res. 31 (11), 1549-1556 (2019).
- Shu, H., et al. An integrated study of hormone-related sarcopenia for modeling and comparative transcriptome in rats. Front Endocrinol. 14, 1073587 (2023).
- Nakaoka, K., Yamada, A., Noda, S., Goseki-Sone, M. Influence of dietary vitamin D deficiency on bone strength, body composition, and muscle in ovariectomized rats fed a high-fat diet. Nutrition. 60, 87-93 (2019).
- Chong, L., Xiaonan, Q., Hao, Z., Xiaosheng, Y. Castration method was used to construct a rat model of kidney-yang deficiency sarcopeniaosteoporosis and explore the mechanism. Chin Arch Tradit Chin Med. , (2024).
- Ma, X., et al. (S)-10-hydroxycamptothecin inhibits EMT-evoked osteosarcoma cell growth and metastasis by activating the HIPPO signaling pathway. Combin Chem High Throughput Screen. 27 (15), 2239-2248 (2024).
- Yamazaki, I., Yamaguchi, H. Characteristics of an ovariectomized osteopenic rat model. J Bone Miner Res. 4 (4), 13-22 (1989).
- Lee, H., et al. MiR-141-3p promotes mitochondrial dysfunction in ovariectomy-induced sarcopenia via targeting Fkbp5 and Fibin. Aging (Albany NY). 13 (4), 4881-4894 (2021).
- China, S. P., et al. Globular adiponectin reverses osteo-sarcopenia and altered body composition in ovariectomized rats. Bone. 105, 75-86 (2017).
- Rodgers, J. B., Monier-Faugere, M. C., Malluche, H. Animal models for the study of bone loss after cessation of ovarian function. Bone. 14 (3), 369-377 (1993).
- Matsushita, M., et al. Age-related changes in bone mass in the senescence-accelerated mouse (SAM). SAM-R/3 and SAM-P/6 as new murine models for senile osteoporosis. Am J Pathol. 125 (2), 276-283 (1986).
- Cheng, M., et al. A traditional Chinese herbal preparation, Er-Zhi-Wan, prevent ovariectomy-induced osteoporosis in rats. J Ethnopharmacol. 138 (2), 279-285 (2011).
- Roch, P. J., et al. Ostarine and ligandrol improve muscle tissue in an ovariectomized rat model. Front Endocrinol. 11, 556581 (2020).
- Bei, M. J., et al. Raloxifene retards cartilage degradation and improves subchondral bone microarchitecture in ovariectomized rats with patella baja-induced - patellofemoral joint osteoarthritis. Osteoarthritis Cartilage. 28 (3), 344-355 (2020).
- Wen, K., et al. Fecal and serum metabolomic signatures and microbial community profiling of postmenopausal osteoporosis mice model. Front Cell Infect Microbiol. 10, 535310 (2020).
- Shah, F. A., Stoica, A., Cardemil, C., Palmquist, A. Multiscale characterization of cortical bone composition, microstructure, and nanomechanical properties in experimentally induced osteoporosis. J Biomed Mater Res A. 106 (4), 997-1007 (2018).
- Andreollo, N. A., Santos, E. F., Araújo, M. R., Lopes, L. R. Rat's age versus human's age: what is the relationship. Arq Bras Cir Dig. 25 (1), 49-51 (2012).
- Fuchs, C. J., et al. Thigh muscles are more susceptible to age-related muscle loss when compared to lower leg and pelvic muscles. Exp Gerontol. 175, 112159 (2023).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten