Method Article
A criação de um modelo de rato para osteosarcopenia via ovariectomia
Neste Artigo
Resumo
Este protocolo atual descreve um procedimento para criar um modelo de osteosarcopenia em ratos usando ovariectomia.
Resumo
A osteosarcopenia (OS), uma doença degenerativa complexa, é caracterizada pelo declínio concomitante da massa muscular esquelética e da densidade mineral óssea (DMO), representando um enorme risco à saúde da população idosa. Apesar de sua relevância clínica, os mecanismos fisiopatológicos subjacentes à OS não são totalmente compreendidos, ressaltando a necessidade de uma compreensão mais profunda de sua etiologia para facilitar estratégias de tratamento eficazes. O desenvolvimento de um modelo animal confiável é fundamental nessa empreitada. Este estudo apresenta um protocolo refinado para a indução de osteosarcopenia pós-menopausa em ratas por meio de ovariectomia bilateral, um método conhecido por acelerar o aparecimento de perda muscular e óssea relacionada à idade. Neste estudo, ratos com 12 semanas de idade foram estratificados por peso corporal e aleatoriamente designados para um grupo de operação simulada ou um grupo ovariectomizado (OVX). Amostras de tecido dos músculos quadríceps e tríceps do membro posterior esquerdo, bem como do fêmur esquerdo, foram coletadas sistematicamente em 4, 8 e 12 semanas após a cirurgia. Essa abordagem metódica garante uma avaliação abrangente dos efeitos da ovariectomia na saúde muscular e óssea. A avaliação histológica da atrofia das fibras musculares e da morfologia femoral foi realizada por meio da coloração de hematoxilina e eosina (HE), enquanto a densidade mineral óssea foi quantificada por meio de absorciometria de raios-X de dupla energia (DXA). A progressão temporal da OS foi meticulosamente monitorada nos intervalos acima mencionados, fornecendo informações sobre a interação dinâmica entre a degeneração muscular e óssea. Este modelo não apenas reflete com precisão as manifestações clínicas da SG, mas também serve como uma plataforma robusta para investigar novas abordagens terapêuticas e seus mecanismos subjacentes.
Introdução
A osteosarcopenia é uma condição degenerativa multifacetada que encapsula as manifestações clínicas da osteoporose e da sarcopenia 1,2,3,4. A osteoporose, um distúrbio esquelético prevalente, é caracterizada por diminuição da massa óssea, microarquitetura comprometida e maior suscetibilidade a fraturas. A sarcopenia, muitas vezes referida como síndrome de perda de massa muscular, é caracterizada por uma redução na força e massa muscular 5,6. Os7 achados de Maryam revelaram que a osteosarcopenia aumentou o risco de morte em 30% em relação à sarcopenia isolada e em 8% em relação à baixa DMO isolada. A pesquisa mostrou que 16,4% dos indivíduos residentes na comunidade com 60 anos ou mais são afetados pela osteosarcopenia8. Na Coreia do Sul, a incidência de osteosarcopenia entre idosos com 60 anos ou mais que sofreram fraturas de quadril é relatada em 27,2%9. Indivíduos com EO enfrentam maiores riscos de quedas, fraturas, hospitalização e institucionalização, o que sobrecarrega o sistema de saúde e a sociedade10,11. Dada a gravidade dessas consequências, é crucial desenvolver e implementar medidas eficientes para a prevenção e tratamento da SG. Apesar da urgência, a pesquisa neste campo permanece incipiente, com debates em andamento em torno dos critérios diagnósticos e da eficácia de várias modalidades de tratamento. O desenvolvimento de modelos animais confiáveis é, portanto, essencial para dissecar a patogênese da OS e descobrir os fundamentos moleculares que podem informar abordagens de tratamento mais eficazes.
Atualmente, os modelos comumente usados para estudos pré-clínicos sobre osteosarcopenia incluem o modelo de envelhecimento, que simula o processo de envelhecimento humano sem intervenção medicamentosa. Essa abordagem está mais próxima do processo natural e é econômica; no entanto, exige um investimento significativo de tempo para maturação12. O método de injeção química de drogas oferece certos benefícios, como um ciclo de modelagem curto, resultados estáveis e baixo custo. No entanto, também apresenta desafios, incluindo a determinação precisa da dosagem hormonal, a habilidade técnica necessária para a injeção e os efeitos variáveis das intervenções hormonais13,14. Os modelos de engenharia genética podem envolver organismos geneticamente modificados que podem ser geneticamente defeituosos e caros. Embora esses modelos sejam altamente específicos, eles são notavelmente mais complexos e caros de produzir15. Os modelos de desuso simulam os efeitos do repouso prolongado no leito em pacientes clínicos16. Os modelos de desuso são eficazes e econômicos para lidar com a perda muscular, mas estão associados a complicações como coágulos sanguíneos e úlceras de decúbito. Esses modelos são monitorados rotineiramente para prevenir necrose domembro17,18 e modelos deficientes em hormônios; Há um consenso predominante na comunidade científica de que a ovariectomia bilateral serve como um método eficaz para estabelecer um modelo animal de osteoporose19,20.
Pesquisas indicam que os tecidos ósseo e muscular também podem interagir entre si por meio de mecanismos autócrinos, endócrinos e parácrinos21. O acúmulo de tecido adiposo no músculo e na medula óssea serve como um indicador de redução da massa óssea e muscular no contexto da osteosarcopenia2. A sarcopenia em idosos está diretamente associada à redução da densidade óssea e à deterioração da microarquitetura óssea. Além disso, a diminuição da massa muscular serve como um fator de risco independente para a degradação da microestrutura óssea22. Essa metodologia tem sido reconhecida como uma estratégia viável para a modelagem da sarcopenia23,24, que poderia potencialmente servir como um modelo combinado para ambas as condições25. Apesar do corpo limitado de pesquisas sobre a aplicação da ovariectomia como meio de induzir osteosarcopenia, essa abordagem demonstra eficácia potencial. Os benefícios da utilização da ovariectomia em estudos pré-clínicos abrangem um processo de modelagem rápido, a eliminação de intervenções farmacológicas, a criação de um modelo experimental estável, implementação direta e custo-benefício.
O presente estudo tem como objetivo delinear o procedimento para a criação de um modelo pré-clínico em ratas por meio da remoção de um segmento de ambas as trompas de falópio e ovários em indivíduos não gestantes. Essa abordagem serve como uma ferramenta valiosa para investigar os fundamentos moleculares da OS e para avaliar os benefícios terapêuticos das intervenções em um ambiente experimental controlado.
Protocolo
Ratos fêmeas da raça Sprague Dawley (n = 36), com 12 semanas de idade e pesando aproximadamente 200-240 g, foram alojados individualmente em gaiolas ventiladas em uma sala de animais livre de patógenos específicos (FPS) com um ciclo claro/escuro de 12 horas. Eles tinham livre acesso a ração SPF e água estéril. Os ratos foram autorizados a se aclimatar ao ambiente por uma semana antes dos experimentos. Usando alocação aleatória, os ratos foram divididos em grupos ovariectomizados (OVX) (cada um com 6 ratos) e grupos simulados (cada um com 6 ratos) por 4, 8 e 12 semanas após a cirurgia. Todos os procedimentos com animais foram realizados seguindo as diretrizes aprovadas pelo comitê de bem-estar animal da Universidade de Medicina Tradicional Chinesa de Liaoning (nº 21000042021040).
1. Ovariectomia em ratos
NOTA: O aparelho cirúrgico utilizado neste protocolo está na Figura 1.
- Mantenha os ratos na sala de animais SPF e siga todos os procedimentos necessários usando equipamentos esterilizados em um ambiente estéril.
- Misture pentobarbital de sódio, um pó branco, com água destilada ou uma solução salina normal a 0,9% para criar uma solução anestésica. A dose padrão é de 30 mg/kg; Encha a seringa em conformidade.
NOTA: É importante observar que a solução é instável e deve ser usada imediatamente. Prepare a quantidade necessária para um experimento de cada vez. - Eleve o abdômen do rato acima da cabeça para deslocar as vísceras para a parte superior do abdômen. Usando a mão dominante, posicione uma seringa a 1-1,5 cm do lado esquerdo (ou direito) da linha média do abdômen e insira-a em um ângulo de 45° no corpo do rato. Após a administração da solução do medicamento, gire a agulha e retire-a.
- Após a administração da anestesia, monitore cuidadosamente a respiração do rato e aperte os dedos dos pés para confirmar que está completamente anestesiado.
NOTA: Se houver sinais de espasmos ou convulsões, é aconselhável esperar mais tempo antes de prosseguir. - Posicione o rato na mesa de operação, prenda seus membros e remova os pelos de ambos os lados das costas usando um aparador (Figura 2A).
NOTA: Se o efeito de depilação não for o ideal, o creme depilatório pode ser usado para depilação. - Desinfete a área onde o cabelo foi removido usando bolas de algodão embebidas em iodo.
NOTA: O processo de desinfecção cirúrgica envolve começar do centro e mover-se para fora em um padrão circular, normalmente repetido três vezes. - Faça uma incisão nas costas, a cerca de 1,0 cm de distância da linha central. Faça a incisão próxima à junção entre a curvatura da caixa torácica e a borda da coluna vertebral, ligeiramente mais baixa em 0,5-1 cm, separando a pele, a fáscia e o músculo em ambos os lados (Figura 2B).
NOTA: Para acessar a cavidade abdominal através da camada muscular mais fraca da parede abdominal posterior, a incisão é mantida o mínimo possível. - Encontrar o ovário pode ser um desafio no início. Comece localizando o oviduto e traçando-o até a extremidade terminal do ovário, que é envolta em uma camada de tecido adiposo frouxo.
NOTA: O ovário direito está posicionado na lateral da 4ª à 5ª vértebra lombar, 7-12 mm atrás do rim e 15 mm de distância da linha central. O ovário esquerdo está situado no lado da 5ª à 6ª vértebras lombares, 3-5 mm atrás do rim e 11 mm da linha central. - Levante cuidadosamente o ovário e a extremidade do oviduto para fora do corpo (Figura 2C). Aplique a pinça hemostática na região mais contraída entre a extremidade uterina e o ovário. Use um fio cirúrgico para amarrá-lo e, em seguida, excise o ovário completamente com uma tesoura.
NOTA: É fundamental ser gentil ao manusear o oviduto e o útero durante o procedimento, evitando puxões excessivos. A ligadura usada antes da ovariectomia deve ser firmemente presa, pois o tecido lipídico mole ao redor do ovário pode facilmente fazer com que ele se solte. Essa precaução é necessária para evitar sangramento pós-operatório, que pode resultar na morte dos ratos. No grupo sham, o tecido adiposo de igual volume e tamanho adjacente ao ovário foi excisado, seguido de sutura do músculo e da pele. - Solte a pinça hemostática e retorne suavemente o útero à cavidade abdominal.
- Administre penicilina nas feridas abdominais onde os ovários e as trompas de falópio são ligados para evitar infecções.
NOTA: Administre penicilina 80.000 unidades/rato uma vez ao dia durante 3 dias consecutivos. - Suturar individualmente (tamanho 3-0) as camadas de pele e músculo (Figura 2D).
NOTA: A esterilização deve ser realizada 24-48 h após a cirurgia, com intervalo de 1-2 dias. - Coloque o rato de volta em uma gaiola higienizada e monitore-o até que ele recupere completamente a consciência da anestesia.
NOTA: Continue a fornecer suporte térmico durante o procedimento até que o animal esteja totalmente recuperado da anestesia. - Para evitar infecção da ferida, administrar aos ratos de cada grupo uma injeção intramuscular de penicilina sódica 80.000 unidades/rato uma vez ao dia por 3 dias consecutivos26.
2. Coleta de tecido ósseo e tecido muscular
NOTA: Os ratos foram eutanasiados com uma overdose de pentobarbital sódico (100-200 mg / kg) em 4, 8 e 12 semanas após a cirurgia de modelagem. Um total de 36 amostras foram coletadas.
- Exponha os músculos tríceps braquial e quadríceps da panturrilha esquerda. Identifique e disseque cuidadosamente esses músculos em seus pontos de origem e ponto final para preservar sua integridade. Em seguida, registre e calcule a média dos pesos úmidos dos músculos para determinar os coeficientes de peso úmido dos músculos.
NOTA: Peso corporal do animal e coeficiente de peso úmido do músculo esquelético = peso úmido do músculo de rato/peso corporal. - Separe totalmente o fêmur cortando a cápsula articular para cima ao longo do fêmur. Em seguida, elimine o tecido muscular e ligamentar próximo.
3. Exame patológico
- Mergulhe os tecidos musculares em um recipiente contendo uma solução de formalina tamponada neutra a 10% por um período de 24 h. Em seguida, enxágue os tecidos musculares extensivamente em água corrente para remover o fixador.
- Coloque o fêmur esquerdo em uma solução de paraformaldeído a 4% por 1 semana e, em seguida, mergulhe-o em uma quantidade suficiente de solução de descalcificação de ácido etilenodiaminotetracético (EDTA) para remover os depósitos de cálcio, com o tampão sendo trocado diariamente.
- Meça os valores de densidade mineral óssea usando um densitômetro ósseo de absorciometria de raios-X de dupla energia (DXA). Coloque o fêmur em um raio-X de dupla energia. Defina a precisão da medição para Fina, ajustando o modo para Modo específico de pequenos animais, e analise a DMO de fêmures de ratos usando o software de análise de DMO que o acompanha.
- Coloque a amostra em cera de parafina. Seque as amostras para o exame histológico de rotina27.
4. Análise estatística
- Apresentar as variáveis contínuas como média ±± desvio padrão (DP) e comparar entre os dois grupos usando o teste t para amostra independente. Todas as análises estatísticas seguiram uma abordagem bilateral, com significância estatística fixada em P < 0,05. Use o software de análise de dados apropriado para realizar análises de dados.
Resultados
Este protocolo fornece uma descrição detalhada do procedimento de ovariectomia bilateral para estabelecer um modelo de osteosarcopenia em ratos. A Figura 3 demonstra uma diminuição no coeficiente de peso úmido do músculo quadríceps no grupo OVX em comparação com o grupo sham. Embora não tenha havido variação estatisticamente significativa na DMO entre os dois grupos 4 semanas após a cirurgia, a DMO no grupo OVX foi significativamente menor do que no grupo operado de forma simulada em 8 e 12 semanas após a cirurgia.
Na Figura 4, observa-se atrofia significativa do músculo tríceps braquial no grupo OVX, com maior gap de fibras musculares em comparação com o grupo sham 12 semanas após a modelagem. A Figura 5 demonstra que, com 4 semanas de pós-operatório, a densidade trabecular da cabeça femoral nos grupos OVX e sham foi semelhante, mostrando um arranjo regular e denso com boa conectividade. No entanto, 8 semanas após a cirurgia, as trabéculas no grupo OVX começaram a diminuir em número, tornando-se esparsamente dispostas com um aumento da área da cavidade da medula óssea. A quantidade de adipócitos na cavidade da medula óssea foi maior do que no grupo sham. No pós-operatório de 12 semanas, as trabéculas no OVX exibiram uma redução acentuada, exibindo interconexões incompletas, uma expansão notável na área da cavidade da medula óssea e uma contagem de adipócitos significativamente elevada em comparação com o grupo simulado.

Figura 1: Instrumentos cirúrgicos. (A) Porta-agulha reto. (B) Tesoura Mayo reta. (C) Bandeja de troca de medicamentos descartáveis. (D) Bola de algodão estéril (E) Seringas. (F) Iodo. (G) Agulha de sutura. (H) Linha de sutura. Clique aqui para ver uma versão maior desta figura.
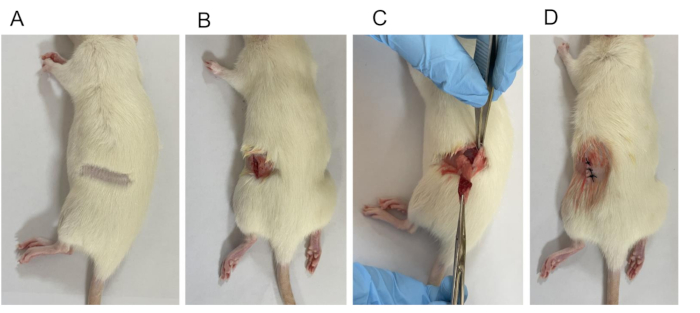
Figura 2: Estabelecimento do modelo OVX. (A) Depilação. (B) Foi feita uma abertura cirúrgica de 1 cm de comprimento da pele para a camada subcutânea. (C) Ligadura envolvendo a remoção de ovários e uma parte das trompas de Falópio. (D) Ferida fechada. Clique aqui para ver uma versão maior desta figura.
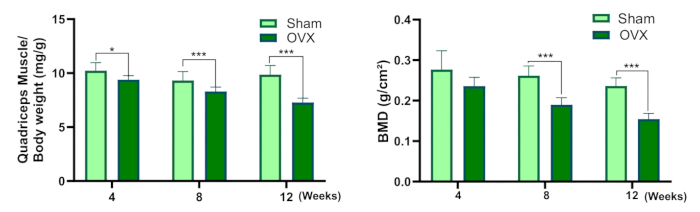
Figura 3: Músculo quadríceps/peso corporal e densidade mineral óssea. (A) Coeficiente de peso úmido dos músculos quadríceps. (B) Densidade mineral óssea (em comparação com o grupo simulado, * P<0,05, ** P<0,01, *** P<0,001). Clique aqui para ver uma versão maior desta figura.
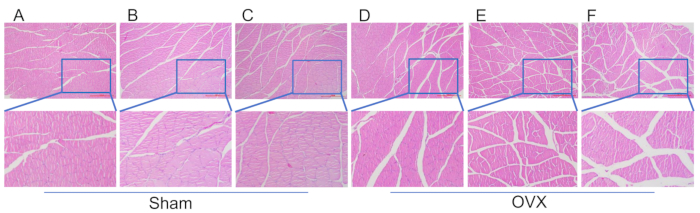
Figura 4: Coloração HE de seções de tecido das fibras musculares do músculo tríceps da panturrilha. (A) Morfologia muscular 4 semanas após o procedimento de modelagem no grupo simulado. (B) Morfologia muscular 8 semanas após o procedimento de modelagem no grupo simulado. (C) Morfologia muscular 12 seguindo o procedimento de modelagem no grupo simulado. (D) Morfologia muscular 4 semanas após a modelagem no grupo OVX. (E) Morfologia muscular 8 semanas após a modelagem no grupo OVX. (F) Morfologia muscular 12 semanas após a modelagem no grupo OVX. Barras de escala: 1000 μm. Clique aqui para ver uma versão maior desta figura.

Figura 5: Coloração HE de seções de tecido da cabeça femoral. (A) Morfologia femoral 4 semanas após a modelagem no grupo simulado. (B) Morfologia femoral 8 semanas após a modelagem no grupo simulado. (C) Femoral 12 semanas após a modelagem no grupo simulado. (D) Morfologia femoral 4 semanas após a modelagem no grupo OVX. (E) Morfologia femoral 8 semanas após a modelagem no grupo OVX. (F) Morfologia femoral 12 semanas após a modelagem no grupo OVX. Barras de escala: 1000 μm. (G) Área de adiposidade quantificada. Clique aqui para ver uma versão maior desta figura.
Discussão
O modelo animal ovariectomizado bilateral é fundamental para elucidar os mecanismos subjacentes à osteosarcopenia e avaliar possíveis intervenções terapêuticas. A osteoporose induzida por ovariectomia em ratos, que reflete a diminuição abrupta dos níveis de estrogênio observada em mulheres na pós-menopausa, é comumente empregada como modelo para a pesquisa da osteoporose. Além disso, a pesquisa destacou uma associação significativa entre osteoporose e sarcopenia em indivíduos mais velhos, com perda muscular e óssea concomitante frequentemente observada. Consequentemente, vários estudos utilizaram esse modelo para investigar a sarcopenia 28,29. Como resultado, o presente estudo estabelece com sucesso um modelo animal de osteosarcopenia.
Vários fatores importantes devem ser levados em consideração ao estabelecer um modelo confiável. Um modelo animal adequado deve ser caracterizado por conveniência, relevância e especificidade30. Os ratos SD são os animais mais comumente usados na modelagem da osteoporose. Após a remoção dos ovários, esse mecanismo de transformação que ocorre nos ossos de ratas se assemelha muito ao processo de perda óssea pós-menopausa observado em humanos31,32. Pesquisas indicam que ratos com idade entre 11 semanas e 36 semanas são ideais para replicar os modelos de osteoporose ou sarcopenia 33,34,35,36. Em termos de sexo, a prevalência de osteosarcopenia entre as mulheres foi maior em 28% do que entre os homens em 14%21; Para tanto, foram selecionadas ratas. Os ratos tornam-se sexualmente maduros por volta das 6 semanas de idade37, então selecionamos ratos de 12 semanas. Um estudo descobriu que os volumes dos músculos do quadríceps foram significativamente reduzidos em adultos mais velhos em comparação com indivíduos mais jovens, sugerindo que o envelhecimento tem um impacto mais prejudicial no volume do quadríceps38. A osteoporose utiliza a densidade mineral óssea femoral como padrão-ouro32. Assim, selecionamos o músculo quadríceps e o osso femoral.
A consistência na técnica cirúrgica é crucial, sendo recomendado que o mesmo indivíduo realize todos os procedimentos para garantir uniformidade na localização e tamanho da incisão. Todo o procedimento consiste em várias etapas cruciais. Primeiro, a injeção intraperitoneal de anestésico deve evitar perfurar órgãos internos. Antes da administração do medicamento, é essencial aspirar para garantir que a agulha não tenha entrado em um vaso sanguíneo, empurrar o êmbolo da seringa com precisão e manter a estabilidade e a velocidade durante todo o processo. Em segundo lugar, identificar o ovário rapidamente após o corte do peritônio pode ser um desafio, exigindo uma compreensão abrangente da anatomia do rato pelo operador. Uma vez localizado o ovário, a ligadura e a remoção de parte do oviduto e do ovário é uma etapa vital para a sobrevivência pós-operatória do rato. Devido ao tecido adiposo mole próximo ao ovário, a sutura pode facilmente se soltar após a amarração, levando a sangramento e potencialmente morte após a cirurgia. Por fim, antes da sutura, recomenda-se a aplicação de penicilina no sítio cirúrgico, com administração intramuscular adicional 3 dias após a cirurgia como medida preventiva contra infecção.
Como resultado de procedimentos cirúrgicos e da administração de anestesia, os ratos podem sentir dor intensa ou até mesmo a morte, necessitando de sua colocação em um ambiente quente, higiênico e bem ventilado até que recuperem a consciência. O monitoramento vigilante é imperativo durante a semana inicial de pós-operatório, com atenção à atividade comportamental dos ratos durante todo o estudo.
Os benefícios deste modelo incluem sua natureza amigável, recursos de modelagem eficientes, custo-benefício e capacidade de imitar o desenvolvimento natural da osteoporose e perda muscular. No entanto, existem certas restrições associadas a esse modelo, como o rápido declínio nos níveis de estrogênio após a cirurgia de remoção ovariana, com o estrogênio não sendo reconhecido como um contribuinte direto para a sarcopenia. O presente experimento foi conduzido em ratos fêmeas e não envolveu ratos machos. Apesar dessas limitações, o modelo animal de ovariectomia bilateral emergiu como um recurso valioso para investigar a SG e explorar caminhos para o avanço da doença.
Divulgações
Cada autor declara não ter interesses financeiros concorrentes.
Agradecimentos
Este trabalho é apoiado por doações de (1) National Nature Science Foundation (82305275). (2) Programa da Fundação Provincial de Ciências Naturais de Liaoning (2022-YGJC-80 e 2022-YGJC-79). (3) Projeto de Construção de Disciplina Chave de Medicina Chinesa de Alto Nível da Administração Nacional da MTC (zyyzdxk-2023040).
Materiais
| Name | Company | Catalog Number | Comments |
| Double lion Irradiated Rodent Diet | Suzhou Shuangshi Experimental Animal Feed Technology Co., Ltd. | GB 14924.3 | Animal feed |
| Disposable medication changing tray | Yangzhou Chenglin Medical Technology Co., Ltd. | RVnpFXLc | |
| Dual Energy X-ray Bone Densitometer | Xuzhou PinyuanElectronic Technology Co., Ltd. | DXA-800E | |
| Iodine | Shanghai Likang Sterilization Hi-Tech Co., Ltd. | LK-310512 | |
| IVCs rat cage | Suzhou Monkey King Animal Experimental Equipment Technology Co., Ltd. | HH-MMB-2 | Animal barrier |
| Penicillin sodium | North China Pharmaceutical Group Limited Liability Co., Ltd. | H13020654 | |
| sodium pentobarbital | Sigma-Aldrich, St. Louis, MO | P3761-5G | |
| Sterile cotton ball | Henan Piaoan Group Co., Ltd | 20140017 | |
| Straight Mayo scissors | Shenzhen Huayang Biotechnology Co., Ltd. | 18-0410 | |
| Straight needle holder | Shanghai Simplicity Biotechnology Co., Ltd. | 32100-14 | |
| Suture line | Shenzhen Huayang Biotechnology Co., Ltd. | 18-5902 | |
| Suture needle | Shenzhen Huayang Biotechnology Co., Ltd. | 18-5036 | |
| Syringes | Shenzhen Huayang Biotechnology Co., Ltd. | 21-3021 |
Referências
- Binkley, N., Buehring, B. Beyond FRAX®: It's time to consider "Sarco-Osteopenia. J Clin Densitom. 12 (4), 413-416 (2009).
- Hirschfeld, H. P., Kinsella, R., Duque, G. Osteosarcopenia: where bone, muscle, and fat collide. Osteoporos Int. 28 (10), 2781-2790 (2017).
- Kaplan, S. J., et al. Association of radiologic indicators of frailty with 1-year mortality in older trauma patients. JAMA Surg. 152 (2), e164604 (2017).
- Nielsen, B. R., Abdulla, J., Andersen, H. E., Schwarz, P., Suetta, C. Sarcopenia and osteoporosis in older people: a systematic review and meta-analysis. Eur Geriatr Med. 9 (4), 419-434 (2018).
- Cruz-Jentoft, A. J., et al. Sarcopenia: European consensus on definition and diagnosis: Report of the European Working Group on sarcopenia in older people. Age Ageing. 39 (4), 412-423 (2010).
- Polito, A., Barnaba, L., Ciarapica, D., Azzini, E. Osteosarcopenia: A narrative review on clinical studies. Int J Mol Sci. 23 (10), 5591 (2022).
- Pourhassan, M., et al. Three-year mortality of older hospitalized patients with osteosarcopenia: Data from the OsteoSys study. Nutrients. 16 (9), 1328 (2024).
- Salech, F., et al. Osteosarcopenia predicts falls, fractures, and mortality in Chilean community-dwelling older adults. J Am Med Dir Assoc. 22 (4), 853-858 (2021).
- Yoo, J. I., Ha, Y. C. Review of epidemiology, diagnosis, and treatment of osteosarcopenia in Korea. J Bone Metab. 25 (1), 1-7 (2018).
- Inoue, T., et al. Related factors and clinical outcomes of osteosarcopenia: A narrative review. Nutrients. 13 (2), 291 (2021).
- Teng, Z., et al. The analysis of osteosarcopenia as a risk factor for fractures, mortality, and falls. Osteoporos Int. 32 (11), 2173-2183 (2021).
- Scheuren, A. C., et al. Hallmarks of frailty and osteosarcopenia in prematurely aged PolgA(D257A/D257A) mice. J Cachexia Sarcopenia Muscle. 11 (4), 1121-1140 (2020).
- Gasparini, S. J., et al. Continuous corticosterone delivery via the drinking water or pellet implantation: A comparative study in mice. Steroids. 116, 76-82 (2016).
- Pal, S., et al. A butanolic fraction from the standardized stem extract of Cassia occidentalis L delivered by a self-emulsifying drug delivery system protects rats from glucocorticoid-induced osteopenia and muscle atrophy. Sci Rep. 10 (1), 195 (2020).
- Mito, T., et al. Mitochondrial DNA mutations in mutator mice confer respiration defects and B-cell lymphoma development. PLoS One. 8 (2), e55789 (2013).
- Thomsen, J. S., et al. Cancellous bone structure of iliac crest biopsies following 370 days of head-down bed rest. Aviat Space Environ Med. 76 (10), 915-922 (2005).
- Papadopoulou, S. K., et al. Exercise and nutrition impact on osteoporosis and sarcopenia-The incidence of osteosarcopenia: A narrative review. Nutrients. 13 (12), 4499 (2021).
- Du, F., et al. A hind limb disuse model inducing extensor digitorum longus atrophy in rats: tail suspension-immobilization. Aviat Space Environ Med. 82 (7), 689-693 (2011).
- Gomes, R. M., et al. Strength training reverses ovariectomy-induced bone loss and improve metabolic parameters in female Wistar rats. Life Sci. 213, 134-141 (2018).
- Ma, J., et al. Establishment of a rat model of osteosarcopenia. Chin J Osteoporos. 28 (1), 1-5 (2022).
- Huang, T., et al. Prevalence and risk factors of osteosarcopenia: a systematic review and meta-analysis. BMC Geriatr. 23 (1), 369 (2023).
- Qi, H., et al. mineral density and trabecular bone score in Chinese subjects with sarcopenia. Aging Clin Exp Res. 31 (11), 1549-1556 (2019).
- Shu, H., et al. An integrated study of hormone-related sarcopenia for modeling and comparative transcriptome in rats. Front Endocrinol. 14, 1073587 (2023).
- Nakaoka, K., Yamada, A., Noda, S., Goseki-Sone, M. Influence of dietary vitamin D deficiency on bone strength, body composition, and muscle in ovariectomized rats fed a high-fat diet. Nutrition. 60, 87-93 (2019).
- Chong, L., Xiaonan, Q., Hao, Z., Xiaosheng, Y. Castration method was used to construct a rat model of kidney-yang deficiency sarcopeniaosteoporosis and explore the mechanism. Chin Arch Tradit Chin Med. , (2024).
- Ma, X., et al. (S)-10-hydroxycamptothecin inhibits EMT-evoked osteosarcoma cell growth and metastasis by activating the HIPPO signaling pathway. Combin Chem High Throughput Screen. 27 (15), 2239-2248 (2024).
- Yamazaki, I., Yamaguchi, H. Characteristics of an ovariectomized osteopenic rat model. J Bone Miner Res. 4 (4), 13-22 (1989).
- Lee, H., et al. MiR-141-3p promotes mitochondrial dysfunction in ovariectomy-induced sarcopenia via targeting Fkbp5 and Fibin. Aging (Albany NY). 13 (4), 4881-4894 (2021).
- China, S. P., et al. Globular adiponectin reverses osteo-sarcopenia and altered body composition in ovariectomized rats. Bone. 105, 75-86 (2017).
- Rodgers, J. B., Monier-Faugere, M. C., Malluche, H. Animal models for the study of bone loss after cessation of ovarian function. Bone. 14 (3), 369-377 (1993).
- Matsushita, M., et al. Age-related changes in bone mass in the senescence-accelerated mouse (SAM). SAM-R/3 and SAM-P/6 as new murine models for senile osteoporosis. Am J Pathol. 125 (2), 276-283 (1986).
- Cheng, M., et al. A traditional Chinese herbal preparation, Er-Zhi-Wan, prevent ovariectomy-induced osteoporosis in rats. J Ethnopharmacol. 138 (2), 279-285 (2011).
- Roch, P. J., et al. Ostarine and ligandrol improve muscle tissue in an ovariectomized rat model. Front Endocrinol. 11, 556581 (2020).
- Bei, M. J., et al. Raloxifene retards cartilage degradation and improves subchondral bone microarchitecture in ovariectomized rats with patella baja-induced - patellofemoral joint osteoarthritis. Osteoarthritis Cartilage. 28 (3), 344-355 (2020).
- Wen, K., et al. Fecal and serum metabolomic signatures and microbial community profiling of postmenopausal osteoporosis mice model. Front Cell Infect Microbiol. 10, 535310 (2020).
- Shah, F. A., Stoica, A., Cardemil, C., Palmquist, A. Multiscale characterization of cortical bone composition, microstructure, and nanomechanical properties in experimentally induced osteoporosis. J Biomed Mater Res A. 106 (4), 997-1007 (2018).
- Andreollo, N. A., Santos, E. F., Araújo, M. R., Lopes, L. R. Rat's age versus human's age: what is the relationship. Arq Bras Cir Dig. 25 (1), 49-51 (2012).
- Fuchs, C. J., et al. Thigh muscles are more susceptible to age-related muscle loss when compared to lower leg and pelvic muscles. Exp Gerontol. 175, 112159 (2023).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados