Method Article
La creazione di un modello di ratto per l'osteosarcopenia tramite ovariectomia
In questo articolo
Riepilogo
Questo protocollo attuale delinea una procedura per la creazione di un modello di osteosarcopenia nel ratto utilizzando l'ovariectomia.
Abstract
L'osteosarcopenia (OS), una malattia degenerativa complessa, è caratterizzata dal concomitante declino della massa muscolare scheletrica e della densità minerale ossea (BMD), che rappresenta un enorme rischio per la salute della popolazione anziana. Nonostante la sua rilevanza clinica, i meccanismi fisiopatologici alla base della OS non sono completamente compresi, sottolineando la necessità di una comprensione più profonda della sua eziologia per facilitare strategie di trattamento efficaci. Lo sviluppo di un modello animale affidabile è fondamentale in questo sforzo. Questo studio presenta un protocollo raffinato per l'induzione dell'osteosarcopenia postmenopausale nei ratti attraverso l'ovariectomia bilaterale, un metodo noto per accelerare l'insorgenza della perdita muscolare e ossea legata all'età. In questo studio, i ratti di 12 settimane sono stati stratificati in base al peso corporeo e assegnati in modo casuale a un gruppo di operazione fittizia o a un gruppo ovariectomizzato (OVX). I campioni di tessuto dei muscoli quadricipiti e tricipiti dell'arto posteriore sinistro, così come del femore sinistro, sono stati raccolti sistematicamente a 4, 8 e 12 settimane dopo l'intervento chirurgico. Questo approccio metodico garantisce una valutazione completa degli effetti dell'ovariectomia sulla salute muscolare e ossea. La valutazione istologica dell'atrofia delle fibre muscolari e della morfologia femorale è stata condotta utilizzando la colorazione con ematossilina ed eosina (HE), mentre la densità minerale ossea è stata quantificata utilizzando l'assorbimetria a raggi X a doppia energia (DXA). La progressione temporale della OS è stata meticolosamente monitorata agli intervalli sopra menzionati, fornendo informazioni sull'interazione dinamica tra degenerazione muscolare e ossea. Questo modello non solo riflette accuratamente le manifestazioni cliniche della OS, ma funge anche da solida piattaforma per lo studio di nuovi approcci terapeutici e dei loro meccanismi sottostanti.
Introduzione
L'osteosarcopenia è una condizione degenerativa multiforme che racchiude le manifestazioni cliniche sia dell'osteoporosi che della sarcopenia 1,2,3,4. L'osteoporosi, un disturbo scheletrico prevalente, è caratterizzata da una ridotta massa ossea, una microarchitettura compromessa e un'elevata suscettibilità alle fratture. La sarcopenia, spesso indicata come sindrome da atrofia muscolare, è caratterizzata da una riduzione della forza e della massa muscolare 5,6. I7 risultati di Maryam hanno rivelato che l'osteosarcopenia aumenta il rischio di morte del 30% rispetto alla sola sarcopenia e dell'8% rispetto alla sola BMD bassa. La ricerca ha dimostrato che il 16,4% degli individui che vivono in comunità di età pari o superiore a 60 anni sono affetti da osteosarcopenia8. In Corea del Sud, l'incidenza dell'osteosarcopenia tra gli anziani di età pari o superiore a 60 anni che hanno subito fratture dell'anca è del 27,2%9. Gli individui con OS affrontano rischi più elevati di cadute, fratture, ospedalizzazione e istituzionalizzazione, che gravano sul sistema sanitario e sulla società10,11. Data la gravità di queste conseguenze, è fondamentale sviluppare e attuare misure efficaci per la prevenzione e il trattamento della OS. Nonostante l'urgenza, la ricerca in questo campo rimane agli albori, con dibattiti in corso sui criteri diagnostici e sull'efficacia delle varie modalità di trattamento. Lo sviluppo di modelli animali affidabili è quindi essenziale per sezionare la patogenesi della OS e scoprire le basi molecolari che potrebbero informare approcci terapeutici più efficaci.
Attualmente, i modelli comunemente utilizzati per gli studi preclinici sull'osteosarcopenia includono il modello di invecchiamento, che simula il processo di invecchiamento umano senza l'intervento di farmaci. Questo approccio è più vicino al processo naturale ed è conveniente; Tuttavia, richiede un notevole investimento di tempo per la maturazione12. Il metodo di iniezione chimica del farmaco offre alcuni vantaggi, come un ciclo di modellazione breve, risultati stabili e basso costo. Tuttavia, presenta anche sfide, tra cui la determinazione precisa del dosaggio ormonale, l'abilità tecnica richiesta per l'iniezione e gli effetti variabili degli interventi ormonali13,14. I modelli di ingegneria genetica possono coinvolgere organismi geneticamente modificati che possono essere sia geneticamente difettosi che costosi. Sebbene questi modelli siano altamente specifici, sono notevolmente più complessi e costosi da produrre15. I modelli di disuso simulano gli effetti del riposo a letto prolungato sui pazienti clinici16. I modelli di disuso sono efficaci ed economici per affrontare la perdita muscolare, ma sono associati a complicanze come coaguli di sangue e piaghe da decubito. Questi modelli sono monitorati di routine per prevenire la necrosi degli arti17,18 e i modelli con deficit ormonale; C'è un accordo prevalente all'interno della comunità scientifica sul fatto che l'ovariectomia bilaterale serva come metodo efficace per stabilire un modello animale di osteoporosi19,20.
La ricerca indica che i tessuti ossei e muscolari possono anche interagire tra loro attraverso meccanismi autocrini, endocrini e paracrini21. L'accumulo di tessuto adiposo nel muscolo e nel midollo osseo funge da indicatore di riduzione della massa ossea e muscolare nel contesto dell'osteosarcopenia2. La sarcopenia negli anziani è direttamente associata a una riduzione della densità ossea e al deterioramento della microarchitettura ossea. Inoltre, la diminuzione della massa muscolare funge da fattore di rischio indipendente per la degradazione della microstruttura ossea22. Questa metodologia è stata riconosciuta come una strategia praticabile per la modellazione della sarcopenia23,24, che potrebbe potenzialmente servire come modello combinato per entrambe le condizioni25. Nonostante il limitato corpus di ricerche riguardanti l'applicazione dell'ovariectomia come mezzo per indurre l'osteosarcopenia, questo approccio dimostra una potenziale efficacia. I vantaggi dell'utilizzo dell'ovariectomia negli studi preclinici comprendono un rapido processo di modellazione, l'eliminazione degli interventi farmacologici, la creazione di un modello sperimentale stabile, un'implementazione semplice e un rapporto costo-efficacia.
Il presente studio mira a delineare la procedura per la creazione di un modello preclinico in ratti femmina attraverso la rimozione di un segmento di entrambe le tube di Falloppio e delle ovaie in individui non gravidi. Questo approccio funge da strumento prezioso per studiare le basi molecolari dell'OS e per valutare i benefici terapeutici degli interventi in un contesto sperimentale controllato.
Protocollo
Le femmine di ratti Sprague Dawley (n = 36), di età pari a 12 settimane e del peso di circa 200-240 g, sono state alloggiate individualmente in gabbie ventilate in una stanza per animali priva di patogeni specifici (SPF) con un ciclo luce/buio di 12 ore. Avevano libero accesso al mangime SPF e all'acqua sterile. Ai ratti è stato permesso di acclimatarsi all'ambiente per una settimana prima degli esperimenti. Utilizzando l'assegnazione casuale, i ratti sono stati divisi in gruppi ovariectomizzati (OVX) (ciascuno con 6 ratti) e gruppi fittizi (ciascuno con 6 ratti) per 4, 8 e 12 settimane dopo l'intervento chirurgico. Tutte le procedure sugli animali sono state eseguite seguendo le linee guida approvate dal comitato per il benessere degli animali presso l'Università di Medicina Tradizionale Cinese del Liaoning (n. 21000042021040).
1. Ovariectomia nei ratti
NOTA: L'apparato chirurgico utilizzato in questo protocollo è riportato nella Figura 1.
- Tenere i ratti nella stanza degli animali SPF e seguire tutte le procedure necessarie utilizzando attrezzature sterilizzate in un ambiente sterile.
- Mescolare il pentobarbital di sodio, una polvere bianca, con acqua distillata o una soluzione salina normale allo 0,9% per creare una soluzione anestetica. La dose standard è di 30 mg/kg; Riempire la siringa di conseguenza.
NOTA: È importante notare che la soluzione è instabile e deve essere utilizzata immediatamente. Prepara la quantità necessaria per un esperimento alla volta. - Solleva l'addome del ratto sopra la testa per spostare i visceri verso la parte superiore dell'addome. Usando la mano dominante, posizionare una siringa a 1-1,5 cm dal lato sinistro (o destro) della linea mediana dell'addome e inserirla con un angolo di 45° nel corpo del ratto. Dopo che la soluzione farmacologica è stata somministrata, ruotare l'ago e poi ritirare.
- Dopo la somministrazione dell'anestesia, monitorare attentamente la respirazione del ratto e pizzicargli le dita dei piedi per confermare che sia completamente anestetizzato.
NOTA: Se ci sono segni di spasmi o convulsioni, si consiglia di attendere più a lungo prima di procedere. - Posizionare il ratto sul tavolo operatorio, fissare gli arti e rimuovere i peli su entrambi i lati della schiena utilizzando un rifinitore (Figura 2A).
NOTA: Se l'effetto di depilazione non è ideale, è possibile utilizzare una crema depilatoria per la depilazione. - Disinfettare l'area in cui sono stati rimossi i peli utilizzando batuffoli di cotone imbevuti di iodio.
NOTA: Il processo di disinfezione chirurgica prevede di partire dal centro e spostarsi verso l'esterno in uno schema circolare, in genere ripetuto tre volte. - Praticare un'incisione sul retro, a circa 1,0 cm di distanza dalla linea centrale. Praticare l'incisione vicino alla giunzione tra la curvatura della gabbia toracica e il bordo della colonna vertebrale, leggermente più in basso di 0,5-1 cm separando la pelle, la fascia e il muscolo su entrambi i lati (Figura 2B).
NOTA: Per accedere alla cavità addominale attraverso lo strato muscolare più debole della parete addominale posteriore, l'incisione viene mantenuta il più minima possibile. - Trovare l'ovaio può essere difficile all'inizio. Inizia localizzando l'ovidotto e tracciandolo fino all'estremità terminale dell'ovaio, che è racchiusa in uno strato di tessuto adiposo lasso.
NOTA: L'ovaio destro è posizionato sul lato della 4a e 5a vertebra lombare, 7-12 mm dietro il rene e 15 mm di distanza dalla linea centrale. L'ovaio sinistro è situato sul lato della 5a-6a vertebra lombare, 3-5 mm dietro il rene e 11 mm dalla linea centrale. - Sollevare con cautela l'ovaio e l'estremità dell'ovidotto dal corpo (Figura 2C). Applicare la pinza emostatica nella regione più ristretta tra l'estremità uterina e l'ovaio. Usa un filo chirurgico per legarlo, quindi asporta completamente l'ovaio con le forbici.
NOTA: È fondamentale essere delicati quando si maneggia l'ovidotto e l'utero durante la procedura, evitando una trazione eccessiva. La legatura utilizzata prima dell'ovariectomia deve essere saldamente fissata, poiché il tessuto lipidico molle attorno all'ovaio può facilmente causarne l'allentamento. Questa precauzione è necessaria per prevenire il sanguinamento postoperatorio, che potrebbe provocare la morte dei ratti. Nel gruppo sham, è stato asportato tessuto adiposo di uguale volume e dimensione adiacente all'ovaio, seguito dalla sutura del muscolo e della pelle. - Rilasciare la pinza emostatica e riportare delicatamente l'utero nella cavità addominale.
- Somministrare la penicillina alle ferite addominali dove vengono legate le ovaie e le tube di Falloppio per evitare l'infezione.
NOTA: Somministrare penicillina 80.000 unità/ratto una volta al giorno per 3 giorni consecutivi. - Suturare individualmente (misura 3-0) la pelle e gli strati muscolari (Figura 2D).
NOTA: La sterilizzazione deve essere eseguita 24-48 ore dopo l'intervento, distanziata di 1-2 giorni l'una dall'altra. - Rimetti il ratto in una gabbia igienizzata e monitoralo fino a quando non riprende completamente conoscenza dall'anestesia.
NOTA: Continuare a fornire supporto termico durante la procedura fino a quando l'animale non si è completamente ripreso dall'anestesia. - Per evitare l'infezione della ferita, somministrare ai ratti di ciascun gruppo un'iniezione intramuscolare di penicillina sodica 80.000 unità/ratto una volta al giorno per 3 giorni consecutivi26.
2. Raccolta di tessuto osseo e tessuti muscolari
NOTA: I ratti sono stati soppressi con un sovradosaggio di pentobarbital sodico (100-200 mg/kg) a 4, 8 e 12 settimane dopo l'intervento chirurgico di modellazione. Sono stati raccolti un totale di 36 campioni.
- Esporre i muscoli tricipite brachiale e quadricipite del polpaccio sinistro. Identifica e seziona attentamente questi muscoli nei loro punti di origine e punto finale per preservarne l'integrità. Successivamente, registrare e calcolare la media dei pesi umidi dei muscoli per determinare i coefficienti di peso umido dei muscoli.
NOTA: Coefficiente di peso umido del peso corporeo dell'animale e del muscolo scheletrico = peso umido del muscolo di ratto/peso corporeo. - Staccare completamente il femore tagliando la capsula articolare verso l'alto lungo il femore. Quindi, elimina il tessuto muscolare e legamentoso vicino.
3. Esame patologico
- Immergere i tessuti muscolari in un recipiente contenente una soluzione di formalina tamponata neutra al 10% per una durata di 24 ore. Successivamente, sciacquare abbondantemente i tessuti muscolari sotto l'acqua corrente per rimuovere il fissativo.
- Mettere il femore sinistro in una soluzione di paraformaldeide al 4% per 1 settimana, quindi immergerlo in una quantità sufficiente di soluzione decalcificante di acido etilendiamminotetraacetico (EDTA) per rimuovere i depositi di calcio, con il tampone che viene cambiato quotidianamente.
- Misurare i valori della densità minerale ossea utilizzando un densitometro osseo per assorbimetria a raggi X (DXA) a doppia energia. Posizionare il femore in una radiografia a doppia energia. Impostare la precisione della misurazione su Fine, regolando la modalità su Small Animal-Specific Mode, e analizzare la BMD dei femori di ratto utilizzando il software di analisi BMD in dotazione.
- Immergere il campione nella cera di paraffina. Sezionare i campioni per l'esame istologico di routine27.
4. Analisi statistica
- Presentare le variabili continue come media ±± deviazione standard (SD) e confrontare tra i due gruppi utilizzando il t-test del campione indipendente. Tutte le analisi statistiche hanno seguito un approccio bilaterale, con una significatività statistica fissata a P < 0,05. Utilizzare un software di analisi dei dati appropriato per eseguire l'analisi dei dati.
Risultati
Questo protocollo fornisce una descrizione dettagliata della procedura di ovariectomia bilaterale per stabilire un modello di osteosarcopenia nel ratto. La Figura 3 mostra una diminuzione del coefficiente di peso umido del muscolo quadricipite nel gruppo OVX rispetto al gruppo fittizio. Sebbene non vi fosse alcuna varianza statisticamente significativa nella BMD tra i due gruppi 4 settimane dopo l'intervento chirurgico, la BMD nel gruppo OVX era significativamente inferiore a quella del gruppo operato con sham a 8 e 12 settimane dopo l'intervento.
Nella Figura 4, si osserva un'atrofia significativa del muscolo tricipite brachiale nel gruppo OVX, con un gap di fibre muscolari più ampio rispetto al gruppo sham a 12 settimane dopo la modellazione. La Figura 5 dimostra che a 4 settimane dopo l'intervento, la densità trabecolare della testa del femore in entrambi i gruppi operatori OVX e sham era simile, mostrando una disposizione regolare e densa con una buona connettività. Tuttavia, entro 8 settimane dall'intervento, le trabecole nel gruppo OVX hanno iniziato a diminuire di numero, diventando scarsamente disposte con un aumento dell'area della cavità del midollo osseo. La quantità di adipociti nella cavità del midollo osseo era superiore a quella del gruppo sham. Alla 12ª settimana postoperatoria, le trabecole nell'OVX mostravano una marcata riduzione, mostrando interconnessioni incomplete, una notevole espansione nell'area della cavità del midollo osseo e una conta degli adipociti significativamente elevata rispetto al gruppo fittizio.

Figura 1: Strumenti chirurgici. (A) Porta aghi diritto. (B) Forbici maionese dritte. (C) Vassoio monouso per il cambio dei farmaci. (D) Batuffolo di cotone sterile (E) Siringhe. (F) Iodio. (G) Ago da sutura. (H) Linea di sutura. Clicca qui per visualizzare una versione più grande di questa figura.
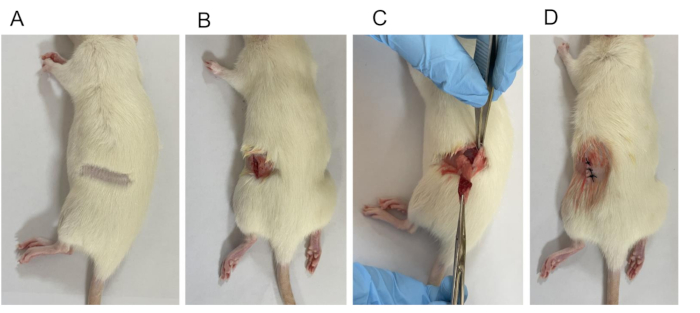
Figura 2: Istituzione del modello OVX. (A) Depilazione. (B) È stata praticata un'apertura chirurgica lunga 1 cm dalla pelle allo strato sottocutaneo. (C) Legatura che comporta la rimozione delle ovaie e di una parte delle tube di Falloppio. (D) Ferita chiusa. Clicca qui per visualizzare una versione più grande di questa figura.
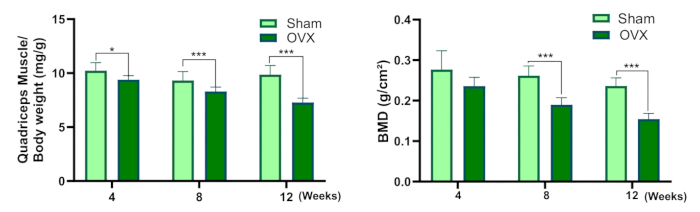
Figura 3: Quadricipite muscolo/peso corporeo e densità minerale ossea. (A) Coefficiente di peso umido dei muscoli del quadricipite. (B) Densità minerale ossea (Rispetto al gruppo sham, * P<0,05, ** P<0,01, *** P<0,001). Clicca qui per visualizzare una versione più grande di questa figura.
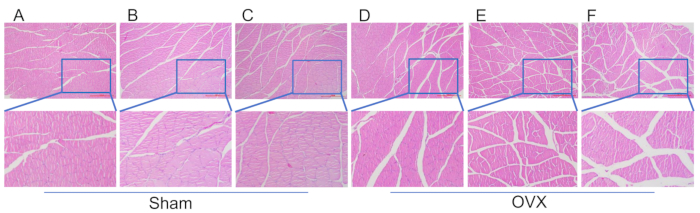
Figura 4: Colorazione HE di sezioni di tessuto dalle fibre muscolari del muscolo tricipite del polpaccio. (A) Morfologia muscolare 4 settimane dopo la procedura di modellazione nel gruppo sham. (B) Morfologia muscolare 8 settimane dopo la procedura di modellazione nel gruppo sham. (C) Morfologia muscolare 12 a seguito della procedura di modellazione nel gruppo sham. (D) Morfologia muscolare 4 settimane dopo la modellazione nel gruppo OVX. (E) Morfologia muscolare 8 settimane dopo il modellamento nel gruppo OVX. (F) Morfologia muscolare 12 settimane dopo la modellazione nel gruppo OVX. Barre di scala: 1000 μm. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 5: Colorazione HE di sezioni di tessuto dalla testa del femore. (A) Morfologia femorale 4 settimane dopo il modellamento nel gruppo sham. (B) Morfologia femorale 8 settimane dopo il modello nel gruppo sham. (C) Femorale 12 settimane dopo il modello nel gruppo fittizio. (D) Morfologia femorale 4 settimane dopo la modellazione nel gruppo OVX. (E) Morfologia femorale 8 settimane dopo il modello nel gruppo OVX. (F) Morfologia femorale 12 settimane dopo il modello nel gruppo OVX. Barre della scala: 1000 μm. (G) Area di adiposità quantificata. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Il modello animale ovariectomizzato bilaterale è fondamentale per chiarire i meccanismi alla base dell'osteosarcopenia e valutare potenziali interventi terapeutici. L'osteoporosi indotta da ovariectomia nei ratti, che rispecchia la brusca diminuzione dei livelli di estrogeni osservata nelle donne in postmenopausa, è comunemente impiegata come modello per la ricerca sull'osteoporosi. Inoltre, la ricerca ha evidenziato un'associazione significativa tra osteoporosi e sarcopenia negli individui più anziani, con concomitante perdita muscolare e ossea frequentemente osservata. Di conseguenza, numerosi studi hanno utilizzato questo modello per studiare la sarcopenia28,29. Di conseguenza, il presente studio stabilisce con successo un modello animale di osteosarcopenia.
Quando si stabilisce un modello affidabile, è necessario tenere conto di diversi fattori importanti. Un modello animale adatto deve essere caratterizzato da praticità, rilevanza e specificità30. I ratti SD sono gli animali più comunemente usati nella modellazione dell'osteoporosi. Dopo la rimozione delle ovaie, questo meccanismo di trasformazione che si verifica nelle ossa dei ratti assomiglia molto al processo di perdita ossea postmenopausale osservato nell'uomo31,32. La ricerca indica che i ratti di età compresa tra 11 settimane e 36 settimane sono ottimali per replicare i modelli di osteoporosi o sarcopenia 33,34,35,36. In termini di genere, la prevalenza dell'osteosarcopenia tra le femmine era più alta (28%) rispetto ai maschi (14%21); Pertanto, abbiamo selezionato ratti femmine. I ratti diventano sessualmente maturi a circa 6 settimane di età37, quindi abbiamo selezionato ratti di 12 settimane. Uno studio di ricerca ha rilevato che i volumi dei muscoli quadricipiti erano significativamente ridotti negli anziani rispetto agli individui più giovani, suggerendo che l'invecchiamento ha un impatto più dannoso sul volume38 del quadricipite. L'osteoporosi utilizza la densità minerale dell'osso femorale come gold standard32. Quindi, abbiamo selezionato il muscolo quadricipite e l'osso femorale.
La coerenza nella tecnica chirurgica è fondamentale, in quanto si raccomanda che lo stesso individuo esegua tutte le procedure per garantire l'uniformità nella localizzazione e nelle dimensioni dell'incisione. L'intera procedura consiste in diversi passaggi cruciali. In primo luogo, l'iniezione intraperitoneale di anestetico dovrebbe evitare di perforare gli organi interni. Prima della somministrazione del farmaco, è essenziale aspirare per assicurarsi che l'ago non sia entrato in un vaso sanguigno, spingere con precisione lo stantuffo della siringa e mantenere stabilità e velocità durante tutto il processo. In secondo luogo, identificare rapidamente l'ovaio dopo aver tagliato il peritoneo può essere impegnativo, richiedendo una comprensione completa dell'anatomia del ratto da parte dell'operatore. Una volta individuato l'ovaio, legare e rimuovere parte dell'ovidotto e dell'ovaio è un passaggio fondamentale per la sopravvivenza postoperatoria del ratto. A causa del tessuto adiposo molle vicino all'ovaio, la sutura può facilmente allentarsi dopo la legatura, causando sanguinamento e potenzialmente la morte dopo l'intervento chirurgico. Infine, prima della sutura, si raccomanda l'applicazione della penicillina al sito chirurgico, con somministrazione intramuscolare aggiuntiva 3 giorni dopo l'intervento chirurgico come misura preventiva contro l'infezione.
A seguito di procedure chirurgiche e della somministrazione di anestesia, i ratti possono provare un forte dolore o addirittura la morte, rendendo necessario il loro posizionamento in un ambiente caldo, igienico e ben ventilato fino a quando non riprendono conoscenza. Il monitoraggio vigile è indispensabile durante la prima settimana postoperatoria, con attenzione all'attività comportamentale dei ratti durante lo studio.
I vantaggi di questo modello includono la sua natura user-friendly, le efficienti capacità di modellazione, l'economicità e la capacità di imitare lo sviluppo naturale dell'osteoporosi e della perdita muscolare. Tuttavia, ci sono alcuni vincoli associati a questo modello, come il rapido declino dei livelli di estrogeni dopo l'intervento chirurgico di rimozione ovarica, con gli estrogeni che non sono riconosciuti come un contributo diretto alla sarcopenia. Il presente esperimento è stato condotto su ratti femmine e non ha coinvolto ratti maschi. Nonostante queste limitazioni, il modello animale di ovariectomia bilaterale è emerso come una risorsa preziosa per studiare la OS e esplorare le strade per l'avanzamento della malattia.
Divulgazioni
Ogni autore dichiara di non avere interessi finanziari concorrenti.
Riconoscimenti
Questo lavoro è supportato da sovvenzioni di (1) National Nature Science Foundation (82305275). (2) Programma della Fondazione provinciale per le scienze naturali del Liaoning (2022-YGJC-80 e 2022-YGJC-79). (3) Progetto di costruzione della disciplina chiave della medicina cinese di alto livello dell'Amministrazione nazionale della MTC (zyyzdxk-2023040).
Materiali
| Name | Company | Catalog Number | Comments |
| Double lion Irradiated Rodent Diet | Suzhou Shuangshi Experimental Animal Feed Technology Co., Ltd. | GB 14924.3 | Animal feed |
| Disposable medication changing tray | Yangzhou Chenglin Medical Technology Co., Ltd. | RVnpFXLc | |
| Dual Energy X-ray Bone Densitometer | Xuzhou PinyuanElectronic Technology Co., Ltd. | DXA-800E | |
| Iodine | Shanghai Likang Sterilization Hi-Tech Co., Ltd. | LK-310512 | |
| IVCs rat cage | Suzhou Monkey King Animal Experimental Equipment Technology Co., Ltd. | HH-MMB-2 | Animal barrier |
| Penicillin sodium | North China Pharmaceutical Group Limited Liability Co., Ltd. | H13020654 | |
| sodium pentobarbital | Sigma-Aldrich, St. Louis, MO | P3761-5G | |
| Sterile cotton ball | Henan Piaoan Group Co., Ltd | 20140017 | |
| Straight Mayo scissors | Shenzhen Huayang Biotechnology Co., Ltd. | 18-0410 | |
| Straight needle holder | Shanghai Simplicity Biotechnology Co., Ltd. | 32100-14 | |
| Suture line | Shenzhen Huayang Biotechnology Co., Ltd. | 18-5902 | |
| Suture needle | Shenzhen Huayang Biotechnology Co., Ltd. | 18-5036 | |
| Syringes | Shenzhen Huayang Biotechnology Co., Ltd. | 21-3021 |
Riferimenti
- Binkley, N., Buehring, B. Beyond FRAX®: It's time to consider "Sarco-Osteopenia. J Clin Densitom. 12 (4), 413-416 (2009).
- Hirschfeld, H. P., Kinsella, R., Duque, G. Osteosarcopenia: where bone, muscle, and fat collide. Osteoporos Int. 28 (10), 2781-2790 (2017).
- Kaplan, S. J., et al. Association of radiologic indicators of frailty with 1-year mortality in older trauma patients. JAMA Surg. 152 (2), e164604 (2017).
- Nielsen, B. R., Abdulla, J., Andersen, H. E., Schwarz, P., Suetta, C. Sarcopenia and osteoporosis in older people: a systematic review and meta-analysis. Eur Geriatr Med. 9 (4), 419-434 (2018).
- Cruz-Jentoft, A. J., et al. Sarcopenia: European consensus on definition and diagnosis: Report of the European Working Group on sarcopenia in older people. Age Ageing. 39 (4), 412-423 (2010).
- Polito, A., Barnaba, L., Ciarapica, D., Azzini, E. Osteosarcopenia: A narrative review on clinical studies. Int J Mol Sci. 23 (10), 5591 (2022).
- Pourhassan, M., et al. Three-year mortality of older hospitalized patients with osteosarcopenia: Data from the OsteoSys study. Nutrients. 16 (9), 1328 (2024).
- Salech, F., et al. Osteosarcopenia predicts falls, fractures, and mortality in Chilean community-dwelling older adults. J Am Med Dir Assoc. 22 (4), 853-858 (2021).
- Yoo, J. I., Ha, Y. C. Review of epidemiology, diagnosis, and treatment of osteosarcopenia in Korea. J Bone Metab. 25 (1), 1-7 (2018).
- Inoue, T., et al. Related factors and clinical outcomes of osteosarcopenia: A narrative review. Nutrients. 13 (2), 291 (2021).
- Teng, Z., et al. The analysis of osteosarcopenia as a risk factor for fractures, mortality, and falls. Osteoporos Int. 32 (11), 2173-2183 (2021).
- Scheuren, A. C., et al. Hallmarks of frailty and osteosarcopenia in prematurely aged PolgA(D257A/D257A) mice. J Cachexia Sarcopenia Muscle. 11 (4), 1121-1140 (2020).
- Gasparini, S. J., et al. Continuous corticosterone delivery via the drinking water or pellet implantation: A comparative study in mice. Steroids. 116, 76-82 (2016).
- Pal, S., et al. A butanolic fraction from the standardized stem extract of Cassia occidentalis L delivered by a self-emulsifying drug delivery system protects rats from glucocorticoid-induced osteopenia and muscle atrophy. Sci Rep. 10 (1), 195 (2020).
- Mito, T., et al. Mitochondrial DNA mutations in mutator mice confer respiration defects and B-cell lymphoma development. PLoS One. 8 (2), e55789 (2013).
- Thomsen, J. S., et al. Cancellous bone structure of iliac crest biopsies following 370 days of head-down bed rest. Aviat Space Environ Med. 76 (10), 915-922 (2005).
- Papadopoulou, S. K., et al. Exercise and nutrition impact on osteoporosis and sarcopenia-The incidence of osteosarcopenia: A narrative review. Nutrients. 13 (12), 4499 (2021).
- Du, F., et al. A hind limb disuse model inducing extensor digitorum longus atrophy in rats: tail suspension-immobilization. Aviat Space Environ Med. 82 (7), 689-693 (2011).
- Gomes, R. M., et al. Strength training reverses ovariectomy-induced bone loss and improve metabolic parameters in female Wistar rats. Life Sci. 213, 134-141 (2018).
- Ma, J., et al. Establishment of a rat model of osteosarcopenia. Chin J Osteoporos. 28 (1), 1-5 (2022).
- Huang, T., et al. Prevalence and risk factors of osteosarcopenia: a systematic review and meta-analysis. BMC Geriatr. 23 (1), 369 (2023).
- Qi, H., et al. mineral density and trabecular bone score in Chinese subjects with sarcopenia. Aging Clin Exp Res. 31 (11), 1549-1556 (2019).
- Shu, H., et al. An integrated study of hormone-related sarcopenia for modeling and comparative transcriptome in rats. Front Endocrinol. 14, 1073587 (2023).
- Nakaoka, K., Yamada, A., Noda, S., Goseki-Sone, M. Influence of dietary vitamin D deficiency on bone strength, body composition, and muscle in ovariectomized rats fed a high-fat diet. Nutrition. 60, 87-93 (2019).
- Chong, L., Xiaonan, Q., Hao, Z., Xiaosheng, Y. Castration method was used to construct a rat model of kidney-yang deficiency sarcopeniaosteoporosis and explore the mechanism. Chin Arch Tradit Chin Med. , (2024).
- Ma, X., et al. (S)-10-hydroxycamptothecin inhibits EMT-evoked osteosarcoma cell growth and metastasis by activating the HIPPO signaling pathway. Combin Chem High Throughput Screen. 27 (15), 2239-2248 (2024).
- Yamazaki, I., Yamaguchi, H. Characteristics of an ovariectomized osteopenic rat model. J Bone Miner Res. 4 (4), 13-22 (1989).
- Lee, H., et al. MiR-141-3p promotes mitochondrial dysfunction in ovariectomy-induced sarcopenia via targeting Fkbp5 and Fibin. Aging (Albany NY). 13 (4), 4881-4894 (2021).
- China, S. P., et al. Globular adiponectin reverses osteo-sarcopenia and altered body composition in ovariectomized rats. Bone. 105, 75-86 (2017).
- Rodgers, J. B., Monier-Faugere, M. C., Malluche, H. Animal models for the study of bone loss after cessation of ovarian function. Bone. 14 (3), 369-377 (1993).
- Matsushita, M., et al. Age-related changes in bone mass in the senescence-accelerated mouse (SAM). SAM-R/3 and SAM-P/6 as new murine models for senile osteoporosis. Am J Pathol. 125 (2), 276-283 (1986).
- Cheng, M., et al. A traditional Chinese herbal preparation, Er-Zhi-Wan, prevent ovariectomy-induced osteoporosis in rats. J Ethnopharmacol. 138 (2), 279-285 (2011).
- Roch, P. J., et al. Ostarine and ligandrol improve muscle tissue in an ovariectomized rat model. Front Endocrinol. 11, 556581 (2020).
- Bei, M. J., et al. Raloxifene retards cartilage degradation and improves subchondral bone microarchitecture in ovariectomized rats with patella baja-induced - patellofemoral joint osteoarthritis. Osteoarthritis Cartilage. 28 (3), 344-355 (2020).
- Wen, K., et al. Fecal and serum metabolomic signatures and microbial community profiling of postmenopausal osteoporosis mice model. Front Cell Infect Microbiol. 10, 535310 (2020).
- Shah, F. A., Stoica, A., Cardemil, C., Palmquist, A. Multiscale characterization of cortical bone composition, microstructure, and nanomechanical properties in experimentally induced osteoporosis. J Biomed Mater Res A. 106 (4), 997-1007 (2018).
- Andreollo, N. A., Santos, E. F., Araújo, M. R., Lopes, L. R. Rat's age versus human's age: what is the relationship. Arq Bras Cir Dig. 25 (1), 49-51 (2012).
- Fuchs, C. J., et al. Thigh muscles are more susceptible to age-related muscle loss when compared to lower leg and pelvic muscles. Exp Gerontol. 175, 112159 (2023).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon
Utilizziamo i cookies per migliorare la tua esperienza sul nostro sito web.
Continuando a utilizzare il nostro sito web o cliccando “Continua”, accetti l'utilizzo dei cookies.