Method Article
Mikroglia Gelişimi ile İnsan Beyni Organoidinin Türetilmesi
Bu Makalede
Özet
İndüklenmiş pluripotent kök hücre (iPSC) türevi hematopoietik progenitör hücreleri (HPC'ler) organoid gelişimine dahil ederek yerleşik mikroglialı bir insan beyni organoidi oluşturmak için bir protokol sunuyoruz.
Özet
İndüklenmiş pluripotent kök hücrelerden (iPSC) türetilen üç boyutlu (3D) beyin organoid kültürleri, insan beyninin gelişimini ve nörolojik hastalıkların patogenezini incelemek için in vitro önemli bir alternatif sağlar. Bununla birlikte, insan beyni organoidlerine mikroglia'nın dahil edilmemesi, nöroinflamasyonun 3D modelleri için hala büyük bir engeldir. Mevcut yaklaşımlar, ya tamamen farklılaşmış mikroglia'nın olgun beyin organoidlerine dahil edilmesini ya da iPSC'den türetilmiş embriyoid cisimciklerinin (EB'ler) erken evresinden mikroglial farklılaşmanın indüklenmesini içerir. İlk yaklaşım, mikroglial farklılaşmanın bitişik nöral çevre ile etkileşime girdiği aşamayı kaçırır ve daha sonraki yaklaşım teknik olarak zordur, bu da mikroglia miktarı ve kalitesi açısından nihai organoidler arasında tutarsızlığa neden olur. Mikroglial ve nöronal gelişim arasındaki erken etkileşimleri incelemek için beyin organoidlerini mikroglia ile modellemek için, insan iPSC'lerinden farklılaşan oldukça saf hematopoietik progenitör hücreler (HPC), beyin organoidleri yapmak için iPSC'den türetilmiş EB'lere dahil edildi. İmmün boyama ve tek hücreli RNA dizileme (sc-RNA-dizilimi) analizini kullanarak, HPC'lerin 3D organoidlere dahil edildiğini ve sonunda hem mikroglia hem de nöronlarla beyin organoidlerine dönüştüğünü doğruladık. HPC'leri olmayan beyin organoidleri ile karşılaştırıldığında, bu yaklaşım beyin organoidlerinde önemli mikroglial birleşme sağlar. Hem mikroglial hem de nöral gelişim özelliklerinden oluşan bu yeni 3D organoid model, doğuştan gelen bağışıklık ve sinir sistemi gelişimi arasındaki erken etkileşimleri incelemek için ve potansiyel olarak nöroinflamasyon ve nöroenfeksiyöz bozukluklar için bir model olarak kullanılabilir.
Giriş
Mikroglia, beyinde bulunan ve hem beyin gelişiminde hem de homeostazda kritik rol oynayan yerleşik bağışıklık hücreleridir 1,2. Mikroglia'nın aktivasyonu, proinflamatuar faktörlerin, yüksek fagositozun ve istilacı patojenleri ve tehlikeye atılmış hücreleri ortadan kaldıran reaktif oksidatif stresin üretilmesine neden olur. Bununla birlikte, mikroglia'nın aşırı aktivasyonu veya uzun süreli aktivasyonu, Parkinson hastalığı da dahil olmak üzere birçok nörolojik bozuklukta patogenez mekanizması olarak nörodejenerasyona neden olabilir 3,4. Mikroglia'nın insan nörolojik bozukluklarını incelemek için ilgili modellere dahil edilmesi önemlidir. Son yıllarda, insan kök hücreleri, hayvan modellerine ve insan denek çalışmalarına alternatif olarak in vitro modeller olarak 3D organoidler geliştirmek için kullanılmaktadır5. İdeal olarak, insan organoidleri, insan fizyolojisini ve patogenezini hayvan modellerinden daha iyi temsil eden, ancak doğrudan insan bireyleri üzerinde yapılan çalışmalarda yer alan etik kaygılar olmadan, karşılık gelen insan organlarına benzer çoklu hücre tipleri ve doku yapıları oluşturur. Patogenez ve ilaç geliştirme çalışmaları ve bireyselleştirilmiş tedavilerin rehberliği için insan hastalık modellemesinin geleceğini temsil edebilirler6. Örnek olarak, insan kaynaklı pluripotent kök hücrelerden (iPSC'ler) türetilen 3D insan beyni organoidleri, ZIKA, SARS-CoV-27 dahil olmak üzere nöral bulaşıcı hastalıkları ve amyotrofik lateral skleroz (ALS) ve Alzheimer hastalığı 8,9 dahil olmak üzere nörodejeneratif hastalıkları modelleyerek sinirbilim araştırmaları alanında hakim olmuştur. Bununla birlikte, nöronal farklılaşmayı indüklemek için çift SMAD inhibisyonu kullanan geleneksel 3D nöral organoidler 10, nöronların11,12'den olduğu nöroektoderm soyu yerine kandan alınan progenitörlerden türetildikleri için mikrogliadan yoksun beyin organoidleri üretir. Mikroglia varlığı olmadan, organoidler CNS enfeksiyonlarını, iltihabı ve ilişkili nörodejenerasyonu modellemek için yetersizdir.
Bu kritik konuyu ele almak için, farklılaşmış mikroglia'yı beyin organoidlerine13 dahil etmek veya çift SMAD inhibisyonu13 yerine alternatif yaklaşımlar kullanarak organoidler içinde mikroglial farklılaşmayı indüklemek için girişimlerde bulunulmuştur. Bununla birlikte, farklılaşmış mikroglia'yı beyin organoidlerine dahil ederek, nöronal ve mikroglial gelişim arasındaki erken etkileşimler gözden kaçar. Bu, CNS gelişiminde veya ZIKA virüsü enfeksiyonu14 gibi bebek beyin gelişimini hedef alan nöroenfeksiyöz bozuklukların patogenezinde önemli olabilir. Öte yandan, iPSC'den türetilmiş beyin organoidleri içindeki doğuştan gelen mikroglia'nın aralıklı aşamalar olmadan ayırt edilmesi, uzun süreli bir süreci içerir ve son ürünler içinde daha yüksek değişkenliğe sahiptir15. Bildirilen bu protokolde, iPSC'den türetilen hematopoietik progenitör hücreleri (HPC'ler), hem nöronlar hem de mikroglia dahil olmak üzere 3D organoidlere daha da farklılaşan embriyoid cisimcikleri (EB'ler) yapmak için iPSC'lere dahil ettik.
Protokolümüz, erken nöron-mikroglial etkileşimleri içeren insan merkezi sinir sistemini ve nöral enfeksiyöz bozuklukların patogenezini ve mikroglial aktivasyonu içeren nöroinflamasyonu incelemek için benimsenebilecek kolay bir yaklaşım sunmaktadır.
Protokol
Sağlıklı yetişkin donörlerden alınan orijinal kan örnekleri NIH Transfüzyon Tıbbı Kan Bankası'nda toplandı ve NIH Kurumsal İnceleme Kurulu'na uygun olarak imzalı bilgilendirilmiş onam formları alındı.
1. İnsan iPSC'lerinden hematopoietik progenitör hücrelerin (HPC'ler) üretilmesi
NOT: Temsili sonuçları üretmek için insan iPSC hücreleri 510 ve 507 kullanıldı. iPSC'lerin üretim ve bakım yöntemleri önceki bir yayındabulunabilir 16.
- 0. Gün: DMEM / F12 ortamında seyreltilmiş 500 μL / kuyu buz gibi soğuk Matrigel (bazal membran matrisi [BMM]) çözeltisi ekleyerek 12 oyuklu bir hücre plakasını kaplayın ve oda sıcaklığında (RT) en az 30 dakika inkübe edin.
- Kaplama süpernatantını tamamen çıkarın ve oyuk başına 1 mL E8 Flex ortamı ile değiştirin.
- iPSC'lerin yüksek kalitede olduğunu ve farklılaşma belirtisi olmadığını doğrulamak için mikroskop altında 6 oyuklu bir plakadaki iPSC kültürünü kontrol edin. Plakanın alt kısmının altında bir işaretleyici kalemle işaretleyerek orta büyüklükte bir koloni seçin.
- Ortamı iPSC kültüründen çıkarın ve kuyucuğa 500 μL etilendiamintetraasetik asit (EDTA) iPSC ayrışma tamponu (0.5 mM EDTA, DPBS'de 0.45 g/L NaCl) ekleyin.
- Koloninin kenarlarından üç ila dört sıra hücre küçülmeye başladığında ve hücreler arasında boş alan göründüğünde hücre ayrışması belirtileri için mikroskop altında gözlemleyin. Bu genellikle 1-3 dakika sürer.
- EDTA çözeltisini tamamen atın. 1 mL E8 Flex ortamını kuvvetlice ve doğrudan üzerine pipetleyerek işaretli iPSC kolonisini yerinden çıkarın. 1-3 kez pipetlemeden sonra koloninin her biri 20-50 hücre içeren hücre yamalarına tamamen ayrıldığından emin olun.
- Süpernatan içeren hücre yamalarını toplayın ve 12 oyuklu plakadaki kaplanmış oyukların ilk oyuğuna ekleyin.
- Kuyuyu bir veya iki kez pipetleyerek karıştırın ve 1 mL hücreyi 1 mL ortam içeren ikinci kuyucuğa aktarın.
- Toplam dört kuyucukta seri seyreltilmiş iPSC kültürleri yapmak için adım 1.8'i iki kez tekrarlayın.
- Plakayı 37 °C, %5 CO2 inkübatörde inkübe edin.
- 24 saat sonra, 1. günde, mikroskop altında kolonileri kontrol edin ve bir kuyudaki tüm tarlalardan sürekli olarak geçerek koloni sayılarını sayın. 10-20 iPSC kolonisi içeren bir kuyu seçin.
- Ortamı hematopoietik Kitten 1 mL ortam A ile değiştirin. Plakayı 48 saat boyunca inkübatöre geri koyun.
- 3. günde, 500 μL kullanılmış ortamı çıkarın ve 500 μL taze ortam A ekleyin.
- 4. günde, mikroskop altında gözlemleyin ve iPSC kolonilerinden önemli hücre büyümesi ve farklılaşması fark edin. Ortamı 1 mL ortam B ile değiştirin.
- Mikroskop altında hücre farklılaşmasını izleyin ve her gün 500 μL Orta B ile yarı-orta değişim yapın. HPC benzeri hücreler 6-7. günlerde ortaya çıkar.
- 10. günde, mikroskop altında, ortamda yüzen normal HPC'lerin morfolojisine sahip veya bazı gevşek hücre agregatları ile düz hücrelerin tek alt tabakasına gevşek bir şekilde bağlanmış parlak tek yuvarlak hücreleri gözlemleyin.
NOT: Farklılaştırılmış HPC'ler, karakterizasyon veya daha fazla deney için toplanmaya hazırdır. - Hücre agregalarını kırmak ve HPC'leri plaka yüzeyinden ayırmak için 1 mL'lik bir pipet ucu kullanarak üç kez yukarı ve aşağı pipetleyerek tüm farklılaşmış HPC'leri toplayın.
- Hücreleri 15 mL'lik bir tüpe ekleyin ve hücreleri 5 dakika boyunca 300 x g'da santrifüjleyin. Süpernatanı çıkarın ve hücre peletini 1 mL ortam B'ye yeniden süspanse edin.
- Hücreleri sayın ve konsantrasyonu 1 milyon hücre / mL'ye ayarlayın. Bu aşamada, 1 milyondan fazla HPC üretilir. Akış sitometrisi ile kontrol edildiğinde, saflığın CD34 + / CD43 + içeren hücrelerin% 85'inden fazla olduğundan emin olun. Önemli ölü hücrelerin (% 5'ten fazla) fark edilmediğinden emin olun.
2. Karışık iPSC'lerden ve HPC'lerden embriyoid cisimlerin geliştirilmesi
- HPC'lerin toplandığı aynı gün, bir iPSC kültürünün de 6 oyuklu bir plakadaki bir kuyucukta (veya 12 oyuklu bir plakadaki iki kuyucukta) %80 birleşmeye ulaştığından emin olun.
- EB oluşumu için mikrokuyu kültür plakasının bir kuyusunu, kabarcıkları en aza indirmek için ekleyerek 500 μL yapışma önleyici durulama solüsyonu ile işlemden geçirin.
- Olası kabarcıkları gidermek için plakayı plaka tutucularla donatılmış sallanan bir kova rotorunda 5 dakika boyunca 2000 x g'da döndürün.
- Durulama solüsyonunu pipetleyerek tamamen çıkarın ve kuyucukları kabarcık oluşturmadan 1 mL DPBS ve ardından 1 mL DMEM/F12 ile iki kez yıkayın.
- Hücreleri 1 mL Accutase çözeltisi ile muamele ederek iPSC'leri plakadan ayırın.
- Hücreler ayrılma belirtileri gösterene ancak hala dibe bağlı olana kadar mikroskop altında gözlemleyin. Bu genellikle Accutase tedavisinden 1-3 dakika sonra olur. iPSC'leri aşırı sindirmeyin.
- Accutase solüsyonunu hücreleri rahatsız etmeden tamamen çıkarın ve kuyucuklara 1 mL DMEM / F12 ortamı ekleyin. Ayrıca, 1 mL'lik bir uç kullanarak birkaç kez yukarı ve aşağı pipetleyerek hücreleri tek hücrelere ayırın.
- Hücreleri 15 mL'lik bir tüpe toplayın ve DMEM / F12 ortamı ile 5 mL'ye doldurun. Hücreleri 5 dakika boyunca 300 x g'da döndürün.
- Süpernatanı pipetleyerek çıkarın ve hücreleri 1 mL E8 Flex ortamında yeniden süspanse edin. Hücreleri sayın ve hücre konsantrasyonunu E8 Flex ortamında mL başına 1 milyon hücreye ayarlayın.
- 1 milyon iPSC (1 mL) ve yarım milyon HPC (500 μL) ekleyerek iPSC'leri HPC'lerle 2:1 oranında karıştırın. Tüm karışık hücreleri, mikrokuyu kültür plakasının önceden işlenmiş kuyucuğuna ekleyin.
- Süpernatanıma 1 mL ortam başına 1 μL Kaya inhibitörü Y27632 stok çözeltisi (1 mM) ekleyin. Hücreleri eşit şekilde dağıtmak için plakayı birkaç kez bir yandan diğer yana sallayın.
- Mikrokuyu kültür plakasını, plaka tutucularla donatılmış sallanan bir kova rotorunda 5 dakika boyunca 300 x g'da döndürün. Hücrelerin mikro kuyulara yerleşip yerleşmediğini görmek için mikroskop altında gözlemleyin. (Ek Şekil 1A).
- Hücreleri rahatsız etmeden, plakayı 37 °C,% 5 CO2 hücre inkübatörüne koyun.
- 2. günde, 48 saat sonra, EB'lerin oluşumu için mikroskop altında hücreleri gözlemleyin. EB'ler net bir şekilde oluştuğunda, bir sonraki adıma geçin (Ek Şekil 1B).
- Düşük bir bağlantı plakası yapmak için 24 oyuklu bir hücre kültürü plakasını yapışma önleyici durulama tamponu (500 μL) ile 15 dakika boyunca tedavi edin.
- Durulama tamponunu tamamen çıkarın ve kuyucukları 1 mL DPBS ile iki kez yıkayın, ardından kuyucuklara 1 mL E8 Flex ortamı ekleyin.
- EB'leri mikrokuyu kültür plakasında 1 mL genişliğinde delikli bir pipet ucu ile birkaç kez pipetleyerek yeniden süspanse edin.
- Düşük yapışma ile muamele edilmiş 24 kuyucuk plakasının her bir oyuğu için, EB'ler içeren 100 μL ortam toplayın ve ekleyin. Bu, kuyu başına 10-20 EB ile sonuçlanacaktır. Kalan EB'leri yedek olarak içeren eski kuyuya E8 Flex medium'u ekleyin.
- Plakayı 37 °C,% 5 CO2 hücreli inkübatörde 48 saat inkübe edin.
3. 3D nöral organoid indüksiyon, proliferasyon ve olgunlaşma
- EB oluşumundan sonraki 2. günde, BMM'nin alikotlarını buz üzerinde en az 30 dakika boyunca çözdürün.
- Önceden soğutulmuş 20 μL'lik bir uç kullanın ve EB'leri kaplamak için ortamın üzerine akıllıca 15 μL buz gibi BMM damlası ekleyin. Bu, EB'lerin bağlanacağı ve üzerine büyüyeceği bir BMM filmi yapar.
- Plakayı 37 °C,% 5 CO2 hücreli inkübatöre koyun.
- 4. günde, EB oluşumundan sonra, EB'leri atmadan 500 μL ortamı dikkatlice çıkarın ve adım 3.2'yi izleyerek BMM kaplamasını tekrarlayın.
- Hücrelerin üzerine 500 μL PSC Nöral İndüksiyon Ortamı ekleyerek hemen nöral indüksiyonu başlatın.
- 6. ve 8. günlerde, hücrelere dokunmadan 500 μL ortamı dikkatlice çıkararak ve 500 μL nöral indüksiyon ortamı ekleyerek yarı orta değişim gerçekleştirin.
- 10, 12 ve 14. günlerde, nöral kök hücre (NSC) ortamı ile yarı orta değişim gerçekleştirin: Nakavt DMEM / F12 + 1x Glutamax takviyesi + 1x Nöral takviye + bFGF + EGF.
- 15. günde, orta dereceli kürelerin tamamını, daha önce tarif edildiği gibi yapışma önleyici durulama çözeltisi ile muamele edilmiş yeni bir 12 oyuklu plakaya aktarın. Kültürün üzerine 500 μL nöronal olgunlaşma ortamı (DMEM/F12 + 1x N2 takviyesi + 1x B27 takviyesi + 1x antibiyotik-antimikotik) ekleyin.
- Her gün nöronal olgunlaşma ortamı ile yarı-orta değişim yapın.
- Olgunlaşma aşamasında, ortamın renk değişimi gibi beslenme tükenmesi belirtileri varsa, organoidi oyuk başına 3 mL'ye kadar ortam tutan 6 oyuklu plakaya taşıyın.
- İsteğe bağlı olarak, EB oluşumundan 17 gün sonra, mikroglial olgunlaşmayı kolaylaştırmak için olgunlaşma ortamını 6 gün boyunca sitokinlerle (IL-34, M-CSF, TGF-β1, CD200, CX3CL1) destekleyin.
- 23. günde, karakterizasyon veya daha ileri deneyler için elde edilen nöral organoidleri toplayın.
4. 3D nöral organoidlerin temizlenmesi ve immün boyanması
- 24 saat boyunca 4 ° C'de 1 mL %4 paraformaldehit (PFA) içine daldırarak 10'a kadar organoidi sabitleyin.
- Organoidleri oyuk başına 96 oyuklu şeffaf bir alt plakaya aktarın ve 200 μL DPBS ile her seferinde 1 saat boyunca 2 kez hafifçe çalkalayarak yıkayın.
- Organoidleri DPBS'de %50 metanol, çift damıtılmış (dd) suda %80 metanol ve %100 kuru metanol içinde her biri 10 dakika boyunca 4 °C'de hafifçe çalkalayarak geçirgen hale getirin.
- Organoidleri seri olarak %20 DMSO / metanol,% 80 metanol dd suda,% 50 metanol DPBS'de,% 100 DPBS'de, daha sonra% 0.2 Triton X-100 ile DPBS'de, her biri 10 dakika boyunca 4 ° C'de hafifçe çalkalayarak yıkayın. Her yıkamadan sonra kalan tamponu tamamen çıkarmak için çaba gösterin.
- RT'de 40 dakika boyunca hafifçe çalkalayarak geçirgen tamponda (% 0.2 Triton X100, 0.3 M glisin ve% 20 DMSO ile DPBS) inkübe edin.
- 37 ° C'de 1 saat boyunca 80 rpm'de bir çalkalayıcı üzerinde hafifçe çalkalayarak bloke edici tamponu (% 0.2 Triton X100,% 6 Keçi serumu ve% 10 DMSO ile DPBS) bloke edin.
- Antikor seyreltme tamponunda antikorlarla inkübe edin (IBA1 1:100, TREM2 1:100, βIII-tubulin, 1:1000, 100 μL / kuyu DPBS'de %0.2 Tween 20, 100 μg/mL Heparin, %3 Keçi serumu ve %5 DMSO) 37 ° C'de 2 saat veya 3 gün boyunca 80 rpm'de hafifçe çalkalama ile soğuk odada.
- DPBS ile %0,2 Tween 20, 100 μg/mL Heparin ile 5 kez, her biri RT'de 10 dakika süreyle 80 rpm'de bir çalkalayıcı üzerinde hafifçe çalkalayarak yıkayın.
- İkincil antikor (1:200 keçi anti-fare Alexa488) ile 37 ° C'de 1 saat inkübe edin, ardından gece boyunca 80 rpm'de bir çalkalayıcı üzerinde hafifçe çalkalayarak RT yapın.
- Nükleer kontrast boyama için, DAPI boyamayı antikor inkübasyonu ile birlikte veya bir yıkama tamponunda gerçekleştirin.
- Organoidleri yıkama tamponunda 10 kez, her seferinde 10 dakika 37 °C'de hafifçe çalkalayarak yıkayın.
- Mikroskop altında gözlemleyin. Arka plan hala yüksekse, 5 kez yıkamaya devam edin.
- Süpernatanı mümkün olduğunca atın. 200 μL organoid temizleme solüsyonu ekleyin ve gözlemden önce 5 dakika inkübe edin ve konfokal mikroskop kullanarak görüntü alın.
Sonuçlar
Protokolümüz, HPC'leri iPSC'lerden ayırmak ve ardından EB'ler yapmak için HPC'leri iPSC'lerle karıştırmak, ardından nöral indüksiyon, farklılaşma ve olgunlaşmak için bir şema izler (Şekil 1). Yüksek kaliteli HPC farklılaşması, EB oluşumunun ve daha sonra organoid farklılaşmasının başarısı için kritik öneme sahiptir. HPC farklılaşmasını başlatmak için uygun sayıda ve boyutta iPSC kolonileri üretmek için bir seri seyreltme kültürü tekniği kullanılır (Şekil 2A). Normalde, iPSC kolonileri, Ortam A'da kültürün sonunda önemli morfolojik değişikliklere uğrayacaktır (Şekil 2B) ve Ortam B'de (Şekil 2C) 3 gün sonra, kültür kaplarının hemen üzerinde yüzen veya dibine bağlı homojen yuvarlak hücreler olarak HPC farklılaşması gösterecektir. HPC, koloni benzeri hücre kümeleri oluşturmak için genişleyebilir (Şekil 2D). HPC'ler, önemli kalıntı göstermeden 10. günde baskındır (Şekil 2E). Yüksek kaliteli HPC ve iPSC karışımı, 24 saat içinde EB oluşumuna neden olur ve bu da minimum hücre kalıntısı ile büyümeye devam eder (Şekil 3A). Aşırı döküntü içeren düşük kaliteli HPC'ler EB oluşumunda zorluğa neden olabilir. EB'ler yeni bir plakaya aktarıldıktan sonra büyümeye devam ettiler ve sonunda olgunlaşma ortamında bir platoya ulaştılar (Şekil 3B). EB'ler, mikroglial sitokinlerle tedavi edilmiş (Şekil 4) veya tedavi edilmeden (Şekil 5) IBA1 ve TREM2 pozitif mikroglia içeren organoidlere farklılaşacaktır. Mikroglial büyüme sitokinleri ile tedavi, TMEM119 spesifik mikroglia sayısını artırabilir (Şekil 6). Temsili organoidler, klerens ve immün boyamadan sonra hem βIII-tubulin pozitif nöronları hem de IBA1-pozitif mikroglia gösterir (Şekil 7). Lipopolisakkarit (LPS) ile tedavi edildiğinde, mikroglial spesifik belirteçler ve proinflamatuar gen aktivasyonu ile mikroglial aktivasyonda bir artış gözlenebilir (Şekil 8). Ek Şekil 2, ek mikroglial sitokinler olmadan kültürlenen organoidlerdeki IBA-1 ve TMEM-119 pozitif hücreleri göstermektedir.
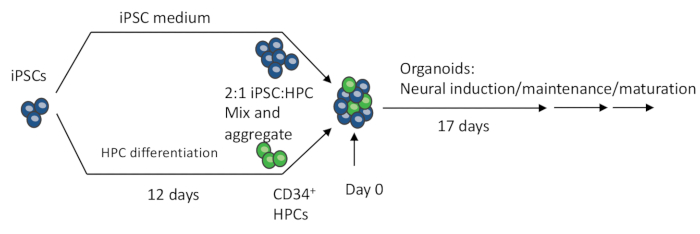
Şekil 1: iPSC'lerden 3D organoid yapmanın şematik prosedürleri. EB'ler, iPSC'lerin ve iPSC ile farklılaştırılmış HPC'lerin karıştırılmasıyla yapılır. EB'ler ayrıca hem nöronları hem de mikrogliaları içeren organoidler üretmek için nöral indüksiyon, farklılaşma ve olgunlaşmaya uğrar. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: iPSC'lerden HPC'lere tipik morfolojik değişiklikler. (A) iPSC kolonisi, (B) Orta A tedavisinin sonunda, (C) Orta B'de 3 gün, (D) Orta B'de 10. gün ve (E) elde edilen yüzen HPC'ler için temsili görüntüler gösterilmiştir. Görüntüler, 10x veya 4x objektif ile bir floresan mikroskobu altında çekildi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
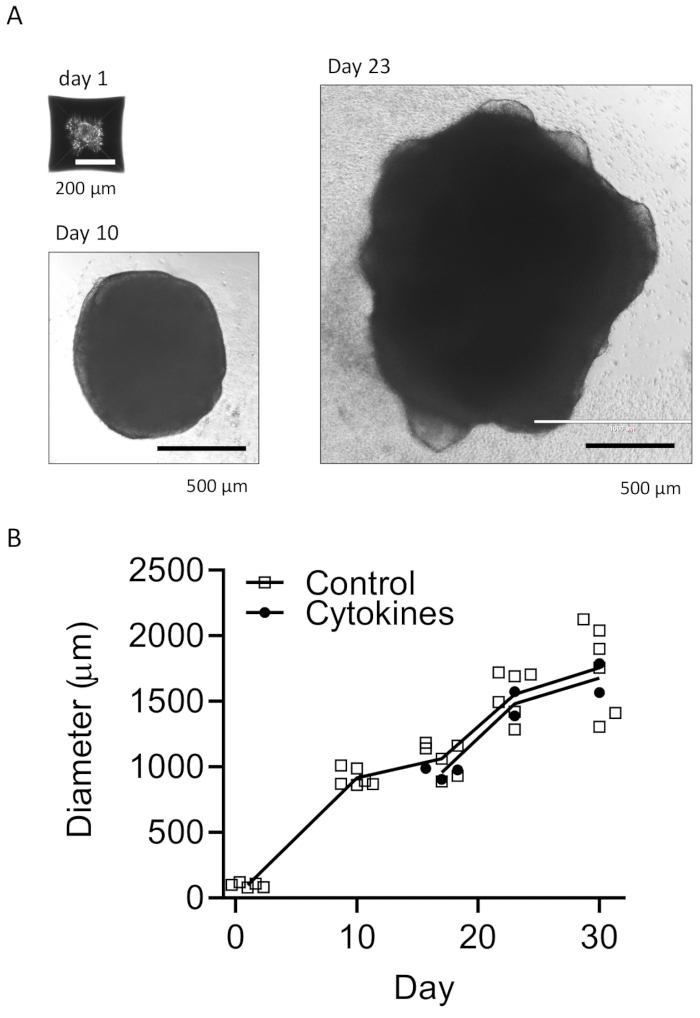
Şekil 3: EB'ler ve olgun organoidler geliştirin. (A) Temsili fotoğraflar EB oluşumunu (1. gün), organoid büyümesini (10. gün) ve olgunlaşmayı (23. gün) göstermektedir. Mikroglial farklılaşma sitokinleri (B) olan veya olmayan organoidlerin boyutları için bir büyüme eğrisi gösterilmiştir. Görüntüler floresan mikroskobu altında 10x veya 4x objektif ile çekildi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
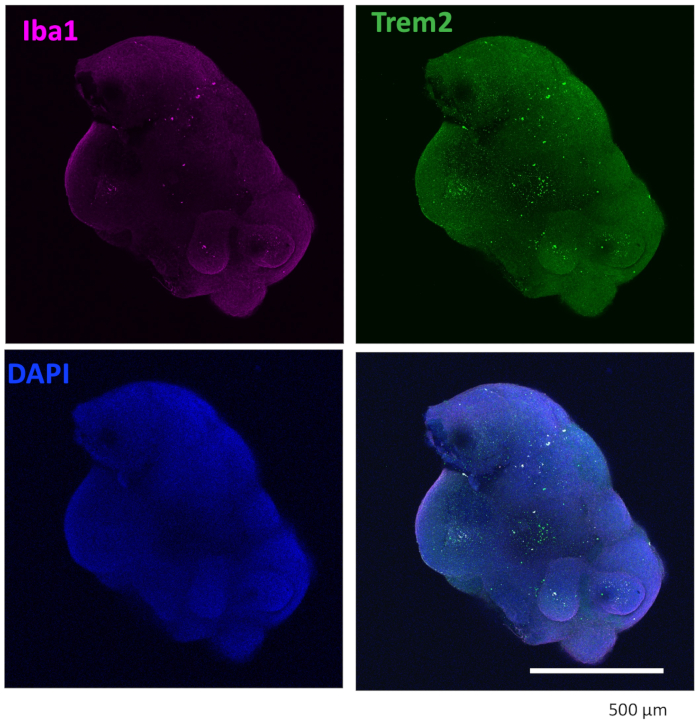
Şekil 4: Mikroglial farklılaşma sitokinleri ile kültürlenen organoidler mikroglia içerir. Klerens ve immün boyamadan sonra, organoid mikroglia'nın hem IBA1 hem de TREM2 ile pozitif olarak boyandığını gösterdi. Konfokal mikroskobun 10x objektifi altında çekilen görüntüler gösterilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
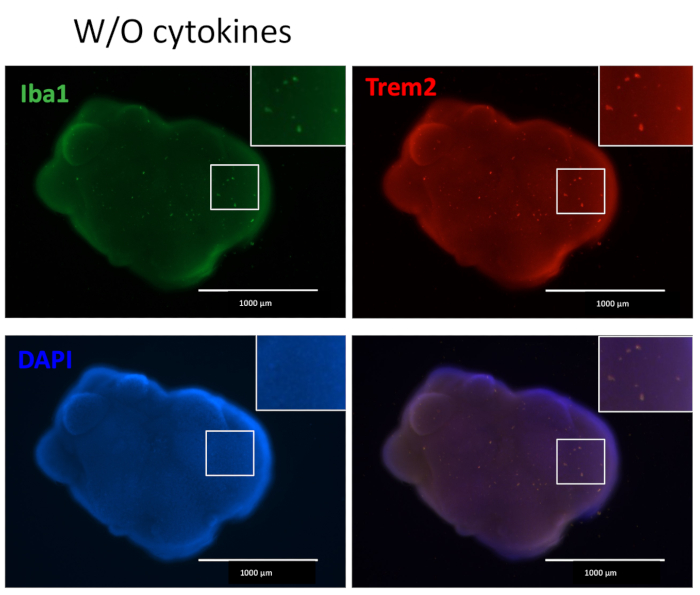
Şekil 5: Ek mikroglial farklılaşma sitokinleri olmadan kültürlenen organoidler mikroglia içerir. Harici mikroglial farklılaşma sitokinlerinin eklenmesi olmadan, organoidler hala hem IBA1 hem de TREM2 ile boyanmış mikroglia pozitif üretti, bu da organoiddeki nöronal gelişimin mikro ortamının HPC'leri mikrogliaya ayırt etmek için yeterli olduğunu gösterir. Görüntüler floresan mikroskobu altında 4x objektif ile çekildi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 6: 3D organoidler içeren mikroglia'nın tek hücreli RNA-seq sonucu. (A) Grafikler, ek mikroglial farklılaşma sitokinleri olmadan bir organoidde IBA1 (AIF1), TMEM119 ve MAP2 dağılımlarını gösterdi. (B) IBA1 ve TEME119 pozitif mikroglia, ek mikroglial farklılaşma sitokinleri olan ve olmayan iki organoidde sayıldı. IBA1 ve TMEM119 pozitif hücrelerin sayısı temsili organoidlerde değişir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
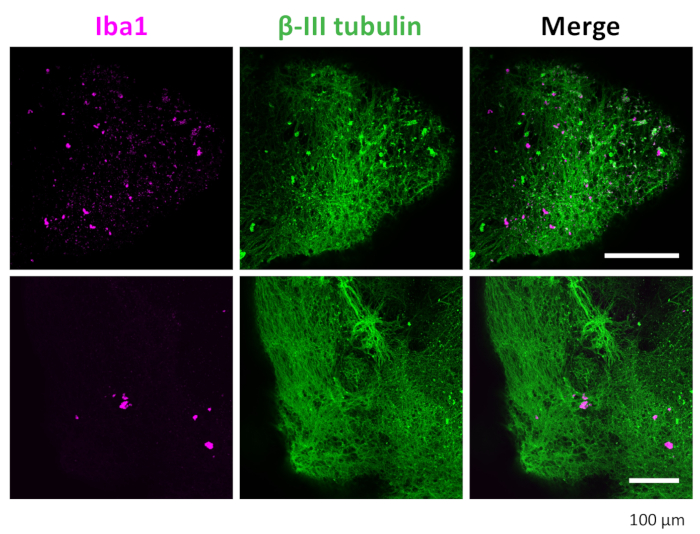
Şekil 7: 3D organoidlerde nöronların ve mikrogliaların immün boyaması. Klerens ve immün boyamadan sonra, organoid IBA1 ile boyanmış mikroglia pozitif ve βIII-tubulin ile boyanmış nöronlar gösterdi. 20x objektif ile konfokal mikroskop altında çekilen temsili görüntüler gösterilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
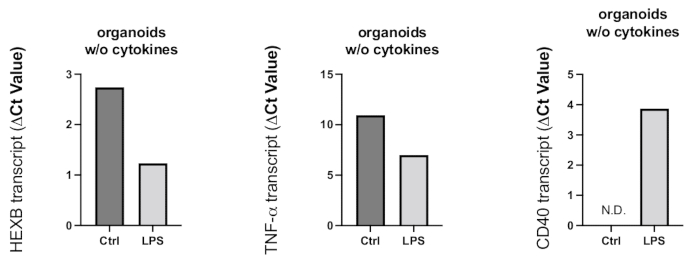
Şekil 8: LPS tedavisi ile organoidlerde indüklenen inflamatuar aktivasyon. LPS ile 24 saatlik tedaviden sonra organoidler toplandı ve mikroglial aktivasyonu ve proinflamatuar reaksiyonu belirlemek için RT-PCR kullanıldı. Ct değerleri, temsili grafiklerde gösterildiği gibi gen ekspresyon seviyeleri ile negatif ilişkili olduğundan, LPS tedavisi, mikroglial aktivasyon belirteci HEXB ve proinflamatuar sitokin TNF-α'nin gen ekspresyonunun artmasına neden oldu. Kontrol organoidlerinde CD40 gen ekspresyonu tespit edilmemesine rağmen, LPS tedavisi saptanabilir CD40 transkriptleri ile sonuçlandı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Ek Şekil 1: Bir mikrokuyu kültür plakasındaki EB'ler. (A) Karışık HPC'ler ve iPSC'ler, santrifüjlemeden sonra bir mikrokuyu kültür plakası içinde mikro kuyulara yerleştirildi. (B) EB'ler, mikroskop altında gözlemlendiğinde mikrokuyu kültür plakasında 24 saatlik inkübasyondan sonra oluşturulmuştur. (C) EB oluşumundan 8 gün sonra oluşan organoidlerde CD34 + hücreleri görüldü. Konfokal görüntüler 20x objektif ile çekildi. Bu rakamı indirmek için lütfen buraya tıklayın.
Ek Şekil 2: Konfokal görüntüler, ek mikroglial sitokinler olmadan kültürlenen organoidlerde IBA-1 ve TMEM-119 pozitif hücreleri gösterdi. Görüntüler, hücrelerin morfolojilerini göstermek için 20x ve 2x yakınlaştırmalı konfokal bir mikroskop kullanılarak çekildi. Bu rakamı indirmek için lütfen buraya tıklayın.
Tartışmalar
Burada, karışık iPSC'lerden ve iPSC ile farklılaşmış HPC'lerden türetilen EB'lerden doğuştan gelen mikroglia içeren 3D nöral organoidlerin yapılması için ayrıntılı bir protokol sunulmaktadır. Çoğu laboratuvarda genel olarak bulunan yalnızca hücre kültürü tekniklerini ve ekipmanlarını içeren nispeten kısa ve kolay bir yaklaşımdır.
Bu protokolün başarısı için en kritik faktör, HPC farklılaşmasının kalitesidir. Bazı değişikliklerle HPC'leri iPSC'lerden ayırt etmek için ticari bir kit kullanarak yayınlanan yöntem17'yi benimsedik. Orijinal protokolle karşılaştırıldığında, daha küçük boyutlu ve daha düşük bir iPSC kolonisi aralığı ile başlıyoruz ve farklılaştırılmış HPC'leri 12 gün yerine 10 günlük farklılaşmadan sonra topluyoruz. Bu yaklaşım, kuyu başına yalnızca 1-2 milyon HPC üretir, ancak yine de 3D organoid üretiminin bir sonraki adımı için fazlasıyla yeterlidir. Bu hücreler ve iPSC kolonileri arasında doğru dengenin korunması önemlidir, çünkü aşırı sayıda hücre sonunda ölü hücrelere/döküntülere neden olarak EB oluşumunun başarısız olmasına neden olabilir. HPC'ler indüksiyondan sonra 10. günden 12. güne kadar toplanabilse de, HPC'lerin kültürün sonuna kadar hızlı büyümesi beslenme faktörlerini kolayca tüketebileceğinden ve yakından izleme ve ek ortam değişiklikleri gerektirdiğinden, 12. günde toplamanın daha fazla ölü hücre ve safsızlık riski taşıyacağını bulduk. HPC'leri 10. günde toplayarak, HPC'lerin daha düşük saflığını zenginleştirmek için gerekli olan akış sitometrisi veya mıknatıs boncuk saflaştırması ile HPC saflaştırmasına gerek kalmayacaktır.
Normal iPSC alt kültürü ve HPC farklılaşması için, etkinin hafif olduğu ve iPSC kolonilerini sadece küçük hücre yamalarına ayırdığı, bu da iPSC'lerin bölündükten sonra yeniden bağlanması için iyi olan EDTA ayrışma tamponu kullanıldı. Bununla birlikte, hücre yamaları EB oluşumuna müdahale edebilir. Bu nedenle, Accutase tedavisi, iPSC'leri ayırmak ve daha homojen EB oluşumu için tek hücreli bir çözelti elde etmek için kullanılır. iPSC'leri ayrıştırarak EB'ler yaparken, iPSC'leri Accutase ile aşırı tedavi etmemek önemlidir, bu da aşırı hücre ölümüne neden olabilir. iPSC'leri oda sıcaklığında ve çok uzun süre süspansiyonda bırakmak da büyük hücre ölümüne ve farklılaşmanın ortadan kaldırılmasına neden olabilir. Bu nedenle, gereksiz gecikmeleri önlemek için 2.1'den 2.13'e kadar olan süreç mümkün olan en kısa sürede tamamlanmalıdır.
Nöral farklılaşmayı ve olgunlaşmayı kolaylaştırmak için, kuyu başına birkaç EB kültürlenir. Bu ayar, EB'lerin füzyonunu kolaylaştırır ve organoid olgunlaşma için gereken süreyi azaltır. Bununla birlikte, füzyon için EB'lerin kesin sayılarını kontrol etmek zordur ve bu nedenle ortaya çıkan organoidlerin boyutlarında ve şekillerinde düzensizliğe neden olabilir. Düzensizlik, plakaları zaman zaman sallayarak veya mümkünse bir biyoreaktör kullanarak en aza indirilebilir. Füzyonu tamamen önlemek için tek EB'yi 96 oyuklu bir plakanın kuyularına tohumlamak da mümkündür, ancak organoidlerin büyümesi ve olgunlaşması için ekstra çaba ve zamana ihtiyaç duyacaktır.
En çok kabul gören yaklaşım18'de organoidleri Matrigel ile tek tek gömmenin aksine, Matrigel damlasını ortamın üzerine birkaç kez akıllıca uyguladık. Bu yaklaşım daha az emek yoğundur, ancak organoidlerde yüksek kalitede nöral farklılaşma üretir. Bu çalışmada açıklanan protokol, mikroglialı kortikal nöronlar üretir. Bununla birlikte, yayınlanmış teknikleri19,20 izleyerek büyüme faktörlerini ve farklılaşma adımlarını ayarlayarak, beynin diğer spesifik nöronal tiplerini veya bölgelerini temsil eden organoidler üretmek için kolayca uyarlanabilir.
Son yayınlar, mikroglial içeren beyin organoidleri yapmak için iPSC ile farklılaşmış mikroglia veya makrofaj benzeri hücreleri, gelişmekte olan kortikal organoidlere dahil etmiştir21. Yetişkin mikroglia, erken embriyonik günlerde12 beyne alınan ilkel HPC'lerden geliştiğinden, HPC'leri EB oluşumuna ve nöral indüksiyondan önce dahil ederiz. İlginçtir ki, genellikle beyin organoidlerinde22 mikroglial farklılaşma üretmek için kullanılan mikroglial farklılaşma için spesifik sitokinleri uygulamadan, TREM2 pozitif hücrelerin sayıları daha düşük olmasına rağmen, ortaya çıkan beyin organoidleri içinde hala iyi mikroglial farklılaşma gözlemliyoruz, sitokinlerle kültürlenenlere kıyasla. HPC'lerin EB oluşumuna dahil edilmesinin ve nöral gelişim süreci ile HPC'lerin sağlanan erken etkileşimlerinin, beyin organoidindeki mikroglia'yı ayırt etmek için yeterli olabileceğini düşündürmektedir. Ayrıca, protokolümüzün beyindeki erken mikroglial gelişimi incelemek için bir model olarak değerli olduğunu öne sürmektedir.
Tartışıldığı gibi, bu protokol erken insan beyninin gelişimini taklit eden organoidler üretir. Organoidlerin morfolojilerine bağlı olarak belirgin bir bozulma fark etmeden 6 haftaya kadar organoidleri kültürlemiş olmamıza ve bazı kültürlerin 4 aydan fazla sürmesine rağmen, 8 haftalık olduğundan beri organoid çekirdeklerde hücre nekrozu bulunmuştur. Bu aynı zamanda diğer beyin organoidleri için de yaygındır, çünkü büyüyen organoidlerdeki merkez hücreler beslenmeye erişimde zorluklar yaşarlar. Sürekli çalkalama ile biyoreaktörlerin kullanılması, organoidlerin canlılığını artırabilir ve ömrünü uzatabilir, bu da daha olgun hücre tiplerinin farklılaşmasına izin verir. Bununla birlikte, uzun vadeli kültür, belirli bir otomatik kültür yardımı olmadan neredeyse kesinlikle daha büyük değişkenliklere yol açacaktır. Bu nedenle, mikroglial ile ilişkili erken beyin gelişiminin yanı sıra nöroenfeksiyonların beyin gelişimi üzerindeki akut etkilerini incelemek için bu protokolü kullanmanızı öneririz. Daha sofistike beyin modellemesi için, araştırmacıların bu protokolü temel olarak kullanmalarını ve tutarlılığı artırmak ve uzun vadeli kültürleri kolaylaştırmak için değişiklikler yapmalarını öneriyoruz.
Özetle, mevcut protokolde, iPSC ile farklılaşmış HPC'leri EB oluşumuna dahil ediyoruz ve daha fazla nöral farklılaşmayı indükliyoruz. Bir aydan kısa bir süre içinde, bu protokol aynı iPSC'lerden üretilen hem nöronları hem de mikrogliaları içeren organoidler üretecektir. Nöronal ve mikroglial gelişim arasında erken etkileşimlere sahip beyin organoidleri yapmak için uygun bir alternatif sunar, böylece insan beyni gelişiminin fizyolojisini ve doğuştan gelen mikroglia'yı içeren nöral enfeksiyöz ve nöroinflamatuar hastalıkları incelemek için faydalı hale getirir.
Açıklamalar
Yazarların ifşa edecek hiçbir şeyi yok.
Teşekkürler
Bu çalışma NINDS intramural araştırma fonları tarafından desteklenmektedir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 12 well cell culture plates | Corning | #3512 | |
| 24 well cell culture plate | SARSTEDT | #83.3922 | |
| Accutase | Thermo | A1110501 | |
| Aggrewell 400 plate | Stemcell technologies | #34411 | Referred to as microwell culture plate |
| Alexa Fluor 488 goat anti-mouse antibody | Life techniologies | A11001 | 1:400 dilution |
| Alexa Fluor 594 goat anti-rabbit antibody | Life techniologies | A11012 | 1:400 dilution |
| Allegra X-30R Centrifuge with rotor S6069 | Beckman Couler | ||
| Anti- Adherence Rinsing solution | Stem Cell Technologies | #07010 | |
| anti-CD34 antibody | Stem Cell Technologies | #60013 | 1:100 dilution |
| anti-Human CD43 antibody | Stem Cell Technologies | #60085 | 1:100 dilution |
| anti-IBA1 rabbbit antibody | Fujifilm | 019-19741 | 2.5 µg/mL |
| anti-TREM2 rat pAb | RD Systems | mab17291 | 2.5 µg/mL |
| Antibiotic-antimycotic | Gibco | 15240-062 | 1x |
| B27 supplement | Life technologies | 17504-044 | 1x |
| bFGF | Peprotech | 100-18B | 20 ng/mL |
| CD200 | Novoprotein | C311 | 100 ng/mL |
| CryoTube vials | Thermo | #368632 | |
| CX3CL1 | Peprotech | 300-31 | 100 ng/mL |
| DAPI | Sigma | D9542 | 1 µg/mL |
| DMEM/F12 | Life technologies | 12400-024 | 1x |
| DMSO | Sigma | D2650 | |
| DPBS | Gibco | #4190136 | 1x |
| E8 Flex medium kit | Thermo | A2858501 | |
| EDTA | Mediatech | 46-034-Cl | 0.5 mM |
| EGF | Peprotech | AF-100-15 | 20 ng/mL |
| EVOS FL Auto Microscope | Thermo | Fluorescence microscope | |
| FastStart Universal SYBR Green PCR master mix | Roche | #4913850001 | |
| Glutamax | Gibco | #35050079 | |
| Goat serum | Sigma | G9023 | 4% |
| IL-34 | Peprotech | 200-34 | 100 ng/mL |
| ImageXpress Micro Confocal | Molecular Devices | ||
| Knockout DMEM/F12 | Gibco | #10829018 | |
| M-CSF | Peprotech | 300-25 | 25 ng/mL |
| Matrigel | Corning | #354277 | Basement membrane matrix (BMM) |
| Mouse anti-βIII-tubulin antibody | Promega | G712A | 1:1000 dilution |
| Mr. Frosty container | Thermo | 5100-0001 | |
| N2 supplement | Life technologies | 17502-048 | 1x |
| Paraformadehyde | Sigma | P6148 | 4% |
| PSC Neural Induction Medium | Gibco | A1647801 | |
| Rock inhibitor Y27632 | Stemcell technologies | #72304 | 1 mM stock |
| RT LTS 1000 ul pipette tips | RAININ | #30389218 | for transferring organoids |
| STEMdiff Cerebral Organoid Kit | Stem Cell Technologies | #08570 | |
| STEMdiff Hematopoietic Kit | StemCell Technologies | #5310 | Referred to as hematopoietic Kit |
| StemPro Neural Supplement | Gibco | A1050801 | Referred to as neural supplement |
| TGF-β1 | Peprotech | 100-21 | 50 ng/mL |
| Total RNA Purification Plus Kit | Norgen | #48400 | |
| TritonX-100 | Sigma | T9284 | 0.10% |
| Visikol Histo-Starter Kit | Visikol | HSK-1 | Contains organoid clearing solution HISTO-M, washing buffer |
| Zeiss LSM 510-META Confocal Microscope | Zeiss |
Referanslar
- Sabate-Soler, S., et al. Microglia integration into human midbrain organoids leads to increased neuronal maturation and functionality. Glia. 70 (7), 1267-1288 (2022).
- Lazarov, T., Juarez-Carreño, S., Cox, N., Geissmann, F. Physiology and diseases of tissue-resident macrophages. Nature. 618 (7966), 698-707 (2023).
- Wang, T., Liu, B., Zhang, W., Wilson, B., Hong, J. S. Andrographolide reduces inflammation-mediated dopaminergic neurodegeneration in mesencephalic neuron-glia cultures by inhibiting microglial activation. J Pharmacol Exp Ther. 308 (3), 975-983 (2004).
- Qian, L., Flood, P. M., Hong, J. S. Neuroinflammation is a key player in Parkinson's disease and a prime target for therapy. J Neural Transm (Vienna). 117 (8), 971-979 (2010).
- Clevers, H. Modeling development and disease with organoids. Cell. 165 (7), 1586-1597 (2016).
- Fakıoğlu, D. M., Altun, B. New therapeutic approaches in cystic fibrosis. Turk J Pharm Sci. 17 (6), 686-697 (2020).
- Mcmillan, R. E., Wang, E., Carlin, A. F., Coufal, N. G. Human microglial models to study host-virus interactions. Exp Neurol. 363, 114375 (2023).
- Scopa, C., et al. Jun upregulation drives aberrant transposable element mobilization, associated innate immune response, and impaired neurogenesis in Alzheimer's disease. Nat Commun. 14 (1), 8021 (2023).
- Tamaki, Y., et al. Spinal cord extracts of amyotrophic lateral sclerosis spread TDP-43 pathology in cerebral organoids. PLoS Genet. 19 (2), e1010606 (2023).
- Chambers, S. M., et al. Highly efficient neural conversion of human es and IPS cells by dual inhibition of smad signaling. Nat Biotechnol. 27 (3), 275-280 (2009).
- Kim, S. H., Chang, M. Y. Application of human brain organoids-opportunities and challenges in modeling human brain development and neurodevelopmental diseases. Int J Mol Sci. 24 (15), 12528 (2023).
- Ginhoux, F., et al. Fate mapping analysis reveals that adult microglia derive from primitive macrophages. Science. 330 (6005), 841-845 (2010).
- Ormel, P. R., et al. Microglia innately develop within cerebral organoids. Nat Commun. 9 (1), 4167 (2018).
- Abdelmalek, C. M., et al. Building a growing genomic data repository for maternal and fetal health through the ping consortium. medRxiv. , (2024).
- Wei, Z., et al. Human IPSC-derived brain organoids: A 3D mini-brain model for studying HIV infection. Exp Neurol. 364, 114386 (2023).
- Wang, T., et al. Regulation of stem cell function and neuronal differentiation by HERV-K via mTOR pathway. Proc Natl Acad Sci U S A. 117 (30), 17842-17853 (2020).
- Mcquade, A., et al. Development and validation of a simplified method to generate human microglia from pluripotent stem cells. Mol Neurodegener. 13 (1), 67 (2018).
- Lancaster, M. A., Knoblich, J. A. Generation of cerebral organoids from human pluripotent stem cells. Nat Protoc. 9 (10), 2329-2340 (2014).
- Fiorenzano, A., et al. Single-cell transcriptomics captures features of human midbrain development and dopamine neuron diversity in brain organoids. Nat Commun. 12 (1), 7302 (2021).
- Qian, X., et al. Brain-region-specific organoids using mini-bioreactors for modeling ZIKV exposure. Cell. 165 (5), 1238-1254 (2016).
- Park, D. S., et al. IPS-cell-derived microglia promote brain organoid maturation via cholesterol transfer. Nature. 623 (7986), 397-405 (2023).
- Schafer, S. T., et al. An in vivo neuroimmune organoid model to study human microglia phenotypes. Cell. 186 (10), 2111-2126.e20 (2023).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır