Method Article
Ableitung eines Organoids des menschlichen Gehirns mit Mikroglia-Entwicklung
In diesem Artikel
Zusammenfassung
Wir stellen ein Protokoll zur Generierung eines menschlichen Gehirnorganoids mit residenten Mikroglia vor, indem von induzierten pluripotenten Stammzellen (iPSC) abgeleitete hämatopoetische Vorläuferzellen (HPCs) in die Organoidentwicklung integriert werden.
Zusammenfassung
Dreidimensionale (3D) Hirnorganoidkulturen, die aus induzierten pluripotenten Stammzellen (iPSC) gewonnen werden, stellen ein wichtiges alternatives In-vitro-Werkzeug für die Untersuchung der Entwicklung des menschlichen Gehirns und der Pathogenese neurologischer Erkrankungen dar. Der fehlende Einbau von Mikroglia in die Organoide des menschlichen Gehirns ist jedoch immer noch eine große Hürde für 3D-Modelle der Neuroinflammation. Zu den aktuellen Ansätzen gehört entweder der Einbau vollständig differenzierter Mikroglia in reife Hirnorganoide oder die Induktion der Mikrogliadifferenzierung ab dem frühen Stadium von iPSC-abgeleiteten Embryoidkörpern (EBs). Der erste Ansatz übersieht das Stadium, in dem die Mikroglia-Differenzierung mit der angrenzenden neuronalen Umgebung interagiert, und der spätere Ansatz ist technisch herausfordernd, was zu Inkonsistenzen zwischen den endgültigen Organoiden in Bezug auf die Quantität und Qualität der Mikroglia führt. Um Gehirnorganoide mit Mikroglia zu modellieren, um die frühen Wechselwirkungen zwischen der Entwicklung von Mikroglia und Neuronen zu untersuchen, wurden hochreine hämatopoetische Vorläuferzellen (HPC), die von menschlichen iPSCs unterschieden wurden, in iPSC-abgeleitete EBs eingebaut, um Gehirnorganoide herzustellen. Mittels Immunfärbung und Einzelzell-RNA-Sequenzierung (sc-RNA-seq) konnten wir bestätigen, dass HPCs in die 3D-Organoide eingebaut wurden, die sich schließlich zu Gehirnorganoiden mit Mikroglia und Neuronen entwickelten. Im Vergleich zu Hirnorganoiden ohne HPCs führt dieser Ansatz zu einem signifikanten Einbau von Mikroglia in die Gehirnorganoide. Dieses neuartige 3D-Organoidmodell, das sowohl aus mikroglialen als auch aus neuronalen Entwicklungseigenschaften besteht, kann zur Untersuchung der frühen Wechselwirkungen zwischen der Entwicklung des angeborenen Immuns und des Nervensystems und möglicherweise als Modell für Neuroinflammation und neuroinfektiöse Erkrankungen verwendet werden.
Einleitung
Mikroglia sind stationäre Immunzellen im Gehirn, die sowohl bei der Gehirnentwicklung als auch bei der Homöostase eine entscheidende Rolle spielen 1,2. Die Aktivierung von Mikroglia führt zur Produktion von proinflammatorischen Faktoren, erhöhter Phagozytose und reaktivem oxidativem Stress, wodurch die eindringenden Krankheitserreger und geschwächten Zellen entfernt werden. Andererseits kann eine Überaktivierung oder eine verlängerte Aktivierung von Mikroglia als Mechanismus der Pathogenese bei vielen neurologischen Erkrankungen, einschließlich der Parkinson-Krankheit, eine Neurodegeneration verursachen 3,4. Es ist wichtig, dass Mikroglia in die relevanten Modelle zur Untersuchung menschlicher neurologischer Erkrankungen einbezogen werden. In den letzten Jahren wurden humane Stammzellen verwendet, um 3D-Organoide als In-vitro-Modelle als Alternative zu Tiermodellen und Studien am Menschen zu entwickeln5. Im Idealfall bestehen menschliche Organoide aus mehreren Zelltypen und Gewebestrukturen, die den entsprechenden menschlichen Organen ähneln und die menschliche Physiologie und Pathogenese besser repräsentieren als Tiermodelle, jedoch ohne die ethischen Bedenken, die bei Studien an menschlichen Individuen direkt auftreten. Sie könnten die Zukunft der Modellierung menschlicher Krankheiten für die Erforschung der Pathogenese und Arzneimittelentwicklung sowie für die Anleitung individualisierter Therapien darstellen6. So haben sich beispielsweise 3D-Organoide des menschlichen Gehirns, die aus humanen induzierten pluripotenten Stammzellen (iPSCs) gewonnen wurden, im Bereich der neurowissenschaftlichen Forschung durchgesetzt, indem neuronale Infektionskrankheiten wie ZIKA, SARS-CoV-27 und neurodegenerative Erkrankungen wie Amyotrophe Lateralsklerose (ALS) und Alzheimer modelliertwurden 8,9. Herkömmliche neuronale 3D-Organoide, die eine duale SMAD-Hemmung zur Induktion der neuronalen Differenzierung10 verwenden, produzieren jedoch Gehirnorganoide ohne Mikroglia, da sie von Vorläufern abstammen, die aus dem Blut rekrutiert wurden, anstatt von der Neuroektoderm-Linie, von der Neuronen abstammen 11,12. Ohne das Vorhandensein von Mikroglia sind die Organoide ungeeignet, um ZNS-Infektionen, Entzündungen und die damit verbundene Neurodegeneration zu modellieren.
Um diese kritische Frage anzugehen, wurden Versuche unternommen, differenzierte Mikroglia in die Gehirnorganoideeinzubauen 13 oder die Mikrogliadifferenzierung innerhalb von Organoiden von Anfang an zu induzieren, wobei alternative Ansätze anstelle der dualen SMAD-Hemmungverwendet wurden 13. Durch den Einbau differenzierter Mikroglia in die Gehirnorganoide werden jedoch die frühen Wechselwirkungen zwischen neuronaler und mikroglialer Entwicklung übersehen. Dies könnte für die Entwicklung des ZNS oder die Pathogenese neuroinfektiöser Erkrankungen wichtig sein, die auf die Entwicklung des Gehirns von Säuglingen abzielen, wie z. B. bei einer ZIKA-Virusinfektion14. Auf der anderen Seite ist die Differenzierung der angeborenen Mikroglia innerhalb von iPSC-abgeleiteten Hirnorganoiden ohne intermittierende Stadien mit einem verlängerten Prozess verbunden und weist eine höhere Variabilität innerhalb der Endprodukteauf 15. In diesem berichteten Protokoll haben wir die von iPSCs abgeleiteten hämatopoetischen Vorläuferzellen (HPCs) in die iPSCs eingebaut, um Embryoidkörper (EBs) herzustellen, die weiter zu 3D-Organoiden differenziert wurden, die sowohl Neuronen als auch Mikroglia umfassen.
Unser Protokoll bietet einen einfachen Ansatz, der zur Untersuchung des menschlichen Zentralnervensystems mit frühen Neuron-Mikroglia-Interaktionen und der Pathogenese von neuronalen Infektionsstörungen und Neuroinflammation mit Mikrogliaaktivierung angewendet werden kann.
Protokoll
Die Originalblutproben von gesunden erwachsenen Spendern wurden in der Transfusionsmedizin Blutbank des NIH entnommen und in Übereinstimmung mit dem NIH Institutional Review Board unterschriebene Einverständniserklärungen eingeholt.
1. Herstellung von hämatopoetischen Vorläuferzellen (HPCs) aus humanen iPSCs
HINWEIS: Zur Erstellung der repräsentativen Ergebnisse wurden die humanen iPS-Zellen 510 und 507 verwendet. Die Methoden zur Erzeugung und Pflege der iPSCs sind in einer früheren Veröffentlichung16 zu finden.
- Tag 0: Beschichten Sie eine 12-Well-Zellplatte mit 500 μl/Well eiskalter Matrigel-Lösung (Basalmembranmatrix [BMM]), verdünnt in DMEM/F12-Medium und inkubieren Sie sie mindestens 30 Minuten lang bei Raumtemperatur (RT).
- Entfernen Sie den Beschichtungsüberstand vollständig und ersetzen Sie ihn durch 1 mL E8 Flex Medium pro Well.
- Überprüfen Sie die iPS-Kultur in einer 6-Well-Platte unter dem Mikroskop, um sicherzustellen, dass die iPS-Zellen von hoher Qualität und ohne Anzeichen einer Differenzierung sind. Wählen Sie eine mittelgroße Kolonie, indem Sie sie mit einem Filzstift unter dem Boden der Platte markieren.
- Nehmen Sie das Medium aus der iPSC-Kultur und geben Sie 500 μl Ethylendiamintetraessigsäure (EDTA) iPSC-Dissoziationspuffer (0,5 mM EDTA, 0,45 g/l NaCl in DPBS) in die Vertiefung.
- Beobachten Sie unter dem Mikroskop auf Anzeichen von Zelldissoziation, wenn drei bis vier Reihen von Zellen an den Rändern der Kolonie zu schrumpfen beginnen und zwischen den Zellen ein leerer Raum entsteht. Dies dauert in der Regel 1-3 min.
- Entsorgen Sie die EDTA-Lösung vollständig. Entfernen Sie die markierte iPS-Kolonie, indem Sie 1 ml E8 Flex Medium kräftig und direkt darauf pipettieren. Stellen Sie sicher, dass sich die Kolonie nach 1-3 maligem Pipettieren vollständig in Zellpflaster mit jeweils 20-50 Zellen ablöst.
- Entnehmen Sie den Überstand mit den Zellpflastern und geben Sie ihn in die erste Vertiefung der beschichteten Vertiefungen in der 12-Well-Platte.
- Mischen Sie die Vertiefung, indem Sie ein- oder zweimal pipettieren und übertragen Sie 1 ml der Zellen in die zweite Vertiefung, die 1 ml Medium enthält.
- Wiederholen Sie Schritt 1.8 zweimal, um seriell verdünnte iPSC-Kulturen in insgesamt vier Vertiefungen herzustellen.
- Inkubieren Sie die Platte in einem 37 °C heißen Inkubator mit 5 % CO2.
- Nach 24 Stunden, an Tag 1, überprüfen Sie die Völker unter dem Mikroskop und zählen Sie die Anzahl der Völker, indem Sie kontinuierlich alle Felder in einem Brunnen durchgehen. Wählen Sie eine Vertiefung aus, die 10-20 iPS-Kolonien enthält.
- Ersetzen Sie das Medium durch 1 ml Medium A aus dem hämatopoetischen Kit. Legen Sie die Platte für 48 h zurück in den Inkubator.
- Entfernen Sie an Tag 3 500 μl verbrauchtes Medium und fügen Sie 500 μl frisches Medium A hinzu.
- Beobachten Sie an Tag 4 unter dem Mikroskop und bemerken Sie ein signifikantes Zellwachstum und eine Differenzierung von den iPS-Kolonien. Ersetzen Sie das Medium durch 1 mL Medium B.
- Überwachen Sie die Zelldifferenzierung unter dem Mikroskop und wechseln Sie jeden zweiten Tag die Hälfte des Mediums mit 500 μl Medium B. Die HPC-ähnlichen Zellen erscheinen an den Tagen 6-7.
- Beobachten Sie am 10. Tag unter dem Mikroskop helle, einzelne runde Zellen mit der Morphologie normaler HPCs, die im Medium schwimmen oder lose an der einzelnen unteren Schicht von flachen Zellen befestigt sind, mit einigen losen Zellaggregaten.
HINWEIS: Die differenzierten HPCs sind bereit für die Entnahme zur Charakterisierung oder für weitere Experimente. - Sammeln Sie alle differenzierten HPCs, indem Sie mit einer 1-ml-Pipettenspitze dreimal auf und ab pipettieren, um die Zellaggregate aufzubrechen und die HPCs von der Plattenoberfläche zu lösen.
- Geben Sie die Zellen in ein 15 mL Röhrchen und zentrifugieren Sie die Zellen bei 300 x g für 5 min. Entfernen Sie den Überstand und resuspendieren Sie das Zellpellet in 1 mL Medium B.
- Zählen Sie die Zellen und stellen Sie die Konzentration auf 1 Million Zellen/ml ein. Zu diesem Zeitpunkt werden mehr als 1 Million HPCs generiert. Bei der Überprüfung mit Durchflusszytometrie ist sicherzustellen, dass die Reinheit mehr als 85 % der Zellen mit CD34+/CD43+ beträgt. Stellen Sie sicher, dass keine signifikanten abgestorbenen Zellen (mehr als 5%) bemerkt werden.
2. Entwicklung von Embryoidkörpern aus gemischten iPSCs und HPCs
- Stellen Sie sicher, dass eine iPS-Kultur am selben Tag, an dem die HPCs entnommen werden, auch in einer Vertiefung in einer 6-Well-Platte (oder zwei Vertiefungen in einer 12-Well-Platte) eine Konfluenz von 80 % erreicht.
- Behandeln Sie eine Vertiefung der Mikrotiterplatte für die EB-Bildung mit 500 μl Anti-Adhärenz-Spüllösung, indem Sie diese hinzufügen, um Blasenbildung zu minimieren.
- Drehen Sie die Platte 5 Minuten lang bei 2000 x g in einem schwingenden Schaufelrotor, der mit Plattenhaltern ausgestattet ist, um mögliche Blasen zu entfernen.
- Entfernen Sie die Spüllösung vollständig durch Pipettieren und waschen Sie die Vertiefungen zweimal mit 1 mL DPBS und dann mit 1 mL DMEM/F12, ohne Blasen zu bilden.
- Dissoziieren Sie die iPS-Zellen von der Platte, indem Sie die Zellen mit 1 ml Accutase-Lösung behandeln.
- Beobachten Sie unter dem Mikroskop, bis die Zellen Anzeichen einer Trennung zeigen, aber noch am Boden befestigt sind. Dies geschieht in der Regel innerhalb von 1-3 Minuten nach der Behandlung mit Accutase. Verdauen Sie die iPS-Zellen nicht zu sehr.
- Entfernen Sie die Accutase-Lösung vollständig, ohne die Zellen zu stören, und geben Sie 1 ml DMEM/F12-Medium in die Vertiefungen. Dissoziieren Sie die Zellen in einzelne Zellen, indem Sie mit einer 1-ml-Spitze ein paar Mal auf und ab pipettieren.
- Sammeln Sie die Zellen in ein 15-ml-Röhrchen und füllen Sie es auf 5 mL mit DMEM/F12-Medium. Die Zellen bei 300 x g 5 min drehen.
- Entfernen Sie den Überstand durch Pipettieren und resuspendieren Sie die Zellen in 1 ml E8 Flex Medium. Zählen Sie die Zellen und stellen Sie die Zellkonzentration auf 1 Million Zellen pro ml im E8 Flex-Medium ein.
- Mischen Sie iPSCs mit HPCs in einem Verhältnis von 2:1, indem Sie 1 Million iPSCs (1 ml) und eine halbe Million HPCs (500 μl) zusammen hinzufügen. Geben Sie alle gemischten Zellen in die zuvor behandelte Vertiefung der Mikrotiterkulturplatte.
- 1 μl des Rock-Inhibitors Y27632 Stammlösung (1 mM) pro 1 ml Medium in den Überstand geben. Schütteln Sie die Platte einige Male von einer Seite zur anderen, um die Zellen gleichmäßig zu verteilen.
- Schleudern Sie die Mikrotiterkulturplatte bei 300 x g für 5 min in einem schwingenden Eimerrotor, der mit Plattenhaltern ausgestattet ist. Beobachten Sie unter dem Mikroskop, ob sich die Zellen in den Mikrovertiefungen niedergelassen haben. (Ergänzende Abbildung 1A).
- Stellen Sie die Platte, ohne die Zellen zu stören, in einen 37 °C, 5 % CO2 -Zellinkubator.
- Am Tag 2, 48 h später, beobachten Sie die Zellen unter dem Mikroskop auf die Bildung von EBs. Wenn die EBs eindeutig gebildet sind, fahren Sie mit dem nächsten Schritt fort (Ergänzende Abbildung 1B).
- Behandeln Sie eine 24-Well-Zellkulturplatte 15 Minuten lang mit Anti-Adhärenz-Spülpuffer (500 μl), um eine Platte mit geringer Anhaftung herzustellen.
- Entfernen Sie den Spülpuffer vollständig und waschen Sie die Vertiefungen zweimal mit 1 mL DPBS, dann geben Sie 1 mL E8 Flex Medium in die Vertiefungen.
- Resuspendieren Sie die EBs in der Mikrotiterkulturplatte, indem Sie sie einige Male mit einer Pipettenspitze mit einer Breite von 1 ml Öffnung pipettieren.
- Für jede Vertiefung der mit geringer Adhärenz behandelten 24-Well-Platten werden 100 μl EB-haltiges Medium aufgefangen und hinzugefügt. Dies führt zu 10-20 EBs pro Bohrung. Fügen Sie dem alten Well E8 Flex-Medium hinzu, das die übrig gebliebenen EBs als Backups enthält.
- Inkubieren Sie die Platte in einem 37 °C heißen Inkubator mit 5 % CO2 -Zellen für 48 Stunden.
3. 3D Induktion, Proliferation und Reifung neuronaler Organoide
- Tauen Sie am Tag 2 nach der EB-Bildung die Aliquots von BMM mindestens 30 Minuten lang auf Eis auf.
- Verwenden Sie eine vorgekühlte 20-μl-Spitze und geben Sie 15 μl eiskalten BMM-Tropfen mit Bedacht auf das Medium, um die EBs zu beschichten. Dadurch entsteht eine Folie aus BMM, an die sich EBs anheften und auf der sie wachsen.
- Stellen Sie die Platte in einen Inkubator mit 37 °C und 5 % CO2 -Zellen.
- Entfernen Sie am 4. Tag nach der EB-Bildung vorsichtig 500 μl Medium, ohne EBs zu verwerfen, und wiederholen Sie die BMM-Beschichtung, indem Sie Schritt 3.2 befolgen.
- Starten Sie sofort die neuronale Induktion, indem Sie 500 μl PSC Neural Induction Medium auf die Zellen geben.
- Führen Sie an den Tagen 6 und 8 einen halben Mediumwechsel durch, indem Sie vorsichtig 500 μl Medium entfernen, ohne die Zellen zu berühren, und 500 μl neuronales Induktionsmedium hinzufügen.
- Führen Sie an den Tagen 10, 12 und 14 einen halben Mediumwechsel mit neuronalem Stammzellmedium (NSC) durch: Knockout DMEM/F12 + 1x Glutamax-Supplement + 1x Neural Supplement + bFGF + EGF.
- Übertragen Sie an Tag 15 die gesamte Vertiefung der Kugeln mit Medium auf eine neue 12-Well-Platte, die wie zuvor beschrieben mit einer Anti-Adhärenz-Spüllösung behandelt wurde. Geben Sie 500 μl neuronales Reifungsmedium (DMEM/F12 + 1x N2-Präparat + 1x B27-Präparat + 1x Antibiotika-Antimykotikum) auf die Kultur.
- Führen Sie jeden zweiten Tag einen halben Mediumwechsel mit neuronalem Reifungsmedium durch.
- Wenn es während der Reifungsphase Anzeichen einer Erschöpfung der Nährstoffe gibt, wie z. B. Farbveränderungen des Mediums, bringen Sie das Organoid auf 6-Well-Platten, die bis zu 3 ml Medium pro Well aufnehmen.
- Optional kann das Reifungsmedium 17 Tage nach der EB-Bildung 6 Tage lang mit Zytokinen (IL-34, M-CSF, TGF-β1, CD200, CX3CL1) ergänzt werden, um die Reifung der Mikroglia zu erleichtern.
- Sammeln Sie an Tag 23 die resultierenden neuronalen Organoide für die Charakterisierung oder weitere Experimente.
4. Clearance und Immunfärbung von neuronalen 3D-Organoiden
- Fixieren Sie bis zu 10 Organoide durch Eintauchen in 1 mL 4 % Paraformaldehyd (PFA) bei 4 °C für 24 h.
- Übertragen Sie die Organoide pro Vertiefung auf eine durchsichtige Bodenplatte mit 96 Vertiefungen und waschen Sie sie mit 200 μl DPBS 2 Mal für jeweils 1 Stunde unter leichtem Schütteln.
- Organoide permeabilisieren, indem sie einmal in 50 % Methanol in DPBS, 80 % Methanol in doppelt destilliertem (dd) Wasser und 100 % trockenem Methanol jeweils 10 Minuten lang bei 4 °C unter leichtem Schütteln gewaschen werden.
- Waschen Sie die Organoide nacheinander in 20 % DMSO/Methanol, 80 % Methanol in dd Wasser, 50 % Methanol in DPBS, in 100 % DPBS, dann in DPBS mit 0,2 % Triton X-100, jeweils 10 min bei 4 °C unter leichtem Schütteln. Bemühen Sie sich, den Restpuffer nach jedem Waschen vollständig zu entfernen.
- Inkubieren Sie in permeabilisierendem Puffer (DPBS mit 0,2 % Triton X100, 0,3 M Glycin und 20 % DMSO) unter leichtem Schütteln für 40 Minuten bei RT.
- Blockierungspuffer (DPBS mit 0,2 % Triton X100, 6 % Ziegenserum und 10 % DMSO) für 1 h bei 37 °C mit leichtem Schütteln auf einem Shaker bei 80 U/min einlagern.
- Inkubieren Sie mit Antikörpern in Antikörperverdünnungspuffer (IBA1 1:100, TREM2 1:100, βIII-Tubulin, 1:1000, 100 μL/Well in DPBS mit 0,2 % Tween 20, 100 μg/mL Heparin, 3 % Ziegenserum und 5 % DMSO) bei 37 °C für 2 h oder im Kühlraum mit leichtem Schütteln bei 80 U/min für 3 Tage.
- Mit DPBS mit 0,2 % Tween 20, 100 μg/mL Heparin 5 mal à 10 min bei RT waschen und auf einem Shaker bei 80 U/min sanft schütteln.
- Inkubieren Sie mit einem Sekundärantikörper (1:200 Ziegen-Anti-Maus Alexa488) bei 37 °C für 1 h, gefolgt von RT über Nacht mit leichtem Schütteln auf einem Shaker bei 80 U/min.
- Für die nukleare Kontrastfärbung führen Sie die DAPI-Färbung zusammen mit einer Antikörperinkubation oder in einem Waschpuffer durch.
- Waschen Sie die Organoide 10 Mal in Waschpuffer, jeweils 10 min bei 37 °C, unter leichtem Schütteln.
- Unter dem Mikroskop beobachten. Wenn der Hintergrund noch hoch ist, waschen Sie es 5 Mal.
- Entsorgen Sie den Überstand so weit wie möglich. Fügen Sie 200 μl Organoid-Clearing-Lösung hinzu und inkubieren Sie sie 5 Minuten lang, bevor Sie sie betrachten, und nehmen Sie Bilder mit einem konfokalen Mikroskop auf.
Ergebnisse
Unser Protokoll folgt einem Schema, um HPCs von iPSCs zu unterscheiden und dann die HPCs mit iPSCs zu mischen, um EBs herzustellen, gefolgt von neuronaler Induktion, Differenzierung und Reifung (Abbildung 1). Eine hohe Qualität der HPC-Differenzierung ist entscheidend für den Erfolg der EB-Bildung und der späteren Organoid-Differenzierung. Eine serielle Verdünnungskulturtechnik wird verwendet, um die entsprechende Anzahl und Größe von iPS-Kolonien zu erzeugen, um die HPC-Differenzierung zu starten (Abbildung 2A). Normalerweise durchlaufen die iPS-Kolonien am Ende der Kultur in Medium A signifikante morphologische Veränderungen (Abbildung 2B) und zeigen nach 3 Tagen in Medium B (Abbildung 2C) eine HPC-Differenzierung als homogene runde Zellen, die direkt über dem Boden der Kulturgefäße schwimmen oder am Boden befestigt sind. Das HPC kann sich zu kolonieartigen Zellclustern ausdehnen (Abbildung 2D). HPCs überwiegen am Tag 10, ohne signifikante Trümmer zu zeigen (Abbildung 2E). Die hohe Qualität des HPC- und iPSC-Gemisches führt innerhalb von 24 Stunden zu einer EB-Bildung, die mit minimalem Zellabfall weiter wächst (Abbildung 3A). Minderwertige HPCs mit übermäßigem Schmutz können zu Schwierigkeiten bei der EB-Bildung führen. Nachdem die EBs auf eine neue Platte übertragen worden waren, wuchsen sie weiter und erreichten schließlich ein Plateau im Reifungsmedium (Abbildung 3B). Die EBs differenzieren sich in Organoide, die IBA1- und TREM2-positive Mikroglia enthalten, mit (Abbildung 4) oder ohne Behandlung mit mikroglialen Zytokinen (Abbildung 5). Die Behandlung mit Wachstumszytokinen der Mikroglia kann die Anzahl der TMEM119-spezifischen Mikroglia erhöhen (Abbildung 6). Die repräsentativen Organoide zeigen sowohl βIII-Tubulin-positive Neuronen als auch IBA1-positive Mikroglia nach Clearance und Immunfärbung (Abbildung 7). Bei Behandlung mit Lipopolysaccharid (LPS) kann eine Zunahme der Mikrogliaaktivierung durch mikroglialspezifische Marker und proinflammatorische Genaktivierung beobachtet werden (Abbildung 8). Ergänzende Abbildung 2 zeigt IBA-1- und TMEM-119-positive Zellen in Organoiden, die ohne zusätzliche mikrogliale Zytokine kultiviert wurden.
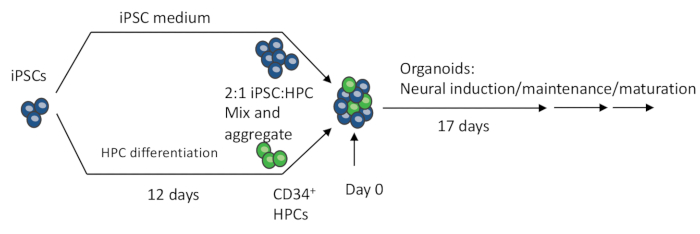
Abbildung 1: Schematische Verfahren zur Herstellung des 3D-Organoids aus iPSCs. EBs werden durch Mischen von iPSCs und iPSC-differenzierten HPCs hergestellt. Die EBs durchlaufen außerdem eine neuronale Induktion, Differenzierung und Reifung, um Organoide zu produzieren, die sowohl Neuronen als auch Mikroglia enthalten. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Typische morphologische Veränderungen von iPSCs zu HPCs. Repräsentative Bilder sind für die (A) iPS-Kolonie, (B) am Ende der Behandlung mit Medium A, (C) 3 Tage in Medium B, (D) Tag 10 in Medium B und (E) die resultierenden schwebenden HPCs zu sehen. Die Bilder wurden unter einem Fluoreszenzmikroskop mit 10x oder 4x Objektiv aufgenommen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
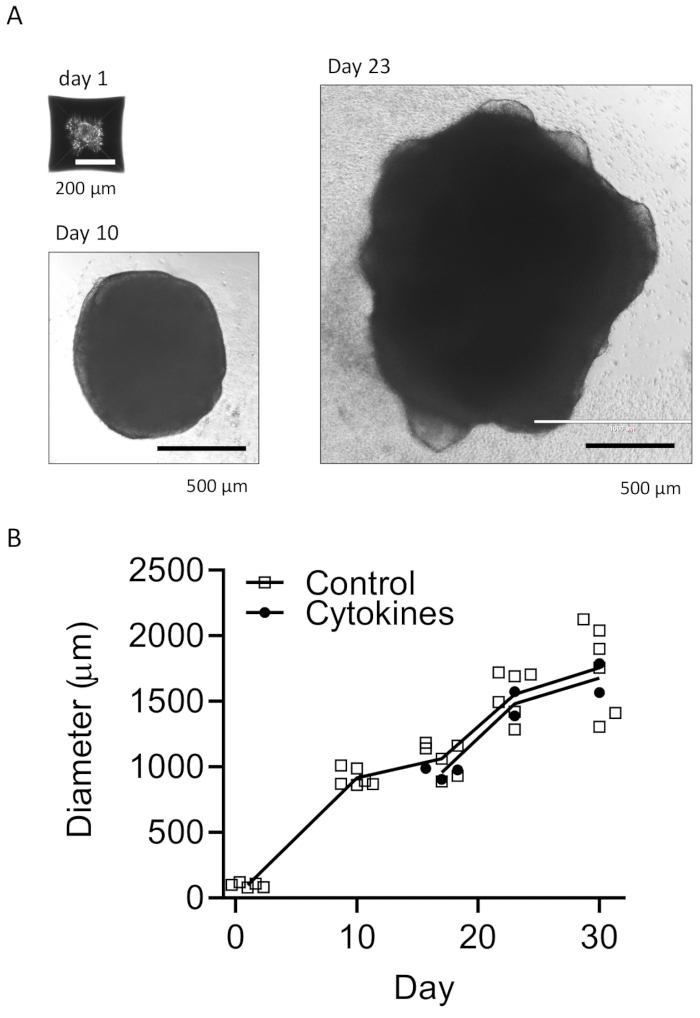
Abbildung 3: Entwicklung von EBs und reifen Organoiden. (A) Repräsentative Fotos zeigen die EB-Bildung (Tag 1), das Organoidwachstum (Tag 10) und die Reifung (Tag 23). Es wird eine Wachstumskurve für die Größen von Organoiden mit oder ohne mikrogliale Differenzierungszytokine (B) gezeigt. Die Bilder wurden unter einem Fluoreszenzmikroskop mit 10x oder 4x Objektiv aufgenommen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
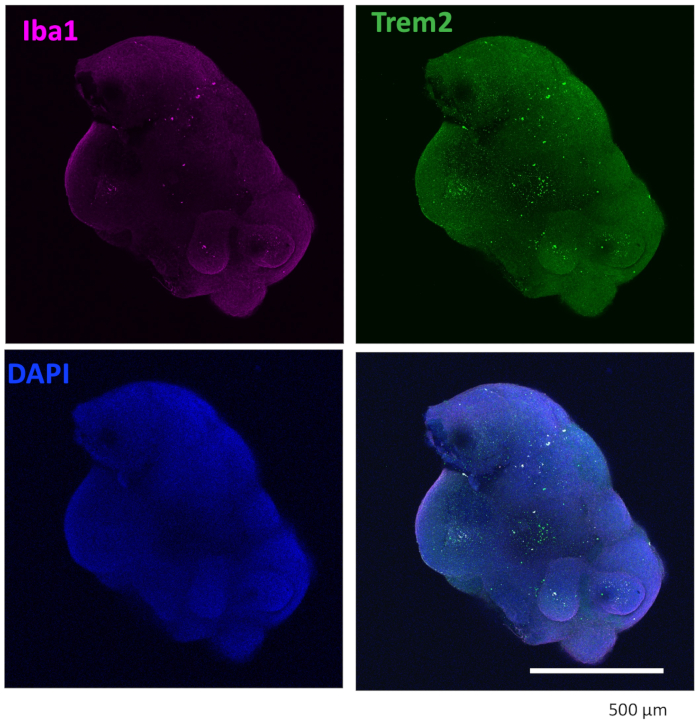
Abbildung 4: Organoide, die mit Mikroglia-Differenzierungszytokinen kultiviert wurden, enthalten Mikroglia. Nach der Clearance und Immunfärbung zeigte das Organoid, dass Mikroglia sowohl mit IBA1 als auch mit TREM2 positiv gefärbt waren. Gezeigt werden Bilder, die unter einem 10-fach-Objektiv eines Konfokalmikroskops aufgenommen wurden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
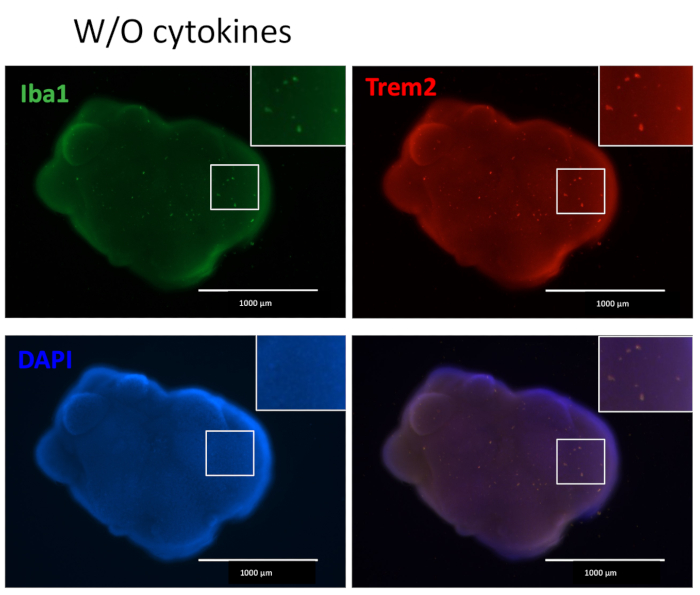
Abbildung 5: Organoide, die ohne zusätzliche Mikroglia-Differenzierungszytokine kultiviert wurden, enthalten Mikroglia. Ohne die Zugabe von externen Mikroglia-Differenzierungszytokinen produzierten die Organoide immer noch Mikroglia-positive Zytokine, die sowohl mit IBA1 als auch mit TREM2 gefärbt waren, was darauf hindeutet, dass die Mikroumgebung der neuronalen Entwicklung im Organoid ausreicht, um HPCs zu Mikroglia zu differenzieren. Die Bilder wurden unter einem Fluoreszenzmikroskop mit einem 4-fach-Objektiv aufgenommen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 6: Einzelzell-RNA-seq-Ergebnis von Mikroglia, die 3D-Organoide enthalten. (A) Die Diagramme zeigten IBA1(AIF1)-, TMEM119- und MAP2-Verteilungen in einem Organoid ohne zusätzliche mikrogliale Differenzierungszytokine. (B) IBA1 und TEME119 positive Mikroglia wurden in zwei Organoiden gezählt, die mit und einem ohne zusätzliche Mikroglia-Differenzierungszytokine kultiviert wurden. Die Anzahl der IBA1- und TMEM119 positiven Zellen ändert sich in repräsentativen Organoiden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
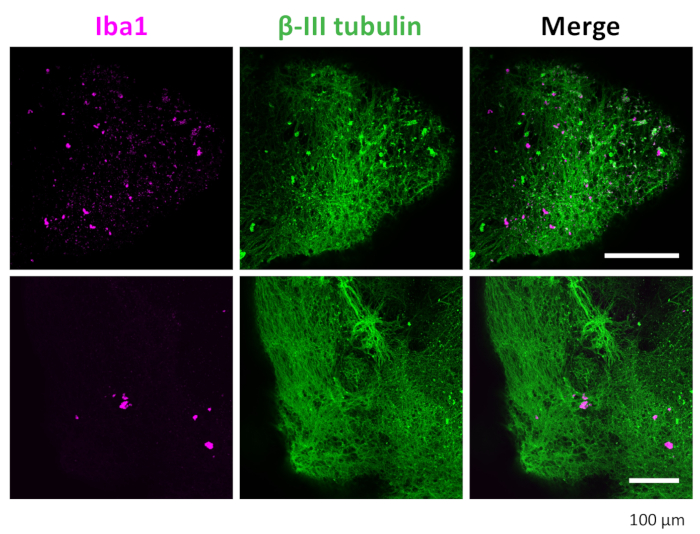
Abbildung 7: Immunfärbung von Neuronen und Mikroglia in den 3D-Organoiden. Nach Clearance und Immunfärbung zeigte das Organoid Mikroglia-positive Mikroglia, die mit IBA1 gefärbt waren, und Neuronen, die mit βIII-Tubulin gefärbt waren. Gezeigt werden repräsentative Bilder, die unter einem Konfokalmikroskop mit einem 20-fachen Objektiv aufgenommen wurden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
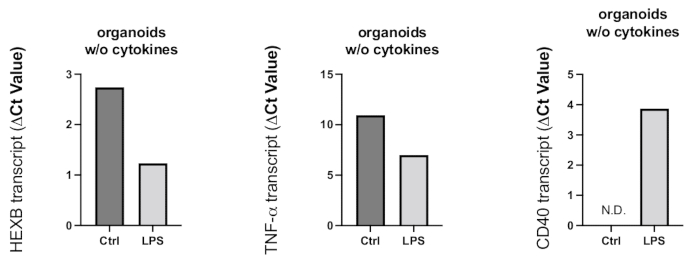
Abbildung 8: Entzündungsaktivierung, die in den Organoiden durch die LPS-Behandlung induziert wird. Nach 24 Stunden Behandlung mit LPS wurden Organoide entnommen und RT-PCR verwendet, um die Mikrogliaaktivierung und die proinflammatorische Reaktion zu bestimmen. Da die Ct-Werte negativ mit den Genexpressionsniveaus zusammenhängen, wie in den repräsentativen Grafiken gezeigt, führte die LPS-Behandlung zu einer erhöhten Genexpression des Mikrogliaaktivierungsmarkers HEXB und des proinflammatorischen Zytokins TNF-α. Obwohl die CD40-Genexpression in Kontrollorganoiden nicht nachgewiesen werden konnte, führte die LPS-Behandlung zu nachweisbaren CD40-Transkripten. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergänzende Abbildung 1: EBs in einer Mikrotiterkulturplatte. (A) Gemischte HPCs und iPSCs wurden in den Mikrowells in einer Mikrotiterkulturplatte gut nach der Zentrifugation abgesetzt. (B) EBs wurden nach 24-stündiger Inkubation in der Mikrotiterkulturplatte gebildet, wenn sie unter einem Mikroskop beobachtet wurden. (C) CD34+-Zellen wurden 8 Tage nach der EB-Bildung in den sich bildenden Organoiden beobachtet. Konfokale Bilder wurden mit einem 20-fachen Objektiv aufgenommen. Bitte klicken Sie hier, um diese Abbildung herunterzuladen.
Ergänzende Abbildung 2: Konfokale Bilder zeigten IBA-1- und TMEM-119-positive Zellen in Organoiden, die ohne zusätzliche mikrogliale Zytokine kultiviert wurden. Die Bilder wurden mit einem konfokalen Mikroskop mit 20- und 2-fachem Zoom aufgenommen, um die Morphologien der Zellen zu zeigen. Bitte klicken Sie hier, um diese Abbildung herunterzuladen.
Diskussion
Hier wird ein detailliertes Protokoll zur Herstellung von 3D-Neuronalen Organoiden vorgestellt, die angeborene Mikroglia aus EBs enthalten, die aus gemischten iPSCs und iPSC-differenzierten HPCs stammen. Es handelt sich um einen relativ kurzen und einfachen Ansatz, bei dem nur Zellkulturtechniken und -geräte verwendet werden, die in den meisten Labors allgemein verfügbar sind.
Der wichtigste Faktor für den Erfolg dieses Protokolls ist die Qualität der HPC-Differenzierung. Wir haben die veröffentlichte Methode17 unter Verwendung eines kommerziellen Kits übernommen, um HPCs von iPSCs mit einigen Modifikationen zu unterscheiden. Im Vergleich zum ursprünglichen Protokoll beginnen wir mit einer kleineren Größe und einem kleineren Bereich von iPS-Kolonien und sammeln die differenzierten HPCs nach 10 Tagen Differenzierung statt nach 12 Tagen. Dieser Ansatz erzeugt nur 1-2 Millionen HPCs pro Well, ist aber immer noch mehr als genug für den nächsten Schritt der 3D-Organoidproduktion. Die Aufrechterhaltung des richtigen Gleichgewichts zwischen diesen Zellen und iPS-Kolonien ist wichtig, da eine übermäßige Anzahl von Zellen am Ende zu abgestorbenen Zellen/Trümmern führen kann, die zu einem Versagen der EB-Bildung führen. Obwohl HPCs von Tag 10 bis Tag 12 nach der Induktion gesammelt werden können, stellten wir fest, dass eine Entnahme an Tag 12 das Risiko birgt, dass mehr tote Zellen und Verunreinigungen vorhanden sind, da das schnelle Wachstum der HPCs bis zum Ende der Kultur die Ernährungsfaktoren leicht erschöpfen könnte und eine genaue Überwachung und zusätzliche Medienwechsel erfordert. Durch die Entnahme von HPCs an Tag 10 ist keine HPC-Aufreinigung durch Durchflusszytometrie oder Magnetbead-Reinigung erforderlich, die notwendig sind, um die geringere Reinheit von HPCs anzureichern.
Für die normale iPSC-Subkultur und HPC-Differenzierung wurde EDTA-Dissoziationspuffer verwendet, bei dem die Wirkung mild ist und die iPSC-Kolonien nur in kleine Zellpflaster dissoziiert, die gut für das Reattachment von iPSCs nach der Teilung sind. Die Zellpflaster können jedoch die EB-Bildung stören. Daher wird die Accutase-Behandlung verwendet, um iPS-Zellen zu dissoziieren und eine Einzelzelllösung für eine gleichmäßigere EB-Bildung zu erzielen. Bei der Herstellung von EBs durch Dissoziation von iPS-Zellen ist es wichtig, die iPS-Zellen nicht mit Accutase zu überbehandeln, da dies zu einem übermäßigen Zelltod führen kann. Wenn iPS-Zellen zu lange bei Raumtemperatur und in Suspension belassen werden, kann dies ebenfalls zu einem massiven Zelltod und einer aufgehobenen Differenzierung führen. Daher sollte der Prozess von den Schritten 2.1 bis 2.13 so schnell wie möglich abgeschlossen werden, um unnötige Verzögerungen zu vermeiden.
Um die neuronale Differenzierung und Reifung zu erleichtern, werden mehrere EBs pro Vertiefung kultiviert. Diese Einstellung erleichtert die Fusion von EBs und verkürzt die Zeit, die für die Reifung der Organoide benötigt wird. Es ist jedoch schwierig, die genaue Anzahl der EBs für die Fusion zu kontrollieren und kann daher zu Unregelmäßigkeiten in der Größe und Form der resultierenden Organoide führen. Die Unregelmäßigkeit kann minimiert werden, indem die Platten von Zeit zu Zeit geschüttelt werden oder, wenn möglich, ein Bioreaktor verwendet wird. Es ist auch möglich, einzelne EB in Vertiefungen einer 96-Well-Platte zu säen, um die Fusion ganz zu vermeiden, aber es erfordert zusätzlichen Aufwand und Zeit, damit die Organoide wachsen und reifen können.
Im Gegensatz zur individuellen Einbettung von Organoiden mit Matrigel in den am weitesten verbreiteten Ansatz18 haben wir den Matrigeltropfen mehrmals mit Bedacht auf das Medium aufgetragen. Dieser Ansatz ist weniger arbeitsintensiv, führt aber zu einer hohen Qualität der neuronalen Differenzierung in den Organoiden. Das in dieser Studie beschriebene Protokoll erzeugt kortikale Neuronen mit Mikroglia. Durch Anpassung der Wachstumsfaktoren und Differenzierungsschritte nach den veröffentlichten Techniken19,20 konnte es jedoch leicht angepasst werden, um Organoide zu produzieren, die andere spezifische neuronale Typen oder Regionen des Gehirns repräsentieren.
Jüngste Veröffentlichungen haben iPSC-differenzierte Mikroglia oder Makrophagen-ähnliche Zellen in die Entwicklung kortikaler Organoide integriert, um Mikroglia-haltige Gehirnorganoide herzustellen21. Da adulte Mikroglia aus primitiven HPCs entwickelt werden, die während der frühen embryonalen Tage in das Gehirn rekrutiert werden12, integrieren wir HPCs in die EB-Bildung und vor der neuronalen Induktion. Es ist interessant festzustellen, dass wir ohne Anwendung der spezifischen Zytokine für die Mikroglia-Differenzierung, die im Allgemeinen zur Erzeugung der Mikroglia-Differenzierung in Gehirn-Organoiden verwendet werden22, immer noch eine anständige Mikroglia-Differenzierung innerhalb der resultierenden Gehirn-Organoide beobachten, obwohl die TREM2-positiven Zellen im Vergleich zu denen, die mit Zytokinen kultiviert wurden, zahlenmäßig geringer sind. Es deutet darauf hin, dass die Einbeziehung von HPCs in die EB-Bildung und die sichergestellten frühen Interaktionen des neuronalen Entwicklungsprozesses und der HPCs ausreichen könnten, um die Mikroglia im Hirnorganoid zu differenzieren. Es deutet auch darauf hin, dass unser Protokoll als wertvolles Modell für die Untersuchung der frühen Mikrogliaentwicklung im Gehirn ist.
Wie bereits erwähnt, produziert dieses Protokoll Organoide, die die frühe Entwicklung des menschlichen Gehirns nachahmen. Obwohl wir Organoide bis zu 6 Wochen kultiviert haben, ohne eine offensichtliche Verschlechterung aufgrund der Morphologien der Organoide zu bemerken, und einige Kulturen mehr als 4 Monate erreicht haben, wurde in den Organoidkernen seit einem Alter von 8 Wochen Zellnekrose gefunden. Dies ist auch bei anderen Arten von Gehirn-Organoiden üblich, da die Zentrumszellen in den wachsenden Organoiden Schwierigkeiten haben, Zugang zu Nahrung zu erhalten. Die Verwendung von Bioreaktoren mit kontinuierlichem Schütteln kann die Lebensfähigkeit der Organoide erhöhen und die Lebensdauer verlängern, so dass sich reifere Zelltypen differenzieren können. Eine langfristige Kultur wird jedoch mit ziemlicher Sicherheit zu größeren Variabilitäten führen, ohne dass eine gewisse automatische Kulturunterstützung erforderlich ist. Daher empfehlen wir, dieses Protokoll zu verwenden, um die frühe Entwicklung des Gehirns im Zusammenhang mit Mikroglia sowie die akuten Auswirkungen von Neuroinfektionen auf die Gehirnentwicklung zu untersuchen. Für eine ausgefeiltere Gehirnmodellierung schlagen wir vor, dass Forscher dieses Protokoll als Grundlage verwenden und Modifikationen vornehmen, um die Konsistenz zu erhöhen und Langzeitkulturen zu erleichtern.
Zusammenfassend lässt sich sagen, dass wir im vorliegenden Protokoll iPSC-differenzierte HPCs in die EB-Bildung einbeziehen und die neuronale Differenzierung weiter induzieren. In weniger als einem Monat wird dieses Protokoll Organoide produzieren, die sowohl Neuronen als auch Mikroglia enthalten, die aus denselben iPS-Zellen erzeugt wurden. Es bietet eine bequeme Alternative zur Herstellung von Gehirn-Organoiden mit frühen Wechselwirkungen zwischen neuronaler und mikroglialer Entwicklung und ist somit nützlich für die Untersuchung der Physiologie der menschlichen Gehirnentwicklung und der neuronalen infektiösen und neuroinflammatorischen Erkrankungen mit angeborenen Mikroglia.
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Diese Studie wird durch interne Forschungsgelder des NINDS unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 12 well cell culture plates | Corning | #3512 | |
| 24 well cell culture plate | SARSTEDT | #83.3922 | |
| Accutase | Thermo | A1110501 | |
| Aggrewell 400 plate | Stemcell technologies | #34411 | Referred to as microwell culture plate |
| Alexa Fluor 488 goat anti-mouse antibody | Life techniologies | A11001 | 1:400 dilution |
| Alexa Fluor 594 goat anti-rabbit antibody | Life techniologies | A11012 | 1:400 dilution |
| Allegra X-30R Centrifuge with rotor S6069 | Beckman Couler | ||
| Anti- Adherence Rinsing solution | Stem Cell Technologies | #07010 | |
| anti-CD34 antibody | Stem Cell Technologies | #60013 | 1:100 dilution |
| anti-Human CD43 antibody | Stem Cell Technologies | #60085 | 1:100 dilution |
| anti-IBA1 rabbbit antibody | Fujifilm | 019-19741 | 2.5 µg/mL |
| anti-TREM2 rat pAb | RD Systems | mab17291 | 2.5 µg/mL |
| Antibiotic-antimycotic | Gibco | 15240-062 | 1x |
| B27 supplement | Life technologies | 17504-044 | 1x |
| bFGF | Peprotech | 100-18B | 20 ng/mL |
| CD200 | Novoprotein | C311 | 100 ng/mL |
| CryoTube vials | Thermo | #368632 | |
| CX3CL1 | Peprotech | 300-31 | 100 ng/mL |
| DAPI | Sigma | D9542 | 1 µg/mL |
| DMEM/F12 | Life technologies | 12400-024 | 1x |
| DMSO | Sigma | D2650 | |
| DPBS | Gibco | #4190136 | 1x |
| E8 Flex medium kit | Thermo | A2858501 | |
| EDTA | Mediatech | 46-034-Cl | 0.5 mM |
| EGF | Peprotech | AF-100-15 | 20 ng/mL |
| EVOS FL Auto Microscope | Thermo | Fluorescence microscope | |
| FastStart Universal SYBR Green PCR master mix | Roche | #4913850001 | |
| Glutamax | Gibco | #35050079 | |
| Goat serum | Sigma | G9023 | 4% |
| IL-34 | Peprotech | 200-34 | 100 ng/mL |
| ImageXpress Micro Confocal | Molecular Devices | ||
| Knockout DMEM/F12 | Gibco | #10829018 | |
| M-CSF | Peprotech | 300-25 | 25 ng/mL |
| Matrigel | Corning | #354277 | Basement membrane matrix (BMM) |
| Mouse anti-βIII-tubulin antibody | Promega | G712A | 1:1000 dilution |
| Mr. Frosty container | Thermo | 5100-0001 | |
| N2 supplement | Life technologies | 17502-048 | 1x |
| Paraformadehyde | Sigma | P6148 | 4% |
| PSC Neural Induction Medium | Gibco | A1647801 | |
| Rock inhibitor Y27632 | Stemcell technologies | #72304 | 1 mM stock |
| RT LTS 1000 ul pipette tips | RAININ | #30389218 | for transferring organoids |
| STEMdiff Cerebral Organoid Kit | Stem Cell Technologies | #08570 | |
| STEMdiff Hematopoietic Kit | StemCell Technologies | #5310 | Referred to as hematopoietic Kit |
| StemPro Neural Supplement | Gibco | A1050801 | Referred to as neural supplement |
| TGF-β1 | Peprotech | 100-21 | 50 ng/mL |
| Total RNA Purification Plus Kit | Norgen | #48400 | |
| TritonX-100 | Sigma | T9284 | 0.10% |
| Visikol Histo-Starter Kit | Visikol | HSK-1 | Contains organoid clearing solution HISTO-M, washing buffer |
| Zeiss LSM 510-META Confocal Microscope | Zeiss |
Referenzen
- Sabate-Soler, S., et al. Microglia integration into human midbrain organoids leads to increased neuronal maturation and functionality. Glia. 70 (7), 1267-1288 (2022).
- Lazarov, T., Juarez-Carreño, S., Cox, N., Geissmann, F. Physiology and diseases of tissue-resident macrophages. Nature. 618 (7966), 698-707 (2023).
- Wang, T., Liu, B., Zhang, W., Wilson, B., Hong, J. S. Andrographolide reduces inflammation-mediated dopaminergic neurodegeneration in mesencephalic neuron-glia cultures by inhibiting microglial activation. J Pharmacol Exp Ther. 308 (3), 975-983 (2004).
- Qian, L., Flood, P. M., Hong, J. S. Neuroinflammation is a key player in Parkinson's disease and a prime target for therapy. J Neural Transm (Vienna). 117 (8), 971-979 (2010).
- Clevers, H. Modeling development and disease with organoids. Cell. 165 (7), 1586-1597 (2016).
- Fakıoğlu, D. M., Altun, B. New therapeutic approaches in cystic fibrosis. Turk J Pharm Sci. 17 (6), 686-697 (2020).
- Mcmillan, R. E., Wang, E., Carlin, A. F., Coufal, N. G. Human microglial models to study host-virus interactions. Exp Neurol. 363, 114375 (2023).
- Scopa, C., et al. Jun upregulation drives aberrant transposable element mobilization, associated innate immune response, and impaired neurogenesis in Alzheimer's disease. Nat Commun. 14 (1), 8021 (2023).
- Tamaki, Y., et al. Spinal cord extracts of amyotrophic lateral sclerosis spread TDP-43 pathology in cerebral organoids. PLoS Genet. 19 (2), e1010606 (2023).
- Chambers, S. M., et al. Highly efficient neural conversion of human es and IPS cells by dual inhibition of smad signaling. Nat Biotechnol. 27 (3), 275-280 (2009).
- Kim, S. H., Chang, M. Y. Application of human brain organoids-opportunities and challenges in modeling human brain development and neurodevelopmental diseases. Int J Mol Sci. 24 (15), 12528 (2023).
- Ginhoux, F., et al. Fate mapping analysis reveals that adult microglia derive from primitive macrophages. Science. 330 (6005), 841-845 (2010).
- Ormel, P. R., et al. Microglia innately develop within cerebral organoids. Nat Commun. 9 (1), 4167 (2018).
- Abdelmalek, C. M., et al. Building a growing genomic data repository for maternal and fetal health through the ping consortium. medRxiv. , (2024).
- Wei, Z., et al. Human IPSC-derived brain organoids: A 3D mini-brain model for studying HIV infection. Exp Neurol. 364, 114386 (2023).
- Wang, T., et al. Regulation of stem cell function and neuronal differentiation by HERV-K via mTOR pathway. Proc Natl Acad Sci U S A. 117 (30), 17842-17853 (2020).
- Mcquade, A., et al. Development and validation of a simplified method to generate human microglia from pluripotent stem cells. Mol Neurodegener. 13 (1), 67 (2018).
- Lancaster, M. A., Knoblich, J. A. Generation of cerebral organoids from human pluripotent stem cells. Nat Protoc. 9 (10), 2329-2340 (2014).
- Fiorenzano, A., et al. Single-cell transcriptomics captures features of human midbrain development and dopamine neuron diversity in brain organoids. Nat Commun. 12 (1), 7302 (2021).
- Qian, X., et al. Brain-region-specific organoids using mini-bioreactors for modeling ZIKV exposure. Cell. 165 (5), 1238-1254 (2016).
- Park, D. S., et al. IPS-cell-derived microglia promote brain organoid maturation via cholesterol transfer. Nature. 623 (7986), 397-405 (2023).
- Schafer, S. T., et al. An in vivo neuroimmune organoid model to study human microglia phenotypes. Cell. 186 (10), 2111-2126.e20 (2023).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten