Method Article
小胶质细胞发育的人脑类器官的衍生
摘要
我们提出了一种方案,通过将诱导多能干细胞 (iPSC) 衍生的造血祖细胞 (HPC) 整合到类器官发育中来生成具有驻留小胶质细胞的人脑类器官。
摘要
源自诱导多能干细胞 (iPSC) 的三维 (3D) 脑类器官培养物为研究人脑发育和神经系统疾病的发病机制提供了一种 重要的体外替代 工具。然而,人脑类器官中缺乏小胶质细胞的掺入仍然是神经炎症 3D 模型的主要障碍。目前的方法包括将完全分化的小胶质细胞掺入成熟的脑类器官中,或从 iPSC 衍生的拟胚体 (EB) 的早期阶段诱导小胶质细胞分化。第一种方法错过了小胶质细胞分化与相邻神经环境相互作用的阶段,而后一种方法在技术上具有挑战性,导致最终类器官在小胶质细胞的数量和质量方面不一致。为了模拟具有小胶质细胞的脑类器官以研究小胶质细胞和神经元发育之间的早期相互作用,将从人类 iPSC 分化的高纯度造血祖细胞 (HPC) 掺入 iPSC 衍生的 EB 中以制造脑类器官。使用免疫染色和单细胞 RNA 测序 (sc-RNA-seq) 分析,我们证实 HPC 被整合到 3D 类器官中,最终发育成具有小胶质细胞和神经元的脑类器官。与没有 HPC 的脑类器官相比,这种方法在脑类器官中产生显着的小胶质细胞掺入。这种新颖的 3D 类器官模型由小胶质细胞和神经发育特性组成,可用于研究先天免疫和神经系统发育之间的早期相互作用,并有可能作为神经炎症和神经感染性疾病的模型。
引言
小胶质细胞是大脑中的寄宿免疫细胞,在大脑发育和体内平衡中起关键作用 1,2。小胶质细胞的激活导致促炎因子的产生、吞噬作用升高和反应性氧化应激,从而清除入侵的病原体和受损细胞。然而,另一方面,小胶质细胞的过度激活或长期激活可能导致神经退行性变,这是许多神经系统疾病(包括帕金森病)的发病机制 3,4。将小胶质细胞包含在研究人类神经系统疾病的相关模型中非常重要。近年来,人类干细胞已被用于开发 3D 类器官作为体外模型,作为动物模型和人类受试者研究的替代方案5。理想情况下,人类类器官由多种细胞类型和组织结构组成,类似于相应的人体器官,比动物模型更能代表人类生理学和发病机制,但没有直接研究人类个体所涉及的伦理问题。它们可能代表人类疾病建模的未来,用于发病机制和药物开发的研究以及个体化治疗的指导6。例如,源自人类诱导多能干细胞 (iPSC) 的 3D 人脑类器官在神经科学研究领域占主导地位,对神经传染病(包括 ZIKA、SARS-CoV-27)和神经退行性疾病(包括肌萎缩侧索硬化症 (ALS) 和阿尔茨海默病)进行建模 8,9。然而,使用双重 SMAD 抑制诱导神经元分化10 的常规 3D 神经类器官会产生缺乏小胶质细胞的脑类器官,因为它们来自从血液中募集的祖细胞,而不是神经元来自神经外胚层谱系11,12。如果没有小胶质细胞的存在,类器官不足以模拟 CNS 感染、炎症和相关的神经退行性变。
为了解决这一关键问题,已经尝试将分化的小胶质细胞整合到大脑类器官中13 或从一开始就使用替代方法而不是双重 SMAD 抑制在类器官内诱导小胶质细胞分化13。然而,通过将分化的小胶质细胞整合到大脑类器官中,神经元和小胶质细胞发育之间的早期相互作用被错过了。这在 CNS 发育或针对婴儿大脑发育的神经感染性疾病的发病机制中可能很重要,例如寨卡病毒感染14。另一方面,在没有间歇阶段的情况下,在 iPSC 衍生的脑类器官中区分先天性小胶质细胞涉及一个漫长的过程,并且在最终产物中具有更高的可变性15。在这个报道的方案中,我们将 iPSC 衍生的造血祖细胞 (HPC) 掺入 iPSC 中以制造拟胚体 (EB),其进一步分化为包括神经元和小胶质细胞在内的 3D 类器官。
我们的方案提供了一种简单的方法,可用于研究涉及早期神经元-小胶质细胞相互作用的人类中枢神经系统以及涉及小胶质细胞激活的神经感染性疾病和神经炎症的发病机制。
研究方案
在 NIH 的输血医学血库收集健康成年捐献者的原始血样,并根据 NIH 机构审查委员会获得签署的知情同意书。
1. 从人 iPSC 产生造血祖细胞 (HPC)
注:人 iPSC 细胞 510 和 507 用于产生代表性结果。iPSC 的产生和维持方法可在以前的出版物中找到16。
- 第 0 天:加入 500 μL/孔在 DMEM/F12 培养基中稀释的冰冷基质胶(基底膜基质 [BMM])溶液,包被 12 孔细胞板,并在室温 (RT) 下孵育至少 30 分钟。
- 完全去除涂层上清液,并用每孔 1 mL 的 E8 Flex 培养基替换。
- 在显微镜下检查 6 孔板中的 iPSC 培养物,以确认 iPSC 质量高且无分化迹象。通过在板底部下方用记号笔标记来选择一个中等大小的菌落。
- 从 iPSC 培养物中取出培养基,并向孔中加入 500 μL 乙二胺四乙酸 (EDTA) iPSC 解离缓冲液(0.5 mM EDTA,0.45 g/L NaCl 的 DPBS 溶液)。
- 当来自集落边缘的 3 到 4 行细胞开始收缩,细胞之间出现空隙时,在显微镜下观察细胞解离的迹象。这通常需要 1-3 分钟。
- 完全丢弃 EDTA 溶液。将 1 mL E8 Flex 培养基用力直接移液到标记的 iPSC 集落上,以去除标记的 iPSC 集落。确保菌落在移液 1-3 次后完全分离成含有 20-50 个细胞的细胞斑块。
- 收集含有细胞贴剂的上清液,并将其添加到 12 孔板中包被孔的第一个孔中。
- 通过移液 1 或 2 次混合孔,然后将 1 mL 细胞转移到含有 1 mL 培养基的第二个孔中。
- 重复步骤 1.8 两次,在总共四个孔中制备连续稀释的 iPSC 培养物。
- 将板在 37 °C、5% CO2 培养箱中孵育。
- 24 小时后,在第 1 天,在显微镜下检查菌落,并通过连续穿过井中的所有田来计算菌落的数量。选择一个包含 10-20 个 iPSC 集落的孔。
- 用造血试剂盒中的 1 mL 培养基 A 替换培养基。将板放回培养箱中 48 小时。
- 第 3 天,去除 500 μL 用过的培养基,并加入 500 μL 新鲜培养基 A。
- 第 4 天,在显微镜下观察,注意到 iPSC 集落的显着细胞生长和分化。用 1 mL 培养基 B 替换培养基。
- 在显微镜下监测细胞分化,并每隔一天用 500 μL 培养基 B 更换一半培养基。HPC 样细胞出现在第 6-7 天。
- 第 10 天,在显微镜下观察明亮的单圆形细胞,其形态与正常 HPCs 的形态漂浮在培养基中或松散地附着在扁平细胞的单底层上,带有一些松散的细胞聚集体。
注:差异化的 HPC 已准备好用于表征或进一步实验。 - 通过使用 1 mL 移液器吸头上下吹打 3 次来收集所有分化的 HPC,以打破细胞聚集体并将 HPC 从板表面分离。
- 将细胞加入 15 mL 试管中,并以 300 x g 离心细胞 5 分钟。去除上清液,将细胞沉淀重悬于 1 mL 培养基 B 中。
- 对细胞进行计数,并将浓度调节至 100 万个细胞/mL。在这个阶段,生成了超过 100 万个 HPC。使用流式细胞术检查时,确保 CD34+/CD43+ 细胞的纯度超过 85%。确保没有发现明显的死细胞(超过 5%)。
2. 从混合的 iPSC 和 HPC 发育胚状体
- 在收集 HPC 的同一天,确保 iPSC 培养物在 6 孔板中的一个孔(或 12 孔板中的两个孔)中也达到 80% 汇合。
- 用 500 μL 抗粘附冲洗溶液处理微孔培养板的一个孔以形成 EB,以尽量减少气泡。
- 在装有板支架的摆动桶转子中以 2000 x g 的速度旋转板 5 分钟,以去除可能的气泡。
- 通过移液完全去除冲洗溶液,然后用 1 mL DPBS 和 1 mL DMEM/F12 洗涤孔两次,而不会产生气泡。
- 通过用 1 mL Accutase 溶液处理细胞,将 iPSC 从板中解离。
- 在显微镜下观察,直到细胞出现分离迹象但仍附着在底部。这通常发生在 Accutase 治疗后 1-3 分钟内。不要过度消化 iPSC。
- 在不干扰细胞的情况下完全去除 Accutase 溶液,并向孔中加入 1 mL DMEM/F12 培养基。此外,使用 1 mL 吸头上下吹打几次,将细胞解离成单个细胞。
- 将细胞收集到 15 mL 试管中,并用 DMEM/F12 培养基填充至 5 mL。将细胞以 300 x g 旋转 5 分钟。
- 通过移液去除上清液,并将细胞重悬于 1 mL E8 Flex 培养基中。对细胞进行计数,并在 E8 Flex 培养基中将细胞浓度调节至 100 万个细胞/mL。
- 通过同时添加 100 万个 iPSC (1 mL) 和五十万个 HPC (500 μL),以 2:1 的比例混合 iPSC 和 HPC。将所有混合细胞添加到微孔培养板的先前处理的孔中。
- 将每 1 mL 培养基中加入 1 μL Rock 抑制剂 Y27632 储备溶液 (1 mM) 到上清液中。左右摇动板几次,使细胞均匀分布。
- 在装有板架的摆动桶转子中以 300 x g 旋转微孔培养板 5 分钟。在显微镜下观察,看细胞是否已经沉降到微孔中。(补充图 1A)。
- 在不干扰细胞的情况下,将板放入 37 °C、5% CO2 细胞培养箱中。
- 第 2 天,48 小时后,在显微镜下观察细胞是否形成 EB。当 EB 清晰形成后,继续下一步(补充图 1B)。
- 用抗粘附冲洗缓冲液 (500 μL) 处理 24 孔细胞培养板 15 分钟,以制成低附着板。
- 完全去除冲洗缓冲液,用 1 mL DPBS 洗涤孔两次,然后向孔中加入 1 mL E8 Flex 培养基。
- 用 1 mL 宽口移液器吸头移液几次,将 EB 重悬于微孔培养板中。
- 对于低粘附处理的 24 孔板的每个孔,收集并添加 100 μL 含有 EB 的培养基。这将导致每孔 10-20 个 EB。将 E8 Flex 培养基添加到包含剩余 EB 作为备份的旧孔中。
- 将板在 37 °C、5% CO2 细胞培养箱中孵育 48 小时。
3. 3D 神经类器官诱导、增殖和成熟
- 在 EB 形成后的第 2 天,在冰上解冻 BMM 等分试样至少 30 分钟。
- 使用预冷的 20 μL 吸头,并在培养基上明智地加入 15 μL 冰冷的 BMM 滴剂以包被 EB。这会形成一层 BMM 薄膜,EB 将附着并生长在上面。
- 将板放入 37 °C、5% CO2 细胞培养箱中。
- 第 4 天,在 EB 形成后,小心去除 500 μL 培养基,不要丢弃 EB,并按照步骤 3.2 重复 BMM 涂层。
- 通过在细胞顶部添加 500 μL PSC 神经诱导培养基立即开始神经诱导。
- 在第 6 天和第 8 天,通过小心去除 500 μL 培养基而不接触细胞并添加 500 μL 神经诱导培养基来进行半培养基更换。
- 在第 10 天、第 12 天和第 14 天,用神经干细胞 (NSC) 培养基进行半培养基更换:敲除 DMEM/F12 + 1x Glutamax 补充剂 + 1x 神经补充剂 + bFGF + EGF。
- 第 15 天,将含有培养基的整个球体孔转移到新的12孔板中,如前所述,用防粘附冲洗溶液处理。在培养物上加入 500 μL 神经元成熟培养基(DMEM/F12 + 1x N2 补充剂 + 1x B27 补充剂 + 1x 抗生素-抗真菌剂)。
- 每隔一天用神经元成熟培养基进行半培养基更换。
- 在成熟阶段,如果有营养耗尽的迹象,例如培养基的颜色变化,请将类器官移至 6 孔板中,每孔最多可容纳 3 mL 培养基。
- 或者,在 EB 形成后 17 天,在成熟培养基中补充细胞因子(IL-34、M-CSF、TGF-β1、CD200、CX3CL1)6 天,以促进小胶质细胞成熟。
- 在第 23 天,收集所得神经类器官用于表征或进一步实验。
4. 3D 神经类器官的清除和免疫染色
- 通过在 4 °C 下浸入 1 mL 的 4% 多聚甲醛 (PFA) 中 24 小时,固定多达 10 个类器官。
- 将每孔的类器官转移到 96 孔透明底板中,用 200 μL DPBS 洗涤 2 次,每次轻轻摇动 1 小时。
- 通过在 50% 甲醇的 DPBS 溶液中洗涤一次,在 80% 甲醇的双蒸 (dd) 水中洗涤一次,并在 4 °C 下轻轻摇动,分别洗涤 10 分钟,使类器官透化。
- 在 20% DMSO/甲醇、80% 甲醇的 dd 水溶液、50% 甲醇的 DPBS 溶液、100% DPBS 中连续洗涤类器官,然后在含有 0.2% Triton X-100 的 DPBS 中连续洗涤类器官,每次在 4 °C 下轻轻摇动。每次洗涤后努力完全去除残留的缓冲液。
- 在透化缓冲液(含 0.2% Triton X100、0.3 M 甘氨酸和 20% DMSO 的 DPBS)中孵育,在 RT 下轻轻摇动 40 分钟。
- 在 37 °C 下封闭缓冲液(含 0.2% Triton X100、6% 山羊血清和 10% DMSO 的 DPBS)中封闭 1 小时,同时在振荡器上以 80 rpm 轻轻摇动。
- 在抗体稀释缓冲液(IBA1 1:100、TREM2 1:100、βIII-微管蛋白、1:1000、100 μL/孔的 DPBS 中,含 0.2% 吐温 20、100 μg/mL 肝素、3% 山羊血清和 5% DMSO)中与抗体一起在 37 °C 下孵育 2 小时,或在冷藏室中以 80 rpm 轻轻摇动孵育 3 天。
- 用含 0.2% 吐温 20、100 μg/mL 肝素的 DPBS 洗涤 5 次,每次 10 分钟,在 RT 下在摇床上以 80 rpm 的速度轻轻摇动。
- 与 2 抗(1:200 山羊抗小鼠 Alexa488)在 37 °C 下孵育 1 小时,然后在摇床上以 80 rpm 的速度轻轻摇动 RT 过夜。
- 对于核对比染色,在抗体孵育的同时或在洗涤缓冲液中进行 DAPI 染色。
- 在洗涤缓冲液中洗涤类器官 10 次,每次在 37 °C 下洗涤 10 分钟,轻轻摇动。
- 在显微镜下观察。如果背景仍然很高,请继续洗涤 5 次。
- 尽可能丢弃上清液。加入 200 μL 类器官透明化溶液,孵育 5 分钟后观察,并使用共聚焦显微镜拍摄图像。
结果
我们的方案遵循一种方案,将 HPC 与 iPSC 区分开来,然后将 HPC 与 iPSC 混合以制造 EB,然后进行神经诱导、分化和成熟(图 1)。高质量的 HPC 分化对于 EB 形成和随后的类器官分化的成功至关重要。使用连续稀释培养技术产生适当数量和大小的 iPSC 集落以开始 HPC 分化(图 2A)。正常情况下,iPSC 集落在培养基 A 中培养结束时会发生显著的形态变化(图 2B),并在培养基 B 中 3 天后进一步显示 HPC 分化(图 2C),表现为均匀的圆形细胞,漂浮在培养容器的上方或附着在培养容器的底部。HPC 可能会扩展以形成集落样细胞簇(图 2D)。HPC 在第 10 天占主导地位,没有显示明显的碎片(图 2E)。高质量的 HPC 和 iPSC 混合物导致 EB 在 24 小时内形成,EB 以最少的细胞碎片继续生长(图 3A)。碎片过多的低质量 HPC 可能会导致 EB 形成困难。将 EB 转移到新板后,它们继续生长,并最终在成熟培养基中达到平台期(图 3B)。EB 将分化为含有 IBA1 和 TREM2 阳性小胶质细胞的类器官,有或没有小胶质细胞因子处理(图 4)或没有处理(图 5)。用小胶质细胞生长细胞因子治疗可能会增加TMEM119特异性小胶质细胞的数量(图 6)。代表性类器官在清除和免疫染色后显示 βIII 微管蛋白阳性神经元和 IBA1 阳性小胶质细胞(图 7)。当用脂多糖 (LPS) 处理时,可以通过小胶质细胞特异性标志物和促炎基因激活观察到小胶质细胞活化的增加(图 8)。 补充 图 2 显示了在没有额外小胶质细胞因子的情况下培养的类器官中的 IBA-1 和 TMEM-119 阳性细胞。
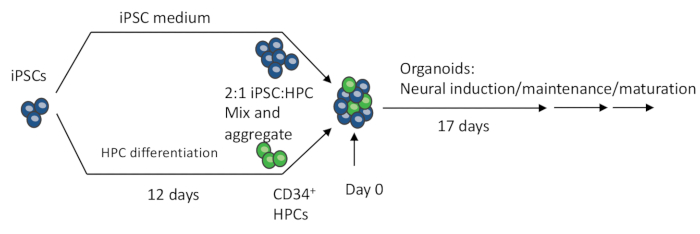
图 1:从 iPSC 制备 3D 类器官的示意图。 EB 是通过混合 iPSC 和 iPSC 分化的 HPC 制成的。EB 进一步经历神经诱导、分化和成熟,以产生包含神经元和小胶质细胞的类器官。 请单击此处查看此图的较大版本。

图 2:从 iPSC 到 HPC 的典型形态变化。 显示了 (A) iPSC 集落、(B) 培养基 A 处理结束时、(C) 培养基 B 中 3 天、(D) 培养基 B 中第 10 天和 (E) 所得漂浮 HPC 的代表性图像。在荧光显微镜下用 10 倍或 4 倍物镜拍摄图像。 请单击此处查看此图的较大版本。
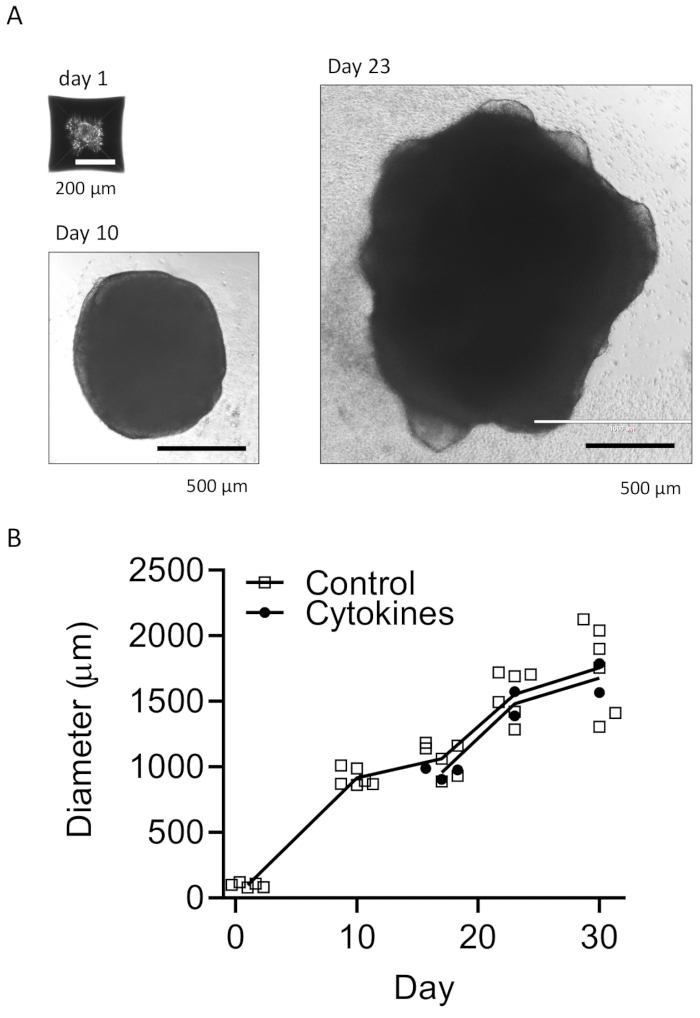
图 3:开发 EB 和成熟类器官。 (A) 代表性照片显示了 EB 形成(第 1 天)、类器官生长(第 10 天)和成熟(第 23 天)。显示了具有或不具有小胶质细胞分化细胞因子的类器官大小的生长曲线 (B)。在荧光显微镜下用 10 倍或 4 倍物镜拍摄图像。 请单击此处查看此图的较大版本。
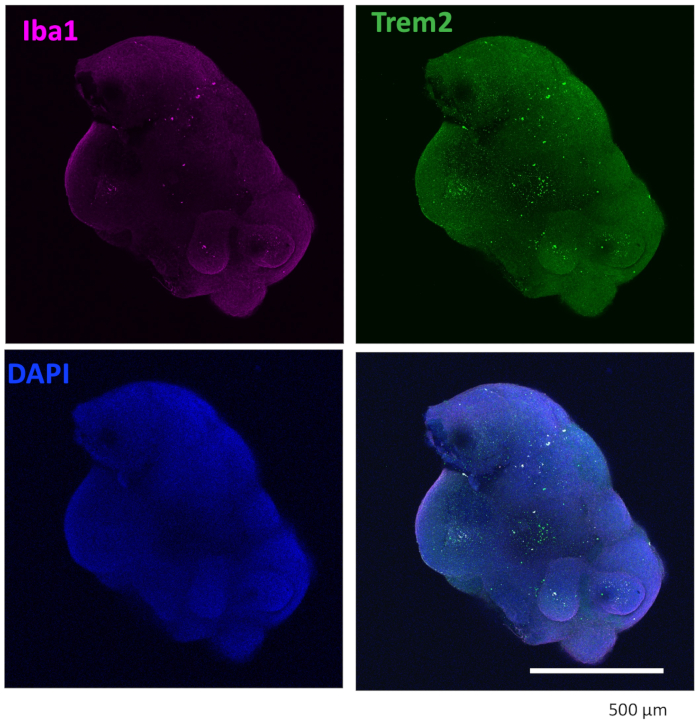
图 4:用小胶质细胞分化细胞因子培养的类器官含有小胶质细胞。 清除和免疫染色后,类器官显示小胶质细胞用 IBA1 和 TREM2 呈阳性染色。显示了在共聚焦显微镜的 10 倍物镜下拍摄的图像。 请单击此处查看此图的较大版本。
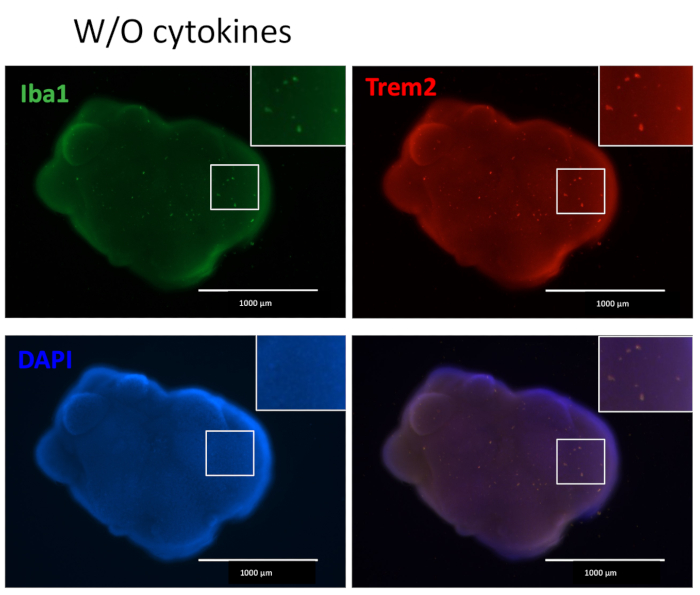
图 5:没有额外小胶质细胞分化细胞因子培养的类器官含有小胶质细胞。 在没有添加外部小胶质细胞分化细胞因子的情况下,类器官仍然产生用 IBA1 和 TREM2 染色的小胶质细胞阳性,表明类器官中神经元发育的微环境足以将 HPC 分化为小胶质细胞。在荧光显微镜下用 4 倍物镜拍摄图像。 请单击此处查看此图的较大版本。

图 6:含有 3D 类器官的小胶质细胞的单细胞 RNA-seq 结果。 (A) 图显示 IBA1 (AIF1) 、 TMEM119 和 MAP2 在类器官中分布,没有额外的小胶质细胞分化细胞因子。(B) 在两种培养有额外小胶质细胞分化细胞因子的类器官中计数 IBA1 和 TEME119 阳性小胶质细胞。IBA1 和 TMEM119 阳性细胞的数量在代表性类器官中发生变化。 请单击此处查看此图的较大版本。
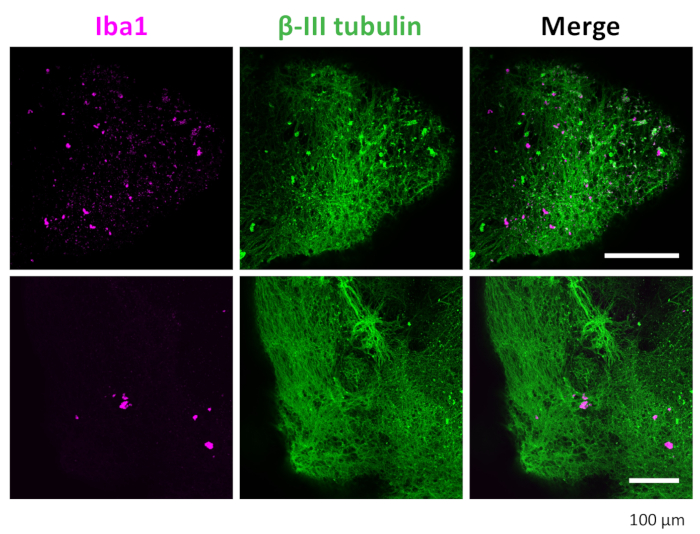
图 7:3D 类器官中神经元和小胶质细胞的免疫染色。 经过清除和免疫染色,类器官显示 IBA1 染色的小胶质细胞阳性和 βIII-微管蛋白染色的神经元。显示了在具有 20 倍物镜的共聚焦显微镜下拍摄的代表性图像。 请单击此处查看此图的较大版本。
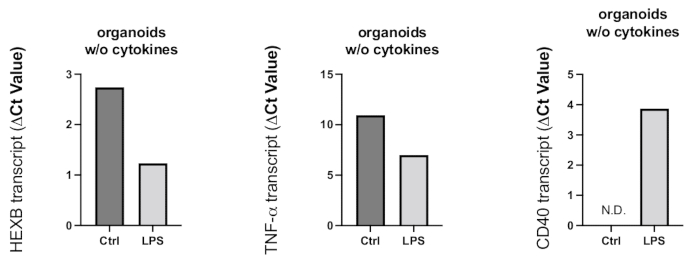
图 8:LPS 处理在类器官中诱导的炎症激活。 LPS 处理 24 h 后,收集类器官,采用 RT-PCR 测定小胶质细胞活化和促炎反应。由于 Ct 值与基因表达水平呈负相关,如代表性图表所示,LPS 处理导致小胶质细胞活化标志物 HEXB 和促炎细胞因子 TNF-α 的基因表达增加。虽然在对照类器官中未检测到 CD40 基因表达,但 LPS 处理导致可检测到 CD40 转录本。 请单击此处查看此图的较大版本。
补充 图 1:微孔培养板中的 EB。 (A) 离心后,将混合的 HPC 和 iPSC 沉淀在微孔培养板的微孔中。(B) 在显微镜下观察时,在微孔培养板中孵育 24 小时后形成 EB。(C) 在 EB 形成后 8 天在形成的类器官中观察到 CD34+ 细胞。共聚焦图像是使用 20 倍物镜拍摄的。 请点击此处下载此图表。
补充 图 2:共聚焦图像显示在没有额外小胶质细胞因子的情况下培养的类器官中存在 IBA-1 和 TMEM-119 阳性细胞。 使用共聚焦显微镜以 20 倍和 2 倍放大显示细胞的形态,以拍摄图像。 请点击此处下载此图表。
讨论
在这里,提出了一种详细的方案,用于制造含有来自混合 iPSC 和 iPSC 分化 HPC 的 EB 的先天性小胶质细胞的 3D 神经类器官。这是一种相对较短且简单的方法,仅涉及大多数实验室中通常可用的细胞培养技术和设备。
该协议成功的最关键因素是 HPC 差异化的质量。我们采用了已发表的方法17 ,使用商业试剂盒将 HPC 与 iPSC 区分开来,并进行了一些修改。与原始方案相比,我们从较小大小和较低范围的 iPSC 集落开始,并在分化 10 天而不是 12 天后收集分化的 HPC。这种方法每孔仅产生 1-200 万个 HPC,但对于下一步的 3D 类器官生产来说仍然绰绰有余。保持这些细胞和 iPSC 集落之间的适当平衡很重要,因为过多的细胞最终可能导致死细胞/碎片,从而导致 EB 形成失败。虽然可以在诱导后第 10 天到第 12 天收集 HPC,但我们发现在第 12 天收集会有更多死细胞和杂质的风险,因为 HPC 的快速生长到培养结束时很容易耗尽营养因子,需要密切监测和额外的培养基更换。通过在第 10 天收集 HPC,无需通过流式细胞术或磁珠纯化进行 HPC 纯化,而这些对于富集较低纯度的 HPC 是必需的。
对于正常的 iPSC 传代培养和 HPC 分化,使用 EDTA 解离缓冲液,其效果温和,仅将 iPSC 集落解离成小细胞斑块,有利于分裂后 iPSC 的重新附着。然而,细胞斑块可能会干扰 EB 的形成。因此,Accutase 处理用于解离 iPSC 并实现单细胞溶液,以实现更均匀的 EB 形成。当通过解离 iPSC 来制备 EB 时,重要的是不要用 Accutase 过度处理 iPSC,这可能会导致细胞过度死亡。将 iPSC 置于室温下并悬浮过长时间也可能导致大量细胞死亡和分化终止。因此,应尽快完成从步骤 2.1 到 2.13 的过程,以避免不必要的延误。
为了促进神经分化和成熟,每孔培养几个 EB。此设置有助于 EB 的融合并减少类器官成熟所需的时间。然而,很难控制用于融合的 EB 的确切数量,因此可能会在所得类器官的大小和形状中引入不规则性。可以通过不时摇动板或尽可能使用生物反应器来最大限度地减少不规则性。也可以将单个 EB 接种到 96 孔板的孔中以完全避免融合,但类器官的生长和成熟需要额外的努力和时间。
与以最公认的方法18 用 Matrigel 单独包埋类器官相反,我们明智地将 Matrigel 滴剂涂抹在培养基顶部数次。这种方法劳动强度较低,但在类器官中产生高质量的神经分化。本研究中描述的方案生成具有小胶质细胞的皮质神经元。然而,通过按照已发表的技术19,20 调整生长因子和分化步骤,它可以很容易地适应产生代表大脑其他特定神经元类型或区域的类器官。
最近的出版物已将 iPSC 分化的小胶质细胞或巨噬细胞样细胞整合到发育中的皮质类器官中,以制造含有小胶质细胞的脑类器官21。由于成年小胶质细胞是从胚胎早期第12 天募集到大脑中的原始 HPC 发育而来的,因此我们将 HPC 整合到 EB 形成中,并在神经诱导之前。有趣的是,如果不应用通常用于在脑类器官中产生小胶质细胞分化的特异性细胞因子22,我们仍然在产生的脑类器官中观察到不错的小胶质细胞分化,尽管 TREM2 阳性细胞的数量较少,与用细胞因子培养的细胞相比。它表明,将 HPC 包含在 EB 形成中并确保神经发育过程和 HPC 的早期相互作用可能足以区分大脑类器官中的小胶质细胞。它还表明,我们的方案作为研究大脑早期小胶质细胞发育的模型很有价值。
如前所述,该协议产生模拟早期人类大脑发育的类器官。尽管我们已经培养了类器官长达 6 周而没有注意到基于类器官形态的明显恶化,并且一些培养已经达到 4 个月以上,但自 8 周龄以来,在类器官核心中发现了细胞坏死。这在其他类型的脑类器官中也很常见,因为生长中的类器官中的中心细胞在获取营养方面遇到困难。使用连续振荡的生物反应器可以提高类器官的活力并延长其寿命,从而使更成熟的细胞类型分化。然而,如果没有某些自动培养帮助,长期培养几乎肯定会导致更大的变异性。因此,我们建议使用该方案来研究与小胶质细胞相关的早期大脑发育以及神经感染对大脑发育的急性影响。对于更复杂的大脑建模,我们建议研究人员使用此方案作为基础并应用修改以提高一致性并促进长期培养。
总之,在本方案中,我们将 iPSC 分化的 HPC 整合到 EB 形成中并进一步诱导神经分化。在不到一个月的时间里,该方案将产生包含由相同 iPSC 产生的神经元和小胶质细胞的类器官。它提供了一种方便的替代方案,可以制造具有神经元和小胶质细胞发育之间早期相互作用的脑类器官,从而使其可用于研究人脑发育的生理学以及涉及先天性小胶质细胞的神经感染和神经炎症性疾病。
披露声明
作者没有什么可披露的。
致谢
这项研究得到了 NINDS 校内研究基金的支持。
材料
| Name | Company | Catalog Number | Comments |
| 12 well cell culture plates | Corning | #3512 | |
| 24 well cell culture plate | SARSTEDT | #83.3922 | |
| Accutase | Thermo | A1110501 | |
| Aggrewell 400 plate | Stemcell technologies | #34411 | Referred to as microwell culture plate |
| Alexa Fluor 488 goat anti-mouse antibody | Life techniologies | A11001 | 1:400 dilution |
| Alexa Fluor 594 goat anti-rabbit antibody | Life techniologies | A11012 | 1:400 dilution |
| Allegra X-30R Centrifuge with rotor S6069 | Beckman Couler | ||
| Anti- Adherence Rinsing solution | Stem Cell Technologies | #07010 | |
| anti-CD34 antibody | Stem Cell Technologies | #60013 | 1:100 dilution |
| anti-Human CD43 antibody | Stem Cell Technologies | #60085 | 1:100 dilution |
| anti-IBA1 rabbbit antibody | Fujifilm | 019-19741 | 2.5 µg/mL |
| anti-TREM2 rat pAb | RD Systems | mab17291 | 2.5 µg/mL |
| Antibiotic-antimycotic | Gibco | 15240-062 | 1x |
| B27 supplement | Life technologies | 17504-044 | 1x |
| bFGF | Peprotech | 100-18B | 20 ng/mL |
| CD200 | Novoprotein | C311 | 100 ng/mL |
| CryoTube vials | Thermo | #368632 | |
| CX3CL1 | Peprotech | 300-31 | 100 ng/mL |
| DAPI | Sigma | D9542 | 1 µg/mL |
| DMEM/F12 | Life technologies | 12400-024 | 1x |
| DMSO | Sigma | D2650 | |
| DPBS | Gibco | #4190136 | 1x |
| E8 Flex medium kit | Thermo | A2858501 | |
| EDTA | Mediatech | 46-034-Cl | 0.5 mM |
| EGF | Peprotech | AF-100-15 | 20 ng/mL |
| EVOS FL Auto Microscope | Thermo | Fluorescence microscope | |
| FastStart Universal SYBR Green PCR master mix | Roche | #4913850001 | |
| Glutamax | Gibco | #35050079 | |
| Goat serum | Sigma | G9023 | 4% |
| IL-34 | Peprotech | 200-34 | 100 ng/mL |
| ImageXpress Micro Confocal | Molecular Devices | ||
| Knockout DMEM/F12 | Gibco | #10829018 | |
| M-CSF | Peprotech | 300-25 | 25 ng/mL |
| Matrigel | Corning | #354277 | Basement membrane matrix (BMM) |
| Mouse anti-βIII-tubulin antibody | Promega | G712A | 1:1000 dilution |
| Mr. Frosty container | Thermo | 5100-0001 | |
| N2 supplement | Life technologies | 17502-048 | 1x |
| Paraformadehyde | Sigma | P6148 | 4% |
| PSC Neural Induction Medium | Gibco | A1647801 | |
| Rock inhibitor Y27632 | Stemcell technologies | #72304 | 1 mM stock |
| RT LTS 1000 ul pipette tips | RAININ | #30389218 | for transferring organoids |
| STEMdiff Cerebral Organoid Kit | Stem Cell Technologies | #08570 | |
| STEMdiff Hematopoietic Kit | StemCell Technologies | #5310 | Referred to as hematopoietic Kit |
| StemPro Neural Supplement | Gibco | A1050801 | Referred to as neural supplement |
| TGF-β1 | Peprotech | 100-21 | 50 ng/mL |
| Total RNA Purification Plus Kit | Norgen | #48400 | |
| TritonX-100 | Sigma | T9284 | 0.10% |
| Visikol Histo-Starter Kit | Visikol | HSK-1 | Contains organoid clearing solution HISTO-M, washing buffer |
| Zeiss LSM 510-META Confocal Microscope | Zeiss |
参考文献
- Sabate-Soler, S., et al. Microglia integration into human midbrain organoids leads to increased neuronal maturation and functionality. Glia. 70 (7), 1267-1288 (2022).
- Lazarov, T., Juarez-Carreño, S., Cox, N., Geissmann, F. Physiology and diseases of tissue-resident macrophages. Nature. 618 (7966), 698-707 (2023).
- Wang, T., Liu, B., Zhang, W., Wilson, B., Hong, J. S. Andrographolide reduces inflammation-mediated dopaminergic neurodegeneration in mesencephalic neuron-glia cultures by inhibiting microglial activation. J Pharmacol Exp Ther. 308 (3), 975-983 (2004).
- Qian, L., Flood, P. M., Hong, J. S. Neuroinflammation is a key player in Parkinson's disease and a prime target for therapy. J Neural Transm (Vienna). 117 (8), 971-979 (2010).
- Clevers, H. Modeling development and disease with organoids. Cell. 165 (7), 1586-1597 (2016).
- Fakıoğlu, D. M., Altun, B. New therapeutic approaches in cystic fibrosis. Turk J Pharm Sci. 17 (6), 686-697 (2020).
- Mcmillan, R. E., Wang, E., Carlin, A. F., Coufal, N. G. Human microglial models to study host-virus interactions. Exp Neurol. 363, 114375(2023).
- Scopa, C., et al. Jun upregulation drives aberrant transposable element mobilization, associated innate immune response, and impaired neurogenesis in Alzheimer's disease. Nat Commun. 14 (1), 8021(2023).
- Tamaki, Y., et al. Spinal cord extracts of amyotrophic lateral sclerosis spread TDP-43 pathology in cerebral organoids. PLoS Genet. 19 (2), e1010606(2023).
- Chambers, S. M., et al. Highly efficient neural conversion of human es and IPS cells by dual inhibition of smad signaling. Nat Biotechnol. 27 (3), 275-280 (2009).
- Kim, S. H., Chang, M. Y. Application of human brain organoids-opportunities and challenges in modeling human brain development and neurodevelopmental diseases. Int J Mol Sci. 24 (15), 12528(2023).
- Ginhoux, F., et al. Fate mapping analysis reveals that adult microglia derive from primitive macrophages. Science. 330 (6005), 841-845 (2010).
- Ormel, P. R., et al. Microglia innately develop within cerebral organoids. Nat Commun. 9 (1), 4167(2018).
- Abdelmalek, C. M., et al. Building a growing genomic data repository for maternal and fetal health through the ping consortium. medRxiv. , (2024).
- Wei, Z., et al. Human IPSC-derived brain organoids: A 3D mini-brain model for studying HIV infection. Exp Neurol. 364, 114386(2023).
- Wang, T., et al. Regulation of stem cell function and neuronal differentiation by HERV-K via mTOR pathway. Proc Natl Acad Sci U S A. 117 (30), 17842-17853 (2020).
- Mcquade, A., et al. Development and validation of a simplified method to generate human microglia from pluripotent stem cells. Mol Neurodegener. 13 (1), 67(2018).
- Lancaster, M. A., Knoblich, J. A. Generation of cerebral organoids from human pluripotent stem cells. Nat Protoc. 9 (10), 2329-2340 (2014).
- Fiorenzano, A., et al. Single-cell transcriptomics captures features of human midbrain development and dopamine neuron diversity in brain organoids. Nat Commun. 12 (1), 7302(2021).
- Qian, X., et al. Brain-region-specific organoids using mini-bioreactors for modeling ZIKV exposure. Cell. 165 (5), 1238-1254 (2016).
- Park, D. S., et al. IPS-cell-derived microglia promote brain organoid maturation via cholesterol transfer. Nature. 623 (7986), 397-405 (2023).
- Schafer, S. T., et al. An in vivo neuroimmune organoid model to study human microglia phenotypes. Cell. 186 (10), 2111-2126.e20 (2023).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。