Method Article
Derivación de un organoide cerebral humano con desarrollo de microglía
En este artículo
Resumen
Presentamos un protocolo para generar un organoide cerebral humano con microglía residente mediante la incorporación de células progenitoras hematopoyéticas (HPC) derivadas de células madre pluripotentes inducidas (iPSC) en el desarrollo de organoides.
Resumen
Los cultivos tridimensionales (3D) de organoides cerebrales derivados de células madre pluripotentes inducidas (iPSC) proporcionan una importante herramienta alternativa in vitro para estudiar el desarrollo del cerebro humano y la patogénesis de las enfermedades neurológicas. Sin embargo, la falta de incorporación de microglía en los organoides del cerebro humano sigue siendo un obstáculo importante para los modelos 3D de neuroinflamación. Los enfoques actuales incluyen la incorporación de microglía completamente diferenciada en organoides cerebrales maduros o la inducción de la diferenciación microglial desde la etapa temprana de cuerpos embrioides (EB) derivados de iPSC. El primer enfoque pasa por alto la etapa en la que la diferenciación microglial interactúa con el entorno neuronal adyacente, y el último enfoque es técnicamente desafiante, lo que resulta en inconsistencia entre los organoides finales en términos de la cantidad y calidad de la microglía. Para modelar organoides cerebrales con microglía para estudiar las interacciones tempranas entre el desarrollo microglial y neuronal, se incorporaron células progenitoras hematopoyéticas (HPC) de alta pureza diferenciadas de las iPSC humanas en EB derivadas de iPSC para producir organoides cerebrales. Mediante el uso de inmunotinción y secuenciación de ARN de una sola célula (sc-RNA-seq), confirmamos que las HPC se incorporaron a los organoides 3D, que finalmente se convirtieron en organoides cerebrales con microglía y neuronas. En comparación con los organoides cerebrales sin HPC, este enfoque produce una incorporación microglial significativa en los organoides cerebrales. Este novedoso modelo de organoide 3D, que consta de propiedades de desarrollo microglial y neuronal, se puede utilizar para estudiar las interacciones tempranas entre el desarrollo inmunitario innato y del sistema nervioso y, potencialmente, como modelo para la neuroinflamación y los trastornos neuroinfecciosos.
Introducción
Las microglías son células inmunitarias residenciales en el cerebro, que desempeñan un papel fundamental tanto en el desarrollo del cerebro como en la homeostasis 1,2. La activación de la microglía da lugar a la producción de factores proinflamatorios, fagocitosis elevada y estrés oxidativo reactivo, que elimina los patógenos invasores y las células comprometidas. Sin embargo, la sobreactivación o la activación prolongada de la microglía puede, por otro lado, causar neurodegeneración como mecanismo de patogénesis en muchos trastornos neurológicos, incluida la enfermedad de Parkinson 3,4. Es importante que la microglía se incluya en los modelos relevantes para el estudio de los trastornos neurológicos humanos. En los últimos años, las células madre humanas se han utilizado para desarrollar organoides 3D como modelos in vitro como alternativa a los modelos animales y a los estudios con sujetos humanos5. Idealmente, los organoides humanos constituyen múltiples tipos de células y estructuras de tejidos similares a los órganos humanos correspondientes, representando mejor la fisiología y la patogénesis humanas que los modelos animales, pero sin las preocupaciones éticas involucradas en los estudios de individuos humanos directamente. Pueden representar el futuro de la modelización de enfermedades humanas para el estudio de la patogénesis y el desarrollo de fármacos y para la orientación de terapias individualizadas6. Por ejemplo, los organoides cerebrales humanos en 3D derivados de células madre pluripotentes inducidas por humanos (iPSC) han prevalecido en el campo de la investigación en neurociencia, modelando enfermedades infecciosas neuronales como el ZIKA, el SARS-CoV-27 y enfermedades neurodegenerativas como la esclerosis lateral amiotrófica (ELA) y la enfermedad de Alzheimer 8,9. Sin embargo, los organoides neuronales 3D convencionales que utilizan la inhibición de SMAD dual para inducir la diferenciación neuronal10 producen organoides cerebrales que carecen de microglía, ya que se derivan de progenitores reclutados de la sangre en lugar del linaje del neuroectodermo del que provienen las neuronas 11,12. Sin la presencia de microglía, los organoides son inadecuados para modelar las infecciones del SNC, la inflamación y la neurodegeneración asociada.
Para abordar este problema crítico, se han realizado intentos de incorporar microglía diferenciada en los organoides cerebrales13 o inducir la diferenciación microglial dentro de los organoides desde el principio utilizando enfoques alternativos en lugar de la inhibición de SMAD dual13. Sin embargo, al incorporar microglía diferenciada en los organoides cerebrales, se pierden las interacciones tempranas entre el desarrollo neuronal y microglial. Esto podría ser importante en el desarrollo del SNC o en la patogénesis de trastornos neuroinfecciosos dirigidos al desarrollo del cerebro infantil, como en la infección por el virus ZIKA14. Por otro lado, la diferenciación de la microglía innata dentro de organoides cerebrales derivados de iPSC sin etapas intermitentes implica un proceso prolongado y tiene una mayor variabilidad dentro de los productos finales15. En este protocolo informado, incorporamos las células progenitoras hematopoyéticas (HPC) derivadas de iPSC en las iPSC para crear cuerpos embrioides (EB), que se diferenciaron aún más en organoides 3D que incluían neuronas y microglía.
Nuestro protocolo proporciona un enfoque fácil que se puede adoptar para estudiar el sistema nervioso central humano que involucra interacciones neuronas y microgliales tempranas y la patogénesis de trastornos infecciosos neuronales y neuroinflamación que involucran activación microglial.
Protocolo
Las muestras de sangre originales de donantes adultos sanos se recolectaron en el Banco de Sangre de Medicina Transfusional de los NIH, y se obtuvieron formularios de consentimiento informado firmados de acuerdo con la Junta de Revisión Institucional de los NIH.
1. Producción de células progenitoras hematopoyéticas (HPC) a partir de iPSC humanas
NOTA: Se utilizaron las células iPSC humanas 510 y 507 para producir los resultados representativos. Los métodos de generación y mantenimiento de las iPSCs se pueden encontrar en una publicación anterior16.
- Día 0: Cubrir una placa de celdas de 12 pocillos añadiendo 500 μL/pocillo de solución helada de Matrigel (matriz de membrana basal [BMM]) diluida en medio DMEM/F12 e incubarla durante al menos 30 minutos a temperatura ambiente (RT).
- Retire completamente el sobrenadante de recubrimiento y reemplácelo con 1 mL de medio E8 Flex por pocillo.
- Verifique el cultivo de iPSC en una placa de 6 pocillos bajo el microscopio para confirmar que las iPSC son de alta calidad y sin signos de diferenciación. Elige una colonia de tamaño mediano marcándola con un rotulador debajo de la parte inferior del plato.
- Retire el medio del cultivo de iPSC y añada 500 μL de tampón de disociación iPSC de ácido etilendiaminotetraacético (EDTA) (0,5 mM de EDTA, 0,45 g/L de NaCl en DPBS) al pocillo.
- Observe bajo un microscopio los signos de disociación celular cuando tres o cuatro filas de células de los bordes de la colonia comienzan a encogerse, con la aparición de espacio vacío entre las células. Esto suele tardar entre 1 y 3 minutos.
- Deseche la solución de EDTA por completo. Desaloje la colonia de iPSC marcada pipeando 1 mL de medio E8 Flex con fuerza y directamente sobre ella. Asegúrese de que la colonia se desprenda completamente en parches celulares que contengan de 20 a 50 células cada uno después de 1 a 3 veces de pipeteo.
- Recoja el sobrenadante que contiene parches celulares y agréguelo al primer pocillo de los pocillos recubiertos en la placa de 12 pocillos.
- Mezcle el pocillo pipeteando una o dos veces y transfiera 1 mL de las células al segundo pocillo que contiene 1 mL de medio.
- Repita el paso 1.8 dos veces para hacer cultivos de iPSC diluidos en serie en un total de cuatro pocillos.
- Incubar la placa en una incubadora a 37 °C, 5% de CO2.
- Pasadas las 24 h, el día 1, revisa las colonias bajo el microscopio y cuenta el número de colonias recorriendo todos los campos de un pozo de forma continua. Elija un pozo que contenga de 10 a 20 colonias de iPSC.
- Reemplace el medio con 1 mL de medio A del kit hematopoyético. Vuelva a colocar la placa en la incubadora durante 48 h.
- El día 3, retire 500 μL de medio gastado y agregue 500 μL de medio A fresco.
- El día 4, observe bajo el microscopio y note un crecimiento celular significativo y una diferenciación de las colonias de iPSC. Reemplace el medio con 1 mL de medio B.
- Controle la diferenciación celular bajo el microscopio y realice el cambio de medio medio con 500 μL de medio B cada dos días. Las células tipo HPC aparecen en los días 6-7.
- En el día 10, observe bajo el microscopio células redondas brillantes con la morfología de las HPC normales flotando en el medio o débilmente unidas a la capa inferior única de células planas, con algunos agregados de células sueltas.
NOTA: Las HPC diferenciadas están listas para su recolección para su caracterización o experimentación adicional. - Recoja todas las HPC diferenciadas pipeteando hacia arriba y hacia abajo tres veces con una punta de pipeta de 1 ml para romper los agregados de células y separar las HPC de la superficie de la placa.
- Agregue las células en un tubo de 15 ml y centrifugue las células a 300 x g durante 5 minutos. Retire el sobrenadante y vuelva a suspender el pellet celular en 1 mL de medio B.
- Cuente las células y ajuste la concentración a 1 millón de células/mL. En esta etapa, se generan más de 1 millón de HPC. Cuando se comprueba con citometría de flujo, asegúrese de que la pureza sea superior al 85% de las células con CD34+/CD43+. Asegúrese de que no se detecten células muertas significativas (más del 5%).
2. Desarrollo de cuerpos embrioides a partir de iPSCs y HPCs mixtas
- El mismo día de la recolección de las HPC, asegúrese de que un cultivo de iPSC también alcance el 80 % de confluencia en un pocillo en una placa de 6 pocillos (o dos pocillos en una placa de 12 pocillos).
- Trate un pocillo de la placa de cultivo de micropocillos para la formación de EB con 500 μL de solución de enjuague antiadherente agregándola para minimizar las burbujas.
- Girar la placa a 2000 x g durante 5 min en un rotor de cubo oscilante equipado con soportes de placa para eliminar posibles burbujas.
- Retire completamente la solución de enjuague pipeteando y lave los pocillos dos veces con 1 mL de DPBS y luego 1 mL de DMEM/F12 sin generar burbujas.
- Disocie las iPSC de la placa tratando las células con 1 mL de solución de Accutasa.
- Observe bajo el microscopio hasta que las células muestren signos de separación, pero aún estén unidas al fondo. Esto suele ocurrir entre 1 y 3 minutos después del tratamiento con Accutase. No digiera en exceso las iPSC.
- Retire completamente la solución de Accutase sin alterar las células y agregue 1 mL de medio DMEM/F12 a los pocillos. Además, disocie las células en células individuales pipeteando hacia arriba y hacia abajo un par de veces con una punta de 1 mL.
- Recoja las células en un tubo de 15 mL y llénelo hasta 5 mL con medio DMEM/F12. Girar las celdas a 300 x g durante 5 min.
- Retire el sobrenadante pipeteando y vuelva a suspender las células en 1 ml de medio E8 Flex. Cuente las células y ajuste la concentración de células a 1 millón de células por ml en el medio E8 Flex.
- Mezcle iPSC con HPC en una proporción de 2:1 añadiendo 1 millón de iPSC (1 mL) y medio millón de HPC (500 μL) juntos. Agregue todas las células mezcladas en el pocillo previamente tratado de la placa de cultivo de micropocillos.
- Añada 1 μL de solución madre del inhibidor de rocas Y27632 (1 mM) por 1 mL de medio en el sobrenadante. Agite el plato de lado a lado varias veces para distribuir las células de manera uniforme.
- Gire la placa de cultivo de micropocillos a 300 x g durante 5 min en un rotor de cangilón oscilante equipado con soportes para placas. Observe bajo el microscopio para ver si las células se han asentado en los micropocillos. (Figura complementaria 1A).
- Sin alterar las células, coloque la placa en una incubadora de células a 37 °C, 5% de CO2 .
- El día 2, 48 h después, observe las células bajo el microscopio para detectar la formación de EB. Cuando los EB estén claramente formados, continúe con el siguiente paso (Figura complementaria 1B).
- Trate una placa de cultivo celular de 24 pocillos con tampón de enjuague antiadherente (500 μL) durante 15 min para hacer una placa de fijación baja.
- Retire el tampón de enjuague por completo y lave los pocillos dos veces con 1 mL de DPBS, luego agregue 1 mL de medio E8 Flex en los pocillos.
- Vuelva a suspender los EB en la placa de cultivo de micropocillos pipeteándolos con una punta de pipeta de orificio de 1 ml de ancho varias veces.
- Para cada pocillo de las placas de 24 pocillos tratados con baja adherencia, recoja y agregue 100 μL de medio que contenga EB. Esto dará como resultado de 10 a 20 EB por pozo. Agregue el medio E8 Flex al pozo antiguo que contiene los EB sobrantes como respaldo.
- Incubar la placa en una incubadora de células deCO2 al 5% de 37 °C durante 48 h.
3. 3D inducción, proliferación y maduración de organoides neuronales
- El día 2 después de la formación de EB, descongele las alícuotas de BMM en el hielo durante al menos 30 minutos.
- Use una punta preenfriada de 20 μL y agregue 15 μL de gota de BMM helada sabiamente sobre el medio para cubrir los EB. Esto crea una película de BMM a la que los EB se adherirán y crecerán.
- Coloque la placa en una incubadora de células de CO2 al 5% a 37 °C.
- El día 4, después de la formación de EB, retire 500 μL de medio con cuidado sin descartar EB y repita el recubrimiento BMM siguiendo el paso 3.2.
- Inicie inmediatamente la inducción neuronal agregando 500 μL de medio de inducción neuronal PSC sobre las células.
- En los días 6 y 8, realice el medio cambio de medio retirando cuidadosamente 500 μL de medio sin tocar las células y agregando 500 μL de medio de inducción neural.
- En los días 10, 12 y 14, realice un medio cambio de medio con medio de células madre neurales (NSC): Knockout DMEM/F12 + 1x suplemento Glutamax + 1x suplemento neural + bFGF + EGF.
- El día 15, transfiera todo el pocillo de esferas con medio a una nueva placa de 12 pocillos tratada con una solución de enjuague antiadherente como se describió anteriormente. Añadir 500 μL de medio de maduración neuronal (DMEM/F12 + 1x suplemento de N2 + 1x suplemento de B27 + 1x antibióticos-antimicóticos) sobre el cultivo.
- Realizar un cambio de medio medio con medio de maduración neuronal cada dos días.
- Durante la etapa de maduración, si hay signos de agotamiento de la nutrición, como el cambio de color del medio, mueva el organoide a placas de 6 pocillos, que contienen hasta 3 ml de medio por pocillo.
- Opcionalmente, 17 días después de la formación de EB, suplementar el medio de maduración con citocinas (IL-34, M-CSF, TGF-β1, CD200, CX3CL1) durante 6 días para facilitar la maduración microglial.
- El día 23, recoja los organoides neuronales resultantes para su caracterización o experimentos adicionales.
4. Aclaramiento e inmunotinción de organoides neuronales 3D
- Fijar hasta 10 organoides por inmersión en 1 mL de paraformaldehído (PFA) al 4% a 4 °C durante 24 h.
- Transfiera los organoides por pocillo a una placa inferior transparente de 96 pocillos y lave con 200 μL de DPBS 2 veces durante 1 h cada vez con una agitación suave.
- Permeabilizar los organoides lavándolos una vez con metanol al 50% en DPBS, al 80% de metanol en agua bidestilada (dd) y al 100% de metanol seco durante 10 minutos cada uno, a 4 °C con una agitación suave.
- Lavar los organoides en serie con 20% de DMSO/metanol, 80% de metanol en agua dd, 50% de metanol en DPBS, en 100% de DPBS, luego en DPBS con 0,2% Triton X-100, durante 10 min cada uno a 4 °C con una agitación suave. Haga un esfuerzo por eliminar completamente el tampón residual después de cada lavado.
- Incubar en tampón permeable (DPBS con 0,2% de Triton X100, 0,3 M de glicina y 20% de DMSO) con una agitación suave durante 40 min en RT.
- Bloquear en tampón de bloqueo (DPBS con 0,2% Triton X100, 6% suero de cabra y 10% DMSO) durante 1 h a 37 °C con una suave agitación en un agitador a 80 rpm.
- Incubar con anticuerpos en tampón de dilución de anticuerpos (IBA1 1:100, TREM2 1:100, βIII-tubulina, 1:1000, 100 μL /pocillo en DPBS con 0,2% Tween 20, 100 μg/mL de heparina, 3% de suero de cabra y 5% de DMSO) a 37 °C durante 2 h o en cámara frigorífica con agitación suave a 80 rpm durante 3 días.
- Lavar con DPBS con 0,2% Tween 20, 100 μg/mL de heparina 5 veces, 10 min cada una a RT con agitación suave en un agitador a 80 rpm.
- Incubar con anticuerpo secundario (Alexa488 anti-ratón de cabra 1:200) a 37 °C durante 1 h, seguido de RT durante la noche con agitación suave en un agitador a 80 rpm.
- Para la tinción con contraste nuclear, realice la tinción DAPI junto con la incubación de anticuerpos o en un tampón de lavado.
- Lavar los organoides 10 veces en tampón de lavado, 10 min cada vez a 37 °C, agitando suavemente.
- Observa bajo un microscopio. Si el fondo sigue siendo alto, sigue lavándolo 5 veces.
- Deseche el sobrenadante tanto como sea posible. Añadir 200 μL de solución de aclarado de organoides e incubar durante 5 minutos antes de la observación y tomar imágenes con un microscopio confocal.
Resultados
Nuestro protocolo sigue un esquema para diferenciar las HPC de las iPSC y luego mezclar las HPC con las iPSC para hacer EB, seguido de inducción, diferenciación y maduración neuronal (Figura 1). La alta calidad de la diferenciación de HPC es fundamental para el éxito de la formación de EB y la posterior diferenciación de organoides. Se utiliza una técnica de cultivo de dilución en serie para producir el número y el tamaño adecuados de colonias de iPSC para iniciar la diferenciación de HPC (Figura 2A). Normalmente, las colonias de iPSC experimentarán cambios morfológicos significativos al final del cultivo en el medio A (Figura 2B) y mostrarán además una diferenciación de HPC después de 3 días en el medio B (Figura 2C), como células redondas homogéneas, flotando justo por encima o unidas al fondo de los recipientes de cultivo. La HPC puede expandirse para formar grupos de células similares a colonias (Figura 2D). Las HPC predominan en el día 10 sin mostrar residuos significativos (Figura 2E). La alta calidad de la mezcla de HPC e iPSC da como resultado la formación de EB en 24 h, que continúa creciendo con un mínimo de desechos celulares (Figura 3A). Las HPC de baja calidad con exceso de residuos pueden dificultar la formación de EB. Después de que los EB se transfirieron a una nueva placa, continuaron creciendo y finalmente alcanzaron una meseta en el medio de maduración (Figura 3B). Los EB se diferenciarán en organoides que contienen microglía IBA1 y TREM2 positiva, con (Figura 4) o sin tratamiento con citocinas microgliales (Figura 5). El tratamiento con citocinas de crecimiento microglial puede aumentar el número de microglías específicas de TMEM119 (Figura 6). Los organoides representativos muestran tanto neuronas βIII-tubulina positivas como microglía IBA1 positiva después de la eliminación y la inmunotinción (Figura 7). Cuando se trata con lipopolisacárido (LPS), se puede observar un aumento en la activación microglial mediante marcadores específicos de microglía y activación de genes proinflamatorios (Figura 8). La Figura 2 suplementaria muestra células positivas para IBA-1 y TMEM-119 en organoides cultivados sin citocinas microgliales adicionales.
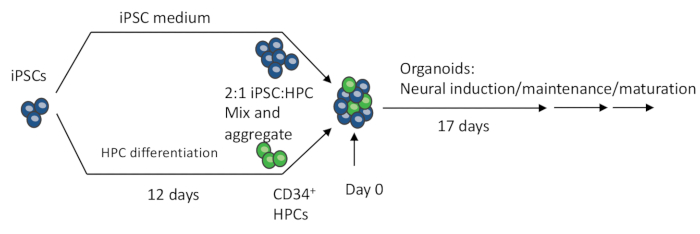
Figura 1: Procedimientos esquemáticos de fabricación del organoide 3D a partir de iPSCs. Los EB se fabrican mezclando iPSC y HPC diferenciados por iPSC. Además, los EB se someten a inducción neuronal, diferenciación y maduración para producir organoides que contienen neuronas y microglía. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Cambios morfológicos típicos de iPSCs a HPCs. Se muestran imágenes representativas para la (A) colonia de iPSC, (B) al final del tratamiento con el medio A, (C) 3 días en el medio B, (D) día 10 en el medio B y (E) las HPC flotantes resultantes. Las imágenes se tomaron bajo un microscopio de fluorescencia con objetivo de 10x o 4x. Haga clic aquí para ver una versión más grande de esta figura.
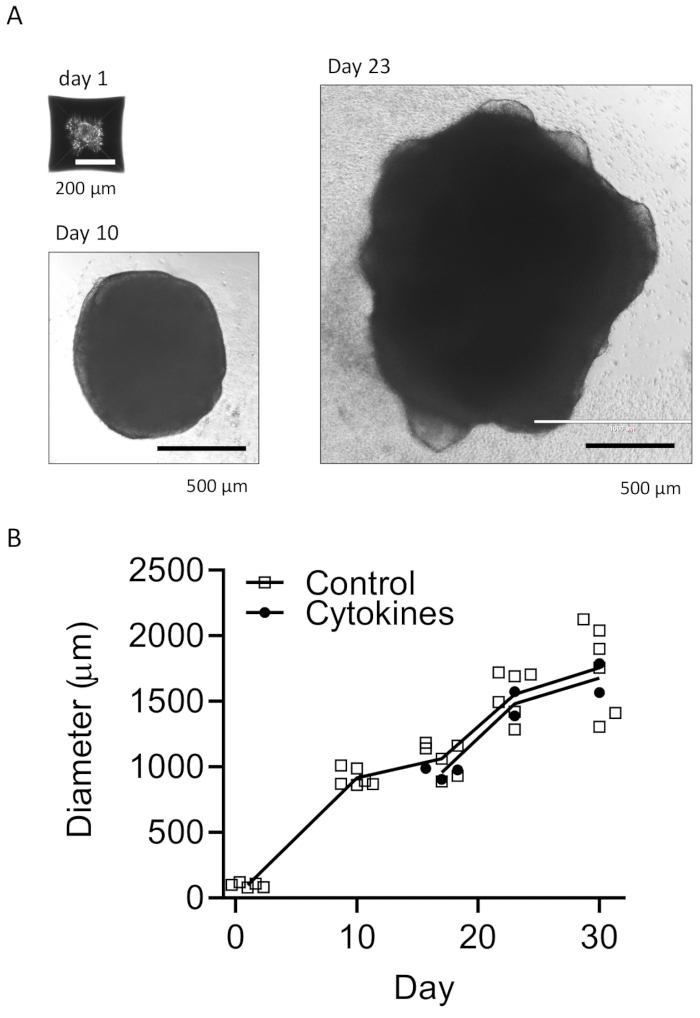
Figura 3: Desarrollo de EB y organoides maduros. (A) Las fotos representativas muestran la formación de EB (Día 1), el crecimiento de organoides (Día 10) y la maduración (Día 23). Se muestra una curva de crecimiento para los tamaños de los organoides con o sin citocinas de diferenciación microglial (B). Las imágenes se tomaron bajo un microscopio de fluorescencia con objetivo de 10x o 4x. Haga clic aquí para ver una versión más grande de esta figura.
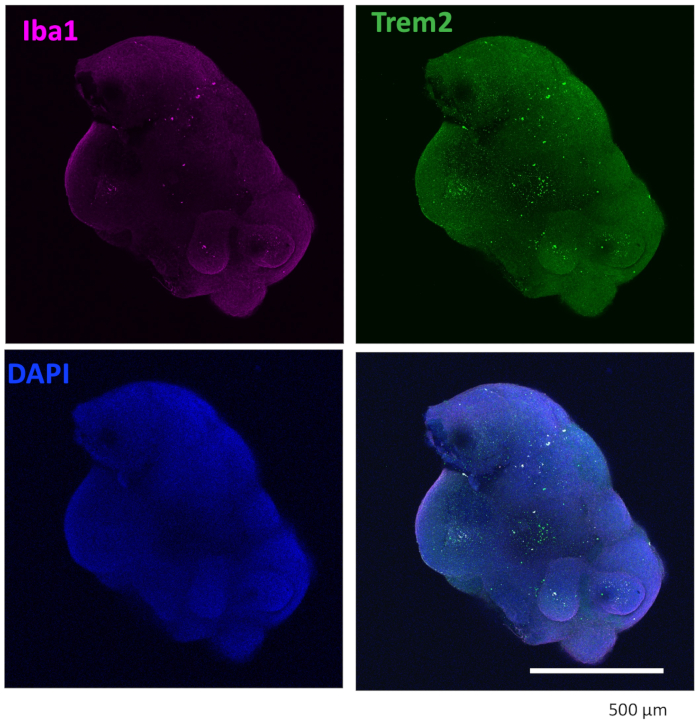
Figura 4: Los organoides cultivados con citocinas de diferenciación microglial contienen microglía. Después de la eliminación y la inmunotinción, el organoide mostró que la microglía se tiñó positivamente con IBA1 y TREM2. Se muestran imágenes tomadas bajo un objetivo 10x de un microscopio confocal. Haga clic aquí para ver una versión más grande de esta figura.
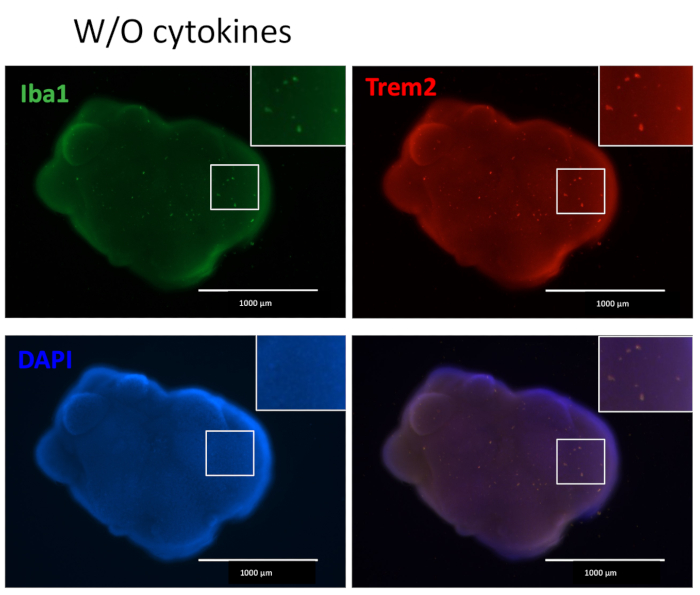
Figura 5: Organoides cultivados sin citocinas adicionales de diferenciación microglial contienen microglía. Sin la adición de citocinas de diferenciación microglial externa, los organoides aún producían microglía positiva teñida con IBA1 y TREM2, lo que indica que el microambiente de desarrollo neuronal en el organoide es suficiente para diferenciar las HPC a la microglía. Las imágenes se tomaron bajo un microscopio de fluorescencia con un objetivo 4x. Haga clic aquí para ver una versión más grande de esta figura.

Figura 6: Resultado de la secuenciación de ARN de una sola célula de microglía que contiene organoides 3D. (A) Los gráficos mostraron distribuciones de IBA1 (AIF1), TMEM119 y MAP2 en un organoide sin citocinas de diferenciación microglial adicionales. (B) IBA1 y TEME119 microglía positiva se contaron en dos organoides cultivados con y uno sin citocinas de diferenciación microglial adicionales. El número de células IBA1 y TMEM119 positivas cambia en los organoides representativos. Haga clic aquí para ver una versión más grande de esta figura.
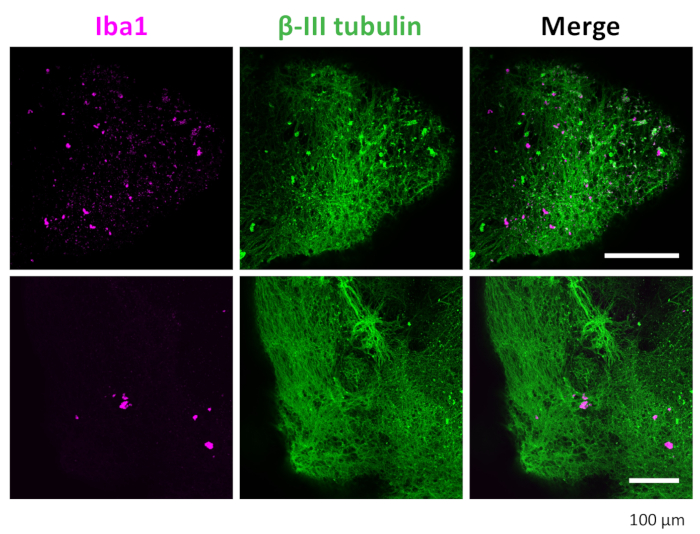
Figura 7: Inmunotinción de neuronas y microglía en los organoides 3D. Después del aclaramiento y la inmunotinción, el organoide mostró microglía positiva teñida con IBA1 y neuronas teñidas con βIII-tubulina. Se muestran imágenes representativas tomadas bajo un microscopio confocal con un objetivo de 20x. Haga clic aquí para ver una versión más grande de esta figura.
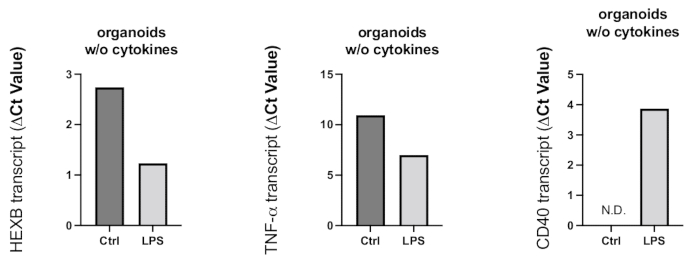
Figura 8: Activación inflamatoria inducida en los organoides por el tratamiento con LPS. Después de 24 h de tratamiento con LPS, se recolectaron organoides y se utilizó RT-PCR para determinar la activación microglial y la reacción proinflamatoria. Debido a que los valores de Ct se relacionan negativamente con los niveles de expresión génica, como se muestra en los gráficos representativos, el tratamiento con LPS resultó en un aumento de la expresión génica del marcador de activación microglial HEXB y la citocina proinflamatoria TNF-α. Aunque no se detectó la expresión del gen CD40 en los organoides de control, el tratamiento con LPS dio lugar a transcripciones de CD40 detectables. Haga clic aquí para ver una versión más grande de esta figura.
Figura suplementaria 1: EBs en una placa de cultivo de micropocillos. (A) Las HPC e iPSC mixtas se asentaron en los micropocillos en una placa de cultivo de micropocillos mucho después de la centrifugación. (B) Las EB se formaron después de 24 h de incubación en la placa de cultivo de micropocillos cuando se observaron bajo un microscopio. (C) Se observaron células CD34+ en los organoides en formación 8 días después de la formación de EB. Las imágenes confocales se tomaron con un objetivo de 20x. Haga clic aquí para descargar esta figura.
Figura complementaria 2: Las imágenes confocales mostraron células positivas para IBA-1 y TMEM-119 en organoides cultivados sin citocinas microgliales adicionales. Las imágenes se tomaron utilizando un microscopio confocal con zoom de 20x y 2x para mostrar las morfologías de las células. Haga clic aquí para descargar esta figura.
Discusión
Aquí, se presenta un protocolo detallado para hacer organoides neuronales 3D que contienen microglía innata a partir de EB derivadas de iPSC mixtas y HPC diferenciadas por iPSC. Es un enfoque relativamente corto y fácil que involucra solo técnicas y equipos de cultivo celular generalmente disponibles en la mayoría de los laboratorios.
El factor más crítico para el éxito de este protocolo es la calidad de la diferenciación de HPC. Adoptamos el método publicado17 utilizando un kit comercial para diferenciar las HPC de las iPSC con algunas modificaciones. En comparación con el protocolo original, comenzamos con un tamaño más pequeño y un rango más bajo de colonias de iPSC y recolectamos las HPC diferenciadas después de 10 días de diferenciación en lugar de 12 días. Este enfoque genera solo 1-2 millones de HPC por pocillo, pero sigue siendo más que suficiente para el siguiente paso de la producción de organoides 3D. Es importante mantener el equilibrio adecuado entre estas células y las colonias de iPSC, ya que un número excesivo de células puede dar lugar a células muertas/residuos al final, lo que provoca el fracaso de la formación de EB. Aunque las HPC se pueden recolectar desde el día 10 hasta el día 12 después de la inducción, descubrimos que la recolección en el día 12 correría el riesgo de tener más células muertas e impurezas, ya que el rápido crecimiento de las HPC hasta el final del cultivo podría agotar fácilmente los factores nutricionales y requerir un seguimiento estrecho y cambios de medio adicionales. Al recolectar HPC en el día 10, no habrá necesidad de realizar la purificación de HPC por citometría de flujo o purificación de perlas magnéticas, que son necesarias para enriquecer la pureza inferior de las HPC.
Para el subcultivo normal de iPSC y la diferenciación de HPC, se utilizó un tampón de disociación de EDTA, para el cual el efecto es leve y solo disocia las colonias de iPSC en pequeños parches de células, que son buenos para la reinserción de iPSC después de la división. Sin embargo, los parches celulares pueden interferir con la formación de EB. Por lo tanto, el tratamiento con Accutase se utiliza para disociar las iPSC y lograr una solución de una sola célula para una formación de EB más uniforme. Al producir EB disociando iPSCs, es importante no tratar en exceso las iPSCs con Accutase, lo que puede resultar en una muerte celular excesiva. Dejar las iPSC a temperatura ambiente y en suspensión durante demasiado tiempo también puede provocar la muerte celular masiva y la diferenciación abrogada. Por lo tanto, el proceso de los pasos 2.1 a 2.13 debe completarse lo antes posible para evitar retrasos innecesarios.
Para facilitar la diferenciación y maduración neuronal, se cultivan varios EBs por pocillo. Este ajuste facilita la fusión de los EB y disminuye el tiempo necesario para la maduración de los organoides. Sin embargo, es difícil controlar el número exacto de EBs para la fusión y, por lo tanto, puede introducir irregularidades en los tamaños y formas de los organoides resultantes. La irregularidad se puede minimizar agitando las placas de vez en cuando o, si es posible, utilizando un biorreactor. También es posible sembrar EB individual en pocillos de una placa de 96 pocillos para evitar la fusión por completo, pero necesitará esfuerzo y tiempo adicionales para que los organoides crezcan y maduren.
A diferencia de la inclusión de organoides individualmente con Matrigel en el enfoque más aceptado18, aplicamos la gota de Matrigel sabiamente sobre el medio varias veces. Este enfoque es menos laborioso, pero produce una alta calidad de diferenciación neuronal en los organoides. El protocolo descrito en este estudio genera neuronas corticales con microglía. Sin embargo, ajustando los factores de crecimiento y los pasos de diferenciación siguiendo las técnicas publicadas19,20, podría adaptarse fácilmente para producir organoides que representan otros tipos neuronales o regiones específicas del cerebro.
Publicaciones recientes han incorporado microglía diferenciada por iPSC o células similares a macrófagos en el desarrollo de organoides corticales para producir organoides cerebrales que contienen microglios21. A medida que las microglías adultas se desarrollan a partir de HPCs primitivas reclutadas en el cerebro durante los primeros días embrionarios12, incorporamos las HPCs en la formación de EB y antes de la inducción neuronal. Es interesante encontrar que sin aplicar las citocinas específicas para la diferenciación microglial, que generalmente se utilizan para producir la diferenciación microglial en los organoides cerebrales22, todavía observamos una diferenciación microglial decente dentro de los organoides cerebrales resultantes, aunque las células TREM2 positivas son menores en número, en comparación con las cultivadas con citocinas. Sugiere que la inclusión de HPCs en la formación de EB y las interacciones tempranas aseguradas del proceso de desarrollo neuronal y las HPCs podrían ser suficientes para diferenciar la microglía en el organoide cerebral. También sugiere que nuestro protocolo es valioso como modelo para estudiar el desarrollo microglial temprano en el cerebro.
Como se ha comentado, este protocolo produce organoides que imitan el desarrollo temprano del cerebro humano. A pesar de que hemos cultivado organoides hasta 6 semanas sin notar deterioro aparente en base a las morfologías de los organoides, y algunos cultivos han alcanzado más de 4 meses, se encontró necrosis celular en los núcleos de organoides desde las 8 semanas de edad. Esto también es común a otros tipos de organoides cerebrales, ya que las células centrales de los organoides en crecimiento experimentan dificultades para acceder a la nutrición. El uso de biorreactores con agitación continua puede aumentar la viabilidad y prolongar la vida de los organoides, permitiendo que los tipos de células más maduras se diferencien. Sin embargo, es casi seguro que el cultivo a largo plazo dará lugar a mayores variabilidades sin cierta ayuda automática del cultivo. Por lo tanto, recomendamos utilizar este protocolo para estudiar el desarrollo cerebral temprano relacionado con la microglía, así como los efectos agudos de las neuroinfecciones en el desarrollo cerebral. Para un modelado cerebral más sofisticado, sugerimos que los investigadores utilicen este protocolo como base y apliquen modificaciones para aumentar la consistencia y facilitar los cultivos a largo plazo.
En resumen, en el presente protocolo, incorporamos HPCs diferenciadas por iPSC en la formación de EB e inducimos aún más la diferenciación neuronal. En menos de un mes, este protocolo producirá organoides que contendrán tanto neuronas como microglía generadas a partir de las mismas iPSCs. Proporciona una alternativa conveniente para hacer organoides cerebrales con interacciones tempranas entre el desarrollo neuronal y microglial, lo que lo hace útil para estudiar la fisiología del desarrollo del cerebro humano y las enfermedades infecciosas y neuroinflamatorias neuronales que involucran a la microglía innata.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este estudio cuenta con el apoyo de fondos de investigación interna del NINDS.
Materiales
| Name | Company | Catalog Number | Comments |
| 12 well cell culture plates | Corning | #3512 | |
| 24 well cell culture plate | SARSTEDT | #83.3922 | |
| Accutase | Thermo | A1110501 | |
| Aggrewell 400 plate | Stemcell technologies | #34411 | Referred to as microwell culture plate |
| Alexa Fluor 488 goat anti-mouse antibody | Life techniologies | A11001 | 1:400 dilution |
| Alexa Fluor 594 goat anti-rabbit antibody | Life techniologies | A11012 | 1:400 dilution |
| Allegra X-30R Centrifuge with rotor S6069 | Beckman Couler | ||
| Anti- Adherence Rinsing solution | Stem Cell Technologies | #07010 | |
| anti-CD34 antibody | Stem Cell Technologies | #60013 | 1:100 dilution |
| anti-Human CD43 antibody | Stem Cell Technologies | #60085 | 1:100 dilution |
| anti-IBA1 rabbbit antibody | Fujifilm | 019-19741 | 2.5 µg/mL |
| anti-TREM2 rat pAb | RD Systems | mab17291 | 2.5 µg/mL |
| Antibiotic-antimycotic | Gibco | 15240-062 | 1x |
| B27 supplement | Life technologies | 17504-044 | 1x |
| bFGF | Peprotech | 100-18B | 20 ng/mL |
| CD200 | Novoprotein | C311 | 100 ng/mL |
| CryoTube vials | Thermo | #368632 | |
| CX3CL1 | Peprotech | 300-31 | 100 ng/mL |
| DAPI | Sigma | D9542 | 1 µg/mL |
| DMEM/F12 | Life technologies | 12400-024 | 1x |
| DMSO | Sigma | D2650 | |
| DPBS | Gibco | #4190136 | 1x |
| E8 Flex medium kit | Thermo | A2858501 | |
| EDTA | Mediatech | 46-034-Cl | 0.5 mM |
| EGF | Peprotech | AF-100-15 | 20 ng/mL |
| EVOS FL Auto Microscope | Thermo | Fluorescence microscope | |
| FastStart Universal SYBR Green PCR master mix | Roche | #4913850001 | |
| Glutamax | Gibco | #35050079 | |
| Goat serum | Sigma | G9023 | 4% |
| IL-34 | Peprotech | 200-34 | 100 ng/mL |
| ImageXpress Micro Confocal | Molecular Devices | ||
| Knockout DMEM/F12 | Gibco | #10829018 | |
| M-CSF | Peprotech | 300-25 | 25 ng/mL |
| Matrigel | Corning | #354277 | Basement membrane matrix (BMM) |
| Mouse anti-βIII-tubulin antibody | Promega | G712A | 1:1000 dilution |
| Mr. Frosty container | Thermo | 5100-0001 | |
| N2 supplement | Life technologies | 17502-048 | 1x |
| Paraformadehyde | Sigma | P6148 | 4% |
| PSC Neural Induction Medium | Gibco | A1647801 | |
| Rock inhibitor Y27632 | Stemcell technologies | #72304 | 1 mM stock |
| RT LTS 1000 ul pipette tips | RAININ | #30389218 | for transferring organoids |
| STEMdiff Cerebral Organoid Kit | Stem Cell Technologies | #08570 | |
| STEMdiff Hematopoietic Kit | StemCell Technologies | #5310 | Referred to as hematopoietic Kit |
| StemPro Neural Supplement | Gibco | A1050801 | Referred to as neural supplement |
| TGF-β1 | Peprotech | 100-21 | 50 ng/mL |
| Total RNA Purification Plus Kit | Norgen | #48400 | |
| TritonX-100 | Sigma | T9284 | 0.10% |
| Visikol Histo-Starter Kit | Visikol | HSK-1 | Contains organoid clearing solution HISTO-M, washing buffer |
| Zeiss LSM 510-META Confocal Microscope | Zeiss |
Referencias
- Sabate-Soler, S., et al. Microglia integration into human midbrain organoids leads to increased neuronal maturation and functionality. Glia. 70 (7), 1267-1288 (2022).
- Lazarov, T., Juarez-Carreño, S., Cox, N., Geissmann, F. Physiology and diseases of tissue-resident macrophages. Nature. 618 (7966), 698-707 (2023).
- Wang, T., Liu, B., Zhang, W., Wilson, B., Hong, J. S. Andrographolide reduces inflammation-mediated dopaminergic neurodegeneration in mesencephalic neuron-glia cultures by inhibiting microglial activation. J Pharmacol Exp Ther. 308 (3), 975-983 (2004).
- Qian, L., Flood, P. M., Hong, J. S. Neuroinflammation is a key player in Parkinson's disease and a prime target for therapy. J Neural Transm (Vienna). 117 (8), 971-979 (2010).
- Clevers, H. Modeling development and disease with organoids. Cell. 165 (7), 1586-1597 (2016).
- Fakıoğlu, D. M., Altun, B. New therapeutic approaches in cystic fibrosis. Turk J Pharm Sci. 17 (6), 686-697 (2020).
- Mcmillan, R. E., Wang, E., Carlin, A. F., Coufal, N. G. Human microglial models to study host-virus interactions. Exp Neurol. 363, 114375(2023).
- Scopa, C., et al. Jun upregulation drives aberrant transposable element mobilization, associated innate immune response, and impaired neurogenesis in Alzheimer's disease. Nat Commun. 14 (1), 8021(2023).
- Tamaki, Y., et al. Spinal cord extracts of amyotrophic lateral sclerosis spread TDP-43 pathology in cerebral organoids. PLoS Genet. 19 (2), e1010606(2023).
- Chambers, S. M., et al. Highly efficient neural conversion of human es and IPS cells by dual inhibition of smad signaling. Nat Biotechnol. 27 (3), 275-280 (2009).
- Kim, S. H., Chang, M. Y. Application of human brain organoids-opportunities and challenges in modeling human brain development and neurodevelopmental diseases. Int J Mol Sci. 24 (15), 12528(2023).
- Ginhoux, F., et al. Fate mapping analysis reveals that adult microglia derive from primitive macrophages. Science. 330 (6005), 841-845 (2010).
- Ormel, P. R., et al. Microglia innately develop within cerebral organoids. Nat Commun. 9 (1), 4167(2018).
- Abdelmalek, C. M., et al. Building a growing genomic data repository for maternal and fetal health through the ping consortium. medRxiv. , (2024).
- Wei, Z., et al. Human IPSC-derived brain organoids: A 3D mini-brain model for studying HIV infection. Exp Neurol. 364, 114386(2023).
- Wang, T., et al. Regulation of stem cell function and neuronal differentiation by HERV-K via mTOR pathway. Proc Natl Acad Sci U S A. 117 (30), 17842-17853 (2020).
- Mcquade, A., et al. Development and validation of a simplified method to generate human microglia from pluripotent stem cells. Mol Neurodegener. 13 (1), 67(2018).
- Lancaster, M. A., Knoblich, J. A. Generation of cerebral organoids from human pluripotent stem cells. Nat Protoc. 9 (10), 2329-2340 (2014).
- Fiorenzano, A., et al. Single-cell transcriptomics captures features of human midbrain development and dopamine neuron diversity in brain organoids. Nat Commun. 12 (1), 7302(2021).
- Qian, X., et al. Brain-region-specific organoids using mini-bioreactors for modeling ZIKV exposure. Cell. 165 (5), 1238-1254 (2016).
- Park, D. S., et al. IPS-cell-derived microglia promote brain organoid maturation via cholesterol transfer. Nature. 623 (7986), 397-405 (2023).
- Schafer, S. T., et al. An in vivo neuroimmune organoid model to study human microglia phenotypes. Cell. 186 (10), 2111-2126.e20 (2023).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ISSN 2578-2746
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados
Utilizamos cookies para mejorar su experiencia en nuestra página web.
Al continuar usando nuestro sitio web o al hacer clic en 'Continuar', está aceptando nuestras cookies.