Method Article
Derivazione di un organoide cerebrale umano con sviluppo di microglia
In questo articolo
Riepilogo
Presentiamo un protocollo per generare un organoide cerebrale umano con microglia residente incorporando cellule progenitrici ematopoietiche (HPC) derivate da cellule staminali pluripotenti indotte (iPSC) nello sviluppo di organoidi.
Abstract
Le colture tridimensionali (3D) di organoidi cerebrali derivate da cellule staminali pluripotenti indotte (iPSC) forniscono un importante strumento alternativo in vitro per lo studio dello sviluppo del cervello umano e della patogenesi delle malattie neurologiche. Tuttavia, la mancanza di incorporazione di microglia negli organoidi cerebrali umani è ancora un grosso ostacolo per i modelli 3D di neuroinfiammazione. Gli approcci attuali includono l'incorporazione di microglia completamente differenziate in organoidi cerebrali maturi o l'induzione della differenziazione microgliale fin dallo stadio iniziale di corpi embrioidi (EB) derivati da iPSC. Il primo approccio manca la fase in cui la differenziazione microgliale interagisce con l'ambiente neurale adiacente, mentre il successivo approccio è tecnicamente impegnativo, con conseguente incoerenza tra gli organoidi finali in termini di quantità e qualità della microglia. Per modellare gli organoidi cerebrali con la microglia per studiare le prime interazioni tra lo sviluppo microgliale e neuronale, le cellule progenitrici ematopoietiche (HPC) altamente pure differenziate dalle iPSC umane sono state incorporate nelle EB derivate da iPSC per produrre organoidi cerebrali. Utilizzando l'immunocolorazione e l'analisi del sequenziamento dell'RNA a singola cellula (sc-RNA-seq), abbiamo confermato che le HPC sono state incorporate negli organoidi 3D, che alla fine si sono sviluppati in organoidi cerebrali con microglia e neuroni. Rispetto agli organoidi cerebrali senza HPC, questo approccio produce una significativa incorporazione microgliale negli organoidi cerebrali. Questo nuovo modello 3D di organoidi, che consiste in proprietà di sviluppo sia microgliale che neurale, può essere utilizzato per studiare le prime interazioni tra lo sviluppo del sistema immunitario innato e del sistema nervoso e potenzialmente come modello per la neuroinfiammazione e i disturbi neuroinfettivi.
Introduzione
Le microglia sono cellule immunitarie residenziali nel cervello, che svolgono un ruolo critico sia nello sviluppo cerebrale che nell'omeostasi 1,2. L'attivazione della microglia provoca la produzione di fattori proinfiammatori, fagocitosi elevata e stress ossidativo reattivo, che rimuove gli agenti patogeni invasori e le cellule compromesse. Tuttavia, l'iperattivazione o l'attivazione prolungata della microglia può, d'altra parte, causare neurodegenerazione come meccanismo di patogenesi in molti disturbi neurologici, tra cui il morbo di Parkinson 3,4. È importante che le microglia siano incluse nei modelli pertinenti per lo studio dei disturbi neurologici umani. Negli ultimi anni, le cellule staminali umane sono state utilizzate per sviluppare organoidi 3D come modelli in vitro in alternativa ai modelli animali e agli studi su soggetti umani5. Idealmente, gli organoidi umani costituiscono più tipi di cellule e strutture tissutali simili ai corrispondenti organi umani, rappresentando meglio la fisiologia e la patogenesi umana rispetto ai modelli animali, ma senza le preoccupazioni etiche coinvolte direttamente negli studi sugli individui umani. Possono rappresentare il futuro della modellizzazione delle malattie umane per lo studio della patogenesi e dello sviluppo di farmaci e per la guida di terapie individualizzate6. Ad esempio, gli organoidi cerebrali umani 3D derivati da cellule staminali pluripotenti indotte umane (iPSC) hanno prevalso nel campo della ricerca neuroscientifica, modellando malattie infettive neurali tra cui ZIKA, SARS-CoV-27 e malattie neurodegenerative tra cui la sclerosi laterale amiotrofica (SLA) e il morbo di Alzheimer 8,9. Tuttavia, gli organoidi neurali 3D convenzionali che utilizzano l'inibizione dual-SMAD per indurre la differenziazione neuronale10 producono organoidi cerebrali privi di microglia, poiché derivano da progenitori reclutati dal sangue invece che dal lignaggio neuroectodermico da cui provengono i neuroni 11,12. Senza la presenza di microglia, gli organoidi sono inadeguati per modellare le infezioni del SNC, l'infiammazione e la neurodegenerazione associata.
Per affrontare questo problema critico, sono stati fatti tentativi di incorporare microglia differenziate negli organoidi cerebrali13 o di indurre la differenziazione microgliale all'interno degli organoidi fin dall'inizio utilizzando approcci alternativi invece dell'inibizione dual-SMAD13. Tuttavia, incorporando microglia differenziate negli organoidi cerebrali, le prime interazioni tra lo sviluppo neuronale e microgliale vengono perse. Ciò potrebbe essere importante nello sviluppo del SNC o nella patogenesi di disturbi neuroinfettivi che mirano allo sviluppo del cervello infantile, come nell'infezione da virus ZIKA14. D'altra parte, la differenziazione della microglia innata all'interno di organoidi cerebrali derivati da iPSC senza stadi intermittenti comporta un processo prolungato e ha una maggiore variabilità all'interno dei prodotti finali15. In questo protocollo, abbiamo incorporato le cellule progenitrici ematopoietiche (HPC) derivate da iPSC nelle iPSC per creare corpi embrioidi (EB), che sono stati ulteriormente differenziati in organoidi 3D che includono sia neuroni che microglia.
Il nostro protocollo fornisce un approccio semplice che può essere adottato per studiare il sistema nervoso centrale umano coinvolgendo le prime interazioni neurone-microglia e la patogenesi delle malattie infettive neurali e della neuroinfiammazione che coinvolge l'attivazione microgliale.
Protocollo
I campioni di sangue originali di donatori adulti sani sono stati raccolti presso la Banca del sangue di medicina trasfusionale del NIH e sono stati ottenuti moduli di consenso informato firmati in conformità con il NIH Institutional Review Board.
1. Produzione di cellule progenitrici ematopoietiche (HPC) da iPSC umane
NOTA: Le cellule iPSC umane 510 e 507 sono state utilizzate per produrre i risultati rappresentativi. I metodi di generazione e manutenzione delle iPSC possono essere trovati in una precedente pubblicazione16.
- Giorno 0: Rivestire una piastra cellulare a 12 pozzetti aggiungendo 500 μL/pozzetto di soluzione ghiacciata di Matrigel (matrice di membrana basale [BMM]) diluita in terreno DMEM/F12 e incubarla per almeno 30 minuti a temperatura ambiente (RT).
- Rimuovere completamente il surnatante di rivestimento e sostituirlo con 1 mL di terreno E8 Flex per pozzetto.
- Controllare la coltura di iPSC in una piastra a 6 pozzetti al microscopio per verificare che le iPSC siano di alta qualità e senza segni di differenziazione. Scegli una colonia di medie dimensioni contrassegnandola con un pennarello sotto il fondo della piastra.
- Rimuovere il terreno dalla coltura iPSC e aggiungere 500 μL di tampone di dissociazione iPSC dell'acido etilendiamminotetraacetico (EDTA) (0,5 mM EDTA, 0,45 g/L di NaCl in DPBS) al pozzetto.
- Osservare al microscopio i segni di dissociazione cellulare quando tre o quattro file di cellule dai bordi della colonia iniziano a restringersi, con lo spazio vuoto che appare tra le cellule. Questo di solito richiede 1-3 minuti.
- Eliminare completamente la soluzione di EDTA. Spostare la colonia di iPSC contrassegnata pipettando 1 mL di terreno E8 Flex con forza e direttamente su di essa. Assicurarsi che la colonia si stacchi completamente in chiazze cellulari contenenti 20-50 cellule ciascuna dopo 1-3 volte di pipettaggio.
- Raccogliere il surnatante contenente cerotti cellulari e aggiungerlo al primo pozzetto dei pozzetti rivestiti nella piastra a 12 pozzetti.
- Miscelare il pozzetto pipettandolo una o due volte e trasferire 1 mL di cellule nel secondo pozzetto che contiene 1 mL di terreno.
- Ripetere il passaggio 1.8 due volte per ottenere colture di iPSC diluite in serie in un totale di quattro pozzetti.
- Incubare la piastra in un incubatore a 37 °C con CO2 al 5%.
- Dopo 24 ore, il giorno 1, controllare le colonie al microscopio e contare il numero di colonie passando attraverso tutti i campi in un pozzo continuamente. Scegli un pozzetto che contenga 10-20 colonie di iPSC.
- Sostituire il terreno con 1 mL di terreno A del Kit ematopoietico. Rimettere la piastra nell'incubatrice per 48 ore.
- Il giorno 3, rimuovere 500 μl di terreno esaurito e aggiungere 500 μl di terreno A fresco.
- Il giorno 4, osservare al microscopio e notare una significativa crescita e differenziazione cellulare dalle colonie di iPSC. Sostituire il terreno con 1 ml di terreno B.
- Monitorare la differenziazione cellulare al microscopio ed eseguire il cambio semi-terreno con 500 μL di terreno B a giorni alterni. Le cellule HPC-like compaiono nei giorni 6-7.
- Il giorno 10, osservare al microscopio singole cellule rotonde luminose con la morfologia delle normali HPC che galleggiano nel terreno o debolmente attaccate al singolo strato inferiore di cellule piatte, con alcuni aggregati di cellule sciolte.
NOTA: Le HPC differenziate sono pronte per la raccolta per la caratterizzazione o ulteriori esperimenti. - Raccogliere tutti gli HPC differenziati pipettandoli su e giù tre volte utilizzando un puntale per pipetta da 1 ml per rompere gli aggregati cellulari e staccare gli HPC dalla superficie della piastra.
- Aggiungere le cellule in una provetta da 15 mL e centrifugare le cellule a 300 x g per 5 minuti. Rimuovere il surnatante e risospendere il pellet cellulare in 1 mL di terreno B.
- Contare le cellule e regolare la concentrazione a 1 milione di cellule/mL. In questa fase, vengono generati più di 1 milione di HPC. Quando viene controllato con la citometria a flusso, assicurarsi che la purezza sia superiore all'85% delle cellule con CD34+/CD43+. Assicurarsi che non si notino cellule morte significative (più del 5%).
2. Sviluppo di corpi embrioidi da iPSCs e HPCs miste
- Lo stesso giorno della raccolta degli HPC, assicurarsi che una coltura iPSC raggiunga anche l'80% di confluenza in un pozzetto in una piastra a 6 pozzetti (o due pozzetti in una piastra a 12 pozzetti).
- Trattare un pozzetto della piastra di coltura a micropozzetti per la formazione di EB con 500 μl di soluzione di risciacquo antiaderente aggiungendola per ridurre al minimo le bolle.
- Centrifugare la piastra a 2000 x g per 5 min in un rotore a secchiello oscillante dotato di portapiastre per rimuovere eventuali bolle.
- Rimuovere completamente la soluzione di risciacquo mediante pipettaggio e lavare i pozzetti due volte con 1 mL di DPBS e poi 1 mL di DMEM/F12 senza generare bolle.
- Dissociare le iPSC dalla piastra trattando le cellule con 1 mL di soluzione di Accutasio.
- Osservare al microscopio fino a quando le cellule mostrano segni di separazione ma sono ancora attaccate al fondo. Questo di solito accade entro 1-3 minuti dal trattamento con Accutase. Non digerire eccessivamente le iPSC.
- Rimuovere completamente la soluzione di Accutase senza disturbare le cellule e aggiungere 1 mL di terreno DMEM/F12 ai pozzetti. Inoltre, dissociare le cellule in singole cellule pipettando su e giù un paio di volte utilizzando un puntale da 1 ml.
- Raccogliere le cellule in una provetta da 15 mL e riempirla fino a 5 mL con terreno DMEM/F12. Centrifugare le celle a 300 x g per 5 min.
- Rimuovere il surnatante mediante pipettaggio e risospendere le cellule in 1 mL di terreno E8 Flex. Contare le cellule e regolare la concentrazione delle cellule a 1 milione di cellule per mL nel terreno E8 Flex.
- Mescola iPSC con HPC in un rapporto di 2:1 aggiungendo 1 milione di iPSC (1 mL) e mezzo milione di HPC (500 μL) insieme. Aggiungere tutte le cellule miscelate nel pozzetto precedentemente trattato della piastra di coltura a micropozzetti.
- Aggiungere 1 μL di soluzione madre Y27632 dell'inibitore di Rock (1 mM) per 1 mL di terreno nel surnatante. Agitare la piastra da un lato all'altro alcune volte per distribuire uniformemente le cellule.
- Centrifugare la piastra di coltura per micropozzetti a 300 x g per 5 minuti in un rotore a secchio oscillante dotato di portapiastre. Osservare al microscopio per vedere se le cellule si sono depositate nei micropozzetti. (Figura supplementare 1A).
- Senza disturbare le cellule, mettere la piastra in un incubatore cellulare a 37 °C, 5% CO2 .
- Il giorno 2, 48 ore dopo, osservare le cellule al microscopio per la formazione di EB. Quando gli EB sono chiaramente formati, continuare con il passaggio successivo (Figura 1B supplementare).
- Trattare una piastra per colture cellulari a 24 pozzetti con tampone di risciacquo antiaderente (500 μl) per 15 minuti per ottenere una piastra di fissaggio bassa.
- Rimuovere completamente il tampone di risciacquo e lavare i pozzetti due volte con 1 mL di DPBS, quindi aggiungere 1 mL di terreno E8 Flex nei pozzetti.
- Risospendere gli EB nella piastra di coltura a micropozzetti pipettandoli per alcune volte con un puntale per pipetta con orifizio largo 1 ml.
- Per ogni pozzetto delle piastre da 24 pozzetti trattate a bassa aderenza, raccogliere e aggiungere 100 μl di terreno contenente EB. Ciò si tradurrà in 10-20 EB per pozzo. Aggiungere il mezzo E8 Flex al vecchio pozzo contenente gli EB rimanenti come backup.
- Incubare la piastra in un incubatore cellulare a 37 °C, 5% CO2 per 48 ore.
3. 3D induzione, proliferazione e maturazione degli organoidi neurali
- Il giorno 2 dopo la formazione di EB, scongelare aliquote di BMM su ghiaccio per almeno 30 minuti.
- Utilizzare un puntale da 20 μl pre-raffreddato e aggiungere 15 μl di goccia di BMM ghiacciata saggiamente sopra il terreno per ricoprire gli EB. Questo crea una pellicola di BMM su cui gli EB si attaccheranno e su cui cresceranno.
- Mettere la piastra in un incubatore cellulare a 37 °C, 5% CO2 .
- Il giorno 4, dopo la formazione di EB, rimuovere con cura 500 μl di terreno senza scartare gli EB e ripetere il rivestimento BMM seguendo il passaggio 3.2.
- Avviare immediatamente l'induzione neurale aggiungendo 500 μl di PSC Neural Induction Medium sulla parte superiore delle cellule.
- Nei giorni 6 e 8, eseguire il cambio del mezzo terreno rimuovendo con cura 500 μl di terreno senza toccare le cellule e aggiungendo 500 μl di terreno di induzione neurale.
- Nei giorni 10, 12 e 14, eseguire il mezzo di cambio del terreno con cellule staminali neurali (NSC): Knockout DMEM/F12 + 1x integratore di Glutamax + 1x integratore neurale + bFGF + EGF.
- Il giorno 15, trasferire l'intero pozzetto di sfere con terreno in una nuova piastra a 12 pozzetti trattata con soluzione di risciacquo antiaderente come descritto in precedenza. Aggiungere 500 μl di terreno di maturazione neuronale (DMEM/F12 + 1x integratore di N2 + 1x integratore di B27 + 1x antibiotici-antimicotici) sopra la coltura.
- Eseguire il cambio semi-medio con il mezzo di maturazione neuronale a giorni alterni.
- Durante la fase di maturazione, se ci sono segni di esaurimento della nutrizione, come il cambiamento di colore del terreno, spostare l'organoide su piastre a 6 pozzetti, che contengono fino a 3 ml di terreno per pozzetto.
- Opzionalmente, 17 giorni dopo la formazione di EB, integrare il terreno di maturazione con citochine (IL-34, M-CSF, TGF-β1, CD200, CX3CL1) per 6 giorni per facilitare la maturazione microgliale.
- Il giorno 23, raccogli gli organoidi neurali risultanti per la caratterizzazione o ulteriori esperimenti.
4. Clearance e immunocolorazione di organoidi neurali 3D
- Fissare fino a 10 organoidi mediante immersione in 1 mL di paraformaldeide (PFA) al 4% a 4 °C per 24 ore.
- Trasferire gli organoidi per pozzetto in una piastra inferiore trasparente a 96 pozzetti e lavare con 200 μl di DPBS 2 volte per 1 ora ogni volta agitando delicatamente.
- Permeabilizzare gli organoidi lavandoli una volta in metanolo al 50% in DPBS, metanolo all'80% in acqua a doppia distillazione (dd) e metanolo secco al 100% per 10 minuti ciascuno, a 4 °C agitando delicatamente.
- Lavare gli organoidi in serie in 20% DMSO/metanolo, 80% metanolo in dd acqua, 50% metanolo in DPBS, in 100% DPBS, quindi in DPBS con Triton X-100 allo 0,2%, per 10 minuti ciascuno a 4 °C agitando delicatamente. Sforzarsi di rimuovere completamente il tampone residuo dopo ogni lavaggio.
- Incubare in tampone permeabilizzante (DPBS con Triton X100 allo 0,2%, glicina 0,3 M e DMSO al 20%) agitando delicatamente per 40 minuti a RT.
- Bloccare nel tampone bloccante (DPBS con 0,2% Triton X100, 6% siero di capra e 10% DMSO) per 1 ora a 37 °C agitando delicatamente su uno shaker a 80 giri/min.
- Incubare con anticorpi in tampone di diluizione anticorpale (IBA1 1:100, TREM2 1:100, βIII-tubulina, 1:1000, 100 μL/pozzetto in DPBS con 0,2% Tween 20, 100 μg/mL di eparina, 3% di siero di capra e 5% DMSO) a 37 °C per 2 ore o in cella frigorifera con agitazione delicata a 80 giri/min per 3 giorni.
- Lavare con DPBS con 0,2% Tween 20, 100 μg/mL di eparina 5 volte, 10 min ciascuna a RT con agitazione delicata su uno shaker a 80 giri/min.
- Incubare con anticorpo secondario (1:200 capra anti-topo Alexa488) a 37 °C per 1 ora seguito da RT per una notte con agitazione delicata su un agitatore a 80 giri/min.
- Per la colorazione con mezzo di contrasto nucleare, eseguire la colorazione DAPI insieme all'incubazione degli anticorpi o in un tampone di lavaggio.
- Lavare gli organoidi 10 volte in tampone di lavaggio, 10 minuti ogni volta a 37 °C, agitando delicatamente.
- Osservare al microscopio. Se lo sfondo è ancora alto, continua a lavarlo 5 volte.
- Scartare il surnatante il più possibile. Aggiungere 200 μL di soluzione per la chiarificazione degli organoidi e incubare per 5 minuti prima dell'osservazione e scattare immagini utilizzando un microscopio confocale.
Risultati
Il nostro protocollo segue uno schema per differenziare le HPC dalle iPSC e quindi mescolare le HPC con le iPSC per produrre EB, seguite dall'induzione, differenziazione e maturazione neurale (Figura 1). L'alta qualità della differenziazione HPC è fondamentale per il successo della formazione di EB e della successiva differenziazione degli organoidi. Viene utilizzata una tecnica di coltura di diluizione seriale per produrre il numero e la dimensione appropriati di colonie di iPSC per avviare la differenziazione HPC (Figura 2A). Normalmente, le colonie di iPSC subiranno cambiamenti morfologici significativi alla fine della coltura nel terreno A (Figura 2B) e mostreranno ulteriormente la differenziazione dell'HPC dopo 3 giorni nel terreno B (Figura 2C), come cellule rotonde omogenee, che galleggiano appena sopra o attaccate al fondo dei recipienti di coltura. L'HPC può espandersi per formare cluster cellulari simili a colonie (Figura 2D). Le HPC predominano al giorno 10 senza mostrare detriti significativi (Figura 2E). L'alta qualità della miscela di HPC e iPSC provoca la formazione di EB entro 24 ore, che continua a crescere con detriti cellulari minimi (Figura 3A). HPC di bassa qualità con detriti eccessivi possono causare difficoltà nella formazione di EB. Dopo che gli EB sono stati trasferiti su una nuova piastra, hanno continuato a crescere e alla fine hanno raggiunto un plateau nel mezzo di maturazione (Figura 3B). Gli EB si differenzieranno in organoidi contenenti microglia IBA1 e TREM2 positive, con (Figura 4) o senza trattamento con citochine microgliali (Figura 5). Il trattamento con citochine di crescita microgliali può aumentare il numero di microglia TMEM119-specifiche (Figura 6). Gli organoidi rappresentativi mostrano sia neuroni βIII-tubuline-positivi che microglia IBA1-positivi dopo clearance e immunocolorazione (Figura 7). Quando trattato con lipopolisaccaride (LPS), si può osservare un aumento dell'attivazione microgliale da parte di marcatori specifici della microglia e attivazione genica proinfiammatoria (Figura 8). La Figura 2 supplementare mostra le cellule IBA-1 e TMEM-119 positive in organoidi coltivati senza ulteriori citochine microgliali.
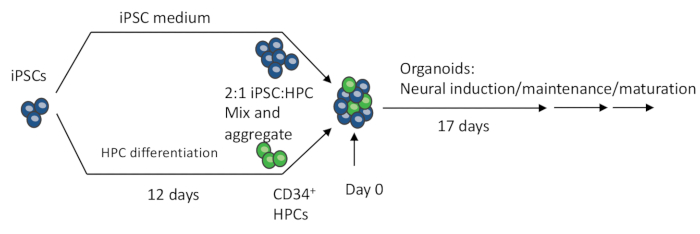
Figura 1: Procedure schematiche per la realizzazione dell'organoide 3D da iPSC. Gli EB sono prodotti mescolando iPSC e HPC differenziate con iPSC. Gli EB subiscono inoltre l'induzione, la differenziazione e la maturazione neurale per produrre organoidi contenenti sia neuroni che microglia. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Cambiamenti morfologici tipici da iPSCs a HPCs. Le immagini rappresentative sono mostrate per la (A) colonia di iPSC, (B) alla fine del trattamento con il terreno A, (C) 3 giorni nel terreno B, (D) il giorno 10 nel terreno B e (E) le HPC galleggianti risultanti. Le immagini sono state scattate al microscopio a fluorescenza con obiettivo 10x o 4x. Clicca qui per visualizzare una versione più grande di questa figura.
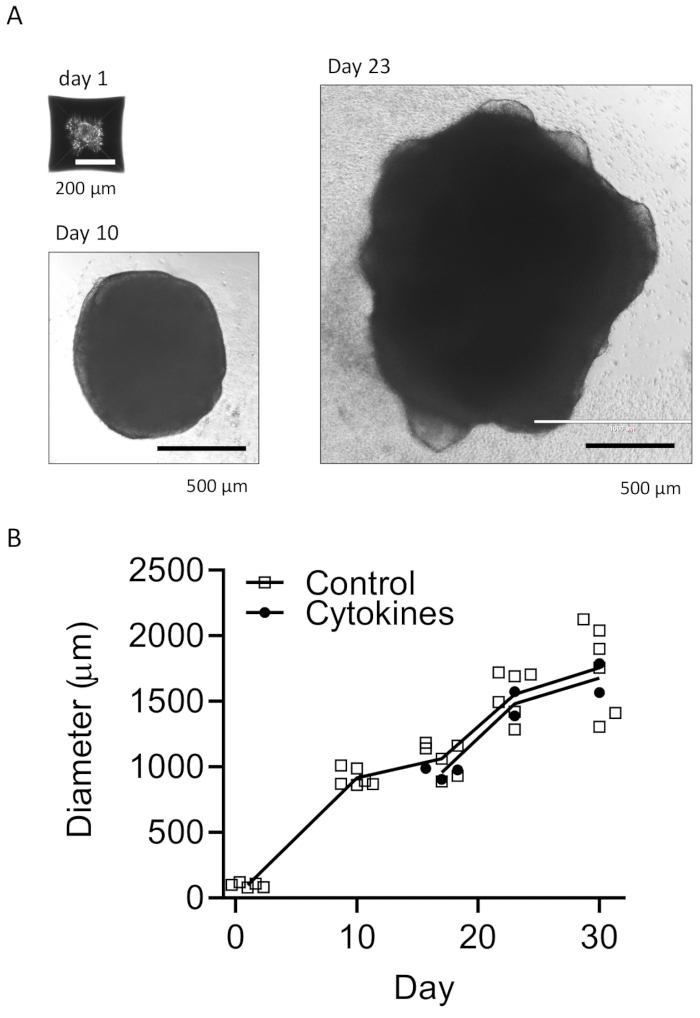
Figura 3: Sviluppo di EB e organoidi maturi. (A) Le foto rappresentative mostrano la formazione di EB (Giorno 1), la crescita degli organoidi (Giorno 10) e la maturazione (Giorno 23). Viene mostrata una curva di crescita per le dimensioni degli organoidi con o senza citochine di differenziazione microgliale (B). Le immagini sono state scattate al microscopio a fluorescenza con obiettivo 10x o 4x. Clicca qui per visualizzare una versione più grande di questa figura.
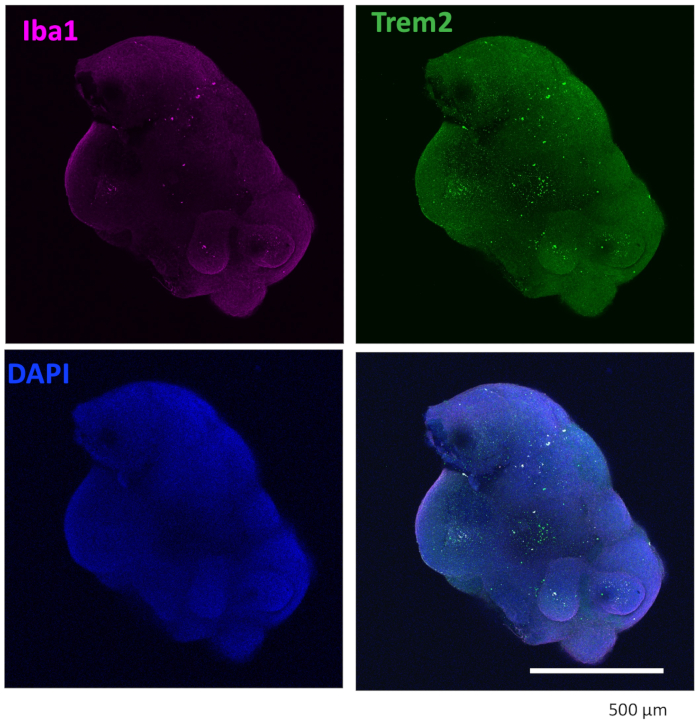
Figura 4: Gli organoidi coltivati con citochine di differenziazione microgliale contengono microglia. Dopo la clearance e l'immunocolorazione, l'organoide ha mostrato che le microglia erano colorate positivamente sia con IBA1 che con TREM2. Vengono mostrate le immagini scattate con un obiettivo 10x di un microscopio confocale. Clicca qui per visualizzare una versione più grande di questa figura.
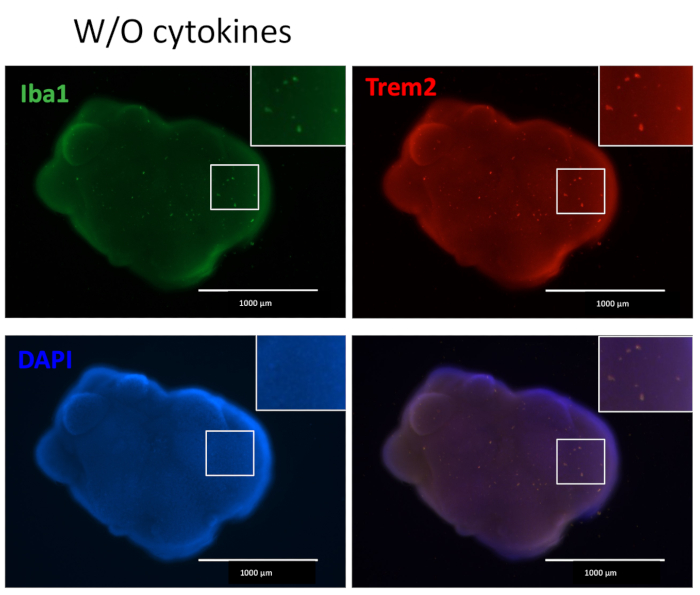
Figura 5: Organoidi coltivati senza ulteriori citochine di differenziazione microgliale contengono microglia. Senza l'aggiunta di citochine di differenziazione microgliale esterna, gli organoidi hanno comunque prodotto microglia positive colorate sia con IBA1 che con TREM2, indicando che il microambiente di sviluppo neuronale nell'organoide è sufficiente per differenziare le HPC in microglia. Le immagini sono state scattate con un microscopio a fluorescenza con un obiettivo 4x. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 6: Risultato dell'RNA-seq a singola cellula di microglia contenenti organoidi 3D. (A) I grafici hanno mostrato distribuzioni di IBA1 (AIF1), TMEM119 e MAP2 in un organoide senza ulteriori citochine di differenziazione microgliale. (B) IBA1 e TEME119 microglia positive sono state contate in due organoidi coltivati con citochine di differenziazione microgliale aggiuntive e in uno senza ulteriori citochine di differenziazione microgliale. Il numero di cellule IBA1 e TMEM119 positive cambia negli organoidi rappresentativi. Clicca qui per visualizzare una versione più grande di questa figura.
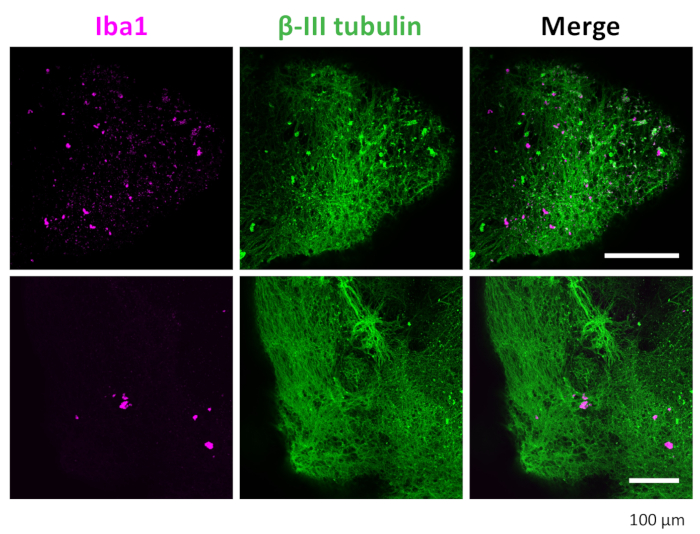
Figura 7: Immunocolorazione di neuroni e microglia negli organoidi 3D. Dopo la clearance e l'immunocolorazione, l'organoide ha mostrato microglia positive colorate con IBA1 e neuroni colorati con βIII-tubulina. Vengono mostrate immagini rappresentative scattate al microscopio confocale con un obiettivo 20x. Clicca qui per visualizzare una versione più grande di questa figura.
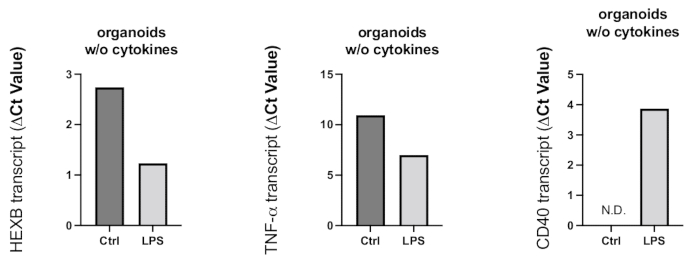
Figura 8: Attivazione infiammatoria indotta negli organoidi dal trattamento con LPS. Dopo 24 ore di trattamento con LPS, sono stati raccolti gli organoidi e la RT-PCR è stata utilizzata per determinare l'attivazione microgliale e la reazione proinfiammatoria. Poiché i valori di Ct sono correlati negativamente ai livelli di espressione genica, come mostrato nei grafici rappresentativi, il trattamento con LPS ha determinato un aumento dell'espressione genica del marcatore di attivazione microgliale HEXB e della citochina proinfiammatoria TNF-α. Sebbene l'espressione del gene CD40 non sia stata rilevata negli organoidi di controllo, il trattamento con LPS ha portato a trascritti CD40 rilevabili. Clicca qui per visualizzare una versione più grande di questa figura.
Figura 1 supplementare: EB in una piastra di coltura a micropozzetti. (A) Le HPC e le iPSC miste sono state depositate nei micropozzetti in una piastra di coltura a micropozzetti dopo la centrifugazione. (B) Gli EB si sono formati dopo 24 ore di incubazione nella piastra di coltura a micropozzetti, osservati al microscopio. (C) Le cellule CD34+ sono state osservate negli organoidi in formazione 8 giorni dopo la formazione di EB. Le immagini confocali sono state scattate con un obiettivo 20x. Clicca qui per scaricare questa figura.
Figura 2 supplementare: Le immagini confocali hanno mostrato cellule IBA-1 e TMEM-119 positive in organoidi coltivati senza citochine microgliali aggiuntive. Le immagini sono state scattate utilizzando un microscopio confocale con zoom 20x e 2x per mostrare le morfologie delle cellule. Clicca qui per scaricare questa figura.
Discussione
Qui viene presentato un protocollo dettagliato per la realizzazione di organoidi neurali 3D contenenti microglia innate da EB derivati da iPSC miste e HPC differenziate da iPSC. Si tratta di un approccio relativamente breve e semplice che coinvolge solo le tecniche e le attrezzature di coltura cellulare generalmente disponibili nella maggior parte dei laboratori.
Il fattore più critico per il successo di questo protocollo è la qualità della differenziazione HPC. Abbiamo adottato il metodo pubblicato17 utilizzando un kit commerciale per differenziare le HPC dalle iPSC con alcune modifiche. Rispetto al protocollo originale, iniziamo con una gamma di colonie di iPSC di dimensioni più piccole e inferiori e raccogliamo le HPC differenziate dopo 10 giorni di differenziazione invece di 12 giorni. Questo approccio genera solo 1-2 milioni di HPC per pozzetto, ma è comunque più che sufficiente per la fase successiva della produzione di organoidi 3D. Mantenere il giusto equilibrio tra queste cellule e le colonie di iPSC è importante poiché un numero eccessivo di cellule può causare alla fine cellule morte/detriti, causando la mancata formazione di EB. Sebbene le HPC possano essere raccolte dal giorno 10 al giorno 12 dopo l'induzione, abbiamo scoperto che la raccolta al giorno 12 rischierebbe di avere più cellule morte e impurità poiché la rapida crescita delle HPC fino alla fine della coltura potrebbe esaurire facilmente i fattori nutrizionali e richiedere un attento monitoraggio e ulteriori cambiamenti del terreno. Raccogliendo le HPC al giorno 10, non sarà necessario eseguire la purificazione delle HPC mediante citometria a flusso o purificazione con microsfere magnetiche, necessarie per arricchire la minore purezza delle HPC.
Per la normale sottocoltura di iPSC e la differenziazione HPC, è stato utilizzato il tampone di dissociazione EDTA, per il quale l'effetto è lieve e dissocia solo le colonie di iPSC in piccole chiazze cellulari, che sono utili per il riattacco delle iPSC dopo la scissione. Tuttavia, le chiazze cellulari possono interferire con la formazione di EB. Pertanto, il trattamento con Accutase viene utilizzato per dissociare le iPSC e ottenere una soluzione a cellula singola per una formazione di EB più uniforme. Quando si producono EB dissociando le iPSC, è importante non trattare eccessivamente le iPSC con l'accutasi, che può provocare un'eccessiva morte cellulare. Lasciare le iPSC a temperatura ambiente e in sospensione per troppo tempo può anche portare a una massiccia morte cellulare e all'abrogazione della differenziazione. Pertanto, il processo dai passaggi 2.1 a 2.13 dovrebbe essere completato il prima possibile per evitare inutili ritardi.
Per facilitare la differenziazione e la maturazione neurale, vengono coltivati diversi EB per pozzetto. Questa impostazione facilita la fusione degli EB e riduce il tempo necessario per la maturazione degli organoidi. Tuttavia, è difficile controllare il numero esatto di EB per la fusione e quindi può introdurre irregolarità nelle dimensioni e nelle forme degli organoidi risultanti. L'irregolarità può essere minimizzata agitando di tanto in tanto le piastre o, se possibile, utilizzando un bioreattore. È anche possibile seminare un singolo EB nei pozzetti di una piastra a 96 pozzetti per evitare del tutto la fusione, ma sarà necessario uno sforzo e un tempo extra per la crescita e la maturazione degli organoidi.
Contrariamente all'inclusione di organoidi singolarmente con Matrigel nell'approccio più accettato18, abbiamo applicato saggiamente la goccia di Matrigel sopra il terreno diverse volte. Questo approccio è meno laborioso ma produce un'alta qualità di differenziazione neurale negli organoidi. Il protocollo descritto in questo studio genera neuroni corticali con microglia. Tuttavia, regolando i fattori di crescita e le fasi di differenziazione seguendo le tecniche pubblicate19,20, potrebbe essere facilmente adattato per produrre organoidi che rappresentano altri tipi neuronali specifici o regioni del cervello.
Recenti pubblicazioni hanno incorporato microglia differenziate con iPSC o cellule simili ai macrofagi nello sviluppo di organoidi corticali per produrre organoidi cerebrali contenenti microgliali21. Poiché le microglia adulte si sviluppano da HPC primitive reclutate nel cervello durante i primi giorni embrionali12, incorporiamo le HPC nella formazione di EB e prima dell'induzione neurale. E' interessante scoprire che senza applicare le citochine specifiche per il differenziamento microgliale, che sono generalmente utilizzate per produrre il differenziamento microgliale negli organoidi cerebrali22, osserviamo ancora un discreto differenziamento microgliale all'interno degli organoidi cerebrali risultanti, sebbene le cellule TREM2 positive siano in numero inferiore, rispetto a quelle coltivate con citochine. Suggerisce che l'inclusione delle HPC nella formazione di EB e le interazioni precoci garantite del processo di sviluppo neurale e delle HPC potrebbero essere sufficienti per differenziare la microglia nell'organoide cerebrale. Suggerisce anche che il nostro protocollo è prezioso come modello per studiare lo sviluppo precoce della microglia nel cervello.
Come discusso, questo protocollo produce organoidi che imitano lo sviluppo precoce del cervello umano. Sebbene abbiamo coltivato organoidi fino a 6 settimane senza notare un deterioramento apparente in base alle morfologie degli organoidi, e alcune colture abbiano raggiunto più di 4 mesi, la necrosi cellulare è stata riscontrata nei nuclei degli organoidi a partire dalle 8 settimane di vita. Questo è comune anche ad altri tipi di organoidi cerebrali, poiché le cellule centrali degli organoidi in crescita incontrano difficoltà nell'accesso alla nutrizione. L'uso di bioreattori con agitazione continua può aumentare la vitalità e prolungare la vita degli organoidi, consentendo ai tipi di cellule più mature di differenziarsi. Tuttavia, la cultura a lungo termine si tradurrà quasi certamente in maggiori variabilità senza una certa assistenza culturale automatica. Pertanto, si consiglia di utilizzare questo protocollo per studiare lo sviluppo cerebrale precoce correlato alle microgliali e gli effetti acuti delle neuroinfezioni sullo sviluppo cerebrale. Per una modellazione cerebrale più sofisticata, suggeriamo ai ricercatori di utilizzare questo protocollo come base e applicare modifiche per aumentare la coerenza e facilitare le colture a lungo termine.
In sintesi, nel presente protocollo, incorporiamo HPC differenziate con iPSC nella formazione di EB e induciamo ulteriormente il differenziamento neurale. In meno di un mese, questo protocollo produrrà organoidi contenenti sia neuroni che microglia generati dalle stesse iPSC. Fornisce una comoda alternativa per realizzare organoidi cerebrali con interazioni precoci tra lo sviluppo neuronale e microgliale, rendendolo così utile per studiare la fisiologia dello sviluppo del cervello umano e le malattie infettive e neuroinfiammatorie neurali che coinvolgono la microglia innata.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo studio è supportato dai fondi di ricerca intramurale NINDS.
Materiali
| Name | Company | Catalog Number | Comments |
| 12 well cell culture plates | Corning | #3512 | |
| 24 well cell culture plate | SARSTEDT | #83.3922 | |
| Accutase | Thermo | A1110501 | |
| Aggrewell 400 plate | Stemcell technologies | #34411 | Referred to as microwell culture plate |
| Alexa Fluor 488 goat anti-mouse antibody | Life techniologies | A11001 | 1:400 dilution |
| Alexa Fluor 594 goat anti-rabbit antibody | Life techniologies | A11012 | 1:400 dilution |
| Allegra X-30R Centrifuge with rotor S6069 | Beckman Couler | ||
| Anti- Adherence Rinsing solution | Stem Cell Technologies | #07010 | |
| anti-CD34 antibody | Stem Cell Technologies | #60013 | 1:100 dilution |
| anti-Human CD43 antibody | Stem Cell Technologies | #60085 | 1:100 dilution |
| anti-IBA1 rabbbit antibody | Fujifilm | 019-19741 | 2.5 µg/mL |
| anti-TREM2 rat pAb | RD Systems | mab17291 | 2.5 µg/mL |
| Antibiotic-antimycotic | Gibco | 15240-062 | 1x |
| B27 supplement | Life technologies | 17504-044 | 1x |
| bFGF | Peprotech | 100-18B | 20 ng/mL |
| CD200 | Novoprotein | C311 | 100 ng/mL |
| CryoTube vials | Thermo | #368632 | |
| CX3CL1 | Peprotech | 300-31 | 100 ng/mL |
| DAPI | Sigma | D9542 | 1 µg/mL |
| DMEM/F12 | Life technologies | 12400-024 | 1x |
| DMSO | Sigma | D2650 | |
| DPBS | Gibco | #4190136 | 1x |
| E8 Flex medium kit | Thermo | A2858501 | |
| EDTA | Mediatech | 46-034-Cl | 0.5 mM |
| EGF | Peprotech | AF-100-15 | 20 ng/mL |
| EVOS FL Auto Microscope | Thermo | Fluorescence microscope | |
| FastStart Universal SYBR Green PCR master mix | Roche | #4913850001 | |
| Glutamax | Gibco | #35050079 | |
| Goat serum | Sigma | G9023 | 4% |
| IL-34 | Peprotech | 200-34 | 100 ng/mL |
| ImageXpress Micro Confocal | Molecular Devices | ||
| Knockout DMEM/F12 | Gibco | #10829018 | |
| M-CSF | Peprotech | 300-25 | 25 ng/mL |
| Matrigel | Corning | #354277 | Basement membrane matrix (BMM) |
| Mouse anti-βIII-tubulin antibody | Promega | G712A | 1:1000 dilution |
| Mr. Frosty container | Thermo | 5100-0001 | |
| N2 supplement | Life technologies | 17502-048 | 1x |
| Paraformadehyde | Sigma | P6148 | 4% |
| PSC Neural Induction Medium | Gibco | A1647801 | |
| Rock inhibitor Y27632 | Stemcell technologies | #72304 | 1 mM stock |
| RT LTS 1000 ul pipette tips | RAININ | #30389218 | for transferring organoids |
| STEMdiff Cerebral Organoid Kit | Stem Cell Technologies | #08570 | |
| STEMdiff Hematopoietic Kit | StemCell Technologies | #5310 | Referred to as hematopoietic Kit |
| StemPro Neural Supplement | Gibco | A1050801 | Referred to as neural supplement |
| TGF-β1 | Peprotech | 100-21 | 50 ng/mL |
| Total RNA Purification Plus Kit | Norgen | #48400 | |
| TritonX-100 | Sigma | T9284 | 0.10% |
| Visikol Histo-Starter Kit | Visikol | HSK-1 | Contains organoid clearing solution HISTO-M, washing buffer |
| Zeiss LSM 510-META Confocal Microscope | Zeiss |
Riferimenti
- Sabate-Soler, S., et al. Microglia integration into human midbrain organoids leads to increased neuronal maturation and functionality. Glia. 70 (7), 1267-1288 (2022).
- Lazarov, T., Juarez-Carreño, S., Cox, N., Geissmann, F. Physiology and diseases of tissue-resident macrophages. Nature. 618 (7966), 698-707 (2023).
- Wang, T., Liu, B., Zhang, W., Wilson, B., Hong, J. S. Andrographolide reduces inflammation-mediated dopaminergic neurodegeneration in mesencephalic neuron-glia cultures by inhibiting microglial activation. J Pharmacol Exp Ther. 308 (3), 975-983 (2004).
- Qian, L., Flood, P. M., Hong, J. S. Neuroinflammation is a key player in Parkinson's disease and a prime target for therapy. J Neural Transm (Vienna). 117 (8), 971-979 (2010).
- Clevers, H. Modeling development and disease with organoids. Cell. 165 (7), 1586-1597 (2016).
- Fakıoğlu, D. M., Altun, B. New therapeutic approaches in cystic fibrosis. Turk J Pharm Sci. 17 (6), 686-697 (2020).
- Mcmillan, R. E., Wang, E., Carlin, A. F., Coufal, N. G. Human microglial models to study host-virus interactions. Exp Neurol. 363, 114375 (2023).
- Scopa, C., et al. Jun upregulation drives aberrant transposable element mobilization, associated innate immune response, and impaired neurogenesis in Alzheimer's disease. Nat Commun. 14 (1), 8021 (2023).
- Tamaki, Y., et al. Spinal cord extracts of amyotrophic lateral sclerosis spread TDP-43 pathology in cerebral organoids. PLoS Genet. 19 (2), e1010606 (2023).
- Chambers, S. M., et al. Highly efficient neural conversion of human es and IPS cells by dual inhibition of smad signaling. Nat Biotechnol. 27 (3), 275-280 (2009).
- Kim, S. H., Chang, M. Y. Application of human brain organoids-opportunities and challenges in modeling human brain development and neurodevelopmental diseases. Int J Mol Sci. 24 (15), 12528 (2023).
- Ginhoux, F., et al. Fate mapping analysis reveals that adult microglia derive from primitive macrophages. Science. 330 (6005), 841-845 (2010).
- Ormel, P. R., et al. Microglia innately develop within cerebral organoids. Nat Commun. 9 (1), 4167 (2018).
- Abdelmalek, C. M., et al. Building a growing genomic data repository for maternal and fetal health through the ping consortium. medRxiv. , (2024).
- Wei, Z., et al. Human IPSC-derived brain organoids: A 3D mini-brain model for studying HIV infection. Exp Neurol. 364, 114386 (2023).
- Wang, T., et al. Regulation of stem cell function and neuronal differentiation by HERV-K via mTOR pathway. Proc Natl Acad Sci U S A. 117 (30), 17842-17853 (2020).
- Mcquade, A., et al. Development and validation of a simplified method to generate human microglia from pluripotent stem cells. Mol Neurodegener. 13 (1), 67 (2018).
- Lancaster, M. A., Knoblich, J. A. Generation of cerebral organoids from human pluripotent stem cells. Nat Protoc. 9 (10), 2329-2340 (2014).
- Fiorenzano, A., et al. Single-cell transcriptomics captures features of human midbrain development and dopamine neuron diversity in brain organoids. Nat Commun. 12 (1), 7302 (2021).
- Qian, X., et al. Brain-region-specific organoids using mini-bioreactors for modeling ZIKV exposure. Cell. 165 (5), 1238-1254 (2016).
- Park, D. S., et al. IPS-cell-derived microglia promote brain organoid maturation via cholesterol transfer. Nature. 623 (7986), 397-405 (2023).
- Schafer, S. T., et al. An in vivo neuroimmune organoid model to study human microglia phenotypes. Cell. 186 (10), 2111-2126.e20 (2023).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon