Method Article
Dérivation d’un organoïde du cerveau humain avec développement de la microglie
Dans cet article
Résumé
Nous présentons un protocole pour générer un organoïde cérébral humain avec une microglie résidente en incorporant des cellules progénitrices hématopoïétiques (HPC) dérivées de cellules souches pluripotentes induites (iPSC) dans le développement d’organoïdes.
Résumé
Les cultures tridimensionnelles (3D) d’organoïdes cérébraux dérivées de cellules souches pluripotentes induites (iPSC) constituent un outil in vitro alternatif important pour l’étude du développement du cerveau humain et de la pathogenèse des maladies neurologiques. Cependant, le manque d’incorporation de la microglie dans les organoïdes du cerveau humain reste un obstacle majeur pour les modèles 3D de neuroinflammation. Les approches actuelles comprennent soit l’incorporation de microglies entièrement différenciées dans des organoïdes cérébraux matures, soit l’induction de la différenciation microgliale à partir du stade précoce des corps embryoïdes (EB) dérivés d’iPSC. La première approche manque l’étape où la différenciation microgliale interagit avec l’environnement neuronal adjacent, et la dernière approche est techniquement difficile, entraînant une incohérence entre les organoïdes finaux en termes de quantité et de qualité de la microglie. Pour modéliser des organoïdes cérébraux avec des cellules microgliales afin d’étudier les interactions précoces entre le développement microglial et neuronal, des cellules progénitrices hématopoïétiques (HPC) hautement pures différenciées des iPSC humaines ont été incorporées dans des EB dérivées d’iPSC pour fabriquer des organoïdes cérébraux. En utilisant l’immunocoloration et l’analyse de séquençage de l’ARN unicellulaire (sc-RNA-seq), nous avons confirmé que les HPC étaient incorporés dans les organoïdes 3D, qui se sont finalement développés en organoïdes cérébraux avec à la fois des microglies et des neurones. Par rapport aux organoïdes cérébraux sans HPC, cette approche produit une incorporation microgliale significative dans les organoïdes cérébraux. Ce nouveau modèle organoïde 3D, qui comprend à la fois des propriétés de développement microglial et neuronal, peut être utilisé pour étudier les interactions précoces entre le développement du système immunitaire inné et du système nerveux et potentiellement comme modèle pour la neuroinflammation et les troubles neuroinfectieux.
Introduction
Les microglies sont des cellules immunitaires résidentielles dans le cerveau, jouant un rôle essentiel dans le développement du cerveau et l’homéostasie 1,2. L’activation de la microglie entraîne la production de facteurs pro-inflammatoires, une phagocytose élevée et un stress oxydatif réactif, qui élimine les agents pathogènes envahissants et les cellules compromises. Cependant, une suractivation ou une activation prolongée de la microglie peut, d’autre part, provoquer une neurodégénérescence en tant que mécanisme de pathogenèse dans de nombreux troubles neurologiques, y compris la maladie de Parkinson 3,4. Il est important que les microglies soient incluses dans les modèles pertinents pour l’étude des troubles neurologiques humains. Ces dernières années, les cellules souches humaines ont été utilisées pour développer des organoïdes 3D sous forme de modèles in vitro comme alternative aux modèles animaux et aux études sur des sujets humains5. Idéalement, les organoïdes humains constituent plusieurs types de cellules et de structures tissulaires similaires aux organes humains correspondants, représentant mieux la physiologie et la pathogenèse humaines que les modèles animaux, mais sans les préoccupations éthiques impliquées dans les études directes des individus humains. Ils peuvent représenter l’avenir de la modélisation des maladies humaines pour l’étude de la pathogenèse et le développement de médicaments et pour l’orientation de thérapies individualisées6. À titre d’exemple, les organoïdes cérébraux humains en 3D dérivés de cellules souches pluripotentes induites humaines (iPSC) ont prévalu dans le domaine de la recherche en neurosciences, modélisant les maladies infectieuses neuronales, notamment ZIKA, le SRAS-CoV-27, et les maladies neurodégénératives, notamment la sclérose latérale amyotrophique (SLA) et la maladie d’Alzheimer 8,9. Cependant, les organoïdes neuronaux 3D conventionnels utilisant l’inhibition dual-SMAD pour induire la différenciation neuronale10 produisent des organoïdes cérébraux dépourvus de microglie, car ils sont dérivés de progéniteurs recrutés dans le sang au lieu de la lignée neuroectodermique dont les neurones sont issus11,12. Sans la présence de microglie, les organoïdes sont inadéquats pour modéliser les infections du SNC, l’inflammation et la neurodégénérescence associée.
Pour résoudre ce problème critique, des tentatives ont été faites pour incorporer la microglie différenciée dans les organoïdes cérébraux13 ou induire la différenciation microgliale au sein des organoïdes dès le début en utilisant des approches alternatives au lieu de l’inhibition duale de la SMAD13. Cependant, en incorporant des microglies différenciées dans les organoïdes cérébraux, les interactions précoces entre le développement neuronal et microglial sont manquées. Cela pourrait être important dans le développement du SNC ou dans la pathogenèse de troubles neuro-infectieux ciblant le développement du cerveau du nourrisson, comme dans l’infection par le virus ZIKA14. D’autre part, la différenciation de la microglie innée au sein d’organoïdes cérébraux dérivés d’iPSC sans stades intermittents implique un processus prolongé et présente une variabilité plus élevée dans les produits finaux15. Dans ce protocole, nous avons incorporé les cellules progénitrices hématopoïétiques (HPC) dérivées d’iPSC dans les iPSC pour créer des corps embryoïdes (EB), qui ont été différenciés en organoïdes 3D, y compris les neurones et la microglie.
Notre protocole fournit une approche simple qui peut être adoptée pour étudier le système nerveux central humain impliquant des interactions neurones-microgliales précoces et la pathogenèse des troubles infectieux neuronaux et de la neuroinflammation impliquant l’activation microgliale.
Protocole
Les échantillons de sang originaux de donneurs adultes en bonne santé ont été prélevés à la Transfusion Medicine Blood Bank des NIH, et des formulaires de consentement éclairé signés ont été obtenus conformément au NIH Institutional Review Board.
1. Produire des cellules progénitrices hématopoïétiques (HPC) à partir d’iPSC humaines
REMARQUE : Les cellules iPSC humaines 510 et 507 ont été utilisées pour produire les résultats représentatifs. Les méthodes de génération et de maintenance des iPSC ont été trouvées dans une publication précédente16.
- Jour 0 : Enduire une plaque cellulaire de 12 puits en ajoutant 500 μL/puits de solution glacée de Matrigel (matrice de membrane basale [BMM]) diluée dans un milieu DMEM/F12 et l’incuber pendant au moins 30 minutes à température ambiante (RT).
- Retirer complètement le surnageant de revêtement et le remplacer par 1 mL de milieu E8 Flex par puits.
- Vérifiez la culture d’iPSC dans une plaque de 6 puits au microscope pour confirmer que les iPSC sont de haute qualité et sans signe de différenciation. Choisissez une colonie de taille moyenne en la marquant à l’aide d’un marqueur sous le bas de la plaque.
- Retirer le milieu de la culture d’iPSC et ajouter 500 μL de tampon de dissociation de l’acide éthylènediaminetétraacétique (EDTA) (0,5 mM d’EDTA, 0,45 g/L de NaCl dans le DPBS) dans le puits.
- Observez au microscope des signes de dissociation cellulaire lorsque trois à quatre rangées de cellules des bords de la colonie commencent à rétrécir, avec un espace vide apparaissant entre les cellules. Cela prend généralement 1 à 3 min.
- Jetez complètement la solution EDTA. Délogez la colonie d’iPSC marquée en pipetant 1 mL de milieu E8 Flex avec force et directement sur celle-ci. Assurez-vous que la colonie se détache complètement en patchs cellulaires contenant 20 à 50 cellules chacun après 1 à 3 fois de pipetage.
- Prélevez le surnageant contenant des patchs cellulaires et ajoutez-le dans le premier puits des puits recouverts de la plaque à 12 puits.
- Mélangez le puits en pipetant une ou deux fois et transférez 1 mL des cellules dans le deuxième puits qui contient 1 mL de milieu.
- Répétez l’étape 1.8 deux fois pour faire des cultures d’iPSC diluées en série dans un total de quatre puits.
- Incuber la plaque dans un incubateur à 37 °C et 5 % de CO2.
- Après 24 h, le jour 1, vérifiez les colonies au microscope et comptez le nombre de colonies en parcourant tous les champs dans un puits en continu. Choisissez un puits qui contient 10 à 20 colonies d’iPSC.
- Remplacez le milieu par 1 mL de milieu A de la trousse hématopoïétique. Remettez la plaque dans l’incubateur pendant 48 h.
- Le jour 3, prélever 500 μL de milieu épuisé et ajouter 500 μL de milieu frais A.
- Le jour 4, observez au microscope et remarquez une croissance cellulaire et une différenciation significatives à partir des colonies d’iPSC. Remplacer le milieu par 1 mL de milieu B.
- Surveillez la différenciation cellulaire au microscope et effectuez un changement à mi-moyen avec 500 μL de milieu B tous les deux jours. Les cellules de type HPC apparaissent les jours 6 et 7.
- Le 10e jour, observez au microscope des cellules rondes uniques brillantes avec la morphologie des HPC normaux flottant dans le milieu ou faiblement attachées à la couche inférieure unique des cellules plates, avec quelques agrégats de cellules lâches.
REMARQUE : Les HPC différenciés sont prêts à être collectés pour une caractérisation ou une expérience plus approfondie. - Collectez tous les HPC différenciés en pipetant trois fois vers le haut et vers le bas à l’aide d’une pointe de pipette de 1 mL pour briser les agrégats cellulaires et détacher les HPC de la surface de la plaque.
- Ajouter les cellules dans un tube de 15 mL et centrifuger les cellules à 300 x g pendant 5 min. Retirer le surnageant et remettre en suspension la pastille de cellule dans 1 mL de milieu B.
- Comptez les cellules et ajustez la concentration à 1 million de cellules/ml. À ce stade, plus d'1 million de HPC sont générés. Lors de la cytométrie en flux, assurez-vous que la pureté est supérieure à 85 % des cellules avec CD34+/CD43+. Assurez-vous qu’aucune cellule morte importante (plus de 5 %) n’est remarquée.
2. Développement de corps embryoïdes à partir d’iPSC et de HPC mixtes
- Le jour même de la collecte des HPC, assurez-vous qu’une culture d’iPSC atteint également une confluence de 80 % dans un puits d’une plaque de 6 puits (ou deux puits dans une plaque de 12 puits).
- Traitez un puits de la plaque de culture à micropuits pour la formation d’EB avec 500 μL de solution de rinçage anti-adhérence en l’ajoutant pour minimiser les bulles.
- Faites tourner la plaque à 2000 x g pendant 5 min dans un rotor à godet oscillant équipé de porte-plaques pour éliminer les éventuelles bulles.
- Retirer complètement la solution de rinçage par pipetage et laver les puits deux fois avec 1 mL de DPBS, puis 1 mL de DMEM/F12 sans générer de bulles.
- Dissocier les iPSC de la plaque en traitant les cellules avec 1 mL de solution d’Accutase.
- Observez au microscope jusqu’à ce que les cellules montrent des signes de séparation mais soient toujours attachées au fond. Cela se produit généralement dans les 1 à 3 minutes suivant le traitement par Accutase. Ne digérez pas trop les iPSC.
- Retirer complètement la solution d’Accutase sans déranger les cellules et ajouter 1 mL de milieu DMEM/F12 dans les puits. De plus, dissociez les cellules en cellules uniques en pipetant de haut en bas à quelques reprises à l’aide d’un embout de 1 ml.
- Rassemblez les cellules dans un tube de 15 ml et remplissez-le à 5 ml avec un milieu DMEM/F12. Faites tourner les cellules à 300 x g pendant 5 min.
- Retirer le surnageant par pipetage et remettre les cellules en suspension dans 1 mL de milieu E8 Flex. Comptez les cellules et ajustez la concentration cellulaire à 1 million de cellules par ml dans le milieu E8 Flex.
- Mélangez des iPSC avec des HPC dans un rapport de 2:1 en additionnant 1 million d’iPSC (1 ml) et un demi-million de HPC (500 μL). Ajouter toutes les cellules mélangées dans le puits préalablement traité de la plaque de culture du micropuits.
- Ajouter 1 μL de solution mère d’inhibiteur de roche Y27632 (1 mM) par milieu de 1 mL dans le surnageant. Secouez la plaque d’un côté à l’autre plusieurs fois pour répartir uniformément les cellules.
- Faites tourner la plaque de culture à micropuits à 300 x g pendant 5 min dans un rotor à godets oscillants équipé de porte-plaques. Observez au microscope pour voir si les cellules se sont installées dans les micropuits. (Figure supplémentaire 1A).
- Sans déranger les cellules, placez la plaque dans un incubateur à cellules à 37 °C, 5 % CO2 .
- Le jour 2, 48 h plus tard, observez les cellules au microscope pour la formation d’EB. Lorsque les EB sont clairement formés, passez à l’étape suivante (figure supplémentaire 1B).
- Traiter une plaque de culture cellulaire à 24 puits avec un tampon de rinçage anti-adhérence (500 μL) pendant 15 min pour obtenir une plaque à faible fixation.
- Retirez complètement le tampon de rinçage et lavez les puits deux fois avec 1 mL de DPBS, puis ajoutez 1 mL de milieu E8 Flex dans les puits.
- Remettez les EB en suspension dans la plaque de culture à micropuits en les pipetant à l’aide d’une pointe de pipette à orifice de 1 mL de large pendant quelques fois.
- Pour chaque puits des plaques de 24 puits traitées à faible adhérence, prélever et ajouter 100 μL de milieu contenant des EB. Cela se traduira par 10 à 20 EB par puits. Ajoutez le support E8 Flex à l’ancien puits contenant les EB restants en tant que sauvegarde.
- Incuber la plaque dans un incubateur à cellules à 37 °C, 5 % de CO2 pendant 48 h.
3. 3D l’induction, la prolifération et la maturation des organoïdes neuronaux
- Le jour 2 après la formation de l’EB, décongeler les aliquotes de BMM sur la glace pendant au moins 30 min.
- Utilisez une pointe de 20 μL pré-refroidie et ajoutez judicieusement une goutte BMM glacée de 15 μL sur le milieu pour enrober les EB. Cela fait un film de BMM sur lequel les EB se fixeront et se développeront.
- Placez la plaque dans un incubateur à cellules à 37 °C, 5 % de CO2 .
- Le jour 4, après la formation de l’EB, retirez soigneusement 500 μL de milieu sans jeter les EB et répétez l’enrobage BMM en suivant l’étape 3.2.
- Démarrez immédiatement l’induction neurale en ajoutant 500 μL de milieu d’induction neurale PSC sur les cellules.
- Les jours 6 et 8, effectuez un demi-changement de milieu en retirant soigneusement 500 μL de milieu sans toucher les cellules et en ajoutant 500 μL de milieu à induction neurale.
- Les jours 10, 12 et 14, effectuez un demi-changement de milieu avec un milieu de cellules souches neurales (NSC) : Knockout DMEM/F12 + 1x supplément Glutamax + 1x supplément neural + bFGF + EGF.
- Le 15e jour, transférez l’ensemble du puits de sphères avec le milieu dans une nouvelle plaque à 12 puits traitée avec une solution de rinçage anti-adhérence comme décrit précédemment. Ajouter 500 μL de milieu de maturation neuronale (DMEM/F12 + 1x supplément N2 + 1x supplément B27 + 1x antibiotiques-antimycosiques) sur la culture.
- Effectuez un changement mi-moyen avec un milieu de maturation neuronale tous les deux jours.
- Au cours de la phase de maturation, s’il y a des signes d’épuisement nutritionnel, tels qu’un changement de couleur du milieu, déplacez l’organoïde vers des plaques à 6 puits, qui contiennent jusqu’à 3 ml de milieu par puits.
- En option, 17 jours après la formation de l’EB, compléter le milieu de maturation avec des cytokines (IL-34, M-CSF, TGF-β1, CD200, CX3CL1) pendant 6 jours pour faciliter la maturation microgliale.
- Le 23e jour, collectez les organoïdes neuronaux résultants pour la caractérisation ou d’autres expériences.
4. Clairance et immunocoloration des organoïdes neuronaux 3D
- Fixer jusqu’à 10 organoïdes par immersion dans 1 mL de paraformaldéhyde à 4 % (PFA) à 4 °C pendant 24 h.
- Transférez les organoïdes par puits dans une plaque inférieure transparente de 96 puits et lavez-les avec 200 μL de DPBS 2 fois pendant 1 h à chaque fois en secouant doucement.
- Perméabiliser les organoïdes en les lavant une fois dans du méthanol à 50 % dans du DPBS, du méthanol à 80 % dans de l’eau bidistillée (dd) et du méthanol sec à 100 % pendant 10 minutes chacun, à 4 °C avec une légère agitation.
- Laver les organoïdes en série dans 20 % de DMSO/méthanol, 80 % de méthanol dans de l’eau dd, 50 % de méthanol dans du DPBS, dans du DPBS à 100 %, puis dans du DPBS avec 0,2 % de Triton X-100, pendant 10 min chacun à 4 °C en secouant doucement. Faites un effort pour éliminer complètement le tampon résiduel après chaque lavage.
- Incuber dans un tampon de perméabilisation (DPBS avec 0,2 % de Triton X100, 0,3 M de glycine et 20 % de DMSO) en agitant doucement pendant 40 min à RT.
- Bloquer dans un tampon bloquant (DPBS avec 0,2 % de Triton X100, 6 % de sérum de chèvre et 10 % de DMSO) pendant 1 h à 37 °C avec agitation douce sur un agitateur à 80 tr/min.
- Incuber avec des anticorps dans un tampon de dilution d’anticorps (IBA1 1:100, TREM2 1:100, βIII-tubuline, 1:1000, 100 μL /puits dans du DPBS avec 0,2 % de Tween 20, 100 μg/mL d’héparine, 3 % de sérum de chèvre et 5 % de DMSO) à 37 °C pendant 2 h ou en chambre froide avec agitation douce à 80 tr/min pendant 3 jours.
- Laver avec du DPBS avec 0,2 % de Tween 20, 100 μg/mL d’héparine 5 fois, 10 min chacune à RT avec une légère secousse sur un shaker à 80 tr/min.
- Incuber avec l’anticorps secondaire (1:200 chèvre anti-souris Alexa488) à 37 °C pendant 1 h, suivi d’une RT pendant la nuit avec une légère agitation sur un agitateur à 80 tr/min.
- Pour la coloration de contraste nucléaire, effectuez la coloration DAPI en même temps que l’incubation d’anticorps ou dans un tampon de lavage.
- Laver les organoïdes 10 fois dans un tampon de lavage, 10 min à chaque fois à 37 °C, en secouant doucement.
- Observez au microscope. Si le fond est encore élevé, continuez à le laver 5 fois.
- Jetez le surnageant autant que possible. Ajouter 200 μL de solution de clarification des organoïdes et l’incuber pendant 5 minutes avant l’observation et prendre des images à l’aide d’un microscope confocal.
Résultats
Notre protocole suit un schéma permettant de différencier les HPC des iPSC, puis de mélanger les HPC avec les iPSC pour produire des EB, suivis d’une induction neuronale, d’une différenciation et d’une maturation (Figure 1). Une différenciation HPC de haute qualité est essentielle pour le succès de la formation de l’EB et de la différenciation ultérieure des organoïdes. Une technique de culture par dilution en série est utilisée pour produire le nombre et la taille appropriés de colonies d’iPSC pour commencer la différenciation HPC (Figure 2A). Normalement, les colonies d’iPSC subissent des changements morphologiques significatifs à la fin de la culture dans le milieu A (Figure 2B) et montrent une différenciation HPC après 3 jours dans le milieu B (Figure 2C), sous forme de cellules rondes homogènes, flottant juste au-dessus ou attachées au fond des récipients de culture. Le HPC peut s’étendre pour former des amas de cellules ressemblant à des colonies (Figure 2D). Les HPC prédominent au jour 10 sans montrer de débris significatifs (Figure 2E). La haute qualité du mélange HPC et iPSC entraîne la formation d’EB dans les 24 heures, qui continue de croître avec un minimum de débris cellulaires (Figure 3A). Les HPC de mauvaise qualité avec un excès de débris peuvent entraîner des difficultés de formation d’EB. Après avoir été transférés sur une nouvelle plaque, les EB ont continué à croître et ont finalement atteint un plateau dans le milieu de maturation (figure 3B). Les EB vont se différencier en organoïdes contenant des microglies positives pour IBA1 et TREM2, avec (Figure 4) ou sans traitement par cytokines microgliales (Figure 5). Le traitement avec des cytokines de croissance microgliale peut augmenter le nombre de microglies spécifiques à TMEM119 (Figure 6). Les organoïdes représentatifs montrent à la fois des neurones βIII-tubuline positifs et une microglie IBA1-positive après clairance et immunocoloration (Figure 7). Lorsqu’il est traité avec un lipopolysaccharide (LPS), une augmentation de l’activation microgliale peut être observée par des marqueurs spécifiques des microglies et une activation génique pro-inflammatoire (Figure 8). La figure supplémentaire 2 montre les cellules IBA-1 et TMEM-119 positives dans des organoïdes cultivés sans cytokines microgliales supplémentaires.
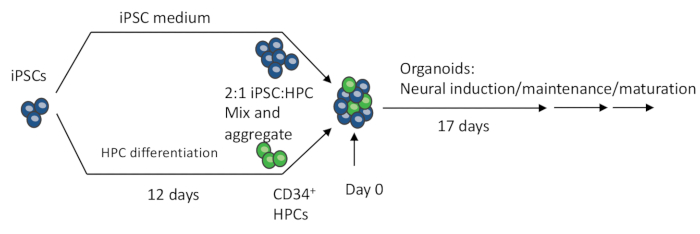
Figure 1 : Procédures schématiques de fabrication de l’organoïde 3D à partir d’iPSC. Les EB sont fabriqués en mélangeant des iPSC et des HPC différenciés par des iPSC. Les EB subissent ensuite une induction neuronale, une différenciation et une maturation pour produire des organoïdes contenant à la fois des neurones et des microglies. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Changements morphologiques typiques des iPSC aux HPC. Des images représentatives sont montrées pour (A) la colonie d’iPSC, (B) à la fin du traitement dans le milieu A, (C) 3 jours dans le milieu B, (D) le jour 10 dans le milieu B et (E) les HPC flottants résultants. Les images ont été prises au microscope à fluorescence avec objectif 10x ou 4x. Veuillez cliquer ici pour voir une version agrandie de cette figure.
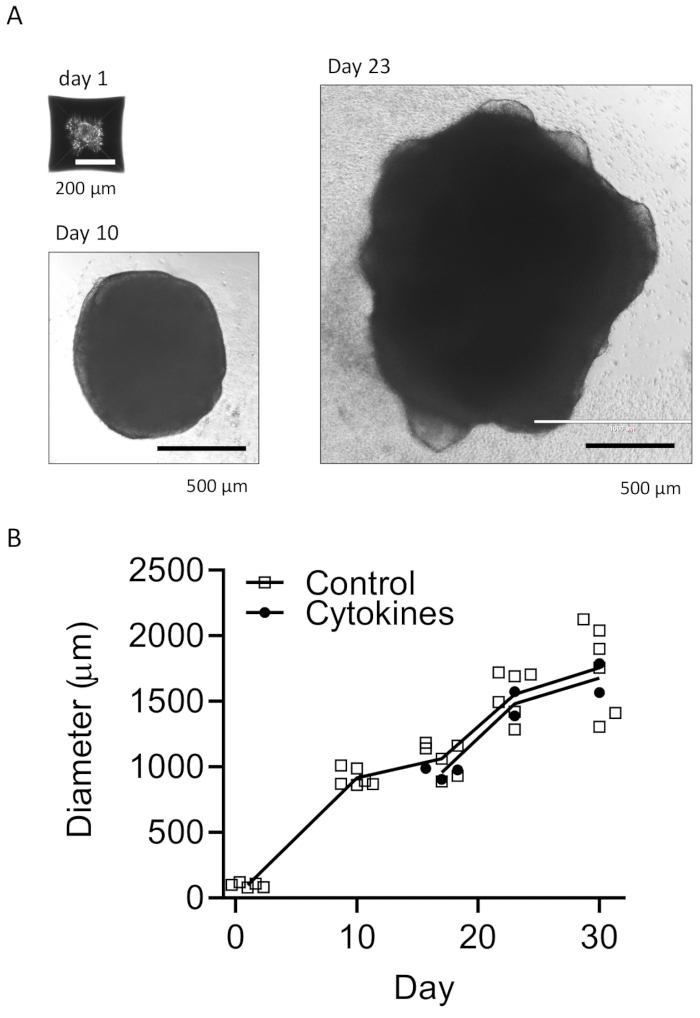
Figure 3 : Développement des EB et des organoïdes matures. (A) Des photos représentatives montrent la formation des EB (jour 1), la croissance des organoïdes (jour 10) et la maturation (jour 23). Une courbe de croissance est représentée pour la taille des organoïdes avec ou sans cytokines de différenciation microgliale (B). Les images ont été prises au microscope à fluorescence avec un objectif 10x ou 4x. Veuillez cliquer ici pour voir une version agrandie de cette figure.
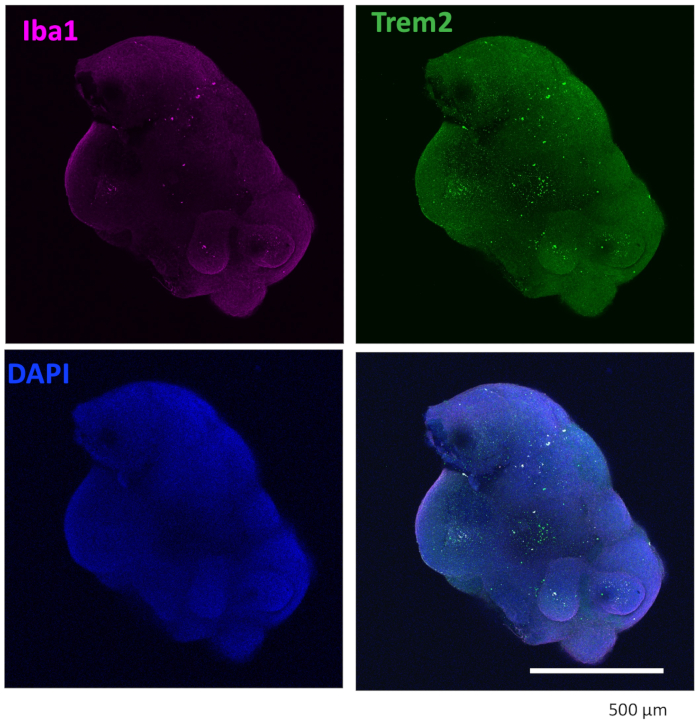
Figure 4 : Les organoïdes cultivés avec des cytokines de différenciation microgliale contiennent de la microglie. Après clairance et immunomarquage, l’organoïde a montré que les microglies étaient positivement colorées avec IBA1 et TREM2. Des images prises sous un objectif 10x d’un microscope confocal sont présentées. Veuillez cliquer ici pour voir une version agrandie de cette figure.
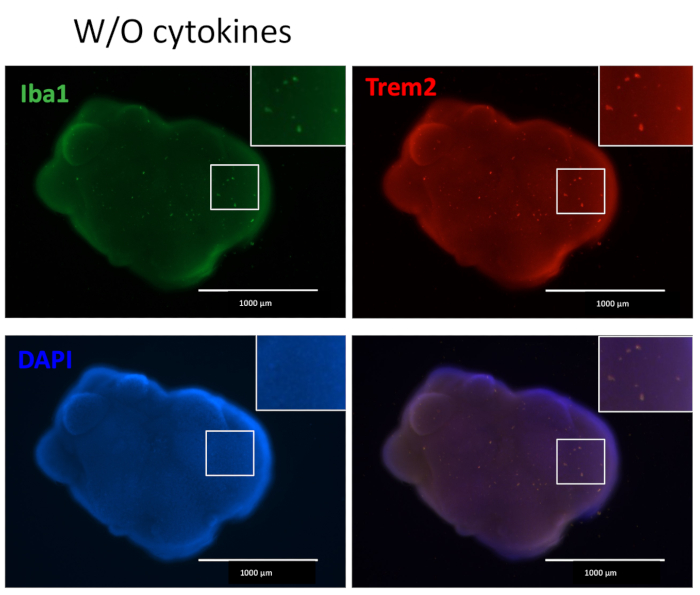
Figure 5 : Organoïdes cultivés sans différenciation microgliale supplémentaire Les cytokines contiennent de la microglie. Sans l’ajout de cytokines de différenciation microgliale externe, les organoïdes produisaient toujours des microglies positives colorées à la fois avec IBA1 et TREM2, indiquant que le microenvironnement du développement neuronal dans l’organoïde est suffisant pour différencier les HPC en microglie. Les images ont été prises sous un microscope à fluorescence avec un objectif 4x. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 6 : Résultat de séquençage de l’ARN d’une cellule unique d’une microglie contenant des organoïdes 3D. (A) Les graphiques ont montré les distributions IBA1(AIF1), TMEM119 et MAP2 dans un organoïde sans cytokines de différenciation microgliale supplémentaires. (B) IBA1 et TEME119 microglie positive ont été comptés dans deux organoïdes cultivés avec et un sans cytokines de différenciation microgliale supplémentaires. Le nombre de cellules IBA1 et TMEM119 positives changent en organoïdes représentatifs. Veuillez cliquer ici pour voir une version agrandie de cette figure.
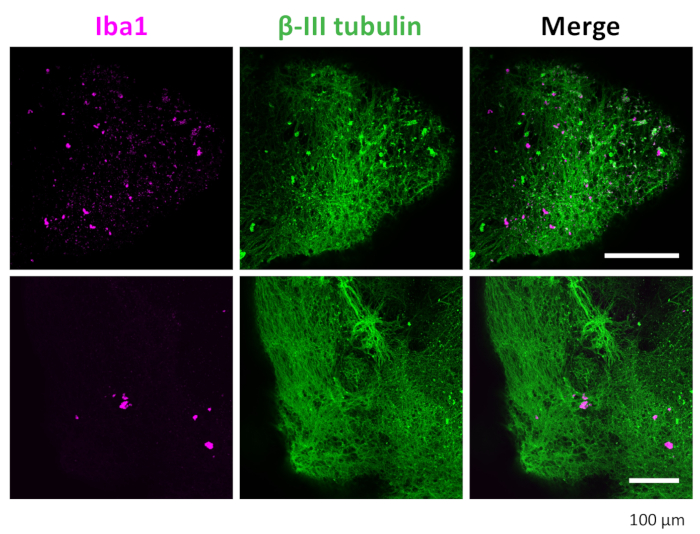
Figure 7 : Immunomarquage des neurones et de la microglie dans les organoïdes 3D. Après clairance et immunomarquage, l’organoïde a montré une microglie positive colorée à IBA1 et des neurones colorés à la βIII-tubuline. Des images représentatives prises au microscope confocal avec un objectif 20x sont présentées. Veuillez cliquer ici pour voir une version agrandie de cette figure.
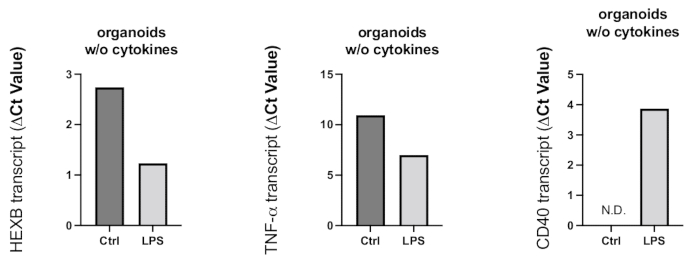
Figure 8 : Activation inflammatoire induite dans les organoïdes par le traitement LPS. Après 24 h de traitement par LPS, des organoïdes ont été prélevés et la RT-PCR a été utilisée pour déterminer l’activation microgliale et la réaction pro-inflammatoire. Étant donné que les valeurs Ct sont négativement liées aux niveaux d’expression génique, comme le montrent les graphiques représentatifs, le traitement par LPS a entraîné une augmentation de l’expression génique du marqueur d’activation microgliale HEXB et de la cytokine pro-inflammatoire TNF-α. Bien que l’expression du gène CD40 n’ait pas été détectée dans les organoïdes témoins, le traitement par LPS a permis d’obtenir des transcrits CD40 détectables. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Figure supplémentaire 1 : EB dans une plaque de culture de micropuits. (A) Des HPC et des iPSC mixtes ont été déposés dans les micropuits dans une plaque de culture de micropuits bien après centrifugation. (B) Les EB se sont formés après 24 h d’incubation dans la plaque de culture du micropuits lorsqu’ils ont été observés au microscope. (C) Des cellules CD34+ ont été observées dans les organoïdes en formation 8 jours après la formation de l’EB. Des images confocales ont été prises avec un objectif 20x. Veuillez cliquer ici pour télécharger cette figure.
Figure supplémentaire 2 : Les images confocales ont montré des cellules IBA-1 et TMEM-119 positives dans des organoïdes cultivés sans cytokines microgliales supplémentaires. Les images ont été prises à l’aide d’un microscope confocal avec zoom avant 20x et 2x pour montrer les morphologies des cellules. Veuillez cliquer ici pour télécharger cette figure.
Discussion
Ici, un protocole détaillé pour la fabrication d’organoïdes neuronaux 3D contenant des microglies innées à partir d’EB dérivées d’iPSC mixtes et de HPC différenciés par iPSC est présenté. Il s’agit d’une approche relativement courte et facile qui ne fait appel qu’à des techniques et à des équipements de culture cellulaire généralement disponibles dans la plupart des laboratoires.
Le facteur le plus critique pour le succès de ce protocole est la qualité de la différenciation HPC. Nous avons adopté la méthode publiée17 à l’aide d’un kit commercial pour différencier les HPC des iPSC avec quelques modifications. Par rapport au protocole original, nous commençons avec une taille plus petite et une gamme plus basse de colonies d’iPSC et collectons les HPC différenciés après 10 jours de différenciation au lieu de 12 jours. Cette approche ne génère que 1 à 2 millions de HPC par puits, mais reste plus que suffisante pour la prochaine étape de la production d’organoïdes 3D. Il est important de maintenir le bon équilibre entre ces cellules et les colonies d’iPSC, car un nombre excessif de cellules peut entraîner des cellules mortes/débris à la fin, entraînant un échec de la formation d’EB. Bien que les HPC puissent être collectés du 10e au 12e jour après l’induction, nous avons constaté que la collecte au 12e jour risquerait d’avoir plus de cellules mortes et d’impuretés, car la croissance rapide des HPC jusqu’à la fin de la culture pourrait facilement épuiser les facteurs nutritionnels et nécessiter une surveillance étroite et des changements de milieu supplémentaires. En collectant les HPC au jour 10, il n’est pas nécessaire de procéder à une purification HPC par cytométrie en flux ou à une purification par billes magnétiques, qui sont nécessaires pour enrichir la pureté inférieure des HPC.
Pour la sous-culture normale d’iPSC et la différenciation HPC, un tampon de dissociation EDTA a été utilisé, pour lequel l’effet est léger et ne dissocie que les colonies d’iPSC en petites plaques cellulaires, ce qui est bon pour la réattachement des iPSC après la séparation. Cependant, les plaques cellulaires peuvent interférer avec la formation d’EB. Ainsi, le traitement à l’accutase est utilisé pour dissocier les iPSC et obtenir une solution unicellulaire pour une formation plus uniforme de l’EB. Lors de la fabrication d’EB en dissociant les iPSC, il est important de ne pas surtraiter les iPSC avec de l’Accutase, ce qui peut entraîner une mort cellulaire excessive. Laisser les iPSC à température ambiante et en suspension pendant trop longtemps peut également entraîner une mort cellulaire massive et une différenciation abrogée. Ainsi, le processus des étapes 2.1 à 2.13 doit être terminé dès que possible afin d’éviter des retards inutiles.
Pour faciliter la différenciation et la maturation neuronales, plusieurs EB sont cultivés par puits. Ce réglage facilite la fusion des EB et diminue le temps nécessaire à la maturation des organoïdes. Cependant, il est difficile de contrôler le nombre exact d’EB pour la fusion et peut donc introduire des irrégularités dans les tailles et les formes des organoïdes résultants. L’irrégularité peut être minimisée en secouant les plaques de temps en temps ou, si possible, en utilisant un bioréacteur. Il est également possible de semer un seul EB dans les puits d’une plaque de 96 puits pour éviter complètement la fusion, mais il faudra plus d’efforts et de temps pour que les organoïdes poussent et mûrissent.
Contrairement à l’intégration individuelle d’organoïdes avec Matrigel dans l’approche la plus acceptée18, nous avons appliqué la goutte de Matrigel à bon escient sur le milieu à plusieurs reprises. Cette approche demande moins de main-d’œuvre, mais produit une grande qualité de différenciation neuronale dans les organoïdes. Le protocole décrit dans cette étude génère des neurones corticaux avec une microglie. Cependant, en ajustant les facteurs de croissance et les étapes de différenciation selon les techniques publiées19,20, il pourrait être facilement adapté pour produire des organoïdes représentant d’autres types neuronaux ou régions spécifiques du cerveau.
Des publications récentes ont incorporé des cellules microgliales différenciées par iPSC ou des cellules de type macrophage dans des organoïdes corticaux en développement pour fabriquer des organoïdes cérébraux contenant des microglies21. Comme les microglies adultes se développent à partir de HPC primitifs recrutés dans le cerveau au cours des premiers jours embryonnaires12, nous incorporons les HPC dans la formation de l’EB et avant l’induction neurale. Il est intéressant de constater que, sans appliquer les cytokines spécifiques à la différenciation microgliale, qui sont généralement utilisées pour produire la différenciation microgliale dans les organoïdes cérébraux22, nous observons toujours une différenciation microgliale décente au sein des organoïdes cérébraux résultants, bien que les cellules positives à TREM2 soient moins nombreuses, par rapport à celles cultivées avec des cytokines. Il suggère que l’inclusion des HPC dans la formation de l’EB et les interactions précoces assurées du processus de développement neuronal et des HPC pourraient suffire à différencier la microglie dans l’organoïde cérébral. Cela suggère également que notre protocole est précieux en tant que modèle pour étudier le développement microglial précoce dans le cerveau.
Comme nous l’avons vu, ce protocole produit des organoïdes imitant le développement précoce du cerveau humain. Bien que nous ayons cultivé des organoïdes jusqu’à 6 semaines sans remarquer de détérioration apparente basée sur les morphologies des organoïdes, et que certaines cultures aient atteint plus de 4 mois, une nécrose cellulaire a été trouvée dans les noyaux d’organoïdes depuis l’âge de 8 semaines. Ceci est également commun à d’autres types d’organoïdes cérébraux, car les cellules centrales des organoïdes en croissance éprouvent des difficultés à accéder à la nutrition. L’utilisation de bioréacteurs à agitation continue peut augmenter la viabilité et prolonger la durée de vie des organoïdes, permettant ainsi à des types de cellules plus matures de se différencier. Cependant, la culture à long terme entraînera presque certainement de plus grandes variabilités sans une certaine aide automatique à la culture. Ainsi, nous recommandons d’utiliser ce protocole pour étudier le développement précoce du cerveau lié aux microglies ainsi que les effets aigus des neuroinfections sur le développement du cerveau. Pour une modélisation cérébrale plus sophistiquée, nous suggérons aux chercheurs d’utiliser ce protocole comme base et d’appliquer des modifications pour augmenter la cohérence et faciliter les cultures à long terme.
En résumé, dans le protocole actuel, nous incorporons des HPC différenciés par iPSC dans la formation de l’EB et induisons davantage la différenciation neuronale. En moins d’un mois, ce protocole produira des organoïdes contenant à la fois des neurones et des microglies générés à partir des mêmes iPSC. Il fournit une alternative pratique pour fabriquer des organoïdes cérébraux avec des interactions précoces entre le développement neuronal et microglial, ce qui le rend utile pour étudier la physiologie du développement du cerveau humain et les maladies neuronales infectieuses et neuro-inflammatoires impliquant la microglie innée.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Cette étude est financée par les fonds de recherche intra-muros du NINDS.
matériels
| Name | Company | Catalog Number | Comments |
| 12 well cell culture plates | Corning | #3512 | |
| 24 well cell culture plate | SARSTEDT | #83.3922 | |
| Accutase | Thermo | A1110501 | |
| Aggrewell 400 plate | Stemcell technologies | #34411 | Referred to as microwell culture plate |
| Alexa Fluor 488 goat anti-mouse antibody | Life techniologies | A11001 | 1:400 dilution |
| Alexa Fluor 594 goat anti-rabbit antibody | Life techniologies | A11012 | 1:400 dilution |
| Allegra X-30R Centrifuge with rotor S6069 | Beckman Couler | ||
| Anti- Adherence Rinsing solution | Stem Cell Technologies | #07010 | |
| anti-CD34 antibody | Stem Cell Technologies | #60013 | 1:100 dilution |
| anti-Human CD43 antibody | Stem Cell Technologies | #60085 | 1:100 dilution |
| anti-IBA1 rabbbit antibody | Fujifilm | 019-19741 | 2.5 µg/mL |
| anti-TREM2 rat pAb | RD Systems | mab17291 | 2.5 µg/mL |
| Antibiotic-antimycotic | Gibco | 15240-062 | 1x |
| B27 supplement | Life technologies | 17504-044 | 1x |
| bFGF | Peprotech | 100-18B | 20 ng/mL |
| CD200 | Novoprotein | C311 | 100 ng/mL |
| CryoTube vials | Thermo | #368632 | |
| CX3CL1 | Peprotech | 300-31 | 100 ng/mL |
| DAPI | Sigma | D9542 | 1 µg/mL |
| DMEM/F12 | Life technologies | 12400-024 | 1x |
| DMSO | Sigma | D2650 | |
| DPBS | Gibco | #4190136 | 1x |
| E8 Flex medium kit | Thermo | A2858501 | |
| EDTA | Mediatech | 46-034-Cl | 0.5 mM |
| EGF | Peprotech | AF-100-15 | 20 ng/mL |
| EVOS FL Auto Microscope | Thermo | Fluorescence microscope | |
| FastStart Universal SYBR Green PCR master mix | Roche | #4913850001 | |
| Glutamax | Gibco | #35050079 | |
| Goat serum | Sigma | G9023 | 4% |
| IL-34 | Peprotech | 200-34 | 100 ng/mL |
| ImageXpress Micro Confocal | Molecular Devices | ||
| Knockout DMEM/F12 | Gibco | #10829018 | |
| M-CSF | Peprotech | 300-25 | 25 ng/mL |
| Matrigel | Corning | #354277 | Basement membrane matrix (BMM) |
| Mouse anti-βIII-tubulin antibody | Promega | G712A | 1:1000 dilution |
| Mr. Frosty container | Thermo | 5100-0001 | |
| N2 supplement | Life technologies | 17502-048 | 1x |
| Paraformadehyde | Sigma | P6148 | 4% |
| PSC Neural Induction Medium | Gibco | A1647801 | |
| Rock inhibitor Y27632 | Stemcell technologies | #72304 | 1 mM stock |
| RT LTS 1000 ul pipette tips | RAININ | #30389218 | for transferring organoids |
| STEMdiff Cerebral Organoid Kit | Stem Cell Technologies | #08570 | |
| STEMdiff Hematopoietic Kit | StemCell Technologies | #5310 | Referred to as hematopoietic Kit |
| StemPro Neural Supplement | Gibco | A1050801 | Referred to as neural supplement |
| TGF-β1 | Peprotech | 100-21 | 50 ng/mL |
| Total RNA Purification Plus Kit | Norgen | #48400 | |
| TritonX-100 | Sigma | T9284 | 0.10% |
| Visikol Histo-Starter Kit | Visikol | HSK-1 | Contains organoid clearing solution HISTO-M, washing buffer |
| Zeiss LSM 510-META Confocal Microscope | Zeiss |
Références
- Sabate-Soler, S., et al. Microglia integration into human midbrain organoids leads to increased neuronal maturation and functionality. Glia. 70 (7), 1267-1288 (2022).
- Lazarov, T., Juarez-Carreño, S., Cox, N., Geissmann, F. Physiology and diseases of tissue-resident macrophages. Nature. 618 (7966), 698-707 (2023).
- Wang, T., Liu, B., Zhang, W., Wilson, B., Hong, J. S. Andrographolide reduces inflammation-mediated dopaminergic neurodegeneration in mesencephalic neuron-glia cultures by inhibiting microglial activation. J Pharmacol Exp Ther. 308 (3), 975-983 (2004).
- Qian, L., Flood, P. M., Hong, J. S. Neuroinflammation is a key player in Parkinson's disease and a prime target for therapy. J Neural Transm (Vienna). 117 (8), 971-979 (2010).
- Clevers, H. Modeling development and disease with organoids. Cell. 165 (7), 1586-1597 (2016).
- Fakıoğlu, D. M., Altun, B. New therapeutic approaches in cystic fibrosis. Turk J Pharm Sci. 17 (6), 686-697 (2020).
- Mcmillan, R. E., Wang, E., Carlin, A. F., Coufal, N. G. Human microglial models to study host-virus interactions. Exp Neurol. 363, 114375(2023).
- Scopa, C., et al. Jun upregulation drives aberrant transposable element mobilization, associated innate immune response, and impaired neurogenesis in Alzheimer's disease. Nat Commun. 14 (1), 8021(2023).
- Tamaki, Y., et al. Spinal cord extracts of amyotrophic lateral sclerosis spread TDP-43 pathology in cerebral organoids. PLoS Genet. 19 (2), e1010606(2023).
- Chambers, S. M., et al. Highly efficient neural conversion of human es and IPS cells by dual inhibition of smad signaling. Nat Biotechnol. 27 (3), 275-280 (2009).
- Kim, S. H., Chang, M. Y. Application of human brain organoids-opportunities and challenges in modeling human brain development and neurodevelopmental diseases. Int J Mol Sci. 24 (15), 12528(2023).
- Ginhoux, F., et al. Fate mapping analysis reveals that adult microglia derive from primitive macrophages. Science. 330 (6005), 841-845 (2010).
- Ormel, P. R., et al. Microglia innately develop within cerebral organoids. Nat Commun. 9 (1), 4167(2018).
- Abdelmalek, C. M., et al. Building a growing genomic data repository for maternal and fetal health through the ping consortium. medRxiv. , (2024).
- Wei, Z., et al. Human IPSC-derived brain organoids: A 3D mini-brain model for studying HIV infection. Exp Neurol. 364, 114386(2023).
- Wang, T., et al. Regulation of stem cell function and neuronal differentiation by HERV-K via mTOR pathway. Proc Natl Acad Sci U S A. 117 (30), 17842-17853 (2020).
- Mcquade, A., et al. Development and validation of a simplified method to generate human microglia from pluripotent stem cells. Mol Neurodegener. 13 (1), 67(2018).
- Lancaster, M. A., Knoblich, J. A. Generation of cerebral organoids from human pluripotent stem cells. Nat Protoc. 9 (10), 2329-2340 (2014).
- Fiorenzano, A., et al. Single-cell transcriptomics captures features of human midbrain development and dopamine neuron diversity in brain organoids. Nat Commun. 12 (1), 7302(2021).
- Qian, X., et al. Brain-region-specific organoids using mini-bioreactors for modeling ZIKV exposure. Cell. 165 (5), 1238-1254 (2016).
- Park, D. S., et al. IPS-cell-derived microglia promote brain organoid maturation via cholesterol transfer. Nature. 623 (7986), 397-405 (2023).
- Schafer, S. T., et al. An in vivo neuroimmune organoid model to study human microglia phenotypes. Cell. 186 (10), 2111-2126.e20 (2023).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon
Nous utilisons des cookies afin d'améliorer votre expérience sur notre site web.
En continuant à utiliser notre site ou en cliquant sur le bouton ''continuer'', vous acceptez l'utilisation de cookies.