Method Article
İnsan Kaynaklı Pluripotent Kök Hücre Kaynaklı Kimerik Antijen Reseptörü İfade Eden Doğal Öldürücü Hücrelerdeki Gelişmeler
Bu Makalede
Özet
Burada, insan iPSC'den türetilmiş kimerik antijen reseptörü (CAR) eksprese eden doğal öldürücü hücreleri çeşitli malignitelere karşı daha iyi öldürme ile ayırt etmek ve genişletmek için bir yöntem sunuyoruz. Bu protokol, doğal öldürücü (NK) optimize edilmiş iPSC'den türetilmiş CAR-NK hücrelerinin farklılaşmasını ve genişlemesini ve çeşitli tümör hücre hatlarına karşı antitümör aktivitesinin ölçümünü gösterir.
Özet
Doğal öldürücü (NK) hücreler, vücudun tümörlere ve viral enfeksiyonlara karşı savunmasında çok önemli bir rol oynayan doğuştan gelen bağışıklık hücreleridir. NK hücrelerini eksprese eden insan kaynaklı pluripotent kök hücre (iPSC) türevi kimerik antijen reseptörünün (CAR) üretilmesi, "kullanıma hazır" kanser immünoterapisi için umut verici bir yol olarak ortaya çıkmıştır. Burada, NKG2D'nin transmembran alanını, 2B4 ko-stimülatör alanını ve sağlam antijene özgü NK hücre aracılı antitümör aktivitesini uyardığı gösterilen CD3ζ sinyal alanını içeren NK hücresi için optimize edilmiş bir CAR yapısı kullandık. CAR NK hücre üretimi için iPSC'lerin kullanımı, homojen CAR ekspresyonu, ölçeklenebilirlik, tekrarlanabilirlik ve klinik uygulama potansiyeli dahil olmak üzere çeşitli avantajlar sunar. Hücre mühendisliğinden farklılaşmaya kadar bu ayrıntılı adım adım protokol, NK hücresi için optimize edilmiş iPSC'den türetilmiş CAR eksprese eden NK hücrelerinin oluşturulmasını sağlayarak, gelişmiş antitümör aktivitesi ile standartlaştırılmış ve hedefe yönelik bir kanser immünoterapisi sağlar ve çeşitli maligniteler için umut verici bir tedavi seçeneği olarak potansiyellerini vurgular.
Giriş
Doğuştan gelen bağışıklık sistemi içindeki bir tür lenfosit olan NK hücreleri, tümörlere ve viral olarak enfekte olmuş hücrelere karşı erken savunmada çok önemlidir 1,2,3. T hücrelerinin aksine, NK hücreleri majör histouyumluluk kompleksi (MHC) molekülleri aracılığıyla antijen sunumuna ihtiyaç duymazlar. Bunun yerine, NK hücreleri, aktivitelerini düzenleyen aktive edici ve inhibitör reseptörlerden oluşan bir repertuara sahiptir3. NK hücre aracılı sitotoksik aktivite, perforin ve granzimlerin salınımı, ölüm reseptörlerinin katılımı ve IFN-γ ve TNF-α gibi pro-inflamatuar sitokinlerin üretimi dahil olmak üzere çeşitli mekanizmaları kullanır. Bu benzersiz etki şekli, NK hücrelerini, özellikle immün kaçırmanın önemli bir engel olduğu katı kanserlerin tedavisindekanser immünoterapisi için çekici bir aday olarak konumlandırır 1,2,3,4.
Hepatosellüler karsinom (HCC), dünya çapında karaciğer kanserinin en yaygın ve ölümcül formlarından biridir5. Cerrahi, kemoterapi ve radyoterapi dahil olmak üzere geleneksel terapötik yaklaşımlar tipik olarak sınırlı klinik fayda sağlar ve yüksek nüks oranlarına neden olur 6,7. İmmünoterapi ve hedefe yönelik tedavideki son gelişmeler HCC 8,9 tedavisini önemli ölçüde etkilemiştir. Nivolumab ve pembrolizumab gibi bağışıklık kontrol noktası inhibitörleri, kanser hücrelerine karşı bağışıklık hücresi tepkisini artırarak umut verici sonuçlar göstermiştir10,11. Bu tedaviler, bazı hastalar için sağkalım oranlarının artmasına ve daha iyi yaşam kalitesine yol açmıştır. Bununla birlikte, bazı hastalarda kullanımlarını sınırlayabilecek bağışıklıkla ilgili yan etkilere de neden olabilirler12. Sorafenib ve lenvatinib gibi hedefe yönelik tedaviler, özellikle kanser hücresi büyümesini ve anjiyogenezi destekleyen yolları inhibe eder13. Bu tedavilerin hastalığın ilerlemesini kontrol etmek ve sağkalımı uzatmak için etkinliği bilinmektedir 8,14. Bununla birlikte, hedefe yönelik tedavilere direnç tipik olarak gelişir ve tedavinin yan etkileri yaygındır15,16. Kanser immünoterapötik stratejilerinde umut verici yollar arasında, kimerik antijen reseptörü (CAR) CAR T hücrelerinin ortaya çıkışı, özellikle lenfoma ve multipl miyelom gibi hematolojik malignitelerin tedavisinde kanser tedavisinde devrim yaratmıştır 17,18,19.
NK hücrelerinin doğuştan gelen sitotoksik aktivitesini CAR teknolojisinin hassas hedeflemesi ile birleştiren CAR eksprese eden NK hücreleri, HCC 20,21,22,23,24 gibi katı tümörler için yenilikçi ve potansiyel olarak dönüştürücü bir yaklaşımı temsil eder. CAR tarafından tasarlanmış hücreler, normal dokuları korurken hedef antijeni eksprese eden tümör hücrelerini spesifik olarak tanıyabilir ve öldürebilir, böylece geleneksel tedavilerle ilişkili hedef dışı etki riskini azaltır 25,26,27. Periferik kan veya kordon kanından izole edilen NK hücrelerinden üretilen CAR-NK hücreleri tipik olarak, bir hücre dışı antijen tanıma alanı, bir transmembran alanı ve aktivasyon ve proliferasyon için gerekli hücre içi sinyal alanlarından oluşan CAR yapılarına sahip NK hücrelerinin dönüştürülmesiyle üretilir 28,29,30.
Klinik tedavi için fonksiyonel olarak tasarlanmış NK hücrelerinin stabil ve homojen bir popülasyonunu tasarlamanın zorluğu, indüklenmiş pluripotent kök hücreler (iPSC'ler) kullanılarak ele alınabilir31,32. NK hücresi için optimize edilmiş CAR'larla insan iPSC'lerinin mühendisliği, gelişmiş bir NK hücre aktivasyonu ve proliferasyon sinyali sağlar ve standartlaştırılmış, "kullanıma hazır bir tedavi" olarak tükenmez ve homojen bir CAR eksprese eden NK hücresi popülasyonu sağlar20,33. Bu protokolde, CAR eksprese eden iPSC'den türetilmiş NK hücreleri oluşturmak için iPSC'lerin genetik modifikasyonu, NK hücresinden türetilmiş transmembran ve sinyal alanlarını (NKG2D-2B4-CD3ζ) ve önceki çalışmalarımızda açıklandığı gibi bir anti-glipikan-3 (GPC3) scFv'yi içeren bir NK hücresi optimize edilmiş CAR yapısının entegre edilmesini içerir23. Genetik olarak tasarlanmış iPSC'ler daha sonra daha önce geliştirilen bir NK hücre farklılaştırma protokolü kullanılarak farklılaştırılır ve genişletilir34. Bu tasarlanmış CAR eksprese eden iPSC'den türetilmiş NK hücreleri, HCC ve diğer malignitelerde aşırı eksprese edilen Glypican 3 (GPC3) gibi spesifik tümörle ilişkili antijenleri eksprese eden HCC ve diğer tümör hücrelerini tanıma ve ortadan kaldırma yeteneğine sahiptir 35,36,37,38.
Çeşitli kanserlerin tedavisi için iPSC'den türetilmiş CAR-NK hücrelerinin uygulanması önemli bir umut vaat etmektedir 30,39,40; bu iPSC'den türetilen CAR-NK hücrelerinin çoğu şu anda klinik deneylerdedir 41,42,43. Bu alandaki ilerlemeyi kolaylaştırmak için bu protokol, hücre mühendisliğinden olgun NK hücrelerine farklılaşmaya ve in vitro genişlemeye kadar tasarlanmış iPSC'den türetilmiş CAR-NK hücrelerinin verimli bir şekilde üretilmesini sağlar.
Protokol
1. İnsan iPSC'lerinin besleyicisiz kültür yöntemi
NOT: Donmuş farklılaşmamış insan iPSC'lerini çözün ve daha önce tarif edildiği gibi Matrigel (bundan böyle bazal membran matrisi [BMM] olarak anılacaktır) önceden kaplanmış plakalar üzerinde mTeSR 1-plus kullanarak kültürleyin23,34. iPSC'lerin mühendislikten önce ve sonra farklılaşmadığından emin olmak çok önemlidir. Taze çözülmüş iPSC'ler, insan pluripotent kök hücreleri ile tutarlı pluripotens morfolojisi sergilemek için yaklaşık 2-3 pasaj boyunca kültürlenmelidir. Aşağıdaki talimatlar, hücreleri 6 oyuklu bir plakanın bir oyuğundan geçirmek için kullanılır.
- iPSC'leri geçmeden önce, yeni 6 oyuklu plakayı 1x BMM (1 mL/kuyu) ile kaplayın ve kullanmadan önce 37 °C'lik bir inkübatörde 2-4 saat inkübe edin.
- 1x çözündürülmüş BMM'yi hazırlayın.
- 5 mL'lik bir BMM stok şişesini gece boyunca 4 ° C'de çözdürün.
- Önceden soğutulmuş uçları kullanarak BMM'yi önceden soğutulmuş mikrosantrifüj tüplerine hızlı bir şekilde alikot edin.
- -80 °C'de 6 aya kadar saklayın.
- 1x BMM çalışma çözümü hazırlamak için, bir BMM alikotunu 1:100 oranında soğuk bir DMEM/F12 ortamına yeniden süspanse edin. 1x BMM çalışma çözümü -4 °C'de 2 hafta saklanabilir.
- Plakayı, yüzeyi kaplamak için yeterli hacimle kaplayın (örneğin, 6 oyuklu plakanın oyuğu başına 1 mL kullanın).
- Kullanmadan önce 37 °C inkübatörde 2-4 saat inkübe edin.
- Dondurulmuş iPSC'lerden oluşan bir şişeyi (tipik olarak 1 × 106 hücre/şişe) 37 ° C'de bir su banyosunda çözdürün.
- Çözülmüş iPSC'leri, 5 mL önceden ısıtılmış mTeSR Plus ortamı içeren 15 mL'lik bir konik tüpe kademeli olarak ekleyin, böylece hücrelerin hücresel şoku en aza indirmek için damla damla ekleyerek alışmasına izin verin.
- Hücreleri 300 × g'da 5 dakika santrifüjleyin.
- Süpernatanı aspire edin ve hücreleri bir kez 5 mL PBS ile yıkayın.
- Hücreleri mTeSR Plus ortamında yeniden süspanse edin ve BMM önceden kaplanmış 6 oyuklu plakada yaklaşık 200.000 hücre / 3 mL / kuyu yoğunluğunda plakalayın.
- Geçiş iPSC'leri.
- iPSC'ler %70-80 birleşmeye ulaştığında, ortamı aspire edin ve 37 ° C'de 5 dakika boyunca TrypLE ile tek hücreli geçiş gerçekleştirin (6 oyuklu plakada 1 mL / kuyu).
- 5 dakika sonra, ayrışma reaksiyonunu durdurmak için 3 mL 1x PBS ekleyin ve hücreleri bir kez 3 mL PBS ile yıkayın.
- Hücreleri 300 × g'da 5 dakika santrifüjleyin. Yıkadıktan sonra, tek hücreli iPSC'leri mTeSR Plus ortamında yeniden süspanse edin, ardından BMM önceden kaplanmış 6 oyuklu plaka üzerine plakalayın.
NOT: Gerekli toplam ortam hacmi, 6 oyuklu bir plakada 3 mL/kuyucuktur. Ortamın her 2-3 günde bir değiştirilmesi gerekir ve iPSC'leri tasarlamadan önce hücreler en az 1-2 geçiş boyunca %70-80 oranında birleştiğinde adım 1.8 tekrarlanmalıdır.
- iPSC'lerin pluripotentliğini düzenli olarak kontrol edin. iPSC'leri Allofikosiyanin (APC) konjuge TRA-1-81 ve PE-Cy7 konjuge evreye özgü embriyonik antijen-4 (SSEA-4) antikoru ile buz üzerinde 30 dakika boyunca boyayın, daha sonra daha önce tarif edildiği gibi akış sitometrisi kullanarak analiz edin23,41.
NOT: Bu deneyde kullanılan iPSC'ler TrypLE'ye uyarlanmıştır. Daha önce TrypLE ile geçilmemiş iPSC'ler, TrypLE'ye tam olarak adapte olmak için tipik olarak 8-10 geçiş gerektirir, bu da yüksek kaliteli spin embriyoid cisimciklerinin (EB'ler) üretimini sağlar.
2. PiggyBac vektörü kullanarak anti-GPC3 CAR'ı ifade etmek için insan iPSC'lerinin mühendisliği
- Yeni bir 6 oyuklu plakayı BMM ile kaplayın ve en az 1 saat boyunca 37 ° C'de inkübe edin (sıvı kurumadığı sürece daha uzun olabilir).
- 10 μM Rho ile ilişkili, protein kinaz (ROCK) İnhibitörü (Y-27632) (steril damıtılmış suda hazırlanan 1 mM stoktan) içeren mTeSR Plus'ı 37 °C'de önceden ısıtın.
- Nükleofeksiyon sistemini açın. X birimini seçin, ardından transfekte edilecek kuyuların konumlarını seçin. P3 çözümünü seçin ve kodu manuel olarak girin (CA-137).
- iPSC'leri 1 mL TrypLE ile %70-80 birleştiğinde hasat edin ve 37 ° C'de 5 dakika inkübe edin. Ayrışmayı doğrulamak için mikroskop altında kontrol edin.
- Tek hücreli bir süspansiyon elde etmek için 4-6 kez pipetleyin, ardından 5 mL PBS ile nötralize edin ve 5 dakika boyunca 300 × g'da pelet haline getirin.
- Tüm TrypLE izlerini gidermek için hücreleri bir kez daha nazikçe yıkayın.
- Kaya İnhibitörü ile 1 mL mTeSR Plus'ta tekrar süspanse edin ve hücreleri sayın.
- Anti-GPC3 CAR iPSC'ler oluşturmak için, bir mikrosantrifüj tüpünde transfeksiyon başına 1 × 106 hücre kullanın ve 5 dakika boyunca 300 × g'da döndürün.
- Eğirme sırasında, CAR eksprese eden transpozon DNA'sını süper PiggyBac transpozaz ekspresyon vektörü ile 1.5 mL'lik bir mikrosantrifüj tüpünde 3: 1 oranında birleştirin (ör., transpozonu içeren 3 μg plazmit, 1 μg transpozaz plazmidi).
- 0.5 μL 1 mg / mL çözelti kullanan bir yeşil floresan proteini (GFP) pozitif kontrolü (Malzeme Tablosu) ve GFP ekspresyonunu doğrulamak için transfekte edilmemiş bir negatif kontrol ekleyin.
- Hücre peletini, nükleofeksiyon kitinde sağlanan takviye ile 20 μL oda sıcaklığında (RT) P3 Nükleofektör çözeltisinde dikkatlice yeniden süspanse edin. Daha sonra, bu karışımı plazmit DNA içeren 1.5 mL'lik bir mikrosantrifüj tüpüne ekleyin ve yaklaşık 22-25 μL'lik bir nihai hacim elde edin.
NOT: Hücrelere GPC3 CAR plazmitleri veya GFP kontrol plazmiti eklemeden önce P3 Nükleofektör çözeltisinde transfekte edilecek tüm iPSC'leri yeniden askıya alın. - Hücre / DNA süspansiyonunu 20 μL'lik 16 oyuklu şeritlere aktarın. Numunenin küvetin altını kabarcık olmadan kapladığından emin olun.
- Hava kabarcıklarını gidermek ve alttaki hücreleri yerleştirmek için tezgahın üstündeki 16 oyuklu şeritlere hafifçe vurun.
- iPSC'leri ve CAR DNA karışımını içeren 16 oyuklu şeritleri Nükleofeksiyon sistemine yerleştirin, CA-137, P3 çözeltisini seçin ve ardından programı başlatın. Bu program 1 saniye içinde sona erecek ve yeşil bir onay işareti gösterecektir.
- Kuyuya 80 μL önceden ısıtılmış mTeSR Plus ROCK-İnhibitör ortamı ekleyin ve hücreleri dikkatlice BMM ile kaplanmış 6 oyuklu plakaya aktarın (son hacim kuyucuk başına 1 mL).
- Transfeksiyonun başarı oranını doğrulamak için herhangi bir GFP ekspresyonu için 4 saat sonra floresan mikroskobu altında hücreleri kısaca kontrol edin.
- GFP ekspresyonunu doğrulamak için akış sitometrisi 23,41 kullanarak transfeksiyondan 24 saat sonra transfeksiyon verimliliğini değerlendirmek için GFP ekspresyonu için iPSC'leri tarayın.
- 37 ° C'de 4 gün boyunca inkübe edin, ilaç seçimine geçmeden önce ortamı gerektiği gibi değiştirin.
NOT: Her nükleofeksiyon, reaksiyon başına 0.2-2 x 106 iPSC gerektirir. Reaksiyon sayısına bağlı olarak, 24 oyuklu plakalar veya 6 oyuklu plakalar kullanılabilir.
3. GPC3-CAR iPSC'lerin klonal seçimi ve pluripotentlik doğrulaması
- GPC3-CAR ifade eden iPSC'leri klonal olarak seçmek için transfekte edilmiş iPSC'ler üzerinde bir dizi zeosin seçimi (1:10.000) gerçekleştirin.
- Transfeksiyon verimliliğini doğrulamak için, bir floresan mikroskobu ve akış sitometrisi23,41 kullanarak GFP ekspresyonunu ölçün.
NOT: CAR yapısı, hem iPSC aşamasında hem de NK hücre farklılaşmasını takiben CAR ekspresyonunu değerlendirmek amacıyla bir FLAG etiketi44,45 ile birleştirilmiştir. - Transfekte edilmiş CAR iPSC'leri, optimal CAR geni ve GFP ekspresyonu elde edene kadar ilaç seçimi altında tutun.
- Homojen GFP ve CAR ekspresyonunu sağlamak için ilaç seçim süresini 2-3 hafta uzatın.
- Klonal olarak seçilmiş iPSC'lerin homojen bir popülasyonunu elde etmek için akış sitometrisi kullanarak GFP veya CAR ekspresyonuna dayalı hücre sıralaması yapın23.
- Burada kullanılan CAR yapısı, bir zeosin ilaç seçim markörü içerir. Kültür ortamına zeosin (50 μg/mL zeosin) ekleyerek GPC3 CAR geni transfekte edilmiş hücreleri seçin.
- Zeosin seçiminden sonra, GPC3 CAR geni transfekte edilmiş iPSC'leri seyreltin ve kuyucuk başına yaklaşık bir hücre elde etmek için bunları 96 oyuklu bir plakaya yerleştirin. Bu, seri seyreltme yoluyla veya bir hücre sıralayıcı kullanılarak yapılabilir.
NOT: CAR yapısına bağlı bir floresan işaretleyicinin ifadesine dayalı olarak tek transfekte edilmiş hücreleri izole etmek için floresanla etkinleştirilen hücre sıralamasını (FACS) kullanın. - Tek hücrelerin 96 oyuklu plakada koloniler halinde genişlemesine izin verin.
- Hücreleri her 3-4 günde bir taze kültür ortamı ile besleyin ve koloni büyümesi için kuyuları izleyin.
- CAR ifadesi için kolonileri tarayın. Bu, polimeraz zincir reaksiyonu (PCR), kantitatif polimeraz zincir reaksiyonu (qPCR) veya CAR yapısının23,47 varlığını doğrulamak için Western blotlama ile yapılabilir.
- Alternatif olarak, CAR proteininin yüzey ekspresyonunu tespit etmek için akış sitometrisi 23,41'i kullanın.
NOT: Bu çalışmada, CAR ifadesi, akış sitometrisi kullanılarak FLAG etiket ifadesi ile ölçülmüştür. - Ek olarak, herhangi bir kromozomal anormalliği tanımlamak için karyotipleme yapın.
NOT: Bu, Wicell (wicell.org) veya Thermo Fisher Scientific (thermofisher.com) gibi üçüncü taraf kuruluşlar tarafından yapılabilir. - CAR-pozitif klonlar herhangi bir anormallik olmadan tanımlandıktan sonra, bu klonları 6 kuyulu plaka ve T75 şişesi gibi daha büyük kültür kaplarında genişletin.
- Gelecekte kullanmak üzere birden fazla şişede bir kriyoprezervasyon ortamı kullanarak klonal olarak genişletilmiş CAR iPSC'leri kriyoprezervasyon yapın.
NOT: Bu adımda aşağıdaki noktalar önerilir: (i) Farklılaşmayı önlemek için iPSC'ler için en uygun kültür koşullarını koruyun. (ii) İlaç seçiminden sonra iPSC'lerde homojen bir CAR ve GFP ekspresyonu popülasyonu elde etmek için 1-4 hafta bekleyin. (iii) CAR ekspresyonunun ve pluripotens belirteçlerinin stabilitesi için hücreleri izlemeye devam edin. (iv) Tarama ve doğrulama adımları sırasında uygun kontrolleri kullanın. (v) Klonal seçim ve genişletmeden sonra, CAR eksprese eden iPSC'lerde TRA-1-81 ve SSEA-4 ekspresyonunu değerlendirerek pluripotensi doğrulayın.
4. Spin embriyoid cisimciği (EB) Oluşumu ile tasarlanmış CAR iPSC'lerden hematopoietik progenitör hücrelerin üretilmesi
NOT: Hematopoietik progenitörleri üretmek için bir spin EB veya hematopoietik organoid protokolü kullanılır23,34. EB'ler içindeki hücreler, lenfosit gelişimini desteklemek için stromal hücrelere farklılaşır38, böylece OP9 23,34,48 gibi kseno türevli stromal hücrelere olan ihtiyacı ortadan kaldırır. Aşağıda, EB oluşumu için 6 oyuklu bir plakanın tek bir kuyusundan hücre toplama talimatları verilmiştir.
- Spin EB oluşumundan 2 gün önce ~ 200.000 hücre / kuyu 6 oyuklu BMM önceden kaplanmış plakanın geçişi. Spin EB'lerin kurulduğu gün %70-80 birleşmeye ulaştığından emin olun. Genel olarak, 6 oyuklu bir plakanın 1 oyuğu, iki spin EB plakası için yeterlidir.
- Kültür ortamını çıkarın ve 1 mL önceden ısıtılmış TrypLE Select ile 37 °C'de 5 dakika inkübe ederek hücreleri ayırın.
- Hücre agregalarını 1 mL'lik bir mikropipet kullanarak dikkatlice tek bir hücre süspansiyonuna ayırın ve hücreleri 15 mL'lik bir konik tüpe aktarın. Ayrışma reaksiyonunu durdurmak için 3 mL 1x PBS ekleyin ve hücreleri bir kez 3 mL PBS ile yıkayın.
- Hücreleri mTesR Plus ortamında yeniden süspanse edin ve agregaları çıkarmak için 70 μM'lik bir hücre süzgecinden süzün.
- Süpernatanı çıkarmak için hücreleri aşağı doğru döndürün ve hücreleri bir kez daha 5 mL PBS ile yıkayın. Daha sonra hücreleri 1 mL STEMdiff APEL ortamında (EB oluşum ortamı) yeniden süspanse edin.
- Aşağıdaki sitokinleri (SCF: 40 ng / mL, BMP4: 20 ng / mL, VEGF: 20 ng / mL) ve 10 μM ROCK inhibitörü içeren EB oluşum ortamını kullanarak hücreleri uygun yoğunluğa kadar sayın ve seyreltin.
- 96 oyuklu plakalarda 100 μL ortamda (100.000 hücre / mL) 3000-10000 hücre / kuyu tohumlayın.
NOT: EB oluşumunda kullanılan hücre sayısı iPSC hattına bağlı olarak değişebilir. 96 oyuklu plakalarda kuyu başına 3.000 ila 10.000 hücrenin test edilmesi önerilir. - Çok kanallı bir pipet kullanarak, hücre süspansiyonunu 100 μL/oyukta 96 oyuklu plakalara yükleyin.
NOT: Daha iyi embriyoid cisimcikleri (EB'ler) oluşumu için, ultra düşük bağlantılı yuvarlak tabanlı 96 oyuklu plakaların kullanılması önerilir. - 96 oyuklu plakayı 300 × g'da 5 dakika santrifüjleyin, ardından plakaları 37 °C'de %5CO2 ile 6 gün inkübe edin.
NOT: Ön çalışmalar, bu çalışmada CAR iPSC hatları için% >30 CD34 + hücrelerinin oluşması için 6 günün yeterli olduğunu bulmuştur. - Akış sitometrisi23,41 ile EB kalitesini kontrol edin.
- EB'leri ayırmak için 4 mL önceden ısıtılmış %0.25 tripsin ve %0.4 tavuk serumu (4 mL tripsin için 16 μL) hazırlayın.
- 10-30 EB'yi 15 mL'lik bir konik tüpe aktarın.
- Tripsin / tavuk serum çözeltisini EB'lere ekleyin ve EB'lerin tamamen ayrışmasını sağlamak için her 30 saniyede bir girdap yaparak 10 dakika boyunca bir su banyosunda inkübe edin.
- Tripsinizli EB'leri pipetleyin. EBS'yi tamamen ayırmak için birkaç kez yukarı ve aşağı karıştırın.
- Tripsinizasyon işlemini durdurmak için 5 mL 1x PBS ekleyin.
- Hücre çözeltisini yeni bir konik tüpte 70 μm'lik bir hücre süzgecinden süzün.
- Hücreleri 5 dakika boyunca 300 x g'da santrifüjleyin.
- Süpernatanı aspire edin ve 3-5 mL taze ortamda yeniden süspanse edin.
- Hücreleri sayın, CD34, CD31, CD43 ve CD45 gibi tipik EB belirteçleri ile boyayın ve akış sitometrisi23,41 kullanarak analiz edin (Şekil 3).
- 100 μL akış tamponunda ayrışmış tek EB hücreleri içeren her tüpe üretici talimatlarına göre önerilen antikor hacmini ekleyin ve 30 dakika39,41 buz üzerinde inkübe edin.
- İnkübasyondan sonra, hücreleri akış tamponu ile iki kez yıkayın, SYTOX mavi canlı / ölü leke ekleyin ve akış sitometrisi kullanarak analiz edin.
NOT: Tipik olarak,% >30 CD34 + hücreleri, bu çalışmada kullanılan iPSC'ler kullanılarak 6. günde ayrışmış Spin embriyoid cisimlerinin toplam popülasyonundan elde edilir, ancak bu yüzde iPSC kaynağına ve kültür koşullarına bağlı olarak değişebilir.
5. GPC3 CAR iPSC türevi NK hücrelerinin Spin EB'lerden farklılaşması
NOT: GPC3 CAR eksprese eden Spin EB'ler, 24 oyuklu plakalara veya %2 jelatin ile kaplanmış veya kaplamasız 6 oyuklu plakalara aktarılabilir. Orta değişiklikler için 6 oyuklu plakalar daha uygundur, %2 jelatin kaplama ise EB'lerin bağlanmasını artırır.
- Aşağıdaki adımları izleyerek jelatin kaplı 6 oyuklu plakaları hazırlayın.
- Jelatini doku kültürü dereceli suda çözerek %2 (a/a) jelatin çözeltisi hazırlayın.
- Solüsyonu 121 °C, 15 psi'de 30 dakika otoklavlayarak sterilize edin.
- Her bir oyuğun yüzeyinicm2 başına 5-10 μL jelatin çözeltisi ile kaplayın (6 oyuklu bir plakanın oyuğu başına ~ 1 mL).
- Kullanmadan önce plakaları 37 °C'de 2-4 saat inkübe edin. İnkübasyondan sonra, EB transferine devam etmeden önce kalan jelatin çözeltisini aspire edin.
- NK hücre farklılaşma ortamını hazırlayın:% 56.6 DMEM + GlutaMAX-I,% 28.3 F12 + GlutaMAX-I,% 15 ısıyla inaktive edilmiş insan AB serumu,% 1 P / S, 2 mM L-glutamin, 1 μM β-merkaptoetanol, 5 ng / mL sodyum selenit, 50 μM etanolamin ve 20 mg / L askorbik asit. Karanlıkta 4 °C'de saklayın.
- Jelatin kaplı 6 oyuklu plakaların her bir oyuğuna aşağıdaki sitokinleri içeren 3 mL NK farklılaşma ortamı ekleyin (IL-3: 5 ng/mL, SCF: 20 ng/mL, IL-7: 20 ng/mL ve IL-15: 10 ng/mL).
- 6. günde, aşağıdaki adımları izleyerek Spin EB'leri doğrudan NK farklılaşma ortamı içeren hazırlanmış jelatin kaplı 6 oyuklu plakalara aktarın.
- Ortamın çoğunu çıkarmak için 10 mL'lik bir serolojik pipet kullanarak EB'leri 96 oyuklu plakalardan 10 cm'lik bir tabağa dikkatlice aktarın.
- Jelatin kaplı 6 oyuklu plakanın her bir oyuğuna yukarıdaki sitokinleri içeren 3 mL NK farklılaşma ortamı ekleyin.
- 1 mL'lik bir mikropipet kullanarak 6 oyuklu plakanın her bir oyuğuna 16-20 EB dağıtın.
NOT: Ortalama olarak, tek bir 96 oyuklu plakadan elde edilen EB'ler, NK farklılaşma plakası için bir 6 oyuklu plakayı tohumlamak için kullanılabilir.
- Her 5-7 günde bir orta değişiklikler yapın. NK hücre farklılaşmasının ilk haftasından sonra, IL-3'ü ortamdan çıkarın.
NOT: 14 gün sonra, ortamın her 3-4 günde bir değiştirilmesi gerekir. - 3-4 hafta boyunca orta değişikliklere devam edin. Süspansiyon hücreleri üzerinde akış sitometrisi24,42 ile NK hücre belirteçlerinin (CD45 + CD56 +) ekspresyonunu değerlendirin.
- Süspansiyon hücrelerinin %>80'i CD45 + CD56 + eksprese ettiğinde, kümeleri gidermek için hücreleri 70 μm'lik bir filtreden geçirerek hasat edin.
- 100 gri ışınlanmış aAPC34,48 ile ko-kültür hasat edilmiş NK hücreleri ve IL-2 (100ng/mL) ve IL-15 (10 ng/mL) içeren NK genleşme ortamında kültür.
6. Anti-GPC3 CAR iPSC'den türetilmiş NK hücrelerinin genişletilmesi
NOT: Tipik olarak, genişlemeden önce bile tek bir 6 oyuklu plakadan 2-20 × 106 NK hücre verimi elde edilebilir. Aşağı akış uygulamaları için NK hücrelerinin daha fazla genişlemesini kolaylaştırmak için, >1 × 109 NK hücreleri oluşturmak için yapay antijen sunan hücreler (aAPC'ler) kullanılır.
- NK hücre genişlemesini indüklemek için aAPC'ler olarak 41BBL ve membrana bağlı IL-21 (41BBL-mbIL-21)48 eksprese eden tasarlanmış K562 hücrelerini kullanın.
- aAPC'leri NK hücreleri ile birlikte kültürlemeden önce, aAPC'leri 100 gri ile ışınlayın ve bunları donmuş stoklar olarak koruyun.
- Süspansiyon hücrelerini 6 oyuklu plakadan hasat edin ve NK hücrelerini, 5 × 105 hücre / mL yoğunlukta 50 U / mL IL-2 ve IL-15 (10 ng / mL; taze eklenecek) ile desteklenmiş NK genleşme ortamında kültürleyin.
- Çözülmüş ışınlanmış aAPC'leri NK hücrelerine 1: 1 oranında ekleyin.
- Kültür ortamını her 3-4 günde bir yenileyin, sırasıyla 50 U / mL ve 10 ng / mL konsantrasyonda taze IL-2 ve IL-15 ekleyin.
- CAR iPSC'den türetilen NK hücrelerinin, hem hücre canlılığını hem de sitolitik aktiviteyi koruyarak >3 aylık bir süre boyunca genişleme kapasitesini koruduğundan emin olun.
7. GPC3 CAR iPSC'den türetilen NK hücrelerinin fenotipik ve fonksiyonel karakterizasyonu
NOT: GPC3 CAR iPSC'den türetilen NK hücrelerinin karakterizasyonu, fenotipik profillerinin ve fonksiyonel aktivitelerinin kapsamlı bir değerlendirmesini içerir.
- CD45, CD56, CD94, CD16, NKp30, NKp44, NKp46, NKG2D, DNAM, TRAIL ve FasL dahil olmak üzere NK aktivasyon reseptörlerini, anti-GPC3 CAR iPSC'den türetilen NK hücreleri üzerindeki ekspresyonunu akış sitometrisi24,42 yoluyla değerlendirin CAR NK hücre aktivitesini ve olgunlaşma durumunu belirlemek için (Şekil 4).
- Çeşitli tümör hedeflerine karşı akış sitometrisi tabanlı Kaspaz-3/7 testleri, CD107a granül salım testleri, IFN-γ ve TNF-α sitokin salınım testleri kullanarak GPC3 CAR iPSC'den türetilmiş NK hücrelerinin in vitro fonksiyonel aktivitesini değerlendirin.
- Caspase3/7 testi için aşağıdaki adımları izleyin.
- Hedef hücreleri sayın ve 37 ° C'de 15 dakika boyunca PBS'de 5 μM'lik bir son konsantrasyonda hücre izleme floresan boyası ile önceden boyayın.
- 37 ° C'de çeşitli efektör-hedef (E: T) oranlarında CAR iPSC'den türetilmiş NK hücreleri ile ko-kültürden önce lekeli hedef hücreleri tam bir kültür ortamında yıkayın.
- 3 saat ve 30 dakikalık ko-kültürden sonra, 30 dakikalık başka bir inkübasyon için Caspase-3/7 yeşil tespit reaktifi ekleyin, bu da toplam 4 saatlik bir inkübasyon süresi ile sonuçlanır.
- Boyamanın son 5 dakikasında 1 μL ölü hücre boyama solüsyonu ekleyin ve hafifçe karıştırın.
- Lekeli hücreleri akış sitometrisi23,41 kullanarak analiz edin (Şekil 5).
- GPC3 CAR iPSC'den türetilen NK hücrelerinin fenotipik özelliklerinin ve fonksiyonel aktivitesinin kapsamlı bir şekilde anlaşılmasını sağlamak için bu protokolü uygulayın ve terapötik potansiyellerinin sağlam bir şekilde değerlendirilmesini sağlayın.
NOT: GPC3 CAR iPSC hatları kullanılarak spin EB tabanlı GPC3 CAR iPSC'den türetilmiş NK hücre farklılaşması ve NK genişleme koşullarından %>90 CD45 + CD56+ hücrelerinin elde edilmesi tipik olarak 4-5 hafta sürer. Bazı iPSC hücre hatları sadece 3 hafta gerektirebilir ve bazı hatlar daha uzun sürebilir (yaklaşık 4-5 hafta).
8. Sorun giderme öğeleri ve çözümleri
NOT: Spin embriyoid cisimciği (EB) yöntemi kullanılarak iPSC'den türetilmiş GPC3 CAR NK hücrelerinin farklılaşması, genişlemesi ve fonksiyonel testinde sorun giderme birkaç adım içerebilir. Aşağıda, önerilen çözümlerle birlikte karşılaşılabilecek bazı yaygın sorunlar yer almaktadır:
- Tutarsız EB oluşumunun belirtileri
- EB'lerin düzensiz şekillere sahip çok küçük veya çok büyük olup olmadığını kontrol edin.
- Tutarsız EB oluşumu için çözüm
- EB'leri oluşturmak için kullanılan santrifüj hızını ve süresini ayarlayın. 5-10 dakika boyunca yaklaşık 200-300 × g hız tipiktir.
- EB oluşumunu kolaylaştırmak için uygun U-tabanlı plakaların veya ultra düşük bağlantılı kültür kaplarının kullanıldığından emin olun.
- iPSC'lerin homojen olduğunu ve EB oluşumunu etkileyebilecek farklılaşmış hücrelerden arınmış olduğunu onaylayın.
- iPSC'lerin NK hücrelerine zayıf farklılaşmasının belirtileri
- NK hücre belirteçlerinin düşük ekspresyonunu kontrol edin (ör., CD56, NKp46).
- EB'lerin oluşturulamadığını veya kötü biçimlendirilmiş EB'leri kontrol edin.
- iPSC'lerin NK hücrelerine zayıf farklılaşması için çözüm
- Temel büyüme faktörlerinin konsantrasyonlarının (ör., VEGF, BMP4, Y-27632, FLT3, IL-15, IL-7, SCF ve IL-3) EB oluşumu ve NK hücre farklılaşması için optimal olduğundan emin olun. Konsantrasyonları önceki çalışmalara göre ayarlayın 23,34,41.
- iPSC'lerin ilk tohumlama yoğunluğunun uygun olduğundan emin olun. Tipik olarak, spin EB oluşumu için 8000-10.000 hücre / 100 μL'lik bir yoğunluk önerilir.
- Gerekli takviyeler (örn., serum veya serumsuz alternatifler, diğer sitokinler) dahil olmak üzere farklılaşma ortamının doğru şekilde formüle edildiğini doğrulayın.
- NK hücre farklılaşma ortamına geçmeden önce EB oluşumu için en az 6 gün ila 12 güne kadar yeterli zaman tanıyın.
- NK hücrelerinin zayıf genişleme belirtileri
- Genişleme sırasında sınırlı hücre verimini kontrol edin.
- Genişletilmiş NK hücrelerinin canlılığının azalıp azalmadığını kontrol edin.
- NK hücrelerinin zayıf genleşmesi için çözümler
- Genleşme aşaması sırasında IL-15 ve IL-2 konsantrasyonunu arttırın. Bu, NK hücre proliferasyonunu önemli ölçüde artırabilir.
- NK hücresinin hayatta kalmasını ve genişlemesini iyileştirmek için ışınlanmış aAPC'ler gibi besleyici hücreleri kullanmayı düşünün.
- Hücre yoğunluğunu düzenli olarak izleyin ve optimum büyüme koşullarını sürdürmek için hücreleri aşırı kalabalığa ulaşmadan önce geçirin.
- Optimal olmayan fonksiyonel test sonuçlarının belirtileri
- Hedef hücrelere karşı azaltılmış sitotoksisite olup olmadığını kontrol edin.
- Düşük sitokin sekresyon seviyelerini kontrol edin (ör., IFN-γ, TNF-α).
- Optimal olmayan fonksiyonel test sonuçları için çözümler
- Sitotoksisite deneylerinde hedef-efektör oranını optimize edin. 10:1 oranıyla başlayın ve sonuçlara göre ayarlayın.
- Fonksiyonel tahlillerden önce NK hücrelerinin yeterince aktive edildiğinden emin olun. Bu, sitokinlerle ön stimülasyonu veya ışınlanmış aAPC'lerle birlikte kültürlemeyi içerebilir.
- Hedef hücre hattının NK hücre aracılı lizise duyarlılığını doğrulayın. Bilinen hassas hedefleri denetim olarak kullanın.
- NK hücre aktivitesinin ortaya çıkması için yeterli zamana izin vermek için fonksiyonel tahlillerin süresini uzatın.
- Değişken CAR ekspresyon seviyelerinin belirtileri
- NK hücreleri arasında tutarsız CAR ifadesi olup olmadığını kontrol edin.
- Değişken CAR ifade seviyeleri için çözümler
- CAR transfeksiyon yönteminin verimliliğini doğrulayın (örn., viral transdüksiyon, elektroporasyon). Gerekirse MOI'yi (enfeksiyon çokluğu) veya elektroporasyon koşullarını ayarlayın.
- CAR+ NK hücrelerini zenginleştirmek için uygun seçim işaretleyicilerini uygulayın. Gerektiği gibi antibiyotik seçimi veya floresan işaretleyici sıralaması kullanın.
Sonuçlar
Anti-GPC3-CAR iPSC'den türetilen NK hücrelerinin farklılaşması ve genişlemesinin şematik diyagramı
Şematik diyagram, insan kaynaklı pluripotent kök hücrelerden (iPSC'ler) türetilen anti-GPC3-CAR mühendislik NK hücrelerinin in vitro farklılaşmasını ve GPC3 CAR yapısını taşıyan piggyBac vektörünün şematik bir temsilini göstermektedir. Başlangıçta, modifiye edilmemiş iPSC'ler, GPC3 CAR'ı (kimerik antijen reseptörü) kodlayan bir piggyBac vektörü ile transfekte edilir. Transfeksiyonu takiben, bu GPC3 CAR eksprese eden iPSC'ler klonal olarak genişletilir ve daha sonra fonksiyonel CAR iPSC'den türetilmiş NK hücrelerine farklılaşır. Bu tasarlanmış NK hücreleri daha sonra çeşitli tümör hücre hatlarına karşı antitümör aktivitelerini değerlendirmek için in vitro ve in vivo fonksiyonel testlere tabi tutulur (Şekil 1).
WT ve anti-GPC3-CAR mühendislik iPSC'lerin NK farklılaşma sürecinin çeşitli aşamalarda mikroskobik analizi
GPC3 CAR tarafından tasarlanan iPSC'ler, anti-GPC3 CAR tarafından tasarlanmış iPSC NK hücrelerine ayrılır. GPC3 CAR tarafından tasarlanmış iPSC'lerden GPC3-CAR iPSC NK hücrelerinin farklılaşmasına kadar spin embriyoid cisimciklerinin (EB'ler) oluşumu, anti-GPC3-CAR mühendislik iPSC'lerinin fonksiyonel GPC3 CAR iPSC NK hücrelerine farklılaşma aşamalarını belgeleyen bir dizi mikroskobik görüntü olarak sunuldu. Farklılaşmamış vahşi tip (WT) ve GPC3 CAR iPSC'ler mTeSR Plus ortamında kültürlendi (Şekil 2A). Bu WT ve anti-GPC3-CAR iPSC'ler daha sonra tek hücrelere ayrıştırılır ve SCF (40 ng/mL), BMP4 (20 ng/mL), VEGF (20 ng/mL) ve 10 μM ROCK inhibitörü içeren STEMdiff APEL ortamında 6 gün boyunca ultra düşük bağlantılı U-tabanlı 96 oyuklu bir plakada. Spin EB'lerin oluşumu 6. günde hem WT hem de GPC3 CAR iPSC'lerden yakalandı (Şekil 2B). Bu spin EB'ler ayrıca aşağıdaki sitokinler IL-3 (5 ng / mL), SCF (20 ng / mL), IL-7 (20 ng / mL) ve IL-15 (10 ng / mL) ile NK farklılaşma ortamı içeren 6 kuyulu plakaya aktarılır. WT ve GPC3 CAR iPSC'den türetilen NK hücrelerinin 3. günden 28. güne kadar çeşitli zaman noktalarında farklılaşma süreci, 100x büyütmede bir mikroskop kullanılarak yakalandı (Şekil 2C).
WT ve anti-GPC3 CAR iPSC'den türetilmiş EB'lerin fenotipi (6. gün) ve WT ve GPC3 CAR iPSC'den türetilmiş NK hücreleri (35. gün)
WT ve GPC3 CAR iPSC'den türetilen hücreler, NK farklılaşma sürecinin farklı aşamalarında fenotipik olarak karakterize edilir. Panel A, WT ve GPC3'ün spin EB'lerinden tipik hematopoietik antijenler CD34, CD31, CD43 ve CD45'in ekspresyonunu göstermektedir 6. günde toplanan CAR iPSC'leri akış sitometrisi ile ölçülmüştür (Şekil 3A). Panel b, 35. günde NK farklılaşma ortamından hasat edilen WT ve GPC3 CAR iPSC'den türetilmiş NK hücrelerinin fenotipini sunar ve olgun NK hücreleri ile ilişkili NK'ya özgü belirteçleri (CD45, CD56, CD16 ve NKG2D) vurgular akış sitometrisi ile ölçülmüştür (Şekil 3B).
Genişletilmiş WT ve anti-GPC3-CAR iPSC türevi NK hücrelerinin fenotipi
WT ve anti-GPC3 CAR iPSC'den türetilmiş NK hücrelerinin farklılaşmasından sonra, farklılaşmış NK hücreleri, IL-2 (100 U/mL) ve IL-15 (10 ng/mL) içeren bir Gibco NK Xpander ortamında ışınlanmış aAPC'ler kullanılarak hasat edilir ve genişletilir. CD94, CD16, NKp30, NKp44, NKp46, NKG2D, CD226, FasL ve TRAIL gibi genişletilmiş WT ve anti-GPC3 CAR iPSC NK hücreleri aktivasyon reseptörleri akım sitometrisi kullanılarak ölçüldü (Şekil 4A). Genişletilmiş WT ve anti-GPC3 CAR iPSC NK hücreleri üzerinde NK aktivasyon fenotipini doğruladıktan sonra, akış sitometrisi yoluyla HepG2, SNU-449, SKOV3 ve CAL27 dahil olmak üzere çeşitli tümör hücre hatları üzerinde GPC3 antijeninin yüzey ekspresyonunu değerlendirdik (Şekil 4B). Ayrıca, akış sitometrik analizi ile genişletilmiş anti-GPC3 CAR iPSC'den türetilmiş NK hücreleri üzerindeki CAR ekspresyonunu da doğruladık.
WT ve anti-GPC3 CAR iPSC türevi NK hücrelerinin HCC ve diğer tümör hücre hatlarına karşı fonksiyonel aktivitesi
WT ve anti-GPC3 CAR iPSC'den türetilmiş NK hücrelerinin fenotipini doğruladıktan sonra, çeşitli tümör hücre hatlarına karşı fonksiyonel antitümör aktivitesini değerlendirdik. Kaspaz3/7 bazlı öldürme deneyleri, WT ve anti-GPC3 CAR iPSC'den türetilmiş NK hücrelerinin HepG2, SNU-449, CAL27 ve SKOV3 hücre hatlarına karşı çeşitli efektör-hedef oranlarında sitotoksik aktivitesini değerlendirmek için yapılmıştır. Sonuçlar, anti-GPC3 CAR iPSC'den türetilen NK hücrelerinin, WT iPSC NK hücrelerine kıyasla artmış antitümör etkinliğini göstererek, CAR özgüllüğü ve diğer NK aktivasyon mekanizmaları yoluyla GPC3 eksprese eden tümör hücrelerini hedefleme potansiyellerini göstermektedir (Şekil 5A-D).

Şekil 1: Anti-GPC3-CAR iPSC'den türetilen NK farklılaşması, genişlemesi ve klinik uygulamasının şematik diyagramı. (A) Klinik öncesi ve klinik kullanım için anti-GPC3 CAR iPSC'den türetilmiş NK hücreleri oluşturma sürecine genel bakış. Modifiye edilmemiş iPSC'ler, anti-GPC3-CAR geni taşıyan bir piggyBac vektörü ile transfekte edilir. Başarılı transfeksiyondan sonra, anti-GPC3-CAR eksprese eden iPSC'ler klonal olarak genişletilir ve fonksiyonel NK hücrelerine farklılaşır. Bu anti-GPC3 CAR iPSC'den türetilmiş NK hücreleri, çeşitli GPC3 eksprese eden tümör hücresi hatlarına karşı sitotoksik aktivitelerini değerlendirmek için hem in vitro hem de in vivo fonksiyonel testlere tabi tutulur39. Etkinliklerinin ve güvenliklerinin doğrulanmasının ardından, bu CAR iPSC'den türetilen NK hücreleri, kanser tedavisinde klinik uygulamalar için potansiyel bir "kullanıma hazır" tedavi olarak daha da geliştirilir. (B) iPSC'leri transfekte etmek için kullanılan anti-GPC3 CAR yapısını içeren piggyBac vektörünün şematik gösterimi. (C) iPSC'den türetilmiş NK hücre farklılaşması, genişlemesi, hasadı ve fonksiyonel tahlillerin gerçekleştirilmesinin tipik zaman çizelgesi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
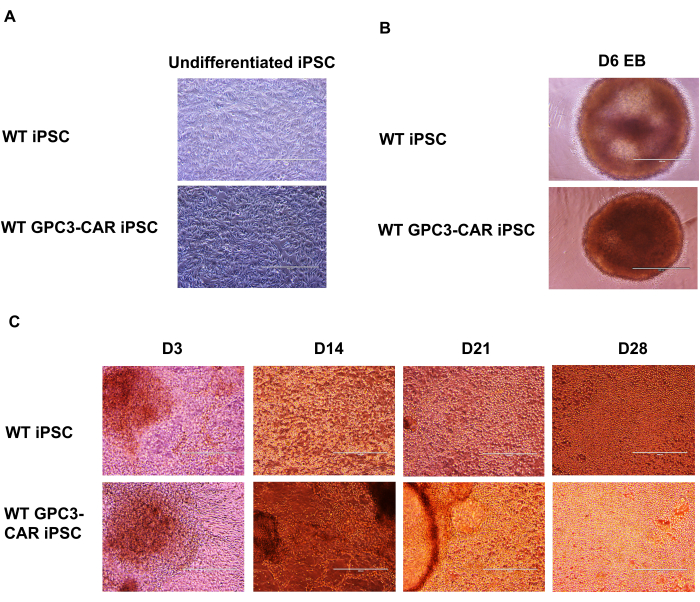
Şekil 2: Farklı aşamalarda anti-GPC3-CAR mühendislik iPSC'lerden CAR iPSC NK farklılaşmasının mikroskobik görüntüleri. (A) mTeSR artı ortamında kültürlenmiş farklılaşmamış WT ve GPC3 CAR iPSC. (B) WT ve GPC3 CAR iPSC 6. günde embriyoid gövdeyi döndürür. (C) WT ve GPC3 CAR iPSC, D3'ten D28'e kadar farklı günlerde NK hücre farklılaşmasından türetilmiştir. A'dan c'ye 100x büyütme. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
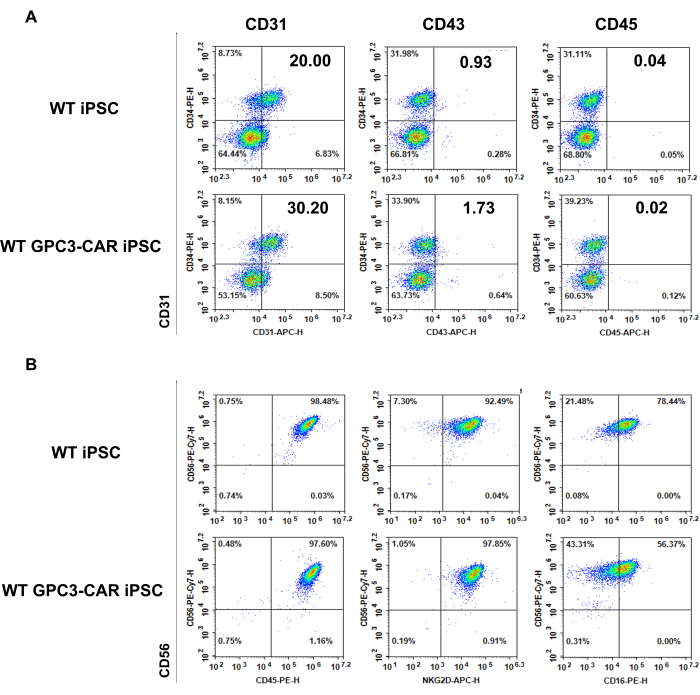
Şekil 3: WT ve anti-GPC3 CAR iPSC'nin fenotipi 6. gün EB ve 35. günde farklılaşmış WT ve GPC3 CAR iPSC'den türetilmiş NK hücreleri. (A) Hematopoietik Farklılaşmanın Farklılaşmasının 6. gününde WT ve GPC3 CAR iPSC'lerde eksprese edilen tipik hematopoietik antijenler. (B) WT ve GPC3 CAR iPSC'den türetilen NK hücrelerinin fenotipi, 35. günde NK farklılaşma ortamından hasat edilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: Genişleme sonrası WT ve anti-GPC3-CAR iPSC türevi NK hücrelerinin fenotipi. (A) WT ve GPC3 CAR iPSC'den türetilen NK hücreleri Gibco NK Xpander besiyerinde genişletildi ve NK olgunlaşma belirteçleri akış sitometrisi kullanılarak değerlendirildi. (B) HepG2, SNU-449, SKOV3 ve CAL27 dahil olmak üzere çeşitli tümör hücre hatları üzerindeki GPC3 antijeninin yüzey ekspresyonu akış sitometrisi kullanılarak ölçüldü. (C) Genişlemeden sonra GPC3 CAR iPSC'den türetilen NK hücrelerinde CAR ifadesini gösteren temsili histogram. CAR yapısı, CAR'ı akış sitometrisi ile ölçmek için FLAG etiketi ve GFP ile birleştirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 5: WT ve anti-GPC3 CAR iPSC'den türetilen NK hücrelerinin HCC ve diğer tümör hücre hatlarına karşı fonksiyonel aktivitesi. (AD) WT ve GPC3 CAR iPSC'den türetilen NK hücrelerinin antitümör aktivitesi, HepG2, SNU-449, CAL27 ve SKOV3 dahil olmak üzere çeşitli tümör hücre hatlarına karşı test edildi. X ekseni, HepG3, SNU-2, CAL449 ve SKOV27'e karşı test edilen WT ve anti-GPC3 CAR iPSC'den türetilen NK hücrelerinin E:T oranlarını temsil eder. X ekseninde belirtilen belirli E: T oranları 10:1, 5:1, 2.5:1, 1:1, 0.5:1 ve 0.25:1'dir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Bu protokol, hedeflenen "kullanıma hazır" kanser immünoterapisini kolaylaştırmayı amaçlayan tutarlı bir hücre kaynağından CAR eksprese eden, iPSC'den türetilmiş NK hücreleri üretmek için standartlaştırılmış ve tekrarlanabilir bir yaklaşımı ana hatlarıyla belirtir. Çok sayıda klinik öncesi ve klinik çalışma, greft versus host hastalıkları (GvHD) veya sitokin salınım sendromu (CRS) gibi toksisiteleri en aza indirirken kanserlerin tedavisinde evlat edinen NK hücre bazlı immünoterapinin etkinliğini göstermiştir23,42, 49,50,51,52,53,54,55,56,57 . Bu yaklaşım, homojen ve iyi karakterize edilmiş CAR iPSC'den türetilen NK hücreleri üretmek için verimli ve iyi tanımlanmış bir sistem kullanır, klinik uygulama için ölçeklendirilebilir. Ek olarak, NK ile optimize edilmiş CAR'ı eksprese etmek için tasarlanmış iPSC'den türetilmiş NK hücreleri, tipik NK hücre fenotiplerini ve sitolitik fonksiyonları korur 23,39,42,50,51,52,58.
CAR iPSC'den türetilen NK hücre üretimi için insan iPSC'lerinin kullanılması, periferik kandan izole edilen birincil NK hücrelerine kıyasla CAR ekspresyonu da dahil olmak üzere genetik modifikasyon için daha verimli bir yöntem sunar 31,59,60. CAR ekspresyonuna ek olarak, inhibitör reseptörlerin silinmesi veya sitokin ekspresyonununeklenmesi gibi modifikasyonlar yoluyla bu hücrelerin antitümör aktivitesinde daha fazla iyileştirme sağlanabilir 41,39,61. Bu, mevcut CAR-T hücre tedavilerinde görüldüğü gibi hastaya özgü modifikasyon ihtiyacını ortadan kaldıran tek bir genetik modifikasyon olayı ile başarılabilir 31,62,63. Ek olarak, yeni CAR eksprese eden hücrelere sahip NK hücre bazlı tedaviler, kronik bulaşıcı hastalıkların tedavisinde potansiyel olarak kullanılabilir 30,64,65,66,67,68.
Bu protokol toplu olarak, in vitro ve in vivo antitümör aktiviteyi arttırmak için CAR eksprese eden NK hücrelerinin homojen popülasyonlarını oluşturmak için insan iPSC'lerini kullanma potansiyelini göstermektedir. NK hücresi için optimize edilmiş CAR'lar, sinyal yollarının antijene özgü aktivasyonunu sağlayarak bu hücrelerin işlevini iyileştirir. CAR NK hücrelerinin verimini ve işlevselliğini optimize etmek için modifikasyonlar ve sorun giderme çok önemlidir. Sitokin kokteylinin ve zamanlamasının ayarlanması farklılaşma verimliliğini artırabilir. NK hücrelerinde CAR yapısının stabilitesini ve ekspresyonunu sağlamak, transfeksiyon yöntemlerinin veya vektör tasarımının optimize edilmesini gerektirebilir. Ek sorun giderme, düşük transdüksiyon verimliliği, hücre canlılığı ve CAR iPSC'den türetilen NK hücrelerinin fonksiyonel aktivitesi gibi sorunları ele alabilir ve kalıcılığı, sitotoksisiteyi ve güvenliği artırmak için farklı kültür koşullarının veya genetik modifikasyonların yinelemeli testini içerebilir.
Yöntemimizin önemi, standartlaştırılmış bir iPSC kaynağından potansiyel olarak sınırsız bir CAR NK hücresi kaynağı üretme yeteneğinde yatmaktadır. iPSC'den türetilen CAR NK hücreleri, çoklu gen düzenlemeleri için kararlı bir platform sunarak değişkenliği azaltır ve tasarlanmış hücrelerin tutarlılığını iyileştirir. Bu yöntem aynı zamanda, kişiselleştirilmiş hücre tedariki ve işleme ihtiyacını ortadan kaldırarak, hemen kullanıma hazır "kullanıma hazır" NK hücre tedavilerinin oluşturulmasını sağlar.
Ek olarak, bu protokolün, piggyBac vektörleri kullanılırken CAR ekspresyonunun stabilitesini korumada belirli sınırlamaları vardır, çünkü transgen entegrasyonunun geçici doğası zaman içinde değişken ekspresyon seviyelerine neden olabilir. Ayrıca, genişleme için aAPC'lere ve spesifik sitokinlere güvenmek, bu süreçlerin klinik uygulamalar için ölçeklenebilirliğini karmaşıklaştırabilir. Son olarak, piggyBac elementlerine karşı potansiyel bağışıklık tepkileri, terapötik ortamlarda risk oluşturabilir.
Sonuç olarak, CAR-NK hücrelerinin insan iPSC'lerinden farklılaşması ve genişlemesi, hepatosellüler karsinom (HCC) ve diğer malignitelerin tedavisi için önemli bir umut vaat etmektedir. Bu yenilikçi yaklaşım, güçlü ve hedefe yönelik bir kanser immünoterapisi oluşturmak için iPSC'lerin rejeneratif potansiyelinden ve NK hücrelerinin doğuştan gelen bağışıklık özelliklerinden yararlanır. Bu alandaki ilerlemeler, HCC ve diğer tedavisi zor hastalıkları olan hastalar için yeni umutlar sunarak daha etkili ve yaygın olarak kullanılabilen NK hücre bazlı tedavilere yol açabilir.
Açıklamalar
DSK, Shoreline Biosciences'ın kurucu ortağı ve danışmanıdır ve şirkette hisse senedi payına sahiptir. DSK ayrıca Therabest ve RedC Bio'ya da danışmanlık yapar ve bunlar için gelir ve/veya öz sermaye alır. Bu düzenlemelerin şartları, çıkar çatışması politikalarına uygun olarak California Üniversitesi, San Diego tarafından gözden geçirilmiş ve onaylanmıştır. Kalan yazarlar hiçbir rakip çıkar beyan etmezler.
Teşekkürler
Tüm Kaufman laboratuvar üyelerine destekleri, bilimsel görüşleri ve tartışmaları için teşekkür ederiz. Bu çalışmalar, NIH / NCI hibe U01CA217885, P30CA023100 (idari ek) ve UCSD'deki Sanford Kök Hücre Enstitüsü tarafından desteklenmiştir. JT: el yazmasının yazılması ve revizyonu. DSK: taslağı gözden geçirdi ve düzenledi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| aAPC | Dean A. Lee lab | N/A | |
| a-MEM culture medium | Fisher Scientific | Cat#12634 | |
| APC anti-DYKDDDDK (FLAG Tag) | BD Biosciences | Cat#637308 | |
| APC-anti-human TRA-1-81 | ThermoFisher | 17-8883-42 | |
| APC-CD16 | BD Biosciences | Cat#302015 | |
| APC-CD43 | BD Biosciences | Cat# 560198 | |
| APC-CD45 | BD Biosciences | Cat# 555485 | |
| APC-GPC3 | BD Biosciences | Cat#DB100B | |
| APC-NKG2D | BD Biosciences | Cat# 558071 | |
| CellEvent Caspase-3/7 Green Detection Reagent | Thermo fisher | Cat#C10423 | |
| CellTrace Violet Cell Proliferation Kit | Thermo fisher | Cat#C34571 | Cell tracing fluorescent dye |
| CryoStor solution | Stem Cell Technologies | https://www.stemcell.com/products/cryostor-cs10.html | Cryopreservation medium |
| CTS NK Xpander | Gibco | A5019001 | |
| CTS NK-Xpander Medium | Life Technologies | Cat#A5019001 | |
| DMEM | Gibco | 11965084 | |
| DMEM, high glucose, GlutaMAX Supplement, pyruvate | Gibco | 10569010 | |
| EasySep Human NK Cell Enrichment Kit | StemCell Technologies, Inc. | Cat#19055 | |
| Ethanolamine | Sigma Aldrich | E9508 | |
| Fetal bovine serum | Fisher Scientific | Cat# 10437010 | |
| FITC-CD94 | BD Biosciences | Cat#555888 | |
| GlutaMAX Supplement | Gibco | 35050061 | |
| GolgiPlug | BD Biosciences | Cat#555029 | |
| GolgiStop | BD Biosciences | Cat#554724 | |
| Ham's F-12 Nutrient Mix, GlutaMAX Supplement | Gibco | 31765035 | |
| Horse serum | Fisher Scientific | Cat#16050130 | |
| Human Serum | AB Sigma-Aldrich | Cat#BP2525100 | |
| Human Stem Cell NucleofectorTM Kit | Lonza | Cat# VPH-5012 | |
| Human: HePG2 cells | ATCC | Cat#HB-8065 | |
| Human: HePG2-td-tomato-luc cells | Dan S. Kaufman lab | N/A | |
| Human: iPS cells | Dan S. Kaufman lab | N/A | |
| Human: SNU-449 cells | ATCC | Cat#CRL-2234 | |
| Human: SNU-449-td-tomato-luc cells | Dan S. Kaufman lab | N/A | |
| IncuCyte Caspase-3/7 Green Apoptosis Assay | Essenbioscience | Cat#4440 | |
| L-Ascorbic acid | Sigma Aldrich | A5960 | |
| MP Biomedicals Human Serum, Type AB | MP Biomedicals | ICN2938249 | |
| mTeSR plus | StemCell Technologies, Inc. | 100-0276 | |
| NovoExpress software | ACEA Biosciences | https://www.agilent.com/en/product/research-flow-cytometry/flow-cytometry-software/novocyte-novoexpress-software-1320805 | |
| PE/Cy7 anti-human SSEA-4 Antibody | Biolegend | 330420 | |
| PE-CD16 | BD Biosciences | Cat#560995 | |
| PE-CD226 | BD Biosciences | Cat#559789 | |
| PE-CD34 | BD Biosciences | Cat# 555822 | |
| PE-CD45 | BD Biosciences | Cat# 555483 | |
| PE-CD94 | BD Biosciences | Cat#555888 | |
| PE-cy7-CD56 | BioLegend | Cat# 318318 | |
| PE-FAS Ligand | BD Biosciences | Cat#564261 | |
| PE-NKp30 | BD Biosciences | Cat# 558407 | |
| PE-NKp44 | BD Biosciences | Cat#558563 | |
| PE-NKp46 | BD Biosciences | Cat#331908 | |
| PE-NKp46 | BD Biosciences | Cat#557991 | |
| Peripheral blood buffy coat | San Diego Blood Bank (https://www. sandiegobloodbank.org/) | N/A | |
| PE-TRAIL | BD Biosciences | Cat#565499 | |
| pKT2-mCAG-IRES-GFP-ZEO | Branden Moriarity lab | N/A | |
| pMAX-GFP plasmid | Lonza | N/A | GFP positive control |
| Prism 9 | Graphpad | Version 9 | |
| pSpCas9 | GenScript | PX165 | |
| RBC Lysis Buffer (10x) | Biolegend | Cat#420301 | |
| Recombinant human bFGF basic | R&D Systems | Cat#4114-TC | |
| Recombinant human BMP-4 | PeproTech | Cat#120-05 | |
| Recombinant human FLT-3 Ligand | PeproTech | Cat# 300-19 | |
| Recombinant human IL-15 | PeproTech | Cat# 200-15 | |
| Recombinant human IL-2 | PeproTech | Cat# 200-02 | |
| Recombinant human IL-3 | PeproTech | Cat#200-03 | |
| Recombinant human IL-7 | PeproTech | Cat# 200-07 | |
| Recombinant Human Nodal Protein | R&D Systems | Cat#3218-ND-025 | |
| Recombinant human SCF | PeproTech | Cat# 300-07 | |
| Recombinant Human TGF-β1 | PeproTech | Cat#100-21 | |
| Recombinant human VEGF | PeproTech | Cat# 100-20 | |
| RPMI1640 | Gibco | 11875093 | |
| Sodium selenite | Sigma Aldrich | 214485 | |
| STEMdiff APEL 2 Medium | StemCell Technologies, Inc. | 5270 | EB formation medium |
| STEMdiff APEL2 Medium | StemCell Technologies, Inc. | Cat#05270 | |
| Super piggyBac Transposase expression vector | SBI | Cat#PB210PA-1 | |
| SYTOX AADvanced Dead Cell Stain Kit | ThermoFisher Scientific | S10274, S10349 | Dead cell staining solution kit |
| β-mercaptoethanol | Gibco | 21985023 |
Referanslar
- Chan, I. S., Ewald, A. J. The changing role of natural killer cells in cancer metastasis. J Clin Invest. 132 (6), e143762 (2022).
- Yu, Y. The function of NK cells in tumor metastasis and NK cell-based immunotherapy. Cancers (Basel). 15 (8), 2323 (2023).
- Paul, S., Lal, G. The molecular mechanism of natural killer cells function and its importance in cancer immunotherapy. Front Immunol. 8, 1124 (2017).
- Myers, J. A., Miller, J. S. Exploring the NK cell platform for cancer immunotherapy. Nat Rev Clin Oncol. 18 (2), 85-100 (2021).
- Llovet, J. M., et al. Hepatocellular carcinoma. Nat Rev Dis Primers. 7, 6 (2021).
- Yang, Y., Xiong, L., Li, M., Jiang, P., Wang, J., Li, C. Advances in radiotherapy and immunity in hepatocellular carcinoma. J Transl Med. 21 (1), 526 (2023).
- Rich, N. E., Yopp, A. C., Singal, A. G. Medical management of hepatocellular carcinoma. J Oncol Pract. 13 (6), 356-364 (2017).
- Niu, M., Yi, M., Li, N., Wu, K., Wu, K. Advances of Targeted Therapy for Hepatocellular Carcinoma. Front Oncol. 11, 719896 (2021).
- Yu, S. J. Immunotherapy for hepatocellular carcinoma: Recent advances and future targets. Pharmacol Ther. 244, 108387 (2023).
- Ntellas, P., Chau, I. Updates on systemic therapy for hepatocellular carcinoma. Am Soc Clin Oncol Educ Book. 44, e430028. 44, e430028 (2024).
- Liu, T. -. H., Shen, Y. -. C., Cheng, A. -. L. Immune checkpoint inhibitors for hepatocellular carcinoma - A game changer in treatment landscape. J Formos Med Assoc. 121 (8), 1371-1383 (2022).
- Sun, Q., Hong, Z., Zhang, C., Wang, L., Han, Z., Ma, D. Immune checkpoint therapy for solid tumours: clinical dilemmas and future trends. Signal Transduct Target Ther. 8 (1), 320 (2023).
- Huang, A., Yang, X. -. R., Chung, W. -. Y., Dennison, A. R., Zhou, J. Targeted therapy for hepatocellular carcinoma. Signal Transduct Target Ther. 5 (1), 146 (2020).
- Girardi, D. M., Pacífico, J. P. M., Guedes de Amorim, F. P. L., Dos Santos Fernandes, G., Teixeira, M. C., Pereira, A. A. L. Immunotherapy and targeted therapy for hepatocellular carcinoma: A literature review and treatment perspectives. Pharmaceuticals (Basel). 14 (1), 28 (2020).
- Laface, C., et al. Targeted therapy for hepatocellular carcinoma: Old and new opportunities. Cancers (Basel). 14 (16), 4028 (2022).
- Shyam Sunder, S., Sharma, U. C., Pokharel, S. Adverse effects of tyrosine kinase inhibitors in cancer therapy: pathophysiology, mechanisms and clinical management. Signal Transduct Target Ther. 8 (1), 262 (2023).
- Cappell, K. M., Kochenderfer, J. N. Long-term outcomes following CAR T cell therapy: what we know so far. Nat Rev Clin Oncol. 20 (6), 359-371 (2023).
- June, C. H., O'Connor, R. S., Kawalekar, O. U., Ghassemi, S., Milone, M. C. CAR T cell immunotherapy for human cancer. Science. 359 (6382), 1361-1365 (2018).
- Schuster Stephen, J., et al. Chimeric antigen receptor T cells in refractory B-cell lymphomas. N Engl J Med. 377 (26), 2545-2554 (2017).
- Schmidt, D., et al. Engineering CAR-NK cells: how to tune innate killer cells for cancer immunotherapy. Immunother Adv. 2 (1), Itac003 (2022).
- Zhang, B., et al. Chimeric antigen receptor-based natural killer cell immunotherapy in cancer: from bench to bedside. Cell Death Dis. 15 (1), 50 (2024).
- Wang, K., et al. Reprogramming natural killer cells for cancer therapy. Mol Ther. 32 (9), 2835-2855 (2024).
- Li, Y., Hermanson, D. L., Moriarity, B. S., Kaufman, D. S. Human iPSC-derived natural killer cells engineered with chimeric antigen receptors enhance antitumor activity. Cell Stem Cell. 23 (2), 181-192.e5 (2018).
- Liu, E., Marin, D., et al. Use of CAR-transduced natural killer cells in CD19-positive lymphoid tumors. N Engl J Med. 382 (6), 545-553 (2020).
- Chen, L., Xie, T., Wei, B., Di, D. L. Current progress in CAR-T cell therapy for tumor treatment. Oncol Lett. 24 (4), 358 (2022).
- Rafiq, S., Hackett, C. S., Brentjens, R. J. Engineering strategies to overcome the current roadblocks in CAR T cell therapy. Nat Rev Clin Oncol. 17 (3), 147-167 (2020).
- Sterner, R. C., Sterner, R. M. CAR-T cell therapy: current limitations and potential strategies. Blood Cancer J. 11 (4), 69 (2021).
- Albinger, N., Hartmann, J., Ullrich, E. Current status and perspective of CAR-T and CAR-NK cell therapy trials in Germany. Gene Ther. 28 (9), 513-527 (2021).
- Dagher, O. K., Posey, A. D. Forks in the road for CAR T and CAR NK cell cancer therapies. Nat Immunol. 24 (12), 1994-2007 (2023).
- Xie, G., Dong, H., Liang, Y., Ham, J. D., Rizwan, R., Chen, J. CAR-NK cells: A promising cellular immunotherapy for cancer. EBioMedicine. 59, 102975 (2020).
- Cichocki, F., van der Stegen, S. J. C., Miller, J. S. Engineered and banked iPSCs for advanced NK- and T-cell immunotherapies. Blood. 141 (8), 846-855 (2023).
- Goldenson, B. H., Hor, P., Kaufman, D. S. iPSC-derived natural killer cell therapies - Expansion and targeting. Front Immunol. 13, 841107 (2022).
- Zhu, H., Kaufman, D. S. Engineered human pluripotent stem cell-derived natural killer cells: the next frontier for cancer immunotherapy. Blood Sci. 1 (1), 4-11 (2019).
- Knorr, D. A., et al. Clinical-scale derivation of natural killer cells from human pluripotent stem cells for cancer therapy. Stem Cells Transl Med. 2 (4), 274-283 (2013).
- Shimizu, Y., Suzuki, T., Yoshikawa, T., Endo, I., Nakatsura, T. Next-generation cancer immunotherapy targeting Glypican-3. Front Oncol. 9, 248 (2019).
- Schepers, E. J., Glaser, K., Zwolshen, H. M., Hartman, S. J., Bondoc, A. J. Structural and functional impact of posttranslational modification of Glypican-3 on liver carcinogenesis. Cancer Res. 83 (12), 1933-1940 (2023).
- Batra, S. A., et al. Glypican-3-specific CAR T cells coexpressing IL15 and IL21 have superior expansion and antitumor activity against hepatocellular carcinoma. Cancer Immunol Res. 8 (3), 309-320 (2020).
- Gao, W., et al. Immunotoxin targeting glypican-3 regresses liver cancer via dual inhibition of Wnt signalling and protein synthesis. Nat Commun. 6, 6536 (2015).
- Thangaraj, J. L., Coffey, M., Lopez, E., Kaufman, D. S. Disruption of TGF-β signaling pathway is required to mediate effective killing of hepatocellular carcinoma by human iPSC-derived NK cells. Cell Stem Cell. 31 (9), 1327-1343.e5 (2024).
- Maddineni, S., Silberstein, J. L., Sunwoo, J. B. Emerging NK cell therapies for cancer and the promise of next generation engineering of iPSC-derived NK cells. J Immunother Cancer. 10 (5), e004693 (2022).
- Zhu, H., et al. Metabolic reprograming via deletion of CISH in human iPSC-derived NK cells promotes in vivo persistence and enhances antitumor activity. Cell Stem Cell. 27 (2), 224-237.e6 (2020).
- Strati, P., et al. Preliminary results of a phase I trial of FT516, an off-the-shelf natural killer (NK) cell therapy derived from a clonal master induced pluripotent stem cell (iPSC) line expressing high-affinity, non-cleavable CD16 (hnCD16), in patients (pts) with relapsed/refractory (R/R) B-cell lymphoma (BCL). J Clin Oncol. 39, 7541-7541 (2021).
- Hong, D., et al. Preliminary results of an ongoing phase I trial of FT500, a first-in-class, off-the-shelf, induced pluripotent stem cell (iPSC) derived natural killer (NK) cell therapy in advanced solid tumors. J Immunother Cancer. 8 (3), A231-A232 (2020).
- Zah, E., et al. Systematically optimized BCMA/CS1 bispecific CAR-T cells robustly control heterogeneous multiple myeloma. Nat Commun. 11 (1), 2283 (2020).
- Ahn, S., et al. Cancer immunotherapy with T cells carrying bispecific receptors that mimic antibodies. Cancer Immunol Res. 7 (5), 773-783 (2019).
- Ludwik, K. A., Telugu, N., Schommer, S., Stachelscheid, H., Diecke, S. ASSURED-optimized CRISPR protocol for knockout/SNP knockin in hiPSCs. STAR Protoc. 4 (3), 102406 (2023).
- Zhu, H., Kaufman, D. S. An improved method to produce clinical scale natural killer cells from human pluripotent stem cells. Methods Mol Biol. 2048, 107-119 (2019).
- Denman, C. J., et al. Membrane-bound IL-21 promotes sustained ex vivo proliferation of human natural killer cells. PLoS One. 7 (1), e30264 (2012).
- Leivas, A., et al. NKG2D-CAR-transduced natural killer cells efficiently target multiple myeloma. Blood Cancer J. 11 (8), 146 (2021).
- Ramdial, J. L., et al. A phase II clinical trial of "Off-the-Shelf" NK cells with allogeneic stem cell transplantation to decrease disease relapse in patients with high-risk myeloid malignancies. Blood. 140 (Supplement 1), 7484-7485 (2022).
- Bachanova, V., et al. Initial clinical activity of FT596, a first-in-class, multi-antigen targeted, off-the-shelf, iPSC-derived CD19 CAR NK cell therapy in relapsed/refractory B-cell lymphoma. Blood. 136, 8 (2020).
- Bae, W. K., et al. A phase I study of locoregional high-dose autologous natural killer cell therapy with hepatic arterial infusion chemotherapy in patients with locally advanced hepatocellular carcinoma. Front Immunol. 13, 879452 (2022).
- Marin, D., et al. Safety, efficacy and determinants of response of allogeneic CD19-specific CAR-NK cells in CD19+ B cell tumors: a phase 1/2 trial. Nat Med. 30 (3), 772-784 (2024).
- Fehniger, T. A., et al. A phase 1 trial of CNDO-109-activated natural killer cells in patients with high-risk acute myeloid leukemia. Biol Blood Marrow Transplant. 24 (8), 1581-1589 (2018).
- Nguyen, R., et al. A phase II clinical trial of adoptive transfer of haploidentical natural killer cells for consolidation therapy of pediatric acute myeloid leukemia. J Immunother Cancer. 7 (1), 81 (2019).
- Miller, J. S., et al. Successful adoptive transfer and in vivo expansion of human haploidentical NK cells in patients with cancer. Blood. 105 (8), 3051-3057 (2005).
- Liu, E., et al. Use of CAR-transduced natural killer cells in CD19-positive lymphoid tumors. N Engl J Med. 382 (6), 545-553 (2020).
- Daher, M., Melo Garcia, L., Li, Y., Rezvani, K. CAR-NK cells: the next wave of cellular therapy for cancer. Clin Transl Immunology. 10 (4), e1274 (2021).
- Lin, X., Sun, Y., Dong, X., Liu, Z., Sugimura, R., Xie, G. IPSC-derived CAR-NK cells for cancer immunotherapy. Biomed Pharmacother. 165, 115123 (2023).
- Bachanova, V., et al. Safety and efficacy of FT596, a first-in-class, multi-antigen targeted, off-the-shelf, iPSC-derived CD19 CAR NK cell therapy in relapsed/refractory B-cell lymphoma. Blood. 138, 823 (2021).
- Saetersmoen, M. L., Hammer, Q., Valamehr, B., Kaufman, D. S., Malmberg, K. J. Off-the-shelf cell therapy with induced pluripotent stem cell-derived natural killer cells. Semin Immunopathol. 41 (1), 59-68 (2019).
- Gerew, A., et al. Deletion of CISH and TGFβR2 in iPSC-derived NK cells promotes high cytotoxicity and enhances in vivo tumor killing. Blood. 138, 2780 (2021).
- Goldenson, B. H., Hor, P., Kaufman, D. S. iPSC-derived natural killer cell therapies - Expansion and targeting. Front Immunol. 13, 841107 (2022).
- Karvouni, M., Vidal-Manrique, M., Lundqvist, A., Alici, E. Engineered NK cells against cancer and their potential applications beyond. Front Immunol. 13, 825979 (2022).
- Ayuso, J. M., et al. Microphysiological model reveals the promise of memory-like natural killer cell immunotherapy for HIV± cancer. Nat Commun. 14 (1), 6681 (2023).
- Miller, J. S., et al. Safety and virologic impact of haploidentical NK cells plus interleukin 2 or N-803 in HIV infection. J Infect Dis. 229 (5), 1256-1265 (2024).
- Gutiérrez-Hoya, A., Soto-Cruz, I. NK cell regulation in cervical cancer and strategies for immunotherapy. Cells. 10 (11), 3104 (2021).
- Lisco, A., et al. Treatment of relapsing HPV diseases by restored function of natural killer cells. N Engl J Med. 385 (10), 921-929 (2021).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır