Method Article
ヒト人工多能性幹細胞由来キメラ抗原受容体発現ナチュラルキラー細胞の進歩
要約
ここでは、ヒトiPS細胞由来のキメラ抗原受容体(CAR)を発現するナチュラルキラー細胞を分化・増殖させ、様々な悪性腫瘍に対する死傷性を向上させる方法を紹介します。このプロトコールは、ナチュラルキラー(NK)に最適化されたiPS細胞由来CAR-NK細胞の分化と増殖、およびさまざまな腫瘍細胞株に対する抗腫瘍活性の測定を示しています。
要約
ナチュラルキラー(NK)細胞は、腫瘍やウイルス感染に対する体の防御に重要な役割を果たす自然免疫細胞です。NK細胞を発現するヒト人工多能性幹細胞(iPSC)由来のキメラ抗原受容体(CAR)の作製は、「既製」のがん免疫療法の有望な手段として浮上しています。ここでは、NKG2Dの膜貫通ドメイン、2B4共刺激ドメイン、およびCD3ζシグナル伝達ドメインを含むNK細胞最適化CARコンストラクトを利用しました。これにより、NK細胞特異的な抗腫瘍活性を刺激することが実証されています。CAR NK細胞の作製にiPS細胞を用いることで、CARの発現が均一であること、拡張性、再現性、臨床応用の可能性など、いくつかのメリットがあります。細胞工学から分化までのこの詳細なステップバイステップのプロトコルにより、NK細胞に最適化されたiPS細胞由来CAR発現NK細胞の作製が可能になり、抗腫瘍活性が改善された標準化された標的がん免疫療法が提供され、さまざまな悪性腫瘍の有望な治療選択肢としての可能性が強調されています。
概要
NK細胞は、自然免疫系内のリンパ球の一種であり、腫瘍やウイルス感染細胞に対する早期防御において極めて重要である1,2,3。T細胞とは異なり、NK細胞は主要組織適合遺伝子複合体(MHC)分子を介した抗原提示を必要としません。それどころか、NK細胞は、その活性を調節する活性化受容体と抑制性受容体のレパートリーを持っています3。NK細胞媒介性細胞傷害性活性は、パーフォリンやグランザイムの放出、死受容体の関与、IFN-γやTNF-αなどの炎症誘発性サイトカインの産生など、さまざまなメカニズムを利用しています。このユニークな作用機序は、NK細胞をがん免疫療法、特に免疫回避が大きなハードルである固形がんの治療において、魅力的な候補として位置付けています1,2,3,4。
肝細胞がん(HCC)は、世界で最も一般的で致命的な肝臓がんの1つです5。手術、化学療法、放射線療法などの従来の治療アプローチは、通常、臨床的利益が限られており、高い再発率をもたらします6,7。近年の免疫療法と標的療法の進歩は、HCC 8,9の治療に大きな影響を与えています。ニボルマブやペムブロリズマブなどの免疫チェックポイント阻害剤は、がん細胞に対する免疫細胞の応答を増強することにより有望な結果を示しています10,11。これらの治療法は、一部の患者の生存率と生活の質の向上につながっています。しかし、それらはまた、免疫関連の副作用を引き起こす可能性があり、特定の患者ではその使用を制限する可能性があります12。ソラフェニブやレンバチニブなどの標的療法は、がん細胞の増殖と血管新生を促進する経路を特異的に阻害します13。これらの治療法は、疾患の進行を制御し、生存期間を延長する有効性が知られています8,14。それにもかかわらず、標的療法に対する耐性は通常発症し、治療の副作用は一般的です15,16。がん免疫療法戦略の有望な手段の中で、キメラ抗原受容体(CAR)CAR T細胞の出現は、特にリンパ腫や多発性骨髄腫などの血液悪性腫瘍の治療において、がん治療に革命をもたらしました17,18,19。
CARを発現するNK細胞は、NK細胞の自然細胞傷害活性とCAR技術の精密な標的化を組み合わせることで、HCC 20,21,22,23,24などの固形腫瘍に対する革新的で潜在的に変革的なアプローチを表しています。CAR改変細胞は、正常組織を温存しながら標的抗原を発現する腫瘍細胞を特異的に認識し、殺すことができるので、従来の治療法25,26,27に関連するオフターゲット効果のリスクを低減することができる。末梢血または臍帯血から単離されたNK細胞から産生されるCAR-NK細胞は、典型的には、活性化および増殖に必要な細胞外抗原認識ドメイン、膜貫通ドメイン、および細胞内シグナル伝達ドメインからなるCARコンストラクトをNK細胞に形質導入することによって産生される28,29,30。
機能的に操作されたNK細胞の安定で均質な集団を臨床治療のために作製するという課題は、人工多能性幹細胞(iPSC)31,32を採用することで対処できる。NK細胞最適化CARを用いたヒトiPS細胞のエンジニアリングは、NK細胞の活性化と増殖シグナルの改善をもたらし、CAR発現NK細胞の無尽蔵で均質な集団を標準化された「既製治療薬」として提供します20,33。このプロトコルでは、CAR発現iPS細胞由来NK細胞を生成するためのiPS細胞の遺伝子改変には、NK細胞由来の膜貫通およびシグナル伝達ドメイン(NKG2D-2B4-CD3ζ)および抗グリピカン-3(GPC3)scFvを含むNK細胞最適化CARコンストラクトを統合することが含まれます。次に、遺伝子操作されたiPS細胞は、以前に開発されたNK細胞分化プロトコルを使用して分化および増殖されます34。これらの改変CAR発現iPS細胞由来NK細胞は、HCCおよび特定の腫瘍関連抗原を発現する他の腫瘍細胞、例えば、HCCおよび他の悪性腫瘍において過剰発現するグリピカン3(GPC3)を認識し、排除する能力を有する35,36,37,38。
iPS細胞由来CAR-NK細胞の多様ながん治療への応用は、大きな期待を寄せています30,39,40;これらのiPS細胞由来CAR-NK細胞の多くは、現在臨床試験中である41,42,43。この分野での進歩を促進するために、このプロトコールは、細胞工学から成熟NK細胞への分化、in vitroでの増殖まで、遺伝子操作されたiPS細胞由来のCAR-NK細胞の効率的な生産を可能にします。
プロトコル
1. ヒトiPS細胞のフィーダーフリー培養法
注:凍結した未分化ヒトiPS細胞を解凍し、前述したように、マトリゲル(以下、基底膜マトリックス[BMM]と呼ぶ)プレコートプレート上でmTeSR 1-plusを使用して培養します23,34。iPS細胞がエンジニアリングの前後で区別されないようにすることは非常に重要です。解凍したばかりのiPS細胞は、ヒト多能性幹細胞と一致する多能性の形態を示すために、約2〜3継代培養する必要があります。次の手順は、6ウェルプレートの1つのウェルから細胞を継代するために使用されます。
- iPS細胞を継代する前に、新しい6ウェルプレートに1x BMM(1 mL/well)をコーティングし、37°Cのインキュベーターで2〜4時間インキュベートしてから使用してください。
- 1x可溶化BMMを調製します。
- BMMの5 mLストックバイアルを4°Cで一晩解凍します。
- 事前に冷却したチップを使用して、事前に冷却した微量遠心チューブにBMMをすばやく分注します。
- -80°Cで最大6か月間保管してください。
- 1x BMMワーキング溶液を調製するには、1:100の比率で1つのBMMアリコートを冷たいDMEM/F12培地に再懸濁します。1x BMMワーキング溶液は、-4°Cで2週間保存できます。
- プレートの表面を覆うのに十分な量でコーティングします(たとえば、6ウェルプレートのウェルあたり1 mLを使用します)。
- 使用前に37°Cインキュベーターで2〜4時間インキュベートしてください。
- 凍結したiPS細胞(通常は1×106 細胞/バイアル)のバイアルを37°Cの水浴で解凍します。
- 解凍したiPS細胞を、5 mLの予熱したmTeSR Plus培地が入った15 mLのコニカルチューブに徐々に加え、細胞のショックを最小限に抑えるために一滴ずつ追加することで細胞が順応できるようにします。
- 細胞を300 × g で5分間遠心分離します。
- 上清を吸引し、細胞を5mLのPBSで一度洗浄します。
- 細胞をmTeSR Plus培地に再懸濁し、BMMプレコート6ウェルプレートに約200,000細胞/3 mL/ウェルの密度でプレート化します。
- パッセージiPSC。
- iPS細胞が70〜80%のコンフルエンシーに達したら、培地を吸引し、TrypLEで37°Cで5分間シングルセル継代を行います(1 mL/ウェルを6ウェルプレートに充填)。
- 5分後、1x PBSを3 mL加えて解離反応を停止し、細胞を3 mLのPBSで1回洗浄します。
- 細胞を300 × g で5分間遠心分離します。洗浄後、シングルセルiPS細胞をmTeSR Plus培地に再懸濁し、プレコートしたBMM製6ウェルプレートにプレート化します。
注:必要な培地の総量は、6ウェルプレートで3 mL/ウェルです。培地は2〜3日ごとに交換する必要があり、iPS細胞をエンジニアリングする前に、細胞が少なくとも1〜2継代で70〜80%コンフルエントになったときにステップ1.8を繰り返す必要があります。
- iPS細胞の多能性を定期的にチェックしてください。iPS細胞をアロフィコシアニン(APC)標識TRA-1-81およびPE-Cy7標識ステージ特異的胚性抗原-4(SSEA-4)抗体で氷上で30分間染色し、前述の23,41と同様にフローサイトメトリーを用いて解析します。
注:この実験で使用したiPS細胞は、TrypLEに適合しています。これまでにTrypLEで継代されていないiPS細胞は、通常、TrypLEに完全に適応するために8〜10回の継代を必要とします。これにより、高品質のスピン胚様体(EB)の産生が保証されます。
2. piggyBacベクターを用いたヒトiPS細胞の抗GPC3 CAR発現作製
- 新しい6ウェルプレートにBMMをコーティングし、37°Cで少なくとも1時間インキュベートします(液体が乾燥しない限り、さらに長くなることがあります)。
- 10 μM Rho 随伴コイルコイル含有プロテインキナーゼ (ROCK) 阻害剤 (Y-27632) (滅菌蒸留水で調製した 1 mM ストックから) を 37 °C で温めた mTeSR Plus を温めます。
- ヌクレオフェクションシステムをオンにします。Xユニットを選択し、トランスフェクションするウェルの位置を選択します。P3 ソリューションを選択し、コード (CA-137) を手動で入力します。
- 1 mLのTrypLEと70-80%のコンフルエントでiPS細胞を回収し、37°Cで5分間インキュベートします。顕微鏡で確認して、解離を確認します。
- ピペットを4〜6回ピペットで1細胞懸濁液を得てから、5mLのPBSとペレットで300× g で5分間中和します。
- 細胞をもう一度優しく洗浄して、TrypLEの痕跡をすべて取り除きます。
- 1 mLのmTeSR PlusとRock-Inhibitorに再懸濁し、細胞をカウントします。
- 抗GPC3 CAR iPS細胞を作製するには、トランスフェクションごとに1個×10個の6 細胞を微量遠心チューブで使用し、300 × g で5分間スピンダウンします。
- 遠心しながら、CAR発現トランスポゾンDNAとSuper PiggyBacトランスポザース発現ベクターを1.5 mLの微量遠心チューブで3:1の比率で組み合わせます(例:トランスポゾンを含むプラスミド3 μgとトランスポゼーゼプラスミド1 μg)。
- 0.5 μL の 1 mg/mL 溶液を使用した緑色蛍光タンパク質(GFP)ポジティブコントロール(材料表)と、GFP 発現を確認するためのトランスフェクションされていないネガティブコントロールを含めます。
- 細胞ペレットを20 μLの室温(RT)P3 Nucleofector溶液に、ヌクレオフェクションキットに付属のサプリメントとともに慎重に再懸濁します。次に、この混合物をプラスミドDNAを含む1.5 mLの微量遠心チューブに加えると、最終容量は約22〜25 μLになります。
注:GPC3 CARプラスミドまたはGFPコントロールプラスミドを細胞に添加する前に、トランスフェクションするすべてのiPS細胞をP3 Nucleofector溶液に再懸濁してください。 - 細胞/DNA懸濁液を20 μL 16ウェルストリップに移します。サンプルがキュベットの底を覆い、気泡がないことを確認します。
- ベンチトップの16ウェルストリップを軽くたたいて、気泡を取り除き、セルを底に沈殿させます。
- iPS細胞とCAR DNAミックスを含む16ウェルストリップをヌクレオフェクションシステムに入れ、プログラム CA-137、P3溶液を選択してからプログラムを開始します。このプログラムは1秒で終了し、緑色のチェックマークが表示されます。
- 温めたmTeSR PlusとROCK-Inhibitor培地をウェルに80 μL加え、BMMでコーティングした6ウェルプレート(最終容量1 mL/ウェル)に細胞を慎重に移します。
- トランスフェクションの成功率を確認するために、GFPの発現について4時間後に蛍光顕微鏡で細胞を簡単にチェックします。
- トランスフェクションの24時間後にフローサイトメトリー23,41を使用してトランスフェクション効率を評価するために、GFP発現についてiPS細胞をスクリーニングし、GFP発現を確認します。
- 37°Cで4日間インキュベートし、必要に応じて培地を交換してから薬剤選択に進みます。
注:各ヌクレオフェクションには、反応ごとに0.2-2 x 106 iPS細胞が必要です。反応回数に応じて、24ウェルプレートまたは6ウェルプレートを使用することができます。
3. GPC3-CAR iPS細胞のクローン選択と多能性確認
- トランスフェクションしたiPS細胞に対してゼオシン選択(1:10,000)を行い、iPS細胞を発現するGPC3-CARをクローン的に選択します。
- トランスフェクション効率を確認するために、蛍光顕微鏡およびフローサイトメトリー23,41を用いてGFP発現を測定する。
注:CARコンプレックスは、iPS細胞期およびNK細胞分化後の両方でCAR発現を評価する目的で、FLAGタグ44,45とともに組み込まれています。 - トランスフェクションしたCAR iPS細胞は、最適なCAR遺伝子とGFP発現が得られるまで、薬剤選択下で維持します。
- GFPおよびCARの発現を均一にするために、薬剤選択の期間を2〜3週間延長します。
- フローサイトメトリーを用いてGFPまたはCAR発現に基づく細胞選別を行い、クローン性に選択されたiPS細胞の均質な集団を得る23。
- ここで使用されるCARコンストラクトには、ゼオシン薬物選択マーカーが含まれています。GPC3 CAR遺伝子トランスフェクト細胞を、ゼオシン(50 μg/mLのゼオシン)を培地に添加して選択してください。
- ゼオシン選択後、GPC3 CAR遺伝子トランスフェクトiPS細胞を希釈し、96ウェルプレートに播種して、ウェルあたり約1細胞を達成します。これは、段階希釈またはセルソーターを使用して行うことができます。
注:蛍光活性化セルソーティング(FACS)を使用して、CARコンストラクトにリンクされた蛍光マーカーの発現に基づいて、トランスフェクションされた単一細胞を単離します。 - 単一細胞が96ウェルプレートのコロニーに増殖するのを待ちます。
- 3〜4日ごとに新鮮な培地を細胞に一度供給し、ウェルのコロニー成長を監視します。
- CAR発現のためにコロニーをスクリーニングします。これは、ポリメラーゼ連鎖反応(PCR)、定量的ポリメラーゼ連鎖反応(qPCR)、またはウェスタンブロッティングによって行うことができ、CARコンストラクト23,47の存在を確認する。
- あるいは、フローサイトメトリー23,41を使用して、CARタンパク質の表面発現を検出します。
注:この研究では、CAR発現をフローサイトメトリーを用いたFLAGタグ発現により定量化しました。 - さらに、核型分析を実行して、染色体異常を特定します。
注意: これは、Wicell(wicell.org)やThermo Fisher Scientific(thermofisher.com)などのサードパーティ組織が行うことができます。 - CAR陽性クローンが異常なく同定されたら、これらのクローンを6ウェルプレートやT75フラスコなどのより大きな培養容器で増殖させます。
- クローン増殖したCAR iPS細胞を、複数のバイアル中の凍結保存培地を用いて凍結保存し、将来の使用に備えます。
注:このステップでは、次の点が推奨されます:(i)分化を防ぐために、iPS細胞の最適な培養条件を維持します。(ii)薬剤選択後、iPS細胞におけるCARおよびGFP発現の均一な集団を達成するために、1〜4週間かかります。(iii)CAR発現の安定性と多能性マーカーについて、細胞のモニタリングを続けます。(iv) スクリーニングおよび検証ステップ中に適切な管理を使用してください。(v) クローン選択・増殖後、CAR発現iPS細胞上のTRA-1-81およびSSEA-4発現を評価し、多能性を確認する。
4. スピン胚様体(EB)形成による改変CAR-iPS細胞からの造血前駆細胞の作製
注:スピンEBまたは造血オルガノイドプロトコルは、造血前駆細胞23,34を産生するために使用されます。EB内の細胞は、リンパ球の発達を支援するために間質細胞に分化し38、それによりOP9のような異種由来の間質細胞の必要性を排除します23,34,48。以下は、EB形成用の6ウェルプレートの1つのウェルから細胞を採取する手順です。
- スピンEB形成の2日前に、6ウェルBMMプレコートプレートの~200,000細胞/ウェルを継代。スピンEBのセットアップ日に70〜80%の合流点に達することを確認します。一般に、スピンEBの2枚のプレートに対しては、6ウェルプレートの1ウェルで十分です。
- 培地を取り出し、予熱したTrypLE Select1 mLと37°Cで5分間インキュベートして細胞を剥離します。
- 1 mLマイクロピペットを使用して細胞凝集体を1つの細胞懸濁液に慎重に解離し、細胞を15 mLのコニカルチューブに移します。1x PBSを3 mL添加して解離反応を停止させ、細胞を3 mLのPBSで1回洗浄します。
- 細胞をmTesR Plus培地に再懸濁し、70 μMの細胞ストレーナーでろ過して凝集体を除去します。
- 細胞をスピンダウンして上清を除去し、5mLのPBSで細胞を再度洗浄します。次に、細胞を1 mLのSTEMdiff APEL培地(EB形成培地)に再懸濁します。
- 以下のサイトカイン(SCF:40 ng/mL、BMP4:20 ng/mL、VEGF:20 ng/mL)と10 μM ROCK阻害剤を含むEB形成培地を用いて、細胞をカウントし、適切な密度に希釈してください。
- 96ウェルプレートの培地100 μL(100,000細胞/mL)に3000-10000細胞/ウェルを播種します。
注:EB形成に使用される細胞の数は、iPS細胞株によって異なる場合があります。96ウェルプレートでウェルあたり3,000〜10,000個の細胞をテストすることをお勧めします。 - マルチチャンネルピペットを使用して、細胞懸濁液を100 μL/ウェルで96ウェルプレートにロードします。
注:胚様体(EB)の形成を良くするために、超低付着の丸底96ウェルプレートを使用することをお勧めします。 - 96ウェルプレートを300 × g で5分間遠心分離し、その後、プレートを5% CO2 と共に37°Cで6日間インキュベートします。
注:予備研究では、この研究でCAR iPS細胞株の>30%のCD34 + 細胞を生じさせるには6日で十分であることがわかっています。 - フローサイトメトリーによるEB品質の確認 23,41.
- EBsを解離するために、予熱した0.25%トリプシン4mLを0.4%チキン血清(4mLトリプシンの場合は16μL)と共に調製します。
- 10〜30個のEBを15mLのコニカルチューブに移します。
- トリプシン/チキン血清溶液をEBに加え、水浴中で10分間インキュベートし、30秒ごとにボルテックスしてEBが完全に解離するようにします。
- トリプシン処理されたEBをピペットで掴みます。数回上下に混ぜて、EBSを完全に解離します。
- 1x PBSを5mL追加して、トリプシン化プロセスを停止します。
- 新しい円錐形チューブ内の70 μmセルストレーナーでセル溶液をろ過します。
- 細胞を300 x g で5分間遠心分離します。
- 上清を吸引し、3〜5 mLの新鮮な培地に再懸濁します。.
- 細胞をカウントし、CD34、CD31、CD43、CD45などの典型的なEBマーカーで染色し、フローサイトメトリー23,41を使用して分析します(図3)。
- メーカーの指示に従って推奨量の抗体を、100 μLのフローバッファーに分離したEBの単一細胞を含む各チューブに加え、氷上で30分間インキュベートします39,41。
- インキュベーション後、細胞をフローバッファーで2回洗浄し、SYTOX blue生/死染色を添加し、フローサイトメトリーを用いて解析します。
注:通常、>30%のCD34+ 細胞は、この研究で使用したiPS細胞を使用して、6日目に解離したSpin胚様体の全集団から得られますが、この割合はiPS細胞の供給源と培養条件によって異なります。
5. スピンEBsからのGPC3 CAR iPS細胞由来NK細胞の分化
注:GPC3 CAR発現スピンEBは、24ウェルプレートまたは2%ゼラチンでコーティングされた6ウェルプレート、またはコーティングなしで移すことができます。中程度の変更には、6ウェルプレートがより適しており、2%ゼラチンコーティングはEBの付着を強化します。
- ゼラチンコーティングされた6ウェルプレートを以下の手順に従って調製します。
- ゼラチンを組織培養グレードの水に溶解することにより、2%(w / v)ゼラチン溶液を調製します。
- 溶液を121°C、15psiで30分間オートクレーブして滅菌します。
- 各ウェルの表面を cm2 あたり 5-10 μL のゼラチン溶液でコーティングします (6 ウェルプレートのウェルあたり ~1 mL)。
- プレートを37°Cで2〜4時間インキュベートしてから使用してください。インキュベーション後、EBsの転写を進める前に、残っているゼラチン溶液を吸引してください。
- NK細胞分化培地を調製する:56.6% DMEM+ GlutaMAX-I、28.3% F12+ GlutaMAX-I、15%熱不活化ヒトAB血清、1% P/S、2 mM L-グルタミン、1 μM β-メルカプトエタノール、5 ng/mL 亜セレン酸ナトリウム、50 μM エタノールアミン、および 20 mg/L アスコルビン酸を添加します。暗所で4°Cで保管してください。
- ゼラチンコーティングされた6ウェルプレートの各ウェル(IL-3:5 ng/mL、SCF:20 ng/mL、IL-7:20 ng/mL、IL-15:10 ng/mL)に、以下のサイトカインを含むNK分化培地3 mLを添加します。
- 6日目に、以下の手順に従って、NK分化培地を含む調製したゼラチンコーティング6ウェルプレートにSpin EBsを直接移します。
- 96ウェルプレートから10 cmディッシュにEBを慎重に移し、10 mLの血清学的ピペットを使用して培地の大部分を除去します。
- 上記のサイトカインを含むNK分化培地3 mLをゼラチンコーティングした6ウェルプレートの各ウェルに加えます。
- 1 mLマイクロピペットを使用して、16〜20 EBを6ウェルプレートの各ウェルに分配します。
注:平均して、1つの96ウェルプレートからのEBを使用して、NK分化プレート用の1つの6ウェルプレートをシードできます。
- 5〜7日ごとに中程度の変更を行います。NK細胞分化の最初の1週間後、培地からIL-3を除外します。
注:14日後、メディアは3〜4日ごとに交換する必要があります。 - 中程度の変化を3〜4週間続けます。浮遊細胞上のフローサイトメトリー24,42によるNK細胞マーカー(CD45+CD56+)の発現を評価します。
- 浮遊細胞の>80%がCD45+CD56+を発現したら、70μmのフィルターに細胞を通して細胞を回収し、凝集物を除去します。
- 100個の灰色を照射したaAPCs34,48で回収したNK細胞を共培養し、IL-2(100 ng/mL)およびIL-15(10 ng/mL)を含むNK増殖培地で培養します。
6. 抗GPC3 CAR iPS細胞由来NK細胞の増殖
注:通常、増殖前であっても、1つの6ウェルプレートから2〜20×10個の6 NK細胞の収量を得ることができます。ダウンストリームアプリケーションのためのNK細胞のさらなる増殖を促進するために、人工抗原提示細胞(aAPC)を使用して>1×109 NK細胞を作製します。
- 41BBLおよび膜結合IL-21(41BBL-mbIL-21)48をaAPCとして発現するK562細胞を改変し、NK細胞の増殖を誘導します。
- aAPCをNK細胞と共培養する前に、aAPCに100グレーを照射し、凍結ストックとして保存してください。
- 6ウェルプレートから浮遊細胞を回収し、50 U/mL IL-2およびIL-15(10 ng/mL;新たに添加する)を添加したNK増殖培地でNK細胞を5 × 105 細胞/mLの密度で培養します。
- 解凍した照射済みaAPCをNK細胞に1:1の割合で添加します。
- 3〜4日ごとに培地を補充し、新鮮なIL-2とIL-15をそれぞれ50 U/mLと10 ng/mLの濃度で加えます。
- CAR iPS細胞由来NK細胞が>3ヶ月間にわたって増殖能力を維持し、細胞生存率と細胞溶解活性の両方を維持することを確認します。
7. GPC3 CAR iPS細胞由来NK細胞の表現型および機能的評価
注:GPC3 CAR iPSC由来NK細胞の特性評価には、その表現型プロファイルと機能活性の包括的な評価が含まれます。
- CD45、CD56、CD94、CD16、NKp30、NKp44、NKp46、NKG2D、DNAM、TRAIL、FasLなどのNK活性化受容体を、抗GPC3 CAR iPS細胞由来NK細胞に発現させるフローサイトメトリー24,42を通じて評価し、CAR NK細胞の活性と成熟状態を決定します(図4)。
- フローサイトメトリーベースのCaspase-3/7アッセイ、CD107a顆粒放出アッセイ、IFN-γおよびTNF-αサイトカイン放出アッセイを用いて、GPC3 CAR iPS細胞由来NK細胞の in vitro 機能活性を評価します。
- Caspase3/7アッセイの場合は、以下の手順に従ってください。
- 標的細胞をカウントし、PBS中の最終濃度5 μMのCell Tracing Fluorescent Dyeで37°Cで15分間プレステイミングします。
- 染色した標的細胞を完全培地で洗浄してから、CAR iPS細胞由来NK細胞と共培養し、さまざまなエフェクター対ターゲット(E:T)比で37°Cで行ってください。
- 3時間および30分の共培養後、Caspase-3/7緑色検出試薬をさらに30分間インキュベーションすると、合計インキュベーション時間が4時間になります。
- 染色の最後の5分間に1 μLの死細胞染色溶液を加え、穏やかに混合します。
- フローサイトメトリー23,41(図5)を使用して染色した細胞を解析します。
- このプロトコールを実施することで、GPC3 CAR iPS細胞由来NK細胞の表現型特性と機能活性を包括的に理解し、その治療可能性をしっかりと評価することができます。
注:スピンEBベースのGPC3 CAR iPS細胞由来NK細胞分化およびGPC3 CAR iPS細胞株を使用したNK増殖条件から>90%のCD45 + CD56+ 細胞を得るには、通常4〜5週間かかります。iPS細胞株の中には、3週間しかかからないものもあれば、もっと長くかかるもの(約4〜5週間)もあります。
8. トラブルシューティングの項目と解決策
注:スピン胚様体(EB)法を用いたiPS細胞由来GPC3 CAR NK細胞の分化、増殖、および機能試験のトラブルシューティングには、いくつかのステップが含まれる場合があります。以下は、発生する可能性のある一般的な問題と推奨される解決策です。
- 一貫性のないEB形成の症状
- EBが小さすぎたり大きすぎたり、不規則な形状になっていないか確認します。
- 一貫性のないEB形成の解決策
- EBの形成に使用する遠心分離機の速度と時間を調整します。5〜10分間で約200〜300 × gの速度が一般的です。
- EB形成を促進するために、適切なUボトムプレートまたは超低付着培養皿が使用されていることを確認してください。
- iPS細胞が均一であり、EB形成に影響を与える可能性のある分化細胞がないことを確認します。
- iPS細胞のNK細胞への分化不良の症状
- NK細胞マーカー(CD56、NKp46など)の発現が低いか確認します。
- EB の形成に失敗していないか、または形成が不十分な EB がないか確認します。
- iPS細胞のNK細胞への分化不良に対する解決策
- 必須成長因子(VEGF、BMP4、Y-27632、FLT3、IL-15、IL-7、SCF、IL-3など)の濃度がEB形成とNK細胞分化に最適であることを確認してください。以前の研究に基づいて濃度を調整します23,34,41。
- iPS細胞の初期播種密度が適切であることを確認してください。通常、スピンEB形成には8000-10,000細胞/100μLの密度が推奨されます。
- 必要なサプリメント(例:血清または無血清代替品、他のサイトカイン)を含む分化培地が正しく処方されていることを確認します。
- EB形成に十分な時間をかけ、NK細胞分化培地に切り替える前に、最低6日から最大12日かかります。
- NK細胞の増殖不良の症状
- 増殖中の細胞収量が制限されていないか確認してください。
- 増殖したNK細胞の生存率が低下していないか確認します。
- NK細胞の増殖不良に対する解決策
- 膨張期にはIL-15とIL-2の濃度を上げます。これにより、NK細胞の増殖を大幅に促進することができます。
- 照射されたaAPCなどのフィーダー細胞を使用して、NK細胞の生存と増殖を改善することを検討してください。
- 細胞密度を定期的にモニタリングし、細胞が過密状態に達する前に細胞を継代して、最適な増殖条件を維持します。
- 最適でない機能テスト結果の症状
- 標的細胞に対する細胞毒性の低下を確認します。
- サイトカイン分泌レベルが低いか確認します(IFN-γ、TNF-αなど)。
- 最適でない機能テスト結果のためのソリューション
- 細胞毒性アッセイにおけるターゲット対エフェクター比を最適化します。10:1の比率から始めて、結果に基づいて調整します。
- 機能アッセイの前に、NK細胞が適切に活性化されていることを確認してください。これには、サイトカインによる事前刺激や、照射されたaAPCとの共培養が含まれる場合があります。
- NK細胞媒介溶解に対する標的細胞株の感度を確認します。既知の機密性の高いターゲットをコントロールとして使用します。
- NK細胞の活性が発現するのに十分な時間を確保するために、機能アッセイの期間を延長します。
- CAR発現レベルが変動する症状
- NK細胞間でCAR発現に一貫性がないか確認します。
- 可変CAR発現レベルのソリューション
- CARトランスフェクション法(ウイルス形質導入、エレクトロポレーションなど)の効率を検証します。必要に応じて、MOI(感染の多重度)またはエレクトロポレーション条件を調整します。
- 適切な選択マーカーを実装して、CAR+ NK細胞を濃縮します。必要に応じて、抗生物質の選択または蛍光マーカーの選別を使用してください。
結果
抗GPC3-CAR iPS細胞由来NK細胞の分化と増殖の模式図
概略図は、ヒト人工多能性幹細胞(iPSC)に由来する抗GPC3-CAR改変NK細胞の in vitro 分化と、GPC3 CARコンストラクトを保有するpiggyBacベクターの概略図を示しています。まず、非改変iPS細胞にGPC3 CAR(キメラ抗原受容体)をコードするpiggyBacベクターをトランスフェクションします。トランスフェクション後、これらのGPC3 CAR発現iPS細胞はクローン増殖し、機能的なCAR-iPS細胞由来NK細胞に分化します。これらの改変されたNK細胞は、その後、 in vitro および in vivo の機能アッセイにかけられ、さまざまな腫瘍細胞株に対する抗腫瘍活性が評価されます(図1)。
WTと抗GPC3-CAR改変iPS細胞のNK分化過程の様々な段階における顕微鏡的解析
GPC3 CAR改変iPS細胞は、抗GPC3-CAR改変iPSC NK細胞に分化します。GPC3 CAR改変iPS細胞からのスピン胚様体(EB)の形成からGPC3-CAR iPSC NK細胞の分化までを、抗GPC3-CAR改変iPS細胞の機能的GPC3 CAR iPSC NK細胞への分化段階を記録する一連の顕微鏡画像として提示されました。未分化野生型(WT)およびGPC3 CAR iPS細胞をmTeSR Plus培地で培養しました(図2A)。次に、これらのWTおよび抗GPC3-CAR iPS細胞を単一細胞に解離し、SCF(40 ng/mL)、BMP4(20 ng/mL)、VEGF(20 ng/mL)、および10 μM ROCK阻害剤を含むSTEMdiff APEL培地で、超低アタッチメントのU-bottom 96ウェルプレートで6日間培養します。スピンEBの形成は、WTおよびGPC3 CAR iPS細胞の両方から6日目に捕捉されました(図2B)。これらのスピンEBは、IL-3(5 ng/mL)、SCF(20 ng/mL)、IL-7(20 ng/mL)、およびIL-15(10 ng/mL)のサイトカインを含むNK分化培地を含む6ウェルプレートにさらに移します。3日目から28日目までのさまざまな時点におけるWT細胞とGPC3 CAR iPS細胞由来NK細胞の分化過程を、顕微鏡で100倍の倍率で撮影しました(図2C)。
WTおよび抗GPC3 CAR iPS細胞由来EBsの表現型(6日目)およびWTおよびGPC3 CAR iPS細胞由来NK細胞(35日目)
WTおよびGPC3 CAR iPS細胞由来細胞は、NK分化プロセスの異なる段階で表現型的に特徴付けられます。パネルAは、6日目に採取したWTおよびGPC3 CAR iPS細胞のスピンEBからの典型的な造血抗原CD34、CD31、CD43、およびCD45の発現をフローサイトメトリーで測定したものです(図3A)。パネルbは、35日目にNK分化培地から採取したWTおよびGPC3 CAR iPSC由来NK細胞の表現型を示し、成熟NK細胞に関連するNK特異的マーカー(CD45、CD56、CD16、およびNKG2D)をフローサイトメトリーで測定しました(図3B)。
拡大WT細胞および抗GPC3-CAR iPS細胞由来NK細胞の表現型
WT細胞と抗GPC3 CAR iPS細胞由来NK細胞の分化後、分化したNK細胞を回収し、IL-2(100 U/mL)およびIL-15(10 ng/mL)を含むGibco NK Xpander培地で照射aAPCを使用して増殖させます。CD94、CD16、NKp30、NKp44、NKp46、NKG2D、CD226、FasL、TRAILなどの増殖したWT細胞および抗GPC3 CAR iPSC NK細胞の活性化受容体を、フローサイトメトリーを用いて測定しました(図4A)。拡大したWT細胞および抗GPC3 CAR iPSC NK細胞でNK活性化表現型を確認した後、フローサイトメトリー(図4B)により、HepG2、SNU-449、SKOV3、CAL27などのさまざまな腫瘍細胞株におけるGPC3抗原の表面発現を評価しました(図4B)。また、増殖した抗GPC3 CAR iPS細胞由来NK細胞のCAR発現をフローサイトメトリー解析により確認しました。
WTおよび抗GPC3 CAR iPS細胞由来NK細胞のHCCおよびその他の腫瘍細胞株に対する機能活性
WT細胞と抗GPC3 CAR iPS細胞由来NK細胞の表現型を確認した後、様々な腫瘍細胞株に対する機能的な抗腫瘍活性を評価しました。HepG2、SNU-449、CAL27、およびSKOV3細胞株に対するWTおよび抗GPC3 CAR iPSC由来NK細胞の細胞傷害活性をさまざまなエフェクター対ターゲット比で評価するために、Caspase3/7ベースの殺傷アッセイを実施しました。この結果は、WT iPSC NK細胞と比較して、抗GPC3 CAR iPS細胞由来NK細胞の抗腫瘍効果が高いことを示しており、CAR特異性やその他のNK活性化メカニズムを介してGPC3発現腫瘍細胞を標的とする可能性を示しています(図5A-D)。

図1:抗GPC3-CAR iPS細胞由来NKの分化・拡大と臨床応用の概略図 (A)前臨床および臨床用抗GPC3 CAR iPS細胞由来NK細胞の作製プロセスの概要。未改変iPS細胞に抗GPC3-CAR遺伝子を保有するpiggyBacベクターをトランスフェクションします。トランスフェクションが成功すると、抗GPC3-CAR発現iPS細胞はクローン的に増殖し、機能的なNK細胞に分化します。これらの抗GPC3 CAR iPS細胞由来NK細胞は、 in vitro および in vivo の両方の機能アッセイにかけられ、さまざまなGPC3発現腫瘍細胞株に対する細胞傷害活性が評価されます39。これらのCAR iPS細胞由来NK細胞の有効性と安全性が検証された後、がん治療の臨床応用のための潜在的な「既製」治療薬としてさらに開発されます。(B)iPS細胞のトランスフェクションに用いる抗GPC3 CARコンストラクトを含むpiggyBacベクターの概略図。(C)iPS細胞由来NK細胞の分化、増殖、回収、および機能アッセイの実施の典型的なタイムライン。 この図の拡大版を表示するには、ここをクリックしてください。
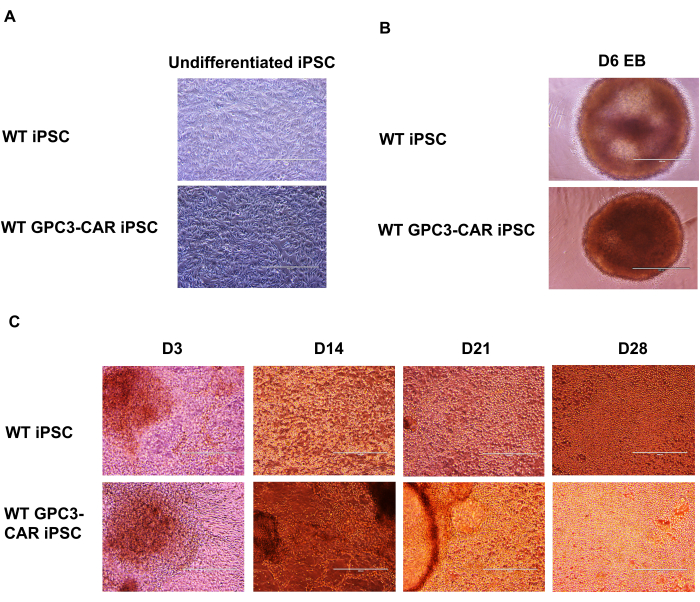
図2:抗GPC3-CAR改変iPS細胞と異なる段階でのCAR iPSC NKの分化の顕微鏡画像(A)mTeSRと培地で培養した未分化WTおよびGPC3 CAR iPSCの微分。(B)6日目のWTおよびGPC3 CAR iPSCスピン胚体。(C)WTおよびGPC3 CAR iPS細胞由来NK細胞のD3からD28までの異なる日での分化。aからc.の100倍の倍率この図の拡大版を表示するには、ここをクリックしてください。
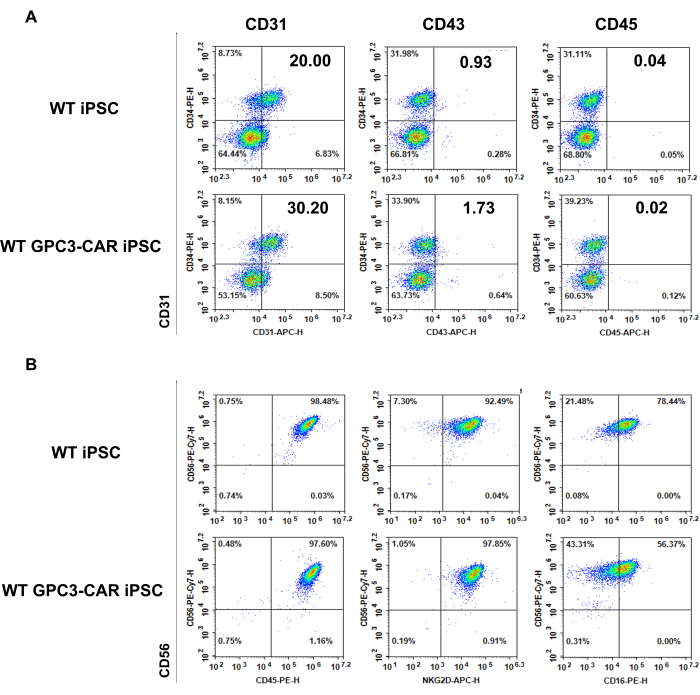
図3:35日目のWTおよび抗GPC3 CAR iPS細胞由来の6日目EBおよび分化したWTおよびGPC3 CAR iPS細胞由来NK細胞の表現型 (A)造血分化の6日目にWTおよびGPC3 CAR iPS細胞に発現した典型的な造血抗原。(B)WTおよびGPC3 CAR iPS細胞由来NK細胞の表現型を35日目にNK分化培地から採取する。 この図の拡大版を表示するには、ここをクリックしてください。

図4:増殖後のWTおよび抗GPC3-CAR iPS細胞由来NK細胞の表現型 (A)WTおよびGPC3 CAR iPS細胞由来NK細胞をGibco NK Xpander培地で増殖させ、フローサイトメトリーを用いてNK成熟マーカーを評価した。(B)HepG2、SNU-449、SKOV3、CAL27などのさまざまな腫瘍細胞株におけるGPC3抗原の表面発現をフローサイトメトリーを用いて測定した。(C)増殖後のGPC3 CAR iPS細胞由来NK細胞のCAR発現を示す代表的なヒストグラム。CAR.コンストラクトにFLAGタグとGFPを組み込んで、フローサイトメトリーでCARを測定します。 この図の拡大版を表示するには、ここをクリックしてください。

図5:WTおよび抗GPC3 CAR iPS細胞由来NK細胞のHCCおよび他の腫瘍細胞株に対する機能活性 (A-D) WTおよびGPC3 CAR iPS細胞由来NK細胞の抗腫瘍活性を、HepG2、SNU-449、CAL27、SKOV3を含むさまざまな腫瘍細胞株に対して試験した。X軸は、HepG2、SNU-449、CAL27、およびSKOV3に対して試験したWTおよび抗GPC3 CAR iPS細胞由来NK細胞のE:T比を表しています。X軸に示されている特定のE:T比は、10:1、5:1、2.5:1、1:1、0.5:1、および0.25:1です。この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
このプロトコールは、標的を絞った「既製」のがん免疫療法を促進することを目的とした、一貫した細胞源からCAR発現iPSC由来NK細胞を生成するための標準化された再現性のあるアプローチを概説しています。複数の前臨床および臨床研究により、移植片対宿主病 (GvHD) やサイトカイン放出症候群 (CRS) などの毒性を最小限に抑えながら、がんの治療における養子 NK 細胞ベースの免疫療法の有効性が示されています23,42、 49,50,51,52,53,54,55,56,57 .このアプローチでは、効率的で明確に定義されたシステムを利用して、均一で十分に特性評価されたCAR iPS細胞由来のNK細胞を作製し、臨床応用のためにスケーリングすることができます。さらに、NKに最適化されたCARを発現するように改変されたiPS細胞由来NK細胞は、典型的なNK細胞の表現型と細胞溶解機能を保持しています23,39,42,50,51,52,58。
CAR iPS細胞由来NK細胞の作製にヒトiPS細胞を用いることは、末梢血から単離された初代NK細胞と比較して、CAR発現を含む遺伝子改変のためのより効率的な方法を提供する31,59,60。CAR発現に加えて、これらの細胞の抗腫瘍活性のさらなる増強は、阻害性受容体の欠失またはサイトカイン発現の導入などの修飾を通じて達成することができる41,39,61。これは、単一の遺伝子改変イベントを通じて達成することができ、現在のCAR-T細胞療法31,62,63に見られるような患者特異的な改変の必要性を排除する。さらに、新規のCAR発現細胞を用いたNK細胞ベースの治療法は、慢性感染症の治療に使用できる可能性がある30,64,65,66,67,68。
このプロトコールは、ヒトiPS細胞を使用してCAR発現NK細胞の均質な集団を作成し、 in vitro および in vivo の抗腫瘍活性を高める可能性を総合的に示しています。NK細胞最適化CARは、シグナル伝達経路の抗原特異的な活性化を可能にし、これらの細胞の機能を改善します。CAR NK細胞の収量と機能を最適化するためには、改変とトラブルシューティングが不可欠です。サイトカインカクテルとタイミングを調整することで、分化効率を向上させることができます。NK細胞におけるCARコンストラクトの安定性と発現を確保するには、トランスフェクション法またはベクター設計の最適化が必要になる場合があります。追加のトラブルシューティングにより、CAR iPS細胞由来NK細胞の形質導入効率、細胞生存率、機能活性の低さなどの問題に対処できるほか、さまざまな培養条件の反復試験や、持続性、細胞毒性、安全性を高めるための遺伝子改変が含まれる場合があります。
私たちの方法の重要性は、標準化されたiPSC源からCAR NK細胞を無限に供給できる可能性があることにあります。iPS細胞由来のCAR NK細胞は、複数の遺伝子編集のための安定したプラットフォームを提供し、変動性を低減し、改変された細胞の一貫性を向上させます。また、この方法により、すぐに使用できる「既製の」NK細胞療法の作成が可能になり、個別の細胞調達と処理の必要性を回避できます。
さらに、このプロトコルには、piggyBacベクターを使用する場合のCAR発現の安定性の維持に一定の制限があります。これは、導入遺伝子統合の一過性の性質により、時間の経過とともに発現レベルが変動する可能性があるためです。さらに、増殖のためにaAPCと特定のサイトカインに依存すると、臨床応用のためのこれらのプロセスのスケーラビリティが複雑になる可能性があります。最後に、piggyBac要素に対する潜在的な免疫応答は、治療現場でリスクをもたらす可能性があります。
結論として、ヒトiPS細胞からのCAR-NK細胞の分化と増殖は、肝細胞がん(HCC)やその他の悪性腫瘍の治療に大きな期待が寄せられています。この革新的なアプローチは、iPS細胞の再生能力とNK細胞の自然免疫特性を活用して、強力で標的を絞ったがん免疫療法を創出します。この分野の進歩により、NK細胞を用いた治療がより効果的で広く利用できるようになる可能性があり、HCCやその他の治療が困難な疾患の患者に新たな希望をもたらす可能性があります。
開示事項
DSKは、Shoreline Biosciencesの共同創設者兼アドバイザーであり、同社に株式を保有しています。DSKはまた、TherabestおよびRedC Bioのコンサルティングも行っており、収入や株式を受け取ります。これらの取り決めの条件は、カリフォルニア大学サンディエゴ校の利益相反ポリシーに従って見直され、承認されています。残りの著者は、競合する利益を宣言しません。
謝辞
Kaufman研究室のメンバーの皆様のご支援、科学的な洞察、議論に感謝いたします。これらの研究は、NIH/NCI助成金U01CA217885、P30CA023100(管理補助)、およびUCSDのSanford Stem Cell Instituteによって支援されました。JT:原稿の執筆と修正。DSK:原稿の査読と編集を行いました。
資料
| Name | Company | Catalog Number | Comments |
| aAPC | Dean A. Lee lab | N/A | |
| a-MEM culture medium | Fisher Scientific | Cat#12634 | |
| APC anti-DYKDDDDK (FLAG Tag) | BD Biosciences | Cat#637308 | |
| APC-anti-human TRA-1-81 | ThermoFisher | 17-8883-42 | |
| APC-CD16 | BD Biosciences | Cat#302015 | |
| APC-CD43 | BD Biosciences | Cat# 560198 | |
| APC-CD45 | BD Biosciences | Cat# 555485 | |
| APC-GPC3 | BD Biosciences | Cat#DB100B | |
| APC-NKG2D | BD Biosciences | Cat# 558071 | |
| CellEvent Caspase-3/7 Green Detection Reagent | Thermo fisher | Cat#C10423 | |
| CellTrace Violet Cell Proliferation Kit | Thermo fisher | Cat#C34571 | Cell tracing fluorescent dye |
| CryoStor solution | Stem Cell Technologies | https://www.stemcell.com/products/cryostor-cs10.html | Cryopreservation medium |
| CTS NK Xpander | Gibco | A5019001 | |
| CTS NK-Xpander Medium | Life Technologies | Cat#A5019001 | |
| DMEM | Gibco | 11965084 | |
| DMEM, high glucose, GlutaMAX Supplement, pyruvate | Gibco | 10569010 | |
| EasySep Human NK Cell Enrichment Kit | StemCell Technologies, Inc. | Cat#19055 | |
| Ethanolamine | Sigma Aldrich | E9508 | |
| Fetal bovine serum | Fisher Scientific | Cat# 10437010 | |
| FITC-CD94 | BD Biosciences | Cat#555888 | |
| GlutaMAX Supplement | Gibco | 35050061 | |
| GolgiPlug | BD Biosciences | Cat#555029 | |
| GolgiStop | BD Biosciences | Cat#554724 | |
| Ham's F-12 Nutrient Mix, GlutaMAX Supplement | Gibco | 31765035 | |
| Horse serum | Fisher Scientific | Cat#16050130 | |
| Human Serum | AB Sigma-Aldrich | Cat#BP2525100 | |
| Human Stem Cell NucleofectorTM Kit | Lonza | Cat# VPH-5012 | |
| Human: HePG2 cells | ATCC | Cat#HB-8065 | |
| Human: HePG2-td-tomato-luc cells | Dan S. Kaufman lab | N/A | |
| Human: iPS cells | Dan S. Kaufman lab | N/A | |
| Human: SNU-449 cells | ATCC | Cat#CRL-2234 | |
| Human: SNU-449-td-tomato-luc cells | Dan S. Kaufman lab | N/A | |
| IncuCyte Caspase-3/7 Green Apoptosis Assay | Essenbioscience | Cat#4440 | |
| L-Ascorbic acid | Sigma Aldrich | A5960 | |
| MP Biomedicals Human Serum, Type AB | MP Biomedicals | ICN2938249 | |
| mTeSR plus | StemCell Technologies, Inc. | 100-0276 | |
| NovoExpress software | ACEA Biosciences | https://www.agilent.com/en/product/research-flow-cytometry/flow-cytometry-software/novocyte-novoexpress-software-1320805 | |
| PE/Cy7 anti-human SSEA-4 Antibody | Biolegend | 330420 | |
| PE-CD16 | BD Biosciences | Cat#560995 | |
| PE-CD226 | BD Biosciences | Cat#559789 | |
| PE-CD34 | BD Biosciences | Cat# 555822 | |
| PE-CD45 | BD Biosciences | Cat# 555483 | |
| PE-CD94 | BD Biosciences | Cat#555888 | |
| PE-cy7-CD56 | BioLegend | Cat# 318318 | |
| PE-FAS Ligand | BD Biosciences | Cat#564261 | |
| PE-NKp30 | BD Biosciences | Cat# 558407 | |
| PE-NKp44 | BD Biosciences | Cat#558563 | |
| PE-NKp46 | BD Biosciences | Cat#331908 | |
| PE-NKp46 | BD Biosciences | Cat#557991 | |
| Peripheral blood buffy coat | San Diego Blood Bank (https://www. sandiegobloodbank.org/) | N/A | |
| PE-TRAIL | BD Biosciences | Cat#565499 | |
| pKT2-mCAG-IRES-GFP-ZEO | Branden Moriarity lab | N/A | |
| pMAX-GFP plasmid | Lonza | N/A | GFP positive control |
| Prism 9 | Graphpad | Version 9 | |
| pSpCas9 | GenScript | PX165 | |
| RBC Lysis Buffer (10x) | Biolegend | Cat#420301 | |
| Recombinant human bFGF basic | R&D Systems | Cat#4114-TC | |
| Recombinant human BMP-4 | PeproTech | Cat#120-05 | |
| Recombinant human FLT-3 Ligand | PeproTech | Cat# 300-19 | |
| Recombinant human IL-15 | PeproTech | Cat# 200-15 | |
| Recombinant human IL-2 | PeproTech | Cat# 200-02 | |
| Recombinant human IL-3 | PeproTech | Cat#200-03 | |
| Recombinant human IL-7 | PeproTech | Cat# 200-07 | |
| Recombinant Human Nodal Protein | R&D Systems | Cat#3218-ND-025 | |
| Recombinant human SCF | PeproTech | Cat# 300-07 | |
| Recombinant Human TGF-β1 | PeproTech | Cat#100-21 | |
| Recombinant human VEGF | PeproTech | Cat# 100-20 | |
| RPMI1640 | Gibco | 11875093 | |
| Sodium selenite | Sigma Aldrich | 214485 | |
| STEMdiff APEL 2 Medium | StemCell Technologies, Inc. | 5270 | EB formation medium |
| STEMdiff APEL2 Medium | StemCell Technologies, Inc. | Cat#05270 | |
| Super piggyBac Transposase expression vector | SBI | Cat#PB210PA-1 | |
| SYTOX AADvanced Dead Cell Stain Kit | ThermoFisher Scientific | S10274, S10349 | Dead cell staining solution kit |
| β-mercaptoethanol | Gibco | 21985023 |
参考文献
- Chan, I. S., Ewald, A. J. The changing role of natural killer cells in cancer metastasis. J Clin Invest. 132 (6), e143762(2022).
- Yu, Y. The function of NK cells in tumor metastasis and NK cell-based immunotherapy. Cancers (Basel). 15 (8), 2323(2023).
- Paul, S., Lal, G. The molecular mechanism of natural killer cells function and its importance in cancer immunotherapy. Front Immunol. 8, 1124(2017).
- Myers, J. A., Miller, J. S. Exploring the NK cell platform for cancer immunotherapy. Nat Rev Clin Oncol. 18 (2), 85-100 (2021).
- Llovet, J. M., et al. Hepatocellular carcinoma. Nat Rev Dis Primers. 7, 6(2021).
- Yang, Y., Xiong, L., Li, M., Jiang, P., Wang, J., Li, C. Advances in radiotherapy and immunity in hepatocellular carcinoma. J Transl Med. 21 (1), 526(2023).
- Rich, N. E., Yopp, A. C., Singal, A. G. Medical management of hepatocellular carcinoma. J Oncol Pract. 13 (6), 356-364 (2017).
- Niu, M., Yi, M., Li, N., Wu, K., Wu, K. Advances of Targeted Therapy for Hepatocellular Carcinoma. Front Oncol. 11, 719896(2021).
- Yu, S. J. Immunotherapy for hepatocellular carcinoma: Recent advances and future targets. Pharmacol Ther. 244, 108387(2023).
- Ntellas, P., Chau, I. Updates on systemic therapy for hepatocellular carcinoma. Am Soc Clin Oncol Educ Book. 44, e430028. 44, e430028(2024).
- Liu, T. -H., Shen, Y. -C., Cheng, A. -L. Immune checkpoint inhibitors for hepatocellular carcinoma - A game changer in treatment landscape. J Formos Med Assoc. 121 (8), 1371-1383 (2022).
- Sun, Q., Hong, Z., Zhang, C., Wang, L., Han, Z., Ma, D. Immune checkpoint therapy for solid tumours: clinical dilemmas and future trends. Signal Transduct Target Ther. 8 (1), 320(2023).
- Huang, A., Yang, X. -R., Chung, W. -Y., Dennison, A. R., Zhou, J. Targeted therapy for hepatocellular carcinoma. Signal Transduct Target Ther. 5 (1), 146(2020).
- Girardi, D. M., Pacífico, J. P. M., Guedes de Amorim, F. P. L., Dos Santos Fernandes, G., Teixeira, M. C., Pereira, A. A. L. Immunotherapy and targeted therapy for hepatocellular carcinoma: A literature review and treatment perspectives. Pharmaceuticals (Basel). 14 (1), 28(2020).
- Laface, C., et al. Targeted therapy for hepatocellular carcinoma: Old and new opportunities. Cancers (Basel). 14 (16), 4028(2022).
- Shyam Sunder, S., Sharma, U. C., Pokharel, S. Adverse effects of tyrosine kinase inhibitors in cancer therapy: pathophysiology, mechanisms and clinical management. Signal Transduct Target Ther. 8 (1), 262(2023).
- Cappell, K. M., Kochenderfer, J. N. Long-term outcomes following CAR T cell therapy: what we know so far. Nat Rev Clin Oncol. 20 (6), 359-371 (2023).
- June, C. H., O'Connor, R. S., Kawalekar, O. U., Ghassemi, S., Milone, M. C. CAR T cell immunotherapy for human cancer. Science. 359 (6382), 1361-1365 (2018).
- Schuster Stephen, J., et al. Chimeric antigen receptor T cells in refractory B-cell lymphomas. N Engl J Med. 377 (26), 2545-2554 (2017).
- Schmidt, D., et al. Engineering CAR-NK cells: how to tune innate killer cells for cancer immunotherapy. Immunother Adv. 2 (1), Itac003(2022).
- Zhang, B., et al. Chimeric antigen receptor-based natural killer cell immunotherapy in cancer: from bench to bedside. Cell Death Dis. 15 (1), 50(2024).
- Wang, K., et al. Reprogramming natural killer cells for cancer therapy. Mol Ther. 32 (9), 2835-2855 (2024).
- Li, Y., Hermanson, D. L., Moriarity, B. S., Kaufman, D. S. Human iPSC-derived natural killer cells engineered with chimeric antigen receptors enhance antitumor activity. Cell Stem Cell. 23 (2), 181-192.e5 (2018).
- Liu, E., Marin, D., et al. Use of CAR-transduced natural killer cells in CD19-positive lymphoid tumors. N Engl J Med. 382 (6), 545-553 (2020).
- Chen, L., Xie, T., Wei, B., Di, D. L. Current progress in CAR-T cell therapy for tumor treatment. Oncol Lett. 24 (4), 358(2022).
- Rafiq, S., Hackett, C. S., Brentjens, R. J. Engineering strategies to overcome the current roadblocks in CAR T cell therapy. Nat Rev Clin Oncol. 17 (3), 147-167 (2020).
- Sterner, R. C., Sterner, R. M. CAR-T cell therapy: current limitations and potential strategies. Blood Cancer J. 11 (4), 69(2021).
- Albinger, N., Hartmann, J., Ullrich, E. Current status and perspective of CAR-T and CAR-NK cell therapy trials in Germany. Gene Ther. 28 (9), 513-527 (2021).
- Dagher, O. K., Posey, A. D. Forks in the road for CAR T and CAR NK cell cancer therapies. Nat Immunol. 24 (12), 1994-2007 (2023).
- Xie, G., Dong, H., Liang, Y., Ham, J. D., Rizwan, R., Chen, J. CAR-NK cells: A promising cellular immunotherapy for cancer. EBioMedicine. 59, 102975(2020).
- Cichocki, F., van der Stegen, S. J. C., Miller, J. S. Engineered and banked iPSCs for advanced NK- and T-cell immunotherapies. Blood. 141 (8), 846-855 (2023).
- Goldenson, B. H., Hor, P., Kaufman, D. S. iPSC-derived natural killer cell therapies - Expansion and targeting. Front Immunol. 13, 841107(2022).
- Zhu, H., Kaufman, D. S. Engineered human pluripotent stem cell-derived natural killer cells: the next frontier for cancer immunotherapy. Blood Sci. 1 (1), 4-11 (2019).
- Knorr, D. A., et al. Clinical-scale derivation of natural killer cells from human pluripotent stem cells for cancer therapy. Stem Cells Transl Med. 2 (4), 274-283 (2013).
- Shimizu, Y., Suzuki, T., Yoshikawa, T., Endo, I., Nakatsura, T. Next-generation cancer immunotherapy targeting Glypican-3. Front Oncol. 9, 248(2019).
- Schepers, E. J., Glaser, K., Zwolshen, H. M., Hartman, S. J., Bondoc, A. J. Structural and functional impact of posttranslational modification of Glypican-3 on liver carcinogenesis. Cancer Res. 83 (12), 1933-1940 (2023).
- Batra, S. A., et al. Glypican-3-specific CAR T cells coexpressing IL15 and IL21 have superior expansion and antitumor activity against hepatocellular carcinoma. Cancer Immunol Res. 8 (3), 309-320 (2020).
- Gao, W., et al. Immunotoxin targeting glypican-3 regresses liver cancer via dual inhibition of Wnt signalling and protein synthesis. Nat Commun. 6, 6536(2015).
- Thangaraj, J. L., Coffey, M., Lopez, E., Kaufman, D. S. Disruption of TGF-β signaling pathway is required to mediate effective killing of hepatocellular carcinoma by human iPSC-derived NK cells. Cell Stem Cell. 31 (9), 1327-1343.e5 (2024).
- Maddineni, S., Silberstein, J. L., Sunwoo, J. B. Emerging NK cell therapies for cancer and the promise of next generation engineering of iPSC-derived NK cells. J Immunother Cancer. 10 (5), e004693(2022).
- Zhu, H., et al. Metabolic reprograming via deletion of CISH in human iPSC-derived NK cells promotes in vivo persistence and enhances antitumor activity. Cell Stem Cell. 27 (2), 224-237.e6 (2020).
- Strati, P., et al. Preliminary results of a phase I trial of FT516, an off-the-shelf natural killer (NK) cell therapy derived from a clonal master induced pluripotent stem cell (iPSC) line expressing high-affinity, non-cleavable CD16 (hnCD16), in patients (pts) with relapsed/refractory (R/R) B-cell lymphoma (BCL). J Clin Oncol. 39, 7541-7541 (2021).
- Hong, D., et al. Preliminary results of an ongoing phase I trial of FT500, a first-in-class, off-the-shelf, induced pluripotent stem cell (iPSC) derived natural killer (NK) cell therapy in advanced solid tumors. J Immunother Cancer. 8 (3), A231-A232 (2020).
- Zah, E., et al. Systematically optimized BCMA/CS1 bispecific CAR-T cells robustly control heterogeneous multiple myeloma. Nat Commun. 11 (1), 2283(2020).
- Ahn, S., et al. Cancer immunotherapy with T cells carrying bispecific receptors that mimic antibodies. Cancer Immunol Res. 7 (5), 773-783 (2019).
- Ludwik, K. A., Telugu, N., Schommer, S., Stachelscheid, H., Diecke, S. ASSURED-optimized CRISPR protocol for knockout/SNP knockin in hiPSCs. STAR Protoc. 4 (3), 102406(2023).
- Zhu, H., Kaufman, D. S. An improved method to produce clinical scale natural killer cells from human pluripotent stem cells. Methods Mol Biol. 2048, 107-119 (2019).
- Denman, C. J., et al. Membrane-bound IL-21 promotes sustained ex vivo proliferation of human natural killer cells. PLoS One. 7 (1), e30264(2012).
- Leivas, A., et al. NKG2D-CAR-transduced natural killer cells efficiently target multiple myeloma. Blood Cancer J. 11 (8), 146(2021).
- Ramdial, J. L., et al. A phase II clinical trial of "Off-the-Shelf" NK cells with allogeneic stem cell transplantation to decrease disease relapse in patients with high-risk myeloid malignancies. Blood. 140 (Supplement 1), 7484-7485 (2022).
- Bachanova, V., et al. Initial clinical activity of FT596, a first-in-class, multi-antigen targeted, off-the-shelf, iPSC-derived CD19 CAR NK cell therapy in relapsed/refractory B-cell lymphoma. Blood. 136, 8(2020).
- Bae, W. K., et al. A phase I study of locoregional high-dose autologous natural killer cell therapy with hepatic arterial infusion chemotherapy in patients with locally advanced hepatocellular carcinoma. Front Immunol. 13, 879452(2022).
- Marin, D., et al. Safety, efficacy and determinants of response of allogeneic CD19-specific CAR-NK cells in CD19+ B cell tumors: a phase 1/2 trial. Nat Med. 30 (3), 772-784 (2024).
- Fehniger, T. A., et al. A phase 1 trial of CNDO-109-activated natural killer cells in patients with high-risk acute myeloid leukemia. Biol Blood Marrow Transplant. 24 (8), 1581-1589 (2018).
- Nguyen, R., et al. A phase II clinical trial of adoptive transfer of haploidentical natural killer cells for consolidation therapy of pediatric acute myeloid leukemia. J Immunother Cancer. 7 (1), 81(2019).
- Miller, J. S., et al. Successful adoptive transfer and in vivo expansion of human haploidentical NK cells in patients with cancer. Blood. 105 (8), 3051-3057 (2005).
- Liu, E., et al. Use of CAR-transduced natural killer cells in CD19-positive lymphoid tumors. N Engl J Med. 382 (6), 545-553 (2020).
- Daher, M., Melo Garcia, L., Li, Y., Rezvani, K. CAR-NK cells: the next wave of cellular therapy for cancer. Clin Transl Immunology. 10 (4), e1274(2021).
- Lin, X., Sun, Y., Dong, X., Liu, Z., Sugimura, R., Xie, G. IPSC-derived CAR-NK cells for cancer immunotherapy. Biomed Pharmacother. 165, 115123(2023).
- Bachanova, V., et al. Safety and efficacy of FT596, a first-in-class, multi-antigen targeted, off-the-shelf, iPSC-derived CD19 CAR NK cell therapy in relapsed/refractory B-cell lymphoma. Blood. 138, 823(2021).
- Saetersmoen, M. L., Hammer, Q., Valamehr, B., Kaufman, D. S., Malmberg, K. J. Off-the-shelf cell therapy with induced pluripotent stem cell-derived natural killer cells. Semin Immunopathol. 41 (1), 59-68 (2019).
- Gerew, A., et al. Deletion of CISH and TGFβR2 in iPSC-derived NK cells promotes high cytotoxicity and enhances in vivo tumor killing. Blood. 138, 2780(2021).
- Goldenson, B. H., Hor, P., Kaufman, D. S. iPSC-derived natural killer cell therapies - Expansion and targeting. Front Immunol. 13, 841107(2022).
- Karvouni, M., Vidal-Manrique, M., Lundqvist, A., Alici, E. Engineered NK cells against cancer and their potential applications beyond. Front Immunol. 13, 825979(2022).
- Ayuso, J. M., et al. Microphysiological model reveals the promise of memory-like natural killer cell immunotherapy for HIV± cancer. Nat Commun. 14 (1), 6681(2023).
- Miller, J. S., et al. Safety and virologic impact of haploidentical NK cells plus interleukin 2 or N-803 in HIV infection. J Infect Dis. 229 (5), 1256-1265 (2024).
- Gutiérrez-Hoya, A., Soto-Cruz, I. NK cell regulation in cervical cancer and strategies for immunotherapy. Cells. 10 (11), 3104(2021).
- Lisco, A., et al. Treatment of relapsing HPV diseases by restored function of natural killer cells. N Engl J Med. 385 (10), 921-929 (2021).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved