Method Article
인간 유도 만능 줄기 세포 유래 키메라 항원 수용체 발현 자연 살해 세포의 발전
요약
여기에서는 다양한 악성 종양에 대한 사멸을 개선하여 인간 iPSC 유래 키메라 항원 수용체(CAR)를 발현하는 자연 살해 세포를 분화하고 확장하는 방법을 제시합니다. 이 프로토콜은 자연살해(NK)에 최적화된 iPSC 유래 CAR-NK 세포의 분화 및 증식과 다양한 종양 세포주에 대한 항종양 활성의 측정을 보여줍니다.
초록
자연살해(NK) 세포는 종양과 바이러스 감염에 대한 신체의 방어에 중요한 역할을 하는 선천면역 세포입니다. NK 세포를 발현하는 인간 유도 만능 줄기 세포(iPSC) 유래 키메라 항원 수용체(CAR)의 생성은 "기성품" 암 면역 요법의 유망한 방법으로 부상했습니다. 여기에서는 강력한 항원 특이적 NK 세포 매개 항종양 활성을 자극하는 것으로 입증된 NKG2D의 막관통 도메인, 2B4 공동 자극 도메인 및 CD3ζ 신호 도메인을 포함하는 NK 세포 최적화 CAR 구조를 활용했습니다. CAR NK 세포 생성에 iPSC를 사용하면 균일한 CAR 발현, 확장성, 재현성 및 임상 적용 가능성 등 여러 가지 이점을 얻을 수 있습니다. 세포 엔지니어링에서 분화에 이르는 이 상세한 단계별 프로토콜은 NK 세포에 최적화된 iPSC 유래 CAR 발현 NK 세포의 생성을 가능하게 하여 항종양 활성이 향상된 표준화되고 표적화된 암 면역 요법을 제공하고 다양한 악성 종양에 대한 유망한 치료 옵션으로서의 잠재력을 강조합니다.
서문
선천면역계에 속하는 림프구의 일종인 NK 세포는 종양과 바이러스에 감염된 세포에 대한 조기 방어에 중추적인 역할을 합니다 1,2,3. T 세포와 달리 NK 세포는 주요 조직적합성 복합체(MHC) 분자를 통한 항원 제시가 필요하지 않습니다. 대신, NK 세포는 그들의 활동을 조절하는 활성화 및 억제 수용체의 레퍼토리를 가지고 있습니다3. NK 세포 매개 세포독성 활성은 퍼포린과 그랜자임의 방출, 사멸 수용체의 관여, IFN-γ 및 TNF-α와 같은 전염증성 사이토카인의 생성 등 다양한 메커니즘을 활용합니다. 이러한 독특한 작용 방식은 NK 세포를 암 면역 요법의 매력적인 후보로 자리매김하게 하며, 특히 면역 회피가 중요한 장애물인 고형암 치료에서 그렇습니다 1,2,3,4.
간세포암종(Hepatocellular carcinoma, HCC)은 전 세계적으로 가장 흔하고 치명적인 형태의 간암 중 하나이다5. 수술, 화학요법, 방사선 요법을 포함한 전통적인 치료법은 일반적으로 임상적 효과가 제한적이고 재발률이 높다6,7. 최근 면역요법과 표적 요법의 발전은 간세포암 치료에 상당한 영향을 미쳤다 8,9. 니볼루맙(nivolumab) 및 펨브롤리주맙(pembrolizumab)과 같은 면역관문억제제는 암세포에 대한 면역세포 반응을 향상시킴으로써 유망한 결과를 보여주었습니다10,11. 이러한 치료법은 일부 환자의 생존율을 높이고 삶의 질을 향상시키는 결과를 가져왔습니다. 그러나 면역 관련 부작용을 유발할 수도 있으며, 이로 인해 특정 환자에서는 사용이 제한될 수 있다12. 소라페닙(sorafenib) 및 렌바티닙(lenvatinib)과 같은 표적 치료제는 암세포 성장과 혈관신생을 촉진하는 경로를 특이적으로 억제한다13. 이러한 치료법은 질병의 진행을 조절하고 생존을 연장하는 효능이 있는 것으로 알려져 있다 8,14. 그럼에도 불구하고, 표적 치료에 대한 내성이 전형적으로 발생하며, 치료의 부작용이 흔하다 15,16. 암 면역 치료 전략의 유망한 방법 중 키메라 항원 수용체(CAR) CAR T 세포의 출현은 암 치료, 특히 림프종 및 다발성 골수종과 같은 혈액 악성 종양 치료에 혁명을 일으켰습니다 17,18,19.
NK 세포의 타고난 세포독성 활성과 CAR 기술의 정밀 표적화를 결합한 CAR 발현 NK 세포는 HCC 20,21,22,23,24와 같은 고형 종양에 대한 혁신적이고 잠재적으로 변형적인 접근 방식을 나타냅니다. CAR 엔지니어링 세포는 정상 조직을 보존하면서 표적 항원을 발현하는 종양 세포를 특이적으로 인식하고 사멸시킬 수 있으므로 기존 치료법과 관련된 off-target 효과의 위험을 줄일 수 있습니다 25,26,27. 말초혈액 또는 제대혈에서 분리된 NK 세포에서 생산된 CAR-NK 세포는 일반적으로 NK 세포를 세포 외 항원 인식 도메인, 막관통 도메인 및 활성화 및 증식에 필요한 세포 내 신호 도메인으로 구성된 CAR 구조체로 형질주입하여 생성됩니다 28,29,30.
임상 치료를 위해 기능적으로 조작된 NK 세포의 안정적이고 균질한 집단을 엔지니어링하는 문제는 유도 만능 줄기 세포(iPSC)를 사용하여 해결할 수 있습니다31,32. NK 세포에 최적화된 CAR을 이용한 인간 iPSC의 엔지니어링은 향상된 NK 세포 활성화 및 증식 신호를 제공하고, 표준화된 "기성품"으로 CAR을 발현하는 NK 세포의 무궁무진하고 균질한 집단을 제공합니다20,33. 이 프로토콜에서 CAR 발현 iPSC 유래 NK 세포를 생성하기 위한 iPSC의 유전자 변형에는 이전 연구에서 설명한 바와 같이 NK 세포 유래 막관통 및 신호 전달 도메인(NKG2D-2B4-CD3ζ) 및 항글리피칸-3(GPC3) scFv를 포함하는 NK 세포 최적화 CAR 구축물을 통합하는 것이 포함됩니다23. 그런 다음 유전자 조작 iPSC는 이전에 개발된 NK 세포 분화 프로토콜을 사용하여 분화 및 확장됩니다34. 이러한 조작된 CAR 발현 iPSC 유래 NK 세포는 간세포암 및 기타 악성 종양에서 과발현되는 글리피칸 3(GPC3)과 같은 특정 종양 관련 항원을 발현하는 HCC 및 기타 종양 세포를 인식하고 제거할 수 있는 능력을 가지고 있습니다 35,36,37,38.
다양한 암 치료를 위한 iPSC 유래 CAR-NK 세포의 적용은 중요한 가능성을 가지고 있습니다 30,39,40; 이러한 iPSC 유래 CAR-NK 세포 중 다수는 현재 임상 시험 41,42,43 단계에 있습니다. 이 분야의 발전을 촉진하기 위해 이 프로토콜은 세포 엔지니어링에서 성숙한 NK 세포로의 분화 및 체외 확장에 이르기까지 엔지니어링된 iPSC 유래 CAR-NK 세포의 효율적인 생산을 가능하게 합니다.
프로토콜
1. 인간 iPSC의 피더 없는 배양 방법
참고: 앞서 설명한 바와 같이 동결된 미분화 인간 iPSC를 해동하고 Matrigel(이하 기저막 매트릭스[BMM]) 사전 코팅된 플레이트에서 mTeSR 1-plus를 사용하여 배양합니다23,34. 엔지니어링 전과 후에 iPSC가 구분되지 않도록 하는 것이 매우 중요합니다. 갓 해동한 iPSC는 인간 만능 줄기세포와 일치하는 다능성 형태를 나타내기 위해 약 2-3 계대 동안 배양해야 합니다. 다음 지침은 6웰 플레이트의 한 웰에서 세포를 전달하기 위해 사용됩니다.
- iPSC를 전달하기 전에 새로운 6웰 플레이트를 1x BMM(1mL/웰)으로 코팅하고 사용하기 전에 37°C 인큐베이터에서 2-4시간 동안 배양합니다.
- 1x 가용화 된 BMM을 준비하십시오.
- 5mL의 BMM 바이알을 4°C에서 밤새 해동합니다.
- 사전 냉각된 팁을 사용하여 BMM을 사전 냉각된 마이크로 원심분리기 튜브에 빠르게 분취합니다.
- -80 °C에서 최대 6 개월 동안 보관하십시오.
- 1x BMM 작업 용액을 준비하려면 1개의 BMM 부분 표본을 1:100 비율로 차가운 DMEM/F12 배지에 재현탁합니다. 1x BMM 작업 솔루션은 -4°C에서 2주 동안 보관할 수 있습니다.
- 표면을 덮을 수 있을 만큼 충분한 부피로 플레이트를 코팅합니다(예: 6웰 플레이트의 웰당 1mL 사용).
- 사용하기 전에 37 ° C 인큐베이터에서 2-4 시간 동안 배양하십시오.
- 냉동 iPSC 바이알(일반적으로 1 × 106 cells/바이알)을 37°C의 수조에서 해동합니다.
- 5mL의 예열된 mTeSR Plus 배지가 들어 있는 15mL 코니컬 튜브에 해동된 iPSC를 점진적으로 첨가하고, 세포 충격을 최소화하기 위해 한 방울씩 첨가하여 세포가 적응할 수 있도록 합니다.
- 300 × g 에서 5분 동안 세포를 원심분리합니다.
- 상층액을 흡인하고 PBS 5mL로 세포를 한 번 세척합니다.
- mTeSR Plus 배지에 세포를 재현탁하고 BMM 사전 코팅된 6-well 플레이트에서 약 200,000 cells/3 mL/well의 밀도로 플레이트화합니다.
- 계대 iPSC.
- iPSC가 70-80% 포화도에 도달하면 배지를 흡인하고 37°C(6웰 플레이트의 1mL/웰)에서 5분 동안 TrypLE로 단일 세포 계대요법을 수행합니다.
- 5분 후 1x PBS 3mL를 첨가하여 해리 반응을 중지하고 PBS 3mL로 세포를 한 번 세척합니다.
- 300 × g 에서 5분 동안 세포를 원심분리합니다. 세척 후 mTeSR Plus 배지에 단일 세포 iPSC를 재현탁한 다음 BMM이 사전 코팅된 6웰 플레이트에 플레이트합니다.
참고: 필요한 총 배지 부피는 6웰 플레이트에서 3mL/웰입니다. 배지는 2-3일마다 교체해야 하며, iPSC를 엔지니어링하기 전에 세포가 최소 1-2 계대에 대해 70-80% 융합될 때 1.8단계를 반복해야 합니다.
- iPSC의 다능성을 정기적으로 확인합니다. iPSC를 Allophycocyanin (APC) conjugated TRA-1-81 및 PE-Cy7 conjugated stage specific embryonic antigen-4 (SSEA-4) 항체로 얼음에서 30분 동안 염색한 다음 앞서 설명한 대로 유세포 분석을 사용하여 분석합니다23,41.
참고: 이 실험에 사용된 iPSC는 TrypLE에 맞게 조정되었습니다. 이전에 TrypLE로 계대측정된 적이 없는 iPSC는 일반적으로 TrypLE에 완전히 적응하기 위해 8-10개의 계대가 필요하며, 이는 고품질 스핀 배아체(EB)의 생산을 보장합니다.
2. piggyBac 벡터를 사용하여 anti-GPC3 CAR을 발현하는 인간 iPSC 엔지니어링
- 새 6웰 플레이트를 BMM으로 코팅하고 37°C에서 최소 1시간 동안 배양합니다(액체가 건조되지 않는 한 더 길어질 수 있음).
- 37°C에서 10μM Rho 관련 코일 함유 단백질 키나아제(ROCK) 억제제(Y-27632)를 사용한 예열 mTeSR Plus(멸균 증류수에서 준비된 1mM 스톡).
- 핵 펙션 시스템을 켭니다. X 단위를 선택한 다음 transfection할 웰의 위치를 선택합니다. P3 솔루션을 선택하고 코드(CA-137)를 수동으로 입력합니다.
- 1mL의 TrypLE를 사용하여 70-80% 포화도에서 iPSC를 수확하고 37°C에서 5분 동안 배양합니다. 현미경 아래를 확인하여 해리를 확인하십시오.
- 4-6회 피펫팅하여 단일 세포 현탁액을 얻은 다음 PBS 5mL와 펠렛으로 300 × g 에서 5분 동안 중화합니다.
- 세포를 한 번 더 부드럽게 세척하여 TrypLE의 모든 흔적을 제거합니다.
- Rock-Inhibitor를 사용하여 1mL의 mTeSR Plus를 재현탁하고 세포를 계수합니다.
- anti-GPC3 CAR iPSC를 생성하려면 마이크로 원심분리기 튜브에서 transfection당 1 × 106 세포를 사용하고 300 × g 에서 5분 동안 스핀다운합니다.
- 회전하는 동안 1.5mL 마이크로 원심분리 튜브에서 CAR 발현 transposon DNA와 super PiggyBac transposase 발현 벡터를 3:1의 비율로 결합합니다(예: transposon을 포함하는 plasmid 3μg과 transposase plasmid 1μg).
- 0.5 μL의 1 mg/mL 용액을 사용하는 녹색 형광 단백질(GFP) 양성 대조군(Table of Materials)과 GFP 발현을 확인하기 위한 비형질 주입 음성 대조군을 포함합니다.
- nucleofection kit에 제공된 보충제를 사용하여 20μL의 실온(RT) P3 Nucleofector 용액에 세포 펠릿을 조심스럽게 재현탁합니다. 그런 다음 이 혼합물을 플라스미드 DNA가 들어 있는 1.5mL 마이크로 원심분리 튜브에 첨가하면 최종 부피가 약 22-25μL가 됩니다.
참고: GPC3 CAR 플라스미드 또는 GFP 대조군 플라스미드를 세포에 첨가하기 전에 P3 Nucleofector 용액에 transfection할 모든 iPSC를 재현탁합니다. - 세포/DNA 현탁액을 20μL 16웰 스트립으로 옮깁니다. 샘플이 거품 없이 큐벳 바닥을 덮습니다.
- 벤치 상단의 16웰 스트립을 부드럽게 두드려 기포를 제거하고 하단의 세포를 가라앉힙니다.
- iPSC와 CAR DNA 혼합물이 포함된 16웰 스트립을 Nucleofection 시스템에 배치하고 프로그램 CA-137, P3 용액을 선택한 다음 프로그램을 시작합니다. 이 프로그램은 1초 후에 끝나고 녹색 체크 표시가 표시됩니다.
- ROCK-Inhibitor 배지가 포함된 예열된 mTeSR Plus 80μL를 웰에 추가하고 BMM으로 코팅된 6웰 플레이트(웰당 최종 부피 1mL)로 세포를 조심스럽게 옮깁니다.
- 형광 현미경으로 4시간 후 세포에서 GFP 발현을 간략하게 확인하여 transfection의 성공률을 확인합니다.
- GFP 발현을 확인하기 위해 유세포 분석23,41을 사용하여 transfection 후 24시간 동안 transfection 효율을 평가하기 위해 GFP 발현에 대한 iPSC를 스크리닝합니다.
- 37°C에서 4일 동안 배양하고 약물 선택을 진행하기 전에 필요에 따라 배지를 변경합니다.
참고: 각 nucleofection은 반응당 0.2-2 x 106 iPSC를 필요로 합니다. 반응 횟수에 따라 24웰 플레이트 또는 6웰 플레이트를 사용할 수 있습니다.
3. GPC3-CAR iPSC의 클론 선택 및 다능성 확인
- 형질주입된 iPSC에 대해 일련의 zeocin selection(1:10,000)을 수행하여 iPSC를 발현하는 GPC3-CAR을 클론학적으로 선택합니다.
- transfection 효율을 확인하려면 형광 현미경 및 유세포 분석23,41을 사용하여 GFP 발현을 측정하십시오.
참고: CAR 구조체는 iPSC 단계 및 NK 세포 분화 후 CAR 발현을 평가하기 위해 FLAG 태그44,45와 통합됩니다. - transfection된 CAR iPSC가 최적의 CAR 유전자 및 GFP 발현을 달성할 때까지 약물 선별 하에 유지합니다.
- 균일한 GFP 및 CAR 발현을 보장하려면 약물 선택 기간을 2-3주 연장합니다.
- 유세포분석을 사용하여 GFP 또는 CAR 발현을 기반으로 세포 분류를 수행하여 클론으로 선택된 iPSC의 동질적인 집단을 얻습니다23.
- 여기에 사용된 CAR 구문에는 제오신 약물 선택 마커가 포함되어 있습니다. 배양 배지에 제오신(zeocin, 50μg/mL)을 첨가하여 GPC3 CAR 유전자 형질주입 세포를 선택합니다.
- zeocin 선택 후 GPC3 CAR 유전자 transfection된 iPSC를 희석하고 96웰 플레이트에 플레이트화하여 웰당 약 1개의 세포를 만듭니다. 이는 연속 희석을 통해 또는 세포 분류기를 사용하여 수행할 수 있습니다.
참고: FACS(Fluorescence-activated cell sorting)를 사용하여 CAR 구조체에 연결된 형광 마커의 발현을 기반으로 단일 transfection된 세포를 분리합니다. - 단일 세포가 96웰 플레이트의 콜로니로 확장되도록 합니다.
- 3-4일마다 한 번씩 세포에 신선한 배양 배지를 공급하고 웰의 군집 성장을 모니터링합니다.
- CAR 발현을 위해 군체를 스크리닝합니다. 이는 중합효소연쇄반응(polymerase chain reaction, PCR), 정량적 중합효소연쇄반응(quantitative polymerase chain reaction, qPCR) 또는 웨스턴 블로팅(western blotting)에 의해 수행될 수 있으며, 이를 통해 CAR 구조체23,47의 존재를 확인할 수 있다.
- 또는 유세포 분석23,41을 사용하여 CAR 단백질의 표면 발현을 검출합니다.
참고: 이 연구에서 CAR 발현은 유세포 분석을 사용하여 FLAG 태그 발현으로 정량화되었습니다. - 또한 핵형 분석을 수행하여 염색체 이상을 식별합니다.
참고: 이 작업은 Wicell(wicell.org) 또는 Thermo Fisher Scientific(thermofisher.com)과 같은 타사 조직에서 수행할 수 있습니다. - CAR 양성 클론이 이상 없이 확인되면 6웰 플레이트 및 T75 플라스크와 같은 더 큰 배양 용기에서 이러한 클론을 확장합니다.
- 향후 사용을 위해 여러 바이알에서 동결 보존 배지를 사용하여 클론으로 확장된 CAR iPSC를 동결 보존합니다.
참고: 이 단계에서는 다음 사항을 권장합니다: (i) 분화를 방지하기 위해 iPSC에 대한 최적의 배양 조건을 유지합니다. (ii) 약물 선택 후 iPSC에서 CAR 및 GFP 발현의 균일한 집단을 달성하는 데 1-4주가 소요됩니다. (iii) CAR 발현 및 다능성 마커의 안정성에 대해 세포를 계속 모니터링합니다. (iv) 심사 및 검증 단계에서 적절한 통제를 사용합니다. (v) 클론 선택 및 확장 후, CAR 발현 iPSC에서 TRA-1-81 및 SSEA-4 발현을 평가하여 다능성을 검증합니다.
4. 스핀 배아체(EB) 형성에 의한 조작된 CAR iPSC로부터 조혈전구세포의 생성
참고: 스핀 EB 또는 조혈 오가노이드 프로토콜은 조혈 전구 세포를 생산하는 데 사용됩니다23,34. EB 내의 세포는 림프구 발달을 지원하기 위해 기질 세포로 분화합니다38, 따라서 OP9와 같은 이종 유래 기질 세포의 필요성을 제거합니다 23,34,48. 다음은 EB 형성을 위해 6웰 플레이트의 단일 웰에서 세포를 수집하는 지침입니다.
- 스핀 EB 형성 2일 전 6-well BMM 사전 코팅된 플레이트의 ~200,000 cells/well 통과. 스핀 EB 설정 당일에 70-80% 합류점에 도달하는지 확인합니다. 일반적으로 6웰 플레이트 1웰은 스핀 EB 플레이트 2개에 충분합니다.
- 배양 배지를 제거하고 37°C 5분에서 예열된 TrypLE Select 1mL로 배양하여 세포를 분리합니다.
- 1mL 마이크로피펫을 사용하여 세포 응집체를 단일 세포 현탁액으로 조심스럽게 해리하고 세포를 15mL 원뿔형 튜브로 옮깁니다. 해리 반응을 멈추기 위해 1x PBS 3mL를 첨가하고 PBS 3mL로 세포를 한 번 세척합니다.
- mTesR Plus 배지에서 세포를 재현탁하고 70μM 세포 스트레이너를 통해 필터링하여 응집체를 제거합니다.
- 세포를 스핀다운하여 상층액을 제거하고 5mL PBS로 다시 한 번 세포를 세척합니다. 그런 다음 1mL의 STEMdiff APEL 배지(EB 형성 배지)에 세포를 재현탁합니다.
- 다음 사이토카인(SCF: 40 ng/mL, BMP4: 20 ng/mL, VEGF: 20 ng/mL)과 10 μM ROCK 억제제를 함유한 EB 형성 배지를 사용하여 세포를 계수하고 적절한 밀도로 희석합니다.
- 96웰 플레이트에 100μL의 배지(100,000 cells/mL)에 3000-10000 cells/well을 시딩합니다.
참고: EB 형성에 사용되는 세포의 수는 iPSC 라인에 따라 다를 수 있습니다. 96웰 플레이트에서 웰당 3,000개에서 10,000개 사이의 세포를 테스트하는 것이 좋습니다. - 멀티채널 피펫을 사용하여 100 μL/well에서 96-well 플레이트에 cell suspension을 로드합니다.
참고: 더 나은 배아체(EB) 형성을 위해 초저 부착 둥근 바닥 96웰 플레이트를 사용하는 것이 좋습니다. - 96웰 플레이트를 300 × g 에서 5분 동안 원심분리한 다음 37°C에서 5% CO2 로 플레이트를 6일 동안 배양합니다.
참고: 예비 연구에 따르면 이 연구에서 CAR iPSC 라인에 대해 >30% CD34+ 세포를 생성하기에 6일이 충분한 것으로 나타났습니다. - 유세포 분석으로 EB 품질 확인23,41.
- EB 해리를 위해 0.4% 치킨 세럼(4mL 트립신의 경우 16μL)과 함께 예열된 0.25% 트립신 4mL를 준비합니다.
- 10-30 EB를 15 mL 코니컬 튜브로 옮깁니다.
- 트립신/치킨 세럼 용액을 EB에 첨가하고 EB의 완전한 해리를 보장하기 위해 30초마다 볼텍싱하여 10분 동안 수조에서 배양합니다.
- 트립신화된 EB를 피펫팅합니다. EBS를 완전히 분리하기 위해 위아래로 여러 번 혼합합니다.
- 1x PBS 5mL를 첨가하여 트립신화 과정을 중지합니다.
- 새 원뿔형 튜브의 70μm 세포 스트레이너를 통해 세포 용액을 여과합니다.
- 300 x g 에서 5분 동안 세포를 원심분리합니다.
- 상층액을 흡인하고 3-5mL의 새로운 배지에 재현탁합니다.
- 세포를 계수하고 CD34, CD31, CD43 및 CD45와 같은 일반적인 EB 마커로 염색하고 유세포 분석23,41을 사용하여 분석합니다(그림 3).
- 100 μL의 흐름 완충액에 해리된 EB 단일 세포를 포함하는 각 튜브에 제조업체 지침에 따라 권장되는 양의 항체를 추가하고 30분 동안 얼음에서 배양합니다39,41.
- 배양 후 flow buffer로 세포를 2회 세척하고 SYTOX blue live/dead stain을 첨가한 후 유세포 분석을 사용하여 분석합니다.
참고: 일반적으로 이 연구에 사용된 iPSC를 사용하여 6일째에 해리된 Spin 배아체의 총 모집단에서 >30% CD34+ 세포를 얻지만, 이 비율은 iPSC 소스 및 배양 조건에 따라 달라질 수 있습니다.
5. Spin EBs에서 GPC3 CAR iPSC 유래 NK 세포의 분화
참고: GPC3 CAR 발현 Spin EB는 2% 젤라틴으로 코팅되거나 코팅되지 않은 24웰 플레이트 또는 6웰 플레이트로 이송될 수 있습니다. 매체 변화의 경우 6웰 플레이트가 더 적합하며 2% 젤라틴 코팅은 EB 부착력을 향상시킵니다.
- 아래 단계에 따라 젤라틴으로 코팅된 6웰 플레이트를 준비합니다.
- 조직 배양 등급의 물에 젤라틴을 용해하여 2%(w/v) 젤라틴 용액을 준비합니다.
- 121°C, 15psi에서 30분 동안 고압증기멸균하여 용액을 멸균합니다.
- 각 웰의 표면을 cm2 당 5-10 μL의 젤라틴 용액으로 코팅합니다 (6 웰 플레이트의 웰 당 ~ 1 mL).
- 사용하기 전에 37 ° C에서 2-4 시간 동안 플레이트를 배양하십시오. 배양 후 EB 전달을 진행하기 전에 남아 있는 젤라틴 용액을 흡입합니다.
- NK 세포 분화 배지 준비: 56.6% DMEM+ GlutaMAX-I, 28.3% F12+ GlutaMAX-I, 15% 열비활성화 human AB 혈청, 1% P/S, 2mM L-글루타민, 1μM β-메르캅토에탄올, 5ng/mL 아셀렌산나트륨, 50μM 에탄올아민 및 20mg/L 아스코르브산을 추가합니다. 어두운 곳에서 4 °C에서 보관하십시오.
- 젤라틴으로 코팅된 6-웰 플레이트의 각 웰에 다음 사이토카인을 함유한 NK 분화 배지 3mL를 추가합니다(IL-3: 5ng/mL, SCF: 20ng/mL, IL-7: 20ng/mL 및 IL-15: 10ng/mL).
- 6일차에 아래 단계에 따라 NK 분화 배지를 함유한 준비된 젤라틴 코팅된 6-well plates에 Spin EBs를 직접 옮깁니다.
- 10mL 혈청학 피펫을 사용하여 대부분의 배지를 제거하면서 96웰 플레이트에서 10cm 접시로 EB를 조심스럽게 옮깁니다.
- 위의 사이토카인을 함유하는 NK 분화 배지 3mL를 젤라틴으로 코팅된 6웰 플레이트의 각 웰에 추가합니다.
- 1mL 마이크로피펫을 사용하여 16-20EB를 6웰 플레이트의 각 웰에 분배합니다.
참고: 평균적으로 단일 96웰 플레이트의 EB를 사용하여 NK 분화 플레이트를 위한 6웰 플레이트 1개를 시딩할 수 있습니다.
- 5-7일마다 중간 정도의 변화를 수행합니다. NK 세포 분화 첫 주가 지나면 배지에서 IL-3를 제외합니다.
참고: 14일 후에는 3-4일마다 매체를 교체해야 합니다. - 3-4주 동안 중간 정도의 변화를 계속합니다. 현탁 세포에서 유세포 분석24,42를 통해 NK 세포 마커(CD45+CD56+)의 발현을 평가합니다.
- 부유 세포의 >80%가 CD45+CD56+를 발현하면 70μm 필터를 통과시켜 세포를 채취하여 덩어리를 제거합니다.
- 100개의 회색 방사선 조사 aAPC34,48과 함께 수확된 NK 세포를 공동 배양하고 IL-2(100ng/mL) 및 IL-15(10ng/mL)를 포함하는 NK 확장 배지에서 배양합니다.
6. anti-GPC3 CAR iPSC 유래 NK cell의 증식
참고: 일반적으로 2-20 × 106 NK 셀의 수율은 팽창 전에도 단일 6-well 플레이트에서 얻을 수 있습니다. 다운스트림 애플리케이션을 위한 NK 세포의 추가 확장을 촉진하기 위해 인공 항원 제시 세포(aAPC)를 사용하여 >1 × 109 NK 세포를 생성합니다.
- 41BBL을 발현하는 엔지니어링된 K562 세포와 막결합 IL-21(41BBL-mbIL-21)48을 aAPC로 활용하여 NK 세포 증식을 유도합니다.
- NK 세포와 aAPC를 공동 배양하기 전에 aAPC에 100개의 회색을 조사하고 동결 스톡으로 보존합니다.
- 6-well plate에서 현탁 세포를 채취하고 50 U/mL IL-2 및 IL-15(10 ng/mL, 새로 첨가)가 보충된 NK 확장 배지에서 5 × 105 cells/mL의 밀도로 NK 세포를 배양합니다.
- 방사선 조사된 해동된 aAPC를 NK 세포에 1:1 비율로 첨가합니다.
- 3-4일마다 배양 배지를 보충하고 각각 50 U/mL 및 10 ng/mL 농도의 새로운 IL-2 및 IL-15를 첨가합니다.
- CAR iPSC 유래 NK 세포가 >3개월 동안 확장 능력을 유지하여 세포 생존력과 세포 용해 활성을 모두 유지하는지 확인합니다.
7. GPC3 CAR iPSC 유래 NK 세포의 표현형 및 기능적 특성화
참고: GPC3 CAR iPSC 유래 NK 세포의 특성화에는 표현형 프로필 및 기능 활성에 대한 포괄적인 평가가 포함됩니다.
- 유세포분석24,42를 통해 CD45, CD56, CD94, CD16, NKp30, NKp44, NKp46, NKG2D, DNAM, TRAIL 및 FasL을 포함한 NK 활성화 수용체를 항-GPC3 CAR iPSC 유래 NK 세포의 발현을 평가하여 CAR NK 세포 활성과 성숙 상태를 확인합니다(그림 4).
- 다양한 종양 표적에 대한 유세포 분석 기반 Caspase-3/7 분석, CD107a 과립 방출 분석, IFN-γ 및 TNF-α 사이토카인 방출 분석을 사용하여 GPC3 CAR iPSC 유래 NK 세포의 체외 기능 활성을 평가합니다.
- Caspase3/7 분석의 경우 아래 단계를 따르십시오.
- 표적 세포를 계수하고 37°C에서 15분 동안 PBS에서 최종 농도 5μM의 세포 추적 형광 염료로 사전 염색합니다.
- 37°C에서 다양한 effector 대 target(E:T) 비율로 CAR iPSC 유래 NK 세포와 공동 배양하기 전에 염색된 표적 세포를 완전한 배양 배지에서 세척합니다.
- 3시간 30분의 공동 배양 후 Caspase-3/7 녹색 검출 시약을 추가로 30분 동안 배양하여 총 배양 시간을 4시간으로 만듭니다.
- 염색의 마지막 5분 동안 1μL의 사세포 염색 용액을 추가하고 부드럽게 혼합합니다.
- 유세포분석법23,41(그림 5)을 사용하여 염색된 세포를 분석합니다.
- 이 프로토콜을 구현하여 GPC3 CAR iPSC 유래 NK 세포의 표현형 특성 및 기능적 활성에 대한 포괄적인 이해를 보장하여 치료 가능성에 대한 강력한 평가를 가능하게 합니다.
참고: GPC3 CAR iPSC 라인을 사용하여 spin EB 기반 GPC3 CAR iPSC 유래 NK 세포 분화 및 NK 확장 조건에서 >90% CD45+CD56+ 세포를 얻는 데 일반적으로 4-5주가 소요됩니다. 일부 iPSC 세포주는 3주만 걸릴 수 있으며 일부 세포주는 더 오래 걸릴 수 있습니다(약 4-5주).
8. 문제 해결 항목 및 해결 방법
참고: 스핀 배아체(EB) 방법을 사용하여 iPSC 유래 GPC3 CAR NK 세포의 분화, 확장 및 기능 테스트 문제를 해결하려면 여러 단계를 거쳐야 할 수 있습니다. 다음은 발생할 수 있는 몇 가지 일반적인 문제와 제안된 솔루션입니다.
- 일관되지 않은 EB 형성의 증상
- EB가 너무 작거나 너무 커서 불규칙한 모양인지 확인하십시오.
- 일관되지 않은 EB 형성에 대한 솔루션
- EB를 형성하는 데 사용되는 원심분리기 속도와 지속 시간을 조정합니다. 5-10분 동안 약 200-300×g의 속도가 일반적입니다.
- EB 형성을 촉진하기 위해 적절한 U-바닥 플레이트 또는 매우 낮은 부착성 배양 접시가 사용되는지 확인하십시오.
- iPSC가 균질하고 EB 형성에 영향을 줄 수 있는 분화된 세포가 없는지 확인합니다.
- iPSC와 NK 세포의 분화가 잘 이루어지지 않는 증상
- NK 세포 마커(예: CD56, NKp46)의 발현이 낮은지 확인합니다.
- EB를 형성하지 못했거나 잘못 형성된 EB를 확인합니다.
- iPSC와 NK 세포의 분화 불량에 대한 해결책
- 필수 성장 인자(예: VEGF, BMP4, Y-27632, FLT3, IL-15, IL-7, SCF 및 IL-3)의 농도가 EB 형성 및 NK 세포 분화에 최적인지 확인합니다. 이전 연구를 기반으로 농도를 조정하십시오 23,34,41.
- iPSC의 초기 시딩 밀도가 적절한지 확인합니다. 일반적으로 스핀 EB 형성에는 8000-10,000 cells/100 μL의 밀도가 권장됩니다.
- 필요한 보충제(예: 혈청 또는 무혈청 대체물, 기타 사이토카인)를 포함하여 분화 배지가 올바르게 제형화되었는지 확인합니다.
- EB 형성을 위한 충분한 시간을 확보하고, NK 세포 분화 배지로 전환하기 전에 최소 6일에서 최대 12일까지 기다립니다.
- NK 세포의 증식 불량 증상
- 확장 중 제한된 세포 수율을 확인합니다.
- 팽창된 NK cell의 생존율 감소를 확인합니다.
- NK cell의 불량한 증식에 대한 해결책
- 팽창 단계에서 IL-15 및 IL-2의 농도를 증가시킵니다. 이는 NK 세포 증식을 크게 향상시킬 수 있습니다.
- NK 세포의 생존과 증식을 개선하기 위해 방사선 조사된 aAPC와 같은 공급세포를 사용하는 것이 좋습니다.
- 최적의 성장 조건을 유지하기 위해 세포 밀도를 정기적으로 모니터링하고 세포가 과밀에 도달하기 전에 세포를 계대에 계대시킵니다.
- 최적이 아닌 기능 테스트 결과의 증상
- 표적 세포에 대한 세포 독성 감소를 확인합니다.
- 사이토카인 분비 수치가 낮은지 확인합니다(예: IFN-γ, TNF-α).
- 최적이 아닌 기능 테스트 결과를 위한 솔루션
- 세포독성 분석에서 Target-to-Effector 비율을 최적화합니다. 10:1 비율로 시작하여 결과에 따라 조정합니다.
- 기능 분석 전에 NK 세포가 적절하게 활성화되었는지 확인합니다. 여기에는 사이토카인을 사용한 사전 자극 또는 방사선 조사된 aAPC를 사용한 공동 배양이 포함될 수 있습니다.
- NK cell-mediated lysis에 대한 타겟 세포주의 민감도를 확인합니다. 알려진 민감한 대상을 컨트롤로 사용합니다.
- NK 세포 활성이 나타날 수 있는 충분한 시간을 허용하기 위해 기능 분석의 지속 기간을 연장합니다.
- 다양한 CAR 발현 수준의 증상
- NK 세포 간에 일관되지 않은 CAR 발현을 확인합니다.
- 다양한 CAR 발현 수준에 대한 솔루션
- CAR transfection 방법(예: 바이러스 transduction, electroporation)의 효율성을 검증합니다. 필요한 경우 MOI(감염의 다양성) 또는 전기천공 조건을 조정합니다.
- CAR+ NK 세포를 농축하기 위해 적절한 선택 마커를 구현합니다. 필요에 따라 항생제 선별 또는 형광 마커 분류를 사용합니다.
결과
anti-GPC3-CAR iPSC 유래 NK 세포 분화 및 증식의 개략도
개략도는 인간 유도 만능 줄기 세포(iPSC)에서 유래한 anti-GPC3-CAR 엔지니어링 NK 세포의 체외 분화와 GPC3 CAR 구조를 운반하는 piggyBac 벡터의 개략도를 보여줍니다. 초기에는 변형되지 않은 iPSC가 GPC3 CAR(키메라 항원 수용체)을 인코딩하는 piggyBac 벡터로 transfection됩니다. transfection 후 이러한 GPC3 CAR 발현 iPSC는 클론으로 증식된 다음 기능적 CAR iPSC 유래 NK 세포로 분화됩니다. 이러한 조작된 NK 세포는 이후 시험관 내 및 생체 내 기능 분석을 통해 다양한 종양 세포주에 대한 항종양 활성을 평가합니다(그림 1).
다양한 단계에서 WT 및 anti-GPC3-CAR 엔지니어링 iPSC의 NK 분화 과정에 대한 현미경 분석
GPC3 CAR 엔지니어링 iPSC는 anti-GPC3-CAR 엔지니어링 iPSC NK 세포로 분화됩니다. GPC3 CAR 엔지니어링 iPSC에서 GPC3-CAR iPSC NK 세포의 분화에 이르는 스핀 배아체(EB)의 형성은 anti-GPC3-CAR 엔지니어링 iPSC의 기능적 GPC3 CAR iPSC NK 세포로의 분화 단계를 문서화하는 일련의 현미경 이미지로 제시되었습니다. 미분화 야생형(WT) 및 GPC3 CAR iPSC를 mTeSR Plus 배지에서 배양했습니다(그림 2A). 그런 다음 이러한 WT 및 anti-GPC3-CAR iPSC를 단일 세포로 해리하고 초저 부착 U-bottom 96 웰 플레이트에서 SCF(40ng/mL), BMP4(20ng/mL), VEGF(20ng/mL) 및 10μM ROCK 억제제를 포함하는 STEMdiff APEL 배지에서 6일 동안 배양합니다. 스핀 EB의 형성은 WT 및 GPC3 CAR iPSC 모두에서 6일째에 포착되었습니다(그림 2B). 이러한 스핀 EB는 사이토카인 IL-3(5ng/mL), SCF(20ng/mL), IL-7(20ng/mL) 및 IL-15(10ng/mL)와 함께 NK 분화 배지를 포함하는 6웰 플레이트로 추가로 전달됩니다. 3일차부터 28일차까지 다양한 시점에서 WT 및 GPC3 CAR iPSC 유래 NK 세포의 분화 과정을 100배 배율의 현미경을 사용하여 캡처했습니다(그림 2C).
WT 및 anti-GPC3 CAR iPSC 유래 EB(6일차) 및 WT 및 GPC3 CAR iPSC 유래 NK 세포(35일차)의 표현형
WT 및 GPC3 CAR iPSC 유래 세포는 NK 분화 과정의 여러 단계에서 표현형으로 특성화됩니다. 패널 A는 유세포 분석으로 측정한 WT 및 GPC3 CAR iPSC의 스핀 EB에서 전형적인 조혈 항원 CD34, CD31, CD43 및 CD45의 발현을 보여줍니다(그림 3A). 패널 b는 35일째에 NK 분화 배지에서 수확한 WT 및 GPC3 CAR iPSC 유래 NK 세포의 표현형을 제시하며, 유세포 분석으로 성숙한 NK 세포와 관련된 NK 특이적 마커(CD45, CD56, CD16 및 NKG2D)를 강조합니다(그림 3B).
expanded WT 및 anti-GPC3-CAR iPSC 유래 NK 세포의 표현형
WT 및 anti-GPC3 CAR iPSC 유래 NK 세포의 분화 후, IL-2(100 U/mL) 및 IL-15(10 ng/mL)를 함유한 Gibco NK Xpander 배지에서 방사선 조사된 aAPC를 사용하여 분화된 NK 세포를 수확하고 증식합니다. CD94, CD16, NKp30, NKp44, NKp46, NKG2D, CD226, FasL 및 TRAIL과 같은 확장된 WT 및 항 GPC3 CAR iPSC NK 세포 활성화 수용체를 유세포 분석을 사용하여 측정했습니다(그림 4A). 팽창된 WT 및 anti-GPC3 CAR iPSC NK 세포에서 NK 활성화 표현형을 확인한 후, 유세포분석을 통해 HepG2, SNU-449, SKOV3, CAL27 등 다양한 종양세포주에서 GPC3 항원의 표면 발현을 평가했습니다(그림 4B). 또한 유세포 분석을 통해 확장된 anti-GPC3 CAR iPSC 유래 NK 세포에서 CAR 발현을 확인했습니다.
HCC 및 기타 종양 세포주에 대한 WT 및 anti-GPC3 CAR iPSC 유래 NK 세포의 기능적 활성
WT 및 anti-GPC3 CAR iPSC 유래 NK 세포의 표현형을 확인한 후 다양한 종양 세포주에 대한 기능적 항종양 활성을 평가했습니다. 다양한 effector-to-target 비율로 HepG2, SNU-449, CAL27 및 SKOV3 세포주에 대한 WT 및 anti-GPC3 CAR iPSC 유래 NK 세포의 세포독성 활성을 평가하기 위해 Caspase3/7 기반 killing assay를 수행했습니다. 이러한 결과는 WT iPSC NK 세포에 비해 항-GPC3 CAR iPSC 유래 NK 세포의 향상된 항종양 효능을 나타내며, CAR 특이성 및 기타 NK 활성화 메커니즘을 통해 GPC3 발현 종양 세포를 표적으로 할 수 있는 잠재력을 보여줍니다(그림 5A-D).

그림 1: anti-GPC3-CAR iPSC 유래 NK 분화, 확장 및 임상 적용의 개략도. (A) 전임상 및 임상용 anti-GPC3 CAR iPSC 유래 NK 세포를 생성하는 과정의 개요. 변형되지 않은 iPSC는 anti-GPC3-CAR 유전자를 운반하는 piggyBac 벡터로 transfection됩니다. transfection에 성공한 후 anti-GPC3-CAR 발현 iPSC는 클론으로 확장되어 기능성 NK 세포로 분화됩니다. 이러한 anti-GPC3 CAR iPSC 유래 NK 세포는 다양한 GPC3 발현 종양 세포주에 대한 세포독성 활성을 평가하기 위해 in vitro 및 in vivo 기능 분석을 모두 받습니다39. 효능과 안전성이 검증됨에 따라 이러한 CAR iPSC 유래 NK 세포는 암 치료의 임상 적용을 위한 잠재적인 "기성품" 치료제로 더욱 개발됩니다. (B) iPSC 형질주입에 사용되는 anti-GPC3 CAR 구조체를 포함하는 piggyBac 벡터의 개략도. (C) iPSC 유래 NK 세포 분화, 증식, 수확 및 기능 분석 수행의 일반적인 타임라인. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
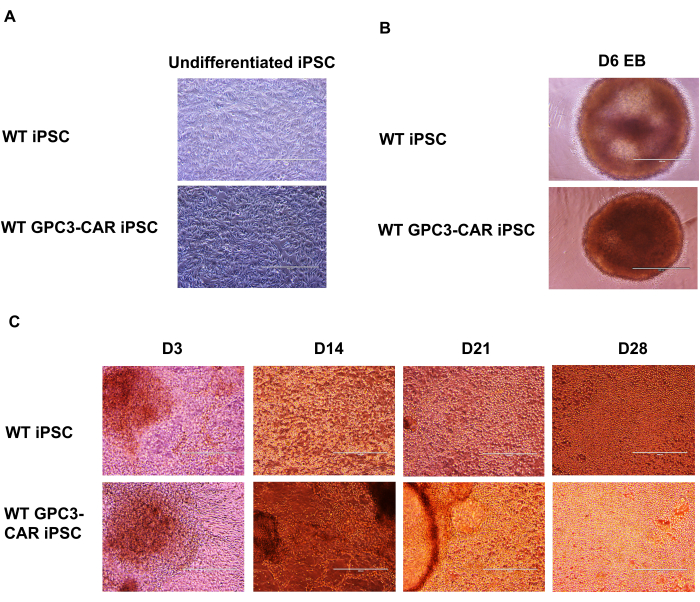
그림 2: 서로 다른 단계에서 항-GPC3-CAR 엔지니어링 iPSC와 CAR iPSC NK 분화의 현미경 이미지. (A) mTeSR과 배지에서 배양된 미분화 WT 및 GPC3 CAR iPSC. (B) 6일차의 WT 및 GPC3 CAR iPSC 스핀 배아체. (C) WT 및 GPC3 CAR iPSC는 D3에서 D28까지 다른 날에 NK 세포 분화를 유도했습니다. a에서 c까지 100배 확대. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
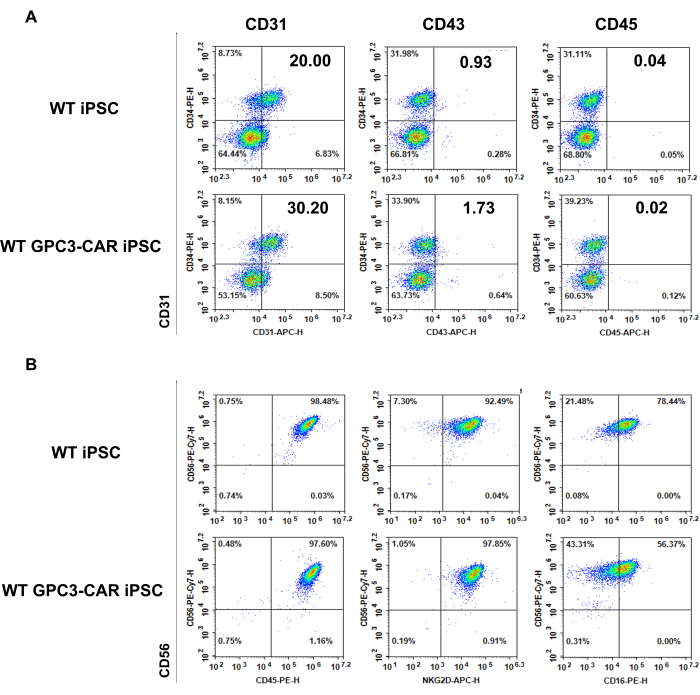
그림 3: WT 및 anti-GPC3 CAR iPSC 유래 6일차 EB의 표현형 및 35일차에 분화된 WT 및 GPC3 CAR iPSC 유래 NK 세포. (A) 조혈 분화 6일차에 WT 및 GPC3 CAR iPSC에서 발현된 전형적인 조혈 항원. (B) WT 및 GPC3 CAR iPSC 유래 NK 세포의 표현형을 35일째에 NK 분화 배지에서 수확합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 증식 후 WT 및 anti-GPC3-CAR iPSC 유래 NK 세포의 표현형. (A) WT 및 GPC3 CAR iPSC 유래 NK 세포는 Gibco NK Xpander 배지에서 증식되었으며, 유세포 분석을 사용하여 NK 성숙 마커를 평가했습니다. (B) HepG2, SNU-449, SKOV3 및 CAL27을 포함한 다양한 종양 세포주에서 GPC3 항원의 표면 발현을 유세포 분석을 사용하여 측정했습니다. (C) GPC3 CAR iPSC 유래 NK 세포의 발현 후 CAR 발현을 보여주는 대표 히스토그램. CAR 구문은 유세포 분석으로 CAR을 측정하기 위해 FLAG 태그 및 GFP와 통합되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: HCC 및 기타 종양 세포주에 대한 WT 및 항-GPC3 CAR iPSC 유래 NK 세포의 기능적 활성.(A-D) HepG2, SNU-449, CAL27 및 SKOV3를 포함한 다양한 종양 세포주에 대해 WT 및 GPC3 CAR iPSC 유래 NK 세포의 항종양 활성을 테스트했습니다. X축은 HepG2, SNU-449, CAL27 및 SKOV3에 대해 테스트된 WT 및 anti-GPC3 CAR iPSC 유래 NK 세포의 E:T 비율을 나타냅니다. x축에 표시된 특정 E: T 비율은 10:1, 5:1, 2.5:1, 1:1, 0.5:1 및 0.25:1입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
이 프로토콜은 표적 "기성품" 암 면역 요법을 촉진하는 것을 목표로 하는 일관된 세포 공급원에서 CAR 발현 iPSC 유래 NK 세포를 생성하기 위한 표준화되고 재현 가능한 접근 방식을 설명합니다. 여러 전임상 및 임상 연구에서 이식편대숙주병(GvHD) 또는 사이토카인 방출 증후군(CRS)과 같은 독성을 최소화하면서 암을 치료하는 데 양자 NK 세포 기반 면역요법의 효능이 입증되었습니다23,42, 49,50,51,52,53,54,55,56,57 . 이 접근법은 효율적이고 잘 정의된 시스템을 활용하여 균질하고 잘 특성화된 CAR iPSC 유래 NK 세포를 생산하며, 임상 적용을 위해 확장할 수 있습니다. 또한, NK에 최적화된 CAR을 발현하도록 조작된 iPSC 유래 NK 세포는 전형적인 NK 세포 표현형과 세포 용해 기능을 유지합니다 23,39,42,50,51,52,58.
CAR iPSC 유래 NK 세포 생산에 인간 iPSC를 사용하면 말초 혈액에서 분리된 1차 NK 세포에 비해 CAR 발현을 포함한 유전자 변형에 더 효율적인 방법을 제공합니다 31,59,60. CAR 발현 외에도 억제 수용체의 결실 또는 사이토카인 발현의 도입과 같은 변형을 통해 이러한 세포의 항종양 활성을 더욱 향상시킬 수 있습니다 41,39,61. 이는 단일 유전자 변형 이벤트를 통해 달성될 수 있으며, 현재 CAR-T 세포 치료제에서 볼 수 있는 환자 특이적 변형의 필요성을 제거합니다 31,62,63. 또한, 새로운 CAR 발현 세포를 이용한 NK 세포 기반 치료법은 만성 감염성 질환 치료에 잠재적으로 사용될 수 있습니다 30,64,65,66,67,68.
이 프로토콜은 인간 iPSC를 사용하여 CAR 발현 NK 세포의 균일한 집단을 생성하여 체외 및 생체 내 항종양 활성을 향상시킬 수 있는 잠재력을 총체적으로 보여줍니다. NK 세포에 최적화된 CAR은 신호 전달 경로의 항원 특이적 활성화를 가능하게 하여 이러한 세포의 기능을 향상시킵니다. 수정 및 문제 해결은 CAR NK 셀의 수율과 기능을 최적화하는 데 필수적입니다. 사이토카인 칵테일과 타이밍을 조정하면 차별화 효율성을 향상시킬 수 있습니다. NK 세포에서 CAR 구조체의 안정성과 발현을 보장하려면 transfection 방법 또는 벡터 설계를 최적화해야 할 수 있습니다. 추가적인 문제 해결을 통해 CAR iPSC 유래 NK 세포의 낮은 형질도입 효율, 세포 생존율 및 기능적 활성과 같은 문제를 해결할 수 있으며, 지속성, 세포 독성 및 안전성을 향상시키기 위해 다양한 배양 조건 또는 유전자 변형에 대한 반복적인 테스트가 포함될 수 있습니다.
이 방법의 중요성은 표준화된 iPSC 소스에서 CAR NK 세포를 잠재적으로 무제한으로 공급할 수 있는 능력에 있습니다. iPSC 유래 CAR NK 세포는 여러 유전자 편집을 위한 안정적인 플랫폼을 제공하여 변동성을 줄이고 엔지니어링된 세포의 일관성을 개선합니다. 또한 이 방법을 사용하면 즉시 사용할 수 있는 "기성품" NK 세포 치료제를 만들 수 있어 개별화된 세포 소싱 및 처리의 필요성을 피할 수 있습니다.
또한, 이 프로토콜은 이식유전자 통합의 일시적인 특성으로 인해 시간이 지남에 따라 발현 수준이 가변될 수 있기 때문에 piggyBac 벡터를 사용할 때 CAR 발현의 안정성을 유지하는 데 특정 제한이 있습니다. 또한 확장을 위해 aAPC 및 특정 사이토카인에 의존하면 임상 응용 분야에서 이러한 프로세스의 확장성이 복잡해질 수 있습니다. 마지막으로, 돼지박(piggyBac) 요소에 대한 잠재적인 면역 반응은 치료 환경에서 위험을 초래할 수 있습니다.
결론적으로, CAR-NK 세포와 인간 iPSC의 분화 및 증식은 간세포암(HCC) 및 기타 악성 종양을 치료하는 데 중요한 가능성을 가지고 있습니다. 이 혁신적인 접근법은 iPSC의 재생 잠재력과 NK 세포의 선천적 면역 특성을 활용하여 강력한 표적 암 면역 요법을 개발합니다. 이 분야의 발전은 보다 효과적이고 널리 이용 가능한 NK 세포 기반 치료법으로 이어질 수 있으며, HCC 및 기타 치료가 어려운 질병을 앓고 있는 환자에게 새로운 희망을 제공할 수 있습니다.
공개
DSK는 쇼어라인 바이오사이언스(Shoreline Biosciences)의 공동 창립자이자 자문사이며, 이 회사의 지분을 보유하고 있다. DSK는 또한 Therabest 및 RedC Bio에 대한 컨설팅을 제공하여 수입 및/또는 자본을 받습니다. 이러한 합의의 조건은 이해 상충 정책에 따라 University of California, San Diego에서 검토 및 승인했습니다. 나머지 저자는 경쟁 이해관계가 없음을 선언합니다.
감사의 말
우리는 모든 Kaufman 연구소 구성원들의 지원, 과학적 통찰력 및 토론에 감사드립니다. 이러한 연구는 NIH/NCI 보조금 U01CA217885, P30CA023100(행정 보조) 및 UCSD의 샌포드 줄기세포 연구소의 지원을 받았습니다. JT: 원고의 작성과 수정. DSK: 원고를 검토하고 편집했습니다.
자료
| Name | Company | Catalog Number | Comments |
| aAPC | Dean A. Lee lab | N/A | |
| a-MEM culture medium | Fisher Scientific | Cat#12634 | |
| APC anti-DYKDDDDK (FLAG Tag) | BD Biosciences | Cat#637308 | |
| APC-anti-human TRA-1-81 | ThermoFisher | 17-8883-42 | |
| APC-CD16 | BD Biosciences | Cat#302015 | |
| APC-CD43 | BD Biosciences | Cat# 560198 | |
| APC-CD45 | BD Biosciences | Cat# 555485 | |
| APC-GPC3 | BD Biosciences | Cat#DB100B | |
| APC-NKG2D | BD Biosciences | Cat# 558071 | |
| CellEvent Caspase-3/7 Green Detection Reagent | Thermo fisher | Cat#C10423 | |
| CellTrace Violet Cell Proliferation Kit | Thermo fisher | Cat#C34571 | Cell tracing fluorescent dye |
| CryoStor solution | Stem Cell Technologies | https://www.stemcell.com/products/cryostor-cs10.html | Cryopreservation medium |
| CTS NK Xpander | Gibco | A5019001 | |
| CTS NK-Xpander Medium | Life Technologies | Cat#A5019001 | |
| DMEM | Gibco | 11965084 | |
| DMEM, high glucose, GlutaMAX Supplement, pyruvate | Gibco | 10569010 | |
| EasySep Human NK Cell Enrichment Kit | StemCell Technologies, Inc. | Cat#19055 | |
| Ethanolamine | Sigma Aldrich | E9508 | |
| Fetal bovine serum | Fisher Scientific | Cat# 10437010 | |
| FITC-CD94 | BD Biosciences | Cat#555888 | |
| GlutaMAX Supplement | Gibco | 35050061 | |
| GolgiPlug | BD Biosciences | Cat#555029 | |
| GolgiStop | BD Biosciences | Cat#554724 | |
| Ham's F-12 Nutrient Mix, GlutaMAX Supplement | Gibco | 31765035 | |
| Horse serum | Fisher Scientific | Cat#16050130 | |
| Human Serum | AB Sigma-Aldrich | Cat#BP2525100 | |
| Human Stem Cell NucleofectorTM Kit | Lonza | Cat# VPH-5012 | |
| Human: HePG2 cells | ATCC | Cat#HB-8065 | |
| Human: HePG2-td-tomato-luc cells | Dan S. Kaufman lab | N/A | |
| Human: iPS cells | Dan S. Kaufman lab | N/A | |
| Human: SNU-449 cells | ATCC | Cat#CRL-2234 | |
| Human: SNU-449-td-tomato-luc cells | Dan S. Kaufman lab | N/A | |
| IncuCyte Caspase-3/7 Green Apoptosis Assay | Essenbioscience | Cat#4440 | |
| L-Ascorbic acid | Sigma Aldrich | A5960 | |
| MP Biomedicals Human Serum, Type AB | MP Biomedicals | ICN2938249 | |
| mTeSR plus | StemCell Technologies, Inc. | 100-0276 | |
| NovoExpress software | ACEA Biosciences | https://www.agilent.com/en/product/research-flow-cytometry/flow-cytometry-software/novocyte-novoexpress-software-1320805 | |
| PE/Cy7 anti-human SSEA-4 Antibody | Biolegend | 330420 | |
| PE-CD16 | BD Biosciences | Cat#560995 | |
| PE-CD226 | BD Biosciences | Cat#559789 | |
| PE-CD34 | BD Biosciences | Cat# 555822 | |
| PE-CD45 | BD Biosciences | Cat# 555483 | |
| PE-CD94 | BD Biosciences | Cat#555888 | |
| PE-cy7-CD56 | BioLegend | Cat# 318318 | |
| PE-FAS Ligand | BD Biosciences | Cat#564261 | |
| PE-NKp30 | BD Biosciences | Cat# 558407 | |
| PE-NKp44 | BD Biosciences | Cat#558563 | |
| PE-NKp46 | BD Biosciences | Cat#331908 | |
| PE-NKp46 | BD Biosciences | Cat#557991 | |
| Peripheral blood buffy coat | San Diego Blood Bank (https://www. sandiegobloodbank.org/) | N/A | |
| PE-TRAIL | BD Biosciences | Cat#565499 | |
| pKT2-mCAG-IRES-GFP-ZEO | Branden Moriarity lab | N/A | |
| pMAX-GFP plasmid | Lonza | N/A | GFP positive control |
| Prism 9 | Graphpad | Version 9 | |
| pSpCas9 | GenScript | PX165 | |
| RBC Lysis Buffer (10x) | Biolegend | Cat#420301 | |
| Recombinant human bFGF basic | R&D Systems | Cat#4114-TC | |
| Recombinant human BMP-4 | PeproTech | Cat#120-05 | |
| Recombinant human FLT-3 Ligand | PeproTech | Cat# 300-19 | |
| Recombinant human IL-15 | PeproTech | Cat# 200-15 | |
| Recombinant human IL-2 | PeproTech | Cat# 200-02 | |
| Recombinant human IL-3 | PeproTech | Cat#200-03 | |
| Recombinant human IL-7 | PeproTech | Cat# 200-07 | |
| Recombinant Human Nodal Protein | R&D Systems | Cat#3218-ND-025 | |
| Recombinant human SCF | PeproTech | Cat# 300-07 | |
| Recombinant Human TGF-β1 | PeproTech | Cat#100-21 | |
| Recombinant human VEGF | PeproTech | Cat# 100-20 | |
| RPMI1640 | Gibco | 11875093 | |
| Sodium selenite | Sigma Aldrich | 214485 | |
| STEMdiff APEL 2 Medium | StemCell Technologies, Inc. | 5270 | EB formation medium |
| STEMdiff APEL2 Medium | StemCell Technologies, Inc. | Cat#05270 | |
| Super piggyBac Transposase expression vector | SBI | Cat#PB210PA-1 | |
| SYTOX AADvanced Dead Cell Stain Kit | ThermoFisher Scientific | S10274, S10349 | Dead cell staining solution kit |
| β-mercaptoethanol | Gibco | 21985023 |
참고문헌
- Chan, I. S., Ewald, A. J. The changing role of natural killer cells in cancer metastasis. J Clin Invest. 132 (6), e143762(2022).
- Yu, Y. The function of NK cells in tumor metastasis and NK cell-based immunotherapy. Cancers (Basel). 15 (8), 2323(2023).
- Paul, S., Lal, G. The molecular mechanism of natural killer cells function and its importance in cancer immunotherapy. Front Immunol. 8, 1124(2017).
- Myers, J. A., Miller, J. S. Exploring the NK cell platform for cancer immunotherapy. Nat Rev Clin Oncol. 18 (2), 85-100 (2021).
- Llovet, J. M., et al. Hepatocellular carcinoma. Nat Rev Dis Primers. 7, 6(2021).
- Yang, Y., Xiong, L., Li, M., Jiang, P., Wang, J., Li, C. Advances in radiotherapy and immunity in hepatocellular carcinoma. J Transl Med. 21 (1), 526(2023).
- Rich, N. E., Yopp, A. C., Singal, A. G. Medical management of hepatocellular carcinoma. J Oncol Pract. 13 (6), 356-364 (2017).
- Niu, M., Yi, M., Li, N., Wu, K., Wu, K. Advances of Targeted Therapy for Hepatocellular Carcinoma. Front Oncol. 11, 719896(2021).
- Yu, S. J. Immunotherapy for hepatocellular carcinoma: Recent advances and future targets. Pharmacol Ther. 244, 108387(2023).
- Ntellas, P., Chau, I. Updates on systemic therapy for hepatocellular carcinoma. Am Soc Clin Oncol Educ Book. 44, e430028. 44, e430028(2024).
- Liu, T. -H., Shen, Y. -C., Cheng, A. -L. Immune checkpoint inhibitors for hepatocellular carcinoma - A game changer in treatment landscape. J Formos Med Assoc. 121 (8), 1371-1383 (2022).
- Sun, Q., Hong, Z., Zhang, C., Wang, L., Han, Z., Ma, D. Immune checkpoint therapy for solid tumours: clinical dilemmas and future trends. Signal Transduct Target Ther. 8 (1), 320(2023).
- Huang, A., Yang, X. -R., Chung, W. -Y., Dennison, A. R., Zhou, J. Targeted therapy for hepatocellular carcinoma. Signal Transduct Target Ther. 5 (1), 146(2020).
- Girardi, D. M., Pacífico, J. P. M., Guedes de Amorim, F. P. L., Dos Santos Fernandes, G., Teixeira, M. C., Pereira, A. A. L. Immunotherapy and targeted therapy for hepatocellular carcinoma: A literature review and treatment perspectives. Pharmaceuticals (Basel). 14 (1), 28(2020).
- Laface, C., et al. Targeted therapy for hepatocellular carcinoma: Old and new opportunities. Cancers (Basel). 14 (16), 4028(2022).
- Shyam Sunder, S., Sharma, U. C., Pokharel, S. Adverse effects of tyrosine kinase inhibitors in cancer therapy: pathophysiology, mechanisms and clinical management. Signal Transduct Target Ther. 8 (1), 262(2023).
- Cappell, K. M., Kochenderfer, J. N. Long-term outcomes following CAR T cell therapy: what we know so far. Nat Rev Clin Oncol. 20 (6), 359-371 (2023).
- June, C. H., O'Connor, R. S., Kawalekar, O. U., Ghassemi, S., Milone, M. C. CAR T cell immunotherapy for human cancer. Science. 359 (6382), 1361-1365 (2018).
- Schuster Stephen, J., et al. Chimeric antigen receptor T cells in refractory B-cell lymphomas. N Engl J Med. 377 (26), 2545-2554 (2017).
- Schmidt, D., et al. Engineering CAR-NK cells: how to tune innate killer cells for cancer immunotherapy. Immunother Adv. 2 (1), Itac003(2022).
- Zhang, B., et al. Chimeric antigen receptor-based natural killer cell immunotherapy in cancer: from bench to bedside. Cell Death Dis. 15 (1), 50(2024).
- Wang, K., et al. Reprogramming natural killer cells for cancer therapy. Mol Ther. 32 (9), 2835-2855 (2024).
- Li, Y., Hermanson, D. L., Moriarity, B. S., Kaufman, D. S. Human iPSC-derived natural killer cells engineered with chimeric antigen receptors enhance antitumor activity. Cell Stem Cell. 23 (2), 181-192.e5 (2018).
- Liu, E., Marin, D., et al. Use of CAR-transduced natural killer cells in CD19-positive lymphoid tumors. N Engl J Med. 382 (6), 545-553 (2020).
- Chen, L., Xie, T., Wei, B., Di, D. L. Current progress in CAR-T cell therapy for tumor treatment. Oncol Lett. 24 (4), 358(2022).
- Rafiq, S., Hackett, C. S., Brentjens, R. J. Engineering strategies to overcome the current roadblocks in CAR T cell therapy. Nat Rev Clin Oncol. 17 (3), 147-167 (2020).
- Sterner, R. C., Sterner, R. M. CAR-T cell therapy: current limitations and potential strategies. Blood Cancer J. 11 (4), 69(2021).
- Albinger, N., Hartmann, J., Ullrich, E. Current status and perspective of CAR-T and CAR-NK cell therapy trials in Germany. Gene Ther. 28 (9), 513-527 (2021).
- Dagher, O. K., Posey, A. D. Forks in the road for CAR T and CAR NK cell cancer therapies. Nat Immunol. 24 (12), 1994-2007 (2023).
- Xie, G., Dong, H., Liang, Y., Ham, J. D., Rizwan, R., Chen, J. CAR-NK cells: A promising cellular immunotherapy for cancer. EBioMedicine. 59, 102975(2020).
- Cichocki, F., van der Stegen, S. J. C., Miller, J. S. Engineered and banked iPSCs for advanced NK- and T-cell immunotherapies. Blood. 141 (8), 846-855 (2023).
- Goldenson, B. H., Hor, P., Kaufman, D. S. iPSC-derived natural killer cell therapies - Expansion and targeting. Front Immunol. 13, 841107(2022).
- Zhu, H., Kaufman, D. S. Engineered human pluripotent stem cell-derived natural killer cells: the next frontier for cancer immunotherapy. Blood Sci. 1 (1), 4-11 (2019).
- Knorr, D. A., et al. Clinical-scale derivation of natural killer cells from human pluripotent stem cells for cancer therapy. Stem Cells Transl Med. 2 (4), 274-283 (2013).
- Shimizu, Y., Suzuki, T., Yoshikawa, T., Endo, I., Nakatsura, T. Next-generation cancer immunotherapy targeting Glypican-3. Front Oncol. 9, 248(2019).
- Schepers, E. J., Glaser, K., Zwolshen, H. M., Hartman, S. J., Bondoc, A. J. Structural and functional impact of posttranslational modification of Glypican-3 on liver carcinogenesis. Cancer Res. 83 (12), 1933-1940 (2023).
- Batra, S. A., et al. Glypican-3-specific CAR T cells coexpressing IL15 and IL21 have superior expansion and antitumor activity against hepatocellular carcinoma. Cancer Immunol Res. 8 (3), 309-320 (2020).
- Gao, W., et al. Immunotoxin targeting glypican-3 regresses liver cancer via dual inhibition of Wnt signalling and protein synthesis. Nat Commun. 6, 6536(2015).
- Thangaraj, J. L., Coffey, M., Lopez, E., Kaufman, D. S. Disruption of TGF-β signaling pathway is required to mediate effective killing of hepatocellular carcinoma by human iPSC-derived NK cells. Cell Stem Cell. 31 (9), 1327-1343.e5 (2024).
- Maddineni, S., Silberstein, J. L., Sunwoo, J. B. Emerging NK cell therapies for cancer and the promise of next generation engineering of iPSC-derived NK cells. J Immunother Cancer. 10 (5), e004693(2022).
- Zhu, H., et al. Metabolic reprograming via deletion of CISH in human iPSC-derived NK cells promotes in vivo persistence and enhances antitumor activity. Cell Stem Cell. 27 (2), 224-237.e6 (2020).
- Strati, P., et al. Preliminary results of a phase I trial of FT516, an off-the-shelf natural killer (NK) cell therapy derived from a clonal master induced pluripotent stem cell (iPSC) line expressing high-affinity, non-cleavable CD16 (hnCD16), in patients (pts) with relapsed/refractory (R/R) B-cell lymphoma (BCL). J Clin Oncol. 39, 7541-7541 (2021).
- Hong, D., et al. Preliminary results of an ongoing phase I trial of FT500, a first-in-class, off-the-shelf, induced pluripotent stem cell (iPSC) derived natural killer (NK) cell therapy in advanced solid tumors. J Immunother Cancer. 8 (3), A231-A232 (2020).
- Zah, E., et al. Systematically optimized BCMA/CS1 bispecific CAR-T cells robustly control heterogeneous multiple myeloma. Nat Commun. 11 (1), 2283(2020).
- Ahn, S., et al. Cancer immunotherapy with T cells carrying bispecific receptors that mimic antibodies. Cancer Immunol Res. 7 (5), 773-783 (2019).
- Ludwik, K. A., Telugu, N., Schommer, S., Stachelscheid, H., Diecke, S. ASSURED-optimized CRISPR protocol for knockout/SNP knockin in hiPSCs. STAR Protoc. 4 (3), 102406(2023).
- Zhu, H., Kaufman, D. S. An improved method to produce clinical scale natural killer cells from human pluripotent stem cells. Methods Mol Biol. 2048, 107-119 (2019).
- Denman, C. J., et al. Membrane-bound IL-21 promotes sustained ex vivo proliferation of human natural killer cells. PLoS One. 7 (1), e30264(2012).
- Leivas, A., et al. NKG2D-CAR-transduced natural killer cells efficiently target multiple myeloma. Blood Cancer J. 11 (8), 146(2021).
- Ramdial, J. L., et al. A phase II clinical trial of "Off-the-Shelf" NK cells with allogeneic stem cell transplantation to decrease disease relapse in patients with high-risk myeloid malignancies. Blood. 140 (Supplement 1), 7484-7485 (2022).
- Bachanova, V., et al. Initial clinical activity of FT596, a first-in-class, multi-antigen targeted, off-the-shelf, iPSC-derived CD19 CAR NK cell therapy in relapsed/refractory B-cell lymphoma. Blood. 136, 8(2020).
- Bae, W. K., et al. A phase I study of locoregional high-dose autologous natural killer cell therapy with hepatic arterial infusion chemotherapy in patients with locally advanced hepatocellular carcinoma. Front Immunol. 13, 879452(2022).
- Marin, D., et al. Safety, efficacy and determinants of response of allogeneic CD19-specific CAR-NK cells in CD19+ B cell tumors: a phase 1/2 trial. Nat Med. 30 (3), 772-784 (2024).
- Fehniger, T. A., et al. A phase 1 trial of CNDO-109-activated natural killer cells in patients with high-risk acute myeloid leukemia. Biol Blood Marrow Transplant. 24 (8), 1581-1589 (2018).
- Nguyen, R., et al. A phase II clinical trial of adoptive transfer of haploidentical natural killer cells for consolidation therapy of pediatric acute myeloid leukemia. J Immunother Cancer. 7 (1), 81(2019).
- Miller, J. S., et al. Successful adoptive transfer and in vivo expansion of human haploidentical NK cells in patients with cancer. Blood. 105 (8), 3051-3057 (2005).
- Liu, E., et al. Use of CAR-transduced natural killer cells in CD19-positive lymphoid tumors. N Engl J Med. 382 (6), 545-553 (2020).
- Daher, M., Melo Garcia, L., Li, Y., Rezvani, K. CAR-NK cells: the next wave of cellular therapy for cancer. Clin Transl Immunology. 10 (4), e1274(2021).
- Lin, X., Sun, Y., Dong, X., Liu, Z., Sugimura, R., Xie, G. IPSC-derived CAR-NK cells for cancer immunotherapy. Biomed Pharmacother. 165, 115123(2023).
- Bachanova, V., et al. Safety and efficacy of FT596, a first-in-class, multi-antigen targeted, off-the-shelf, iPSC-derived CD19 CAR NK cell therapy in relapsed/refractory B-cell lymphoma. Blood. 138, 823(2021).
- Saetersmoen, M. L., Hammer, Q., Valamehr, B., Kaufman, D. S., Malmberg, K. J. Off-the-shelf cell therapy with induced pluripotent stem cell-derived natural killer cells. Semin Immunopathol. 41 (1), 59-68 (2019).
- Gerew, A., et al. Deletion of CISH and TGFβR2 in iPSC-derived NK cells promotes high cytotoxicity and enhances in vivo tumor killing. Blood. 138, 2780(2021).
- Goldenson, B. H., Hor, P., Kaufman, D. S. iPSC-derived natural killer cell therapies - Expansion and targeting. Front Immunol. 13, 841107(2022).
- Karvouni, M., Vidal-Manrique, M., Lundqvist, A., Alici, E. Engineered NK cells against cancer and their potential applications beyond. Front Immunol. 13, 825979(2022).
- Ayuso, J. M., et al. Microphysiological model reveals the promise of memory-like natural killer cell immunotherapy for HIV± cancer. Nat Commun. 14 (1), 6681(2023).
- Miller, J. S., et al. Safety and virologic impact of haploidentical NK cells plus interleukin 2 or N-803 in HIV infection. J Infect Dis. 229 (5), 1256-1265 (2024).
- Gutiérrez-Hoya, A., Soto-Cruz, I. NK cell regulation in cervical cancer and strategies for immunotherapy. Cells. 10 (11), 3104(2021).
- Lisco, A., et al. Treatment of relapsing HPV diseases by restored function of natural killer cells. N Engl J Med. 385 (10), 921-929 (2021).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유