Method Article
Progressi nelle cellule natural killer che esprimono il recettore dell'antigene chimerico derivato da cellule staminali pluripotenti umane
In questo articolo
Riepilogo
Qui, presentiamo un metodo per differenziare ed espandere le cellule natural killer che esprimono il recettore dell'antigene chimerico (CAR) derivato da iPSC umano con una migliore uccisione contro vari tumori maligni. Questo protocollo dimostra la differenziazione e l'espansione di cellule CAR-NK derivate da iPSC ottimizzate per natural killer (NK) e la misurazione dell'attività antitumorale contro varie linee cellulari tumorali.
Abstract
Le cellule natural killer (NK) sono cellule immunitarie innate che svolgono un ruolo cruciale nella difesa dell'organismo contro i tumori e le infezioni virali. La generazione di cellule NK che esprimono il recettore dell'antigene chimerico (CAR) derivato da cellule staminali pluripotenti indotte umane (iPSC) è emersa come una strada promettente per l'immunoterapia del cancro "pronta all'uso". Qui, abbiamo utilizzato un costrutto CAR ottimizzato per le cellule NK che include il dominio transmembrana di NKG2D, il dominio co-stimolatorio 2B4 e il dominio di segnalazione CD3ζ, che ha dimostrato di stimolare una robusta attività antitumorale mediata dalle cellule NK antigene-specifiche. L'uso di iPSC per la generazione di cellule CAR NK offre diversi vantaggi, tra cui l'espressione omogenea di CAR, la scalabilità, la riproducibilità e il potenziale per l'applicazione clinica. Questo dettagliato protocollo passo-passo, dall'ingegneria cellulare alla differenziazione, consente la generazione di cellule NK CAR che esprimono iPSC ottimizzate per le cellule NK, fornendo un'immunoterapia antitumorale standardizzata e mirata con una migliore attività antitumorale e evidenziando il loro potenziale come promettente opzione terapeutica per vari tumori maligni.
Introduzione
Le cellule NK, un tipo di linfocita all'interno del sistema immunitario innato, sono fondamentali nella difesa precoce contro i tumori e le cellule infettate viralmente 1,2,3. A differenza delle cellule T, le cellule NK non richiedono la presentazione dell'antigene attraverso le molecole del complesso maggiore di istocompatibilità (MHC). Invece, le cellule NK hanno un repertorio di recettori attivanti e inibitori che regolano la loro attività3. L'attività citotossica mediata dalle cellule NK utilizza vari meccanismi, tra cui il rilascio di perforina e granzimi, l'impegno dei recettori di morte e la produzione di citochine pro-infiammatorie come l'IFN-γ e il TNF-α. Questa modalità d'azione unica posiziona le cellule NK come un candidato attraente per l'immunoterapia del cancro, in particolare nel trattamento dei tumori solidi in cui l'evasione immunitaria è un ostacolo significativo 1,2,3,4.
Il carcinoma epatocellulare (HCC) è una delle forme più comuni e mortali di cancro al fegato in tutto il mondo5. Gli approcci terapeutici tradizionali, tra cui la chirurgia, la chemioterapia e la radioterapia, in genere forniscono un beneficio clinico limitato e si traducono in alti tassi di recidiva 6,7. I recenti progressi nell'immunoterapia e nella terapia mirata hanno avuto un impatto significativo sul trattamento dell'HCC 8,9. Gli inibitori del checkpoint immunitario, come nivolumab e pembrolizumab, hanno mostrato risultati promettenti migliorando la risposta delle cellule immunitarie contro le cellule tumorali10,11. Queste terapie hanno portato a un miglioramento dei tassi di sopravvivenza e a una migliore qualità della vita per alcuni pazienti. Tuttavia, possono anche causare effetti avversi immuno-correlati, che possono limitarne l'uso in alcuni pazienti12. Le terapie mirate, come sorafenib e lenvatinib, inibiscono specificamente i percorsi che promuovono la crescita delle cellule tumorali e l'angiogenesi13. Questi trattamenti hanno un'efficacia nota nel controllare la progressione della malattia e prolungare la sopravvivenza 8,14. Tuttavia, in genere si sviluppa resistenza alle terapie mirate e gli effetti collaterali del trattamento sono comuni 15,16. Tra le strade promettenti nelle strategie immunoterapeutiche del cancro, l'avvento delle cellule CAR T del recettore chimerico dell'antigene (CAR) ha rivoluzionato il trattamento del cancro, in particolare nel trattamento delle neoplasie ematologiche come il linfoma e il mieloma multiplo 17,18,19.
Le cellule NK che esprimono CAR, combinando l'attività citotossica innata delle cellule NK con il targeting di precisione della tecnologia CAR, rappresentano un approccio innovativo e potenzialmente trasformativo per tumori solidi come HCC 20,21,22,23,24. Le cellule ingegnerizzate con CAR possono riconoscere e uccidere in modo specifico le cellule tumorali che esprimono l'antigene bersaglio risparmiando i tessuti normali, riducendo così il rischio di effetti off-target associati alle terapie convenzionali 25,26,27. Le cellule CAR-NK prodotte da cellule NK isolate dal sangue periferico o dal sangue del cordone ombelicale sono tipicamente prodotte trasducendo cellule NK con costrutti CAR che consistono in un dominio di riconoscimento dell'antigene extracellulare, un dominio transmembrana e domini di segnalazione intracellulare necessari per l'attivazione e la proliferazione 28,29,30.
La sfida di ingegnerizzare una popolazione stabile e omogenea di cellule NK funzionalmente ingegnerizzate per il trattamento clinico può essere affrontata impiegando cellule staminali pluripotenti indotte (iPSC)31,32. L'ingegnerizzazione di iPSC umane con CAR ottimizzate per le cellule NK fornisce un migliore segnale di attivazione e proliferazione delle cellule NK e fornisce una popolazione inesauribile e omogenea di cellule NK che esprimono CAR come terapia standardizzata e "pronta all'uso"20,33. In questo protocollo, la modificazione genetica delle iPSC per generare cellule NK derivate da iPSC che esprimono CAR comporta l'integrazione di un costrutto CAR ottimizzato per le cellule NK che include domini transmembrana e di segnalazione derivati dalle cellule NK (NKG2D-2B4-CD3ζ) e un scFv anti-glipicano-3 (GPC3) come descritto nei nostri studi precedenti23. Le iPSC geneticamente modificate vengono quindi differenziate ed espanse utilizzando un protocollo di differenziazione delle cellule NK sviluppato in precedenza34. Queste cellule NK derivate da iPSC che esprimono CAR ingegnerizzate hanno la capacità di riconoscere ed eliminare l'HCC e altre cellule tumorali che esprimono specifici antigeni associati al tumore, come il Glypican 3 (GPC3), che è sovraespresso nell'HCC e in altre neoplasiemaligne 35,36,37,38.
L'applicazione di cellule CAR-NK derivate da iPSC per il trattamento di diversi tumori è molto promettente 30,39,40; molte di queste cellule CAR-NK derivate da iPSC sono attualmente in fase di sperimentazione clinica 41,42,43. Per facilitare il progresso in questo settore, questo protocollo consente una produzione efficiente di cellule CAR-NK ingegnerizzate derivate da iPSC, dall'ingegneria cellulare alla differenziazione in cellule NK mature e all'espansione in vitro.
Protocollo
1. Metodo di coltura senza alimentatore di iPSC umane
NOTA: Scongelare le iPSC umane indifferenziate congelate e coltivarle con l'uso di mTeSR 1-plus su piastre pre-rivestite Matrigel (d'ora in poi denominate matrice di membrana basale [BMM]), come precedentemente descritto23,34. È molto importante assicurarsi che le iPSC non siano differenziate prima e dopo l'ingegnerizzazione. Le iPSC appena scongelate devono essere coltivate per circa 2-3 passaggi per mostrare una morfologia pluripotente coerente con le cellule staminali pluripotenti umane. Le seguenti istruzioni vengono utilizzate per il passaggio di cellule da un pozzetto di una piastra a 6 pozzetti.
- Prima di passare le iPSC, rivestire la nuova piastra a 6 pozzetti con 1x BMM (1 mL/pozzetto) e incubare in un incubatore a 37 °C per 2-4 ore prima dell'uso.
- Preparare 1x BMM solubilizzato.
- Scongelare un flaconcino da 5 ml di BMM a 4 °C per una notte.
- Aliquotare rapidamente il BMM utilizzando puntali pre-raffreddati in provette da microcentrifuga pre-raffreddate.
- Conservare a -80 °C per un massimo di 6 mesi.
- Per preparare 1x soluzione di lavoro BMM, risospendere un'aliquota BMM in rapporto 1:100 in un mezzo DMEM/F12 freddo. La soluzione di lavoro 1x BMM può essere conservata a -4 °C per 2 settimane.
- Rivestire la piastra con un volume sufficiente a coprire la superficie (ad esempio, utilizzare 1 mL per pozzetto di piastra a 6 pozzetti).
- Incubare in incubatore a 37 °C per 2-4 ore prima dell'uso.
- Scongelare un flaconcino di iPSC congelate (tipicamente 1 × 106 cellule/flaconcino) in un bagno d'acqua a 37 °C.
- Aggiungere gradualmente le iPSC scongelate in una provetta conica da 15 mL contenente 5 mL di terreno mTeSR Plus preriscaldato, consentendo alle cellule di acclimatarsi aggiungendole goccia a goccia per ridurre al minimo lo shock cellulare.
- Centrifugare le celle a 300 × g per 5 min.
- Aspirare il surnatante e lavare le cellule una volta con 5 mL di PBS.
- Risospendere le cellule nel terreno mTeSR Plus e piastrle a una densità di circa 200.000 cellule/3 mL/pozzetto nella piastra a 6 pozzetti prerivestita BMM.
- Passaggio iPSC.
- Una volta che le iPSC raggiungono la confluenza del 70-80%, aspirare il terreno ed eseguire il passaggio di singole cellule con TrypLE per 5 minuti a 37 °C (1 mL/pozzetto in piastra a 6 pozzetti).
- Dopo 5 minuti, aggiungere 3 mL di 1x PBS per fermare la reazione di dissociazione e lavare le cellule una volta con 3 mL di PBS.
- Centrifugare le celle a 300 × g per 5 min. Dopo il lavaggio, risospendere le iPSC a cellula singola in terreno mTeSR Plus, quindi piastrarle su una piastra a 6 pozzetti prerivestita BMM.
NOTA: Il volume totale del terreno richiesto è di 3 ml/pozzetto in una piastra a 6 pozzetti. Il terreno deve essere cambiato ogni 2-3 giorni e il passaggio 1.8 deve essere ripetuto quando le cellule diventano confluenti al 70-80% per almeno 1-2 passaggi prima di ingegnerizzare le iPSC.
- Controllare regolarmente la pluripotenza delle iPSC. Colorare le iPSC con l'anticorpo TRA-1-81 coniugato con alloficocianina (APC) e l'antigene embrionale coniugato PE-Cy7 stadio-specifico (SSEA-4) per 30 minuti su ghiaccio, quindi analizzarle utilizzando la citometria a flusso come descritto in precedenza23,41.
NOTA: Le iPSC utilizzate in questo esperimento sono adattate a TrypLE. Le iPSC che non sono state precedentemente passate con TrypLE richiedono in genere 8-10 passaggi per adattarsi completamente a TrypLE, il che garantisce la produzione di corpi embrioidi di spin (EB) di alta qualità.
2. Ingegnerizzazione di iPSC umane per esprimere CAR anti-GPC3 utilizzando il vettore piggyBac
- Rivestire una nuova piastra a 6 pozzetti con BMM e incubare a 37 °C per almeno 1 ora (può essere più lungo finché il liquido non si asciuga).
- Preriscaldare mTeSR Plus con 10 μM associato a Rho, bobina a spirale contenente inibitore della proteina chinasi (ROCK) (Y-27632) (da 1 mM di stock preparato in acqua distillata sterile) a 37 °C.
- Attiva il sistema Nucleofection. Selezionare l'unità X, quindi selezionare le posizioni dei pozzetti da trasfettare. Scegli la soluzione P3 e inserisci manualmente il codice (CA-137).
- Raccogliere le iPSC alla confluenza del 70-80% con 1 mL di TrypLE e incubare a 37 °C per 5 minuti. Controllare al microscopio per confermare la dissociazione.
- Pipettare 4-6 volte per ottenere una sospensione a singola cellula, quindi neutralizzare con 5 mL di PBS e pellet a 300 × g per 5 min.
- Lavare delicatamente le celle ancora una volta per rimuovere ogni traccia di TrypLE.
- Risospendere in 1 mL di mTeSR Plus con Rock-Inhibitor e contare le cellule.
- Per creare iPSC CAR anti-GPC3, utilizzare 1 × 106 cellule per trasfezione in una provetta da microcentrifuga e centrifugare a 300 × g per 5 minuti.
- Durante la rotazione, combinare il DNA del trasposone che esprime CAR con il vettore di espressione della super trasposisi PiggyBac in una provetta da microcentrifuga da 1,5 ml a un rapporto di 3:1 (ad esempio, 3 μg di plasmide contenente il trasposone per 1 μg di plasmide trasposasi).
- Includere un controllo positivo alla proteina fluorescente verde (GFP) (Tabella dei materiali) utilizzando 0,5 μL di soluzione da 1 mg/mL e un controllo negativo non trasfettato per confermare l'espressione della GFP.
- Risospendere accuratamente il pellet cellulare in 20 μL di soluzione di nucleofettore P3 a temperatura ambiente (RT) con l'integratore fornito nel kit di nucleonucleazione. Quindi, aggiungere questa miscela a una provetta da microcentrifuga da 1,5 ml contenente DNA plasmidico, ottenendo un volume finale di circa 22-25 μl.
NOTA: Risospendere tutte le iPSC da trasfettare nella soluzione di nucleofector P3 prima di aggiungere i plasmidi CAR GPC3 o il plasmide di controllo GFP alle cellule. - Trasferire la sospensione di cellule/DNA in strisce da 20 μl a 16 pozzetti. Assicurarsi che il campione copra il fondo della cuvetta senza bolle.
- Picchiettare delicatamente le strisce a 16 pozzetti sul piano di lavoro per rimuovere eventuali bolle d'aria e depositare le celle sul fondo.
- Posizionare le strisce a 16 pozzetti contenenti iPSC e la miscela di DNA CAR nel sistema di nucleofezione, selezionare il programma CA-137, la soluzione P3 e quindi avviare il programma. Questo programma terminerà in 1 s e mostrerà un segno di spunta verde.
- Aggiungere 80 μL di mTeSR Plus preriscaldato con terreno ROCK-Inhibitor al pozzetto e trasferire con cura le cellule nella piastra a 6 pozzetti rivestita con BMM (volume finale 1 mL per pozzetto).
- Controllare brevemente le cellule al microscopio a fluorescenza dopo 4 ore per verificare la presenza di qualsiasi espressione di GFP per confermare il tasso di successo della trasfezione.
- Screening delle iPSC per l'espressione di GFP per valutare l'efficienza della trasfezione 24 ore dopo la trasfezione utilizzando la citometria a flusso23,41 per confermare l'espressione di GFP.
- Incubare per 4 giorni a 37 °C, cambiando il terreno secondo necessità prima di procedere alla selezione del farmaco.
NOTA: Ogni nucleofezione richiede 0,2-2 x 106 iPSC per reazione. A seconda del numero di reazioni, è possibile utilizzare piastre a 24 pozzetti o piastre a 6 pozzetti.
3. Selezione clonale e conferma della pluripotenza delle iPSC GPC3-CAR
- Eseguire una serie di selezioni di zeocin (1:10.000) sulle iPSC trasfettate per selezionare clonalmente le iPSC che esprimono GPC3-CAR.
- Per confermare l'efficienza della trasfezione, misurare l'espressione della GFP utilizzando un microscopio a fluorescenza e la citometria a flusso23,41.
NOTA: Il costrutto CAR è incorporato con un tag FLAG 44,45 allo scopo di valutare l'espressione di CAR sia durante la fase iPSC che dopo la differenziazione delle cellule NK. - Mantenere le iPSC CAR trasfettate sotto selezione farmacologica fino a quando non raggiungono un'espressione ottimale del gene CAR e della GFP.
- Per garantire un'espressione omogenea di GFP e CAR, prolungare la durata della selezione del farmaco per 2-3 settimane.
- Eseguire la selezione cellulare in base all'espressione di GFP o CAR utilizzando la citometria a flusso per ottenere una popolazione omogenea di iPSC23 selezionate clonalmente.
- Il costrutto CAR utilizzato qui contiene un marcatore di selezione del farmaco zeocina. Selezionare le cellule trasfettate del gene GPC3 CAR aggiungendo zeocina (50 μg/mL di zeocina) al terreno di coltura.
- Dopo la selezione della zeocina, diluire le iPSC trasfettate dal gene GPC3 CAR e piastrelarle in una piastra a 96 pozzetti per ottenere circa una cellula per pozzetto. Questo può essere fatto attraverso la diluizione seriale o utilizzando un selezionatore di cellule.
NOTA: Utilizzare la selezione cellulare attivata dalla fluorescenza (FACS) per isolare singole cellule trasfettate in base all'espressione di un marcatore fluorescente legato al costrutto CAR. - Lasciare che le singole cellule si espandano in colonie nella piastra a 96 pozzetti.
- Nutrire le cellule con terreno di coltura fresco ogni 3-4 giorni una volta e monitorare i pozzetti per la crescita delle colonie.
- Screening delle colonie per l'espressione CAR. Questo può essere fatto mediante reazione a catena della polimerasi (PCR), reazione a catena della polimerasi quantitativa (qPCR) o Western blotting per verificare la presenza del costrutto CAR23,47.
- In alternativa, utilizzare la citometria a flusso23,41 per rilevare l'espressione superficiale della proteina CAR.
NOTA: In questo studio, l'espressione CAR è stata quantificata mediante l'espressione del tag FLAG utilizzando la citometria a flusso. - Inoltre, eseguire il cariotipo per identificare eventuali anomalie cromosomiche.
NOTA: Questa operazione può essere eseguita da organizzazioni di terze parti come Wicell (wicell.org) o Thermo Fisher Scientific (thermofisher.com). - Una volta identificati i cloni CAR-positivi senza alcuna anomalia, espandere questi cloni in recipienti di coltura più grandi come la piastra a 6 pozzetti e il pallone T75.
- Crioconservare le iPSC CAR espanse clonalmente utilizzando un mezzo di crioconservazione in più fiale per un uso futuro.
NOTA: In questa fase si raccomandano i seguenti punti: (i) Mantenere le condizioni di coltura ottimali per le iPSC per prevenire la differenziazione. (ii) Attendere 1-4 settimane per ottenere una popolazione omogenea di espressione di CAR e GFP nelle iPSC dopo la selezione del farmaco. (iii) Continuare a monitorare le cellule per la stabilità dell'espressione CAR e i marcatori di pluripotenza. iv) Utilizzare controlli adeguati durante le fasi di screening e verifica. (v) Dopo la selezione clonale e l'espansione, verificare la pluripotenza valutando l'espressione di TRA-1-81 e SSEA-4 sulle iPSC che esprimono CAR.
4. Generazione di cellule progenitrici ematopoietiche da iPSC CAR ingegnerizzate mediante formazione di corpi embrioidi di spin (EB)
NOTA: Un protocollo di spin EB o organoide ematopoietico viene utilizzato per produrre progenitori ematopoietici23,34. Le cellule all'interno degli EB si differenziano in cellule stromali per supportare lo sviluppo dei linfociti38, eliminando così la necessità di cellule stromali derivate da xeno come OP9 23,34,48. Di seguito sono riportate le istruzioni per la raccolta delle cellule da un singolo pozzetto di una piastra a 6 pozzetti per la formazione di EB.
- Passaggio di ~200.000 cellule/pozzetto di piastra pre-rivestita BMM a 6 pozzetti 2 giorni prima della formazione dello spin EB. Assicurarsi che raggiunga il 70-80% di confluenza il giorno della configurazione degli EB di rotazione. Generalmente, 1 pozzetto di una piastra a 6 pozzetti è sufficiente per due piastre di spin EB.
- Rimuovere il terreno di coltura e staccare le cellule incubando con 1 mL di TrypLE Select preriscaldato a 37 °C per 5 min.
- Dissociare accuratamente gli aggregati cellulari in una sospensione di una singola cellula utilizzando una micropipetta da 1 mL e trasferire le cellule in una provetta conica da 15 mL. Aggiungere 3 mL di 1x PBS per fermare la reazione di dissociazione e lavare le cellule una volta con 3 mL di PBS.
- Risospendere le cellule nel terreno mTesR Plus e filtrarle attraverso un filtro cellulare da 70 μM per rimuovere gli aggregati.
- Centrifugare le cellule per rimuovere il surnatante e lavare nuovamente le cellule con 5 ml di PBS. Quindi risospendere le cellule in 1 mL di terreno STEMdiff APEL (terreno di formazione EB).
- Contare e diluire le cellule alla densità appropriata utilizzando il terreno di formazione EB contenente le seguenti citochine (SCF: 40 ng/mL, BMP4: 20 ng/mL, VEGF: 20 ng/mL) più 10 μM di inibitore ROCK.
- Seminare 3000-10000 cellule/pozzetto in 100 μL di terreno (100.000 cellule/mL) nelle piastre a 96 pozzetti.
NOTA: Il numero di cellule utilizzate nella formazione dell'EB può variare a seconda della linea iPSC. Si consiglia di testare tra 3.000 e 10.000 cellule per pozzetto in piastre da 96 pozzetti. - Utilizzando una pipetta multicanale, caricare la sospensione cellulare in piastre a 96 pozzetti a 100 μL/pozzetto.
NOTA: Per una migliore formazione di corpi embrioidi (EB), si consiglia di utilizzare piastre a fondo tondo a 96 pozzetti con attacco ultrabasso. - Centrifugare la piastra a 96 pozzetti a 300 × g per 5 minuti, quindi incubare le piastre a 37 °C con CO2 al 5% per 6 giorni.
NOTA: Studi preliminari hanno scoperto che 6 giorni sono sufficienti per dare origine al >30% di cellule CD34+ per le linee CAR iPSC in questo studio. - Controllare la qualità dell'EB mediante citometria a flusso23,41.
- Preparare 4 ml di tripsina preriscaldata allo 0,25% con siero di pollo allo 0,4% (16 μl per 4 ml di tripsina) per dissociare gli EB.
- Trasferire 10-30 EB in una provetta conica da 15 mL.
- Aggiungere la soluzione di tripsina/siero di pollo agli EB e incubare a bagnomaria per 10 minuti, agitando ogni 30 s per garantire la completa dissociazione degli EB.
- Pipettare gli EB tripsinizzati. Mescolare su e giù più volte per dissociare completamente l'EBS.
- Aggiungere 5 ml di 1x PBS per interrompere il processo di tripsinizzazione.
- Filtrare la soluzione cellulare attraverso un filtro cellulare da 70 μm in un nuovo tubo conico.
- Centrifugare le celle a 300 x g per 5 min.
- Aspirare il surnatante e risospendere in 3-5 ml di terreno fresco.
- Contare le cellule, colorarle con i tipici marcatori EB come CD34, CD31, CD43 e CD45 e analizzarle utilizzando la citometria a flusso23,41 (Figura 3).
- Aggiungere il volume raccomandato di anticorpi secondo le istruzioni del produttore a ciascuna provetta contenente singole cellule dissociate di EB in 100 μl di tampone di flusso e incubare su ghiaccio per 30 minuti 39,41.
- Dopo l'incubazione, lavare le cellule due volte con il tampone di flusso, aggiungere la colorazione blu viva/morta SYTOX e analizzare utilizzando la citometria a flusso.
NOTA: Tipicamente, il >30% delle cellule CD34+ viene ottenuto dalla popolazione totale di corpi embrioidi di Spin dissociati il giorno 6 utilizzando le iPSC utilizzate in questo studio, sebbene questa percentuale possa variare a seconda della fonte di iPSC e delle condizioni di coltura.
5. Differenziamento di cellule NK derivate da GPC3 CAR iPSC da Spin EB
NOTA: Gli Spin EB GPC3 che esprimono CAR possono essere trasferiti in piastre a 24 pozzetti o piastre a 6 pozzetti rivestite con gelatina al 2% o senza rivestimento. Per le variazioni medie, le piastre a 6 pozzetti sono più adatte, mentre il rivestimento in gelatina al 2% migliora l'adesione degli EB.
- Preparare le piastre a 6 pozzetti ricoperte di gelatina seguendo i passaggi seguenti.
- Preparare una soluzione di gelatina al 2% (p/v) sciogliendo la gelatina in acqua di coltura tissutale.
- Sterilizzare la soluzione in autoclave a 121 °C, 15 psi per 30 min.
- Rivestire la superficie di ciascun pozzetto con 5-10 μL di soluzione di gelatina per cm2 (~1 mL per pozzetto di una piastra a 6 pozzetti).
- Incubare le piastre a 37 °C per 2-4 ore prima dell'uso. Dopo l'incubazione, aspirare l'eventuale soluzione di gelatina rimanente prima di procedere con il trasferimento degli EB.
- Preparare il terreno di differenziazione delle cellule NK: aggiungere il 56,6% di DMEM+ GlutaMAX-I, il 28,3% di F12+ GlutaMAX-I, il 15% di siero AB umano inattivato termicamente, l'1% di P/S, 2 mM di L-glutammina, 1 μM di β-mercaptoetanolo, 5 ng/mL di selenito di sodio, 50 μM di etanolammina e 20 mg/L di acido ascorbico. Conservare a 4 °C al buio.
- Aggiungere 3 mL di terreno di differenziazione NK contenente le seguenti citochine a ciascun pozzetto delle piastre a 6 pozzetti rivestite di gelatina (IL-3: 5 ng/mL, SCF: 20 ng/mL, IL-7: 20 ng/mL e IL-15: 10 ng/mL).
- Il giorno 6, trasferire gli Spin EB direttamente nelle piastre a 6 pozzetti rivestite di gelatina preparate contenenti terreno di differenziazione NK seguendo i passaggi seguenti.
- Trasferire con cura gli EB da piastre da 96 pozzetti a una piastra da 10 cm, utilizzando una pipetta sierologica da 10 ml per rimuovere la maggior parte del terreno.
- Aggiungere 3 mL di terreno di differenziazione NK contenente le citochine di cui sopra a ciascun pozzetto della piastra a 6 pozzetti rivestita di gelatina.
- Distribuire 16-20 EB in ciascun pozzetto della piastra a 6 pozzetti utilizzando una micropipetta da 1 mL.
NOTA: In media, gli EB di una singola piastra a 96 pozzetti possono essere utilizzati per seminare una piastra a 6 pozzetti per la piastra di differenziazione NK.
- Eseguire cambi medi ogni 5-7 giorni. Dopo la prima settimana di differenziazione delle cellule NK, escludere IL-3 dal terreno.
NOTA: Dopo 14 giorni, il mezzo deve essere cambiato ogni 3-4 giorni. - Continuare i cambi medi per 3-4 settimane. Valutare l'espressione di marcatori cellulari NK (CD45+CD56+) mediante citometria a flusso24,42 su cellule in sospensione.
- Quando >80% delle cellule in sospensione esprime CD45+CD56+, raccogliere le cellule facendole passare attraverso un filtro da 70 μm per rimuovere eventuali grumi.
- La co-coltura ha raccolto cellule NK con 100 aAPC34,48 grigie irradiate e coltura in terreno di espansione NK contenente IL-2 (100ng/mL) e IL-15 (10 ng/mL).
6. Espansione di cellule NK derivate da iPSC CAR anti-GPC3
NOTA: Tipicamente, da una singola piastra a 6 pozzetti si può ottenere una resa di 2-20 × 10celle NK , anche prima dell'espansione. Per facilitare l'ulteriore espansione delle cellule NK per le applicazioni a valle, vengono impiegate cellule presentanti l'antigene artificiale (aAPC) per generare >1 × 109 cellule NK.
- Utilizzare cellule K562 ingegnerizzate che esprimono 41BBL e IL-21 legata alla membrana (41BBL-mbIL-21)48 come aAPC per indurre l'espansione delle cellule NK.
- Prima di co-coltivare aAPC con cellule NK, irradiare aAPC con 100 gray e conservarle come ceppi congelati.
- Raccogliere le cellule in sospensione dalla piastra a 6 pozzetti e coltivare le cellule NK in un terreno di espansione NK integrato con 50 U/mL di IL-2 e IL-15 (10 ng/mL; da aggiungere fresco) a una densità di 5 × 105 cellule/mL.
- Aggiungere aAPC irradiate scongelate alle cellule NK con un rapporto 1:1.
- Reintegrare il terreno di coltura ogni 3-4 giorni, aggiungendo IL-2 e IL-15 freschi a una concentrazione di 50 U/mL e 10 ng/mL, rispettivamente.
- Assicurarsi che le cellule NK derivate da CAR iPSC mantengano la capacità di espansione per un periodo di >3 mesi, mantenendo sia la vitalità cellulare che l'attività citolitica.
7. Caratterizzazione fenotipica e funzionale di cellule NK GPC3 CAR derivate da iPSC
NOTA: La caratterizzazione delle cellule NK derivate da GPC3 CAR iPSC comporta una valutazione completa del loro profilo fenotipico e della loro attività funzionale.
- Valutare l'espressione dei recettori di attivazione NK, tra cui CD45, CD56, CD94, CD16, NKp30, NKp44, NKp46, NKG2D, DNAM, TRAIL e FasL, sulle cellule NK derivate da iPSC CAR anti-GPC3 attraverso la citometria a flusso24,42 per determinare l'attività delle cellule CAR NK e lo stato di maturazione (Figura 4).
- Valutare l'attività funzionale in vitro delle cellule NK derivate da GPC3 CAR iPSC utilizzando saggi Caspase-3/7 basati sulla citometria a flusso, saggi di rilascio di granuli CD107a, saggi di rilascio di citochine IFN-γ e TNF-α contro vari bersagli tumorali.
- Per il test Caspase3/7, seguire i passaggi seguenti.
- Contare le cellule bersaglio e precolorarle con colorante fluorescente per tracciatura cellulare a una concentrazione finale di 5 μM in PBS per 15 minuti a 37 °C.
- Lavare le cellule bersaglio colorate in un terreno di coltura completo prima della co-coltura con cellule NK derivate da CAR iPSC a vari rapporti effettore-bersaglio (E:T) a 37 °C.
- Dopo 3 ore e 30 minuti di co-coltura, aggiungere il reagente di rilevazione verde Caspasi-3/7 per altri 30 minuti di incubazione, ottenendo un tempo di incubazione totale di 4 ore.
- Aggiungere 1 μL di soluzione di colorazione delle cellule morte durante gli ultimi 5 minuti di colorazione e mescolare delicatamente.
- Analizzare le cellule colorate utilizzando la citometria a flusso23,41 (Figura 5).
- Implementare questo protocollo per garantire una comprensione completa delle caratteristiche fenotipiche e dell'attività funzionale delle cellule NK derivate da GPC3 CAR iPSC, consentendo una solida valutazione del loro potenziale terapeutico.
NOTA: In genere sono necessarie 4-5 settimane per ottenere il >90% di cellule CD45+CD56+ da GPC3 CAR derivate da iPSC basate su spin EB, differenziazione di cellule NK derivate da iPSC e condizioni di espansione NK utilizzando linee GPC3 CAR iPSC. Alcune linee cellulari iPSC potrebbero richiedere solo 3 settimane e alcune linee potrebbero richiedere più tempo (circa 4-5 settimane).
8. Risoluzione dei problemi e soluzioni
NOTA: La risoluzione dei problemi relativi alla differenziazione, all'espansione e al test funzionale delle cellule CAR NK GPC3 derivate da iPSC utilizzando il metodo del corpo embrioide di spin (EB) può comportare diversi passaggi. Di seguito sono riportati alcuni problemi comuni che si possono incontrare, insieme alle soluzioni suggerite:
- Sintomi di formazione incoerente di EB
- Controlla se gli EB sono troppo piccoli o troppo grandi, con forme irregolari.
- Soluzione per la formazione incoerente di EB
- Regolare la velocità e la durata della centrifuga utilizzate per formare gli EB. Una velocità di circa 200-300 × g per 5-10 minuti è tipica.
- Assicurarsi che vengano utilizzate le piastre con fondo a U appropriate o le piastre di coltura a bassissimo attacco per facilitare la formazione di EB.
- Confermare che le iPSC siano omogenee e prive di cellule differenziate che potrebbero influenzare la formazione di EB.
- Sintomi di una scarsa differenziazione delle iPSC in cellule NK
- Verificare la presenza di una bassa espressione dei marcatori delle cellule NK (ad es. CD56, NKp46).
- Verificare la mancata formazione di EB o EB mal formati.
- Soluzione per la scarsa differenziazione delle iPSC in cellule NK
- Assicurarsi che le concentrazioni di fattori di crescita essenziali (ad es. VEGF, BMP4, Y-27632, FLT3, IL-15, IL-7, SCF e IL-3) siano ottimali per la formazione di EB e la differenziazione delle cellule NK. Regolare le concentrazioni in base a studi precedenti 23,34,41.
- Assicurarsi che la densità di semina iniziale delle iPSC sia appropriata. In genere, per la formazione di spin EB si raccomanda una densità di 8000-10.000 cellule/100 μl.
- Verificare che il mezzo di differenziazione sia formulato correttamente, compresi gli integratori necessari (ad esempio, alternative al siero o senza siero, altre citochine).
- Attendere un tempo sufficiente per la formazione di EB, da un minimo di 6 giorni a un massimo di 12 giorni prima di passare al terreno di differenziazione delle cellule NK.
- Sintomi di scarsa espansione delle cellule NK
- Verificare la presenza di una resa limitata delle celle durante l'espansione.
- Verificare la ridotta vitalità delle cellule NK espanse.
- Soluzioni per la scarsa espansione delle celle NK
- Aumentare la concentrazione di IL-15 e IL-2 durante la fase di espansione. Questo può migliorare significativamente la proliferazione delle cellule NK.
- Prendere in considerazione l'utilizzo di cellule feeder come le aAPC irradiate per migliorare la sopravvivenza e l'espansione delle cellule NK.
- Monitorare regolarmente la densità cellulare e far passare le cellule prima che raggiungano il sovraffollamento per mantenere le condizioni di crescita ottimali.
- Sintomi di risultati dei test funzionali non ottimali
- Verificare la riduzione della citotossicità contro le cellule bersaglio.
- Verificare la presenza di bassi livelli di secrezione di citochine (ad es. IFN-γ, TNF-α).
- Soluzioni per risultati di test funzionali non ottimali
- Ottimizzare il rapporto bersaglio/effettore nei saggi di citotossicità. Inizia con un rapporto 10:1 e regola in base ai risultati.
- Assicurarsi che le cellule NK siano adeguatamente attivate prima dei saggi funzionali. Ciò può includere la pre-stimolazione con citochine o la co-coltura con aAPC irradiate.
- Verificare la sensibilità della linea cellulare bersaglio alla lisi cellulo-mediata NK. Utilizzare destinazioni sensibili note come controlli.
- Prolungare la durata dei saggi funzionali per consentire un tempo sufficiente per la manifestazione dell'attività delle cellule NK.
- Sintomi dei livelli variabili di espressione di CAR
- Verificare l'espressione incoerente di CAR tra le cellule NK.
- Soluzioni per livelli di espressione CAR variabili
- Verificare l'efficienza del metodo di trasfezione CAR (ad es. trasduzione virale, elettroporazione). Se necessario, regolare il MOI (molteplicità di infezioni) o le condizioni di elettroporazione.
- Implementare marcatori di selezione appropriati per arricchire le cellule CAR+ NK. Se necessario, utilizzare la selezione degli antibiotici o la selezione dei marcatori fluorescenti.
Risultati
Diagramma schematico della differenziazione e dell'espansione delle cellule NK derivate da iPSC anti-GPC3-CAR
Il diagramma schematico illustra la differenziazione in vitro di cellule NK ingegnerizzate anti-GPC3-CAR derivate da cellule staminali pluripotenti indotte umane (iPSC) e una rappresentazione schematica del vettore piggyBac che trasporta il costrutto GPC3 CAR. Inizialmente, le iPSC non modificate vengono trasfettate con un vettore piggyBac che codifica per il CAR (recettore chimerico dell'antigene) GPC3. Dopo la trasfezione, queste iPSC che esprimono GPC3 CAR vengono espanse clonalmente e quindi differenziate in cellule NK funzionali derivate da iPSC CAR. Queste cellule NK ingegnerizzate vengono successivamente sottoposte a saggi funzionali in vitro e in vivo per valutare la loro attività antitumorale contro varie linee cellulari tumorali (Figura 1).
Analisi microscopica del processo di differenziazione NK di iPSC ingegnerizzate con WT e anti-GPC3-CAR in varie fasi
Le iPSC ingegnerizzate con GPC3 CAR si differenziano in cellule iPSC NK ingegnerizzate con anti-GPC3-CAR. La formazione di corpi embrioidi di spin (EB) da iPSC ingegnerizzate con GPC3 CAR, fino alla differenziazione di cellule NK iPSC GPC3-CAR sono state presentate come una serie di immagini microscopiche che documentano gli stadi di differenziazione delle iPSC ingegnerizzate anti-GPC3-CAR in cellule NK iPSC CAR GPC3 funzionali. Le iPSC CAR wild-type (WT) indifferenziate e GPC3 sono state coltivate in terreno mTeSR Plus (Figura 2A). Queste iPSC WT e anti-GPC3-CAR vengono quindi dissociate in singole cellule e coltivate in terreno STEMdiff APEL contenente SCF (40 ng/mL), BMP4 (20 ng/mL), VEGF (20 ng/mL) e 10 μM di inibitore di ROCK per 6 giorni in una piastra a 96 pozzetti con fondo a U a bassissimo attacco. La formazione di EB di spin è stata catturata il giorno 6 da entrambe le iPSC CAR WT e GPC3 (Figura 2B). Questi EB di spin vengono ulteriormente trasferiti a una piastra a 6 pozzetti contenente terreno di differenziazione NK con le seguenti citochine IL-3 (5 ng/mL), SCF (20 ng/mL), IL-7 (20 ng/mL) e IL-15 (10 ng/mL). Il processo di differenziazione delle cellule NK derivate da WT e GPC3 CAR iPSC in vari punti temporali dal giorno 3 al giorno 28, è stato catturato utilizzando un microscopio con ingrandimento 100x (Figura 2C).
Fenotipo delle EB derivate da WT e anti-GPC3 CAR iPSC (giorno 6) e delle cellule NK derivate da WT e GPC3 CAR iPSC (giorno 35)
Le cellule derivate da iPSC WT e GPC3 CAR sono caratterizzate fenotipicamente in diversi stadi del processo di differenziazione NK. Il pannello A mostra l'espressione degli antigeni ematopoietici tipici CD34, CD31, CD43 e CD45 dagli EB di spin delle iPSC CAR WT e GPC3 raccolte il giorno 6 sono state misurate mediante citometria a flusso (Figura 3A). Il pannello b presenta il fenotipo delle cellule NK derivate da WT e GPC3 CAR iPSC raccolte dal terreno di differenziazione NK il giorno 35, evidenziando che i marcatori specifici per NK (CD45, CD56, CD16 e NKG2D) associati alle cellule NK mature sono stati misurati mediante citometria a flusso (Figura 3B).
Fenotipo delle cellule NK derivate da WT espanso e iPSC anti-GPC3-CAR
Dopo la differenziazione delle cellule NK derivate da WT e iPSC anti-GPC3 CAR, le cellule NK differenziate vengono raccolte ed espanse utilizzando aAPC irradiate in un terreno Gibco NK Xpander contenente IL-2 (100 U/mL) e IL-15 (10 ng/mL). I recettori di attivazione delle cellule NK iPSC iPSC CAR espansi per la WT e anti-GPC3 come CD94, CD16, NKp30, NKp44, NKp46, NKG2D, CD226, FasL e TRAIL sono stati misurati utilizzando la citometria a flusso (Figura 4A). Dopo aver confermato il fenotipo di attivazione NK sulle cellule NK iPSC CAR espanse e anti-GPC3, abbiamo valutato l'espressione superficiale dell'antigene GPC3 su varie linee cellulari tumorali, tra cui HepG2, SNU-449, SKOV3 e CAL27, tramite citometria a flusso (Figura 4B). Abbiamo anche confermato l'espressione di CAR su cellule NK espanse anti-GPC3 derivate da iPSC anti-GPC3 mediante analisi citofluorimetrica.
Attività funzionale delle cellule NK derivate da WT e anti-GPC3 CAR iPSC contro HCC e altre linee cellulari tumorali
Dopo aver confermato il fenotipo delle cellule NK derivate da WT e CAR anti-GPC3 iPSC, abbiamo valutato l'attività antitumorale funzionale contro varie linee cellulari tumorali. Sono stati condotti saggi di uccisione basati su caspasi3/7 per valutare l'attività citotossica delle cellule NK derivate da WT e CAR iPSC anti-GPC3 contro le linee cellulari HepG2, SNU-449, CAL27 e SKOV3 a vari rapporti effettore-bersaglio. I risultati indicano una maggiore efficacia antitumorale delle cellule NK derivate da iPSC anti-GPC3 CAR rispetto alle cellule NK WT iPSC, mostrando il loro potenziale nel colpire le cellule tumorali che esprimono GPC3 attraverso la specificità CAR e altri meccanismi di attivazione NK (Figura 5A-D).

Figura 1: Diagramma schematico della differenziazione, espansione e applicazione clinica delle NK derivate da iPSC anti-GPC3-CAR. (A) Panoramica del processo di generazione di cellule NK derivate da iPSC anti-GPC3 CAR per uso preclinico e clinico. Le iPSC non modificate vengono trasfettate con un vettore piggyBac che trasporta il gene anti-GPC3-CAR. Dopo una trasfezione riuscita, le iPSC che esprimono anti-GPC3-CAR vengono espanse clonalmente e differenziate in cellule NK funzionali. Queste cellule NK derivate da iPSC anti-GPC3 CAR sono sottoposte a saggi funzionali sia in vitro che in vivo per valutare la loro attività citotossica contro varie linee cellulari tumorali che esprimono GPC339. Dopo la convalida della loro efficacia e sicurezza, queste cellule NK derivate da CAR iPSC vengono ulteriormente sviluppate come potenziale terapia "off-the-shelf" per applicazioni cliniche nel trattamento del cancro. (B) Rappresentazione schematica del vettore piggyBac contenente il costrutto CAR anti-GPC3 utilizzato per la trasfezione di iPSC. (C) Cronologia tipica della differenziazione, espansione, raccolta ed esecuzione di saggi funzionali delle cellule NK derivate da iPSC. Clicca qui per visualizzare una versione più grande di questa figura.
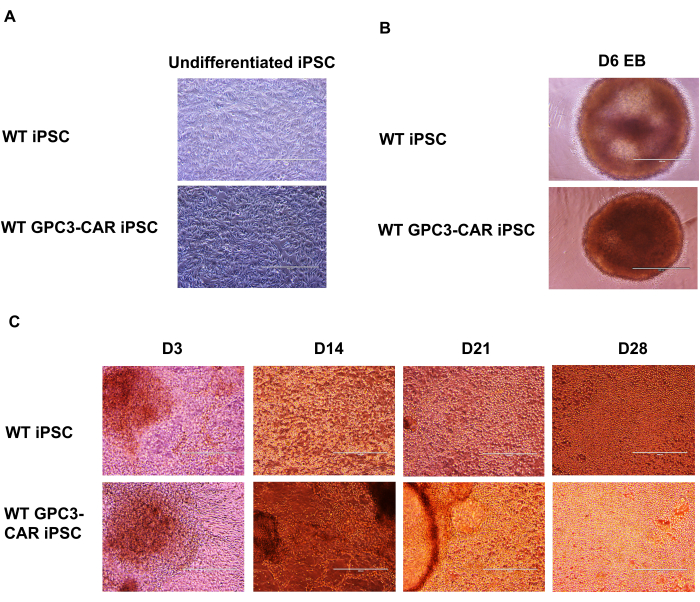
Figura 2: Immagini microscopiche della differenziazione di CAR iPSC NK da iPSC ingegnerizzate anti-GPC3-CAR in diversi stadi. (A) iPSC CAR indifferenziate WT e GPC3 coltivate in mTeSR più terreno. (B) WT e GPC3 CAR iPSC spin embryoid body il giorno 6. (C) Differenziazione delle cellule NK derivate da WT e GPC3 CAR iPSC in giorni diversi da D3 a D28. Ingrandimento di 100x da a a c. Clicca qui per visualizzare una versione più grande di questa figura.
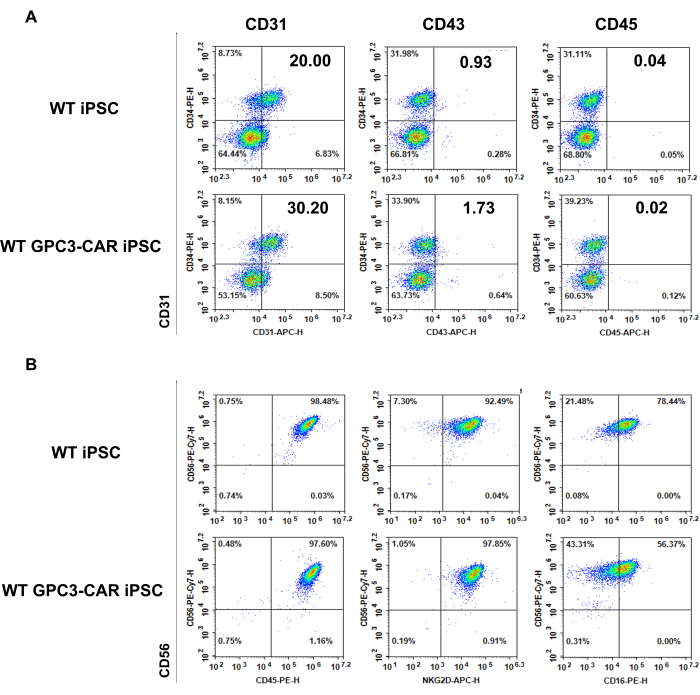
Figura 3: Fenotipo delle cellule EB del giorno 6 derivate da WT e anti-GPC3 CAR iPSC e cellule NK differenziate derivate da WT e GPC3 CAR iPSC al giorno 35. (A) Antigeni ematopoietici tipici espressi sulle iPSC WT e GPC3 CAR al giorno 6 del Differenziamento del Differenziamento ematopoietico. (B) Fenotipo di WT e GPC3 CAR Le cellule NK derivate da iPSC vengono raccolte dal terreno di differenziazione NK il giorno 35. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4: Fenotipo delle cellule NK derivate da WT e anti-GPC3-CAR iPSC dopo l'espansione. (A) Le cellule NK derivate da WT e GPC3 CAR iPSC sono state espanse nel terreno Gibco NK Xpander e i marcatori di maturazione NK sono stati valutati utilizzando la citometria a flusso. (B) L'espressione superficiale dell'antigene GPC3 su varie linee cellulari tumorali, tra cui HepG2, SNU-449, SKOV3 e CAL27, è stata misurata mediante citometria a flusso. (C) Istogramma rappresentativo che mostra l'espressione di CAR sulle cellule NK derivate da GPC3 CAR iPSC dopo l'espansione. Il costrutto CAR incorporato con tag FLAG e GFP per misurare il CAR mediante citometria a flusso. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 5: Attività funzionale delle cellule NK derivate da WT e anti-GPC3 CAR iPSC contro HCC e altre linee cellulari tumorali. (A-D) Attività antitumorale delle cellule NK derivate da WT e GPC3 CAR iPSC sono state testate contro varie linee cellulari tumorali, tra cui HepG2, SNU-449, CAL27 e SKOV3. L'asse X rappresenta i rapporti E:T delle cellule NK WT e anti-GPC3 CAR derivate da iPSC testate contro HepG2, SNU-449, CAL27 e SKOV3. I rapporti E:T specifici indicati sull'asse x sono 10:1, 5:1, 2,5:1, 1:1, 0,5:1 e 0,25:1. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Questo protocollo delinea un approccio standardizzato e riproducibile per la generazione di cellule NK derivate da iPSC che esprimono CAR da una fonte cellulare coerente, con l'obiettivo di facilitare l'immunoterapia oncologica mirata "off-the-shelf". Diversi studi preclinici e clinici hanno dimostrato l'efficacia dell'immunoterapia adottiva basata su cellule NK nel trattamento dei tumori, riducendo al minimo le tossicità, come le malattie del trapianto contro l'ospite (GvHD) o la sindrome da rilascio di citochine (CRS)23,42, 49,50,51,52,53,54,55,56,57 . Questo approccio utilizza un sistema efficiente e ben definito per produrre cellule NK CAR derivate da iPSC omogenee e ben caratterizzate che possono essere scalate per l'applicazione clinica. Inoltre, le cellule NK derivate da iPSC ingegnerizzate per esprimere CAR ottimizzate per NK mantengono i fenotipi tipici delle cellule NK e le funzioni citolitiche 23,39,42,50,51,52,58.
L'utilizzo di iPSC umane per la produzione di cellule NK derivate da iPSC CAR offre un metodo più efficiente per la modificazione genetica, compresa l'espressione di CAR, rispetto alle cellule NK primarie isolate dal sangue periferico 31,59,60. Oltre all'espressione di CAR, ulteriori miglioramenti dell'attività antitumorale di queste cellule possono essere ottenuti attraverso modifiche come la delezione di recettori inibitori o l'introduzione di espressione di citochine 41,39,61. Ciò può essere ottenuto attraverso un singolo evento di modificazione genetica, eliminando la necessità di modifiche specifiche del paziente, come si vede nelle attuali terapie cellulari CAR-T 31,62,63. Inoltre, le terapie basate su cellule NK con nuove cellule che esprimono CAR possono potenzialmente essere utilizzate nel trattamento di malattie infettive croniche 30,64,65,66,67,68.
Questo protocollo dimostra collettivamente il potenziale dell'utilizzo di iPSC umane per creare popolazioni omogenee di cellule NK che esprimono CAR per migliorare l'attività antitumorale in vitro e in vivo . I CAR ottimizzati per le cellule NK consentono l'attivazione antigene-specifica delle vie di segnalazione, migliorando la funzione di queste cellule. Le modifiche e la risoluzione dei problemi sono essenziali per ottimizzare la resa e la funzionalità delle celle CAR NK. La regolazione del cocktail di citochine e dei tempi può migliorare l'efficienza della differenziazione. Garantire la stabilità e l'espressione del costrutto CAR nelle cellule NK può richiedere l'ottimizzazione dei metodi di trasfezione o della progettazione vettoriale. Un'ulteriore risoluzione dei problemi potrebbe risolvere problemi quali la bassa efficienza di trasduzione, la vitalità cellulare e l'attività funzionale delle cellule NK derivate da CAR iPSC e potrebbe comportare test iterativi di diverse condizioni di coltura o modifiche genetiche per migliorare la persistenza, la citotossicità e la sicurezza.
L'importanza del nostro metodo risiede nella sua capacità di generare una fornitura potenzialmente illimitata di cellule CAR NK da una fonte iPSC standardizzata. Le cellule CAR NK derivate da iPSC offrono una piattaforma stabile per molteplici modifiche genetiche, riducendo la variabilità e migliorando la consistenza delle cellule ingegnerizzate. Questo metodo consente anche la creazione di terapie cellulari NK "pronte all'uso" pronte per l'uso immediato, evitando la necessità di approvvigionamento e lavorazione cellulare individualizzati.
Inoltre, questo protocollo presenta alcune limitazioni nel mantenere la stabilità dell'espressione CAR quando si utilizzano vettori piggyBac, poiché la natura transitoria dell'integrazione del transgene può comportare livelli di espressione variabili nel tempo. Inoltre, la dipendenza da aAPC e citochine specifiche per l'espansione può complicare la scalabilità di questi processi per applicazioni cliniche. Infine, le potenziali risposte immunitarie contro gli elementi piggyBac possono comportare rischi in contesti terapeutici.
In conclusione, la differenziazione e l'espansione delle cellule CAR-NK da iPSC umane sono molto promettenti per il trattamento del carcinoma epatocellulare (HCC) e di altre neoplasie. Questo approccio innovativo sfrutta il potenziale rigenerativo delle iPSC e le proprietà immunitarie innate delle cellule NK per creare un'immunoterapia del cancro potente e mirata. I progressi in questo campo potrebbero portare a terapie basate su cellule NK più efficaci e ampiamente disponibili, offrendo nuove speranze per i pazienti con HCC e altre malattie difficili da trattare.
Divulgazioni
DSK è co-fondatore e consulente di Shoreline Biosciences e detiene una partecipazione azionaria nella società. DSK è anche consulente per Therabest e RedC Bio per i quali riceve reddito e/o capitale proprio. I termini di questi accordi sono stati esaminati e approvati dall'Università della California, San Diego, in conformità con le sue politiche sul conflitto di interessi. Gli altri autori dichiarano di non avere interessi concorrenti.
Riconoscimenti
Ringraziamo tutti i membri del laboratorio Kaufman per il loro supporto, le intuizioni scientifiche e le discussioni. Questi studi sono stati supportati dalle sovvenzioni NIH/NCI U01CA217885, P30CA023100 (supplemento amministrativo) e dal Sanford Stem Cell Institute dell'UCSD. JT: scrittura e revisione del manoscritto. DSK: ha rivisto e curato il manoscritto.
Materiali
| Name | Company | Catalog Number | Comments |
| aAPC | Dean A. Lee lab | N/A | |
| a-MEM culture medium | Fisher Scientific | Cat#12634 | |
| APC anti-DYKDDDDK (FLAG Tag) | BD Biosciences | Cat#637308 | |
| APC-anti-human TRA-1-81 | ThermoFisher | 17-8883-42 | |
| APC-CD16 | BD Biosciences | Cat#302015 | |
| APC-CD43 | BD Biosciences | Cat# 560198 | |
| APC-CD45 | BD Biosciences | Cat# 555485 | |
| APC-GPC3 | BD Biosciences | Cat#DB100B | |
| APC-NKG2D | BD Biosciences | Cat# 558071 | |
| CellEvent Caspase-3/7 Green Detection Reagent | Thermo fisher | Cat#C10423 | |
| CellTrace Violet Cell Proliferation Kit | Thermo fisher | Cat#C34571 | Cell tracing fluorescent dye |
| CryoStor solution | Stem Cell Technologies | https://www.stemcell.com/products/cryostor-cs10.html | Cryopreservation medium |
| CTS NK Xpander | Gibco | A5019001 | |
| CTS NK-Xpander Medium | Life Technologies | Cat#A5019001 | |
| DMEM | Gibco | 11965084 | |
| DMEM, high glucose, GlutaMAX Supplement, pyruvate | Gibco | 10569010 | |
| EasySep Human NK Cell Enrichment Kit | StemCell Technologies, Inc. | Cat#19055 | |
| Ethanolamine | Sigma Aldrich | E9508 | |
| Fetal bovine serum | Fisher Scientific | Cat# 10437010 | |
| FITC-CD94 | BD Biosciences | Cat#555888 | |
| GlutaMAX Supplement | Gibco | 35050061 | |
| GolgiPlug | BD Biosciences | Cat#555029 | |
| GolgiStop | BD Biosciences | Cat#554724 | |
| Ham's F-12 Nutrient Mix, GlutaMAX Supplement | Gibco | 31765035 | |
| Horse serum | Fisher Scientific | Cat#16050130 | |
| Human Serum | AB Sigma-Aldrich | Cat#BP2525100 | |
| Human Stem Cell NucleofectorTM Kit | Lonza | Cat# VPH-5012 | |
| Human: HePG2 cells | ATCC | Cat#HB-8065 | |
| Human: HePG2-td-tomato-luc cells | Dan S. Kaufman lab | N/A | |
| Human: iPS cells | Dan S. Kaufman lab | N/A | |
| Human: SNU-449 cells | ATCC | Cat#CRL-2234 | |
| Human: SNU-449-td-tomato-luc cells | Dan S. Kaufman lab | N/A | |
| IncuCyte Caspase-3/7 Green Apoptosis Assay | Essenbioscience | Cat#4440 | |
| L-Ascorbic acid | Sigma Aldrich | A5960 | |
| MP Biomedicals Human Serum, Type AB | MP Biomedicals | ICN2938249 | |
| mTeSR plus | StemCell Technologies, Inc. | 100-0276 | |
| NovoExpress software | ACEA Biosciences | https://www.agilent.com/en/product/research-flow-cytometry/flow-cytometry-software/novocyte-novoexpress-software-1320805 | |
| PE/Cy7 anti-human SSEA-4 Antibody | Biolegend | 330420 | |
| PE-CD16 | BD Biosciences | Cat#560995 | |
| PE-CD226 | BD Biosciences | Cat#559789 | |
| PE-CD34 | BD Biosciences | Cat# 555822 | |
| PE-CD45 | BD Biosciences | Cat# 555483 | |
| PE-CD94 | BD Biosciences | Cat#555888 | |
| PE-cy7-CD56 | BioLegend | Cat# 318318 | |
| PE-FAS Ligand | BD Biosciences | Cat#564261 | |
| PE-NKp30 | BD Biosciences | Cat# 558407 | |
| PE-NKp44 | BD Biosciences | Cat#558563 | |
| PE-NKp46 | BD Biosciences | Cat#331908 | |
| PE-NKp46 | BD Biosciences | Cat#557991 | |
| Peripheral blood buffy coat | San Diego Blood Bank (https://www. sandiegobloodbank.org/) | N/A | |
| PE-TRAIL | BD Biosciences | Cat#565499 | |
| pKT2-mCAG-IRES-GFP-ZEO | Branden Moriarity lab | N/A | |
| pMAX-GFP plasmid | Lonza | N/A | GFP positive control |
| Prism 9 | Graphpad | Version 9 | |
| pSpCas9 | GenScript | PX165 | |
| RBC Lysis Buffer (10x) | Biolegend | Cat#420301 | |
| Recombinant human bFGF basic | R&D Systems | Cat#4114-TC | |
| Recombinant human BMP-4 | PeproTech | Cat#120-05 | |
| Recombinant human FLT-3 Ligand | PeproTech | Cat# 300-19 | |
| Recombinant human IL-15 | PeproTech | Cat# 200-15 | |
| Recombinant human IL-2 | PeproTech | Cat# 200-02 | |
| Recombinant human IL-3 | PeproTech | Cat#200-03 | |
| Recombinant human IL-7 | PeproTech | Cat# 200-07 | |
| Recombinant Human Nodal Protein | R&D Systems | Cat#3218-ND-025 | |
| Recombinant human SCF | PeproTech | Cat# 300-07 | |
| Recombinant Human TGF-β1 | PeproTech | Cat#100-21 | |
| Recombinant human VEGF | PeproTech | Cat# 100-20 | |
| RPMI1640 | Gibco | 11875093 | |
| Sodium selenite | Sigma Aldrich | 214485 | |
| STEMdiff APEL 2 Medium | StemCell Technologies, Inc. | 5270 | EB formation medium |
| STEMdiff APEL2 Medium | StemCell Technologies, Inc. | Cat#05270 | |
| Super piggyBac Transposase expression vector | SBI | Cat#PB210PA-1 | |
| SYTOX AADvanced Dead Cell Stain Kit | ThermoFisher Scientific | S10274, S10349 | Dead cell staining solution kit |
| β-mercaptoethanol | Gibco | 21985023 |
Riferimenti
- Chan, I. S., Ewald, A. J. The changing role of natural killer cells in cancer metastasis. J Clin Invest. 132 (6), e143762 (2022).
- Yu, Y. The function of NK cells in tumor metastasis and NK cell-based immunotherapy. Cancers (Basel). 15 (8), 2323 (2023).
- Paul, S., Lal, G. The molecular mechanism of natural killer cells function and its importance in cancer immunotherapy. Front Immunol. 8, 1124 (2017).
- Myers, J. A., Miller, J. S. Exploring the NK cell platform for cancer immunotherapy. Nat Rev Clin Oncol. 18 (2), 85-100 (2021).
- Llovet, J. M., et al. Hepatocellular carcinoma. Nat Rev Dis Primers. 7, 6 (2021).
- Yang, Y., Xiong, L., Li, M., Jiang, P., Wang, J., Li, C. Advances in radiotherapy and immunity in hepatocellular carcinoma. J Transl Med. 21 (1), 526 (2023).
- Rich, N. E., Yopp, A. C., Singal, A. G. Medical management of hepatocellular carcinoma. J Oncol Pract. 13 (6), 356-364 (2017).
- Niu, M., Yi, M., Li, N., Wu, K., Wu, K. Advances of Targeted Therapy for Hepatocellular Carcinoma. Front Oncol. 11, 719896 (2021).
- Yu, S. J. Immunotherapy for hepatocellular carcinoma: Recent advances and future targets. Pharmacol Ther. 244, 108387 (2023).
- Ntellas, P., Chau, I. Updates on systemic therapy for hepatocellular carcinoma. Am Soc Clin Oncol Educ Book. 44, e430028. 44, e430028 (2024).
- Liu, T. -. H., Shen, Y. -. C., Cheng, A. -. L. Immune checkpoint inhibitors for hepatocellular carcinoma - A game changer in treatment landscape. J Formos Med Assoc. 121 (8), 1371-1383 (2022).
- Sun, Q., Hong, Z., Zhang, C., Wang, L., Han, Z., Ma, D. Immune checkpoint therapy for solid tumours: clinical dilemmas and future trends. Signal Transduct Target Ther. 8 (1), 320 (2023).
- Huang, A., Yang, X. -. R., Chung, W. -. Y., Dennison, A. R., Zhou, J. Targeted therapy for hepatocellular carcinoma. Signal Transduct Target Ther. 5 (1), 146 (2020).
- Girardi, D. M., Pacífico, J. P. M., Guedes de Amorim, F. P. L., Dos Santos Fernandes, G., Teixeira, M. C., Pereira, A. A. L. Immunotherapy and targeted therapy for hepatocellular carcinoma: A literature review and treatment perspectives. Pharmaceuticals (Basel). 14 (1), 28 (2020).
- Laface, C., et al. Targeted therapy for hepatocellular carcinoma: Old and new opportunities. Cancers (Basel). 14 (16), 4028 (2022).
- Shyam Sunder, S., Sharma, U. C., Pokharel, S. Adverse effects of tyrosine kinase inhibitors in cancer therapy: pathophysiology, mechanisms and clinical management. Signal Transduct Target Ther. 8 (1), 262 (2023).
- Cappell, K. M., Kochenderfer, J. N. Long-term outcomes following CAR T cell therapy: what we know so far. Nat Rev Clin Oncol. 20 (6), 359-371 (2023).
- June, C. H., O'Connor, R. S., Kawalekar, O. U., Ghassemi, S., Milone, M. C. CAR T cell immunotherapy for human cancer. Science. 359 (6382), 1361-1365 (2018).
- Schuster Stephen, J., et al. Chimeric antigen receptor T cells in refractory B-cell lymphomas. N Engl J Med. 377 (26), 2545-2554 (2017).
- Schmidt, D., et al. Engineering CAR-NK cells: how to tune innate killer cells for cancer immunotherapy. Immunother Adv. 2 (1), Itac003 (2022).
- Zhang, B., et al. Chimeric antigen receptor-based natural killer cell immunotherapy in cancer: from bench to bedside. Cell Death Dis. 15 (1), 50 (2024).
- Wang, K., et al. Reprogramming natural killer cells for cancer therapy. Mol Ther. 32 (9), 2835-2855 (2024).
- Li, Y., Hermanson, D. L., Moriarity, B. S., Kaufman, D. S. Human iPSC-derived natural killer cells engineered with chimeric antigen receptors enhance antitumor activity. Cell Stem Cell. 23 (2), 181-192.e5 (2018).
- Liu, E., Marin, D., et al. Use of CAR-transduced natural killer cells in CD19-positive lymphoid tumors. N Engl J Med. 382 (6), 545-553 (2020).
- Chen, L., Xie, T., Wei, B., Di, D. L. Current progress in CAR-T cell therapy for tumor treatment. Oncol Lett. 24 (4), 358 (2022).
- Rafiq, S., Hackett, C. S., Brentjens, R. J. Engineering strategies to overcome the current roadblocks in CAR T cell therapy. Nat Rev Clin Oncol. 17 (3), 147-167 (2020).
- Sterner, R. C., Sterner, R. M. CAR-T cell therapy: current limitations and potential strategies. Blood Cancer J. 11 (4), 69 (2021).
- Albinger, N., Hartmann, J., Ullrich, E. Current status and perspective of CAR-T and CAR-NK cell therapy trials in Germany. Gene Ther. 28 (9), 513-527 (2021).
- Dagher, O. K., Posey, A. D. Forks in the road for CAR T and CAR NK cell cancer therapies. Nat Immunol. 24 (12), 1994-2007 (2023).
- Xie, G., Dong, H., Liang, Y., Ham, J. D., Rizwan, R., Chen, J. CAR-NK cells: A promising cellular immunotherapy for cancer. EBioMedicine. 59, 102975 (2020).
- Cichocki, F., van der Stegen, S. J. C., Miller, J. S. Engineered and banked iPSCs for advanced NK- and T-cell immunotherapies. Blood. 141 (8), 846-855 (2023).
- Goldenson, B. H., Hor, P., Kaufman, D. S. iPSC-derived natural killer cell therapies - Expansion and targeting. Front Immunol. 13, 841107 (2022).
- Zhu, H., Kaufman, D. S. Engineered human pluripotent stem cell-derived natural killer cells: the next frontier for cancer immunotherapy. Blood Sci. 1 (1), 4-11 (2019).
- Knorr, D. A., et al. Clinical-scale derivation of natural killer cells from human pluripotent stem cells for cancer therapy. Stem Cells Transl Med. 2 (4), 274-283 (2013).
- Shimizu, Y., Suzuki, T., Yoshikawa, T., Endo, I., Nakatsura, T. Next-generation cancer immunotherapy targeting Glypican-3. Front Oncol. 9, 248 (2019).
- Schepers, E. J., Glaser, K., Zwolshen, H. M., Hartman, S. J., Bondoc, A. J. Structural and functional impact of posttranslational modification of Glypican-3 on liver carcinogenesis. Cancer Res. 83 (12), 1933-1940 (2023).
- Batra, S. A., et al. Glypican-3-specific CAR T cells coexpressing IL15 and IL21 have superior expansion and antitumor activity against hepatocellular carcinoma. Cancer Immunol Res. 8 (3), 309-320 (2020).
- Gao, W., et al. Immunotoxin targeting glypican-3 regresses liver cancer via dual inhibition of Wnt signalling and protein synthesis. Nat Commun. 6, 6536 (2015).
- Thangaraj, J. L., Coffey, M., Lopez, E., Kaufman, D. S. Disruption of TGF-β signaling pathway is required to mediate effective killing of hepatocellular carcinoma by human iPSC-derived NK cells. Cell Stem Cell. 31 (9), 1327-1343.e5 (2024).
- Maddineni, S., Silberstein, J. L., Sunwoo, J. B. Emerging NK cell therapies for cancer and the promise of next generation engineering of iPSC-derived NK cells. J Immunother Cancer. 10 (5), e004693 (2022).
- Zhu, H., et al. Metabolic reprograming via deletion of CISH in human iPSC-derived NK cells promotes in vivo persistence and enhances antitumor activity. Cell Stem Cell. 27 (2), 224-237.e6 (2020).
- Strati, P., et al. Preliminary results of a phase I trial of FT516, an off-the-shelf natural killer (NK) cell therapy derived from a clonal master induced pluripotent stem cell (iPSC) line expressing high-affinity, non-cleavable CD16 (hnCD16), in patients (pts) with relapsed/refractory (R/R) B-cell lymphoma (BCL). J Clin Oncol. 39, 7541-7541 (2021).
- Hong, D., et al. Preliminary results of an ongoing phase I trial of FT500, a first-in-class, off-the-shelf, induced pluripotent stem cell (iPSC) derived natural killer (NK) cell therapy in advanced solid tumors. J Immunother Cancer. 8 (3), A231-A232 (2020).
- Zah, E., et al. Systematically optimized BCMA/CS1 bispecific CAR-T cells robustly control heterogeneous multiple myeloma. Nat Commun. 11 (1), 2283 (2020).
- Ahn, S., et al. Cancer immunotherapy with T cells carrying bispecific receptors that mimic antibodies. Cancer Immunol Res. 7 (5), 773-783 (2019).
- Ludwik, K. A., Telugu, N., Schommer, S., Stachelscheid, H., Diecke, S. ASSURED-optimized CRISPR protocol for knockout/SNP knockin in hiPSCs. STAR Protoc. 4 (3), 102406 (2023).
- Zhu, H., Kaufman, D. S. An improved method to produce clinical scale natural killer cells from human pluripotent stem cells. Methods Mol Biol. 2048, 107-119 (2019).
- Denman, C. J., et al. Membrane-bound IL-21 promotes sustained ex vivo proliferation of human natural killer cells. PLoS One. 7 (1), e30264 (2012).
- Leivas, A., et al. NKG2D-CAR-transduced natural killer cells efficiently target multiple myeloma. Blood Cancer J. 11 (8), 146 (2021).
- Ramdial, J. L., et al. A phase II clinical trial of "Off-the-Shelf" NK cells with allogeneic stem cell transplantation to decrease disease relapse in patients with high-risk myeloid malignancies. Blood. 140 (Supplement 1), 7484-7485 (2022).
- Bachanova, V., et al. Initial clinical activity of FT596, a first-in-class, multi-antigen targeted, off-the-shelf, iPSC-derived CD19 CAR NK cell therapy in relapsed/refractory B-cell lymphoma. Blood. 136, 8 (2020).
- Bae, W. K., et al. A phase I study of locoregional high-dose autologous natural killer cell therapy with hepatic arterial infusion chemotherapy in patients with locally advanced hepatocellular carcinoma. Front Immunol. 13, 879452 (2022).
- Marin, D., et al. Safety, efficacy and determinants of response of allogeneic CD19-specific CAR-NK cells in CD19+ B cell tumors: a phase 1/2 trial. Nat Med. 30 (3), 772-784 (2024).
- Fehniger, T. A., et al. A phase 1 trial of CNDO-109-activated natural killer cells in patients with high-risk acute myeloid leukemia. Biol Blood Marrow Transplant. 24 (8), 1581-1589 (2018).
- Nguyen, R., et al. A phase II clinical trial of adoptive transfer of haploidentical natural killer cells for consolidation therapy of pediatric acute myeloid leukemia. J Immunother Cancer. 7 (1), 81 (2019).
- Miller, J. S., et al. Successful adoptive transfer and in vivo expansion of human haploidentical NK cells in patients with cancer. Blood. 105 (8), 3051-3057 (2005).
- Liu, E., et al. Use of CAR-transduced natural killer cells in CD19-positive lymphoid tumors. N Engl J Med. 382 (6), 545-553 (2020).
- Daher, M., Melo Garcia, L., Li, Y., Rezvani, K. CAR-NK cells: the next wave of cellular therapy for cancer. Clin Transl Immunology. 10 (4), e1274 (2021).
- Lin, X., Sun, Y., Dong, X., Liu, Z., Sugimura, R., Xie, G. IPSC-derived CAR-NK cells for cancer immunotherapy. Biomed Pharmacother. 165, 115123 (2023).
- Bachanova, V., et al. Safety and efficacy of FT596, a first-in-class, multi-antigen targeted, off-the-shelf, iPSC-derived CD19 CAR NK cell therapy in relapsed/refractory B-cell lymphoma. Blood. 138, 823 (2021).
- Saetersmoen, M. L., Hammer, Q., Valamehr, B., Kaufman, D. S., Malmberg, K. J. Off-the-shelf cell therapy with induced pluripotent stem cell-derived natural killer cells. Semin Immunopathol. 41 (1), 59-68 (2019).
- Gerew, A., et al. Deletion of CISH and TGFβR2 in iPSC-derived NK cells promotes high cytotoxicity and enhances in vivo tumor killing. Blood. 138, 2780 (2021).
- Goldenson, B. H., Hor, P., Kaufman, D. S. iPSC-derived natural killer cell therapies - Expansion and targeting. Front Immunol. 13, 841107 (2022).
- Karvouni, M., Vidal-Manrique, M., Lundqvist, A., Alici, E. Engineered NK cells against cancer and their potential applications beyond. Front Immunol. 13, 825979 (2022).
- Ayuso, J. M., et al. Microphysiological model reveals the promise of memory-like natural killer cell immunotherapy for HIV± cancer. Nat Commun. 14 (1), 6681 (2023).
- Miller, J. S., et al. Safety and virologic impact of haploidentical NK cells plus interleukin 2 or N-803 in HIV infection. J Infect Dis. 229 (5), 1256-1265 (2024).
- Gutiérrez-Hoya, A., Soto-Cruz, I. NK cell regulation in cervical cancer and strategies for immunotherapy. Cells. 10 (11), 3104 (2021).
- Lisco, A., et al. Treatment of relapsing HPV diseases by restored function of natural killer cells. N Engl J Med. 385 (10), 921-929 (2021).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon