Method Article
人诱导多能干细胞衍生的嵌合抗原受体表达自然杀伤细胞的研究进展
摘要
在这里,我们提出了一种分化和扩增人 iPSC 衍生的嵌合抗原受体 (CAR) 表达自然杀伤细胞的方法,并提高了对各种恶性肿瘤的杀伤作用。该方案展示了自然杀伤 (NK) 优化的 iPSC 衍生的 CAR-NK 细胞的分化和扩增以及针对各种肿瘤细胞系的抗肿瘤活性的测量。
摘要
自然杀伤 (NK) 细胞是先天免疫细胞,在身体抵御肿瘤和病毒感染方面起着至关重要的作用。表达 NK 细胞的人诱导多能干细胞 (iPSC) 衍生的嵌合抗原受体 (CAR) 的产生已成为"现成"癌症免疫治疗的有前途的途径。在这里,我们利用了 NK 细胞优化的 CAR 构建体,其中包括 NKG2D 的跨膜结构域、2B4 共刺激结构域和 CD3ζ 信号结构域,该结构域已被证明可以刺激强大的抗原特异性 NK 细胞介导的抗肿瘤活性。使用 iPSC 生成 CAR NK 细胞具有多种优势,包括 CAR 均一表达、可扩展性、可重复性和临床应用潜力。这种从细胞工程到分化的详细分步方案能够产生 NK 细胞优化的 iPSC 衍生的表达 CAR 的 NK 细胞,提供标准化和靶向癌症免疫疗法,具有更高的抗肿瘤活性,并突出了它们作为各种恶性肿瘤的有前途的治疗选择的潜力。
引言
NK 细胞是先天免疫系统中的一种淋巴细胞,在早期防御肿瘤和病毒感染细胞中起着关键作用 1,2,3。与 T 细胞不同,NK 细胞不需要通过主要组织相容性复合体 (MHC) 分子呈递抗原。相反,NK 细胞具有一系列调节其活性的激活和抑制受体3。NK 细胞介导的细胞毒活性利用各种机制,包括穿孔素和颗粒酶的释放、死亡受体的参与以及促炎细胞因子(如 IFN-γ 和 TNF-α)的产生。这种独特的作用方式使 NK 细胞成为癌症免疫治疗的有吸引力的候选者,特别是在免疫逃避是一个重大障碍的实体癌治疗中 1,2,3,4。
肝细胞癌 (HCC) 是全球最常见和最致命的肝癌形式之一5。传统的治疗方法,包括手术、化疗和放疗,通常提供的临床益处有限,并且导致高复发率 6,7。免疫治疗和靶向治疗的最新进展对 HCC 的治疗产生了重大影响 8,9。免疫检查点抑制剂,如 nivolumab 和 pembrolizumab,通过增强免疫细胞对癌细胞的反应,显示出有希望的结果10,11。这些疗法提高了一些患者的生存率和生活质量。然而,它们也会引起免疫相关的不良反应,这可能会限制它们在某些患者中的使用12。靶向治疗,如索拉非尼和乐伐替尼,特异性抑制促进癌细胞生长和血管生成的途径13。这些治疗已知可控制疾病进展和延长生存期 8,14。尽管如此,通常会对靶向治疗产生耐药性,并且治疗的副作用很常见15,16。在癌症免疫治疗策略的有前途的途径中,嵌合抗原受体 (CAR) CAR T 细胞的出现彻底改变了癌症治疗,尤其是在淋巴瘤和多发性骨髓瘤等血液系统恶性肿瘤的治疗方面 17,18,19。
表达 CAR 的 NK 细胞将 NK 细胞的先天细胞毒活性与 CAR 技术的精确靶向相结合,代表了 HCC20、21、22、23、24 等实体瘤的创新和潜在变革方法。CAR 工程细胞可以特异性识别和杀死表达靶抗原的肿瘤细胞,同时保留正常组织,从而降低与常规疗法相关的脱靶效应的风险 25,26,27。从外周血或脐带血中分离的 NK 细胞产生的 CAR-NK 细胞通常是通过使用 CAR 构建体转导 NK 细胞产生的,CAR 构建体由细胞外抗原识别结构域、跨膜结构域和激活和增殖所需的细胞内信号结构域组成 28,29,30。
通过使用诱导多能干细胞 (iPSC) 31,32,可以解决为临床治疗设计稳定且均一的功能工程 NK 细胞群的挑战。使用 NK 细胞优化的 CAR 对人类 iPSC 进行工程改造可提供改进的 NK 细胞活化和增殖信号,并提供取之不尽、用之不竭的表达 CAR 的 NK 细胞群,作为标准化的"现成疗法"20,33。在该方案中,iPSC 的基因修饰以产生表达 CAR 的 iPSC 衍生的 NK 细胞涉及整合 NK 细胞优化的 CAR 构建体,其中包括 NK 细胞衍生的跨膜和信号结构域 (NKG2D-2B4-CD3ζ) 和抗磷脂酰聚糖-3 (GPC3) scFv,如我们以前的研究中所述23。然后使用先前开发的 NK 细胞分化方案34 分化和扩增基因工程 iPSC。这些工程化的表达 CAR 的 iPSC 衍生的 NK 细胞具有识别和消除 HCC 和其他表达特定肿瘤相关抗原的肿瘤细胞的能力,例如在 HCC 和其他恶性肿瘤中过表达的 Glypican 3 (GPC3) 35,36,37,38。
iPSC 来源的 CAR-NK 细胞治疗多种癌症的应用前景广阔 30,39,40;许多这些 iPSC 来源的 CAR-NK 细胞目前正处于临床试验中 41,42,43。为了促进该领域的进步,该协议能够高效生产工程化的 iPSC 衍生的 CAR-NK 细胞,从细胞工程到分化为成熟 NK 细胞和体外扩增。
研究方案
1. 人 iPSC 的无饲养层培养方法
注:解冻冷冻的未分化人 iPSC,并在基质胶(以下简称基底膜基质 [BMM])预包被板上使用 mTeSR 1-plus 培养它们,如前所述23,34。确保 iPSC 在工程前后没有分化非常重要。新鲜解冻的 iPSC 应培养约 2-3 代,以表现出与人多能干细胞一致的多能性形态。以下说明用于从 6 孔板的一个孔中传代细胞。
- 在传代 iPSC 之前,用 1x BMM(1 mL/孔)涂覆新的 6 孔板,并在使用前在 37 °C 培养箱中孵育 2-4 小时。
- 准备 1x 溶解的 BMM。
- 将 5 mL BMM 储备瓶在 4 °C 下解冻过夜。
- 使用预冷的吸头将 BMM 快速分装到预冷的微量离心管中。
- 在 -80 °C 下储存长达 6 个月。
- 要制备 1x BMM 工作溶液,请将一个 BMM 等分试样以 1:100 的比例重悬到冷的 DMEM/F12 培养基中。1x BMM 工作溶液可在 -4 °C 下储存 2 周。
- 用足够的体积包被板以覆盖表面(例如,6 孔板每孔使用 1 mL)。
- 使用前在 37 °C 培养箱中孵育 2-4 小时。
- 在 37 °C 的水浴中解冻一小瓶冷冻 iPSC(通常为 1 × 106 个细胞 /小瓶)。
- 逐渐将解冻的 iPSC 加入含有 5 mL 预热 mTeSR Plus 培养基的 15 mL 锥形管中,通过逐滴添加使细胞适应,以最大限度地减少细胞休克。
- 将细胞以 300 × g 离心 5 分钟。
- 吸出上清液并用 5 mL PBS 洗涤细胞一次。
- 将细胞重悬于 mTeSR Plus 培养基中,并以大约 200,000 个细胞/3 mL/孔的密度接种在 BMM 预包被的 6 孔板中。
- 传代 iPSC。
- 一旦 iPSC 达到 70-80% 汇合,吸出培养基并在 37 °C 下用 TrypLE 进行单细胞传代 5 分钟(6 孔板中 1 mL/孔)。
- 5 分钟后,加入 3 mL 1x PBS 以终止解离反应,并用 3 mL PBS 洗涤细胞一次。
- 将细胞以 300 × g 离心 5 分钟。洗涤后,将单细胞 iPSC 重悬于 mTeSR Plus 培养基中,然后接种到 BMM 预包被的 6 孔板上。
注:6 孔板中所需的总培养基体积为 3 mL/孔。培养基需要每 2-3 天更换一次,当细胞汇合 70-80% 至少 1-2 代时,必须重复步骤 1.8,然后才能改造 iPSC。
- 定期检查 iPSC 的多能性。用别藻蓝蛋白 (APC) 缀合的 TRA-1-81 和 PE-Cy7 缀合的阶段特异性胚胎抗原 4 (SSEA-4) 抗体在冰上对 iPSC 染色 30 分钟,然后如前所述使用流式细胞术分析它们23,41。
注:本实验中使用的 iPSC 适用于 TrypLE。以前未使用 TrypLE 传代的 iPSC 通常需要 8-10 次传代才能完全适应 TrypLE,从而确保产生高质量的自旋拟胚体 (EB)。
2. 使用 piggyBac 载体改造人 iPSC 表达抗 GPC3 CAR
- 用 BMM 涂覆新的 6 孔板,并在 37 °C 下孵育至少 1 小时(只要液体不干燥,可以更长)。
- 在 37 °C 下,用 10 μM Rho 缔合的、含有蛋白激酶 (ROCK) 抑制剂 (Y-27632)(来自在无菌蒸馏水中制备的 1 mM 原液)预热 mTeSR Plus。
- 打开 Nucleofection 系统。选择 X 单元,然后选择要转染的孔的位置。选择 P3 解决方案并手动输入代码 (CA-137)。
- 与 1 mL TrypLE 以 70-80% 汇合度收获 iPSC,并在 37 °C 下孵育 5 分钟。在显微镜下检查以确认解离。
- 移液 4-6 次以获得单细胞悬液,然后用 5 mL PBS 中和并以 300 × g 沉淀 5 分钟。
- 再次轻轻洗涤细胞以去除所有痕量的 TrypLE。
- 重悬于 1 mL 含 Rock-Inhibitor 的 mTeSR Plus 中,并对细胞进行计数。
- 要制备抗 GPC3 CAR iPSC,在微量离心管中每次转染使用 1 × 106 个细胞,并以 300 × g 离心 5 分钟。
- 离心时,将表达 CAR 的转座子 DNA 与超级 PiggyBac 转座酶表达载体以 3:1 的比例混合在 1.5 mL 微量离心管中(例如,3 μg 含有转座子的质粒与 1 μg 转座酶质粒)。
- 包括使用 0.5 μL 1 mg/mL 溶液的绿色荧光蛋白 (GFP) 阳性对照(材料表)和未转染的阴性对照,以确认 GFP 表达。
- 在 20 μL 室温 (RT) P3 Nucleofector 溶液中小心地重悬细胞沉淀物和核转染试剂盒中提供的添加剂。然后,将此混合物添加到含有质粒 DNA 的 1.5 mL 微量离心管中,得到约 22-25 μL 的最终体积。
注:在向细胞中添加 GPC3 CAR 质粒或 GFP 对照质粒之前,在 P3 Nucleofector 溶液中重悬所有要转染的 iPSC。 - 将细胞/DNA 悬液转移至 20 μL 16 孔试纸条中。确保样品覆盖比色皿底部,没有任何气泡。
- 轻轻敲击工作台顶部的 16 孔联排,以去除任何气泡并将细胞沉淀在底部。
- 将含有 iPSC 和 CAR DNA 混合物的 16 孔试纸条放入 Nucleofection 系统中,选择程序 CA-137、P3 溶液,然后启动程序。该程序将在 1 秒后结束并显示一个绿色勾号。
- 向孔中加入 80 μL 预热的含 ROCK-Inhibitor 培养基的 mTeSR Plus,然后小心地将细胞转移到涂有 BMM 的 6 孔板中(每孔终体积 1 mL)。
- 4 小时后,在荧光显微镜下短暂检查细胞是否有任何 GFP 表达,以确认转染的成功率。
- 使用流式细胞术23,41 筛选 iPSC 的 GFP 表达,以评估转染后 24 小时的转染效率,以确认 GFP 表达。
- 在 37 °C 下孵育 4 天,在进行药物选择之前根据需要更换培养基。
注:每个核转染每个反应需要 0.2-2 x 10个 6 个 iPSC。根据反应次数,可使用 24 孔板或 6 孔板。
3. GPC3-CAR iPSCs 的克隆选择和多能性确认
- 对转染的 iPSC 进行一系列 zeocin 选择 (1:10,000),以克隆选择表达 GPC3-CAR 的 iPSC。
- 为了确认转染效率,使用荧光显微镜和流式细胞术测量 GFP 表达23,41。
注:CAR 构建体与 FLAG 标签44,45 结合,用于评估 iPSC 阶段和 NK 细胞分化后的 CAR 表达。 - 在药物选择下维持转染的 CAR iPSC,直到它们达到最佳 CAR 基因和 GFP 表达。
- 为确保 GFP 和 CAR 表达的均匀性,将药物选择的持续时间延长 2-3 周。
- 使用流式细胞术根据 GFP 或 CAR 表达进行细胞分选,以获得克隆选择的 iPSC 的均质群体23。
- 此处使用的 CAR 构建体包含 zeocin 药物选择标记。通过向培养基中加入 zeocin(50 μg/mL zeocin)来选择 GPC3 CAR 基因转染的细胞。
- zeocin 选择后,稀释 GPC3 CAR 基因转染的 iPSC,并将其接种到 96 孔板中,以获得每孔大约一个细胞。这可以通过连续稀释或使用细胞分选仪来完成。
注:使用荧光激活细胞分选 (FACS) 根据与 CAR 构建体相连的荧光标记物的表达分离单个转染细胞。 - 让单细胞在 96 孔板中扩增成菌落。
- 每 3-4 天用新鲜培养基喂养细胞一次,并监测孔中的集落生长情况。
- 筛选 CAR 表达的菌落。这可以通过聚合酶链反应 (PCR)、定量聚合酶链反应 (qPCR) 或蛋白质印迹来完成,以验证 CAR 构建体的存在23,47。
- 或者,使用流式细胞术 23,41 检测 CAR 蛋白的表面表达。
注意:在本研究中,使用流式细胞术通过 FLAG 标签表达定量 CAR 表达。 - 此外,进行核型分析以识别任何染色体异常。
注意:这可以由 Wicell (wicell.org) 或 Thermo Fisher Scientific (thermofisher.com) 等第三方组织完成。 - 一旦鉴定出 CAR 阳性克隆且无任何异常,即可在更大的培养容器(如 6 孔板和 T75 培养瓶)中扩增这些克隆。
- 使用冻存培养基将克隆扩增的 CAR iPSC 冻存在多个样品瓶中以备将来使用。
注:此步骤建议采取以下几点:(i) 保持 iPSC 的最佳培养条件以防止分化。(ii) 在药物选择后,需要 1-4 周才能在 iPSC 中实现 CAR 和 GFP 表达的均匀群体。(iii) 继续监测细胞 CAR 表达和多能性标志物的稳定性。(iv) 在筛选和验证步骤中使用适当的控制措施。(v) 克隆选择和扩增后,通过评估 CAR 表达 iPSC 上的 TRA-1-81 和 SSEA-4 表达来验证多能性。
4. 通过自旋胚状体 (EB) 形成从工程化 CAR iPSC 生成造血祖细胞
注意:自旋 EB 或造血类器官方案用于产生造血祖细胞23,34。EB 内的细胞分化为基质细胞以支持淋巴细胞发育38,从而消除了对 OP9 等异种来源的基质细胞的需求 23,34,48。以下是从 6 孔板的单个孔中收集细胞以形成 EB 的说明。
- 离心 EB 形成前 2 天传代 ~200,000 个细胞/孔的 6 孔 BMM 预包被板。确保在自旋 EB 设置当天达到 70-80% 的汇合度。通常,6 孔板的 1 个孔足以容纳两块离心 EB 板。
- 去除培养基,并与 1 mL 预热的 TrypLE Select 在 37 °C 下孵育 5 分钟,分离细胞。
- 使用 1 mL 微量移液器小心地将细胞聚集体解离到单细胞悬液中,并将细胞转移到 15 mL 锥形管中。加入 3 mL 的 1x PBS 以终止解离反应,并用 3 mL 的 PBS 洗涤细胞一次。
- 将细胞重悬于 mTesR Plus 培养基中,并通过 70 μM 细胞过滤器过滤以去除聚集体。
- 离心细胞以去除上清液,然后再次用 5 mL PBS 洗涤细胞。然后将细胞重悬于 1 mL STEMdiff APEL 培养基(EB 形成培养基)中。
- 使用含有以下细胞因子(SCF:40 ng/mL、BMP4:20 ng/mL、VEGF:20 ng/mL)和 10 μM ROCK 抑制剂的 EB 形成培养基对细胞进行计数并稀释至适当的密度。
- 在 96 孔板的 100 μL 培养基(100,000 个细胞/mL)中接种 3000-10000 个细胞/孔。
注:EB 形成中使用的细胞数量可能因 iPSC 细胞系而异。建议在 96 孔板中每孔检测 3,000 至 10,000 个细胞。 - 使用多通道移液器,以 100 μL/孔的浓度将细胞悬液加载到 96 孔板中。
注:为了更好地形成胚状体 (EB),建议使用超低附着圆底 96 孔板。 - 将 96 孔板以 300 × g 离心 5 分钟,然后将板在 37 °C 和 5% CO2 下孵育 6 天。
注意:初步研究发现,在本研究中,6 天足以为 CAR iPSC 系产生 >30% 的 CD34 + 细胞。 - 通过流式细胞术检查 EB 质量23,41。
- 制备 4 mL 预热的 0.25% 胰蛋白酶和 0.4% 鸡血清(4 mL 胰蛋白酶为 16 μL)用于解离 EB。
- 将 10-30 个 EB 转移到 15 mL 锥形管中。
- 将胰蛋白酶/鸡血清溶液添加到 EB 中,并在水浴中孵育 10 分钟,每 30 秒涡旋一次以确保 EB 完全解离。
- 移液管胰蛋白酶化的 EB。上下混合数次以彻底解离 EBS。
- 加入 5 mL 的 1x PBS 以停止胰蛋白酶消化过程。
- 通过新锥形管中的 70 μm 细胞过滤器过滤细胞溶液。
- 将细胞以 300 x g 离心 5 分钟。
- 吸出上清液并重悬于 3-5 mL 新鲜培养基中。
- 对细胞进行计数,用典型的 EB 标志物(如 CD34、CD31、CD43 和 CD45)染色,并使用流式细胞术23,41 进行分析(图 3)。
- 根据制造商的说明,将推荐体积的抗体添加到每个含有解离的 EB 单细胞的试管中,溶于 100 μL 流式缓冲液中,并在冰上孵育 30 分钟39,41。
- 孵育后,用流式缓冲液洗涤细胞两次,加入 SYTOX blue 活/死染剂,并使用流式细胞术进行分析。
注:通常,在第 6 天使用本研究中使用的 iPSC 从解离的 Spin 胚状体总群体中获得 >30% CD34 + 细胞,尽管该百分比可能因 iPSC 来源和培养条件而异。
5. GPC3 CAR iPSC 衍生的 NK 细胞从 Spin EB 中分化
注:表达 GPC3 CAR 的 Spin EB 可以转移到涂有 2% 明胶或无涂层的 24 孔板或 6 孔板中。对于培养基更换,6 孔板更合适,而 2% 明胶涂层可增强 EB 附着。
- 按照以下步骤准备明胶包被的 6 孔板。
- 通过将明胶溶解在组织培养级水中来制备 2% (w/v) 明胶溶液。
- 通过在 121 °C、15 psi 下高压灭菌 30 分钟来消毒溶液。
- 每 cm2 用 5-10 μL 明胶溶液包被每个孔的表面(6 孔板每孔 ~1 mL)。
- 使用前将板在 37 °C 下孵育 2-4 小时。孵育后,在进行 EB 转移之前吸出任何剩余的明胶溶液。
- 制备 NK 细胞分化培养基:添加 56.6% DMEM + GlutaMAX-I、28.3% F12 + GlutaMAX-I、15% 热灭活人 AB 血清、1% P/S、2 mM L-谷氨酰胺、1 μM β-巯基乙醇、5 ng/mL 亚硒酸钠、50 μM 乙醇胺和 20 mg/L 抗坏血酸。在 4 °C 避光中储存。
- 向明胶包被的 6 孔板的每个孔中加入 3 mL 含有以下细胞因子的 NK 分化培养基(IL-3:5 ng/mL,SCF:20 ng/mL,IL-7:20 ng/mL 和 IL-15:10 ng/mL)。
- 第 6 天,按照以下步骤将 Spin EB 直接转移到制备的含有 NK 分化培养基的明胶包被的 6 孔板中。
- 小心地将 EB 从 96 孔板转移到 10 cm 培养皿中,使用 10 mL 血清移液管去除大部分培养基。
- 将 3 mL 含有上述细胞因子的 NK 分化培养基添加到明胶包被的 6 孔板的每个孔中。
- 使用 1 mL 微量移液器将 16-20 个 EB 分配到 6 孔板的每个孔中。
注:平均而言,来自单个 96 孔板的 EB 可用于接种 NK 分化板的一个 6 孔板。
- 每 5-7 天更换一次培养基。NK 细胞分化第一周后,从培养基中排除 IL-3。
注:14 天后,需要每 3-4 天更换一次培养基。 - 继续更换培养基 3-4 周。通过流式细胞术24,42 在悬浮细胞上评估 NK 细胞标志物 (CD45+CD56+) 的表达。
- 当 >80% 的悬浮细胞表达 CD45+CD56+时,通过让细胞通过 70 μm 过滤器以去除任何团块来收获细胞。
- 将收获的 NK 细胞与 100 个灰色辐照的 aAPC34,48 共培养,并在含有 IL-2 (100ng/mL) 和 IL-15 (10 ng/mL) 的 NK 扩增培养基中培养。
6. 抗 GPC3 CAR iPSC 衍生的 NK 细胞的扩增
注:通常,即使在扩增之前,也可以从单个 6 孔板中获得 2-20 × 10个 6 NK 细胞的产量。为了促进 NK 细胞的进一步扩增以用于下游应用,采用人工抗原呈递细胞 (aAPC) 生成 >1 × 109 个 NK 细胞。
- 利用表达 41BBL 和膜结合 IL-21 (41BBL-mbIL-21)48 的工程化 K562 细胞作为 aAPC 诱导 NK 细胞扩增。
- 在将 aAPC 与 NK 细胞共培养之前,用 100 灰度照射 aAPC 并将其保存为冷冻原液。
- 从 6 孔板中收获悬浮细胞,并在补充有 50 U/mL IL-2 和 IL-15(10 ng/mL;新鲜添加)的 NK 扩增培养基中以 5 × 105 个细胞/mL 的密度培养 NK 细胞。
- 以 1:1 的比例将解冻的辐照 aAPC 添加到 NK 细胞中。
- 每 3-4 天补充一次培养基,分别加入浓度为 50 U/mL 和 10 ng/mL 的新鲜 IL-2 和 IL-15。
- 确保 CAR iPSC 来源的 NK 细胞在 >3 个月内保持扩增能力,同时保持细胞活力和溶细胞活性。
7. GPC3 CAR iPSC 来源的 NK 细胞的表型和功能表征
注:GPC3 CAR iPSC 衍生的 NK 细胞的表征涉及对其表型特征和功能活性的全面评估。
- 通过流式细胞术评估抗 GPC3 CAR iPSC 衍生的 NK 细胞上的 NK 激活受体,包括 CD45、CD56、CD94、CD16、NKp30、NKp44、NKp46、NKG2D、DNAM、TRAIL 和 FasL,以确定 CAR NK 细胞活性和成熟状态(图 4)。
- 使用基于流式细胞术的 Caspase-3/7 测定、CD107a 颗粒释放测定、IFN-γ 和 TNF-α 细胞因子释放测定针对各种肿瘤靶标评估 GPC3 CAR iPSC 衍生的 NK 细胞的 体外 功能活性。
- 对于 Caspase3/7 检测,请按照以下步骤作。
- 计数靶细胞,并在 37 °C 下用终浓度为 5 μM 的 PBS 细胞示踪荧光染料预染色 15 分钟。
- 在37°C下以各种效应子与靶标(E:T)比率与CAR iPSC衍生的NK细胞共培养之前,在完全培养基中洗涤染色的靶细胞。
- 共培养 3 小时和 30 分钟后,加入 Caspase-3/7 绿色检测试剂再孵育 30 分钟,总孵育时间为 4 小时。
- 在染色的最后 5 分钟内加入 1 μL 死细胞染色溶液,并轻轻混合。
- 使用流式细胞术23,41 分析染色的细胞(图 5)。
- 实施该方案以确保全面了解 GPC3 CAR iPSC 衍生的 NK 细胞的表型特征和功能活性,从而能够对其治疗潜力进行稳健评估。
注:通常需要 4-5 周才能使用 GPC3 CAR iPSC 系从基于自旋 EB 的 GPC3 CAR iPSC 衍生的 NK 细胞分化和 NK 扩增条件中获得 >90% CD45+CD56+ 细胞。一些 iPSC 细胞系可能只需要 3 周,而有些细胞系可能需要更长的时间(约 4-5 周)。
8. 故障排除项目和解决方案
注:使用自旋胚状体 (EB) 方法对 iPSC 来源的 GPC3 CAR NK 细胞的分化、扩增和功能测试进行故障排除可能涉及几个步骤。以下是您可能会遇到的一些常见问题以及建议的解决方案:
- EB 形成不一致的症状
- 检查 EB 是否太小或太大,形状不规则。
- EB 形成不一致的解决方案
- 调整用于形成 EB 的离心机速度和持续时间。通常的速度约为 200-300 × g 5-10 分钟。
- 确保使用适当的 U 形底板或超低附着点培养皿,以促进 EB 形成。
- 确认 iPSC 是均一的,并且没有可能影响 EB 形成的分化细胞。
- iPSC 向 NK 细胞分化不良的症状
- 检查 NK 细胞标志物(例如 CD56、NKp46)的低表达。
- 检查是否无法形成 EB 或形状不佳的 EB。
- iPSC 向 NK 细胞分化不良的解决方案
- 确保必需生长因子(例如 VEGF、BMP4、Y-27632、FLT3、IL-15、IL-7、SCF 和 IL-3)的浓度最适合 EB 形成和 NK 细胞分化。根据以前的研究调整浓度 23,34,41。
- 确保 iPSC 的初始接种密度合适。通常,建议 8000-10,000 个细胞/100 μL 的密度用于自旋 EB 的形成。
- 验证分化培养基的配方是否正确,包括必要的补充剂(例如,血清或无血清替代品、其他细胞因子)。
- 留出足够的时间形成 EB,在切换到 NK 细胞分化培养基之前至少 6 天到最多 12 天。
- NK 细胞扩增不良的症状
- 检查扩增过程中的细胞产量是否受限。
- 检查扩增的 NK 细胞的活力是否降低。
- NK 细胞扩增不良的解决方案
- 在扩增阶段增加 IL-15 和 IL-2 的浓度。这可以显着增强 NK 细胞增殖。
- 考虑使用饲养层细胞(如辐照的 aAPC)来改善 NK 细胞的存活和扩增。
- 定期监测细胞密度,并在细胞达到过度拥挤之前传代细胞,以保持最佳生长条件。
- 功能测试结果欠佳的症状
- 检查对靶细胞的细胞毒性是否降低。
- 检查细胞因子分泌水平是否低(例如 IFN-γ、TNF-α)。
- 次优功能测试结果的解决方案
- 优化细胞毒性测定中的靶标效应子比。从 10:1 的比率开始,然后根据结果进行调整。
- 确保在功能测定前充分激活 NK 细胞。这可能包括用细胞因子预刺激或与辐照的 aAPC 共培养。
- 验证靶细胞系对 NK 细胞介导的裂解的敏感性。使用已知的敏感靶标作为对照。
- 延长功能测定的持续时间,以便有足够的时间让 NK 细胞活性显现。
- CAR 表达水平不同的症状
- 检查 NK 细胞中 CAR 表达是否不一致。
- 不同 CAR 表达水平的解决方案
- 验证 CAR 转染方法(例如,病毒转导、电穿孔)的效率。如果需要,调整 MOI(感染复数)或电穿孔条件。
- 使用适当的选择标记物来富集 CAR+ NK 细胞。必要时使用抗生素选择或荧光标记物分选。
结果
抗 GPC3-CAR iPSC 衍生的 NK 细胞分化和扩增示意图
示意图说明了源自人诱导多能干细胞 (iPSC) 的抗 GPC3-CAR 工程 NK 细胞的 体外 分化,以及携带 GPC3 CAR 构建体的 piggyBac 载体的示意图。最初,用编码 GPC3 CAR(嵌合抗原受体)的 piggyBac 载体转染未修饰的 iPSC。转染后,这些表达 GPC3 CAR 的 iPSC 被克隆扩增,然后分化为功能性 CAR iPSC 衍生的 NK 细胞。随后对这些工程化的 NK 细胞进行 体外 和 体内 功能测定,以评估它们对各种肿瘤细胞系的抗肿瘤活性(图 1)。
WT 和抗 GPC3-CAR 工程 iPSC 在不同阶段的 NK 分化过程的显微分析
GPC3 CAR 工程改造的 iPSC 分化为抗 GPC3-CAR 工程改造的 iPSC NK 细胞。从 GPC3 CAR 工程改造的 iPSC 到离心胚状体 (EB) 的形成,再到 GPC3-CAR iPSC NK 细胞的分化,以一系列显微图像的形式呈现,记录了抗 GPC3-CAR 工程改造的 iPSC 向功能性 GPC3 CAR iPSC NK 细胞的分化阶段。未分化野生型 (WT) 和 GPC3 CAR iPSCs 在 mTeSR Plus 培养基中培养(图 2A)。然后将这些 WT 和抗 GPC3-CAR iPSC 解离成单细胞,并在含有 SCF (40 ng/mL)、BMP4 (20 ng/mL)、VEGF (20 ng/mL) 和 10 μM ROCK 抑制剂的 STEMdiff APEL 培养基中在超低附着 U 形底 96 孔板中培养 6 天。第 6 天从 WT 和 GPC3 CAR iPSC 捕获自旋 EB 的形成(图 2B)。这些自旋 EB 进一步转移到含有 NK 分化培养基的 6 孔板中,其中含有以下细胞因子 IL-3 (5 ng/mL)、SCF (20 ng/mL)、IL-7 (20 ng/mL) 和 IL-15 (10 ng/mL)。使用显微镜以 100 倍放大倍率捕捉从第 3 天到第 28 天不同时间点的 WT 和 GPC3 CAR iPSC 衍生的 NK 细胞的分化过程(图 2C)。
WT 和抗 GPC3 CAR iPSC 衍生的 EB 的表型(第 6 天)以及 WT 和 GPC3 CAR iPSC 衍生的 NK 细胞(第 35 天)
WT 和 GPC3 CAR iPSC 来源的细胞在 NK 分化过程的不同阶段具有表型特征。图 A 显示了通过流式细胞术测量第 6 天收集的 WT 和 GPC3 CAR iPSC 的自旋 EB 中的典型造血抗原 CD34、CD31、CD43 和 CD45 的表达(图 3A)。图 b 显示了第 35 天从 NK 分化培养基中收获的 WT 和 GPC3 CAR iPSC 衍生的 NK 细胞的表型,突出了通过流式细胞术测量与成熟 NK 细胞相关的 NK 特异性标志物(CD45、CD56、CD16 和 NKG2D)(图 3B)。
扩增的 WT 和抗 GPC3-CAR iPSC 来源的 NK 细胞的表型
在分化 WT 和抗 GPC3 CAR iPSC 来源的 NK 细胞后,在含有 IL-2 (100 U/mL) 和 IL-15 (10 ng/mL) 的 Gibco NK Xpander 培养基中使用辐照的 aAPC 收获和扩增分化的 NK 细胞。使用流式细胞术测量扩增的 WT 和抗 GPC3 CAR iPSC NK 细胞活化受体,如 CD94、CD16、NKp30、NKp44、NKp46、NKG2D、CD226、FasL 和 TRAIL(图 4A)。在确认扩增的 WT 和抗 GPC3 CAR iPSC NK 细胞上的 NK 活化表型后,我们通过流式细胞术评估了 GPC3 抗原在各种肿瘤细胞系(包括 HepG2、SNU-449、SKOV3 和 CAL27)上的表面表达(图 4B)。我们还通过流式细胞术分析证实了扩增的抗 GPC3 CAR iPSC 衍生的 NK 细胞上的 CAR 表达。
WT 和抗 GPC3 CAR iPSC 衍生的 NK 细胞对 HCC 和其他肿瘤细胞系的功能活性
在确认 WT 和抗 GPC3 CAR iPSC 衍生的 NK 细胞的表型后,我们评价了对各种肿瘤细胞系的功能性抗肿瘤活性。进行基于 Caspase3/7 的杀伤试验,以评估 WT 和抗 GPC3 CAR iPSC 衍生的 NK 细胞在不同效应靶标比下对 HepG2 、 SNU-449 、 CAL27 和 SKOV3 细胞系的细胞毒活性。结果表明,与 WT iPSC NK 细胞相比,抗 GPC3 CAR iPSC 衍生的 NK 细胞的抗肿瘤功效增强,展示了它们通过 CAR 特异性和其他 NK 激活机制靶向表达 GPC3 的肿瘤细胞的潜力(图 5A-D)。

图 1:抗 GPC3-CAR iPSC 衍生的 NK 分化、扩增和临床应用的示意图。 (A) 生成用于临床前和临床使用的抗 GPC3 CAR iPSC 衍生的 NK 细胞的过程概述。用携带抗 GPC3-CAR 基因的 piggyBac 载体转染未修饰的 iPSC。成功转染后,表达抗 GPC3-CAR 的 iPSC 克隆扩增并分化为功能性 NK 细胞。这些抗 GPC3 CAR iPSC 衍生的 NK 细胞进行 体外 和 体内 功能测定,以评估它们对各种表达 GPC3 的肿瘤细胞系的细胞毒活性39。在验证其疗效和安全性后,这些 CAR iPSC 衍生的 NK 细胞被进一步开发为潜在的"现成"疗法,用于癌症治疗的临床应用。(B) 含有用于转染 iPSC 的抗 GPC3 CAR 构建体的 piggyBac 载体的示意图。(C) iPSC 衍生的 NK 细胞分化、扩增、收获和进行功能测定的典型时间表。 请单击此处查看此图的较大版本。
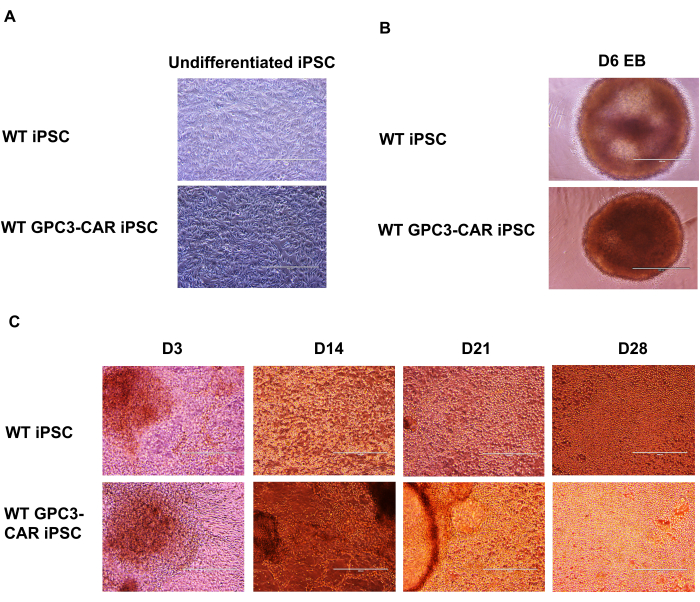
图 2: CAR iPSC NK 分化与抗 GPC3-CAR 工程 iPSC 在不同阶段的显微图像。 (A) 在 mTeSR plus 培养基中培养的未分化 WT 和 GPC3 CAR iPSC。(B) 第 6 天的 WT 和 GPC3 CAR iPSC 自旋胚状体。(C) WT 和 GPC3 CAR iPSC 衍生的 NK 细胞在 D3 至 D28 的不同日期分化。a 到 c 的放大倍数为 100 倍。 请点击此处查看此图的较大版本。
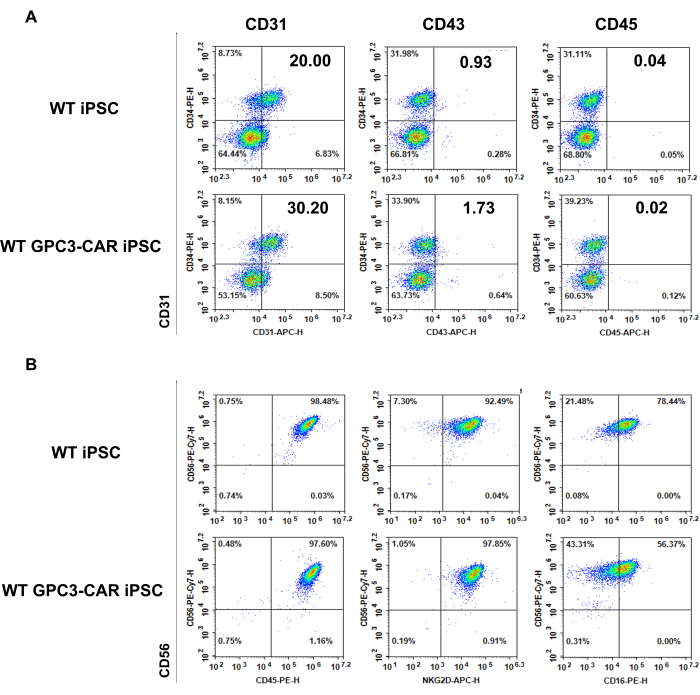
图 3:WT 和抗 GPC3 CAR iPSC 衍生的第 6 天 EB 和分化的 WT 和 GPC3 CAR iPSC 衍生的 NK 细胞的表型在第 35 天。 (A) 造血分化第 6 天在 WT 和 GPC3 CAR iPSC 上表达的典型造血抗原。(B) 在第 35 天从 NK 分化培养基中收获 WT 和 GPC3 CAR iPSC 衍生的 NK 细胞的表型。 请单击此处查看此图的较大版本。

图 4:扩增后 WT 和抗 GPC3-CAR iPSC 衍生的 NK 细胞的表型。 (A) WT 和 GPC3 CAR iPSC 衍生的 NK 细胞在 Gibco NK Xpander 培养基中扩增,并使用流式细胞术评估 NK 成熟标志物。(B) 使用流式细胞术测量 GPC3 抗原在包括 HepG2 、 SNU-449 、 SKOV3 和 CAL27 在内的各种肿瘤细胞系上的表面表达。(C) 代表性直方图显示扩增后 GPC3 CAR iPSC 衍生的 NK 细胞上的 CAR 表达。CAR 构建体与 FLAG 标签和 GFP 结合,通过流式细胞术测量 CAR。 请单击此处查看此图的较大版本。

图 5:WT 和抗 GPC3 CAR iPSC 衍生的 NK 细胞对 HCC 和其他肿瘤细胞系的功能活性。(A-D) 针对各种肿瘤细胞系(包括 HepG2、SNU-449、CAL27 和 SKOV3)检测了 WT 和 GPC3 CAR iPSC 衍生的 NK 细胞的抗肿瘤活性。X 轴表示针对 HepG2、SNU-449、CAL27 和 SKOV3 测试的 WT 和抗 GPC3 CAR iPSC 衍生的 NK 细胞的 E:T 比率。x 轴上指示的特定 E:T 比率为 10:1、5:1、2.5:1、1:1、0.5:1 和 0.25:1。请单击此处查看此图的较大版本。
讨论
该方案概述了一种标准化且可重复的方法,用于从一致的细胞来源生成表达 CAR 的 iPSC 衍生的 NK 细胞,旨在促进靶向"现成"癌症免疫治疗。多项临床前和临床研究表明,基于过继性 NK 细胞的免疫疗法在治疗癌症方面的疗效,同时最大限度地减少毒性,如移植物抗宿主病 (GvHD) 或细胞因子释放综合征 (CRS)23,42, 49,50,51,52,53,54,55,56,57 .这种方法利用高效且定义明确的系统来生产均一且特征明确的 CAR iPSC 衍生的 NK 细胞,可以放大用于临床应用。此外,经工程改造以表达 NK 优化 CAR 的 iPSC 衍生的 NK 细胞保留了典型的 NK 细胞表型和溶细胞功能 23,39,42,50,51,52,58。
与从外周血中分离的原代 NK 细胞相比,使用人 iPSC 进行 CAR iPSC 衍生的 NK 细胞生产提供了一种更有效的基因修饰方法,包括 CAR 表达 31,59,60。除了 CAR 表达外,还可以通过修饰(例如删除抑制性受体或引入细胞因子表达)来进一步增强这些细胞的抗肿瘤活性 41,39,61。这可以通过单一的基因修饰事件来实现,无需像目前的 CAR-T 细胞疗法那样进行患者特异性修饰 31,62,63。此外,具有新型 CAR 表达细胞的基于 NK 细胞的疗法有可能用于治疗慢性传染病 30,64,65,66,67,68。
该方案共同展示了使用人 iPSC 创建表达 CAR 的 NK 细胞的均质群体以增强 体外 和 体内抗 肿瘤活性的潜力。NK 细胞优化的 CAR 能够实现信号通路的抗原特异性激活,从而改善这些细胞的功能。修饰和故障排除对于优化 CAR NK 细胞的产量和功能至关重要。调整细胞因子混合物和时间可以提高分化效率。确保 CAR 构建体在 NK 细胞中的稳定性和表达可能需要优化转染方法或载体设计。其他故障排除可以解决 CAR iPSC 衍生的 NK 细胞的低转导效率、细胞活力和功能活性等问题,并且可能涉及不同培养条件或基因修饰的迭代测试,以增强持久性、细胞毒性和安全性。
我们方法的意义在于它能够从标准化的 iPSC 来源产生潜在无限供应的 CAR NK 细胞。iPSC 来源的 CAR NK 细胞为多个基因编辑提供了一个稳定的平台,减少了变异性并提高了工程细胞的一致性。该方法还能够创建可立即使用的"现成"NK 细胞疗法,无需个体化细胞采购和加工。
此外,当使用 piggyBac 载体时,该方案在维持 CAR 表达的稳定性方面存在一定的局限性,因为转基因整合的瞬时性质可能导致表达水平随时间变化。此外,依赖 aAPC 和特异性细胞因子进行扩增会使这些过程在临床应用中的可扩展性复杂化。最后,针对 piggyBac 元件的潜在免疫反应可能在治疗环境中构成风险。
总之,CAR-NK 细胞从人 iPSC 中分化和扩增对治疗肝细胞癌 (HCC) 和其他恶性肿瘤具有重要前景。这种创新方法利用 iPSC 的再生潜力和 NK 细胞的先天免疫特性来创造一种有效的靶向癌症免疫疗法。该领域的进步可能会带来更有效和更广泛可用的基于 NK 细胞的疗法,为 HCC 和其他难以治疗的疾病患者提供新的希望。
披露声明
DSK 是 Shoreline Biosciences 的联合创始人和顾问,并拥有该公司的股权。DSK 还为 Therabest 和 RedC Bio 提供咨询,他从中获得收入和/或股权。这些安排的条款已由加州大学圣地亚哥分校根据其利益冲突政策审查和批准。其余作者声明没有利益冲突。
致谢
我们感谢所有 Kaufman 实验室成员的支持、科学见解和讨论。这些研究得到了 NIH/NCI 赠款U01CA217885、P30CA023100(行政补充)和加州大学圣地亚哥分校桑福德干细胞研究所的支持。JT:手稿的写作和修改。DSK:审阅和编辑手稿。
材料
| Name | Company | Catalog Number | Comments |
| aAPC | Dean A. Lee lab | N/A | |
| a-MEM culture medium | Fisher Scientific | Cat#12634 | |
| APC anti-DYKDDDDK (FLAG Tag) | BD Biosciences | Cat#637308 | |
| APC-anti-human TRA-1-81 | ThermoFisher | 17-8883-42 | |
| APC-CD16 | BD Biosciences | Cat#302015 | |
| APC-CD43 | BD Biosciences | Cat# 560198 | |
| APC-CD45 | BD Biosciences | Cat# 555485 | |
| APC-GPC3 | BD Biosciences | Cat#DB100B | |
| APC-NKG2D | BD Biosciences | Cat# 558071 | |
| CellEvent Caspase-3/7 Green Detection Reagent | Thermo fisher | Cat#C10423 | |
| CellTrace Violet Cell Proliferation Kit | Thermo fisher | Cat#C34571 | Cell tracing fluorescent dye |
| CryoStor solution | Stem Cell Technologies | https://www.stemcell.com/products/cryostor-cs10.html | Cryopreservation medium |
| CTS NK Xpander | Gibco | A5019001 | |
| CTS NK-Xpander Medium | Life Technologies | Cat#A5019001 | |
| DMEM | Gibco | 11965084 | |
| DMEM, high glucose, GlutaMAX Supplement, pyruvate | Gibco | 10569010 | |
| EasySep Human NK Cell Enrichment Kit | StemCell Technologies, Inc. | Cat#19055 | |
| Ethanolamine | Sigma Aldrich | E9508 | |
| Fetal bovine serum | Fisher Scientific | Cat# 10437010 | |
| FITC-CD94 | BD Biosciences | Cat#555888 | |
| GlutaMAX Supplement | Gibco | 35050061 | |
| GolgiPlug | BD Biosciences | Cat#555029 | |
| GolgiStop | BD Biosciences | Cat#554724 | |
| Ham's F-12 Nutrient Mix, GlutaMAX Supplement | Gibco | 31765035 | |
| Horse serum | Fisher Scientific | Cat#16050130 | |
| Human Serum | AB Sigma-Aldrich | Cat#BP2525100 | |
| Human Stem Cell NucleofectorTM Kit | Lonza | Cat# VPH-5012 | |
| Human: HePG2 cells | ATCC | Cat#HB-8065 | |
| Human: HePG2-td-tomato-luc cells | Dan S. Kaufman lab | N/A | |
| Human: iPS cells | Dan S. Kaufman lab | N/A | |
| Human: SNU-449 cells | ATCC | Cat#CRL-2234 | |
| Human: SNU-449-td-tomato-luc cells | Dan S. Kaufman lab | N/A | |
| IncuCyte Caspase-3/7 Green Apoptosis Assay | Essenbioscience | Cat#4440 | |
| L-Ascorbic acid | Sigma Aldrich | A5960 | |
| MP Biomedicals Human Serum, Type AB | MP Biomedicals | ICN2938249 | |
| mTeSR plus | StemCell Technologies, Inc. | 100-0276 | |
| NovoExpress software | ACEA Biosciences | https://www.agilent.com/en/product/research-flow-cytometry/flow-cytometry-software/novocyte-novoexpress-software-1320805 | |
| PE/Cy7 anti-human SSEA-4 Antibody | Biolegend | 330420 | |
| PE-CD16 | BD Biosciences | Cat#560995 | |
| PE-CD226 | BD Biosciences | Cat#559789 | |
| PE-CD34 | BD Biosciences | Cat# 555822 | |
| PE-CD45 | BD Biosciences | Cat# 555483 | |
| PE-CD94 | BD Biosciences | Cat#555888 | |
| PE-cy7-CD56 | BioLegend | Cat# 318318 | |
| PE-FAS Ligand | BD Biosciences | Cat#564261 | |
| PE-NKp30 | BD Biosciences | Cat# 558407 | |
| PE-NKp44 | BD Biosciences | Cat#558563 | |
| PE-NKp46 | BD Biosciences | Cat#331908 | |
| PE-NKp46 | BD Biosciences | Cat#557991 | |
| Peripheral blood buffy coat | San Diego Blood Bank (https://www. sandiegobloodbank.org/) | N/A | |
| PE-TRAIL | BD Biosciences | Cat#565499 | |
| pKT2-mCAG-IRES-GFP-ZEO | Branden Moriarity lab | N/A | |
| pMAX-GFP plasmid | Lonza | N/A | GFP positive control |
| Prism 9 | Graphpad | Version 9 | |
| pSpCas9 | GenScript | PX165 | |
| RBC Lysis Buffer (10x) | Biolegend | Cat#420301 | |
| Recombinant human bFGF basic | R&D Systems | Cat#4114-TC | |
| Recombinant human BMP-4 | PeproTech | Cat#120-05 | |
| Recombinant human FLT-3 Ligand | PeproTech | Cat# 300-19 | |
| Recombinant human IL-15 | PeproTech | Cat# 200-15 | |
| Recombinant human IL-2 | PeproTech | Cat# 200-02 | |
| Recombinant human IL-3 | PeproTech | Cat#200-03 | |
| Recombinant human IL-7 | PeproTech | Cat# 200-07 | |
| Recombinant Human Nodal Protein | R&D Systems | Cat#3218-ND-025 | |
| Recombinant human SCF | PeproTech | Cat# 300-07 | |
| Recombinant Human TGF-β1 | PeproTech | Cat#100-21 | |
| Recombinant human VEGF | PeproTech | Cat# 100-20 | |
| RPMI1640 | Gibco | 11875093 | |
| Sodium selenite | Sigma Aldrich | 214485 | |
| STEMdiff APEL 2 Medium | StemCell Technologies, Inc. | 5270 | EB formation medium |
| STEMdiff APEL2 Medium | StemCell Technologies, Inc. | Cat#05270 | |
| Super piggyBac Transposase expression vector | SBI | Cat#PB210PA-1 | |
| SYTOX AADvanced Dead Cell Stain Kit | ThermoFisher Scientific | S10274, S10349 | Dead cell staining solution kit |
| β-mercaptoethanol | Gibco | 21985023 |
参考文献
- Chan, I. S., Ewald, A. J. The changing role of natural killer cells in cancer metastasis. J Clin Invest. 132 (6), e143762 (2022).
- Yu, Y. The function of NK cells in tumor metastasis and NK cell-based immunotherapy. Cancers (Basel). 15 (8), 2323 (2023).
- Paul, S., Lal, G. The molecular mechanism of natural killer cells function and its importance in cancer immunotherapy. Front Immunol. 8, 1124 (2017).
- Myers, J. A., Miller, J. S. Exploring the NK cell platform for cancer immunotherapy. Nat Rev Clin Oncol. 18 (2), 85-100 (2021).
- Llovet, J. M., et al. Hepatocellular carcinoma. Nat Rev Dis Primers. 7, 6 (2021).
- Yang, Y., Xiong, L., Li, M., Jiang, P., Wang, J., Li, C. Advances in radiotherapy and immunity in hepatocellular carcinoma. J Transl Med. 21 (1), 526 (2023).
- Rich, N. E., Yopp, A. C., Singal, A. G. Medical management of hepatocellular carcinoma. J Oncol Pract. 13 (6), 356-364 (2017).
- Niu, M., Yi, M., Li, N., Wu, K., Wu, K. Advances of Targeted Therapy for Hepatocellular Carcinoma. Front Oncol. 11, 719896 (2021).
- Yu, S. J. Immunotherapy for hepatocellular carcinoma: Recent advances and future targets. Pharmacol Ther. 244, 108387 (2023).
- Ntellas, P., Chau, I. Updates on systemic therapy for hepatocellular carcinoma. Am Soc Clin Oncol Educ Book. 44, e430028. 44, e430028 (2024).
- Liu, T. -. H., Shen, Y. -. C., Cheng, A. -. L. Immune checkpoint inhibitors for hepatocellular carcinoma - A game changer in treatment landscape. J Formos Med Assoc. 121 (8), 1371-1383 (2022).
- Sun, Q., Hong, Z., Zhang, C., Wang, L., Han, Z., Ma, D. Immune checkpoint therapy for solid tumours: clinical dilemmas and future trends. Signal Transduct Target Ther. 8 (1), 320 (2023).
- Huang, A., Yang, X. -. R., Chung, W. -. Y., Dennison, A. R., Zhou, J. Targeted therapy for hepatocellular carcinoma. Signal Transduct Target Ther. 5 (1), 146 (2020).
- Girardi, D. M., Pacífico, J. P. M., Guedes de Amorim, F. P. L., Dos Santos Fernandes, G., Teixeira, M. C., Pereira, A. A. L. Immunotherapy and targeted therapy for hepatocellular carcinoma: A literature review and treatment perspectives. Pharmaceuticals (Basel). 14 (1), 28 (2020).
- Laface, C., et al. Targeted therapy for hepatocellular carcinoma: Old and new opportunities. Cancers (Basel). 14 (16), 4028 (2022).
- Shyam Sunder, S., Sharma, U. C., Pokharel, S. Adverse effects of tyrosine kinase inhibitors in cancer therapy: pathophysiology, mechanisms and clinical management. Signal Transduct Target Ther. 8 (1), 262 (2023).
- Cappell, K. M., Kochenderfer, J. N. Long-term outcomes following CAR T cell therapy: what we know so far. Nat Rev Clin Oncol. 20 (6), 359-371 (2023).
- June, C. H., O'Connor, R. S., Kawalekar, O. U., Ghassemi, S., Milone, M. C. CAR T cell immunotherapy for human cancer. Science. 359 (6382), 1361-1365 (2018).
- Schuster Stephen, J., et al. Chimeric antigen receptor T cells in refractory B-cell lymphomas. N Engl J Med. 377 (26), 2545-2554 (2017).
- Schmidt, D., et al. Engineering CAR-NK cells: how to tune innate killer cells for cancer immunotherapy. Immunother Adv. 2 (1), Itac003 (2022).
- Zhang, B., et al. Chimeric antigen receptor-based natural killer cell immunotherapy in cancer: from bench to bedside. Cell Death Dis. 15 (1), 50 (2024).
- Wang, K., et al. Reprogramming natural killer cells for cancer therapy. Mol Ther. 32 (9), 2835-2855 (2024).
- Li, Y., Hermanson, D. L., Moriarity, B. S., Kaufman, D. S. Human iPSC-derived natural killer cells engineered with chimeric antigen receptors enhance antitumor activity. Cell Stem Cell. 23 (2), 181-192.e5 (2018).
- Liu, E., Marin, D., et al. Use of CAR-transduced natural killer cells in CD19-positive lymphoid tumors. N Engl J Med. 382 (6), 545-553 (2020).
- Chen, L., Xie, T., Wei, B., Di, D. L. Current progress in CAR-T cell therapy for tumor treatment. Oncol Lett. 24 (4), 358 (2022).
- Rafiq, S., Hackett, C. S., Brentjens, R. J. Engineering strategies to overcome the current roadblocks in CAR T cell therapy. Nat Rev Clin Oncol. 17 (3), 147-167 (2020).
- Sterner, R. C., Sterner, R. M. CAR-T cell therapy: current limitations and potential strategies. Blood Cancer J. 11 (4), 69 (2021).
- Albinger, N., Hartmann, J., Ullrich, E. Current status and perspective of CAR-T and CAR-NK cell therapy trials in Germany. Gene Ther. 28 (9), 513-527 (2021).
- Dagher, O. K., Posey, A. D. Forks in the road for CAR T and CAR NK cell cancer therapies. Nat Immunol. 24 (12), 1994-2007 (2023).
- Xie, G., Dong, H., Liang, Y., Ham, J. D., Rizwan, R., Chen, J. CAR-NK cells: A promising cellular immunotherapy for cancer. EBioMedicine. 59, 102975 (2020).
- Cichocki, F., van der Stegen, S. J. C., Miller, J. S. Engineered and banked iPSCs for advanced NK- and T-cell immunotherapies. Blood. 141 (8), 846-855 (2023).
- Goldenson, B. H., Hor, P., Kaufman, D. S. iPSC-derived natural killer cell therapies - Expansion and targeting. Front Immunol. 13, 841107 (2022).
- Zhu, H., Kaufman, D. S. Engineered human pluripotent stem cell-derived natural killer cells: the next frontier for cancer immunotherapy. Blood Sci. 1 (1), 4-11 (2019).
- Knorr, D. A., et al. Clinical-scale derivation of natural killer cells from human pluripotent stem cells for cancer therapy. Stem Cells Transl Med. 2 (4), 274-283 (2013).
- Shimizu, Y., Suzuki, T., Yoshikawa, T., Endo, I., Nakatsura, T. Next-generation cancer immunotherapy targeting Glypican-3. Front Oncol. 9, 248 (2019).
- Schepers, E. J., Glaser, K., Zwolshen, H. M., Hartman, S. J., Bondoc, A. J. Structural and functional impact of posttranslational modification of Glypican-3 on liver carcinogenesis. Cancer Res. 83 (12), 1933-1940 (2023).
- Batra, S. A., et al. Glypican-3-specific CAR T cells coexpressing IL15 and IL21 have superior expansion and antitumor activity against hepatocellular carcinoma. Cancer Immunol Res. 8 (3), 309-320 (2020).
- Gao, W., et al. Immunotoxin targeting glypican-3 regresses liver cancer via dual inhibition of Wnt signalling and protein synthesis. Nat Commun. 6, 6536 (2015).
- Thangaraj, J. L., Coffey, M., Lopez, E., Kaufman, D. S. Disruption of TGF-β signaling pathway is required to mediate effective killing of hepatocellular carcinoma by human iPSC-derived NK cells. Cell Stem Cell. 31 (9), 1327-1343.e5 (2024).
- Maddineni, S., Silberstein, J. L., Sunwoo, J. B. Emerging NK cell therapies for cancer and the promise of next generation engineering of iPSC-derived NK cells. J Immunother Cancer. 10 (5), e004693 (2022).
- Zhu, H., et al. Metabolic reprograming via deletion of CISH in human iPSC-derived NK cells promotes in vivo persistence and enhances antitumor activity. Cell Stem Cell. 27 (2), 224-237.e6 (2020).
- Strati, P., et al. Preliminary results of a phase I trial of FT516, an off-the-shelf natural killer (NK) cell therapy derived from a clonal master induced pluripotent stem cell (iPSC) line expressing high-affinity, non-cleavable CD16 (hnCD16), in patients (pts) with relapsed/refractory (R/R) B-cell lymphoma (BCL). J Clin Oncol. 39, 7541-7541 (2021).
- Hong, D., et al. Preliminary results of an ongoing phase I trial of FT500, a first-in-class, off-the-shelf, induced pluripotent stem cell (iPSC) derived natural killer (NK) cell therapy in advanced solid tumors. J Immunother Cancer. 8 (3), A231-A232 (2020).
- Zah, E., et al. Systematically optimized BCMA/CS1 bispecific CAR-T cells robustly control heterogeneous multiple myeloma. Nat Commun. 11 (1), 2283 (2020).
- Ahn, S., et al. Cancer immunotherapy with T cells carrying bispecific receptors that mimic antibodies. Cancer Immunol Res. 7 (5), 773-783 (2019).
- Ludwik, K. A., Telugu, N., Schommer, S., Stachelscheid, H., Diecke, S. ASSURED-optimized CRISPR protocol for knockout/SNP knockin in hiPSCs. STAR Protoc. 4 (3), 102406 (2023).
- Zhu, H., Kaufman, D. S. An improved method to produce clinical scale natural killer cells from human pluripotent stem cells. Methods Mol Biol. 2048, 107-119 (2019).
- Denman, C. J., et al. Membrane-bound IL-21 promotes sustained ex vivo proliferation of human natural killer cells. PLoS One. 7 (1), e30264 (2012).
- Leivas, A., et al. NKG2D-CAR-transduced natural killer cells efficiently target multiple myeloma. Blood Cancer J. 11 (8), 146 (2021).
- Ramdial, J. L., et al. A phase II clinical trial of "Off-the-Shelf" NK cells with allogeneic stem cell transplantation to decrease disease relapse in patients with high-risk myeloid malignancies. Blood. 140 (Supplement 1), 7484-7485 (2022).
- Bachanova, V., et al. Initial clinical activity of FT596, a first-in-class, multi-antigen targeted, off-the-shelf, iPSC-derived CD19 CAR NK cell therapy in relapsed/refractory B-cell lymphoma. Blood. 136, 8 (2020).
- Bae, W. K., et al. A phase I study of locoregional high-dose autologous natural killer cell therapy with hepatic arterial infusion chemotherapy in patients with locally advanced hepatocellular carcinoma. Front Immunol. 13, 879452 (2022).
- Marin, D., et al. Safety, efficacy and determinants of response of allogeneic CD19-specific CAR-NK cells in CD19+ B cell tumors: a phase 1/2 trial. Nat Med. 30 (3), 772-784 (2024).
- Fehniger, T. A., et al. A phase 1 trial of CNDO-109-activated natural killer cells in patients with high-risk acute myeloid leukemia. Biol Blood Marrow Transplant. 24 (8), 1581-1589 (2018).
- Nguyen, R., et al. A phase II clinical trial of adoptive transfer of haploidentical natural killer cells for consolidation therapy of pediatric acute myeloid leukemia. J Immunother Cancer. 7 (1), 81 (2019).
- Miller, J. S., et al. Successful adoptive transfer and in vivo expansion of human haploidentical NK cells in patients with cancer. Blood. 105 (8), 3051-3057 (2005).
- Liu, E., et al. Use of CAR-transduced natural killer cells in CD19-positive lymphoid tumors. N Engl J Med. 382 (6), 545-553 (2020).
- Daher, M., Melo Garcia, L., Li, Y., Rezvani, K. CAR-NK cells: the next wave of cellular therapy for cancer. Clin Transl Immunology. 10 (4), e1274 (2021).
- Lin, X., Sun, Y., Dong, X., Liu, Z., Sugimura, R., Xie, G. IPSC-derived CAR-NK cells for cancer immunotherapy. Biomed Pharmacother. 165, 115123 (2023).
- Bachanova, V., et al. Safety and efficacy of FT596, a first-in-class, multi-antigen targeted, off-the-shelf, iPSC-derived CD19 CAR NK cell therapy in relapsed/refractory B-cell lymphoma. Blood. 138, 823 (2021).
- Saetersmoen, M. L., Hammer, Q., Valamehr, B., Kaufman, D. S., Malmberg, K. J. Off-the-shelf cell therapy with induced pluripotent stem cell-derived natural killer cells. Semin Immunopathol. 41 (1), 59-68 (2019).
- Gerew, A., et al. Deletion of CISH and TGFβR2 in iPSC-derived NK cells promotes high cytotoxicity and enhances in vivo tumor killing. Blood. 138, 2780 (2021).
- Goldenson, B. H., Hor, P., Kaufman, D. S. iPSC-derived natural killer cell therapies - Expansion and targeting. Front Immunol. 13, 841107 (2022).
- Karvouni, M., Vidal-Manrique, M., Lundqvist, A., Alici, E. Engineered NK cells against cancer and their potential applications beyond. Front Immunol. 13, 825979 (2022).
- Ayuso, J. M., et al. Microphysiological model reveals the promise of memory-like natural killer cell immunotherapy for HIV± cancer. Nat Commun. 14 (1), 6681 (2023).
- Miller, J. S., et al. Safety and virologic impact of haploidentical NK cells plus interleukin 2 or N-803 in HIV infection. J Infect Dis. 229 (5), 1256-1265 (2024).
- Gutiérrez-Hoya, A., Soto-Cruz, I. NK cell regulation in cervical cancer and strategies for immunotherapy. Cells. 10 (11), 3104 (2021).
- Lisco, A., et al. Treatment of relapsing HPV diseases by restored function of natural killer cells. N Engl J Med. 385 (10), 921-929 (2021).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。