Method Article
Bağırsak İsviçre ruloları ve parafine gömülü dokunun immünofloresan boyaması için optimize edilmiş protokol
Bu Makalede
Özet
Bağırsak, sindirim ve emilim için hayati önem taşır. Her bölge -duodenum, jejunum, ileum, kolon- benzersiz hücresel yapılar nedeniyle farklı işlevlere hizmet eder. Bağırsak fizyolojisini incelemek, titiz bir doku analizi gerektirir. Bu protokol, İsviçre rulo tekniğini kullanarak doku fiksasyonunu ve işlenmesini ana hatlarıyla belirtir ve uygun doku koruması ve oryantasyonu yoluyla doğru immün boyamayı sağlar.
Özet
Bağırsak, ince ve kalın bağırsaklardan oluşan karmaşık bir organdır. İnce bağırsak ayrıca duodenum, jejunum ve ileum olarak ikiye ayrılabilir. Bağırsağın her anatomik bölgesi, hücresel yapıdaki farklılıklarla yansıtılan benzersiz bir işleve sahiptir. Bağırsaktaki değişikliklerin araştırılması, farklı doku bölgelerinin ve hücresel değişikliklerin derinlemesine analizini gerektirir. Bağırsakları incelemek ve büyük doku parçalarını görselleştirmek için, araştırmacılar genellikle bağırsak İsviçre ruloları olarak bilinen bir teknik kullanırlar. Bu teknikte bağırsak her anatomik bölgeye ayrılır ve düz bir yönelimde sabitlenir. Daha sonra, doku dikkatlice yuvarlanır ve parafin gömme için işlenir. Uygun doku fiksasyonu ve oryantasyonu genellikle gözden kaçan bir laboratuvar tekniğidir, ancak aşağı akış analizi için kritik öneme sahiptir. Ek olarak, bağırsak dokusunun yanlış İsviçre yuvarlanması, kırılgan bağırsak epiteline zarar verebilir ve bu da immün boyama için düşük doku kalitesine yol açabilir. Sağlam hücresel yapılara sahip iyi sabitlenmiş ve düzgün yönlendirilmiş dokunun sağlanması, bağırsak hücrelerinin en iyi şekilde görüntülenmesini sağlayan çok önemli bir adımdır. Bağırsağın tüm bölümlerini tek bir parafine gömülü blokta içerecek şekilde İsviçre ruloları yapmak için uygun maliyetli ve basit bir yöntem sunuyoruz. Ayrıca, bağırsak epitelinin çeşitli yönlerini incelemek için bağırsak dokusunun optimize edilmiş immünofloresan boyamasını da tarif ediyoruz. Aşağıdaki protokol, araştırmacılara bağırsak dokusu fiksasyonu, Swiss-roll tekniği ve immünoboyama yoluyla yüksek kaliteli immünofloresan görüntüleri elde etmek için kapsamlı bir kılavuz sağlar. Bu rafine yaklaşımları kullanmak, bağırsak epitelinin karmaşık morfolojisini korur ve bağırsak fizyolojisi ve patobiyolojisinin daha derin bir şekilde anlaşılmasını sağlar.
Giriş
Bağırsağın hücresel mimarisi, bağırsak dokusu immün boyama için korunurken yapısal bütünlüğünün korunmasında benzersiz bir zorluk teşkil eder. İnce bağırsak, villus1 olarak bilinen uzun parmak benzeri yapılardan oluşur. Bu villuslar genellikle gömme işlemleri sırasında malform hale gelir. Araştırmacıların, bağırsağın tüm bölgelerinin yanı sıra bağırsağı oluşturan katmanların (yani muscularis propria, mukoza ve serosa) görselleştirilmesine izin vererek, enine kesitler elde etmek için bağırsakları düzgün bir şekilde gömme tekniklerine sahip olmalarını sağlamak, sağlam deneysel analiz için çok önemlidir2. Yetersiz fiksasyon, aşırı fiksasyon ve yanlış doku kullanımı doku bütünlüğünü tehlikeye atarak bağırsak epitelinde yanlışlıkla hasara neden olur 3,4. Bu adımlar sırasında bağırsak epiteline zarar vermek, immünohistokimya protokollerinin ve kullanılan antikorların etkinliğinden bağımsız olarak, immünofloresan gibi sonraki analizlerin kalitesini önemli ölçüde azaltabilir.
İmmün boyama, uygun doku fiksasyonu gibi, biyomedikal araştırmanın önemli bir parçasıdır. İyi yapıldığında, immün boyama, hücresel yapı ve fonksiyonun daha önce bilinmeyen yönlerini aydınlatabilir. Parafin bölümlerinin immünofloresan boyaması, fiksasyon ve parafin gömme işleminden kaynaklanan fizikokimyasal modifikasyonlar nedeniyle zor olabilir5. Fiksasyon ve parafin gömme, ilgilenilen epitopların immünofloresan tespitine müdahale edebilecek antijen maskelemesi ile sonuçlanır6. Gecikmiş fiksasyon proteolitik bozulmaya neden olabilir, bu da kritik epitoplarınzayıflamasına veya hiç boyanmamasına neden olur 7. Ek olarak, antikorlar genellikle yüksek düzeyde arka plan ile yanlıştır. Tutarlı ve spesifik antikor bağlanmasını ve yüksek sinyal-gürültü oranını destekleyen immün boyama protokolleri, araştırmacılar için değerli bilgiler sağlayabilir.
Burada, bağırsak dokusu fiksasyonu, İsviçre rulo hazırlığı8 ve immünoboyama yoluyla yüksek kaliteli immünofloresan görüntüler elde etmek için tasarlanmış kapsamlı bir protokol sunuyoruz. Bağırsağın bütünlüğünü korumaya yönelik kılavuzları vurgulayan protokol, araştırmacılara immünofloresan görüntüleme çalışmalarının kalitesini ve güvenilirliğini artırmak için sağlam bir metodoloji sağlamayı amaçlamaktadır. Ayrıca, protokolü kısıtlı fonlara sahip olabilecek laboratuvarlar için daha erişilebilir hale getirmek için filtre kağıdı ve ev yapımı antijen alımı, bloke edici çözümler ve antikor seyrelticileri dahil olmak üzere uygun maliyetli kaynakları kullanmaya çalıştık. Tüm deneysel protokollerde olduğu gibi, araştırmacılar mevcut protokolü deneysel yaklaşımlarına ve ilgi alanlarına göre optimize etmelidir.
Protokol
Güney Carolina Tıp Üniversitesi Kurumsal Hayvan Bakımı ve Kullanımı Komitesi, tüm hayvan bakımını, bakımını ve tedavisini onayladı. Bu çalışmada kullanılmak üzere yetişkin C57BL / 6J farelerinden (3-5 aylık erkek ve dişiler, yaklaşık 30 g ağırlığında) bağırsak dokusu toplandı.
1. Bağırsak dokusu fiksasyonu
- Ötenazi uygulanmış bir farenin tüm bağırsağını dikkatlice inceleyin ve fosfat tamponlu salin (PBS) içeren bir tartı teknesine veya Petri kabına yerleştirin.
- Bağırsakları PBS'den çıkarın ve fazla yağ ve bağ dokusunu nazikçe çıkarmak için makas kullanın. Bağ dokusunun kesilmesi, sonraki adımlarda dokunun düz durmasına yardımcı olur.
- Bağırsağı makas kullanarak ayrı bölümlere ayırın (ör. duodenum, jejunum, ileum, çekum ve kolon). Bağırsak uzunluğunun yaklaşık %13'ü duodenum, %58'i jejunum, %8'i ileum, %6'sı çekum ve kolon %15'i olmak üzere segmentleri anatomik özelliklere ve/veya uzunluğa göre bölün9. Duodenum mideyi takip eder ve ileum, çekumdan hemen önce ince bağırsağın terminal bölümüdür.
- Makas kullanarak çekumla birleştiği yeri keserek kolonu serbest bırakın. Duodenum, jejunum, ileum ve kolonu PBS'nin tartı teknesine veya Petri kabına yerleştirin. Çekumu atın veya yayınlanmış diğer yöntemlere göre düzeltin10.
- P200 pipet ucunu 10 mL'lik bir şırıngaya takın ve ucun büyük ucunu bir tıraş bıçağıyla kesin. Şırıngayı PBS ile doldurun.
- Şırınga ucunu forseps kullanarak bir bağırsak segmentinin açıklığına yerleştirin. Bağırsak segmentini şırınga üzerinde tutmak için forsepsleri kullanın ve bağırsak içeriğini çıkarmak için ~ 50 μL / s hızında hafifçe yıkayın. Bağırsak içeriğini boş bir tartı teknesine veya Petri kabına toplayın.
- Islak bağırsak segmentini kuru etiketli selüloz filtre kağıdı şeridi üzerine düz bir çizgi halinde yerleştirin (Malzeme Tablosuna bakınız). Bağırsak segmentinin kuru filtre kağıdına düzgün şekilde yapışacak kadar ıslak olduğundan emin olun. Filtre kağıdını bir kalem kullanarak fare numarası, genotip, deney grubu vb. bilgilerle etiketleyin.
NOT: Filtre kağıdını etiketlemek için kalem kullanmak, sabitleme sırasında etiketlerin kaybolmasına neden olabilir. - Bağırsağı mezenterik çizgi boyunca uzunlamasına açmak için diseksiyon makası kullanın. Kesilen dokuyu filtre kağıdına düz bir şekilde yerleştirmek için makasın alt kenarını veya bir çift forseps kullanarak bir seferde ~ 5 mm kesin. Bağırsağın tüm bölümü kesilene ve filtre kağıdına düz bir şekilde yerleştirilene kadar devam edin. Bağırsakları mümkün olduğunca düz bir çizgide kesmeye özen gösterin, çünkü bu dokuyu yuvarlamayı kolaylaştıracaktır.
NOT: Doku hasarını önlemek için bu adım sırasında bilyeli makas kullanılabilir. - Bağırsak segmentinin üzerine başka bir filtre kağıdı parçası yerleştirin. Filtre kağıdının bağırsak segmentini sıkıştırdığından ve sabitleme sırasında bağırsağın kıvrılmasını veya düzleştirilmiş şeklini kaybetmesini önlediğinden emin olun.
- Dokuyu yerine sabitlemek için filtre kağıdının kenarlarını zımbalayın. Dokuyu zımbalamayın. Sabitleme sırasında dokunun filtre kağıdından ayrılmasını önlemek için dokunun etrafına yeterince zımba yerleştirin.
- Bağırsak segmentlerinin her biri (duodenum, jejunum, ileum ve kolon) için 1.5-1.10 adımlarını tekrarlayın.
- Dokuları gece boyunca 4 ° C'de% 10 normal tamponlu formaline (veya% 4 paraformaldehit, Carnoy fiksatifi vb. gibi tercih edilen fiksatif) daldırın.
DİKKAT: Formalin gibi fiksatifler toksik olduğundan doğru kişisel koruyucu ekipmanın giyildiğinden emin olun.
2. Bağırsak dokusu haddeleme ve işleme
DİKKAT: 2.1-2.6 adımlarını havalandırmalı bir davlumbazda gerçekleştirin.
- Filtre kağıdının üst parçasını (bağırsağın lümen tarafına dokunan) yavaşça çıkarın. Filtre kağıdının alt kısmından bağırsağı dikkatlice soymak için forseps kullanın. Filtre kağıdını atın.
- Üç tartım teknesini PBS ile doldurun. Formalini dokudan çıkarmak için dokuyu PBS 3x'te yıkayın.
- Ters hareket forsepslerini kullanarak (Malzeme Tablosuna bakınız), lümen tarafı yukarı bakacak şekilde kısa kenar boyunca bir parça bağırsak alın. Dokuyu yuvarlamak için forsepsleri çevirin. Dokuyu yuvarlanırken yönlendirmeye yardımcı olması için bir çift normal forseps kullanın. Mendil katlanırsa, açın ve tekrar deneyin.
- Mendili kuru bir tartım teknesine veya Petri kabına yerleştirin. Bir elinizle forseps ile dokuyu yerinde tutun. Ters etkili forsepsleri dikkatlice açın ve dokuyu ters etkili forsepslerden çıkarmak için diğer forsepsleri kullanarak dokuyu serbest bırakın.
- Dokuya 00 numara bir diseksiyon pimi veya minutien pimi yerleştirin (Malzeme Tablosuna bakınız). Pimin keskin ucunu çıkarmak için tel kesiciler kullanın. Dokuyu büyük bir kasete yerleştirin ve ardından kaseti işlemeye hazır olana kadar %70 etanol içeren bir kaba koyun.
- 2.1-2.5 adımlarını tüm bağırsak segmentleri (duodenum, jejunum, ileum ve kolon) ile tekrarlayın ve dört doku rulosunu da aynı büyük kasete yerleştirin (bkz. Etiketin etanol ve ksilen (Malzeme Tablosuna bakınız) çözeltilerinde yıkanmasını önlemek için kasetin bir kalemle etiketlendiğinden emin olun.
- Tüm numuneler yuvarlandıktan sonra, numuneleri bir doku işlemcisine koyun. Bağırsak dokusu için aşağıdaki ayarları kullanın: 35 dakika boyunca% 70 etanol; 35 dakika boyunca% 90 etanol; 35 dakika boyunca% 95 etanol; 35 dakika, 3x% 100 etanol; 35 dakika, 3x ksilen; 60 dakika parafin, 3x. Kasetler erimiş parafin mumunda uzun süre bırakılabilir.
DİKKAT: Ksilen toksik bir kimyasal olduğu için uygun koruyucu ekipmanın giyildiğinden emin olun.
3. Bağırsak dokusunun gömülmesi
- Parafini erimiş tutmak için büyük gömme kalıplarını önceden ısıtın.
- Kasetleri doku işlemcisinden çıkarın ve erimiş parafin dolu bir behere yerleştirin.
- Bir gömme istasyonunda, bir kalıba az miktarda parafin yerleştirin. Dört İsviçre rulosunu kasetten çıkarın ve hepsini mümkün olduğunca düz bir şekilde yerleştirerek tek bir kalıba yerleştirin. Kalıbı doldurmak için daha fazla parafin ekleyin.
- Kalıbı soğuk tabağa taşıyın ve tüm İsviçre rulolarının kalıbın altında düz olduğundan emin olun. Kalıba etiketli küçük bir kaset üstü yerleştirin ( Malzeme Tablosuna bakın) ve gerekirse daha fazla parafin ekleyin.
- Balmumu katılaştıktan sonra bloğu kalıptan çıkarın. Doku artık 5 μm'lik dilimler halinde kesilmeye ve immün boyamaya yönelik şarjlı cam slaytlar üzerinde yüzdürülmeyehazırdır 11.
4. Doku aderansı ve lam hazırlama
- Hazırlanan 5 μm parafin doku bölümünün slayta yapışmasını sağlamak için, cam slaytları 15-30 dakika boyunca 60 °C'ye ayarlanmış bir sürgü ısıtıcısı veya ısı bloğu üzerinde ısıtın. Slaytlar ayrıca daha uzun süre sıcak bırakılabilir; Bu adım zamana duyarlı değildir.
- Slaytları oda sıcaklığına (~ 15 dakika) soğumaya bırakın.
5. Deparafinizasyon
- Slaytların parafinizasyonunun giderilmesine başladıktan sonra, dokunun bir çözelti içinde kaldığından ve tüm immün boyama süreci boyunca kurumadığından emin olun.
- Cam slaytları tutmak için bir sürgülü raf kullanın (Malzeme Tablosuna bakın) ve bunları bir temizleme/parafinizasyon reaktifi ile doldurulmuş solvente dayanıklı bir kabın (Malzeme Tablosuna bakın) içine yerleştirin (Malzeme Tablosuna bakın). Reaktifin her slayttaki dokuyu tamamen kapladığından emin olun. Slaytları temizleme reaktifine tamamen daldırmadan önce, kayar rafı temizleme solüsyonuna birkaç kez daldırın veya itin. Slaytları 10 dakika veya daha uzun süre su altında bırakın.
NOT: Bu adımın, seçilen temizleme maddesine bağlı olarak, tehlikeli dumanlar nedeniyle havalandırmalı bir davlumbazda gerçekleştirilmesi gerekebilir. Bu adımda dokunun deparafinizasyonu, toksik olmayan bir temizleme maddesi kullanılıyorsa zamana duyarlı değildir. - Fazla temizleme reaktifini çıkarmak için sürgülü rafı çıkarın ve çalkalayın. Solvente dayanıklı yeni bir kapta, adım 5.2'yi tekrarlayın.
- Solvente dayanıklı yeni bir kapta, adım 5.3'ü tekrarlayın. Slaytları 15 dakika veya daha uzun süre su altında bırakın. Bu adım zamana duyarlı değildir.
6. Rehidrasyon
- Fazla temizleme reaktifini çıkarmak için sürgülü rafı çıkarın ve çalkalayın. %100 etanol ile doldurulmuş solvente dayanıklı yeni bir tabakta, sürgülü rafı birkaç kez daldırın veya itin ve slaytları 5 dakika su altında bırakın. Bu adım zamana duyarlıdır. 2x tekrarlayın.
- Fazla %100 etanolü çıkarmak için sürgülü rafı çıkarın ve çalkalayın. %95 etanol ile doldurulmuş solvente dayanıklı yeni bir tabakta, sürgülü rafı birkaç kez daldırın veya itin ve slaytları 5 dakika su altında bırakın. Bu adım zamana duyarlıdır. 1x tekrarlayın.
- Fazla %95 etanolü çıkarmak için sürgülü rafı çıkarın ve çalkalayın. %70 etanol ile doldurulmuş solvente dayanıklı yeni bir tabakta, sürgülü rafı birkaç kez daldırın veya itin ve slaytları 5 dakika su altında bırakın. Bu adım zamana duyarlıdır.
- Fazla %70 etanolü çıkarmak için sürgülü rafı çıkarın ve çalkalayın. %50 etanol ile doldurulmuş solvente dayanıklı yeni bir tabakta, sürgülü rafı birkaç kez daldırın veya itin ve slaytları 5 dakika su altında bırakın. Bu adım zamana duyarlıdır.
- Fazla %50 etanolü çıkarmak için sürgülü rafı çıkarın ve çalkalayın. Deiyonize (DI) su ile doldurulmuş, solvente dayanıklı yeni bir kapta, sürgülü rafı birkaç kez daldırın veya itin ve slaytları 5 dakika su altında bırakın. Bu adım zamana duyarlıdır.
- Burada duraklatmak için, 5 dakikalık su rehidrasyon adımından sonra immün boyamaya devam edilebilene kadar slaytları PBS'li bir kaba yerleştirin.
7. Antijen alımı
- Solvente dirençli yeni bir kabı uygun bir antijen alma tamponu ile doldurun. Sürgülü rafı doğrudan bu çözeltiye aktarın. Slaytların, dokuyu tamamen kaplayacak şekilde antijen alma solüsyonuna tamamen batırıldığından emin olun.
NOT: Optimal antijen alma solüsyonları, kullanılan belirli antikora bağlı olarak değişebilir. Bireysel antikorlar için gerekli olan antijen alımının araştırmacı tarafından belirlenmesi gerekebilir.- 1x sitrat antijen alma tamponu yapmak için, 1 L deiyonize su başına 2.94 g sodyum sitrat dihidrat ( Malzeme Tablosuna bakınız) ekleyin. Sodyum sitrat dihidrat çözüldükten sonra, çözelti pH 6'ya ulaşana kadar hidrojen klorür ekleyin ( Malzeme Tablosuna bakınız). Son olarak, 1 L deiyonize su için 500 μL Tween20 ( Malzeme Tablosuna bakınız) ekleyin.
- 1x Tris-EDTA antijen alma tamponu yapmak için, 1 L deiyonize suya 1.211 g Tris Baz ve 0.292 g EDTA ekleyin. Çözündükten sonra pH 9'a ayarlayın.
- Antijen alma solüsyonunu ve sürgüleri içeren solvente dayanıklı kabı bir kapakla kapatın ve kapağı lastik bantlarla sabitleyin.
- Solvente dayanıklı güvenli kabı metal rafın veya nihale üzerine bir düdüklü tencereye ( Malzeme Tablosuna bakın) yerleştirin. Basıncın oluşabilmesi için düdüklü tencerede metal rafa veya nhale ulaşacak kadar su olduğundan emin olun.
- Kapağı düdüklü tencerenin üzerine yerleştirin ve kapağı yerine kilitlemek için saat yönünde çevirin. Kapak üzerinde bulunan basınç limit valfini basınç ayarına çevirin.
- Menü ayarı altında, düdüklü tencere üzerinde yüksek basıncı seçin, ardından zaman ayarı altında düdüklü tencereyi 30 dakikaya ayarlayın. Başlat'ı seçin.
- 30 dakika sonra düdüklü tencere bip sesi çıkaracak ve otomatik olarak sıcak tutma ayarına geçecektir. Basınç doğal olarak serbest kalana ve kapak serbestçe açılana kadar bekleyin.
- Solvente dayanıklı kabı düdüklü tencereden çıkarmak için ısıya dayanıklı eldivenler kullanın ( Malzeme Tablosuna bakın) ve lastik bandı ve kapağı çıkarın. Slaytların oda sıcaklığına soğumasını sağlamak için çanağı ~ 30 dakika buz banyosuna koyun. Bu adım zamana duyarlı değildir.
- Oda sıcaklığına soğuduktan sonra, sürgülü rafı solvente dayanıklı tabaktan çıkarın ve artık antijen alma solüsyonunu çıkarmak için DI suyla doldurulmuş solvente dayanıklı yeni bir kaba yerleştirin. Slaytların tamamen suya daldırıldığından emin olun.
- Sürgülü rafı DI suyundan çıkarın ve 5 dakika boyunca PBS ile doldurulmuş solvente dayanıklı yeni bir kaba koyun. Slaytların tamamen suya daldırıldığından emin olun. Bu adım zamana duyarlı değildir.
8. Spesifik olmayan arka plan lekelenmesini engelleme
- Büyük bir sürgülü kutu alarak ve kapağa yapışan karton kapağı çıkararak nemlendirilmiş bir oda hazırlayın. Sürgülü kutunun tabanına, nemli kağıt havluları dikey olarak aşağı yerleştirin. Nemli kağıt havluların düz durduğundan emin olun.
- PBS'ye batırılmış slayt rafından slaytları teker teker çıkarın. Mendilden kaçınarak cam slayttaki fazla PBS'yi dikkatlice silin.
- Hidrofobik bir kalemle (Malzeme Tablosuna bakınız) hidrofobik kalemle dokunun etrafına bir kutu çizerek dokuyu çevreleyen bir bariyer oluşturun. Mendilden kaçınmaya dikkat edin ve hidrofobik kalemi dokuya çok yakın kullanmayın.
- Belirtilen slaytı nemli kağıt havluların üzerine yatay olarak yerleştirin. Dokuyu kaplamak için bloke edici tampon ekleyin (~ 100 μL).
- Bloke edici bir tampon yapmak için, 9.85 mL PBS'ye 100 μL soğuk su balık derisi jelatini (Teleostein Jelatin; Malzeme Tablosuna bakınız) ekleyin. Son olarak, 50 μL %20 Triton X-100 ekleyin ( Malzeme Tablosuna bakınız) ve eriyene kadar karıştırın.
- Her slayt için 8.2-8.4 adımlarını tekrarlayın. Nemlendirilmiş hazneyi kapatın ve slaytları oda sıcaklığında 90 dakika inkübe edin.
9. Fare engelleme üzerinde fare
- İmmün renkteki fare dokusunu boyamak için birincil fare antikoru kullanırken, ek bir engelleme adımı gerçekleştirin. Fare üzerinde fare engelleme reaktifleri (fare üzerinde fare bloğu; Malzeme Tablosuna bakınız) ticari olarak temin edilebilir; Fare üzerinde fare bloğunu hazırlarken ticari talimatları izleyin.
- Blokaj solüsyonuna hafifçe vurun ve dokuyu kaplamak için hazırlanan fare üzerinde fare bloğunu hemen ekleyin (~ 100 μL). Farelerde ortaya çıkan bir birincil antikor kullanılarak boyanacak olan fare dokusunu içeren her slayt için tekrarlayın.
- Nemlendirilmiş hazne kutusundaki doku bölümlerini oda sıcaklığında 15 dakika inkübe edin.
- Slaytları nemlendirilmiş hazneden çıkarın ve doğrudan PBS'ye batırılmış bir slayt rafına yerleştirin. Fare üzerindeki fare bloğunu temizlemek için slaytları PBS'de 5 dakika bırakın.
10. Birincil antikorlar
- Her slayt için, farklı türlerde ortaya çıkan ilgilenilen birincil antikorları seçin. Antikor seyrelticisindeki birincil antikorları, üreticinin talimatına göre seyreltin. Aşağıdaki primer antikorlar kullanıldı: E-kaderin (1:100), MUC2 (1:200), PCNA (1:500), LAMININ (1:200), β-KATENİN (1:200) ve LAMP1 (1:50).
NOT: Üretici önerilen seyreltmeleri sağlamıyorsa, 1:100 seyreltme iyi bir başlangıç noktasıdır. İlgilenilen birincil antikor bir florofora konjuge ise, adım 12.2'ye bakın.- Antikor seyreltici yapmak için, yukarıda açıklanan balık jelatin engelleme tamponu kullanılıyorsa, PBS'ye 1:20 bloke edici tampon ekleyin.
- Slaytları PBS'den veya nemlendirilmiş odadan çıkarın, fazla engelleme solüsyonunu veya PBS'yi hafifçe vurun ve bunları nemlendirilmiş odaya yatay olarak geri yerleştirin. Adım 8.3'te hidrofobik kalemle oluşturulan bariyerin kaldığından emin olun; Gerekirse dokuyu tekrar ana hatlarıyla belirtin.
- Dokuyu kaplamak için uygun şekilde seyreltilmiş primer antikorları ekleyin (~ 100 μL).
- Nemlendirilmiş odayı kapatın ve slaytları gece boyunca karanlıkta 4 ° C'de düz bir yüzeyde inkübe edin.
11. Slaytları yıkamak
- Slaytları nemlendirilmiş odadan çıkarın, birincil antikorları hafifçe vurun ve slaytları 5 dakika boyunca PBS'ye batırılmış bir slayt rafına yerleştirin.
- Sürgülü rafı çıkarın ve 5 dakika boyunca PBS ile doldurulmuş, solvente dayanıklı yeni bir kaba yerleştirin. 1. adımı tekrarlayın.
12. İkincil antikorlar ve çekirdek karşı boyama
- Her slayt için, birincil antikor türlerine bağlanmak üzere tasarlanmış ikincil antikor floroforlarını seçin. İkincil antikor seyreltici içinde ikincil antikor floroforlarını veya konjuge birincil antikorları seyreltin. Kullanılan ikincil antikorlar eşek anti-keçi 488 (1:200), eşek anti-tavşan cy3 (1:200), eşek anti-fare 647 (1:200), eşek anti-tavşan 647 (1:200) ve eşek anti-sıçan cy3 (1:200) idi. Florofor 647'ye konjuge edilmiş birincil antikor γ-ACTIN, 1:100 seyreltmede kullanıldı.
- İkincil antikor seyreltici yapmak için, yukarıda açıklandığı gibi balık jelatin engelleme tamponu kullanılıyorsa, PBS'ye 1:100 bloke edici tampon ekleyin.
- Slaytları PBS'den çıkarın, fazla PBS'yi nazikçe vurun ve nemlendirilmiş odaya yatay olarak geri yerleştirin. Adım 8.3'te hidrofobik kalemle oluşturulan bariyerin kaldığından emin olun; Gerekirse dokuyu tekrar ana hatlarıyla belirtin.
- Dokuyu kaplamak için uygun şekilde seyreltilmiş ikincil antikor floroforları veya ilgilenilen konjuge birincil antikorları ekleyin (~ 100 μL).
- Nemlendirilmiş odayı kapatın ve slaytları karanlıkta oda sıcaklığında 1 saat inkübe edin.
- PBS kullanarak 1 μg / mL Hoechst veya DAPI'lik bir nihai konsantrasyon için PBS kullanarak 10 mg / mL Hoechst (Malzeme Tablosuna bakınız) veya DAPI'yi seyreltin ve doğrudan dokuya (~ 100 μL) ekleyin. Karanlıkta oda sıcaklığında 5 dakika inkübe edin.
- Slaytları nemlendirilmiş hazneden çıkarın ve karanlıkta 5 dakika boyunca PBS'ye batırılmış bir slayt rafına yerleştirin.
- Sürgülü rafı çıkarın ve karanlıkta 5 dakika boyunca PBS ile doldurulmuş solvente dayanıklı yeni bir kaba yerleştirin. 1. adımı tekrarlayın.
13. Mikroskopi için montaj ve hazırlık
- PBS'ye batırılmış slayt rafından her seferinde bir slayt çıkarın ve kalan slaytları karanlıkta PBS'ye batırılmış halde tutun. Fazla PBS'yi nazikçe hafifçe vurun ve gerekirse, dokudan kaçınarak cam slayttaki fazla PBS'yi dikkatlice silmek için tüy bırakmayan bir mendil kullanın.
- Dokunun merkezine bir ila iki damla antifade montaj ortamı ekleyin (Malzeme Tablosuna bakınız).
- Temiz bir lamel tutun (Malzeme Tablosuna bakın) ve yavaşça 45°'lik bir açıyla sürgünün üzerine indirin. Montaj ortamının doku üzerine eşit şekilde yayıldığından emin olun.
- Dokunun merkezinden başlayarak, hava kabarcıklarını ve fazla montaj ortamını gidermeye yardımcı olmak için lamel üzerine iki parmağınızla hafifçe bastırın. Gerekirse, kenarlara doğru bastırmaya devam edin ve boyunca hafif bir baskı uygulayın.
- Filtrelenmemiş bir P200 pipetinin küçük ucunu kesin ve bir vakuma bağlı serolojik bir pipetin ucuna takın.
- Lamelin kenarlarını takip ederek, fazla montaj ortamını çıkarmak için vakumu kullanın.
- Yeni bir sürgü kutusunda, sürgüyü yatay olarak düz bir şekilde yerleştirin ve sürgüyü karanlıkta oda sıcaklığında kurumaya bırakın.
- Her slayt için bu işlemi tekrarlayın.
Sonuçlar
Daha önce tarif edildiği gibi hematoksilen ve eozin (H&E) boyaması yapıldı12. Optimize edilmiş yöntemi kullanarak, bağırsak İsviçre ruloları, ince bağırsağın ve kalın bağırsağın üç segmentini de tek bir slaytta içeriyordu. Tüm bağırsağın bir slayt üzerine yerleştirilmesi, araştırmacıların bağırsağın tüm bölümlerindeki değişiklikleri analiz etmelerine olanak tanır ve reaktiflerin bölümlendirilmesi ve boyanmasında maliyet tasarrufu sağlar (Şekil 1). Ayrıca, immün boyama sırasında tüm bağırsak segmentlerini aynı anda aynı solüsyonlara maruz bırakmak, doğru sonuçların sağlanmasına yardımcı olur. H&E mikrografı, ince bağırsak ve kalın bağırsağın tüm bölümlerinin korunmuş bağırsak mimarisini gösterir (Şekil 2). Duodenal villus ölçümü, bu İsviçre roll yöntemi ile karşılaştırıldığında, açılmamış bağırsak dokusunda villus yüksekliğinde anlamlı bir fark göstermedi, bu da bağırsağın açılmasının doku mimarisini bozmadığını düşündürmektedir (Şekil 2D). Bağırsak İsviçre rulolarının immün boyama, bağırsağın çeşitli katmanlarının yanı sıra tüm villöz kript eksenini gösterir. Floresan görüntüler, birincil ve ikincil antikor boyamasından düşük arka plan seviyelerini gösterir ve epitelde bulunan tek tek hücreleri açıkça gösterir. Şekil 3 , farklı bağırsak segmentlerinin morfolojisini ve goblet hücreleri (MUC2 pozitif hücreler)13, apikal zar (γ-ACTIN)14, epitel hücrelerinin lateral zarı (E-KAHERİN)15 ve çekirdekler için boyamayı göstermektedir. Bu protokol, proliferatif hücreler (PCNA)16, interstisyum (LAMININ; Şekil 4A) 17, lizozomal alan (LAMP1)14 ve epitel (β-KATENİN; Şekil 4B) 18.

Şekil 1: Bağırsak İsviçre rulolarının hazırlanması ve işlenmesi için iş akışı. (A) Bağırsak segmentleri PBS içeren bir şırınga ile yıkanır ve daha sonra PBS'de yıkanır. (B) Islak bağırsak dokusu daha sonra kuru filtre kağıdına yerleştirilir. (C) Bağırsak, filtre kağıdı üzerinde uzunlamasına kesilir ve (D) hafifçe yayılır. (E) Açılan bağırsağın üzerine bir parça filtre kağıdı serilir ve bağırsak, filtre kağıdı arasına nazikçe sıkıştırılır ve zımbalanır. Bağırsak segmentleri gece boyunca sabitlenir ve (F) forseps kullanılarak yuvarlanır. (G) Bağırsak, ters hareket forsepsinden nazikçe çıkarılır ve (H) rozet görünümündedir. (I, J) Bağırsak dokusu sabitlenir ve büyük bir kasete yerleştirilir. (K) Dört bağırsak segmentinin tümü, doku işleme ve gömme için aynı kasete yerleştirilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
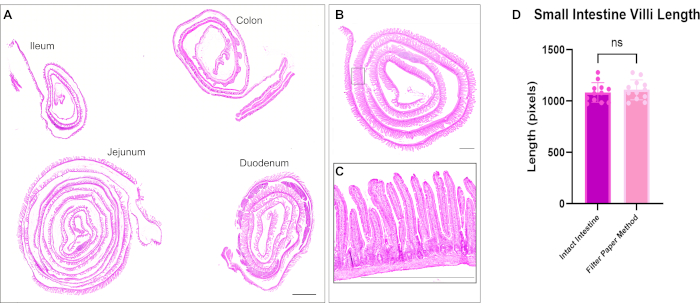
Şekil 2: Bağırsağın dört segmentinin tümünün hematoksilen ve eozin boyanması. (A) Döşeme taraması, duodenum, jejunum, ileum ve kolonun ayrı ayrı İsviçre ruloları ile tüm bağırsağı tek bir slaytta görselleştirme yeteneğini gösterir. (B) Bir bağırsak İsviçre rulosunun mikrografı ve (C) villus ve kript mimarisini göstermek için daha yüksek büyütme girişi. (D) İnce bağırsak villus uzunluğunun ölçülmesi, İsviçre rulo dokusu ile açılmamış doku arasında anlamlı bir fark göstermez. Ölçek çubukları = 1000 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Bağırsağın dört segmentinin tümünün immünofloresan boyanması. Yetişkin C57BL / 6J kontrol fareleri, çekirdekler (camgöbeği), lateral membran markörü, E-KAHERİN (yeşil), MUC2 (sarı) ile tanımlanan goblet hücreleri ve apikal fırça kenarlığı markörü, γ-ACTIN, (macenta) için immün boyandı. Ölçek çubukları = 50 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
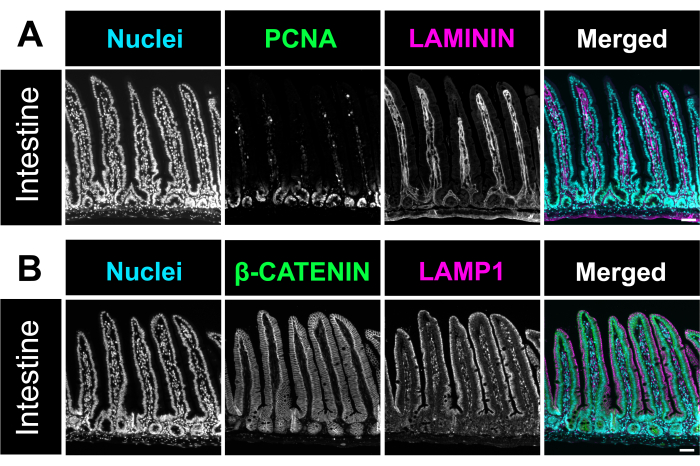
Şekil 4. Bağırsakta immünofloresan boyama. (A) Fare bağırsağının immünofloresan boyanmasının temsili bir mikrografı, çekirdekleri (camgöbeği), proliferatif hücreleri, PCNA'yı (yeşil) ve lamina propria, LAMININ'i (macenta) vurgular. (B) Bağırsakta çekirdekleri (camgöbeği), hücre zarı belirteci β-KATENİN (yeşil) ve lizozom belirteci LAMP1'i (macenta) tanımlayan immünofloresan görüntü. Ölçek çubukları = 50 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Burada, bağırsak mimarisini korumak ve doğru immün boyamayı teşvik etmek için İsviçre rulo tekniğini kullanarak doku fiksasyonu için optimize edilmiş bir yöntem sunuyoruz. Bir kez ustalaştıktan sonra, bu teknik bağırsak fizyolojisi ve hücre biyolojisini içeren çok çeşitli araştırma sorularını araştırmak için kullanılabilir19. Optimize edilmiş birkaç İsviçre haddeleme yöntemi yayınlanmıştır ve çok faydalıdır 20,21. Bu tekniğin bir avantajı, bağırsağın filtre kağıdı üzerinde doğru bir şekilde açılma kolaylığıdır. Bu, dokunun düz bir şekilde sabitlenmesine izin vererek, yuvarlanma sırasında dokunun içe doğru kıvrılmasını önler, bu da özellikle kalınlaşmış muskularis ile iltihaplı dokuyu analiz ederken yararlıdır. Ek olarak, güvenilir sonuçlar elde etmede doku kesitinin kritik rolünü vurgulamak önemlidir. Uygun kesitleme, doku mimarisinin korunmasını sağlar ve doğru immün boyamayı kolaylaştırır, sonuçta aşağı akış analizlerinin başarısına katkıda bulunur11. Optimize edilmiş yaklaşım, diğer protokollere kıyasla daha az zordur ve farklı bireyler arasında tutarlı sonuçlar verir. Bu yazıda ortaya konan teknik aynı zamanda iyi korunmuş doku mimarisi, çok yönlülük ve çeşitli antikorlar kullanılarak yüksek oranda tekrarlanabilir immün boyama sağlar.
Bu protokolün kritik bir yönü, sabitleme ve işlem süresidir. Uygun olmayan doku fiksasyonu ve işlemesi histokimyasal analizleri bozabilir. Aşırı sabitlenmiş doku kırılgan hale gelirken, az sabitlenmiş doku çok yumuşak kalır. Hem aşırı hem de az sabitlenmiş dokuların kesitlenmesi zordur ve immün boyamayı tehlikeye atar. Filtre kağıdına diseke edildikten sonra, ölüm sonrası değişiklikleri azaltmak için doku hemen formalin içine yerleştirilmelidir22. Bu protokolde murin dokusu gece boyunca formalin içinde sabitlenir. Birkaç çalışmada bu fiksasyon süresi20,23,24 kullanılmıştır. Bununla birlikte, Boenisch ve ark. immünoboyamanın formalin içinde sabitlenmiş dokuda 4 güne kadar tutarlı olduğunu göstermiştir25. İstenen analizlere bağlı olarak sabitleme süresinin ve fiksatifin optimizasyonu gereklidir. Örneğin, Carnoy fiksatifi genellikle mukus boyama26 için tercih edilir. Fiksatif seçimi ve fiksasyon süresinin süresi, deneysel yaklaşımlarına bağlı olarak her araştırmacı tarafından optimize edilmelidir. Doğru ve tutarlı işlem süreleri sağlamak için otomatik bir doku işlemcisinin kullanılması önerilir. Laboratuvarımız, bağırsak dokusunu rulo halinde yerinde tutmak için küçük pimler kullanır. Pimler olmadan, işlem sırasında doku açılabilir. Bu pimler oldukça küçük ve keskin olduğu için önlem alınması gerekir. Doku işlemeden önce pimin keskin ucunu çıkarmak için tel kesiciler kullanmanızı öneririz. Bazı histoloji çekirdekleri, pimli dokuyu kabul etmeyecektir; Bu nedenle, kullanmadan önce kontrol etmek en iyisidir. Alternatif bir yaklaşım,27'yi işlemeden önce dokuyu sabitlemek için agar kullanmaktır veya ruloların korunmasına yardımcı olmak için kasetlerde kaset süngerleri kullanılabilir.
İmmün boyama, her antikor için optimizasyon gerektiren bir protokoldür. Mümkün olduğunda nakavt onaylı antikorların kullanılması önerilir. Doku fiksasyonu ve işlemesi için bu yöntem, doğrulanmamış antikorlar kullanıldığında arka plan sinyaline kıyasla antikor bağlanmasının kolay tanımlanmasına izin vererek, net boyama ile sonuçlanır. Fiksatif seçim, antijen alımı ve antikor seyreltmesi antikorun özgüllüğünü etkileyebilir. Araştırmacıların, her antikor için fiksasyon, antijen alımı ve kuluçka süresini ayarlayarak protokolü dikkatli bir şekilde değerlendirmelerini ve optimize etmelerini öneririz. En iyi sonuçları elde etmek için, antikorlar optimal konsantrasyonu belirlemek için çeşitli seyreltmelerde ve farklı antijen alma tamponlarında test edilmelidir. Epitop alımı, fiksasyon sırasında oluşan metilen köprülerini kırarak immün boyamayı iyileştirir. Bu protokolde, proteolitik kaynaklı epitop alımı yerine ısıya bağlı epitop alımı kullanılır, çünkü enzim sindiriminin doku morfolojisini bozma olasılığı daha yüksektir28. En yaygın ısı kaynaklı epitop alma tamponları sitrat tamponu, tris-HCl ve tris-EDTA'dır ve sitrat tamponu doku morfolojisi üzerinde en nazik olanıdır29. Tampon seçimi değişir ve her antikor için belirlenmelidir. Birçok antijen geri alma tamponu, bloke edici çözelti ve antikor seyrelticisi ticari olarak mevcuttur. Ancak, bu çözümler son derece pahalı ve maliyet engelleyici olabilir. Maliyet etkinliğini sağlamak için yaygın antijen alma solüsyonları ve bloke edici ve antikor seyreltici solüsyonların tariflerini sağladık.
Bu yöntemin bir sınırlaması, fiksasyon ve işlemenin dokuyu değiştirebilmesi ve epitopları maskeleyebilmesidir. Alternatif bir yaklaşım, taze donmuş dokuyu immün boyamaktır. Taze donmuş doku, toksik fiksatiflere maruz kalmaktan kaçınmaya, protein yapısını korumaya ve bazı epitopların erişilebilirliğini iyileştirmeye izin verecek şekilde dondurulur. Bununla birlikte, doku mimarisi ve morfolojisi, sabit ve parafine gömülü dokulardan daha zayıftır. Taze donmuş dokuyla ilgili diğer zorluklar arasında, donmuş blokları ve slaytları bölümlere ayırmak ve depolamak için gereken malzemeler ve lojistik yer alır. İsviçre rulolarının bağırsak dokusu şeritlerine karşı analizi, daha önceki bir raporda30 açıklandığı gibi, villus yüksekliği ve genişliğindeki farklılıkları ve lamina propriadaki bağışıklık hücrelerindeki farklılıkları gösterir. Bu sonuçlar, bağırsak İsviçre rulolarının, deneyler planlanırken göz önünde bulundurulması gereken bazı bağırsak özelliklerini değiştirdiğini göstermektedir. Ek olarak, formalinle sabitlenmiş parafine gömülü dokuya spesifik olarak bağlanan birçok antikor, taze donmuş dokuda iyi lekelenmediğinden, antikor yeniden doğrulaması gereklidir31.
Bağırsak dokusunun immün boyanması, gastrointestinal hücre biyolojisi ve fizyolojisi ile ilgili çok çeşitli soruları yanıtlamak için kullanılabilir. Bu teknik, bağırsak iltihabı ortamında, bakteriyel enfeksiyonu takiben ve kanserin ilerlemesi sırasında epitel değişikliklerini tanımlamak için yaygın olarak kullanılmaktadır. Burada sunulan yöntem, bağırsak dokusunun korunması için idealdir, çünkü uygun maliyetlidir, teknik olarak zorlayıcı değildir ve yüksek oranda tekrarlanabilirdir. En iyi sonuçları elde etmek için, deneysel tasarıma ve test edilen hipoteze dayalı olarak bu protokolde belirtilen adımların optimizasyonunu teşvik ediyoruz.
Açıklamalar
Yazarların ifşa edecek hiçbir şeyi yok.
Teşekkürler
Bu çalışma, Ulusal Sağlık Enstitüleri (NIH) tarafından ACE'ye verilen K01 DK121869 tarafından desteklenmiştir ve bu yayın kısmen T32 GM132055 (RME), F31 DK139736 (SAD), T32 DK124191 (SAD), TL1 TR001451 (RS), UL1 TR001450 (RS) ve SAD & RS'ye HCS köşe taşı hibeleri tarafından desteklenmiştir. Bu çalışma, Güney Carolina Tıp Üniversitesi'nden (MUSC) ACE'ye başlangıç fonları tarafından desteklendi ve MUSC Sindirim Hastalığı Araştırma Çekirdek Merkezi (P30 DK123704) ve Sindirim ve Karaciğer Hastalığında COBRE (P20 GM120475) tarafından desteklendi. Görüntüleme, MUSC'deki hücre ve moleküler görüntüleme çekirdeği kullanılarak gerçekleştirildi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| β-CATENIN | GeneTex | GTX101435 | |
| Cellulose filter paper | Cytiva | 10427804 | Thick Whatman paper |
| Charged glass slides | Thermo Fisher Scientific | 23888114 | |
| Coverslip | Epredia | 152440 | |
| Dissecting pins size 00 | Phusis | B082DH4TZF | |
| E-CADHERIN | R&D Systems | AF748 | |
| Freezer gloves | Tempshield | UX-09113-02 | |
| Heating block | Premiere | XH-2001 | Slide Warmer |
| Histo-Clear II | Electron Microscopy Sciences | 64111-04 | Clearing reagent |
| Hoescht | Thermo Fisher Scientific | 62249 | |
| Hydrochloric Acid | Sigma Aldrich | 320331 | |
| Hydrophobic pen | Millipore | 402176 | |
| LAMININ | GeneTex | GTX27463 | |
| LAMP1 | Santa Cruz | SC-19992 | |
| Large cassettes | Tissue-Tek | 4173 | |
| Minutien pins | Fine Science Tools | NC9679721 | |
| Mouse-on-mouse blocking reagent | Vector Laboratories | MKB-2213 | Mouse-on-mouse block |
| MUC2 | GeneTex | GTX100664 | |
| PCNA | Cell Signaling Technology | 2586S | |
| Pressure Cooker | Cuisinart | B000MPA044 | |
| ProLong gold antifade | Thermo Fisher Scientific | P36934 | Mounting medium |
| Reverse action forceps | Dumont | 5748 | |
| Slide Rack | Tissue-Tek | 62543-06 | |
| Slide Staining Set | Tissue-Tek | 62540-01 | Solvent Resistant Dishes and Metal Frame |
| Small cassettes | Fisherbrand | 15-200-403B | |
| Sodium citrate dihydrate | Fisher Bioreagents | BP327-1 | |
| Teleostein Gelatin | Sigma | G7765 | Blocking buffer |
| Triton X-100 | Thermo Fisher Scientific | A16046 | |
| Tween 20 | Thermo Fisher Scientific | J20605-AP | |
| Wipes | KimTech | 34155 | |
| Xylenes | Fisher Chemical | 1330-20-7 | |
| γ-ACTIN | Santa Cruz | SC-65638 |
Referanslar
- Louvard, D., Kedinger, M., Hauri, H. P. The differentiating intestinal epithelial cell: Establishment and maintenance of functions through interactions between cellular structures. Annu Rev Cell Biol. 8, 157-195 (1992).
- Rieger, J., Pelckmann, L. M., Drewes, B. . Animal models of allergic disease: Methods and protocols. , (2021).
- Webster, J. D., Miller, M. A., Dusold, D., Ramos-Vara, J. Effects of prolonged formalin fixation on the immunohistochemical detection of infectious agents in formalin-fixed, paraffin-embedded tissues. Vet Pathol. 47 (3), 529-535 (2010).
- Hayashi, Y., Koike, M., Matsutani, M., Hoshino, T. Effects of fixation time and enzymatic digestion on immunohistochemical demonstration of bromodeoxyuridine in formalin-fixed, paraffin-embedded tissue. J Histochem Cytochemis. 36 (5), 511-514 (1988).
- Werner, M., Chott, A., Fabiano, A., Battifora, H. Effect of formalin tissue fixation and processing on immunohistochemistry. Am J Surg Pathol. 24 (7), 1016-1019 (2000).
- Scalia, C. R., et al. Antigen masking during fixation and embedding, dissected. J Histochem Cytochem. 65 (1), 5-20 (2017).
- Masood, S., Von Wasielewski, R., Mengel, M., Nolte, M., Werner, M. Influence of fixation, antibody clones, and signal amplification on steroid receptor analysis. Breast J. 4 (1), 33-40 (1998).
- Moolenbeek, C., Ruitenberg, E. J. The "swiss roll": A simple technique for histological studies of the rodent intestine. Lab Anim. 15 (1), 57-59 (1981).
- Casteleyn, C., Rekecki, A., Van Der Aa, A., Simoens, P., Van Den Broeck, W. Surface area assessment of the murine intestinal tract as a prerequisite for oral dose translation from mouse to man. Lab Animals. 44 (3), 176-183 (2010).
- Lunnemann, H. M., et al. Cecum axis (cecax) preservation reveals physiological and pathological gradients in mouse gastrointestinal epithelium. Gut Microbes. 15 (1), 2185029 (2023).
- Qin, C., et al. The cutting and floating method for paraffin-embedded tissue for sectioning. J Vis Exp. (139), e58288 (2018).
- Feldman, A. T., Wolfe, D. . Histopathology: Methods and protocols. , (2014).
- Yang, W. H., et al. Innate mechanism of mucosal barrier erosion in the pathogenesis of acquired colitis. iScience. 26 (10), 107883 (2023).
- Dooley, S. A., et al. Myosin 5b is required for proper localization of the intermicrovillar adhesion complex in the intestinal brush border. Am J Physiol Gastrointest Liver Physiol. 323 (5), G501-G510 (2022).
- Danan, C. H., et al. Intestinal transit amplifying cells require mettl3 for growth factor signaling, kras expression, and cell survival. bioRxiv. , (2023).
- Han, B., Qi, S., Hu, B., Luo, H., Wu, J. Tgf-beta i promotes islet beta-cell function and regeneration. J Immunol. 186 (10), 5833-5844 (2011).
- Chen, L. C., Wang, H. W., Huang, C. C. Modulation of inherent niches in 3d multicellular msc spheroids reconfigures metabolism and enhances therapeutic potential. Cells. 10 (10), 2747 (2021).
- Fang, Y., et al. Cd36 inhibits beta-catenin/c-myc-mediated glycolysis through ubiquitination of gpc4 to repress colorectal tumorigenesis. Nat Commun. 10 (1), 3981 (2019).
- Whittem, C. G., Williams, A. D., Williams, C. S. Murine colitis modeling using dextran sulfate sodium (dss). J Vis Exp. (35), e1652 (2010).
- Bialkowska, A. B., Ghaleb, A. M., Nandan, M. O., Yang, V. W. Improved swiss-rolling technique for intestinal tissue preparation for immunohistochemical and immunofluorescent analyses. J Vis Exp. (113), e54161 (2016).
- Le Naour, J., et al. Improved swiss-rolling method for histological analyses of colon tissue. MethodsX. 9, 101630 (2022).
- Cardiff, R. D., Miller, C. H., Munn, R. J. Mouse tissue fixation. Cold Spring Harb Protoc. 2014 (5), 073403 (2014).
- Pereira E Silva, A., Lourenço, A. L., Marmello, B. O., Bitteti, M., Teixeira, G. a. P. B. Comparison of two techniques for a comprehensive gut histopathological analysis: Swiss roll versus intestine strips. Exp Mol Pathol. 111, 104302 (2019).
- Williams, J. M., Duckworth, C. A., Vowell, K., Burkitt, M. D., Pritchard, D. M. Intestinal preparation techniques for histological analysis in the mouse. Curr Prot Mouse Biol. 6 (2), 148-168 (2016).
- Boenisch, T. Effect of heat-induced antigen retrieval following inconsistent formalin fixation. Appl Immunohistochem Mol Morphol. 13 (3), 283-286 (2005).
- Hasegawa, Y., Mark Welch, J. L., Rossetti, B. J., Borisy, G. G. Preservation of three-dimensional spatial structure in the gut microbiome. PLoS One. 12 (11), e0188257 (2017).
- Garabedian, E. M., Roberts, L. J., Mcnevin, M. S., Gordon, J. I. Examining the role of paneth cells in the small intestine by lineage ablation in transgenic mice. J Biol Chem. 272 (38), 23729-23740 (1997).
- Moshi, J. M., Ummelen, M., Broers, J. L. V., Ramaekers, F. C. S., Hopman, A. H. N. Impact of antigen retrieval protocols on the immunohistochemical detection of epigenetic DNA modifications. Histochem Cell Biol. 159 (6), 513-526 (2023).
- Krenacs, L., Krenacs, T., Stelkovics, E., Raffeld, M. Heat-induced antigen retrieval for immunohistochemical reactions in routinely processed paraffin sections. Methods Mol Biol. 588, 103-119 (2010).
- Pereira, E. S. A., Lourenco, A. L., Marmello, B. O., Bitteti, M., Teixeira, G. Comparison of two techniques for a comprehensive gut histopathological analysis: Swiss roll versus intestine strips. Exp Mol Pathol. 111, 104302 (2019).
- Bolognesi, M. a. O., et al. Antibodies validated for routinely processed tissues stain frozen sections unpredictably. Bio Techniques. 3 (3), 137-148 (2021).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır