Method Article
Intestinal Swiss Rolls 및 파라핀 포매 조직의 면역형광 염색에 최적화된 프로토콜
요약
장은 소화와 흡수에 매우 중요합니다. 십이지장, 제주눔, 회장, 결장 등 각 부위는 독특한 세포 구조로 인해 뚜렷한 기능을 수행합니다. 장 생리학을 연구하려면 세심한 조직 분석이 필요합니다. 이 프로토콜은 스위스 롤 기법을 사용한 조직 고정 및 처리를 간략하게 설명하며, 적절한 조직 보존 및 배향을 통해 정확한 면역염색을 보장합니다.
초록
장은 소장과 대장으로 구성된 복잡한 장기입니다. 소장은 십이지장(duodenum), 제주눔(jejunum), 회장(ileum)으로 더 나눌 수 있습니다. 장의 각 해부학적 영역은 세포 구조의 차이에 의해 반영되는 고유한 기능을 가지고 있습니다. 장의 변화를 조사하려면 다양한 조직 영역과 세포 변화에 대한 심층적인 분석이 필요합니다. 장을 연구하고 큰 조직 조각을 시각화하기 위해 연구자들은 일반적으로 장 스위스 롤로 알려진 기술을 사용합니다. 이 기술에서는 장을 각 해부학적 영역으로 나누어 평평한 방향으로 고정합니다. 그런 다음 조직을 조심스럽게 굴려 파라핀 포매를 위해 가공합니다. 적절한 조직 고정 및 배향은 종종 간과되는 실험실 기법이지만 다운스트림 분석에서는 매우 중요합니다. 또한 장 조직을 부적절하게 롤링하면 연약한 장 상피가 손상되어 면역염색을 위한 조직 품질이 저하될 수 있습니다. 온전한 세포 구조를 가진 잘 고정되고 적절하게 방향이 지정된 조직을 보장하는 것은 장 세포의 최적 시각화를 보장하는 중요한 단계입니다. 우리는 단일 파라핀 내장 블록에 장의 모든 부분을 포함하도록 스위스 롤을 만드는 비용 효율적이고 간단한 방법을 제시합니다. 또한 장 상피의 다양한 측면을 연구하기 위해 장 조직의 최적화된 면역형광 염색에 대해 설명합니다. 다음 프로토콜은 장 조직 고정, 스위스 롤 기법 및 면역염색을 통해 고품질 면역형광 이미지를 얻기 위한 포괄적인 가이드를 연구자에게 제공합니다. 이러한 정교한 접근법을 사용하면 장 상피의 복잡한 형태를 보존하고 장 생리학 및 병리생물학에 대한 더 깊은 이해를 촉진할 수 있습니다.
서문
장의 세포 구조는 면역염색을 위해 장 조직을 보존할 때 구조적 무결성을 유지하는 데 고유한 문제를 제기합니다. 소장은 융모1로 알려진 길쭉한 손가락 모양의 구조로 구성되어 있습니다. 이러한 융모는 종종 임베딩 과정에서 기형이 됩니다. 연구자가 장을 적절하게 삽입하여 단면을 얻을 수 있는 기술을 갖추도록 하고, 장의 모든 영역과 장을 구성하는 층(즉, 근근, 점막 및 장막)을 시각화할 수 있도록 하는 것은 강력한 실험 분석에 매우 중요합니다2. 부적절한 고정, 과도한 고정 및 부적절한 조직 취급은 조직 무결성을 손상시켜 장 상피에 부주의한 손상을 초래합니다 3,4. 이러한 단계에서 장 상피를 손상시키면 면역조직화학 프로토콜 및 사용된 항체의 효능에 관계없이 면역형광과 같은 후속 분석의 품질이 크게 저하될 수 있습니다.
적절한 조직 고정과 같은 면역염색은 생물의학 연구의 중요한 부분입니다. 면역염색이 잘 이루어지면 이전에 알려지지 않은 세포 구조 및 기능의 측면을 밝힐 수 있습니다. 파라핀 절편의 면역형광 염색은 고정 및 파라핀 포매 과정으로 인한 물리화학적 변형으로 인해 까다로울 수 있다5. 고정 및 파라핀 임베딩은 관심 항원결정기(epitope)의 면역형광 검출을 방해할 수 있는 항원 마스킹을 초래한다6. 지연된 고정은 단백질 분해를 유발할 수 있으며, 이로 인해 중요한 에피토프(epitopes)의 염색이 약화되거나 아예 나타나지 않을 수 있다7. 또한 항체는 배경 수준이 높으면 부정확한 경우가 많습니다. 일관되고 특이적인 항체 결합과 높은 신호 대 잡음비를 촉진하는 면역염색 프로토콜은 연구자에게 귀중한 정보를 제공할 수 있습니다.
여기에서는 장 조직 고정, Swiss roll preparation8 및 immunostaining을 통해 고품질 면역형광 이미지를 얻도록 설계된 포괄적인 프로토콜을 제공합니다. 장의 무결성을 보존하기 위한 지침을 강조하는 이 프로토콜은 면역형광 이미징 연구의 품질과 신뢰성을 향상시키기 위한 강력한 방법론을 연구자에게 제공하는 것을 목표로 합니다. 우리는 또한 여과지 및 수제 항원 검색, 차단 용액 및 항체 희석제를 포함한 비용 효율적인 리소스를 사용하여 자금이 제한될 수 있는 실험실에서 프로토콜에 더 쉽게 접근할 수 있도록 노력했습니다. 모든 실험 프로토콜과 마찬가지로 연구자는 실험 접근 방식과 관심 영역에 따라 현재 프로토콜을 최적화해야 합니다.
프로토콜
사우스 캐롤라이나 의과대학(Medical University of South Carolina)의 기관 동물 보호 및 사용 위원회(Institutional Animal Care and Use Committee)는 모든 동물 관리, 유지 관리 및 치료를 승인했습니다. 본 연구에 사용하기 위해 성인 C57BL/6J 마우스(생후 3-5개월된 수컷 및 암컷, 체중 약 30g)에서 장 조직을 수집했습니다.
1. 장 조직 고정
- 안락사된 쥐의 장 전체를 조심스럽게 절개하고 인산염 완충 식염수(PBS)가 포함된 계량 보트 또는 페트리 접시에 넣습니다.
- PBS에서 내장을 제거하고 가위를 사용하여 과도한 지방과 결합 조직을 부드럽게 제거합니다. 결합 조직을 절단하면 후속 단계에서 조직이 평평하게 놓이는 데 도움이 됩니다.
- 장을 가위를 사용하여 개별 분절(예: 십이지장, 제주눔, 회장, 맹장, 결장)로 나눕니다. 해부학적 특징 및/또는 길이에 따라 장 길이의 약 13%는 십이지장, 58%는 정장, 8%는 회장, 6%는 맹장, 15%9입니다. 십이지장은 위를 따라가며, 회장은 맹장 바로 앞 소장의 말단 부분입니다.
- 결장이 맹장과 합류하는 부분을 가위로 잘라 결장을 풀어줍니다. 십이지장, jejunum, 회장 및 결장을 PBS의 계량 보트 또는 페트리 접시에 넣습니다. 맹장을 버리거나 다른 공표된 방법에 따라 고치기10.
- 면도날로 팁의 큰 끝부분을 잘라 P200 피펫 팁을 10mL 주사기에 부착합니다. 주사기에 PBS를 채웁니다.
- 집게를 사용하여 주사기 팁을 장 분절의 입구에 삽입합니다. 겸자를 사용하여 주사기의 장 분절을 잡고 ~50μL/s의 속도로 부드럽게 씻어내어 장 내용물을 제거합니다. 장 내용물을 빈 계량 보트 또는 페트리 접시에 모으십시오.
- 젖은 장 세그먼트를 드라이 라벨이 부착된 셀룰로오스 여과지 스트립에 직선으로 놓습니다( 재료 표 참조). 장 부분이 건조한 여과지에 제대로 부착될 수 있을 만큼 충분히 젖었는지 확인하십시오. 연필을 사용하여 마우스 수, 유전자형, 실험군 등에 대한 정보를 여과지에 라벨링합니다.
알림: 펜을 사용하여 여과지에 라벨을 붙이면 고정 중에 라벨이 손실될 수 있습니다. - 해부 가위를 사용하여 장간막 선을 따라 세로로 장을 절단합니다. 가위의 아래쪽 가장자리나 집게를 사용하여 절단된 조직을 여과지에 평평하게 놓아 한 번에 ~5mm를 자릅니다. 장의 전체 부분을 잘라 여과지에 평평하게 놓을 때까지 계속하십시오. 장을 가능한 한 일직선으로 자르면 조직을 더 쉽게 굴릴 수 있으므로 주의하십시오.
알림: 이 단계에서 볼 팁 가위를 사용하여 조직 손상을 방지할 수 있습니다. - 장 세그먼트 위에 다른 여과지 조각을 놓습니다. 여과지가 장 부분을 끼워 넣어 고정 중에 장이 말리거나 평평한 모양을 잃지 않도록 합니다.
- 여과지의 가장자리를 스테이플링하여 조직을 제자리에 고정합니다. 티슈를 스테이플러로 고정하지 마십시오. 고정하는 동안 티슈가 여과지에서 분리되지 않도록 티슈 주변에 충분한 스테이플을 놓습니다.
- 각 장 분절(십이지장, 제주눔, 회장 및 결장)에 대해 1.5-1.10단계를 반복합니다.
- 4 °C에서 하룻밤 동안 10 % 일반 완충 포르말린 (또는 4 % 파라 포름 알데히드, Carnoy 정착제 등과 같은 선택적인 정착제)에 조직을 담그십시오.
주의: 포르말린과 같은 고정제는 독성이 있으므로 올바른 개인 보호 장비를 착용해야 합니다.
2. 장 조직 롤링 및 가공
주의 : 통풍이 잘되는 후드에서 2.1-2.6 단계를 수행하십시오.
- 여과지의 상단 조각(장의 내강 쪽에 닿는 부분)을 부드럽게 제거합니다. 집게를 사용하여 여과지의 바닥 조각에서 장을 조심스럽게 벗겨냅니다. 여과지를 폐기하십시오.
- 3개의 계량 보트를 PBS로 채웁니다. PBS 3x로 티슈를 세척하여 티슈에서 포르말린을 제거합니다.
- 역작용 겸자( 재료 표 참조)를 사용하여 내강 면이 위를 향하도록 하여 짧은 가장자리를 따라 장 조각을 집습니다. 집게를 돌려 티슈를 굴립니다. 한 쌍의 일반 겸자를 사용하여 조직이 롤링될 때 안내하는 데 도움이 됩니다. 티슈가 접혔으면 펴서 다시 시도하십시오.
- 티슈를 마른 계량 보트 또는 페트리 접시에 넣으십시오. 한 손에 집게로 조직을 제자리에 잡습니다. 주의깊게 역작용 겸자를 열고 조직을 풀어주어, 다른 겸자를 사용하여 역작용 겸자에서 조직을 몰아냅니다.
- 크기 00 절개 핀 또는 미세한 핀을 조직에 삽입합니다( 재료 표 참조). 와이어 커터를 사용하여 핀의 날카로운 끝 부분을 제거하십시오. 티슈를 큰 카세트에 넣은 다음 처리할 준비가 될 때까지 카세트를 70% 에탄올 용기에 넣습니다.
- 모든 장 분절(십이지장, jejunum, 회장 및 결장)에 대해 2.1-2.5단계를 반복하여 4개의 조직 롤을 모두 동일한 큰 카세트에 넣습니다( 재료 표 참조). 카세트에 연필로 라벨이 부착되어 있는지 확인하여 라벨이 에탄올과 크실렌( 재료 표 참조) 용액에서 씻겨 나가는 것을 방지하십시오.
- 모든 샘플을 롤링한 후 샘플을 조직 처리기에 넣습니다. 장 조직에 대해 다음 설정을 사용하십시오 : 35 분 동안 70 % 에탄올; 35분 동안 90% 에탄올; 35분 동안 95% 에탄올; 100% 에탄올 35분 동안, 3회; 35분 동안 크실렌, 3x; 60분 동안 파라핀, 3회. 카세트는 녹은 파라핀 왁스에 장기간 방치할 수 있습니다.
주의 : 크실렌은 독성 화학 물질이므로 적절한 보호 장비를 착용하십시오.
3. 장 조직 삽입
- 파라핀이 녹은 상태를 유지하기 위해 대형 임베딩 몰드를 예열하십시오.
- 티슈 프로세서에서 카세트를 제거하고 녹인 파라핀이 담긴 비커에 넣습니다.
- 임베딩 스테이션에서 소량의 파라핀을 금형에 넣습니다. 카세트에서 4개의 스위스 롤을 제거하고 모두 하나의 틀에 넣고 가능한 한 평평하게 놓습니다. 금형을 채우기 위해 파라핀을 더 추가하십시오.
- 금형을 냉각판으로 옮기고 모든 스위스 롤이 금형 바닥에 평평하게 놓이는지 확인합니다. 라벨이 붙은 작은 카세트 상단( 재료 표 참조)을 금형에 놓고 필요한 경우 파라핀을 더 추가합니다.
- 왁스가 응고되면 금형에서 블록을 제거합니다. 이제 조직을 5μm 조각으로 절단하고 면역염색을 위해 하전된 유리 슬라이드에 띄울 준비가 되었습니다11.
4. 조직 부착 및 슬라이드 준비
- 준비된 5μm 파라핀 조직 섹션이 슬라이드에 부착되도록 슬라이드 워머 또는 열 블록에서 유리 슬라이드를 60-15분 동안 30°C로 가열합니다. 슬라이드는 더 오래 가열 할 수도 있습니다. 이 단계는 시간에 민감하지 않습니다.
- 슬라이드를 실온(~15분)으로 식힙니다.
5. 탈파라핀화
- 슬라이드의 탈파라핀화를 시작할 때 조직이 용액에 남아 있고 면역염색의 전체 과정 동안 건조되지 않는지 확인하십시오.
- 슬라이드 랙(재료 표 참조)을 사용하여 유리 슬라이드를 잡고 투명화/탈파라핀화 시약(재료 표 참조)으로 채워진 내용제성 접시(재료 표 참조) 안에 넣습니다. 시약이 각 슬라이드의 조직을 완전히 덮는지 확인하십시오. 슬라이드를 투명화 시약에 완전히 담그기 전에 슬라이드 랙을 투명화 용액에 여러 번 담그거나 밀어 넣습니다. 슬라이드를 10분 이상 물에 담근 상태로 두십시오.
알림: 이 단계는 선택한 청소제에 따라 위험한 연기로 인해 환기가 되는 후드에서 수행해야 할 수 있습니다. 이 단계에서 조직의 탈파라핀화는 무독성 투명화제를 사용하는 경우 시간에 민감하지 않습니다. - 슬라이드 랙을 제거하고 교반하여 과도한 청소 시약을 제거합니다. 새로운 내용제성 접시에서 5.2단계를 반복합니다.
- 새로운 내용제성 접시에서 5.3단계를 반복합니다. 슬라이드를 15분 이상 물에 담가 두십시오. 이 단계는 시간에 민감하지 않습니다.
6. 수분 보충
- 슬라이드 랙을 제거하고 교반하여 과도한 청소 시약을 제거합니다. 100% 에탄올로 채워진 새로운 내용제성 접시에 슬라이드 랙을 여러 번 담그거나 밀고 슬라이드를 5분 동안 물에 담근 상태로 둡니다. 이 단계는 시간에 민감합니다. 2회 반복합니다.
- 슬라이드 랙을 제거하고 교반하여 과도한 100% 에탄올을 제거합니다. 95% 에탄올로 채워진 새로운 내용제성 접시에 슬라이드 랙을 여러 번 담그거나 밀고 슬라이드를 5분 동안 물에 담근 상태로 둡니다. 이 단계는 시간에 민감합니다. 1x 반복합니다.
- 슬라이드 랙을 제거하고 교반하여 초과 95% 에탄올을 제거합니다. 70% 에탄올로 채워진 새로운 내용제성 접시에 슬라이드 랙을 여러 번 담그거나 밀고 슬라이드를 5분 동안 물에 담근 상태로 둡니다. 이 단계는 시간에 민감합니다.
- 슬라이드 랙을 제거하고 교반하여 과도한 70% 에탄올을 제거합니다. 50% 에탄올로 채워진 새로운 내용제성 접시에 슬라이드 랙을 여러 번 담그거나 밀고 슬라이드를 5분 동안 물에 담근 상태로 둡니다. 이 단계는 시간에 민감합니다.
- 슬라이드 랙을 제거하고 교반하여 초과 50% 에탄올을 제거합니다. 탈이온수(DI)를 채운 새로운 내용제성 접시에 슬라이드 랙을 여러 번 담그거나 밀고 슬라이드를 5분 동안 물에 담근 상태로 둡니다. 이 단계는 시간에 민감합니다.
- 여기서 일시 중지하려면 5분 물 재수화 단계 후 면역 염색을 재개할 수 있을 때까지 PBS가 있는 용기에 슬라이드를 넣습니다.
7. 항원 검색
- 새 내용제성 접시에 적절한 항원 회수 완충액을 채웁니다. 슬라이드 랙을 이 솔루션으로 직접 옮깁니다. 슬라이드가 항원 회수 용액에 완전히 잠기고 조직을 완전히 덮었는지 확인합니다.
참고: 최적의 항원 회수 용액은 사용하는 특정 항체에 따라 달라질 수 있습니다. 개별 항체에 필요한 항원 검색은 연구자가 결정해야 할 수 있습니다.- 1x 구연산염 항원 회수 완충액을 만들려면 탈이온수 1L당 2.94g의 구연산나트륨 이수화물( 재료 표 참조)을 추가합니다. 구연산나트륨 이수화물이 용해되면 용액이 pH 6에 도달할 때까지 염화수소( 재료 표 참조)를 추가합니다. 마지막으로 탈이온수 500L당 Tween20( 재료 표 참조) 1μL를 추가합니다.
- 1x Tris-EDTA 항원 회수 완충액을 만들려면 탈이온수 1.211L에 0.292g Tris Base와 1g EDTA를 추가합니다. 용해되면 pH 9로 조정하십시오.
- 항원 회수액과 슬라이드가 들어있는 내용제성 접시를 뚜껑으로 덮고 고무 밴드로 뚜껑을 고정합니다.
- 안전한 내용제성 접시를 압력솥( 재료 표 참조)에 넣고 금속 선반이나 삼발이 위에 놓습니다. 압력솥에 금속 선반이나 삼발이에 닿을 수 있는 충분한 물이 있는지 확인하여 압력이 형성될 수 있도록 합니다.
- 압력솥에 뚜껑을 놓고 시계 방향으로 돌려 뚜껑을 제자리에 잠급니다. 뚜껑에 있는 압력 제한 밸브를 압력 설정으로 비틀십시오.
- 메뉴 설정에서 압력솥의 고압을 선택한 다음 시간 설정에서 압력솥을 30분으로 설정합니다. 시작을 선택합니다.
- 30분이 지나면 압력솥에서 신호음이 울리고 자동으로 보온 설정으로 설정됩니다. 압력이 자연스럽게 풀리고 뚜껑이 자유롭게 풀릴 때까지 기다리십시오.
- 내열 장갑( 재료 표 참조)을 사용하여 압력솥에서 내용제성 접시를 제거하고 고무 밴드와 뚜껑을 제거하십시오. 슬라이드를 실온으로 식힐 수 있도록 접시를 얼음 욕조에 ~30분 동안 넣습니다. 이 단계는 시간에 민감하지 않습니다.
- 실온으로 냉각되면 내용제성 접시에서 슬라이드 랙을 제거하고 DI 물로 채워진 새 내용제성 접시에 넣어 잔류 항원 회수 용액을 제거합니다. 슬라이드가 완전히 잠겼는지 확인하십시오.
- DI 물에서 슬라이드 랙을 제거하고 PBS로 채워진 새 내용제성 접시에 5분 동안 넣습니다. 슬라이드가 완전히 잠겼는지 확인하십시오. 이 단계는 시간에 민감하지 않습니다.
8. 비특이적 배경 염색 차단
- 큰 슬라이드 박스를 취하고 뚜껑에 붙어있는 판지 덮개를 제거하여 가습 챔버를 준비합니다. 슬라이드 박스 바닥에 젖은 종이 타월을 수직으로 놓습니다. 젖은 종이 타월이 평평하게 놓여 있는지 확인하십시오.
- PBS에 잠긴 슬라이드 랙에서 슬라이드를 한 번에 하나씩 제거합니다. 티슈를 피하고 유리 슬라이드의 과도한 PBS를 조심스럽게 닦아냅니다.
- 소수성 펜( 재료 표 참조)을 사용하여 소수성 펜으로 조직 주위에 상자를 그려 조직을 둘러싸는 장벽을 형성합니다. 티슈를 피하고 소수성 펜을 티슈에 너무 가까이 사용하지 않도록 주의하십시오.
- 윤곽선이 표시된 슬라이드를 젖은 종이 타월 위에 수평으로 놓습니다. 조직을 덮기 위해 차단 완충액을 추가합니다(~100μL).
- 차단 완충액을 만들려면 100mL의 PBS에 냉수 어피 젤라틴(Teleostein Gelatin, 재료 표 참조)을 추가합니다. 마지막으로 50μL의 20% Triton X-100( 재료 표 참조)을 넣고 녹을 때까지 섞습니다.
- 각 슬라이드에 대해 8.2-8.4단계를 반복합니다. 가습 챔버를 닫고 실온에서 90분 동안 슬라이드를 배양합니다.
9. 마우스 온 마우스 차단
- 마우스 조직에 대한 면역염색을 위해 1차 마우스 항체를 사용하는 경우 추가 차단 단계를 수행합니다. Mouse-on-mouse 차단 시약(mouse-on-mouse block, 재료 표 참조)은 상업적으로 이용 가능합니다. mouse-on-mouse 블록을 준비할 때 상용 지침을 따르십시오.
- 차단 용액을 부드럽게 두드리고 준비된 mouse-on-mouse 블록을 즉시 추가하여 조직(~100μL)을 덮습니다. 마우스에서 제기된 1차 항체를 사용하여 염색할 마우스 조직이 포함된 각 슬라이드에 대해 반복합니다.
- 가습된 챔버 상자에서 조직 절편을 실온에서 15분 동안 배양합니다.
- 가습 챔버에서 슬라이드를 제거하고 PBS에 잠긴 슬라이드 랙에 직접 넣습니다. 슬라이드를 PBS에 5분 동안 그대로 두어 mouse-on-mouse 블록을 씻어냅니다.
10. 1차 항체
- 각 슬라이드에 대해 서로 다른 종에서 발생하는 관심 있는 1차 항체를 선택합니다. 제조업체의 지침에 따라 1차 항체를 항체 희석제에 희석합니다. E-CADHERIN (1:100), MUC2 (1:200), PCNA (1:500), LAMININ (1:200), β-CATENIN (1:200), LAMP1 (1:50)과 같은 1차 항체가 사용되었습니다.
참고: 제조업체가 권장 희석액을 제공하지 않는 경우 1:100 희석이 좋은 시작점입니다. 관심있는 1 차 항체가 형광단에 접합 된 경우 12.2 단계를 참조하십시오.- 항체를 희석제로 만들기 위해, 위에서 설명한 피쉬 젤라틴 차단 완충액을 사용하는 경우, 차단 완충액 1:20을 PBS에 첨가하십시오.
- PBS 또는 가습 챔버에서 슬라이드를 제거하고 과도한 차단 용액 또는 PBS를 부드럽게 두드린 다음 가습 챔버에 수평으로 다시 놓습니다. 8.3단계에서 소수성 펜으로 만든 장벽이 남아 있는지 확인합니다. 필요한 경우 조직의 윤곽을 다시 그립니다.
- 조직을 덮기 위해 적절하게 희석된 관심 1차 항체를 추가합니다(~100μL).
- 가습 챔버를 닫고 어두운 곳에서 4 °C의 평평한 표면에서 밤새 슬라이드를 배양합니다.
11. 슬라이드 세척
- 가습 챔버에서 슬라이드를 제거하고 1차 항체를 부드럽게 두드린 다음 슬라이드를 PBS에 담근 슬라이드 랙에 5분 동안 넣습니다.
- 슬라이드 랙을 제거하고 PBS로 채워진 새 내용제성 접시에 5분 동안 넣습니다. 1x단계를 반복합니다.
12. 2차 항체 및 핵 대조염색
- 각 슬라이드에 대해 1차 항체 종에 결합하도록 설계된 2차 항체 형광단을 선택합니다. 2차 항체 형광단 또는 접합된 1차 항체를 2차 항체 희석액에 희석합니다. 사용된 2차 항체는 당나귀 항염소 488 (1:200), 당나귀 항-토끼 cy3 (1:200), 당나귀 항-마우스 647 (1:200), 당나귀 항-토끼 647 (1:200) 및 당나귀 항-쥐 cy3 (1:200)였다. 형광단 647에 접합된 1차 항체 γ-ACTIN을 1:100 희석하여 사용했습니다.
- 2차 항체를 희석제로 만들려면 위에서 설명한 대로 생선 젤라틴 차단 완충액을 사용하는 경우 차단 완충액 1:100을 PBS에 추가합니다.
- PBS에서 슬라이드를 제거하고 여분의 PBS를 부드럽게 두드린 다음 가습 챔버에 수평으로 다시 놓습니다. 8.3단계에서 소수성 펜으로 만든 장벽이 남아 있는지 확인합니다. 필요한 경우 조직의 윤곽을 다시 그립니다.
- 조직을 덮기 위해 적절하게 희석된 2차 항체 형광단 또는 접합된 1차 항체를 추가합니다(~100μL).
- 가습 챔버를 닫고 어두운 어두운 곳에서 1시간 동안 실온에서 슬라이드를 배양합니다.
- PBS를 사용하여 10mg/mL Hoechst( 재료 표 참조) 또는 DAPI를 희석하여 PBS를 사용하여 1μg/mL Hoechst 또는 DAPI의 최종 농도를 높이고 조직(~100μL)에 직접 첨가합니다. 어두운 곳에서 실온에서 5분 동안 배양합니다.
- 가습 챔버에서 슬라이드를 제거하고 어둠 속에서 5분 동안 PBS에 잠긴 슬라이드 랙에 넣습니다.
- 슬라이드 랙을 제거하고 PBS로 채워진 새 내용제성 접시에 어두운 곳에서 5분 동안 넣습니다. 1x단계를 반복합니다.
13. 현미경 검사를 위한 장착 및 준비
- PBS에 잠긴 슬라이드 랙에서 한 번에 하나의 슬라이드를 제거하고 나머지 슬라이드는 어두운 곳에서 PBS에 잠기게 합니다. 여분의 PBS를 부드럽게 두드리고 필요한 경우 보풀이 없는 물티슈를 사용하여 티슈를 피하고 유리 슬라이드의 과도한 PBS를 조심스럽게 닦아냅니다.
- 페이드 방지 장착 매체( 재료 표 참조)를 조직 중앙에 한 두 방울 떨어뜨립니다.
- 깨끗한 커버슬립( 재료 표 참조)의 가장자리를 잡고 45° 각도로 슬라이드 위로 천천히 내립니다. 장착 매체가 조직 전체에 고르게 펴 졌는지 확인하십시오.
- 티슈 중앙에서 시작하여 두 손가락으로 커버슬립을 부드럽게 눌러 기포와 과도한 장착 매체를 제거합니다. 필요한 경우 가장자리를 향해 계속 누르고 전체적으로 부드러운 압력을 유지하십시오.
- 여과되지 않은 P200 피펫의 작은 끝을 잘라내고 진공에 연결된 혈청학적 피펫의 팁에 부착합니다.
- 커버슬립의 가장자리를 따라 진공 청소기를 사용하여 과도한 장착 매체를 제거합니다.
- 새 슬라이드 박스에 슬라이드를 수평으로 평평하게 놓고 슬라이드를 실온의 어두운 곳에서 건조시킵니다.
- 각 슬라이드에 대해 이 과정을 반복합니다.
결과
헤마톡실린 및 에오신(H&E) 염색을 앞서 설명한 바와 같이 수행하였다12. 최적화된 방법을 사용하여 장 스위스 롤은 소장과 대장의 세 부분을 모두 단일 슬라이드에 포함했습니다. 전체 장을 슬라이드에 수용하면 연구원은 장의 모든 부분의 변화를 분석할 수 있으며 시약을 절편하고 염색하는 데 드는 비용을 절약할 수 있습니다(그림 1). 또한 면역염색 시 모든 장 분절을 동일한 용액에 동시에 노출시키면 정확한 결과를 보장하는 데 도움이 됩니다. H&E 현미경 사진은 소장과 대장의 모든 부분의 보존된 장 구조를 보여줍니다(그림 2). 십이지장 융모를 측정한 결과, 이 스위스 롤 방법에 비해 미개봉 장 조직의 융모 높이에 큰 차이가 없었으며, 이는 장을 열어도 조직 구조를 방해하지 않는다는 것을 시사합니다(그림 2D). 장 스위스 롤의 면역염색은 장의 다양한 층과 전체 융모 크립트 축을 보여줍니다. 형광 이미지는 1차 및 2차 항체 염색에서 낮은 배경 수준을 보여주며 상피에 존재하는 개별 세포를 명확하게 묘사합니다. 그림 3 은 잔 세포(MUC2 양성 세포)13, 정점막(γ-ACTIN)14, 상피 세포(E-CADHERIN)15의 외측막15 및 핵에 대한 다양한 장 분절 및 염색의 형태를 보여줍니다. 이 프로토콜은 증식 세포(proliferative cells, PCNA)16, 간질(interstitium, LAMININ; 그림 4A) 17, 리소좀 도메인(LAMP1)14 및 상피(β-CATENIN; 그림 4B) 18.

그림 1: 장내 스위스 롤의 준비 및 가공을 위한 워크플로우. (A) 장 분절은 PBS가 함유된 주사기로 세척한 다음 PBS에서 세척합니다. (B) 그런 다음 젖은 장 조직을 건조한 여과지에 놓습니다. (C) 장을 여과지에서 세로로 자르고 (D) 부드럽게 펼칩니다. (E) 열린 장 위에 여과지 조각을 놓고 장을 여과지 사이에 부드럽게 끼우고 스테이플러로 고정합니다. 장 분절은 하룻밤 동안 고정하고 (F)는 집게를 사용하여 굴립니다. (G) 장은 역작용 겸자에서 부드럽게 제거되고 (H)는 장미 모양입니다. (나, J) 장 조직을 핀으로 고정하여 큰 카세트에 넣습니다. (K) 4개의 장 분절은 모두 조직 처리 및 매립을 위해 동일한 카세트에 배치됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
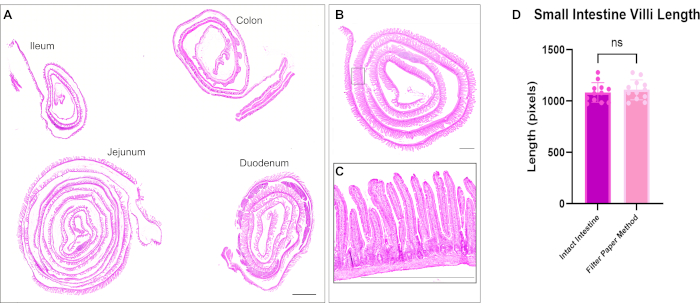
그림 2: 장의 4개 분절 모두의 헤마톡실린(Hematoxylin) 및 에오신 염색. (A) 타일 스캐닝은 십이지장, 제주눔, 회장 및 결장의 개별 스위스 롤을 사용하여 단일 슬라이드에서 전체 장을 시각화할 수 있는 능력을 보여줍니다. (B) 장내 스위스 롤의 현미경 사진 및 (C) 융모 및 크립트 구조를 보여주기 위한 더 높은 배율 삽입물. (D) 소장 융모 길이의 정량화는 스위스 압연 조직과 미개봉 조직 간에 유의한 차이가 없음을 보여줍니다. 스케일 바 = 1000 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 장의 4개 분절 모두의 면역형광 염색. 성체 C57BL/6J 대조군 마우스는 핵(청록색), 외측막 마커인 E-CADHERIN(녹색), MUC2(노란색)로 식별되는 잔 세포 및 정점 브러시 테두리 마커인 γ-ACTIN(자홍색)에 대해 면역염색되었습니다. 스케일 바 = 50 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
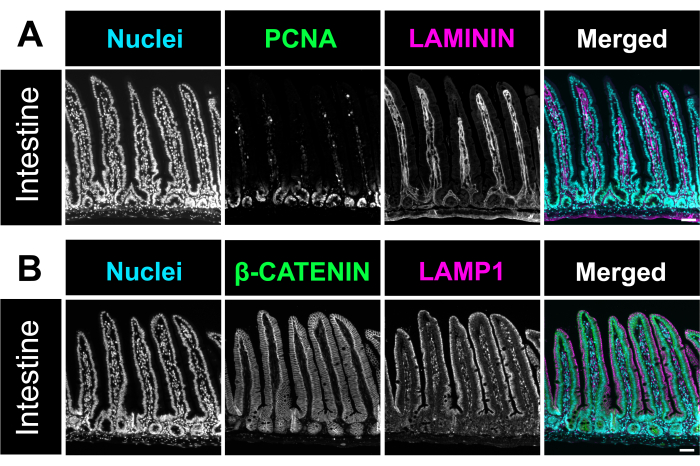
그림 4. 장의 면역 형광 염색. (A) 생쥐 장의 면역형광 염색을 보여주는 대표적인 현미경 사진은 핵(청록색), 증식 세포, PCNA(녹색) 및 lamina propria, LAMININ(자홍색)을 강조합니다. (B) 장에서 핵(청록색), 세포막 마커 β-CATENIN(녹색) 및 리소좀 마커 LAMP1(자홍색)을 식별하는 면역형광 이미지. 스케일 바 = 50 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
여기에서는 장 구조를 보존하고 정확한 면역염색을 촉진하기 위해 스위스 롤 기법을 사용하여 조직 고정에 최적화된 방법을 제시합니다. 일단 숙달되면, 이 기술은 장 생리학 및 세포 생물학과 관련된 다양한 연구 질문을 조사하는 데 사용할 수 있다19. 몇 가지 최적화된 스위스 압연 방법이 발표되었으며 매우 유용합니다20,21. 이 기술의 장점은 여과지에서 장을 정확하게 쉽게 열 수 있다는 것입니다. 이를 통해 조직을 평평하게 고정할 수 있어 롤링할 때 조직이 안쪽으로 말리는 것을 방지할 수 있으며, 이는 근육이 두꺼워진 염증 조직을 분석할 때 특히 유용합니다. 또한 신뢰할 수 있는 결과를 얻기 위해 조직 절편의 중요한 역할을 강조하는 것이 중요합니다. 적절한 절편은 조직 구조의 보존을 보장하고 정확한 면역염색을 용이하게 하여 궁극적으로 다운스트림 분석의 성공에 기여합니다11. 최적화된 접근 방식은 다른 프로토콜에 비해 난이도가 낮아 개인마다 일관된 결과를 얻을 수 있습니다. 이 논문에서 제시된 기술은 또한 다양한 항체를 사용하여 잘 보존된 조직 구조, 다양성 및 재현성이 높은 면역염색을 제공합니다.
이 프로토콜의 중요한 측면은 고정 및 처리 시간입니다. 부적절한 조직 고정 및 처리는 조직화학적 분석을 손상시킬 수 있습니다. 과도하게 고정된 조직은 부서지기 쉬워지고 덜 고정된 조직은 너무 부드러워집니다. 과도하게 고정된 조직과 과소 고정된 조직 모두 절단하기 어렵고 면역염색을 손상시킵니다. 여과지에 해부한 후에는 사후 변형을 줄이기 위해 즉시 포르말린에 조직을 넣어야 한다22. 이 프로토콜에서 쥐 조직은 하룻밤 동안 포르말린으로 고정됩니다. 여러 연구에서 이 고정 시간20,23,24를 사용했습니다. 그러나, Boenisch et al.은 포르말린에 고정된 조직에서 최대 4일 동안 면역염색이 일관됨을 보여주었다25. 원하는 해석에 따라 고정 시간 및 정착제의 최적화가 필요합니다. 예를 들어, Carnoy's fixative는 종종 점액 염색에 선호됩니다26. 정착제의 선택과 정착 시간은 실험적 접근 방식에 따라 각 연구자가 최적화해야 합니다. 정확하고 일관된 처리 시간을 보장하기 위해 자동 조직 처리기를 사용하는 것이 좋습니다. 우리 실험실은 장 조직을 롤처럼 제자리에 고정하기 위해 작은 핀을 사용합니다. 핀이 없으면 가공 중에 티슈가 풀릴 수 있습니다. 이 핀은 매우 작고 날카롭기 때문에 예방 조치를 취해야 합니다. 조직 가공 전에 와이어 커터를 사용하여 핀의 날카로운 끝을 제거하는 것이 좋습니다. 일부 조직학 코어는 핀이 있는 조직을 허용하지 않습니다. 따라서 사용하기 전에 확인하는 것이 가장 좋습니다. 또 다른 접근법은27을 처리하기 전에 한천을 사용하여 조직을 고정하는 것이며, 카세트 스폰지를 카세트에 사용하여 롤을 유지하는 데 도움이 될 수 있습니다.
면역염색은 각 항체에 대한 최적화가 필요한 프로토콜입니다. 가능하면 knockout-validated 항체를 사용하는 것이 좋습니다. 조직 고정 및 처리를 위한 이 방법은 명확한 염색을 생성하여 검증되지 않은 항체를 사용할 때 배경 신호와 비교하여 항체 결합을 쉽게 식별할 수 있습니다. 정착제 선택, 항원 회수 및 항체 희석은 항체의 특이성에 영향을 미칠 수 있습니다. 연구자들은 각 항체에 대한 고정, 항원 회수 및 배양 시간을 조정하여 프로토콜을 신중하게 평가하고 최적화할 것을 권장합니다. 최상의 결과를 얻기 위해, 최적의 농도를 결정하기 위해 다양한 희석액에서 항체를 테스트하고 다양한 항원 회수 완충액에서 항체를 테스트해야 합니다. Epitope retrieval은 고정 중에 형성된 methylene bridge를 파괴하여 면역염색을 개선합니다. 이 프로토콜에서는 단백질 분해 유도 에피토프 회수 대신 열 유도 에피토프 회수가 사용되는데, 이는 효소 분해가 조직 형태를 방해할 가능성이 더 높기 때문이다28. 가장 흔한 열 유도 에피토프 회수 완충액은 구연산염 완충액, tris-HCl 및 tris-EDTA이며, 구연산염 완충액은 조직 형태에 가장 부드럽습니다29. 완충액 선택은 다양하며 각 항체에 대해 결정해야 합니다. 많은 항원 회수 완충액, 차단 용액 및 항체 희석제가 상업적으로 이용 가능합니다. 그러나 이러한 솔루션은 매우 비싸고 비용이 많이 들 수 있습니다. 비용 효율성을 보장하기 위해 일반적인 항원 회수 용액과 차단 및 항체 희석제 용액의 레시피를 제공했습니다.
이 방법의 한계는 고정 및 처리가 조직을 변화시키고 에피토프를 가릴 수 있다는 것입니다. 또 다른 방법은 신선 냉동 조직을 면역염색하는 것입니다. 신선 냉동 조직은 스냅 냉동되어 독성 고정제에 대한 노출을 피하고 단백질 구조를 보존하며 일부 에피토프의 접근성을 향상시킵니다. 그러나 조직 구조와 형태는 고정 및 파라핀 포매 조직보다 열악합니다. 신선 냉동 조직의 또 다른 과제에는 냉동 블록과 슬라이드를 절단하고 보관하는 데 필요한 재료와 물류가 포함됩니다. 스위스 롤과 장 조직 스트립의 분석은 이전 보고서에서 설명한 바와 같이 융모의 높이와 너비의 차이와 lamina propria의 면역 세포의 차이를 보여줍니다30. 이러한 결과는 장내 스위스 롤이 일부 장 기능을 변화시킨다는 것을 시사하며, 이는 실험을 계획할 때 고려해야 합니다. 또한, 포르말린 고정 파라핀 포매 조직에 특이적으로 결합하는 많은 항체가 신선 냉동 조직에서 잘 염색되지 않기 때문에 항체 재검증이 필요하다31.
장 조직의 면역염색은 위장 세포 생물학 및 생리학에 관한 다양한 질문에 답하는 데 사용할 수 있습니다. 이 기법은 장 염증 환경, 세균 감염 후 및 암 진행 중 상피 변화를 식별하는 데 널리 사용됩니다. 여기에 제시된 방법은 비용 효율적이고 기술적으로 까다롭지 않으며 재현성이 높기 때문에 장 조직 보존에 이상적입니다. 최상의 결과를 보장하기 위해 실험 설계와 테스트 중인 가설을 기반으로 이 프로토콜에 설명된 단계를 최적화하는 것이 좋습니다.
공개
저자는 밝힐 것이 없습니다.
감사의 말
이 연구는 미국 국립보건원(NIH)의 ACE에 대한 K01 보조금 DK121869의 지원을 받았으며, 이 출판물은 T32 GM132055(RME), F31 DK139736(SAD), T32 DK124191(SAD), TL1 TR001451(RS), UL1 TR001450(RS) 및 SAD & RS에 대한 HCS 코너스톤 보조금의 지원을 받았습니다. 이 연구는 사우스캐롤라이나 의과대학(Medical University of South Carolina, MUSC)에서 ACE에 이르는 스타트업 자금의 지원을 받았으며, MUSC 소화기 질환 연구 핵심 센터(Digestive Disease Research Core Center, P30 DK123704)와 소화기 및 간 질환 분야의 COBRE(P20 GM120475)의 지원을 받았습니다. 이미징은 MUSC의 세포 및 분자 이미징 코어를 사용하여 수행되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| β-CATENIN | GeneTex | GTX101435 | |
| Cellulose filter paper | Cytiva | 10427804 | Thick Whatman paper |
| Charged glass slides | Thermo Fisher Scientific | 23888114 | |
| Coverslip | Epredia | 152440 | |
| Dissecting pins size 00 | Phusis | B082DH4TZF | |
| E-CADHERIN | R&D Systems | AF748 | |
| Freezer gloves | Tempshield | UX-09113-02 | |
| Heating block | Premiere | XH-2001 | Slide Warmer |
| Histo-Clear II | Electron Microscopy Sciences | 64111-04 | Clearing reagent |
| Hoescht | Thermo Fisher Scientific | 62249 | |
| Hydrochloric Acid | Sigma Aldrich | 320331 | |
| Hydrophobic pen | Millipore | 402176 | |
| LAMININ | GeneTex | GTX27463 | |
| LAMP1 | Santa Cruz | SC-19992 | |
| Large cassettes | Tissue-Tek | 4173 | |
| Minutien pins | Fine Science Tools | NC9679721 | |
| Mouse-on-mouse blocking reagent | Vector Laboratories | MKB-2213 | Mouse-on-mouse block |
| MUC2 | GeneTex | GTX100664 | |
| PCNA | Cell Signaling Technology | 2586S | |
| Pressure Cooker | Cuisinart | B000MPA044 | |
| ProLong gold antifade | Thermo Fisher Scientific | P36934 | Mounting medium |
| Reverse action forceps | Dumont | 5748 | |
| Slide Rack | Tissue-Tek | 62543-06 | |
| Slide Staining Set | Tissue-Tek | 62540-01 | Solvent Resistant Dishes and Metal Frame |
| Small cassettes | Fisherbrand | 15-200-403B | |
| Sodium citrate dihydrate | Fisher Bioreagents | BP327-1 | |
| Teleostein Gelatin | Sigma | G7765 | Blocking buffer |
| Triton X-100 | Thermo Fisher Scientific | A16046 | |
| Tween 20 | Thermo Fisher Scientific | J20605-AP | |
| Wipes | KimTech | 34155 | |
| Xylenes | Fisher Chemical | 1330-20-7 | |
| γ-ACTIN | Santa Cruz | SC-65638 |
참고문헌
- Louvard, D., Kedinger, M., Hauri, H. P. The differentiating intestinal epithelial cell: Establishment and maintenance of functions through interactions between cellular structures. Annu Rev Cell Biol. 8, 157-195 (1992).
- Rieger, J., Pelckmann, L. M., Drewes, B. Animal models of allergic disease: Methods and protocols. , Springer US. New York, NY. (2021).
- Webster, J. D., Miller, M. A., Dusold, D., Ramos-Vara, J. Effects of prolonged formalin fixation on the immunohistochemical detection of infectious agents in formalin-fixed, paraffin-embedded tissues. Vet Pathol. 47 (3), 529-535 (2010).
- Hayashi, Y., Koike, M., Matsutani, M., Hoshino, T. Effects of fixation time and enzymatic digestion on immunohistochemical demonstration of bromodeoxyuridine in formalin-fixed, paraffin-embedded tissue. J Histochem Cytochemis. 36 (5), 511-514 (1988).
- Werner, M., Chott, A., Fabiano, A., Battifora, H. Effect of formalin tissue fixation and processing on immunohistochemistry. Am J Surg Pathol. 24 (7), 1016-1019 (2000).
- Scalia, C. R., et al. Antigen masking during fixation and embedding, dissected. J Histochem Cytochem. 65 (1), 5-20 (2017).
- Masood, S., Von Wasielewski, R., Mengel, M., Nolte, M., Werner, M. Influence of fixation, antibody clones, and signal amplification on steroid receptor analysis. Breast J. 4 (1), 33-40 (1998).
- Moolenbeek, C., Ruitenberg, E. J. The "swiss roll": A simple technique for histological studies of the rodent intestine. Lab Anim. 15 (1), 57-59 (1981).
- Casteleyn, C., Rekecki, A., Van Der Aa, A., Simoens, P., Van Den Broeck, W. Surface area assessment of the murine intestinal tract as a prerequisite for oral dose translation from mouse to man. Lab Animals. 44 (3), 176-183 (2010).
- Lunnemann, H. M., et al. Cecum axis (cecax) preservation reveals physiological and pathological gradients in mouse gastrointestinal epithelium. Gut Microbes. 15 (1), 2185029(2023).
- Qin, C., et al. The cutting and floating method for paraffin-embedded tissue for sectioning. J Vis Exp. (139), e58288(2018).
- Feldman, A. T., Wolfe, D. Histopathology: Methods and protocols. , Springer New York. New York, NY. (2014).
- Yang, W. H., et al. Innate mechanism of mucosal barrier erosion in the pathogenesis of acquired colitis. iScience. 26 (10), 107883(2023).
- Dooley, S. A., et al. Myosin 5b is required for proper localization of the intermicrovillar adhesion complex in the intestinal brush border. Am J Physiol Gastrointest Liver Physiol. 323 (5), G501-G510 (2022).
- Danan, C. H., et al. Intestinal transit amplifying cells require mettl3 for growth factor signaling, kras expression, and cell survival. bioRxiv. , 10.1101/2023.04.06.535853 (2023).
- Han, B., Qi, S., Hu, B., Luo, H., Wu, J. Tgf-beta i promotes islet beta-cell function and regeneration. J Immunol. 186 (10), 5833-5844 (2011).
- Chen, L. C., Wang, H. W., Huang, C. C. Modulation of inherent niches in 3d multicellular msc spheroids reconfigures metabolism and enhances therapeutic potential. Cells. 10 (10), 2747(2021).
- Fang, Y., et al. Cd36 inhibits beta-catenin/c-myc-mediated glycolysis through ubiquitination of gpc4 to repress colorectal tumorigenesis. Nat Commun. 10 (1), 3981(2019).
- Whittem, C. G., Williams, A. D., Williams, C. S. Murine colitis modeling using dextran sulfate sodium (dss). J Vis Exp. (35), e1652(2010).
- Bialkowska, A. B., Ghaleb, A. M., Nandan, M. O., Yang, V. W. Improved swiss-rolling technique for intestinal tissue preparation for immunohistochemical and immunofluorescent analyses. J Vis Exp. (113), e54161(2016).
- Le Naour, J., et al. Improved swiss-rolling method for histological analyses of colon tissue. MethodsX. 9, 101630(2022).
- Cardiff, R. D., Miller, C. H., Munn, R. J. Mouse tissue fixation. Cold Spring Harb Protoc. 2014 (5), 073403(2014).
- Pereira E Silva, A., Lourenço, A. L., Marmello, B. O., Bitteti, M., Teixeira, G. aP. B. Comparison of two techniques for a comprehensive gut histopathological analysis: Swiss roll versus intestine strips. Exp Mol Pathol. 111, 104302(2019).
- Williams, J. M., Duckworth, C. A., Vowell, K., Burkitt, M. D., Pritchard, D. M. Intestinal preparation techniques for histological analysis in the mouse. Curr Prot Mouse Biol. 6 (2), 148-168 (2016).
- Boenisch, T. Effect of heat-induced antigen retrieval following inconsistent formalin fixation. Appl Immunohistochem Mol Morphol. 13 (3), 283-286 (2005).
- Hasegawa, Y., Mark Welch, J. L., Rossetti, B. J., Borisy, G. G. Preservation of three-dimensional spatial structure in the gut microbiome. PLoS One. 12 (11), e0188257(2017).
- Garabedian, E. M., Roberts, L. J., Mcnevin, M. S., Gordon, J. I. Examining the role of paneth cells in the small intestine by lineage ablation in transgenic mice. J Biol Chem. 272 (38), 23729-23740 (1997).
- Moshi, J. M., Ummelen, M., Broers, J. L. V., Ramaekers, F. C. S., Hopman, A. H. N. Impact of antigen retrieval protocols on the immunohistochemical detection of epigenetic DNA modifications. Histochem Cell Biol. 159 (6), 513-526 (2023).
- Krenacs, L., Krenacs, T., Stelkovics, E., Raffeld, M. Heat-induced antigen retrieval for immunohistochemical reactions in routinely processed paraffin sections. Methods Mol Biol. 588, 103-119 (2010).
- Pereira, E. S. A., Lourenco, A. L., Marmello, B. O., Bitteti, M., Teixeira, G. Comparison of two techniques for a comprehensive gut histopathological analysis: Swiss roll versus intestine strips. Exp Mol Pathol. 111, 104302(2019).
- Bolognesi, M. aO., et al. Antibodies validated for routinely processed tissues stain frozen sections unpredictably. Bio Techniques. 3 (3), 137-148 (2021).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유