Method Article
腸内スイスロールおよびパラフィン包埋組織の免疫蛍光染色に最適化されたプロトコール
要約
腸は消化と吸収に不可欠です。各領域(十二指腸、空腸、回腸、結腸)は、独自の細胞構造により、異なる機能を果たします。腸の生理学を研究するには、綿密な組織分析が必要です。このプロトコールでは、スイスロール法を用いた組織の固定と処理の概要を説明し、適切な組織の保存と配向を通じて正確な免疫染色を保証します。
要約
腸は、小腸と大腸からなる複雑な器官です。小腸はさらに十二指腸、空腸、回腸に分けることができます。腸の各解剖学的領域には、細胞構造の違いによって反映される独自の機能があります。腸の変化を調べるには、さまざまな組織領域と細胞の変化を詳細に分析する必要があります。腸を研究し、大きな組織片を視覚化するために、研究者は通常、腸内スイスロールと呼ばれる技術を使用します。この技術では、腸は各解剖学的領域に分割され、平らな向きに固定されます。次に、組織を慎重に巻き、パラフィン包埋のために処理します。適切な組織の固定と配向は、見落とされがちな実験室技術ですが、下流の分析にとって非常に重要です。さらに、腸組織の不適切なスイスローリングは、壊れやすい腸上皮を損傷し、免疫染色のための組織品質の低下につながる可能性があります。無傷の細胞構造でしっかりと固定され、適切に配向された組織を確保することは、腸細胞の最適な視覚化を確実にするための重要なステップです。私たちは、腸のすべてのセクションを単一のパラフィン包埋ブロックに含めるスイスロールを作成するための費用対効果の高い簡単な方法を紹介します。また、腸上皮のさまざまな側面を研究するための腸組織の最適化された免疫蛍光染色についても説明します。以下のプロトコルは、腸管組織固定、スイスロール法、免疫染色を通じて高品質の免疫蛍光画像を取得するための包括的なガイドを研究者に提供します。これらの洗練されたアプローチを採用することで、腸上皮の複雑な形態が維持され、腸の生理学と病理生物学のより深い理解が促進されます。
概要
腸の細胞構造は、腸組織が免疫染色のために保存される際に、その構造的完全性を維持する上で独自の課題を提起します。小腸は、絨毛1として知られる細長い指のような構造で構成されています。これらの絨毛は、埋め込みプロセス中に奇形になることがよくあります。研究者が腸を適切に埋め込んで断面を達成し、腸のすべての領域と腸を構成する層(つまり、固有筋、粘膜、漿膜)を視覚化できるようにする技術を持っていることを確認することは、堅牢な実験的分析2にとって重要です。不適切な固定、過度の固定、および不適切な組織の取り扱いは、組織の完全性を損ない、腸上皮に不注意な損傷をもたらします3,4。これらのステップで腸上皮を損傷すると、免疫組織化学プロトコルや使用される抗体の有効性に関係なく、免疫蛍光法などのその後の分析の品質が大幅に低下する可能性があります。
免疫染色は、適切な組織固定と同様に、生物医学研究の重要な部分です。免疫染色がうまくいけば、細胞の構造と機能のこれまで知られていなかった側面を明らかにすることができます。パラフィン切片の免疫蛍光染色は、固定およびパラフィン包埋プロセス5から生じる物理化学的修飾により、困難な場合があります。固定およびパラフィンの埋め込みにより、目的のエピトープの免疫蛍光検出を妨げる可能性のある抗原マスキングが生じます6。固定の遅延はタンパク質分解を誘発する可能性があり、その結果、重要なエピトープの染色が弱まるか、または存在しないことになります7。さらに、抗体はバックグラウンドが高レベルであると不正確になることがよくあります。一貫性のある特異的な抗体結合と高いS/N比を促進する免疫染色プロトコルは、研究者にとって貴重な情報を提供することができます。
ここでは、腸管組織固定、スイスロール調製8、および免疫染色を通じて高品質の免疫蛍光画像を取得するように設計された包括的なプロトコールを提供します。腸の完全性を維持するためのガイドラインを強調し、このプロトコルは、免疫蛍光イメージング研究の品質と信頼性を向上させるための堅牢な方法論を研究者に提供することを目的としています。また、フィルターペーパーや自家製抗原賦活化、ブロッキング溶液、抗体希釈剤など、費用対効果の高いリソースを使用して、資金が限られている可能性のあるラボでもプロトコルにアクセスしやすくすることを目指してきました。すべての実験プロトコルについて、研究者は実験アプローチと関心のある領域に基づいて現在のプロトコルを最適化する必要があります。
プロトコル
サウスカロライナ医科大学の動物管理・使用委員会は、すべての動物の世話、維持、治療を承認しました。本研究では、C57BL/6Jの成体マウス(生後3〜5ヶ月の雄と雌、体重約30g)から腸管組織を採取しました。
1. 腸管組織固定
- 安楽死させたマウスから腸全体を慎重に解剖し、リン酸緩衝生理食塩水(PBS)を含む計量ボートまたはペトリ皿に入れます。
- PBSから腸を取り出し、ハサミを使って余分な脂肪と結合組織をやさしく取り除きます。結合組織を切断すると、その後のステップで組織が平らになります。
- はさみを使用して腸を個々のセグメントに分割します(つまり、十二指腸、空腸、回腸、盲腸、および結腸)。解剖学的特徴および/または長さに基づいてセグメントを分割し、腸の長さの約13%が十二指腸、58%が空腸、8%が回腸、6%が盲腸、結腸が15%9です。十二指腸は胃に続き、回腸は盲腸の直前の小腸の終末部分です。
- はさみを使用して盲腸を結合する場所を切断することにより、結腸を解放します。十二指腸、空腸、回腸、および結腸をPBSの計量ボートまたはペトリ皿に入れます。盲腸を捨てるか、他の公開された方法に従って固定します10。
- P200ピペットチップを10mLシリンジに取り付け、カミソリの刃でチップの大きい方の端を切り落とします。シリンジにPBSを入れます。
- 鉗子を使用して、シリンジの先端を腸の部分の開口部に挿入します。鉗子を使用して腸の一部をシリンジに保持し、~50 μL/s の速度で穏やかに洗い流して腸の内容物を取り除きます。腸の内容物を空の計量ボートまたはシャーレに集めます。
- 濡れた腸の部分を、乾燥ラベルのセルロースフィルターペーパーのストリップに直線的に置きます( 材料の表を参照)。腸の部分が乾いた濾紙に適切に付着するのに十分なほど濡れていることを確認してください。濾紙にマウス番号、遺伝子型、実験群などの情報を鉛筆でラベル付けします。
注意: ペンを使用して濾紙にラベルを付けると、固定中にラベルが失われる可能性があります。 - 解剖ハサミを使用して、腸間膜線に沿って縦方向に腸を切り開きます。ハサミの下端または一対の鉗子を使用して、切断した組織を濾紙の上に平らに置き、一度に~5mmをカットします。腸の全部分が切断され、濾紙の上に平らに置かれるまで続けます。腸内をできるだけまっすぐに切り開くと、組織が転がりやすくなりますので注意が必要です。
注:このステップでは、組織の損傷を避けるためにボールチップはさみを使用できます。 - 腸のセグメントの上に別の濾紙を置きます。濾紙が腸の部分を挟むことを確認し、固定中に腸がカールしたり、平らな形を失ったりしないようにします。
- 濾紙の端をホチキス止めして、ティッシュを所定の位置に固定します。ティッシュをホチキス止めしないでください。固定中にティッシュが濾紙から剥がれないように、ティッシュの周囲に十分なステープルを配置します。
- 腸のセグメント(十二指腸、空腸、回腸、および結腸)ごとに手順1.5〜1.10を繰り返します。
- 組織を10%正常緩衝ホルマリン(または4%パラホルムアルデヒド、カルノイ固定剤などの任意の固定剤)に4°Cで一晩浸します。
注意: ホルマリンなどの固定剤は有毒であるため、正しい個人用保護具を着用していることを確認してください。
2.腸組織のローリングと処理
注意: 換気されたフードで手順2.1〜2.6を実行します。
- 濾紙の上部(腸の管腔側に触れているもの)をそっと取り除きます。鉗子を使用して、濾紙の底から腸を慎重に剥がします。濾紙を捨てます。
- 3つの計量ボートにPBSを充填します。ティッシュをPBS 3xで洗浄し、ティッシュからホルマリンを除去します。
- 逆作用鉗子( 材料の表を参照)を使用して、管腔側を上にして、短辺に沿って腸の一部を拾います。鉗子を回して組織を転がします。通常の鉗子を使用して、組織が転がされるときに組織をガイドします。ティッシュが折りたたまれている場合は、広げてもう一度試してください。
- ティッシュを乾いた計量ボートまたはペトリ皿に入れます。片手で鉗子で組織を所定の位置に保持します。逆作用鉗子を慎重に開き、組織を解放し、他の鉗子を使用して組織を逆作用鉗子から取り除きます。
- サイズ00の解剖ピンまたは微細ピンを組織に挿入します( 材料の表を参照)。ワイヤーカッターを使用して、ピンの鋭い先端を取り外します。ティッシュを大きなカセットに入れ、処理の準備が整うまでカセットを70%エタノールの容器に入れます。
- すべての腸セグメント(十二指腸、空腸、回腸、および結腸)で手順2.1〜2.5を繰り返し、4つの組織ロールすべてを同じ大きなカセットに入れます( 材料の表を参照)。カセットに鉛筆でラベルが貼付されていることを確認し、ラベルがエタノールとキシレンの溶液で洗い流されないようにします( 材料の表を参照)。
- すべてのサンプルを圧延したら、サンプルをティッシュプロセッサーに入れます。腸組織には次の設定を使用します:70%エタノールを35分間。90%エタノールを35分間;95%エタノールを35分間;100%エタノールを35分間、3回。キシレンを35分間、3x;パラフィン60分、3回。カセットは、溶かしたパラフィンワックスに長時間放置できます。
注意: キシレンは有毒な化学物質であるため、適切な保護具が着用されていることを確認してください。
3. 腸組織の埋め込み
- 大きな包埋型を予熱して、パラフィンを溶かし続けます。
- ティッシュプロセッサーからカセットを取り出し、溶かしたパラフィンのビーカーに入れます。
- 埋め込みステーションで、少量のパラフィンを型に入れます。4つのスイスロールをカセットから取り出し、できるだけ平らに置いて1つの型に入れます。型を埋めるためにパラフィンを追加します。
- 金型をコールドプレートに移動し、すべてのスイスロールが金型の底に平らになっていることを確認します。ラベルの付いた小さなカセットトップ( 材料の表を参照)を型に置き、必要に応じてパラフィンを追加します。
- ワックスが固まったら、ブロックを型から取り出します。これで、組織を5μmのスライスに切断し、免疫染色11のために荷電したスライドガラスに浮かべる準備が整いました。
4. 組織接着とスライド調製
- 調製した5μmのパラフィン組織切片がスライドに付着するように、スライドウォーマーまたは60°Cに設定されたヒートブロックでスライドガラスを15〜30分間加熱します。スライドは、より長く加熱したままにすることもできます。この手順は時間に依存しません。
- スライドを室温まで冷まします(~15分)。
5. 脱パラフィン
- スライドの脱パラフィン処理を開始するときは、組織が溶液中に残り、免疫染色の全過程で乾燥しないことを確認してください。
- スライドラック(資料表を参照)を使用してスライドガラスを保持し、透明化/脱パラフィン試薬(資料表を参照)で満たされた耐溶剤性皿(資料表を参照)の中に置きます。試薬が各スライドの組織を完全に覆っていることを確認してください。スライドを透明化試薬に完全に浸す前に、スライドラックを透明化溶液に数回浸すか、または揺らします。スライドを10分以上沈めておきます。
注意: この手順は、選択したクリアリングエージェントによっては、危険なガスのため、換気されたフードで実行する必要がある場合があります。このステップでの組織の脱パラフィンは、無毒のクリアリング剤を使用する場合、時間に敏感ではありません。 - スライドラックを取り外して攪拌し、余分なクリア試薬を取り除きます。新しい耐溶剤性ディッシュで、手順5.2を繰り返します。
- 新しい耐溶剤性皿で、手順5.3を繰り返します。スライドを15分以上沈めておきます。この手順は時間に依存しません。
6.水分補給
- スライドラックを取り外して攪拌し、余分なクリア試薬を取り除きます。100%エタノールを充填した新しい耐溶剤性皿で、スライドラックを数回浸すか揺らし、スライドを5分間沈めたままにします。この手順は時間的制約があります。2回繰り返します。
- スライドラックを取り外して攪拌し、余分な100%エタノールを取り除きます。95%エタノールを充填した新しい耐溶剤性皿で、スライドラックを数回浸すか押し合い、スライドを5分間沈めたままにします。この手順は時間的制約があります。1回繰り返します。
- スライドラックを取り外して攪拌し、余分な95%エタノールを取り除きます。70%エタノールを充填した新しい耐溶剤性皿で、スライドラックを数回浸すか、押し合い、スライドを5分間沈めたままにします。この手順は時間的制約があります。
- スライドラックを取り外して攪拌し、余分な70%エタノールを取り除きます。50%エタノールを充填した新しい耐溶剤性皿で、スライドラックを数回浸すか押し合い、スライドを5分間沈めたままにします。この手順は時間的制約があります。
- スライドラックを取り外して攪拌し、余分な50%エタノールを取り除きます。脱イオン(DI)水で満たされた新しい耐溶剤性ディッシュで、スライドラックを数回浸すか押し合い、スライドを5分間沈めたままにします。この手順は時間的制約があります。
- ここで一時停止するには、5分間の水再水和ステップ後に免疫染色が再開できるようになるまで、スライドをPBSの入った容器に入れます。
7. 抗原賦活化
- 新しい耐溶媒性ディッシュに適切な抗原賦活化バッファーを充填します。スライドラックをこのソリューションに直接移します。スライドが抗原賦活化溶液に完全に浸され、組織が完全に覆われていることを確認します。
注:最適な抗原賦活化溶液は、使用する抗体によって異なります。個々の抗体に必要な抗原賦活化は、研究者が決定する必要があるかもしれません。- 1xクエン酸抗原賦活化バッファーを作製するには、脱イオン水1 Lあたり2.94 gのクエン酸ナトリウム二水和物( 材料表を参照)を添加します。クエン酸ナトリウム二水和物が溶解したら、溶液がpH 6に達するまで塩化水素( 材料の表を参照)を追加します。最後に、脱イオン水1 Lあたり500 μLのTween20( 材料表を参照)を追加します。
- 1x Tris-EDTA抗原賦活化バッファーを作製するには、1 Lの脱イオン水に1.211 gのTris Baseと0.292 gのEDTAを加えます。溶解したら、pH 9に調整します。
- 抗原賦活化液とスライドの入った耐溶剤性皿に蓋をし、輪ゴムで蓋を固定します。
- 金属製のラックまたは五徳の上にある圧力鍋( 材料の表を参照)に安全な耐溶剤性皿を置きます。圧力がかかるように、圧力鍋に金属製のラックまたは五徳に到達するのに十分な水があることを確認してください。
- 圧力鍋に蓋をし、時計回りにひねって蓋を所定の位置にロックします。蓋にある圧力制限バルブを圧力設定にひねります。
- メニュー設定で圧力鍋の高圧を選択し、時間設定で圧力鍋を30分に設定します。
- 30分後、圧力鍋はビープ音を鳴らし、自動的に保温設定に設定されます。圧力が自然に解放され、蓋が自由に緩むまで待ちます。
- 耐熱手袋( 材料の表を参照)を使用して、耐溶剤性皿を圧力鍋から取り外し、輪ゴムと蓋を取り外します。皿を氷浴に~30分間入れて、スライドを室温まで冷まします。この手順は時間に依存しません。
- 室温まで冷やしたら、耐溶剤性ディッシュからスライドラックを取り出し、DI水で満たされた新しい耐溶剤性ディッシュに入れて、残留抗原賦活化液を除去します。スライドが完全に水没していることを確認します。
- スライドラックをDI水から取り出し、PBSを充填した新しい耐溶剤性皿に5分間置きます。スライドが完全に水没していることを確認します。この手順は時間に依存しません。
8. 非特異的なバックグラウンド染色のブロッキング
- 大きなスライドボックスを取り、フタに貼っている段ボールカバーを取り外して加湿チャンバーを準備します。スライドボックスの底に、広告を置きますamp ペーパータオルを垂直に下向きにします。広告を確認してくださいamp ペーパータオルは平らに置かれます。
- PBSに沈められたスライドラックからスライドを1つずつ取り出します。ティッシュを避けて、スライドガラスの余分なPBSを慎重に拭き取ります。
- 疎水性ペン( 材料の表を参照)を使用して、疎水性ペンで組織の周りにボックスを描くことにより、組織を囲むバリアを形成します。ティッシュを避け、疎水性ペンをティッシュに近づけて使用しないように注意してください。
- 広告の上に輪郭のスライドを水平に置きますamp ペーパータオル。ブロッキングバッファーを組織(~100 μL)に添加します。
- ブロッキングバッファーを作製するには、100 μL の冷水魚皮ゼラチン (Teleostein ゼラチン、 材料表を参照) を 9.85 mL の PBS に加えます。最後に、20% Triton X-100 ( 材料表参照) を50 μL加え、溶解するまで混合します。
- 各スライドについて、手順8.2〜8.4を繰り返します。加湿チャンバーを閉じ、スライドを室温で90分間インキュベートします。
9.マウスオンマウスブロッキング
- マウス組織の免疫染色にマウス一次抗体を使用する場合は、追加のブロッキングステップを実行します。マウス・オン・マウス・ブロッキング試薬(mouse-on-mouse block; Table of Materials参照)は市販されている。Mouse-on-Mouseブロックを準備するときは、商用の指示に従ってください。
- ブロッキング溶液を軽くたたいて、すぐに調製したマウスオンマウスブロックを組織(~100 μL)に加えて覆います。マウス組織を含む各スライドについて繰り返し、マウスで産生した一次抗体を使用して染色します。
- 加湿チャンバーボックス内で組織切片を室温で15分間インキュベートします。
- 加湿チャンバーからスライドを取り出し、PBSに浸したスライドラックに直接置きます。スライドをPBSに5分間置いて、マウスオンマウスブロックを洗い流します。
10. 一次抗体
- 各スライドについて、異なる動物種で産生された目的の一次抗体を選択します。一次抗体を抗体希釈液で希釈し、製造元の指示に従ってください。E-CADHERIN(1:100)、MUC2(1:200)、PCNA(1:500)、LAMININ(1:200)、β-CATENIN(1:200)、LAMP1(1:50)の一次抗体を使用しました。
注:メーカーが推奨希釈を提供していない場合は、1:100の希釈が適切な開始点です。目的の一次抗体が蛍光色素に標識されている場合は、ステップ12.2を参照してください。- 抗体希釈液を調製するには、上記の魚ゼラチンブロッキングバッファーを使用する場合は、ブロッキングバッファーをPBSに1:20添加します。
- スライドをPBSまたは加湿チャンバーから取り出し、余分なブロッキング溶液またはPBSを軽くたたいて、加湿チャンバーに水平に戻します。手順8.3で疎水性ペンで作成したバリアが残っていることを確認します。必要に応じて、ティッシュの輪郭を再度描きます。
- 適切に希釈した目的の一次抗体を組織を覆うように添加します (~100 μL)。
- 加湿チャンバーを閉じ、スライドを4°Cの平らな面に設置し、暗所で一晩インキュベートします。
11.スライドを洗う
- 加湿チャンバーからスライドを取り出し、一次抗体を軽くたたいて、スライドをPBSに浸したスライドラックに5分間置きます。
- スライドラックを取り外し、PBSを充填した新しい耐溶剤性皿に5分間置きます。手順 1x を繰り返します。
12. 二次抗体と核の対比染色
- 各スライドについて、一次抗体種に結合するように設計された二次抗体蛍光色素を選択します。二次抗体の蛍光色素または標識された一次抗体を二次抗体希釈液で希釈します。使用した二次抗体は、ロバ抗ヤギ488(1:200)、ロバ抗ウサギcy3(1:200)、ロバ抗マウス647(1:200)、ロバ抗ウサギ647(1:200)、およびロバ抗ラットcy3(1:200)でした。一次抗体γ-ACTINを蛍光色素647に結合させて、1:100の希釈率で使用しました。
- 二次抗体希釈液を調製するには、上記のように魚のゼラチンブロッキングバッファーを使用する場合は、ブロッキングバッファーをPBSに1:100添加します。
- スライドをPBSから取り外し、余分なPBSを軽くたたいて、加湿チャンバーに水平に戻します。手順8.3で疎水性ペンで作成したバリアが残っていることを確認します。必要に応じて、ティッシュの輪郭を再度描きます。
- 適切に希釈した二次抗体蛍光色素または目的の標識一次抗体を添加して、組織を覆います(~100 μL)。
- 加湿チャンバーを閉じ、スライドを室温で暗所で1時間インキュベートします。
- 10 mg/mL Hoechst( 材料表を参照)またはPBSを使用したDAPIを希釈し、最終濃度を1 μg/mLにするか、PBSを使用してDAPIを組織(~100 μL)に直接添加します。暗所で室温で5分間インキュベートします。
- 加湿チャンバーからスライドを取り出し、暗闇でPBSに5分間沈めたスライドラックに置きます。
- スライドラックを取り外し、PBSを充填した新しい耐溶剤性皿に5分間暗所に置きます。手順 1x を繰り返します。
13. 顕微鏡の取り付けと準備
- PBSに沈められたスライドラックから一度に1枚のスライドを取り出し、残りのスライドは暗闇でPBSに沈めたままにします。余分なPBSをそっと軽くたたいて取り、必要に応じて、糸くずの出ないワイプを使用して、ティッシュを避けてスライドガラスの余分なPBSを慎重に拭き取ります。
- ティッシュの中央に1〜2滴の退色防止用封入剤( 材料表を参照)を加えます。
- 清潔なカバースリップ( 材料表 を参照)の端を持ち、45°の角度でゆっくりとスライドに下ろします。封入剤が組織全体に均一に広がるようにします。
- ティッシュの中央から、カバーガラスを2本の指で優しく押し下げ、気泡や余分な封入剤を取り除きます。必要に応じて、端に向かって押し続け、全体を通して穏やかな圧力を維持します。
- ろ過されていないP200ピペットの小さい方の端を切り取り、真空に接続された血清ピペットの先端に取り付けます。
- カバースリップの端に沿って、バキュームを使用して余分な封入剤を取り除きます。
- 新しいスライドボックスに、スライドを水平に平らに置き、スライドを室温で暗闇で乾燥させます。
- このプロセスをスライドごとに繰り返します。
結果
ヘマトキシリンおよびエオシン(H&E)染色は、前述した12と同様に行った。最適化された方法を使用して、腸のスイスロールは、小腸と大腸の3つのセグメントすべてを1つのスライドに含めました。腸全体をスライド上に収容することで、研究者は腸のあらゆる部分の変化を解析でき、試薬の切片作成や染色のコストを節約できます(図1)。また、免疫染色時にすべての腸セグメントを同時に同じ溶液にさらすことで、正確な結果を得ることができます。H&E顕微鏡写真は、小腸と大腸のすべての部分の保存された腸の構造を示しています(図2)。十二指腸絨毛の測定では、このスイスロール法と比較して、未開封の腸組織の絨毛の高さに有意差は見られず、腸を開いても組織構造が乱れないことが示唆されました(図2D)。腸内スイスロールの免疫染色は、腸のさまざまな層と絨毛陰窩軸全体を示しています。蛍光画像は、一次抗体および二次抗体の染色によるバックグラウンドレベルが低いことを示しており、上皮に存在する個々の細胞をはっきりと示しています。 図3 は、杯細胞(MUC2陽性細胞)13、頂端膜(γ-ACTIN)14、上皮細胞の側膜(E-CADHERIN)15、および核の異なる腸セグメントの形態と染色を示しています。このプロトコルは、増殖細胞(PCNA)16、間質(LAMININ; 図4A)図17、リソソームドメイン(LAMP1)14、および上皮(β-CATENIN; 図4B)18.

図1:腸内スイスロールの調製と処理のワークフロー (A)腸管セグメントをPBS入りシリンジで洗い流し、PBSで洗浄します。(B)次に、湿った腸組織を乾いた濾紙の上に置きます。(C)濾紙の上で腸を縦に切り開き、(D)穏やかに広げます。(E)開いた腸の上に濾紙を敷き、腸を濾紙の間に優しく挟み、ホチキス止めします。腸管を一晩固定し、(F)を鉗子で巻く。(G)腸は逆作用鉗子から穏やかに外れ、(H)はロゼットの外観をしています。(私、 J)腸組織はピンで固定され、大きなカセットに入れられます。(K)4つの腸セグメントすべてを同じカセットに入れて、組織処理と埋め込みを行います。 この図の拡大版を表示するには、ここをクリックしてください。
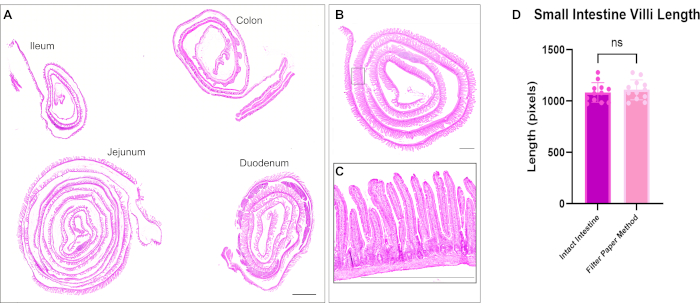
図2:腸の4つのセグメントすべてのヘマトキシリンとエオシンの染色。 (A)タイルスキャンは、十二指腸、空腸、回腸、および結腸の個々のスイスロールを使用して、1枚のスライドで腸全体を視覚化する能力を示しています。(B)腸のスイスロールの顕微鏡写真、および(C)絨毛と陰窩の構造を示すための高倍率の挿入図。(D)スイスの圧延組織と未開封組織との間に有意差は示されていない小腸絨毛の長さの定量化は示されていません。スケールバー = 1000 μm. この図の拡大版を表示するには、ここをクリックしてください。

図3:腸の4つのセグメントすべての免疫蛍光染色。 成体C57BL/6J対照マウスを、核(シアン)、側膜マーカーE-CADHERIN(緑)、MUC2で同定された杯細胞(黄色)、および頂端ブラシボーダーマーカー γ-ACTIN(マゼンタ)について免疫染色しました。スケールバー = 50 μm. この図の拡大版を表示するには、ここをクリックしてください。
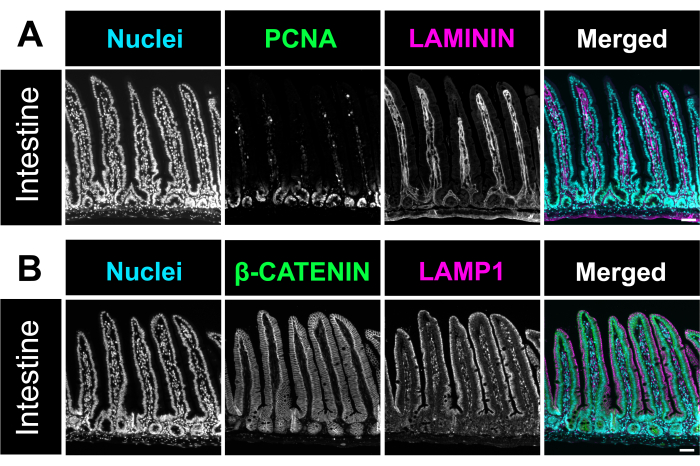
図 4.腸の免疫蛍光染色。 (A)マウス腸の免疫蛍光染色の代表的な顕微鏡写真は、核(シアン)、増殖細胞、PCNA(緑)、および固有層、LAMININ(マゼンタ)を強調しています。(B)腸内の核(シアン)、細胞膜マーカー β-CATENIN(緑)、リソソームマーカーLAMP1(マゼンタ)を特定する免疫蛍光画像。スケールバー = 50 μm. この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
ここでは、腸の構造を保存し、正確な免疫染色を促進するために、スイスロール法を使用した組織固定の最適化された方法を紹介します。一度習得すると、この技術は、腸の生理学や細胞生物学を含むさまざまな研究課題を調査するために使用できる19。いくつかの最適化されたスイスの圧延方法が公開されており、非常に便利です20,21。この技術の利点は、濾紙で腸を正確に開くことの容易さです。これにより、組織を平らに固定することができ、転がるときに組織が内側に丸まるのを防ぐことができ、特に肥厚した筋筋の炎症組織を分析する際に役立ちます。さらに、信頼性の高い結果を得るためには、組織切片化が重要な役割を担っていることを強調することが不可欠です。適切な切片作製は、組織構造の保存を確実にし、正確な免疫染色を促進し、最終的には下流の分析の成功に貢献します11。最適化されたアプローチは、他のプロトコルと比較して難しくなく、異なる個人間で一貫した結果をもたらします。この論文で紹介した技術は、保存状態の良い組織構造、汎用性、および多様な抗体を使用した再現性の高い免疫染色も提供します。
このプロトコルの重要な側面は、固定と処理時間です。不適切な組織の固定と処理は、組織化学分析を損なう可能性があります。過度に固定された組織はもろくなり、固定されすぎた組織は柔らかすぎるままになります。過剰に固定された組織と固定不足の組織の両方が切片化されにくく、免疫染色が損なわれます。濾紙に解剖したら、死後の変化を減らすために、組織を直ちにホルマリンに入れるべきである22。このプロトコルでは、マウス組織をホルマリンで一晩固定します。いくつかの研究は、この固定時間を使用しています20,23,24。しかし、Boenischらは、ホルマリンに最大4日間固定された組織において免疫染色が一貫していることを示した25。固定時間と固定剤の最適化は、目的の分析に応じて必要になります。例えば、Carnoyの固定剤は、粘液染色26にしばしば好まれる。固定剤の選択と固定時間の期間は、各研究者の実験的アプローチに応じて最適化する必要があります。正確で一貫した処理時間を確保するために、自動ティッシュプロセッサーの使用をお勧めします。当研究室では、腸内組織をロール状に保持する小さなピンを使用しています。ピンがないと、処理中にティッシュが広げられる可能性があります。これらのピンは非常に小さくて鋭いため、注意が必要です。ティッシュ処理の前に、ワイヤーカッターを使用してピンの鋭利な端を取り外すことをお勧めします。一部の組織学コアは、ピン付きの組織を受け入れません。そのため、使用する前に確認しておくとよいでしょう。別のアプローチは、27を処理する前に寒天を使用して組織を固定することであり、またはカセットスポンジをカセットに使用してロールを維持することです。
免疫染色は、各抗体の最適化が必要なプロトコールです。可能な限り、ノックアウト検証済み抗体の使用が推奨されます。この組織固定およびプロセシング法により、透明な染色が得られ、未検証の抗体を使用する場合のバックグラウンドシグナルと比較して、抗体結合の同定が容易になります。固定剤の選択、抗原賦活化、抗体の希釈は、抗体の特異性に影響を与える可能性があります。研究者は、各抗体の固定、抗原賦活化、インキュベーション時間を調整することにより、プロトコールを慎重に評価し、最適化することをお勧めします。最良の結果を得るには、抗体をさまざまな希釈液で試験して最適な濃度を決定し、さまざまな抗原賦活化バッファーで試験する必要があります。エピトープ賦活化は、固定中に形成されるメチレン架橋を切断することにより、免疫染色を改善します。このプロトコルでは、酵素消化が組織形態を破壊する可能性が高いため、タンパク質分解誘導エピトープ賦活化ではなく、熱誘起エピトープ賦活化が使用される28。最も一般的な熱誘起エピトープ賦活化バッファーは、クエン酸バッファー、tris-HCl、およびtris-EDTAであり、クエン酸バッファーは組織形態に最も優しい29。バッファーの選択はさまざまであり、抗体ごとに決定する必要があります。多くの抗原賦活化バッファー、ブロッキング溶液、抗体希釈剤が市販されています。ただし、これらのソリューションは非常に高価で、法外なコストがかかる可能性があります。一般的な抗原賦活化液とブロッキングおよび抗体希釈液のレシピを提供し、費用対効果を確保しました。
この方法の限界は、固定とプロセシングによって組織を変化させ、エピトープをマスクする可能性があることです。別のアプローチは、新鮮な凍結組織を免疫染色することです。新鮮な凍結組織は急速冷凍されるため、有毒な固定剤への曝露を回避し、タンパク質構造を維持し、一部のエピトープのアクセシビリティを向上させることができます。しかし、組織の構造と形態は、固定組織やパラフィン包埋組織よりも劣っています。新鮮な冷凍ティッシュのさらなる課題には、凍結ブロックとスライドの切片作成と保管に必要な材料とロジスティクスが含まれます。スイスロールと腸組織のストリップの分析は、以前の報告30で説明したように、絨毛の高さと幅の違い、および固有層の免疫細胞の違いを示しています。これらの結果は、腸内スイスロールが一部の腸の特徴を変化させることを示唆しており、実験を計画する際には考慮する必要があります。さらに、ホルマリン固定パラフィン包埋組織に特異的に結合する多くの抗体は、新鮮な凍結組織ではよく染色されないため、抗体の再検証が必要である31。
腸管組織の免疫染色は、消化管細胞の生物学や生理学に関するさまざまな疑問に答えるために使用できます。この手法は、腸の炎症、細菌感染後、およびがんの進行中の上皮の変化を特定するために広く使用されています。ここで紹介する方法は、費用対効果が高く、技術的に困難ではなく、再現性が高いため、腸組織の保存に最適です。最良の結果を得るために、このプロトコルで概説されているステップの最適化を、実験計画とテスト対象の仮説に基づいて最適化することをお勧めします。
開示事項
著者は何も開示していません。
謝辞
この研究は、米国国立衛生研究所(NIH)のACEへのK01 DK121869助成金の支援を受け、この出版物は、T32 GM132055(RME)、F31 DK139736(SAD)、T32 DK124191(SAD)、TL1 TR001451(RS)、UL1 TR001450(RS)、およびSAD & RSに対するHCSの基礎助成金によって部分的に支援されました。この研究は、サウスカロライナ医科大学(MUSC)からACEへのスタートアップ資金によって支援され、MUSC消化器疾患研究センター(P30 DK123704)および消化器および肝臓疾患のCOBRE GM120475 P20)によって支援されました。イメージングは、MUSCの細胞および分子イメージングコアを使用して行いました。
資料
| Name | Company | Catalog Number | Comments |
| β-CATENIN | GeneTex | GTX101435 | |
| Cellulose filter paper | Cytiva | 10427804 | Thick Whatman paper |
| Charged glass slides | Thermo Fisher Scientific | 23888114 | |
| Coverslip | Epredia | 152440 | |
| Dissecting pins size 00 | Phusis | B082DH4TZF | |
| E-CADHERIN | R&D Systems | AF748 | |
| Freezer gloves | Tempshield | UX-09113-02 | |
| Heating block | Premiere | XH-2001 | Slide Warmer |
| Histo-Clear II | Electron Microscopy Sciences | 64111-04 | Clearing reagent |
| Hoescht | Thermo Fisher Scientific | 62249 | |
| Hydrochloric Acid | Sigma Aldrich | 320331 | |
| Hydrophobic pen | Millipore | 402176 | |
| LAMININ | GeneTex | GTX27463 | |
| LAMP1 | Santa Cruz | SC-19992 | |
| Large cassettes | Tissue-Tek | 4173 | |
| Minutien pins | Fine Science Tools | NC9679721 | |
| Mouse-on-mouse blocking reagent | Vector Laboratories | MKB-2213 | Mouse-on-mouse block |
| MUC2 | GeneTex | GTX100664 | |
| PCNA | Cell Signaling Technology | 2586S | |
| Pressure Cooker | Cuisinart | B000MPA044 | |
| ProLong gold antifade | Thermo Fisher Scientific | P36934 | Mounting medium |
| Reverse action forceps | Dumont | 5748 | |
| Slide Rack | Tissue-Tek | 62543-06 | |
| Slide Staining Set | Tissue-Tek | 62540-01 | Solvent Resistant Dishes and Metal Frame |
| Small cassettes | Fisherbrand | 15-200-403B | |
| Sodium citrate dihydrate | Fisher Bioreagents | BP327-1 | |
| Teleostein Gelatin | Sigma | G7765 | Blocking buffer |
| Triton X-100 | Thermo Fisher Scientific | A16046 | |
| Tween 20 | Thermo Fisher Scientific | J20605-AP | |
| Wipes | KimTech | 34155 | |
| Xylenes | Fisher Chemical | 1330-20-7 | |
| γ-ACTIN | Santa Cruz | SC-65638 |
参考文献
- Louvard, D., Kedinger, M., Hauri, H. P. The differentiating intestinal epithelial cell: Establishment and maintenance of functions through interactions between cellular structures. Annu Rev Cell Biol. 8, 157-195 (1992).
- Rieger, J., Pelckmann, L. M., Drewes, B. . Animal models of allergic disease: Methods and protocols. , (2021).
- Webster, J. D., Miller, M. A., Dusold, D., Ramos-Vara, J. Effects of prolonged formalin fixation on the immunohistochemical detection of infectious agents in formalin-fixed, paraffin-embedded tissues. Vet Pathol. 47 (3), 529-535 (2010).
- Hayashi, Y., Koike, M., Matsutani, M., Hoshino, T. Effects of fixation time and enzymatic digestion on immunohistochemical demonstration of bromodeoxyuridine in formalin-fixed, paraffin-embedded tissue. J Histochem Cytochemis. 36 (5), 511-514 (1988).
- Werner, M., Chott, A., Fabiano, A., Battifora, H. Effect of formalin tissue fixation and processing on immunohistochemistry. Am J Surg Pathol. 24 (7), 1016-1019 (2000).
- Scalia, C. R., et al. Antigen masking during fixation and embedding, dissected. J Histochem Cytochem. 65 (1), 5-20 (2017).
- Masood, S., Von Wasielewski, R., Mengel, M., Nolte, M., Werner, M. Influence of fixation, antibody clones, and signal amplification on steroid receptor analysis. Breast J. 4 (1), 33-40 (1998).
- Moolenbeek, C., Ruitenberg, E. J. The "swiss roll": A simple technique for histological studies of the rodent intestine. Lab Anim. 15 (1), 57-59 (1981).
- Casteleyn, C., Rekecki, A., Van Der Aa, A., Simoens, P., Van Den Broeck, W. Surface area assessment of the murine intestinal tract as a prerequisite for oral dose translation from mouse to man. Lab Animals. 44 (3), 176-183 (2010).
- Lunnemann, H. M., et al. Cecum axis (cecax) preservation reveals physiological and pathological gradients in mouse gastrointestinal epithelium. Gut Microbes. 15 (1), 2185029 (2023).
- Qin, C., et al. The cutting and floating method for paraffin-embedded tissue for sectioning. J Vis Exp. (139), e58288 (2018).
- Feldman, A. T., Wolfe, D. . Histopathology: Methods and protocols. , (2014).
- Yang, W. H., et al. Innate mechanism of mucosal barrier erosion in the pathogenesis of acquired colitis. iScience. 26 (10), 107883 (2023).
- Dooley, S. A., et al. Myosin 5b is required for proper localization of the intermicrovillar adhesion complex in the intestinal brush border. Am J Physiol Gastrointest Liver Physiol. 323 (5), G501-G510 (2022).
- Danan, C. H., et al. Intestinal transit amplifying cells require mettl3 for growth factor signaling, kras expression, and cell survival. bioRxiv. , (2023).
- Han, B., Qi, S., Hu, B., Luo, H., Wu, J. Tgf-beta i promotes islet beta-cell function and regeneration. J Immunol. 186 (10), 5833-5844 (2011).
- Chen, L. C., Wang, H. W., Huang, C. C. Modulation of inherent niches in 3d multicellular msc spheroids reconfigures metabolism and enhances therapeutic potential. Cells. 10 (10), 2747 (2021).
- Fang, Y., et al. Cd36 inhibits beta-catenin/c-myc-mediated glycolysis through ubiquitination of gpc4 to repress colorectal tumorigenesis. Nat Commun. 10 (1), 3981 (2019).
- Whittem, C. G., Williams, A. D., Williams, C. S. Murine colitis modeling using dextran sulfate sodium (dss). J Vis Exp. (35), e1652 (2010).
- Bialkowska, A. B., Ghaleb, A. M., Nandan, M. O., Yang, V. W. Improved swiss-rolling technique for intestinal tissue preparation for immunohistochemical and immunofluorescent analyses. J Vis Exp. (113), e54161 (2016).
- Le Naour, J., et al. Improved swiss-rolling method for histological analyses of colon tissue. MethodsX. 9, 101630 (2022).
- Cardiff, R. D., Miller, C. H., Munn, R. J. Mouse tissue fixation. Cold Spring Harb Protoc. 2014 (5), 073403 (2014).
- Pereira E Silva, A., Lourenço, A. L., Marmello, B. O., Bitteti, M., Teixeira, G. a. P. B. Comparison of two techniques for a comprehensive gut histopathological analysis: Swiss roll versus intestine strips. Exp Mol Pathol. 111, 104302 (2019).
- Williams, J. M., Duckworth, C. A., Vowell, K., Burkitt, M. D., Pritchard, D. M. Intestinal preparation techniques for histological analysis in the mouse. Curr Prot Mouse Biol. 6 (2), 148-168 (2016).
- Boenisch, T. Effect of heat-induced antigen retrieval following inconsistent formalin fixation. Appl Immunohistochem Mol Morphol. 13 (3), 283-286 (2005).
- Hasegawa, Y., Mark Welch, J. L., Rossetti, B. J., Borisy, G. G. Preservation of three-dimensional spatial structure in the gut microbiome. PLoS One. 12 (11), e0188257 (2017).
- Garabedian, E. M., Roberts, L. J., Mcnevin, M. S., Gordon, J. I. Examining the role of paneth cells in the small intestine by lineage ablation in transgenic mice. J Biol Chem. 272 (38), 23729-23740 (1997).
- Moshi, J. M., Ummelen, M., Broers, J. L. V., Ramaekers, F. C. S., Hopman, A. H. N. Impact of antigen retrieval protocols on the immunohistochemical detection of epigenetic DNA modifications. Histochem Cell Biol. 159 (6), 513-526 (2023).
- Krenacs, L., Krenacs, T., Stelkovics, E., Raffeld, M. Heat-induced antigen retrieval for immunohistochemical reactions in routinely processed paraffin sections. Methods Mol Biol. 588, 103-119 (2010).
- Pereira, E. S. A., Lourenco, A. L., Marmello, B. O., Bitteti, M., Teixeira, G. Comparison of two techniques for a comprehensive gut histopathological analysis: Swiss roll versus intestine strips. Exp Mol Pathol. 111, 104302 (2019).
- Bolognesi, M. a. O., et al. Antibodies validated for routinely processed tissues stain frozen sections unpredictably. Bio Techniques. 3 (3), 137-148 (2021).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved