Method Article
פרוטוקול ממוטב לגלילים שוויצריים במעי וצביעה אימונופלואורסצנטית של רקמה משובצת פרפין
In This Article
Summary
המעי חיוני לעיכול וספיגה. כל אזור - תריסריון, ג'ג'ונום, איליאום, המעי הגס - משרת פונקציות נפרדות בשל מבנים תאיים ייחודיים. לימוד הפיזיולוגיה של המעי דורש ניתוח רקמות קפדני. פרוטוקול זה מתאר קיבוע ועיבוד רקמות בטכניקת הרול השוויצרית, ומבטיח אימונוסטיין מדויק באמצעות שימור וכיוון נכון של הרקמות.
Abstract
המעי הוא איבר מורכב המורכב מהמעי הדק והגס. המעי הדק יכול להיות מחולק עוד יותר תריסריון, jejunum, ו ileum. לכל אזור אנטומי במעי יש תפקיד ייחודי המתבטא בהבדלים במבנה התאים. חקירת שינויים במעי דורשת ניתוח מעמיק של אזורי רקמות שונים ושינויים תאיים שונים. כדי לחקור את המעי ולדמיין חתיכות גדולות של רקמה, חוקרים משתמשים בדרך כלל בטכניקה המכונה לחמניות שוויצריות מעיים. בטכניקה זו, המעי מחולק לכל אזור אנטומי קבוע בכיוון שטוח. לאחר מכן, הרקמה מגולגלת בזהירות ומעובדת להטבעת פרפין. קיבוע וכיוון נכונים של רקמות הם טכניקת מעבדה שלעתים קרובות מתעלמים ממנה, אך היא חשובה באופן קריטי לניתוח במורד הזרם. בנוסף, גלגול שוויצרי לא תקין של רקמת המעי עלול לפגוע באפיתל המעי השברירי, מה שמוביל לאיכות רקמה ירודה לצביעת מערכת החיסון. הבטחת רקמה קבועה היטב ומכוונת כראוי עם מבנים תאיים שלמים היא צעד חיוני המבטיח הדמיה אופטימלית של תאי המעי. אנו מציגים שיטה חסכונית ופשוטה להכנת לחמניות שוויצריות כדי לכלול את כל חלקי המעי בבלוק אחד משובץ פרפין. אנו מתארים גם צביעה אימונופלואורסצנטית אופטימלית של רקמת המעי כדי לחקור היבטים שונים של אפיתל המעי. הפרוטוקול הבא מספק לחוקרים מדריך מקיף להשגת תמונות אימונופלואורסנציה באיכות גבוהה באמצעות קיבוע רקמת מעי, טכניקת סוויס-רול וצביעת מערכת החיסון. שימוש בגישות מעודנות אלה משמר את המורפולוגיה המורכבת של אפיתל המעי ומטפח הבנה עמוקה יותר של הפיזיולוגיה של המעי והפתוביולוגיה.
Introduction
הארכיטקטורה התאית של המעי מציבה אתגר ייחודי בשמירה על שלמותו המבנית כאשר רקמת המעי נשמרת לצורך צביעה חיסונית. המעי הדק מורכב ממבנים מוארכים דמויי אצבעות המכונים וילי1. וילי אלה לעתים קרובות הופכים מעוותים במהלך תהליכי הטמעה. הבטחת שלחוקרים יש טכניקות להטמעה נכונה של מעיים כדי להשיג חתכים, המאפשרים הדמיה של כל אזורי המעי, כמו גם את השכבות המרכיבות את המעי (כלומר, muscularis propria, רירית והסרוסה), היא חיונית לניתוח ניסויי חזק2. קיבוע לא מספק, קיבוע מוגזם וטיפול לא נכון ברקמות יפגעו בשלמות הרקמה, וכתוצאה מכך ייגרם נזק לא מכוון לאפיתל המעי 3,4. פגיעה באפיתל המעי במהלך שלבים אלה יכולה להפחית באופן משמעותי את איכות הניתוחים הבאים, כמו immunofluorescence, ללא קשר ליעילות של פרוטוקולים אימונוהיסטוכימיים ונוגדנים בשימוש.
אימונוסטיין, כמו קיבוע רקמות תקין, הוא חלק חשוב במחקר הביו-רפואי. כאשר הוא נעשה היטב, immunostaining יכול להאיר היבטים שלא היו ידועים בעבר של מבנה התא ותפקודו. צביעה אימונופלואורסצנטית של חלקי פרפין יכולה להיות מאתגרת עקב שינויים פיסיקוכימיים הנובעים מתהליך הקיבוע והטמעת הפרפין5. קיבוע והטמעת פרפין גורמים למיסוך אנטיגן שיכול להפריע לזיהוי אימונופלואורסנציה של אפיטופים מעניינים6. קיבוע מושהה עלול לגרום להתפרקות פרוטאוליטית, וכתוצאה מכך הכתמה מוחלשת או נעדרת של אפיטופים קריטיים7. בנוסף, נוגדנים הם לעתים קרובות לא מדויקים עם רמות גבוהות של רקע. פרוטוקולי אימונוסטיין המקדמים קשירת נוגדנים עקבית וספציפית ויחס אות לרעש גבוה יכולים לספק מידע רב ערך לחוקרים.
כאן, אנו מספקים פרוטוקול מקיף שנועד להשיג תמונות אימונופלואורסנציה באיכות גבוהה באמצעות קיבוע רקמת מעי, הכנת גליל שוויצרי8 ו immunostaining. תוך שימת דגש על הנחיות לשמירה על שלמות המעי, הפרוטוקול נועד לספק לחוקרים מתודולוגיה חזקה לשיפור האיכות והאמינות של מחקרי הדמיה אימונופלואורסצנטית. ביקשנו גם להשתמש במשאבים חסכוניים, כולל נייר סינון ואחזור אנטיגן ביתי, פתרונות חסימה ודילול נוגדנים כדי להפוך את הפרוטוקול לנגיש יותר למעבדות שאולי הגבילו את הכספים. באשר לכל פרוטוקולי הניסוי, החוקרים צריכים לייעל את הפרוטוקול הנוכחי בהתבסס על הגישה הניסויית שלהם ותחומי העניין שלהם.
Protocol
הוועדה המוסדית לטיפול ושימוש בבעלי חיים של האוניברסיטה הרפואית של דרום קרוליינה אישרה את כל הטיפול, התחזוקה והטיפול בבעלי חיים. רקמת המעי נאספה מעכברים בוגרים C57BL/6J (זכרים ונקבות בני 3-5 חודשים, במשקל של כ-30 גרם) לשימוש במחקר הנוכחי.
1. קיבוע רקמת המעי
- נתחו בזהירות את המעי כולו מעכבר שעבר המתת חסד והניחו אותו בסירת שקילה או בצלוחית פטרי המכילה מלח חוצץ פוספט (PBS).
- הסר את המעיים מה- PBS והשתמש במספריים כדי להסיר בעדינות עודפי שומן ורקמת חיבור. חיתוך רקמת החיבור מסייע לרקמה להשתטח בשלבים הבאים.
- חלקו את המעי למקטעים נפרדים באמצעות מספריים (כלומר, תריסריון, ג'ג'ונום, איליאום, צקום ומעי גס). חלקו את המקטעים על פי מאפיינים אנטומיים ו/או אורך, כאשר כ-13% מאורך המעי הוא תריסריון, 58% הוא הג'ג'ונום, 8% הוא האילאום, 6% הוא הצקום והמעי הגס הוא 15%9. התריסריון עוקב אחר הקיבה, והאילאום הוא החלק הסופי של המעי הדק מיד לפני הצקום.
- שחררו את המעי הגס על ידי חיתוך במקום שבו הוא מצטרף לצקום באמצעות מספריים. הכניסו את התריסריון, הג'ג'ונום, האילאום והמעי הגס לסירת השקילה או לצלחת הפטרי של PBS. השליכו את הצקום או תקנו אותו לפי שיטות אחרות שפורסמו10.
- חבר קצה פיפטה P200 למזרק 10 מ"ל על ידי חיתוך הקצה הגדול של הקצה עם סכין גילוח. ממלאים את המזרק ב-PBS.
- הכנס את קצה המזרק לפתח של קטע מעיים באמצעות מלקחיים. השתמש במלקחיים כדי להחזיק את קטע המעי על המזרק ולשטוף בעדינות בקצב של ~ 50 μL / s כדי להסיר את תוכן המעי. אספו את תכולת המעי לסירת שקילה ריקה או לצלחת פטרי.
- הניחו את מקטע המעי הרטוב בקו ישר על רצועה של נייר מסנן תאית עם תווית יבשה (ראו טבלת חומרים). ודא שמקטע המעי רטוב מספיק כדי להיצמד כראוי לנייר המסנן היבש. תייג את נייר הסינון עם המידע עבור מספר עכבר, גנוטיפ, קבוצת ניסוי וכו 'באמצעות עיפרון.
הערה: שימוש בעט כדי לתייג את נייר הסינון עלול לגרום לאובדן תוויות במהלך הקיבוע. - השתמש מספריים דיסקציה לחתוך את המעי פתוח לאורך לאורך הקו mesenteric. גזור ~ 5 מ"מ בכל פעם, באמצעות הקצה התחתון של המספריים או זוג מלקחיים כדי להניח את הרקמה החתוכה שטוחה על נייר הסינון. ממשיכים עד שכל החלק של המעי נחתך ומונח שטוח על נייר הסינון. הקפד לחתוך את המעי לפתוח בקו ישר ככל האפשר, כמו זה יקל על גלגול הרקמה.
הערה: ניתן להשתמש במספריים עם קצה כדור במהלך שלב זה כדי למנוע נזק לרקמות. - הניחו פיסת נייר סינון נוספת על גבי קטע המעי. ודאו שנייר הסינון מכסה את קטע המעי, ומונע מהמעי להסתלסל או לאבד את צורתו השטוחה במהלך הקיבוע.
- הדקו את קצוות נייר הסינון כדי לאבטח את הרקמה במקומה. אין להדק את הרקמה. הניחו מספיק סיכות סביב הרקמה כדי למנוע מהרקמה להתנתק מנייר הסינון בזמן הקיבוע.
- חזור על שלבים 1.5-1.10 עבור כל אחד ממקטעי המעי (תריסריון, ג'ג'ונום, אילאום ומעי גס).
- יש לטבול את הרקמות בפורמלין חוצץ 10% רגיל (או קיבוע לפי בחירה כגון 4% פרפורמלדהיד, קיבוע של קרנוי וכו') למשך הלילה בטמפרטורה של 4°C.
אזהרה: יש להקפיד על לבישת ציוד מגן אישי נכון, שכן חומרים מקבעים כגון פורמלין רעילים.
2. גלגול ועיבוד רקמת המעי
התראה: בצע את השלבים 2.1-2.6 במכסה מנוע מאוורר.
- הסר בעדינות את פיסת נייר הסינון העליונה (זו הנוגעת בצד הלומינלי של המעי). השתמש במלקחיים כדי לקלף בזהירות את המעי מפיסת נייר הסינון התחתונה. השליכו את נייר הסינון.
- מלאו שלוש סירות שקילה עם PBS. יש לשטוף את הרקמה ב-PBS 3x כדי להסיר פורמלין מהרקמה.
- בעזרת מלקחיים בעלי פעולה הפוכה (ראו טבלת חומרים), הרימו פיסת מעי לאורך הקצה הקצר כשהצד הלומינלי פונה כלפי מעלה. סובב את המלקחיים כדי לגלגל את הרקמה. השתמש בזוג מלקחיים רגילים כדי לעזור להנחות את הרקמה בזמן שהיא מגולגלת. אם הרקמה מקופלת, פתחו אותה ונסו שוב.
- הניחו את הרקמה בסירת שקילה יבשה או בצלחת פטרי. החזיקו את הרקמה במקומה עם מלקחיים ביד אחת. פתח בזהירות את מלקחיים הפעולה ההפוכה ושחרר את הרקמה, תוך שימוש במלקחיים האחרים כדי לעקור את הרקמה ממלקחיים הפעולה ההפוכה.
- הכנס סיכת חיתוך בגודל 00 או סיכת minutien לרקמה (ראה טבלת חומרים). השתמש בחוטבי תיל כדי להסיר את הקצה החד של הסיכה. מניחים את הרקמה בקלטת גדולה ולאחר מכן מניחים את הקלטת במיכל של 70% אתנול עד מוכן לעיבוד.
- חזור על שלבים 2.1-2.5 עם כל מקטעי המעי (התריסריון, הג'ג'ונום, האילאום והמעי הגס), ומקם את כל ארבעת גלילי הרקמה באותה קסטה גדולה (ראה טבלת חומרים). ודא שהקלטת מסומנת בעיפרון כדי למנוע מהתווית להישטף בתמיסות אתנול וקסילן (ראה טבלת חומרים).
- לאחר שכל הדגימות התגלגלו, הכניסו את הדגימות למעבד רקמות. השתמש בהגדרות הבאות עבור רקמת מעיים: אתנול 70% במשך 35 דקות; 90% אתנול במשך 35 דקות; 95% אתנול במשך 35 דקות; 100% אתנול במשך 35 דקות, 3x; קסילן במשך 35 דקות, 3x; פרפין למשך 60 דקות, 3x. ניתן להשאיר קסטות בשעוות פרפין מומסת לפרקי זמן ממושכים.
אזהרה: יש להקפיד על שימוש בציוד מגן מתאים, שכן קסילן הוא כימיקל רעיל.
3. הטבעת רקמת מעיים
- מחממים תבניות הטבעה גדולות כדי לשמור על הפרפין נמס.
- מוציאים קלטות ממעבד הרקמה ומניחים אותן בכוס של פרפין מומס.
- בתחנת הטבעה, מניחים כמות קטנה של פרפין לתוך תבנית. מוציאים את ארבעת הלחמניות השווייצריות מהקלטת, מניחים את כולן בתבנית אחת, מניחים אותן שטוחות ככל האפשר. מוסיפים עוד פרפין למילוי התבנית.
- מעבירים את התבנית לצלחת הקרה ומוודאים שכל הלחמניות השוויצריות שטוחות בתחתית התבנית. מניחים קסטה קטנה עם תווית (ראו טבלת חומרים) על התבנית ומוסיפים עוד פרפין במידת הצורך.
- לאחר שהשעווה התמצקה, הסירו את הבלוק מהתבנית. הרקמה מוכנה כעת לחיתוך לפרוסות של 5 מיקרומטר וציפה על מגלשות זכוכית טעונות עבור צביעת חיסון11.
4. היצמדות רקמות והכנת שקופיות
- כדי להבטיח שהחלק המוכן של רקמת פרפין בגודל 5 מיקרומטר נצמד למגלשה, יש לחמם את מגלשות הזכוכית על מגלשה מחמם יותר או לחסום חום לטמפרטורה של 60°C למשך 15-30 דקות. ניתן גם להשאיר את המגלשות מחממות למשך זמן רב יותר; שלב זה אינו תלוי זמן.
- תנו לשקופיות להתקרר לטמפרטורת החדר (~ 15 דקות).
5. Deparaffinization
- עם תחילת de-paraffinization של שקופיות, לוודא כי הרקמה נשארת בתמיסה ולא להתייבש במשך כל מהלך immunostaining.
- השתמש במדף שקופיות (ראה רשימת חומרים) כדי להחזיק את שקופיות הזכוכית ולמקם אותן בתוך צלחת עמידה בפני ממס (ראה טבלת חומרים) הממולאת במגיב ניקוי/דה-פרפיניזציה (ראה טבלת חומרים). ודא שהמגיב מכסה לחלוטין את הרקמה בכל שקופית. לפני טבילה מלאה של השקופיות בריאגנט הסליקה, טבלו או דחפו את מדף השקופיות מספר פעמים בתמיסת הסליקה. השאר שקופיות שקועות למשך 10 דקות או יותר.
הערה: ייתכן שיהיה צורך לבצע שלב זה במכסה מנוע מאוורר עקב אדים מסוכנים, בהתאם לחומר הסליקה שנבחר. Deparaffinization של הרקמה בשלב זה אינו רגיש לזמן, אם באמצעות סוכן ניקוי לא רעיל. - הסר והתסיס את מדף השקופיות כדי להסיר מגיב ניקוי עודף. בצלחת חדשה העמידה בפני ממסים, חזור על שלב 5.2.
- בצלחת חדשה העמידה בפני ממסים, חזור על שלב 5.3. השאר שקופיות שקועות למשך 15 דקות או יותר. שלב זה אינו תלוי זמן.
6. התייבשות
- הסר והתסיס את מדף השקופיות כדי להסיר מגיב ניקוי עודף. בצלחת חדשה עמידה בפני ממסים מלאה באתנול 100%, טבלו או דחפו את מדף המגלשות מספר פעמים והשאירו את המגלשות שקועות למשך 5 דקות. שלב זה הוא תלוי זמן. חזור על הפעולה פעמיים.
- הסר ועורר את מדף השקופיות כדי להסיר עודפי אתנול 100%. בצלחת חדשה עמידה בפני ממסים מלאה באתנול 95%, טבלו או דחפו את מדף המגלשות מספר פעמים והשאירו את המגלשות שקועות למשך 5 דקות. שלב זה הוא תלוי זמן. חזור על הפעולה 1x.
- הסר והתסיס את מדף השקופיות כדי להסיר עודפי אתנול 95%. בצלחת חדשה עמידה בפני ממסים מלאה באתנול 70%, טבלו או דחפו את מדף המגלשות מספר פעמים והשאירו את המגלשות שקועות למשך 5 דקות. שלב זה הוא תלוי זמן.
- הסר ועורר את מתלה השקופיות כדי להסיר עודפי אתנול 70%. בצלחת חדשה עמידה בפני ממסים מלאה באתנול 50%, טבלו או דחפו את מדף המגלשות מספר פעמים והשאירו את המגלשות שקועות למשך 5 דקות. שלב זה הוא תלוי זמן.
- הסר ועורר את מתלה השקופיות כדי להסיר עודפי אתנול 50%. בצלחת חדשה עמידה בפני ממסים מלאה במים שעברו דה-יוניזציה (DI), טבלו או דחפו את מדף המגלשות מספר פעמים והשאירו את המגלשות שקועות למשך 5 דקות. שלב זה הוא תלוי זמן.
- כדי לעצור כאן, הניחו את המגלשות במיכל עם PBS עד שניתן יהיה לחדש את ההכתמה החיסונית לאחר שלב החזרת המים למשך 5 דקות.
7. שליפת אנטיגן
- מלאו צלחת חדשה עמידה בפני ממסים במאגר מתאים לשליפת אנטיגן. העבר ישירות את מדף השקופיות לפתרון זה. ודא שהשקופיות שקועות במלואן בתמיסת שליפת האנטיגן, ומכסות את הרקמה לחלוטין.
הערה: פתרונות אופטימליים לשליפת אנטיגן עשויים להשתנות בהתאם לנוגדן המסוים הנמצא בשימוש. ייתכן שיהיה צורך לקבוע את שליפת האנטיגן הנדרשת עבור נוגדנים בודדים על ידי החוקר.- כדי ליצור מאגר אחזור אנטיגן ציטראט 1x, הוסף 2.94 גרם של נתרן ציטראט דיהידרט (ראה טבלת חומרים) לכל 1 ליטר של מים נטולי יונים. לאחר המסת הנתרן ציטראט דיהידרט, מוסיפים מימן כלורי (ראו טבלת חומרים) עד שהתמיסה מגיעה ל-pH של 6. לבסוף, יש להוסיף 500 מיקרוליטר של Tween20 (ראו טבלת חומרים) לכל ליטר אחד של מים שעברו דה-יוניזציה.
- כדי ליצור מאגר אחזור אנטיגן Tris-EDTA אחד, הוסף 1.211 גרם בסיס Tris ו- 0.292 גרם EDTA ב- 1 ליטר מים שעברו דה-יוניזציה. לאחר המסה, יש להסתגל ל-pH 9.
- מכסים את הכלי העמיד בפני ממס המכיל את תמיסת שליפת האנטיגן ומחליקים במכסה ומהדקים את המכסה בגומיות.
- הניחו את הכלי המאובטח העמיד בפני ממסים בסיר לחץ (ראו טבלת חומרים) על גבי מדף המתכת או החצאית. ודאו שיש מספיק מים בסיר הלחץ כדי להגיע למתלה המתכת או לחצאית כדי שהלחץ יוכל להצטבר.
- הניחו את המכסה על סיר הלחץ וסובבו בכיוון השעון כדי לנעול את המכסה למקומו. סובב את שסתום מגבלת הלחץ שנמצא על המכסה להגדרת הלחץ.
- תחת הגדרת התפריט, בחר לחץ גבוה בסיר הלחץ, ולאחר מכן, תחת הגדרת הזמן, הגדר את סיר הלחץ ל- 30 דקות. בחר התחל.
- לאחר 30 דקות סיר הלחץ יצפצף ויוגדר אוטומטית למצב שמור על חום. המתן עד שהלחץ ישתחרר באופן טבעי והמכסה ייפתח בחופשיות.
- השתמשו בכפפות עמידות בחום (ראו טבלת חומרים) כדי להסיר את הכלי העמיד בפני ממס מסיר הלחץ ולהסיר את הגומייה והמכסה. מניחים את המנה באמבט קרח למשך ~ 30 דקות כדי לאפשר לשקופיות להתקרר לטמפרטורת החדר. שלב זה אינו תלוי זמן.
- לאחר התקררות לטמפרטורת החדר, הסר את מתלה השקופיות מהכלי העמיד בפני ממס והנח אותו בכלי חדש עמיד לממס מלא במי DI כדי להסיר תמיסת אחזור אנטיגן שיורית. ודא שהשקופיות שקועות במלואן.
- הסר את מדף המגלשה ממי DI והנח אותו בכלי חדש עמיד בפני ממסים מלא PBS למשך 5 דקות. ודא שהשקופיות שקועות במלואן. שלב זה אינו תלוי זמן.
8. חסימת צביעת רקע לא ספציפית
- הכינו תא לח על ידי לקיחת קופסת שקופיות גדולה והסרת כיסוי הקרטון המודבק למכסה. בבסיס קופסת המגלשה, הניחו מגבות נייר לחות במאונך כלפי מטה. ודאו שמגבות הנייר הלחות מונחות שטוחות.
- הסר שקופית אחת בכל פעם ממדף השקופיות השקוע ב- PBS. נגבו בזהירות עודפי PBS על מגלשת הזכוכית, תוך הימנעות מהרקמה.
- בעזרת עט הידרופובי (ראו טבלת חומרים) יוצרים מחסום המקיף את הרקמה על ידי ציור קופסה סביב הרקמה עם העט ההידרופובי. היזהר להימנע מהרקמה ולא להשתמש בעט הידרופובי קרוב מדי לרקמה.
- הניחו את המגלשה המסומנת אופקית מעל מגבות הנייר הלחות. הוסף חיץ חוסם כדי לכסות את הרקמה (~ 100 μL).
- כדי ליצור חיץ חוסם, הוסף 100 מיקרוליטר של ג'לטין עור דגי מים קרים (ג'לטין טלאוסטיין; ראה טבלת חומרים) ל- 9.85 מ"ל PBS. לבסוף, הוסיפו 50 μL של 20% Triton X-100 (ראו טבלת חומרים) וערבבו עד להמסה.
- חזור על שלבים 8.2-8.4 עבור כל שקופית. סגרו את התא הלח ודגרו על מגלשות בטמפרטורת החדר למשך 90 דקות.
9. עכבר על חסימת עכבר
- בעת שימוש בנוגדן עכבר ראשוני עבור immunostaining רקמת עכבר, בצע שלב חסימה נוסף. ריאגנטים חוסמי עכבר על עכבר (בלוק עכבר על עכבר; ראה רשימת חומרים) זמינים באופן מסחרי; בצע את ההוראות המסחריות בעת הכנת בלוק העכבר על העכבר.
- הקש בעדינות על פתרון החסימה והוסף מיד את בלוק העכבר על העכבר המוכן כדי לכסות את הרקמה (~ 100 μL). חזור על הפעולה עבור כל שקופית המכילה רקמת עכבר, אשר תוכתם באמצעות נוגדן ראשוני שגדל בעכברים.
- יש לדגור על חלקי רקמה בקופסת התא הלח בטמפרטורת החדר למשך 15 דקות.
- הסר שקופיות מהחדר הלח והנח אותן ישירות במדף שקופיות השקוע ב- PBS. השאר שקופיות ב- PBS למשך 5 דקות כדי לשטוף את בלוק העכבר על העכבר.
10. נוגדנים ראשוניים
- עבור כל שקופית, בחר נוגדנים ראשוניים בעלי עניין המועלים במינים שונים. לדלל נוגדנים ראשוניים בנוגדנים מדללים בהתאם להוראות היצרן. נעשה שימוש בנוגדנים העיקריים הבאים: E-CADHERIN (1:100), MUC2 (1:200), PCNA (1:500), LAMININ (1:200), β-CATENIN (1:200) ו-LAMP1 (1:50).
הערה: אם היצרן אינו מספק דילולים מומלצים, דילול 1:100 הוא נקודת התחלה טובה. אם הנוגדן העיקרי של העניין מצומד לפלואורופור, ראה שלב 12.2.- כדי להפוך את הנוגדן לדלל, הוסף חיץ חוסם 1:20 ל- PBS, אם אתה משתמש במאגר חוסם ג'לטין דגים שתואר לעיל.
- הסר שקופיות מ- PBS או מתא הלחות, הקש בעדינות על תמיסת החסימה העודפת או PBS, והנח אותן אופקית בחזרה בתא הלחות. ודא שהמחסום שנוצר עם העט ההידרופובי בשלב 8.3 נשאר; תאר את הרקמה שוב במידת הצורך.
- הוסף נוגדנים ראשוניים מדוללים כראוי של עניין כדי לכסות את הרקמה (~ 100 μL).
- סגרו את התא הלח ודגרו על מגלשות על משטח שטוח בטמפרטורה של 4 מעלות צלזיוס בחושך למשך הלילה.
11. שטיפת המגלשות
- הסר שקופיות מתא הלחות, הקש בעדינות על הנוגדנים הראשוניים והנח את המגלשות במדף שקופיות שקוע ב- PBS למשך 5 דקות.
- הסר את מדף המגלשות והנח אותו בכלי חדש עמיד בפני ממסים מלא PBS למשך 5 דקות. חזור על שלב 1x.
12. נוגדנים משניים וגרעינים counterstaining
- עבור כל שקופית, בחר פלואורופורים של נוגדנים משניים שנועדו להיקשר למיני הנוגדנים הראשוניים. לדלל פלואורופורים של נוגדנים משניים או נוגדנים ראשוניים מצומדים בדילול נוגדנים משני. הנוגדנים המשניים בהם נעשה שימוש היו חמור נגד עז 488 (1:200), חמור נגד ארנב cy3 (1:200), חמור נגד עכבר 647 (1:200), חמור נגד ארנב 647 (1:200) וחמור נגד חולדה cy3 (1:200). הנוגדן העיקרי γ-ACTIN מצומד לפלואורופור 647 שימש בדילול של 1:100.
- כדי לדלל נוגדנים משניים, הוסף חיץ חוסם 1:100 ל- PBS, אם אתה משתמש במאגר חוסם ג'לטין דגים כמתואר לעיל.
- הסר שקופיות מ- PBS, הקש בעדינות על PBS עודף, והנח אותן אופקית בחזרה בתא הלח. ודא שהמחסום שנוצר עם העט ההידרופובי בשלב 8.3 נשאר; תאר את הרקמה שוב במידת הצורך.
- הוסף פלואורופורים משניים מדוללים כראוי או נוגדנים ראשוניים מצומדים בעלי עניין כדי לכסות את הרקמה (~ 100 μL).
- סגרו את התא הלח ודגרו על מגלשות בטמפרטורת החדר בחושך למשך שעה אחת.
- יש לדלל 10 מ"ג/מ"ל Hoechst (ראה טבלת חומרים) או DAPI באמצעות PBS לקבלת ריכוז סופי של 1 מיקרוגרם/מ"ל Hoechst או DAPI באמצעות PBS ולהוסיף ישירות לרקמה (~100 μL). יש לדגור במשך 5 דקות בטמפרטורת החדר בחושך.
- הסר שקופיות מהחדר הלח והנח אותן במדף שקופיות השקוע ב- PBS למשך 5 דקות בחושך.
- הסר את מדף השקופיות והנח בצלחת חדשה עמידה בפני ממסים מלאה PBS למשך 5 דקות בחושך. חזור על שלב 1x.
13. הרכבה והכנה למיקרוסקופ
- הסר שקופית אחת בכל פעם ממדף השקופיות השקוע ב- PBS, והשאר את שאר השקופיות שקועות ב- PBS בחושך. טפחו בעדינות על עודפי PBS, ואם יש צורך, השתמשו במגבון ללא סיבים כדי לנגב בזהירות עודפי PBS על מגלשת הזכוכית, תוך הימנעות מהרקמה.
- יש להוסיף טיפה אחת או שתיים של אמצעי הרכבה נגד דהייה (ראו טבלת חומרים) למרכז הרקמה.
- החזיקו את הכיסוי הנקי (ראו טבלת חומרים ) בקצוות והורידו אותו באיטיות אל המגלשה בזווית של 45°. ודא שאמצעי ההרכבה מתפשט באופן שווה על הרקמה.
- החל ממרכז הרקמה, לחץ בעדינות כלפי מטה על הכיסוי בשתי אצבעות כדי לסייע בהסרת בועות אוויר ואמצעי הרכבה עודפים. במידת הצורך, המשיכו ללחוץ לכיוון הקצוות ושמרו על לחץ עדין לאורך כל הדרך.
- חותכים את הקצה הקטן של פיפטה P200 לא מסוננת ומחברים אותה לקצה של פיפטה סרולוגית המחוברת לוואקום.
- לאחר קצוות הכיסוי, השתמש בשואב כדי להסיר את אמצעי ההרכבה העודפים.
- בתיבת שקופיות חדשה, הניחו אופקית את המגלשה שטוחה ואפשרו למגלשה להתייבש בחושך בטמפרטורת החדר.
- חזור על תהליך זה עבור כל שקופית.
תוצאות
בוצעה צביעת המטוקסילין ואוזין (H&E), כפי שתואר קודם לכן12. בשיטה האופטימלית, לחמניות שוויצריות במעיים כללו את כל שלושת המקטעים של המעי הדק והמעי הגס בשקופית אחת. איכלוס המעי כולו בשקופית מאפשר לחוקרים לנתח שינויים בכל חלקי המעי וחוסך עלויות על ריאגנטים של חתך וצביעה (איור 1). כמו כן, חשיפת כל מקטעי המעי לאותם תמיסות בו זמנית כאשר immunostaining מסייעת להבטיח תוצאות מדויקות. מיקרוגרף H&E מדגים את ארכיטקטורת המעי השמורה של כל חלקי המעי הדק והמעי הגס (איור 2). מדידה של וילי תריסריון לא הראתה הבדל משמעותי בגובה הווילי ברקמת מעי שלא נפתחה בהשוואה לשיטת גליל שוויצרית זו, מה שמרמז על כך שפתיחת המעי אינה משבשת את ארכיטקטורת הרקמה (איור 2D). Immunostaining של לחמניות שוויצריות המעי מראה את השכבות השונות של המעי, כמו גם את כל ציר הקריפטה villous. התמונות הפלואורסצנטיות מראות רמות רקע נמוכות מצביעת הנוגדנים הראשונית והמשנית ומתארות בבירור את התאים הבודדים הנמצאים באפיתל. איור 3 מראה את המורפולוגיה של מקטעי מעיים שונים ואת הצביעה של תאי גביע (תאים חיוביים MUC2)13, הקרום האפי (γ-ACTIN)14, הקרום הצידי של תאי אפיתל (E-CADHERIN)15 וגרעינים. פרוטוקול זה מתאים לזיהוי תאים רבים ושונים, כולל תאים שגשוגיים (PCNA)16, אינטרסטיציום (LAMININ; איור 4A) 17, התחום הליזוזומלי (LAMP1)14, והאפיתל (β-CATENIN; איור 4B) 18.

איור 1: תהליך עבודה להכנה ועיבוד של לחמניות שוויצריות במעיים. (A) מקטעי מעיים נשטפים עם מזרק המכיל PBS ולאחר מכן נשטפים ב-PBS. (B) רקמת מעי רטובה מונחת על נייר סינון יבש. (C) המעי נחתך לאורכו על נייר סינון ו-(D) נמרח בעדינות. (E) פיסת נייר סינון מונחת על גבי המעי הפתוח, והמעי נדחק בעדינות בין נייר הסינון לבין הסיכות. מקטעי המעי קבועים במהלך הלילה, ו-(F) מגולגל באמצעות מלקחיים. (G) המעי נעקר בעדינות מהמלקחיים הפועלים ההפוכים, ו-(H) יש לו מראה רוזטה. (ט, י) רקמת המעי נעוצה ומונחת בקלטת גדולה. (K) כל ארבעת מקטעי המעי מונחים באותה קסטה לצורך עיבוד רקמות והטבעתן. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
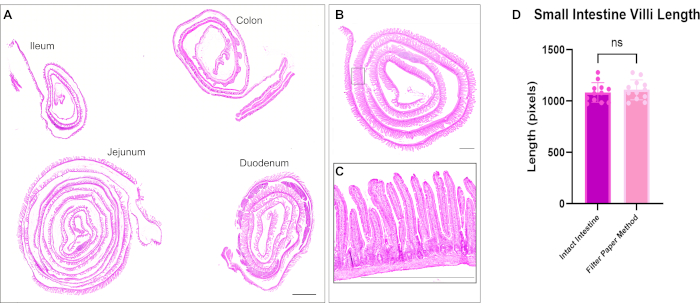
איור 2: צביעת המטוקסילין ואאוזין בכל ארבעת חלקי המעי. (A) סריקת אריחים מדגימה את היכולת לדמיין את המעי כולו בשקופית אחת עם גלילים שוויצריים בודדים של התריסריון, הג'ג'ונום, האילאום והמעי הגס. (B) מיקרוגרף של גליל שוויצרי במעי ו-(C) כניסה בהגדלה גבוהה יותר כדי להראות ארכיטקטורת וילי וקריפטה. (D) כימות אורך המעי הדק במעי הדק לא מראה הבדל משמעותי בין רקמה מגולגלת שוויצרית לרקמה שלא נפתחה. פסי קנה מידה = 1000 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 3: צביעה אימונופלואורסצנטית של כל ארבעת חלקי המעי. עכברי ביקורת בוגרים C57BL/6J עברו חיסון עבור גרעינים (ציאן), סמן הממברנה הצידית, E-CADHERIN (ירוק), תאי גביע שזוהו על ידי MUC2 (צהוב), וסמן גבול המברשת האפיקלית γ-ACTIN, (מגנטה). פסי קנה מידה = 50 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
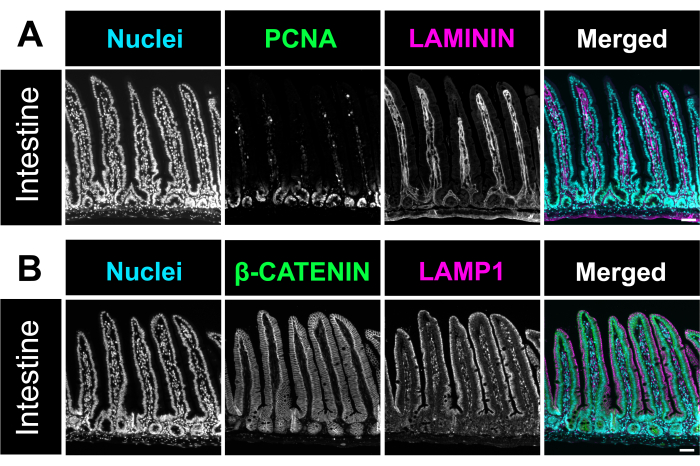
איור 4. מכתים immunofluorescence של המעי. (A) מיקרוגרף מייצג של צביעה אימונופלואורסצנטית של מעי העכבר מדגיש גרעינים (ציאן), תאים מתרבים, PCNA (ירוק), ולמינה פרופריה, למינין (מגנטה). (B) תמונת זיהוי אימונופלואורסנציה (ציאן), סמן קרום התא β-CATENIN (ירוק), והסמן הליזוזום LAMP1 (מגנטה) במעי. פסי קנה מידה = 50 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Discussion
כאן, אנו מציגים שיטה אופטימלית לקיבוע רקמות בטכניקת הרול השוויצרית כדי לשמר את ארכיטקטורת המעי ולקדם אימונוסטיין מדויק. לאחר השליטה, טכניקה זו יכולה לשמש כדי לחקור מגוון רחב של שאלות מחקר הקשורות פיזיולוגיה של המעי וביולוגיה התא19. פורסמו מספר שיטות גלגול שוויצריות אופטימליות והן שימושיות מאוד20,21. יתרון של טכניקה זו הוא הקלות של פתיחה מדויקת של המעי על נייר פילטר. זה מאפשר לרקמה להיות קבועה שטוחה, מניעת רקמה מסתלסלת פנימה בעת גלגול, וזה מועיל במיוחד בעת ניתוח רקמה דלקתית עם שרירים מעובים. בנוסף, חיוני להדגיש את התפקיד הקריטי של חתך רקמות בהשגת תוצאות אמינות. חתך נכון מבטיח שימור של ארכיטקטורת רקמות ומאפשר אימונוסטינה מדויקת, ובסופו של דבר תורם להצלחת הניתוחים במורד הזרם11. הגישה הממוטבת פחות קשה בהשוואה לפרוטוקולים אחרים, ומניבה תוצאות עקביות בקרב אנשים שונים. הטכניקה המוצגת במאמר זה מספקת גם ארכיטקטורת רקמות שהשתמרה היטב, רב-תכליתיות ו-immunostaining הניתן לשחזור באמצעות נוגדנים מגוונים.
היבט קריטי של פרוטוקול זה הוא זמן הקיבוע והעיבוד. קיבוע ועיבוד לא נכונים של רקמות עלולים לפגוע באנליזות היסטוכימיות. רקמה מקובעת יתר על המידה הופכת לפריכה, בעוד רקמה לא מקובעת נשארת רכה מדי. גם רקמות מוגזמות וגם רקמות לא מקובעות קשות לחיתוך ופוגעות בהכתמה חיסונית. לאחר הניתוח על נייר סינון, יש להכניס מיד את הרקמה לפורמלין כדי להפחית שינויים לאחר המוות22. בפרוטוקול זה, רקמת מורין קבועה בפורמלין בן לילה. מספר מחקרים השתמשו בזמן קיבוע זה 20,23,24. עם זאת, Boenisch et al. הראו כי immunostaining עקבי ברקמה קבועה פורמלין עד 4 ימים25. אופטימיזציה של זמן תיקון וקיבוע נדרש בהתאם לניתוחים הרצויים. לדוגמה, הקיבוע של קרנוי מועדף לעתים קרובות עבור כתמי ריר26. בחירת הקיבועים ומשך זמן הקיבוע צריכה להיות אופטימלית על ידי כל חוקר בהתאם לגישתו הניסויית. מומלץ להשתמש במעבד רקמות אוטומטי כדי להבטיח זמני עיבוד מדויקים ועקביים. המעבדה שלנו משתמשת בסיכות קטנות כדי להחזיק את רקמת המעי במקום כמו גלילים. ללא סיכות, הרקמה עלולה להתגלגל במהלך העיבוד. מכיוון שסיכות אלה די קטנות וחדות, יש לנקוט אמצעי זהירות. אנו ממליצים להשתמש בחותכי חוטים כדי להסיר את הקצה החד של הסיכה לפני עיבוד הרקמות. ליבות היסטולוגיה מסוימות לא יקבלו רקמות עם סיכות; לכן, עדיף לבדוק לפני השימוש. גישה חלופית היא להשתמש באגר כדי לעגן רקמות לפני עיבוד27 או שניתן להשתמש בספוגי קסטות בקלטות כדי לסייע בשמירה על גלילים.
Immunostaining הוא פרוטוקול הדורש אופטימיזציה עבור כל נוגדן. מומלץ להשתמש בנוגדנים מאומתים בנוקאאוט במידת האפשר. שיטה זו לקיבוע ועיבוד רקמות גורמת להכתמה ברורה, ומאפשרת זיהוי קל של קשירת נוגדנים בהשוואה לאות רקע כאשר נעשה שימוש בנוגדנים לא מאומתים. בחירה מקבעת, שליפת אנטיגן ודילול נוגדנים יכולים להשפיע על הספציפיות של הנוגדן. אנו ממליצים לחוקרים להעריך בזהירות ולייעל את הפרוטוקול על ידי התאמת הקיבוע, שליפת האנטיגן וזמן הדגירה עבור כל נוגדן. כדי להשיג את התוצאות הטובות ביותר, יש לבדוק נוגדנים בדילולים שונים כדי לקבוע ריכוז אופטימלי ובמאגרי שליפת אנטיגן שונים. שליפת אפיטופים משפרת את ההכתמה החיסונית על ידי שבירת גשרי מתילן שנוצרו במהלך הקיבוע. בפרוטוקול זה, נעשה שימוש בשליפת אפיטופים הנגרמת על ידי חום ולא בשליפת אפיטופים הנגרמת על ידי פרוטאוליטים, מכיוון שעיכול אנזים סביר יותר לשבש את מורפולוגיה של רקמות28. מאגרי שליפת האפיטופים הנפוצים ביותר הנגרמים על ידי חום הם חוצץ ציטראט, tris-HCl ו- tris-EDTA, כאשר חיץ ציטראט הוא העדין ביותר במורפולוגיית רקמות29. בחירת החיץ משתנה ויש לקבוע אותה עבור כל נוגדן. מאגרי אחזור אנטיגן רבים, פתרונות חסימה ודילולי נוגדנים זמינים באופן מסחרי. עם זאת, פתרונות אלה יכולים להיות יקרים מאוד וחסכוניים. סיפקנו מתכונים של פתרונות נפוצים לשליפת אנטיגן ופתרונות חסימה ודילול נוגדנים כדי להבטיח כדאיות כלכלית.
מגבלה של שיטה זו היא שקיבוע ועיבוד יכולים לשנות אפיטופים של רקמות ומסכות. גישה חלופית היא immunostain רקמה קפואה טרייה. רקמה קפואה טרייה מוקפאת, ומאפשרת הימנעות מחשיפה לחומרים רעילים, שימור מבנה החלבונים ושיפור הנגישות של חלק מהאפיטופים. עם זאת, ארכיטקטורת הרקמה והמורפולוגיה גרועות יותר מאלה של רקמה קבועה ומשובצת פרפין. אתגרים נוספים של רקמות קפואות טריות כוללים את החומרים והלוגיסטיקה הנדרשים כדי לחתוך ולאחסן בלוקים ומגלשות קפואים. ניתוח של לחמניות שוויצריות לעומת רצועות של רקמת מעי מראה הבדלים בגובה וברוחב הווילי והבדלים בתאי החיסון בלמינה פרופריה, כפי שתואר בדו"ח מוקדם יותר30. תוצאות אלה מצביעות על כך שלחמניות שוויצריות במעיים משנות כמה תכונות מעיים, שיש לקחת בחשבון בעת תכנון ניסויים. בנוסף, נדרש אימות מחדש של נוגדנים מכיוון שנוגדנים רבים הנקשרים במיוחד לרקמה משובצת פרפין קבועה פורמלין אינם מכתימים היטב ברקמה קפואה טרייה31.
ניתן להשתמש ב-immunostaining של רקמת המעי כדי לענות על מגוון רחב של שאלות בנוגע לביולוגיה ופיזיולוגיה של תאי מערכת העיכול. טכניקה זו נמצאת בשימוש נרחב כדי לזהות שינויים אפיתל הגדרת דלקת מעיים, בעקבות זיהום חיידקי, ובמהלך התקדמות סרטן. השיטה המוצגת כאן אידיאלית לשימור רקמת המעי מכיוון שהיא חסכונית, לא מאתגרת מבחינה טכנית, וניתנת לשחזור ברמה גבוהה. כדי להבטיח את התוצאות הטובות ביותר, אנו מעודדים אופטימיזציה של השלבים המתוארים בפרוטוקול זה בהתבסס על תכנון הניסוי וההשערה הנבדקת.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
מחקר זה נתמך על ידי המכונים הלאומיים לבריאות (NIH) מענקי K01 DK121869 ל- ACE ופרסום זה נתמך בחלקו על ידי T32 GM132055 (RME), F31 DK139736 (SAD), T32 DK124191 (SAD), TL1 TR001451 (RS), UL1 TR001450 (RS) ומענקי אבן הפינה של HCS ל- SAD &; RS. עבודה זו נתמכה על ידי קרנות סטארט-אפ מהאוניברסיטה הרפואית של דרום קרוליינה (MUSC) ל-ACE ונתמכה על ידי MUSC Digestive Disease Research Core Center (P30 DK123704) ו-COBRE in Digestive and Liver Disease (P20 GM120475). ההדמיה בוצעה באמצעות ליבת התא וההדמיה המולקולרית ב-MUSC.
Materials
| Name | Company | Catalog Number | Comments |
| β-CATENIN | GeneTex | GTX101435 | |
| Cellulose filter paper | Cytiva | 10427804 | Thick Whatman paper |
| Charged glass slides | Thermo Fisher Scientific | 23888114 | |
| Coverslip | Epredia | 152440 | |
| Dissecting pins size 00 | Phusis | B082DH4TZF | |
| E-CADHERIN | R&D Systems | AF748 | |
| Freezer gloves | Tempshield | UX-09113-02 | |
| Heating block | Premiere | XH-2001 | Slide Warmer |
| Histo-Clear II | Electron Microscopy Sciences | 64111-04 | Clearing reagent |
| Hoescht | Thermo Fisher Scientific | 62249 | |
| Hydrochloric Acid | Sigma Aldrich | 320331 | |
| Hydrophobic pen | Millipore | 402176 | |
| LAMININ | GeneTex | GTX27463 | |
| LAMP1 | Santa Cruz | SC-19992 | |
| Large cassettes | Tissue-Tek | 4173 | |
| Minutien pins | Fine Science Tools | NC9679721 | |
| Mouse-on-mouse blocking reagent | Vector Laboratories | MKB-2213 | Mouse-on-mouse block |
| MUC2 | GeneTex | GTX100664 | |
| PCNA | Cell Signaling Technology | 2586S | |
| Pressure Cooker | Cuisinart | B000MPA044 | |
| ProLong gold antifade | Thermo Fisher Scientific | P36934 | Mounting medium |
| Reverse action forceps | Dumont | 5748 | |
| Slide Rack | Tissue-Tek | 62543-06 | |
| Slide Staining Set | Tissue-Tek | 62540-01 | Solvent Resistant Dishes and Metal Frame |
| Small cassettes | Fisherbrand | 15-200-403B | |
| Sodium citrate dihydrate | Fisher Bioreagents | BP327-1 | |
| Teleostein Gelatin | Sigma | G7765 | Blocking buffer |
| Triton X-100 | Thermo Fisher Scientific | A16046 | |
| Tween 20 | Thermo Fisher Scientific | J20605-AP | |
| Wipes | KimTech | 34155 | |
| Xylenes | Fisher Chemical | 1330-20-7 | |
| γ-ACTIN | Santa Cruz | SC-65638 |
References
- Louvard, D., Kedinger, M., Hauri, H. P. The differentiating intestinal epithelial cell: Establishment and maintenance of functions through interactions between cellular structures. Annu Rev Cell Biol. 8, 157-195 (1992).
- Rieger, J., Pelckmann, L. M., Drewes, B. . Animal models of allergic disease: Methods and protocols. , (2021).
- Webster, J. D., Miller, M. A., Dusold, D., Ramos-Vara, J. Effects of prolonged formalin fixation on the immunohistochemical detection of infectious agents in formalin-fixed, paraffin-embedded tissues. Vet Pathol. 47 (3), 529-535 (2010).
- Hayashi, Y., Koike, M., Matsutani, M., Hoshino, T. Effects of fixation time and enzymatic digestion on immunohistochemical demonstration of bromodeoxyuridine in formalin-fixed, paraffin-embedded tissue. J Histochem Cytochemis. 36 (5), 511-514 (1988).
- Werner, M., Chott, A., Fabiano, A., Battifora, H. Effect of formalin tissue fixation and processing on immunohistochemistry. Am J Surg Pathol. 24 (7), 1016-1019 (2000).
- Scalia, C. R., et al. Antigen masking during fixation and embedding, dissected. J Histochem Cytochem. 65 (1), 5-20 (2017).
- Masood, S., Von Wasielewski, R., Mengel, M., Nolte, M., Werner, M. Influence of fixation, antibody clones, and signal amplification on steroid receptor analysis. Breast J. 4 (1), 33-40 (1998).
- Moolenbeek, C., Ruitenberg, E. J. The "swiss roll": A simple technique for histological studies of the rodent intestine. Lab Anim. 15 (1), 57-59 (1981).
- Casteleyn, C., Rekecki, A., Van Der Aa, A., Simoens, P., Van Den Broeck, W. Surface area assessment of the murine intestinal tract as a prerequisite for oral dose translation from mouse to man. Lab Animals. 44 (3), 176-183 (2010).
- Lunnemann, H. M., et al. Cecum axis (cecax) preservation reveals physiological and pathological gradients in mouse gastrointestinal epithelium. Gut Microbes. 15 (1), 2185029 (2023).
- Qin, C., et al. The cutting and floating method for paraffin-embedded tissue for sectioning. J Vis Exp. (139), e58288 (2018).
- Feldman, A. T., Wolfe, D. . Histopathology: Methods and protocols. , (2014).
- Yang, W. H., et al. Innate mechanism of mucosal barrier erosion in the pathogenesis of acquired colitis. iScience. 26 (10), 107883 (2023).
- Dooley, S. A., et al. Myosin 5b is required for proper localization of the intermicrovillar adhesion complex in the intestinal brush border. Am J Physiol Gastrointest Liver Physiol. 323 (5), G501-G510 (2022).
- Danan, C. H., et al. Intestinal transit amplifying cells require mettl3 for growth factor signaling, kras expression, and cell survival. bioRxiv. , (2023).
- Han, B., Qi, S., Hu, B., Luo, H., Wu, J. Tgf-beta i promotes islet beta-cell function and regeneration. J Immunol. 186 (10), 5833-5844 (2011).
- Chen, L. C., Wang, H. W., Huang, C. C. Modulation of inherent niches in 3d multicellular msc spheroids reconfigures metabolism and enhances therapeutic potential. Cells. 10 (10), 2747 (2021).
- Fang, Y., et al. Cd36 inhibits beta-catenin/c-myc-mediated glycolysis through ubiquitination of gpc4 to repress colorectal tumorigenesis. Nat Commun. 10 (1), 3981 (2019).
- Whittem, C. G., Williams, A. D., Williams, C. S. Murine colitis modeling using dextran sulfate sodium (dss). J Vis Exp. (35), e1652 (2010).
- Bialkowska, A. B., Ghaleb, A. M., Nandan, M. O., Yang, V. W. Improved swiss-rolling technique for intestinal tissue preparation for immunohistochemical and immunofluorescent analyses. J Vis Exp. (113), e54161 (2016).
- Le Naour, J., et al. Improved swiss-rolling method for histological analyses of colon tissue. MethodsX. 9, 101630 (2022).
- Cardiff, R. D., Miller, C. H., Munn, R. J. Mouse tissue fixation. Cold Spring Harb Protoc. 2014 (5), 073403 (2014).
- Pereira E Silva, A., Lourenço, A. L., Marmello, B. O., Bitteti, M., Teixeira, G. a. P. B. Comparison of two techniques for a comprehensive gut histopathological analysis: Swiss roll versus intestine strips. Exp Mol Pathol. 111, 104302 (2019).
- Williams, J. M., Duckworth, C. A., Vowell, K., Burkitt, M. D., Pritchard, D. M. Intestinal preparation techniques for histological analysis in the mouse. Curr Prot Mouse Biol. 6 (2), 148-168 (2016).
- Boenisch, T. Effect of heat-induced antigen retrieval following inconsistent formalin fixation. Appl Immunohistochem Mol Morphol. 13 (3), 283-286 (2005).
- Hasegawa, Y., Mark Welch, J. L., Rossetti, B. J., Borisy, G. G. Preservation of three-dimensional spatial structure in the gut microbiome. PLoS One. 12 (11), e0188257 (2017).
- Garabedian, E. M., Roberts, L. J., Mcnevin, M. S., Gordon, J. I. Examining the role of paneth cells in the small intestine by lineage ablation in transgenic mice. J Biol Chem. 272 (38), 23729-23740 (1997).
- Moshi, J. M., Ummelen, M., Broers, J. L. V., Ramaekers, F. C. S., Hopman, A. H. N. Impact of antigen retrieval protocols on the immunohistochemical detection of epigenetic DNA modifications. Histochem Cell Biol. 159 (6), 513-526 (2023).
- Krenacs, L., Krenacs, T., Stelkovics, E., Raffeld, M. Heat-induced antigen retrieval for immunohistochemical reactions in routinely processed paraffin sections. Methods Mol Biol. 588, 103-119 (2010).
- Pereira, E. S. A., Lourenco, A. L., Marmello, B. O., Bitteti, M., Teixeira, G. Comparison of two techniques for a comprehensive gut histopathological analysis: Swiss roll versus intestine strips. Exp Mol Pathol. 111, 104302 (2019).
- Bolognesi, M. a. O., et al. Antibodies validated for routinely processed tissues stain frozen sections unpredictably. Bio Techniques. 3 (3), 137-148 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved