Method Article
Optimiertes Protokoll für intestinale Swiss Rolls und Immunfluoreszenzfärbung von in Paraffin eingebettetem Gewebe
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Der Darm ist wichtig für die Verdauung und Resorption. Jede Region - Duodenum, Jejunum, Ileum, Dickdarm - erfüllt aufgrund einzigartiger zellulärer Strukturen unterschiedliche Funktionen. Das Studium der Darmphysiologie erfordert eine sorgfältige Gewebeanalyse. Dieses Protokoll beschreibt die Gewebefixierung und -verarbeitung mit der Swiss-Roll-Technik, um eine genaue Immunfärbung durch die richtige Gewebekonservierung und -ausrichtung zu gewährleisten.
Zusammenfassung
Der Darm ist ein komplexes Organ, das sich aus dem Dünn- und dem Dickdarm zusammensetzt. Der Dünndarm kann weiter in Duodenum, Jejunum und Ileum unterteilt werden. Jede anatomische Region des Darms hat eine einzigartige Funktion, die sich in Unterschieden in der Zellstruktur widerspiegelt. Um Veränderungen im Darm zu untersuchen, bedarf es einer vertieften Analyse verschiedener Geweberegionen und zellulärer Veränderungen. Um den Darm zu untersuchen und große Gewebestücke sichtbar zu machen, verwenden Forscher häufig eine Technik, die als Darmrollen bekannt ist. Bei dieser Technik wird der Darm in jede anatomische Region unterteilt und in einer flachen Ausrichtung fixiert. Anschließend wird das Gewebe sorgfältig gerollt und für die Paraffineinbettung verarbeitet. Die richtige Fixierung und Ausrichtung des Gewebes ist eine oft übersehene Labortechnik, die jedoch für die nachgelagerte Analyse von entscheidender Bedeutung ist. Darüber hinaus kann ein unsachgemäßes Rollen des Darmgewebes das empfindliche Darmepithel schädigen, was zu einer schlechten Gewebequalität für die Immunfärbung führt. Die Sicherstellung eines gut fixierten und richtig ausgerichteten Gewebes mit intakten Zellstrukturen ist ein entscheidender Schritt, um eine optimale Visualisierung der Darmzellen zu gewährleisten. Wir stellen eine kostengünstige und einfache Methode zur Herstellung von Schweizer Rollen vor, bei der alle Teile des Darms in einem einzigen, in Paraffin eingebetteten Block enthalten sind. Wir beschreiben auch eine optimierte Immunfluoreszenzfärbung von Darmgewebe, um verschiedene Aspekte des Darmepithels zu untersuchen. Das folgende Protokoll bietet Forschern einen umfassenden Leitfaden zur Gewinnung hochwertiger Immunfluoreszenzbilder durch Fixierung des Darmgewebes, Swiss-Roll-Technik und Immunfärbung. Die Anwendung dieser verfeinerten Ansätze bewahrt die komplizierte Morphologie des Darmepithels und fördert ein tieferes Verständnis der Darmphysiologie und Pathobiologie.
Einleitung
Die zelluläre Architektur des Darms stellt eine einzigartige Herausforderung für die Aufrechterhaltung seiner strukturellen Integrität dar, wenn Darmgewebe für die Immunfärbung konserviert wird. Der Dünndarm besteht aus länglichen, fingerartigen Strukturen, die als Zotten1 bekannt sind. Diese Zotten werden während der Einbettungsprozesse oft missgebildet. Für eine robuste experimentelleAnalyse ist es von entscheidender Bedeutung, sicherzustellen, dass die Forscher über Techniken zur korrekten Einbettung des Darms verfügen, um Querschnitte zu erzielen, die eine Visualisierung aller Regionen des Darms sowie der Schichten, aus denen der Darm besteht (d. h. Muscularis propria, Mukosa und die Serosa), ermöglichen. Eine unzureichende Fixierung, eine übermäßige Fixierung und eine unsachgemäße Handhabung des Gewebes beeinträchtigen die Integrität des Gewebes, was zu einer unbeabsichtigten Schädigung des Darmepithels führt 3,4. Eine Schädigung des Darmepithels während dieser Schritte kann die Qualität nachfolgender Analysen, wie z. B. der Immunfluoreszenz, erheblich beeinträchtigen, unabhängig von der Wirksamkeit der immunhistochemischen Protokolle und der verwendeten Antikörper.
Die Immunfärbung ist, wie die richtige Gewebefixierung, ein wichtiger Bestandteil der biomedizinischen Forschung. Wenn sie gut gemacht wird, kann die Immunfärbung bisher unbekannte Aspekte der Zellstruktur und -funktion beleuchten. Die Immunfluoreszenzfärbung von Paraffinschnitten kann aufgrund physikalisch-chemischer Modifikationen, die sich aus dem Fixierungs- und Paraffineinbettungsprozess ergeben, eine Herausforderung darstellen5. Die Fixierung und Paraffineinbettung führt zu einer Antigenmaskierung, die die Immunfluoreszenzdetektion von Epitopen von Interesse beeinträchtigen kann6. Eine verzögerte Fixierung kann zu einer proteolytischen Degradation führen, was zu einer geschwächten oder fehlenden Färbung kritischer Epitope führt7. Darüber hinaus sind Antikörper bei hohen Hintergrundwerten oft ungenau. Immunfärbeprotokolle, die eine konsistente und spezifische Antikörperbindung und ein hohes Signal-Rausch-Verhältnis fördern, können wertvolle Informationen für Forscher liefern.
Hier stellen wir ein umfassendes Protokoll zur Verfügung, das entwickelt wurde, um qualitativ hochwertige Immunfluoreszenzbilder durch Fixierung des Darmgewebes, Schweizer Rollenvorbereitung8 und Immunfärbung zu erhalten. Das Protokoll legt den Schwerpunkt auf Richtlinien zur Erhaltung der Integrität des Darms und zielt darauf ab, den Forschern eine robuste Methodik an die Hand zu geben, um die Qualität und Zuverlässigkeit von Immunfluoreszenz-Bildgebungsstudien zu verbessern. Wir haben auch versucht, kostengünstige Ressourcen zu verwenden, darunter Filterpapier und hausgemachte Antigengewinnung, Blockierungslösungen und Antikörperverdünnungsmittel, um das Protokoll für Labore zugänglicher zu machen, die möglicherweise nur über begrenzte Mittel verfügen. Wie bei allen experimentellen Protokollen sollten Forscher das aktuelle Protokoll auf der Grundlage ihres experimentellen Ansatzes und ihrer Interessengebiete optimieren.
Protokoll
Das Institutional Animal Care and Use Committee der Medical University of South Carolina genehmigte die gesamte Pflege, Wartung und Behandlung von Tieren. Darmgewebe wurde von adulten C57BL/6J-Mäusen (Männchen und Weibchen im Alter von 3-5 Monaten, mit einem Gewicht von etwa 30 g) für die Verwendung in der vorliegenden Studie entnommen.
1. Fixierung des Darmgewebes
- Präparieren Sie vorsichtig den gesamten Darm einer euthanasierten Maus und legen Sie ihn in ein Waagschen oder eine Petrischale, die phosphatgepufferte Kochsalzlösung (PBS) enthält.
- Entferne den Darm aus dem PBS und entferne mit einer Schere sanft überschüssiges Fett und Bindegewebe. Das Schneiden des Bindegewebes hilft dabei, dass das Gewebe in den nachfolgenden Schritten flach liegt.
- Teilen Sie den Darm mit einer Schere in einzelne Segmente auf (z. B. Zwölffingerdarm, Jejunum, Ileum, Blinddarm und Dickdarm). Unterteilen Sie die Segmente nach anatomischen Merkmalen und/oder Länge, wobei etwa 13 % der Darmlänge auf den Zwölffingerdarm, 58 % auf das Jejunum, 8 % auf das Ileum, 6 % auf den Blinddarm und 15 % auf den Dickdarm entfallen9. Der Zwölffingerdarm folgt dem Magen, und das Ileum ist der terminale Abschnitt des Dünndarms unmittelbar vor dem Blinddarm.
- Befreie den Dickdarm, indem du mit einer Schere die Stelle schneidest, an der er mit dem Blinddarm zusammentrifft. Legen Sie den Zwölffingerdarm, das Jejunum, das Ileum und den Dickdarm in das Waagschen oder die Petrischale von PBS. Entsorgen Sie den Blinddarm oder reparieren Sie ihn nach anderen veröffentlichten Methoden10.
- Befestigen Sie eine P200-Pipettenspitze an einer 10-ml-Spritze, indem Sie das große Ende der Spitze mit einer Rasierklinge abschneiden. Füllen Sie die Spritze mit PBS.
- Führen Sie die Spritzenspitze mit einer Pinzette in die Öffnung eines Darmabschnitts ein. Halten Sie den Darmabschnitt mit der Pinzette auf der Spritze und spülen Sie ihn vorsichtig mit einer Geschwindigkeit von ~50 μL/s, um den Darminhalt zu entfernen. Sammeln Sie den Darminhalt in einem leeren Waagschiffchen oder einer Petrischale.
- Legen Sie das nasse Darmsegment in einer geraden Linie auf einen Streifen trocken etikettiertes Zellulose-Filterpapier (siehe Materialtabelle). Stellen Sie sicher, dass das Darmsegment feucht genug ist, um richtig auf dem trockenen Filterpapier zu haften. Beschriften Sie das Filterpapier mit einem Bleistift mit den Informationen für Mauszahl, Genotyp, Versuchsgruppe usw.
HINWEIS: Die Verwendung eines Stifts zum Beschriften des Filterpapiers kann zum Verlust der Etiketten während der Fixierung führen. - Schneiden Sie den Darm mit einer Präparierschere längs entlang der Mesenteriallinie auf. Schneiden Sie jeweils ~5 mm und legen Sie das geschnittene Gewebe mit der Unterkante der Schere oder einer Pinzette flach auf das Filterpapier. Fahren Sie fort, bis der gesamte Abschnitt des Darms abgeschnitten und flach auf das Filterpapier gelegt ist. Achten Sie darauf, den Darm so gerade wie möglich aufzuschneiden, da dies das Rollen des Gewebes erleichtert.
HINWEIS: Bei diesem Schritt kann eine Kugelschere verwendet werden, um Gewebeschäden zu vermeiden. - Legen Sie ein weiteres Stück Filterpapier auf das Darmsegment. Stellen Sie sicher, dass das Filterpapier das Darmsegment umschließt und verhindert, dass sich der Darm während der Fixierung kräuselt oder seine abgeflachte Form verliert.
- Tackern Sie die Kanten des Filterpapiers ab, um das Taschentuch an Ort und Stelle zu halten. Tackern Sie das Taschentuch nicht ab. Legen Sie genügend Klammern um das Taschentuch, um zu verhindern, dass sich das Taschentuch beim Fixieren vom Filterpapier löst.
- Wiederholen Sie die Schritte 1.5-1.10 für jedes der Darmsegmente (Zwölffingerdarm, Jejunum, Ileum und Dickdarm).
- Tauchen Sie das Gewebe über Nacht bei 4 °C in 10 % normales gepuffertes Formalin (oder ein Fixiermittel nach Wahl wie 4 % Paraformaldehyd, Carnoy-Fixiermittel usw.).
ACHTUNG: Stellen Sie sicher, dass die richtige persönliche Schutzausrüstung getragen wird, da Fixiermittel wie Formalin giftig sind.
2. Rollen und Verarbeitung von Darmgewebe
ACHTUNG: Führen Sie die Schritte 2.1-2.6 in einer belüfteten Haube durch.
- Entferne vorsichtig das obere Stück Filterpapier (dasjenige, das die luminale Seite des Darms berührt). Ziehe den Darm mit einer Pinzette vorsichtig vom unteren Stück Filterpapier ab. Entsorgen Sie das Filterpapier.
- Füllen Sie drei Wiegeboote mit PBS. Waschen Sie das Tuch in PBS 3x, um Formalin aus dem Gewebe zu entfernen.
- Nehmen Sie mit einer umgekehrten Pinzette (siehe Materialtabelle) ein Stück Darm entlang der kurzen Kante auf, wobei die luminale Seite nach oben zeigt. Drehen Sie die Pinzette, um das Gewebe zu rollen. Verwende eine normale Pinzette, um das Gewebe beim Rollen zu führen. Wenn das Taschentuch gefaltet wird, rollen Sie es ab und versuchen Sie es erneut.
- Legen Sie das Taschentuch in ein trockenes Waagschiffchen oder eine Petrischale. Halten Sie das Gewebe mit einer Pinzette in einer Hand an Ort und Stelle. Öffnen Sie vorsichtig die umgekehrte Pinzette und lassen Sie das Gewebe los, indem Sie die anderen Pinzetten verwenden, um das Gewebe von der umgekehrten Pinzette zu lösen.
- Führen Sie einen Präparierstift der Größe 00 oder einen winzigen Stift in das Gewebe ein (siehe Materialtabelle). Verwenden Sie einen Drahtschneider, um die scharfe Spitze des Stifts zu entfernen. Legen Sie das Taschentuch in eine große Kassette und legen Sie die Kassette dann in einen Behälter mit 70 % Ethanol, bis sie zur Verarbeitung bereit ist.
- Wiederholen Sie die Schritte 2.1-2.5 mit allen Darmsegmenten (Zwölffingerdarm, Jejunum, Ileum und Dickdarm) und legen Sie alle vier Geweberollen in dieselbe große Kassette (siehe Materialtabelle). Stellen Sie sicher, dass die Kassette mit einem Bleistift beschriftet ist, um zu verhindern, dass das Etikett in den Ethanol- und Xylollösungen (siehe Materialtabelle) abgewaschen wird.
- Sobald alle Proben gerollt sind, geben Sie die Proben in einen Tissue-Prozessor. Verwenden Sie die folgenden Einstellungen für das Darmgewebe: 70% Ethanol für 35 Minuten; 90% Ethanol für 35 min; 95% Ethanol für 35 min; 100% Ethanol für 35 min, 3x; Xylol für 35 min, 3x; Paraffin für 60 min, 3x. Die Kassetten können über einen längeren Zeitraum in geschmolzenem Paraffinwachs belassen werden.
ACHTUNG: Stellen Sie sicher, dass die richtige Schutzausrüstung getragen wird, da Xylol eine giftige Chemikalie ist.
3. Einbettung des Darmgewebes
- Heizen Sie große Einbettformen vor, um das Paraffin geschmolzen zu halten.
- Nehmen Sie die Kassetten aus dem Tissue-Prozessor und legen Sie sie in ein Becherglas mit geschmolzenem Paraffin.
- Geben Sie an einer Einbettstation eine kleine Menge Paraffin in eine Form. Nehmen Sie die vier Schweizer Rollen aus der Kassette und legen Sie sie alle so flach wie möglich in eine Form. Füge mehr Paraffin hinzu, um die Form zu füllen.
- Schieben Sie die Form auf die Kühlplatte und stellen Sie sicher, dass alle Schweizer Rollen flach auf dem Boden der Form liegen. Legen Sie einen beschrifteten kleinen Kassettendeckel (siehe Materialtabelle) auf die Form und fügen Sie bei Bedarf mehr Paraffin hinzu.
- Sobald das Wachs erstarrt ist, entferne den Block aus der Form. Das Gewebe ist nun bereit, in 5-μm-Scheiben geschnitten und für die Immunfärbung auf geladene Glasobjektträger aufgewirbelt zu werden11.
4. Gewebeadhärenz und Vorbereitung des Objektträgers
- Um sicherzustellen, dass der vorbereitete 5 μm Paraffingewebeschnitt auf dem Objektträger haftet, erhitzen Sie die Objektträger auf einem Objektträgerwärmer oder Heizblock auf 60 °C für 15-30 min. Die Rutschen können auch länger beheizt werden; Dieser Schritt ist nicht zeitkritisch.
- Lassen Sie die Dias auf Raumtemperatur abkühlen (~15 min).
5. Entparaffinisierung
- Wenn Sie mit der Entparaffinisierung der Objektträger beginnen, stellen Sie sicher, dass das Gewebe während des gesamten Verlaufs der Immunfärbung in einer Lösung verbleibt und nicht austrocknet.
- Verwenden Sie ein Objektträgergestell (siehe Materialtabelle), um die Objektträger zu halten, und legen Sie sie in eine lösungsmittelbeständige Schale (siehe Materialtabelle), die mit einem Reinigungs-/Entparaffinisierungsreagenz gefüllt ist (siehe Materialtabelle). Stellen Sie sicher, dass das Reagenz das Gewebe auf jedem Objektträger vollständig bedeckt. Bevor Sie die Objektträger vollständig in das Clearing-Reagenz eintauchen, tauchen oder stoßen Sie das Objektträgergestell mehrmals in die Clearing-Lösung. Lassen Sie die Objektträger 10 Minuten oder länger unter Wasser.
HINWEIS: Dieser Schritt muss je nach gewähltem Klärmittel aufgrund gefährlicher Dämpfe möglicherweise in einer belüfteten Haube durchgeführt werden. Die Entparaffinisierung des Gewebes ist in diesem Schritt nicht zeitkritisch, wenn ein ungiftiges Klärmittel verwendet wird. - Entfernen Sie das Objektträgergestell und rühren Sie es, um überschüssiges Reinigungsreagenz zu entfernen. In einer neuen lösungsmittelbeständigen Schale Schritt 5.2 wiederholen.
- In einer neuen lösungsmittelbeständigen Schale Schritt 5.3 wiederholen. Lassen Sie die Objektträger 15 Minuten oder länger unter Wasser. Dieser Schritt ist nicht zeitkritisch.
6. Rehydrierung
- Entfernen Sie das Objektträgergestell und rühren Sie es, um überschüssiges Reinigungsreagenz zu entfernen. Tauchen oder stoßen Sie den Objektträger mehrmals in eine neue, lösungsmittelbeständige Schale, die mit 100 % Ethanol gefüllt ist, und lassen Sie die Objektträger 5 Minuten lang eintauchen. Dieser Schritt ist zeitkritisch. 2x wiederholen.
- Entfernen Sie das Schiebegestell und rühren Sie es, um überschüssiges 100%iges Ethanol zu entfernen. Tauchen oder stoßen Sie den Objektträger mehrmals in eine neue, lösungsmittelbeständige Schale, die mit 95 % Ethanol gefüllt ist, und lassen Sie die Objektträger 5 Minuten lang eintauchen. Dieser Schritt ist zeitkritisch. 1x wiederholen.
- Entfernen Sie das Schiebegestell und rühren Sie es, um überschüssiges 95%iges Ethanol zu entfernen. Tauchen oder stoßen Sie den Objektträger mehrmals in eine neue, lösungsmittelbeständige Schale, die mit 70 % Ethanol gefüllt ist, und lassen Sie die Objektträger 5 Minuten lang eintauchen. Dieser Schritt ist zeitkritisch.
- Entfernen Sie das Schiebegestell und rühren Sie es um, um überschüssiges 70%iges Ethanol zu entfernen. Tauchen oder stoßen Sie den Objektträger mehrmals in eine neue, lösungsmittelbeständige Schale, die mit 50 % Ethanol gefüllt ist, und lassen Sie die Objektträger 5 Minuten lang eintauchen. Dieser Schritt ist zeitkritisch.
- Entfernen Sie das Schiebegestell und rühren Sie es um, um überschüssiges 50%iges Ethanol zu entfernen. Tauchen oder stoßen Sie den Objektträger mehrmals in eine neue, lösungsmittelbeständige Schale, die mit deionisiertem (DI) Wasser gefüllt ist, und lassen Sie die Objektträger 5 Minuten lang eintauchen. Dieser Schritt ist zeitkritisch.
- Um hier eine Pause einzulegen, legen Sie die Objektträger in einen Behälter mit PBS, bis die Immunfärbung nach dem 5-minütigen Wasserrehydratisierungsschritt fortgesetzt werden kann.
7. Antigen-Rückgewinnung
- Füllen Sie eine neue lösungsmittelbeständige Schale mit einem geeigneten Antigen-Retrieval-Puffer. Übertragen Sie das Objektträgergestell direkt in diese Lösung. Stellen Sie sicher, dass die Objektträger vollständig in die Antigen-Entnahmelösung eingetaucht sind und das Gewebe vollständig bedeckt.
HINWEIS: Die optimalen Lösungen zur Antigengewinnung können je nach verwendetem Antikörper variieren. Die für einzelne Antikörper erforderliche Antigen-Entnahme muss möglicherweise vom Forscher festgelegt werden.- Um 1x Citrat-Antigen-Retrieval-Puffer herzustellen, fügen Sie 2,94 g Natriumcitrat-Dihydrat (siehe Materialtabelle) pro 1 l deionisiertes Wasser hinzu. Sobald das Natriumcitrat-Dihydrat aufgelöst ist, fügen Sie Chlorwasserstoff hinzu (siehe Materialtabelle), bis die Lösung einen pH-Wert von 6 erreicht. Zum Schluss fügen Sie 500 μl Tween20 (siehe Materialtabelle) pro 1 l deionisiertes Wasser hinzu.
- Um 1x Tris-EDTA-Antigen-Retrieval-Puffer herzustellen, fügen Sie 1,211 g Tris Base und 0,292 g EDTA in 1 L deionisiertes Wasser hinzu. Sobald es aufgelöst ist, stellen Sie es auf pH 9 ein.
- Decken Sie die lösungsmittelbeständige Schale mit der Antigen-Rückgewinnungslösung und den Objektträgern mit einem Deckel ab und sichern Sie den Deckel mit Gummibändern.
- Stellen Sie die sichere, lösungsmittelbeständige Schüssel in einem Schnellkochtopf (siehe Materialtabelle) auf den Metallrost oder Untersetzer. Stellen Sie sicher, dass sich genügend Wasser im Schnellkochtopf befindet, um das Metallgestell oder den Untersetzer zu erreichen, damit sich Druck aufbauen kann.
- Setze den Deckel auf den Schnellkochtopf und drehe ihn im Uhrzeigersinn, um ihn zu verriegeln. Drehen Sie das Druckbegrenzungsventil, das sich auf dem Deckel befindet, auf die Druckeinstellung.
- Wählen Sie in der Menüeinstellung den Schnellkochtopf mit hohem Druck und dann unter der Zeiteinstellung den Schnellkochtopf auf 30 Minuten ein. Wählen Sie Start.
- Nach 30 Minuten piept der Schnellkochtopf und stellt sich automatisch auf die Warmhalteeinstellung. Warten Sie, bis sich der Druck auf natürliche Weise gelöst hat und sich der Deckel frei abschrauben lässt.
- Verwenden Sie hitzebeständige Handschuhe (siehe Materialtabelle), um die lösungsmittelbeständige Schale aus dem Schnellkochtopf zu nehmen und das Gummiband und den Deckel zu entfernen. Stellen Sie die Schale für ~30 Minuten in ein Eisbad, damit die Objektträger auf Raumtemperatur abkühlen können. Dieser Schritt ist nicht zeitkritisch.
- Nach dem Abkühlen auf Raumtemperatur nehmen Sie den Objektträger aus der lösungsmittelbeständigen Schale und legen Sie ihn in eine neue, lösungsmittelbeständige Schale, die mit DI-Wasser gefüllt ist, um die restliche Antigen-Rückhollösung zu entfernen. Stellen Sie sicher, dass die Folien vollständig untergetaucht sind.
- Nehmen Sie den Schieber aus dem DI-Wasser und legen Sie ihn für 5 Minuten in eine neue, lösungsmittelbeständige Schale, die mit PBS gefüllt ist. Stellen Sie sicher, dass die Folien vollständig untergetaucht sind. Dieser Schritt ist nicht zeitkritisch.
8. Blockieren von unspezifischen Hintergrundflecken
- Bereiten Sie eine befeuchtete Kammer vor, indem Sie eine große Objektträgerbox nehmen und die am Deckel haftende Pappabdeckung entfernen. Legen Sie an den Boden der Schiebebox feuchte Papiertücher senkrecht nach unten. Stellen Sie sicher, dass die feuchten Papiertücher flach liegen.
- Entnehmen Sie eine Folie nacheinander aus dem in PBS getauchten Folienhalter. Wischen Sie überschüssiges PBS auf dem Objektträger vorsichtig ab und vermeiden Sie dabei das Gewebe.
- Bilden Sie mit einem hydrophoben Stift (siehe Materialtabelle) eine Barriere, die das Gewebe umgibt, indem Sie mit dem hydrophoben Stift einen Kasten um das Gewebe ziehen. Achten Sie darauf, das Taschentuch zu meiden und den hydrophoben Stift nicht zu nah am Taschentuch zu verwenden.
- Lege die umrandete Folie waagerecht über die feuchten Papiertücher. Fügen Sie Blockierungspuffer hinzu, um das Gewebe (~100 μL) abzudecken.
- Um einen Blockierungspuffer herzustellen, fügen Sie 100 μl Kaltwasser-Fischhautgelatine (Teleostein-Gelatine; siehe Materialtabelle) zu 9,85 ml PBS hinzu. Zum Schluss 50 μl 20 % Triton X-100 (siehe Materialtabelle) hinzufügen und mischen, bis es sich aufgelöst hat.
- Wiederholen Sie die Schritte 8.2 bis 8.4 für jede Folie. Schließen Sie die Befeuchtungskammer und inkubieren Sie die Objektträger 90 Minuten lang bei Raumtemperatur.
9. Blockieren von Maus auf Maus
- Wenn Sie einen primären Maus-Antikörper zur Immunfärbung von Mausgewebe verwenden, führen Sie einen zusätzlichen Blockierungsschritt durch. Maus-auf-Maus-Blockierungsreagenzien (Maus-auf-Maus-Block; siehe Materialtabelle) sind im Handel erhältlich; Befolgen Sie die kommerziellen Anweisungen, wenn Sie den Maus-auf-Maus-Block vorbereiten.
- Klopfen Sie die Blockierungslösung vorsichtig ab und fügen Sie sofort den vorbereiteten Maus-auf-Maus-Block hinzu, um das Gewebe (~100 μL) zu bedecken. Wiederholen Sie den Vorgang für jeden Objektträger, der Mausgewebe enthält und mit einem primären Antikörper gefärbt wird, der in Mäusen gezüchtet wurde.
- Inkubieren Sie die Gewebeschnitte in der befeuchteten Kammerbox bei Raumtemperatur für 15 min.
- Nehmen Sie die Objektträger aus der befeuchteten Kammer und legen Sie sie direkt in ein in PBS getauchtes Objektträgergestell. Lassen Sie die Folien 5 Minuten lang in PBS, um den Maus-auf-Maus-Block abzuwaschen.
10. Primäre Antikörper
- Wählen Sie für jeden Objektträger primäre Antikörper von Interesse aus, die in verschiedenen Spezies gezüchtet wurden. Verdünnen Sie die Primärantikörper in Antikörperverdünnungsmittel gemäß den Anweisungen des Herstellers. Folgende Primärantikörper wurden verwendet: E-CADHERIN (1:100), MUC2 (1:200), PCNA (1:500), LAMININ (1:200), β-CATENIN (1:200) und LAMP1 (1:50).
HINWEIS: Wenn der Hersteller die empfohlenen Verdünnungen nicht angibt, ist eine Verdünnung von 1:100 ein guter Ausgangspunkt. Wenn der primäre Antikörper von Interesse an ein Fluorophor konjugiert ist, siehe Schritt 12.2.- Um das Antikörperverdünnungsmittel herzustellen, fügen Sie PBS einen Blockierungspuffer 1:20 hinzu, wenn Sie den oben beschriebenen Fischgelatine-Blockierungspuffer verwenden.
- Entnehmen Sie die Objektträger aus dem PBS oder aus der Befeuchtungskammer, klopfen Sie die überschüssige Blockierungslösung oder PBS vorsichtig ab und legen Sie sie horizontal zurück in die Befeuchtungskammer. Stellen Sie sicher, dass die mit dem hydrophoben Stift in Schritt 8.3 erstellte Barriere erhalten bleibt. Umreißen Sie das Gewebe bei Bedarf erneut.
- Fügen Sie entsprechend verdünnte Primärantikörper von Interesse hinzu, um das Gewebe (~100 μL) zu bedecken.
- Schließen Sie die Befeuchtungskammer und inkubieren Sie die Objektträger auf einer ebenen Fläche bei 4 °C im Dunkeln über Nacht.
11. Waschen der Dias
- Nehmen Sie die Objektträger aus der befeuchteten Kammer, klopfen Sie die primären Antikörper vorsichtig ab und legen Sie die Objektträger für 5 Minuten in ein Objektträgergestell, das in PBS getaucht ist.
- Nehmen Sie den Schieber heraus und legen Sie ihn für 5 Minuten in eine neue, lösungsmittelbeständige Schüssel, die mit PBS gefüllt ist. Wiederholen Sie Schritt 1x.
12. Gegenfärbung von Sekundärantikörpern und Zellkernen
- Wählen Sie für jeden Objektträger Sekundärantikörper-Fluorophore aus, die an die Primärantikörperspezies binden sollen. Verdünnen Sie Sekundärantikörper-Fluorophore oder konjugierte Primärantikörper in Sekundärantikörper-Verdünnungsmittel. Die verwendeten Sekundärantikörper waren Esel Anti-Ziege 488 (1:200), Esel Anti-Kaninchen cy3 (1:200), Esel Anti-Maus 647 (1:200), Esel Anti-Kaninchen 647 (1:200) und Esel Anti-Ratte cy3 (1:200). Der primäre Antikörper γ-ACTIN, konjugiert mit Fluorophor 647, wurde in einer Verdünnung von 1:100 verwendet.
- Um ein Sekundärantikörper-Verdünnungsmittel herzustellen, fügen Sie PBS einen Blockierungspuffer 1:100 hinzu, wenn Sie wie oben beschrieben Fischgelatine-Blockpuffer verwenden.
- Entnehmen Sie die Objektträger aus PBS, klopfen Sie überschüssiges PBS vorsichtig ab und legen Sie sie horizontal zurück in die befeuchtete Kammer. Stellen Sie sicher, dass die mit dem hydrophoben Stift in Schritt 8.3 erstellte Barriere erhalten bleibt. Umreißen Sie das Gewebe bei Bedarf erneut.
- Fügen Sie entsprechend verdünnte Sekundärantikörper-Fluorophore oder konjugierte Primärantikörper von Interesse hinzu, um das Gewebe (~100 μL) zu bedecken.
- Schließen Sie die Befeuchtungskammer und inkubieren Sie die Objektträger bei Raumtemperatur im Dunkeln für 1 h.
- Verdünnen Sie 10 mg/mL Hoechst (siehe Materialtabelle) oder DAPI mit PBS für eine Endkonzentration von 1 μg/mL, Hoechst oder DAPI mit PBS und geben Sie es direkt in das Gewebe (~100 μL). 5 min bei Raumtemperatur im Dunkeln inkubieren.
- Nehmen Sie die Objektträger aus der befeuchteten Kammer und legen Sie sie in ein Objektträgergestell, das 5 Minuten lang im Dunkeln in PBS getaucht ist.
- Entfernen Sie den Schieberost und stellen Sie ihn in eine neue, lösungsmittelbeständige Schüssel, die mit PBS gefüllt ist, für 5 Minuten im Dunkeln. Wiederholen Sie Schritt 1x.
13. Montage und Vorbereitung für die Mikroskopie
- Entfernen Sie jeweils einen Objektträger aus dem in PBS getauchten Objektträgerhalter, und lassen Sie die restlichen Objektträger im Dunkeln in PBS getaucht. Klopfen Sie überschüssiges PBS vorsichtig ab und wischen Sie bei Bedarf mit einem fusselfreien Tuch überschüssiges PBS vorsichtig auf dem Objektträger ab, wobei Sie das Taschentuch vermeiden.
- Geben Sie ein bis zwei Tropfen Antifading-Eindeckmittel (siehe Materialtabelle) in die Mitte des Gewebes.
- Halten Sie ein sauberes Deckglas (siehe Materialtabelle ) an den Rändern fest und senken Sie es langsam in einem Winkel von 45° auf den Objektträger. Stellen Sie sicher, dass sich das Einbettmedium gleichmäßig über das Gewebe verteilt.
- Beginnen Sie in der Mitte des Gewebes und drücken Sie mit zwei Fingern vorsichtig auf das Deckglas, um Luftblasen und überschüssiges Eindeckmedium zu entfernen. Bei Bedarf weiter in Richtung der Ränder drücken und durchgehend leichten Druck ausüben.
- Schneiden Sie das kleine Ende einer ungefilterten P200-Pipette ab und befestigen Sie es an der Spitze einer serologischen Pipette, die an ein Vakuum angeschlossen ist.
- Entlang der Ränder des Deckglases das überschüssige Eindeckmedium mit dem Staubsauger entfernen.
- Legen Sie den Objektträger in einer neuen Objektträgerbox waagerecht flach hin und lassen Sie den Objektträger im Dunkeln bei Raumtemperatur trocknen.
- Wiederholen Sie diesen Vorgang für jede Folie.
Ergebnisse
Die Hämatoxylin- und Eosin-Färbung (H&E) wurde, wie zuvor beschrieben, durchgeführt12. Mit der optimierten Methode enthielten die Darmrollen alle drei Segmente des Dünndarms und des Dickdarms auf einem einzigen Objektträger. Die Unterbringung des gesamten Darms auf einem Objektträger ermöglicht es den Forschern, Veränderungen in allen Teilen des Darms zu analysieren und Kosten für das Schneiden und Färben von Reagenzien zu sparen (Abbildung 1). Wenn bei der Immunfärbung alle Darmsegmente gleichzeitig denselben Lösungen ausgesetzt werden, können genaue Ergebnisse erzielt werden. Die H&E-Mikroskopaufnahme zeigt die erhaltene Darmarchitektur aller Teile des Dünndarms und des Dickdarms (Abbildung 2). Die Messung der Zwölffingerdarmzotten zeigte keinen signifikanten Unterschied in der Höhe der Zotten im ungeöffneten Darmgewebe im Vergleich zu dieser Swiss-Roll-Methode, was darauf hindeutet, dass die Öffnung des Darms die Gewebearchitektur nicht stört (Abbildung 2D). Die Immunfärbung von intestinalen Schweizer Rollen zeigt die verschiedenen Schichten des Darms sowie die gesamte Zottenkryptenachse. Die Fluoreszenzbilder zeigen niedrige Hintergrundwerte aus der Primär- und Sekundärantikörperfärbung und zeigen deutlich die einzelnen im Epithel vorhandenen Zellen. Abbildung 3 zeigt die Morphologie verschiedener Darmsegmente und die Färbung für Becherzellen (MUC2-positive Zellen)13, die apikale Membran (γ-ACTIN)14, die laterale Membran von Epithelzellen (E-CADHERIN)15 und Zellkerne. Dieses Protokoll eignet sich zur Identifizierung vieler verschiedener zellulärer Kompartimente, einschließlich proliferativer Zellen (PCNA)16, Interstitium (LAMININ; Abbildung 4A) 17, die lysosomale Domäne (LAMP1)14 und das Epithel (β-CATENIN; Abbildung 4B) 18. Urheberrecht

Abbildung 1: Arbeitsablauf für die Zubereitung und Verarbeitung von Schweizer Brötchen im Darm. (A) Die Darmsegmente werden mit einer Spritze mit PBS gespült und dann in PBS gewaschen. (B) Das feuchte Darmgewebe wird dann auf trockenes Filterpapier gelegt. (C) Der Darm wird auf Filterpapier in Längsrichtung aufgeschnitten und (D) sanft gespreizt. (E) Ein Stück Filterpapier wird auf den geöffneten Darm gelegt, und der Darm wird vorsichtig zwischen das Filterpapier gelegt und geheftet. Die Darmsegmente werden über Nacht fixiert und (F) wird mit einer Pinzette gerollt. (G) Der Darm wird sanft von der umgekehrten Pinzette gelöst und (H) hat ein rosettenförmiges Aussehen. (I, J) Das Darmgewebe wird festgesteckt und in eine große Kassette gelegt. (K) Alle vier Darmsegmente werden zur Gewebeaufbereitung und -einbettung in dieselbe Kassette gelegt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
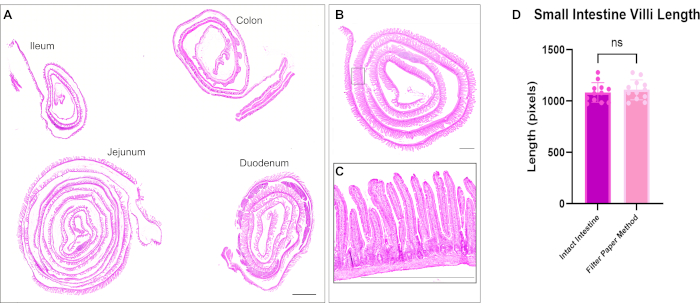
Abbildung 2: Hämatoxylin- und Eosin-Färbung aller vier Darmsegmente. (A) Das Kachelscannen demonstriert die Fähigkeit, den gesamten Darm in einem einzigen Objektträger mit einzelnen Schweizer Rollen des Zwölffingerdarms, des Jejunums, des Ileums und des Dickdarms zu visualisieren. (B) Mikroskopische Aufnahme einer intestinalen Schweizer Rolle und (C) Einsatz mit höherer Vergrößerung, um die Zotten und die Kryptenarchitektur zu zeigen. (D) Die Quantifizierung der Länge der Dünndarmzotten in der zeigt keinen signifikanten Unterschied zwischen Schweizer Rollengewebe und ungeöffnetem Gewebe. Maßstabsbalken = 1000 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Immunfluoreszenzfärbung aller vier Darmsegmente. Adulte C57BL/6J-Kontrollmäuse wurden immungefärbt für Zellkerne (cyan), den lateralen Membranmarker, E-CADHERIN (grün), Becherzellen, die durch MUC2 (gelb) identifiziert wurden, und den apikalen Bürstenrandmarker, γ-ACTIN, (magenta). Maßstabsleisten = 50 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
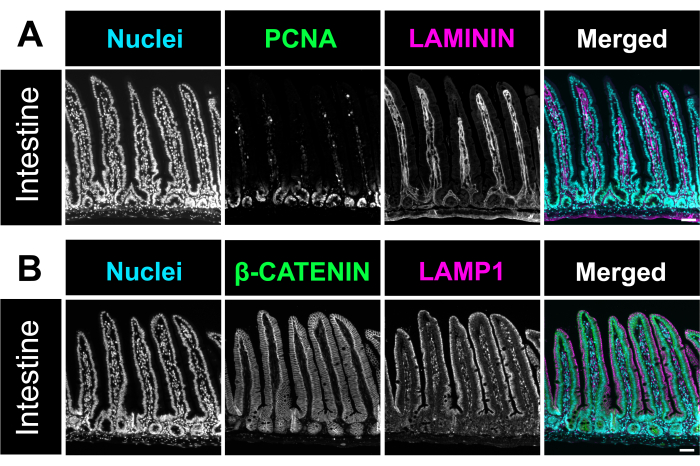
Abbildung 4. Immunfluoreszenzfärbung des Darms. (A) Eine repräsentative mikroskopische Aufnahme der Immunfluoreszenzfärbung des Darms von Mäusen hebt Zellkerne (cyan), proliferative Zellen, PCNA (grün) und Lamina propria, LAMININ (magenta) hervor. (B) Immunfluoreszenzbild zur Identifizierung von Zellkernen (cyan), des Zellmembranmarkers β-CATENIN (grün) und des Lysosomenmarkers LAMP1 (magenta) im Darm. Maßstabsleisten = 50 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Hier stellen wir eine optimierte Methode zur Gewebefixierung mit der Swiss-Roll-Technik vor, um die Darmarchitektur zu erhalten und eine genaue Immunfärbung zu fördern. Einmal gemeistert, kann diese Technik zur Untersuchung einer Vielzahl von Forschungsfragen im Zusammenhang mit der Darmphysiologie und Zellbiologie verwendet werden19. Mehrere optimierte Schweizer Walzverfahren wurden publiziert und sind sehr nützlich20,21. Ein Vorteil dieser Technik ist die Leichtigkeit, den Darm auf Filterpapier genau zu öffnen. Dadurch kann das Gewebe flach fixiert werden, wodurch verhindert wird, dass sich das Gewebe beim Rollen nach innen krümmt, was besonders bei der Analyse von entzündetem Gewebe mit verdickter Muskulis hilfreich ist. Darüber hinaus ist es wichtig, die entscheidende Rolle des Gewebeschnitts bei der Erzielung zuverlässiger Ergebnisse hervorzuheben. Die richtige Schnittbildung gewährleistet die Erhaltung der Gewebearchitektur und erleichtert eine genaue Immunfärbung, was letztendlich zum Erfolg nachgelagerter Analysen beiträgt11. Der optimierte Ansatz ist im Vergleich zu anderen Protokollen weniger schwierig und führt zu konsistenten Ergebnissen bei verschiedenen Personen. Die in dieser Arbeit vorgestellte Technik bietet auch eine gut erhaltene Gewebearchitektur, Vielseitigkeit und eine hochgradig reproduzierbare Immunfärbung mit verschiedenen Antikörpern.
Ein kritischer Aspekt dieses Protokolls ist die Fixierungs- und Verarbeitungszeit. Eine unsachgemäße Fixierung und Verarbeitung des Gewebes kann die histochemischen Analysen beeinträchtigen. Zu fixiertes Gewebe wird spröde, während unterfixiertes Gewebe zu weich bleibt. Sowohl über- als auch unterfixiertes Gewebe sind schwer zu schneiden und beeinträchtigen die Immunfärbung. Nach dem Präparieren auf Filterpapier sollte das Gewebe sofort in Formalin gelegt werden, um postmortale Veränderungen zu reduzieren22. Bei diesem Protokoll wird murines Gewebe über Nacht in Formalin fixiert. Mehrere Studien haben diese Fixationszeit verwendet 20,23,24. Boenisch et al. zeigten jedoch, dass die Immunfärbung in Gewebe, das bis zu 4 Tage lang mit Formalin fixiert war, konsistent ist25. Eine Optimierung der Fixierzeit und des Fixiermittels ist in Abhängigkeit von den gewünschten Analysen erforderlich. Zum Beispiel wird das Fixiermittel von Carnoy häufig für die Verfärbung von Schleimbevorzugt 26. Die Wahl der Fixiermittel und die Dauer der Fixierzeit sollten von jedem Forscher in Abhängigkeit von seinem experimentellen Ansatz optimiert werden. Die Verwendung eines automatisierten Gewebeprozessors wird empfohlen, um genaue und konsistente Verarbeitungszeiten zu gewährleisten. Unser Labor verwendet kleine Stifte, um das Darmgewebe als Rollen an Ort und Stelle zu halten. Ohne Stecknadeln kann sich das Gewebe während der Verarbeitung lösen. Da diese Stifte recht klein und scharf sind, müssen Vorsichtsmaßnahmen getroffen werden. Wir empfehlen die Verwendung eines Drahtschneiders, um das scharfe Ende des Stifts vor der Gewebeverarbeitung zu entfernen. Einige histologische Kerne akzeptieren kein Gewebe mit Stiften; Daher ist es am besten, vor der Verwendung zu überprüfen. Ein alternativer Ansatz besteht darin, Agar zu verwenden, um das Gewebe vor der Verarbeitung zu verankern27 oder Kassettenschwämme könnten in Kassetten verwendet werden, um die Walzen zu halten.
Die Immunfärbung ist ein Protokoll, das eine Optimierung für jeden Antikörper erfordert. Die Verwendung von Knockout-validierten Antikörpern wird empfohlen, wann immer dies möglich ist. Diese Methode zur Gewebefixierung und -verarbeitung führt zu einer klaren Färbung, die eine einfache Identifizierung der Antikörperbindung im Vergleich zum Hintergrundsignal ermöglicht, wenn nicht validierte Antikörper verwendet werden. Die Wahl des Fixiermittels, die Antigengewinnung und die Antikörperverdünnung können die Spezifität des Antikörpers beeinflussen. Wir empfehlen den Forschern, das Protokoll sorgfältig zu bewerten und zu optimieren, indem sie die Fixierung, die Antigengewinnung und die Inkubationszeit für jeden Antikörper anpassen. Um die besten Ergebnisse zu erzielen, sollten Antikörper in verschiedenen Verdünnungen getestet werden, um die optimale Konzentration zu bestimmen, und in verschiedenen Antigen-Retrieval-Puffern. Die Epitopgewinnung verbessert die Immunfärbung, indem sie Methylenbrücken aufbricht, die während der Fixierung gebildet werden. In diesem Protokoll wird die hitzeinduzierte Epitopgewinnung anstelle der proteolytisch induzierten Epitopgewinnung verwendet, da der Enzymverdau die Gewebemorphologie mit größerer Wahrscheinlichkeit stört28. Die gebräuchlichsten hitzeinduzierten Epitop-Retrieval-Puffer sind Citratpuffer, Tris-HCl und Tris-EDTA, wobei Citratpuffer am schonendsten für die Gewebemorphologieist 29. Die Wahl des Puffers variiert und sollte für jeden Antikörper bestimmt werden. Viele Antigen-Retrieval-Puffer, Blockierungslösungen und Antikörperverdünnungsmittel sind im Handel erhältlich. Diese Lösungen können jedoch extrem teuer und unerschwinglich sein. Wir stellten Rezepturen für gängige Antigen-Retrieval-Lösungen sowie Blockierungs- und Antikörperverdünnungslösungen zur Verfügung, um die Kosteneffizienz zu gewährleisten.
Eine Einschränkung dieser Methode besteht darin, dass die Fixierung und Verarbeitung Gewebe- und Maskenepitope verändern kann. Ein alternativer Ansatz ist die Immunfärbung von frischem gefrorenem Gewebe. Frisches gefrorenes Gewebe wird schockgefroren, wodurch die Exposition gegenüber toxischen Fixiermitteln vermieden wird, die Proteinstruktur erhalten bleibt und die Zugänglichkeit einiger Epitope verbessert wird. Die Gewebearchitektur und -morphologie sind jedoch schlechter als die von fixiertem und paraffineingebettetem Gewebe. Zu den weiteren Herausforderungen bei frischem gefrorenem Gewebe gehören die Materialien und die Logistik, die für das Schneiden und Lagern von gefrorenen Blöcken und Objektträgern erforderlich sind. Die Analyse von Schweizer Rollen im Vergleich zu Streifen aus Darmgewebe zeigt Unterschiede in der Höhe und Breite der Zotten und Unterschiede in den Immunzellen in der Lamina propria, wie in einem früheren Berichtbeschrieben 30. Diese Ergebnisse deuten darauf hin, dass intestinale Schweizer Brötchen einige Darmmerkmale verändern, was bei der Planung von Experimenten berücksichtigt werden sollte. Darüber hinaus ist eine Antikörper-Revalidierung erforderlich, da viele Antikörper, die spezifisch an formalinfixiertes, in Paraffin eingebettetes Gewebe binden, in frischem gefrorenem Gewebe nicht gut abfärben31.
Die Immunfärbung von Darmgewebe kann zur Beantwortung einer Vielzahl von Fragen der gastrointestinalen Zellbiologie und Physiologie eingesetzt werden. Diese Technik wird häufig verwendet, um epitheliale Veränderungen im Rahmen von Darmentzündungen, nach bakteriellen Infektionen und während des Fortschreitens von Krebs zu identifizieren. Die hier vorgestellte Methode eignet sich hervorragend für die Konservierung von Darmgewebe, da sie kostengünstig, technisch nicht anspruchsvoll und hochgradig reproduzierbar ist. Um die besten Ergebnisse zu erzielen, ermutigen wir zur Optimierung der in diesem Protokoll beschriebenen Schritte auf der Grundlage des Versuchsdesigns und der zu testenden Hypothese.
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Diese Studie wurde von den National Institutes of Health (NIH) Grants K01 DK121869 an ACE unterstützt, und diese Veröffentlichung wurde teilweise von T32 GM132055 (RME), F31 DK139736 (SAD), T32 DK124191 (SAD), TL1 TR001451 (RS), UL1 TR001450 (RS) und den HCS Cornerstone Grants für SAD & RS unterstützt. Diese Arbeit wurde durch Startkapital von der Medical University of South Carolina (MUSC) bis ACE unterstützt und vom MUSC Digestive Disease Research Core Center (P30 DK123704) und dem COBRE in Digestive and Liver Disease (P20 GM120475) unterstützt. Die Bildgebung wurde mit dem Zell- und molekularen Bildgebungskern am MUSC durchgeführt.
Materialien
| Name | Company | Catalog Number | Comments |
| β-CATENIN | GeneTex | GTX101435 | |
| Cellulose filter paper | Cytiva | 10427804 | Thick Whatman paper |
| Charged glass slides | Thermo Fisher Scientific | 23888114 | |
| Coverslip | Epredia | 152440 | |
| Dissecting pins size 00 | Phusis | B082DH4TZF | |
| E-CADHERIN | R&D Systems | AF748 | |
| Freezer gloves | Tempshield | UX-09113-02 | |
| Heating block | Premiere | XH-2001 | Slide Warmer |
| Histo-Clear II | Electron Microscopy Sciences | 64111-04 | Clearing reagent |
| Hoescht | Thermo Fisher Scientific | 62249 | |
| Hydrochloric Acid | Sigma Aldrich | 320331 | |
| Hydrophobic pen | Millipore | 402176 | |
| LAMININ | GeneTex | GTX27463 | |
| LAMP1 | Santa Cruz | SC-19992 | |
| Large cassettes | Tissue-Tek | 4173 | |
| Minutien pins | Fine Science Tools | NC9679721 | |
| Mouse-on-mouse blocking reagent | Vector Laboratories | MKB-2213 | Mouse-on-mouse block |
| MUC2 | GeneTex | GTX100664 | |
| PCNA | Cell Signaling Technology | 2586S | |
| Pressure Cooker | Cuisinart | B000MPA044 | |
| ProLong gold antifade | Thermo Fisher Scientific | P36934 | Mounting medium |
| Reverse action forceps | Dumont | 5748 | |
| Slide Rack | Tissue-Tek | 62543-06 | |
| Slide Staining Set | Tissue-Tek | 62540-01 | Solvent Resistant Dishes and Metal Frame |
| Small cassettes | Fisherbrand | 15-200-403B | |
| Sodium citrate dihydrate | Fisher Bioreagents | BP327-1 | |
| Teleostein Gelatin | Sigma | G7765 | Blocking buffer |
| Triton X-100 | Thermo Fisher Scientific | A16046 | |
| Tween 20 | Thermo Fisher Scientific | J20605-AP | |
| Wipes | KimTech | 34155 | |
| Xylenes | Fisher Chemical | 1330-20-7 | |
| γ-ACTIN | Santa Cruz | SC-65638 |
Referenzen
- Louvard, D., Kedinger, M., Hauri, H. P. The differentiating intestinal epithelial cell: Establishment and maintenance of functions through interactions between cellular structures. Annu Rev Cell Biol. 8, 157-195 (1992).
- Rieger, J., Pelckmann, L. M., Drewes, B. . Animal models of allergic disease: Methods and protocols. , (2021).
- Webster, J. D., Miller, M. A., Dusold, D., Ramos-Vara, J. Effects of prolonged formalin fixation on the immunohistochemical detection of infectious agents in formalin-fixed, paraffin-embedded tissues. Vet Pathol. 47 (3), 529-535 (2010).
- Hayashi, Y., Koike, M., Matsutani, M., Hoshino, T. Effects of fixation time and enzymatic digestion on immunohistochemical demonstration of bromodeoxyuridine in formalin-fixed, paraffin-embedded tissue. J Histochem Cytochemis. 36 (5), 511-514 (1988).
- Werner, M., Chott, A., Fabiano, A., Battifora, H. Effect of formalin tissue fixation and processing on immunohistochemistry. Am J Surg Pathol. 24 (7), 1016-1019 (2000).
- Scalia, C. R., et al. Antigen masking during fixation and embedding, dissected. J Histochem Cytochem. 65 (1), 5-20 (2017).
- Masood, S., Von Wasielewski, R., Mengel, M., Nolte, M., Werner, M. Influence of fixation, antibody clones, and signal amplification on steroid receptor analysis. Breast J. 4 (1), 33-40 (1998).
- Moolenbeek, C., Ruitenberg, E. J. The "swiss roll": A simple technique for histological studies of the rodent intestine. Lab Anim. 15 (1), 57-59 (1981).
- Casteleyn, C., Rekecki, A., Van Der Aa, A., Simoens, P., Van Den Broeck, W. Surface area assessment of the murine intestinal tract as a prerequisite for oral dose translation from mouse to man. Lab Animals. 44 (3), 176-183 (2010).
- Lunnemann, H. M., et al. Cecum axis (cecax) preservation reveals physiological and pathological gradients in mouse gastrointestinal epithelium. Gut Microbes. 15 (1), 2185029 (2023).
- Qin, C., et al. The cutting and floating method for paraffin-embedded tissue for sectioning. J Vis Exp. (139), e58288 (2018).
- Feldman, A. T., Wolfe, D. . Histopathology: Methods and protocols. , (2014).
- Yang, W. H., et al. Innate mechanism of mucosal barrier erosion in the pathogenesis of acquired colitis. iScience. 26 (10), 107883 (2023).
- Dooley, S. A., et al. Myosin 5b is required for proper localization of the intermicrovillar adhesion complex in the intestinal brush border. Am J Physiol Gastrointest Liver Physiol. 323 (5), G501-G510 (2022).
- Danan, C. H., et al. Intestinal transit amplifying cells require mettl3 for growth factor signaling, kras expression, and cell survival. bioRxiv. , (2023).
- Han, B., Qi, S., Hu, B., Luo, H., Wu, J. Tgf-beta i promotes islet beta-cell function and regeneration. J Immunol. 186 (10), 5833-5844 (2011).
- Chen, L. C., Wang, H. W., Huang, C. C. Modulation of inherent niches in 3d multicellular msc spheroids reconfigures metabolism and enhances therapeutic potential. Cells. 10 (10), 2747 (2021).
- Fang, Y., et al. Cd36 inhibits beta-catenin/c-myc-mediated glycolysis through ubiquitination of gpc4 to repress colorectal tumorigenesis. Nat Commun. 10 (1), 3981 (2019).
- Whittem, C. G., Williams, A. D., Williams, C. S. Murine colitis modeling using dextran sulfate sodium (dss). J Vis Exp. (35), e1652 (2010).
- Bialkowska, A. B., Ghaleb, A. M., Nandan, M. O., Yang, V. W. Improved swiss-rolling technique for intestinal tissue preparation for immunohistochemical and immunofluorescent analyses. J Vis Exp. (113), e54161 (2016).
- Le Naour, J., et al. Improved swiss-rolling method for histological analyses of colon tissue. MethodsX. 9, 101630 (2022).
- Cardiff, R. D., Miller, C. H., Munn, R. J. Mouse tissue fixation. Cold Spring Harb Protoc. 2014 (5), 073403 (2014).
- Pereira E Silva, A., Lourenço, A. L., Marmello, B. O., Bitteti, M., Teixeira, G. a. P. B. Comparison of two techniques for a comprehensive gut histopathological analysis: Swiss roll versus intestine strips. Exp Mol Pathol. 111, 104302 (2019).
- Williams, J. M., Duckworth, C. A., Vowell, K., Burkitt, M. D., Pritchard, D. M. Intestinal preparation techniques for histological analysis in the mouse. Curr Prot Mouse Biol. 6 (2), 148-168 (2016).
- Boenisch, T. Effect of heat-induced antigen retrieval following inconsistent formalin fixation. Appl Immunohistochem Mol Morphol. 13 (3), 283-286 (2005).
- Hasegawa, Y., Mark Welch, J. L., Rossetti, B. J., Borisy, G. G. Preservation of three-dimensional spatial structure in the gut microbiome. PLoS One. 12 (11), e0188257 (2017).
- Garabedian, E. M., Roberts, L. J., Mcnevin, M. S., Gordon, J. I. Examining the role of paneth cells in the small intestine by lineage ablation in transgenic mice. J Biol Chem. 272 (38), 23729-23740 (1997).
- Moshi, J. M., Ummelen, M., Broers, J. L. V., Ramaekers, F. C. S., Hopman, A. H. N. Impact of antigen retrieval protocols on the immunohistochemical detection of epigenetic DNA modifications. Histochem Cell Biol. 159 (6), 513-526 (2023).
- Krenacs, L., Krenacs, T., Stelkovics, E., Raffeld, M. Heat-induced antigen retrieval for immunohistochemical reactions in routinely processed paraffin sections. Methods Mol Biol. 588, 103-119 (2010).
- Pereira, E. S. A., Lourenco, A. L., Marmello, B. O., Bitteti, M., Teixeira, G. Comparison of two techniques for a comprehensive gut histopathological analysis: Swiss roll versus intestine strips. Exp Mol Pathol. 111, 104302 (2019).
- Bolognesi, M. a. O., et al. Antibodies validated for routinely processed tissues stain frozen sections unpredictably. Bio Techniques. 3 (3), 137-148 (2021).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten