Method Article
Protocollo ottimizzato per Swiss Rolls intestinali e colorazione in immunofluorescenza di tessuto incluso in paraffina
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
L'intestino è vitale per la digestione e l'assorbimento. Ogni regione - duodeno, digiuno, ileo, colon - svolge funzioni distinte a causa di strutture cellulari uniche. Lo studio della fisiologia intestinale richiede un'analisi meticolosa dei tessuti. Questo protocollo delinea la fissazione e la lavorazione dei tessuti utilizzando la tecnica del rullo svizzero, garantendo un'immunocolorazione accurata attraverso un'adeguata conservazione e orientamento dei tessuti.
Abstract
L'intestino è un organo complesso composto dall'intestino tenue e dall'intestino crasso. L'intestino tenue può essere ulteriormente suddiviso in duodeno, digiuno e ileo. Ogni regione anatomica dell'intestino ha una funzione unica che si riflette nelle differenze nella struttura cellulare. Indagare sui cambiamenti nell'intestino richiede un'analisi approfondita delle diverse regioni dei tessuti e delle alterazioni cellulari. Per studiare l'intestino e visualizzare grandi pezzi di tessuto, i ricercatori usano comunemente una tecnica nota come involtini svizzeri intestinali. In questa tecnica, l'intestino è diviso in ciascuna regione anatomica e fissato in un orientamento piatto. Quindi, il tessuto viene accuratamente arrotolato e lavorato per l'inclusione della paraffina. La corretta fissazione e orientamento dei tessuti è una tecnica di laboratorio spesso trascurata, ma è di fondamentale importanza per l'analisi a valle. Inoltre, un rotolamento svizzero improprio del tessuto intestinale può danneggiare il fragile epitelio intestinale, portando a una scarsa qualità dei tessuti per l'immunocolorazione. Garantire un tessuto ben fissato e correttamente orientato con strutture cellulari intatte è un passo cruciale che garantisce una visualizzazione ottimale delle cellule intestinali. Presentiamo un metodo semplice ed economico per la produzione di involtini svizzeri che include tutte le sezioni dell'intestino in un unico blocco incorporato in paraffina. Descriviamo anche la colorazione ottimizzata in immunofluorescenza del tessuto intestinale per studiare vari aspetti dell'epitelio intestinale. Il seguente protocollo fornisce ai ricercatori una guida completa per ottenere immagini di immunofluorescenza di alta qualità attraverso la fissazione del tessuto intestinale, la tecnica Swiss-roll e l'immunocolorazione. L'impiego di questi approcci raffinati preserva l'intricata morfologia dell'epitelio intestinale e favorisce una comprensione più profonda della fisiologia intestinale e della patobiologia.
Introduzione
L'architettura cellulare dell'intestino rappresenta una sfida unica nel mantenere la sua integrità strutturale quando il tessuto intestinale viene preservato per l'immunocolorazione. L'intestino tenue è costituito da strutture allungate simili a dita note come villi1. Questi villi spesso diventano malformati durante i processi di inclusione. Garantire che i ricercatori dispongano di tecniche per incorporare correttamente gli intestini per ottenere sezioni trasversali, consentendo la visualizzazione di tutte le regioni dell'intestino, nonché degli strati che compongono l'intestino (ad esempio, la muscularis propria, la mucosa e la sierosa), è fondamentale per una solida analisi sperimentale2. Una fissazione inadeguata, una fissazione eccessiva e una manipolazione impropria dei tessuti compromettono l'integrità dei tessuti, con conseguente danno involontario all'epitelio intestinale 3,4. Danneggiare l'epitelio intestinale durante queste fasi può ridurre significativamente la qualità delle analisi successive, come l'immunofluorescenza, indipendentemente dall'efficacia dei protocolli di immunoistochimica e degli anticorpi impiegati.
L'immunocolorazione, come una corretta fissazione dei tessuti, è una parte importante della ricerca biomedica. Se fatta bene, l'immunocolorazione può illuminare aspetti precedentemente sconosciuti della struttura e della funzione cellulare. La colorazione in immunofluorescenza delle sezioni di paraffina può essere difficile a causa delle modifiche fisico-chimiche derivanti dal processo di fissazione e inclusione della paraffina5. La fissazione e l'inclusione della paraffina provocano il mascheramento dell'antigene che può interferire con la rilevazione in immunofluorescenza degli epitopi di interesse6. La fissazione ritardata può indurre la degradazione proteolitica, che si traduce in una colorazione indebolita o assente degli epitopi critici7. Inoltre, gli anticorpi sono spesso imprecisi con alti livelli di background. I protocolli di immunocolorazione che promuovono un legame anticorpale coerente e specifico e un elevato rapporto segnale/rumore possono fornire informazioni preziose per i ricercatori.
In questo caso, forniamo un protocollo completo progettato per ottenere immagini di immunofluorescenza di alta qualità attraverso la fissazione del tessuto intestinale, la preparazione di rotoli svizzeri8 e l'immunocolorazione. Sottolineando le linee guida per preservare l'integrità dell'intestino, il protocollo mira a fornire ai ricercatori una solida metodologia per migliorare la qualità e l'affidabilità degli studi di imaging in immunofluorescenza. Abbiamo anche cercato di utilizzare risorse convenienti, tra cui carta da filtro e recupero dell'antigene fatto in casa, soluzioni bloccanti e diluenti anticorpali per rendere il protocollo più accessibile ai laboratori che potrebbero avere fondi limitati. Come per tutti i protocolli sperimentali, i ricercatori dovrebbero ottimizzare il protocollo attuale in base al loro approccio sperimentale e alle aree di interesse.
Protocollo
Il Comitato Istituzionale per la Cura e l'Uso degli Animali dell'Università di Medicina della Carolina del Sud ha approvato tutte le cure, il mantenimento e il trattamento degli animali. Il tessuto intestinale è stato raccolto da topi adulti C57BL/6J (maschi e femmine di età compresa tra 3 e 5 mesi, del peso di circa 30 g) per l'uso nel presente studio.
1. Fissazione del tessuto intestinale
- Sezionare con cura l'intero intestino di un topo soppresso e metterlo in una bilancia o in una piastra di Petri contenente soluzione salina tamponata con fosfato (PBS).
- Rimuovi l'intestino dal PBS e usa le forbici per rimuovere delicatamente il grasso in eccesso e il tessuto connettivo. Il taglio del tessuto connettivo aiuta il tessuto a rimanere piatto durante le fasi successive.
- Dividi l'intestino in singoli segmenti usando le forbici (ad esempio, duodeno, digiuno, ileo, cieco e colon). Dividi i segmenti in base alle caratteristiche anatomiche e/o alla lunghezza, con circa il 13% della lunghezza intestinale del duodeno, il 58% del digiuno, l'8% dell'ileo, il 6% del cieco e il colon del 15%9. Il duodeno segue lo stomaco e l'ileo è la sezione terminale dell'intestino tenue immediatamente prima del cieco.
- Libera il colon tagliando il punto in cui si unisce al cieco usando le forbici. Posizionare il duodeno, il digiuno, l'ileo e il colon nella bilancia o nella piastra di Petri di PBS. Scartare il cieco o fissarlo secondo altri metodi pubblicati10.
- Collegare un puntale per pipetta P200 a una siringa da 10 ml tagliando l'estremità più grande del puntale con una lama di rasoio. Riempi la siringa con PBS.
- Inserire la punta della siringa nell'apertura di un segmento intestinale utilizzando una pinza. Utilizzare la pinza per tenere il segmento intestinale sulla siringa e sciacquare delicatamente a una velocità di ~50 μL/s per rimuovere il contenuto intestinale. Raccogli il contenuto intestinale in una bilancia vuota o in una capsula di Petri.
- Stendere il segmento intestinale umido in linea retta su una striscia di carta da filtro di cellulosa etichettata a secco (vedi Tabella dei materiali). Assicurarsi che il segmento intestinale sia sufficientemente umido da aderire correttamente alla carta da filtro asciutta. Etichettare la carta da filtro con le informazioni per il numero del topo, il genotipo, il gruppo sperimentale, ecc. usando una matita.
NOTA: L'uso di una penna per etichettare la carta da filtro può causare la perdita delle etichette durante il fissaggio. - Usa le forbici da dissezione per tagliare l'intestino longitudinalmente lungo la linea mesenterica. Tagliare ~5 mm alla volta, usando il bordo inferiore delle forbici o un paio di pinze per stendere il tessuto tagliato sulla carta da filtro. Continuare fino a quando l'intera sezione dell'intestino è tagliata e adagiata sulla carta da filtro. Fai attenzione a tagliare l'intestino in linea il più dritta possibile, in quanto ciò renderà più facile arrotolare il tessuto.
NOTA: Durante questa fase è possibile utilizzare le forbici a punta sferica per evitare danni ai tessuti. - Metti un altro pezzo di carta da filtro sopra il segmento intestinale. Assicurati che la carta da filtro raccolga il segmento intestinale, evitando che l'intestino si arricci o perda la sua forma appiattita durante la fissazione.
- Pinzare i bordi della carta da filtro per fissare il fazzoletto in posizione. Non pinzare il fazzoletto. Posizionare un numero sufficiente di graffette attorno al fazzoletto per evitare che il fazzoletto si stacchi dalla carta da filtro durante il fissaggio.
- Ripetere i passaggi 1,5-1,10 per ciascuno dei segmenti intestinali (duodeno, digiuno, ileo e colon).
- Immergere i tessuti in formalina tamponata normale al 10% (o fissativo a scelta come paraformaldeide al 4%, fissativo di Carnoy, ecc.) per una notte a 4 °C.
ATTENZIONE: Assicurarsi che vengano indossati dispositivi di protezione individuale corretti poiché i fissativi come la formalina sono tossici.
2. Rotolamento e lavorazione del tessuto intestinale
ATTENZIONE: Eseguire i passaggi 2.1-2.6 in una cappa ventilata.
- Rimuovere delicatamente il pezzo superiore di carta da filtro (quello che tocca il lato luminale dell'intestino). Usa una pinza per staccare con cura l'intestino dal pezzo di carta da filtro inferiore. Eliminare la carta da filtro.
- Riempi tre barche di pesatura con PBS. Lavare il fazzoletto in PBS 3x per rimuovere la formalina dal fazzoletto.
- Usando una pinza ad azione inversa (vedi Tabella dei materiali), prelevare un pezzo di intestino lungo il bordo corto con il lato luminale rivolto verso l'alto. Ruota la pinza per arrotolare il tessuto. Usa un paio di pinze normali per guidare il tessuto mentre viene arrotolato. Se il fazzoletto si piega, srotolalo e riprova.
- Posizionare il fazzoletto in una bilancia asciutta o in una capsula di Petri. Tenere il fazzoletto in posizione con una pinza in una mano. Aprire con cautela la pinza ad azione inversa e rilasciare il tessuto, utilizzando le altre pinze per rimuovere il tessuto dalla pinza ad azione inversa.
- Inserire uno spillo da dissezione di misura 00 o uno spillo da minuzia nel fazzoletto (vedi Tabella dei materiali). Utilizzare tronchesi per rimuovere la punta affilata del perno. Metti il fazzoletto in una grande cassetta e poi metti la cassetta in un contenitore di etanolo al 70% fino al momento della lavorazione.
- Ripetere i passaggi 2.1-2.5 con tutti i segmenti intestinali (duodeno, digiuno, ileo e colon), inserendo tutti e quattro i rotoli di tessuto nella stessa cassetta grande (vedi Tabella dei materiali). Assicurarsi che la cassetta sia etichettata con una matita per evitare che l'etichetta venga lavata via nelle soluzioni di etanolo e xilene (vedere Tabella dei materiali).
- Una volta che tutti i campioni sono stati arrotolati, inserire i campioni in un processatore di tessuti. Utilizzare le seguenti impostazioni per il tessuto intestinale: etanolo al 70% per 35 minuti; etanolo al 90% per 35 min; etanolo al 95% per 35 min; 100% etanolo per 35 min, 3x; xilene per 35 min, 3x; paraffina per 60 min, 3x. Le cassette possono essere lasciate nella cera di paraffina fusa per periodi di tempo prolungati.
ATTENZIONE: Assicurarsi di indossare dispositivi di protezione adeguati poiché lo xilene è una sostanza chimica tossica.
3. Inclusione del tessuto intestinale
- Preriscaldare grandi stampi da incasso per mantenere la paraffina sciolta.
- Rimuovere le cassette dal processatore di tessuti e metterle in un becher di paraffina fusa.
- In una stazione di inclusione, mettere una piccola quantità di paraffina in uno stampo. Togliete i quattro rotoli svizzeri dalla cassetta e metteteli tutti in uno stampo, stendendoli il più piatti possibile. Aggiungere altra paraffina per riempire lo stampo.
- Spostare lo stampo sulla piastra fredda e assicurarsi che tutti i rotoli svizzeri siano piatti sul fondo dello stampo. Posizionare una piccola cassetta etichettata (vedi Tabella dei materiali) sullo stampo e aggiungere altra paraffina se necessario.
- Una volta che la cera si sarà solidificata, togliete il blocco dallo stampo. Il tessuto è ora pronto per essere tagliato in fette da 5 μm e fatto galleggiare su vetrini carichi per l'immunocolorazione11.
4. Aderenza tissutale e preparazione dei vetrini
- Per garantire che la sezione di tessuto di paraffina da 5 μm preparata aderisca al vetrino, riscaldare i vetrini su uno scaldavetrini o un blocco termico impostato a 60 °C per 15-30 minuti. I vetrini possono anche essere lasciati riscaldati più a lungo; Questo passaggio non è sensibile al fattore tempo.
- Lasciare raffreddare i vetrini a temperatura ambiente (~15 min).
5. Deparaffinazione
- All'inizio della deparaffinazione dei vetrini, assicurarsi che il tessuto rimanga in una soluzione e non si asciughi per l'intero ciclo di immunocolorazione.
- Utilizzare una rastrelliera per vetrini (vedere Tabella dei materiali) per tenere i vetrini e posizionarli all'interno di un piatto resistente ai solventi (vedere Tabella dei materiali) riempito con un reagente chiarificante/deparaffinante (vedere Tabella dei materiali). Assicurarsi che il reagente copra completamente il tessuto su ogni vetrino. Prima di immergere completamente i vetrini nel reagente di chiasso, immergere o spingere più volte il rack dei vetrini nella soluzione di chiasso. Lasciare le diapositive immerse per 10 minuti o più.
NOTA: Potrebbe essere necessario eseguire questa fase in una cappa ventilata a causa di fumi pericolosi, a seconda dell'agente di pulizia scelto. La deparaffinizzazione del tessuto in questa fase non è sensibile al tempo, se si utilizza un agente di pulizia non tossico. - Rimuovere e agitare il rack per vetrini per rimuovere il reagente di chiarificazione in eccesso. In un nuovo piatto resistente ai solventi, ripetere il passaggio 5.2.
- In un nuovo piatto resistente ai solventi, ripetere il passaggio 5.3. Lasciare le diapositive immerse per 15 minuti o più. Questo passaggio non è sensibile al fattore tempo.
6. Reidratazione
- Rimuovere e agitare il rack per vetrini per rimuovere il reagente di chiarificazione in eccesso. In un nuovo piatto resistente ai solventi riempito con etanolo al 100%, immergere o spingere più volte la griglia dei vetrini e lasciare i vetrini immersi per 5 minuti. Questo passaggio è sensibile al fattore tempo. Ripeti 2 volte.
- Rimuovere e agitare la griglia per vetrini per rimuovere l'etanolo al 100% in eccesso. In un nuovo piatto resistente ai solventi riempito con etanolo al 95%, immergere o spingere più volte la griglia per vetrini e lasciare i vetrini immersi per 5 minuti. Questo passaggio è sensibile al fattore tempo. Ripeti 1 volta.
- Rimuovere e agitare la griglia per vetrini per rimuovere l'eccesso di etanolo al 95%. In una nuova capsula resistente ai solventi riempita con etanolo al 70%, immergere o spingere più volte la griglia per vetrini e lasciare i vetrini immersi per 5 minuti. Questo passaggio è sensibile al fattore tempo.
- Rimuovere e agitare la griglia per vetrini per rimuovere l'etanolo al 70% in eccesso. In un nuovo piatto resistente ai solventi riempito con etanolo al 50%, immergere o spingere più volte il rack per vetrini e lasciare i vetrini immersi per 5 minuti. Questo passaggio è sensibile al fattore tempo.
- Rimuovere e agitare la griglia per vetrini per rimuovere l'etanolo al 50% in eccesso. In un nuovo piatto resistente ai solventi riempito con acqua deionizzata (DI), immergere o spingere più volte il rack per vetrini e lasciare i vetrini immersi per 5 minuti. Questo passaggio è sensibile al fattore tempo.
- Per fare una pausa qui, posizionare i vetrini in un contenitore con PBS fino a quando l'immunocolorazione può essere ripresa dopo la fase di reidratazione in acqua di 5 minuti.
7. Recupero dell'antigene
- Riempire una nuova capsula resistente ai solventi con un tampone di recupero dell'antigene appropriato. Trasferire direttamente il rack per vetrini in questa soluzione. Assicurarsi che i vetrini siano completamente immersi nella soluzione di recupero dell'antigene, coprendo completamente il tessuto.
NOTA: Le soluzioni ottimali per il recupero dell'antigene possono variare a seconda del particolare anticorpo utilizzato. Potrebbe essere necessario determinare il recupero dell'antigene richiesto per i singoli anticorpi dal ricercatore.- Per preparare 1x tampone per il recupero dell'antigene citrato, aggiungere 2,94 g di citrato di sodio diidrato (vedi Tabella dei materiali) per 1 litro di acqua deionizzata. Una volta disciolto il citrato di sodio diidrato, aggiungere acido cloridrico (vedi Tabella dei materiali) fino a quando la soluzione raggiunge un pH di 6. Infine, aggiungere 500 μL di Tween20 (vedi Tabella dei materiali) per 1 L di acqua deionizzata.
- Per preparare 1 tampone per il recupero dell'antigene Tris-EDTA, aggiungere 1,211 g di Tris Base e 0,292 g di EDTA in 1 L di acqua deionizzata. Una volta sciolto, regolare a pH 9.
- Coprire il piatto resistente ai solventi contenente la soluzione di recupero dell'antigene e i vetrini con un coperchio e fissare il coperchio con elastici.
- Posizionare il piatto sicuro e resistente ai solventi in una pentola a pressione (vedi Tabella dei materiali) sopra la griglia metallica o il sottopentola. Assicurarsi che ci sia abbastanza acqua nella pentola a pressione per raggiungere la griglia metallica o il sottopentola in modo che la pressione possa aumentare.
- Posizionare il coperchio sulla pentola a pressione e ruotare in senso orario per bloccare il coperchio in posizione. Ruotare la valvola limitatrice di pressione che si trova sul coperchio fino all'impostazione della pressione.
- Nelle impostazioni del menu, selezionare l'alta pressione sulla pentola a pressione, quindi nell'impostazione dell'ora, impostare la pentola a pressione su 30 min. Seleziona Avvia.
- Dopo 30 minuti la pentola a pressione emetterà un segnale acustico e si imposterà automaticamente sull'impostazione di mantenimento in caldo. Attendere che la pressione si sia allentata naturalmente e che il coperchio si sviti liberamente.
- Utilizzare guanti resistenti al calore (vedere la tabella dei materiali) per rimuovere il piatto resistente ai solventi dalla pentola a pressione e rimuovere l'elastico e il coperchio. Mettere il piatto in un bagno di ghiaccio per ~30 minuti per consentire ai vetrini di raffreddarsi a temperatura ambiente. Questo passaggio non è sensibile al fattore tempo.
- Una volta raffreddato a temperatura ambiente, rimuovere il rack per vetrini dalla piastra resistente ai solventi e posizionarlo in una nuova piastra resistente ai solventi riempita con acqua deionizzata per rimuovere la soluzione residua di recupero dell'antigene. Assicurarsi che i vetrini siano completamente sommersi.
- Rimuovere la griglia per vetrini dall'acqua deionizzata e posizionarla in un nuovo piatto resistente ai solventi riempito di PBS per 5 minuti. Assicurarsi che i vetrini siano completamente sommersi. Questo passaggio non è sensibile al fattore tempo.
8. Blocco della colorazione di fondo non specifica
- Preparare una camera umidificata prendendo una grande scatola di vetrini e rimuovendo il coperchio di cartone aderente al coperchio. Alla base della scatola di scorrimento, posiziona i tovaglioli di carta umidi verticalmente verso il basso. Assicurati che i tovaglioli di carta umidi siano piatti.
- Rimuovere una diapositiva alla volta dal rack per vetrini immerso nel PBS. Rimuovere accuratamente il PBS in eccesso sul vetrino, evitando il fazzoletto.
- Con una penna idrofobica (vedi Tabella dei materiali) formare una barriera che circonda il tessuto disegnando una scatola attorno al tessuto con la penna idrofobica. Fare attenzione a evitare il fazzoletto e a non usare la penna idrofobica troppo vicino al fazzoletto.
- Posiziona la diapositiva delineata orizzontalmente sopra i tovaglioli di carta umidi. Aggiungere un tampone bloccante per coprire il tessuto (~100 μL).
- Per creare un tampone bloccante, aggiungere 100 μL di gelatina per pelle di pesce d'acqua fredda (Gelatina di Teleosteina; vedi Tabella dei Materiali) a 9,85 mL di PBS. Infine, aggiungere 50 μl di Triton X-100 al 20% (vedere la tabella dei materiali) e mescolare fino a dissoluzione.
- Ripetere i passaggi 8.2-8.4 per ogni diapositiva. Chiudere la camera umidificata e incubare i vetrini a temperatura ambiente per 90 minuti.
9. Blocco del mouse sul mouse
- Quando si utilizza un anticorpo primario di topo per l'immunocolorazione del tessuto di topo, eseguire un ulteriore passaggio di blocco. I reagenti bloccanti topo su topo (blocco topo su topo; vedi Tabella dei materiali) sono disponibili in commercio; Seguire le istruzioni commerciali durante la preparazione del blocco mouse-on-mouse.
- Picchiettare delicatamente la soluzione bloccante e aggiungere immediatamente il blocco topo su topo preparato per coprire il tessuto (~100 μL). Ripetere l'operazione per ogni vetrino contenente tessuto di topo, che verrà colorato utilizzando un anticorpo primario sollevato nei topi.
- Incubare le sezioni di tessuto nella camera umidificata a temperatura ambiente per 15 minuti.
- Rimuovere i vetrini dalla camera umidificata e posizionarli direttamente in un rack per vetrini immerso nel PBS. Lasciare le diapositive in PBS per 5 minuti per lavare via il blocco mouse-on-mouse.
10. Anticorpi primari
- Per ogni vetrino, selezionare gli anticorpi primari di interesse che vengono allevati in specie diverse. Diluire gli anticorpi primari nel diluente anticorpale secondo le istruzioni del produttore. Sono stati utilizzati i seguenti anticorpi primari: E-CADHERIN (1:100), MUC2 (1:200), PCNA (1:500), LAMININ (1:200), β-CATENINA (1:200) e LAMP1 (1:50).
NOTA: Se il produttore non fornisce le diluizioni consigliate, la diluizione 1:100 è un buon punto di partenza. Se l'anticorpo primario di interesse è coniugato a un fluoroforo, vedere il punto 12.2.- Per rendere il diluente anticorpale, aggiungere il tampone bloccante 1:20 al PBS, se si utilizza il tampone bloccante della gelatina di pesce descritto sopra.
- Rimuovere i vetrini dal PBS o dalla camera umidificata, picchiettare delicatamente la soluzione bloccante in eccesso o PBS e riposizionarli orizzontalmente nella camera umidificata. Assicurarsi che la barriera creata con la penna idrofobica nel passaggio 8.3 rimanga; Delineare nuovamente il tessuto se necessario.
- Aggiungere anticorpi primari di interesse opportunamente diluiti per coprire il tessuto (~100 μL).
- Chiudere la camera umidificata e incubare i vetrini su una superficie piana a 4 °C al buio per una notte.
11. Lavaggio delle diapositive
- Rimuovere i vetrini dalla camera umidificata, picchiettare delicatamente gli anticorpi primari e posizionare i vetrini in un rack per vetrini immerso nel PBS per 5 minuti.
- Rimuovere la griglia per vetrini e posizionarla in una nuova pirofila resistente ai solventi riempita di PBS per 5 minuti. Ripetere il passaggio 1 volta.
12. Anticorpi secondari e controcolorazione dei nuclei
- Per ogni vetrino, selezionare i fluorofori degli anticorpi secondari progettati per legarsi alla specie di anticorpi primari. Diluire i fluorofori degli anticorpi secondari o gli anticorpi primari coniugati nel diluente degli anticorpi secondari. Gli anticorpi secondari utilizzati sono stati asino anti-capra 488 (1:200), asino anti-coniglio cy3 (1:200), asino anti-topo 647 (1:200), asino anti-coniglio 647 (1:200) e asino anti-ratto cy3 (1:200). L'anticorpo primario γ-ACTINA coniugato al fluoroforo 647 è stato utilizzato con una diluizione di 1:100.
- Per produrre il diluente per anticorpi secondari, aggiungere il tampone bloccante 1:100 al PBS, se si utilizza il tampone bloccante per gelatina di pesce come descritto sopra.
- Rimuovere i vetrini dal PBS, picchiettare delicatamente il PBS in eccesso e riposizionarli orizzontalmente nella camera umidificata. Assicurarsi che la barriera creata con la penna idrofobica nel passaggio 8.3 rimanga; Delineare nuovamente il tessuto se necessario.
- Aggiungere fluorofori di anticorpi secondari opportunamente diluiti o anticorpi primari coniugati di interesse per coprire il tessuto (~100 μL).
- Chiudere la camera umidificata e incubare i vetrini a temperatura ambiente al buio per 1 ora.
- Diluire 10 mg/mL di Hoechst (vedere la Tabella dei materiali) o DAPI utilizzando PBS per una concentrazione finale di 1 μg/mL di Hoechst o DAPI utilizzando PBS e aggiungere direttamente al tessuto (~100 μL). Incubare per 5 minuti a temperatura ambiente al buio.
- Rimuovere i vetrini dalla camera umidificata e posizionarli in un rack per vetrini immerso nel PBS per 5 minuti al buio.
- Rimuovere la griglia per vetrini e posizionarla in un nuovo piatto resistente ai solventi riempito di PBS per 5 minuti al buio. Ripetere il passaggio 1 volta.
13. Montaggio e preparazione per la microscopia
- Rimuovere un vetrino alla volta dal rack per vetrini immerso nel PBS, mantenendo i vetrini rimanenti immersi nel PBS al buio. Picchiettare delicatamente il PBS in eccesso e, se necessario, utilizzare un panno privo di lanugine per rimuovere accuratamente il PBS in eccesso sul vetrino, evitando il fazzoletto.
- Aggiungere una o due gocce di mezzo di montaggio antisbiadimento (vedere la Tabella dei materiali) al centro del tessuto.
- Tenere un vetrino coprioggetti pulito (vedi Tabella dei materiali ) per i bordi e abbassarlo lentamente sul vetrino con un angolo di 45°. Assicurarsi che il mezzo di montaggio si distribuisca uniformemente sul tessuto.
- Partendo dal centro del fazzoletto, premere delicatamente sul vetrino coprioggetti con due dita per aiutare a rimuovere le bolle d'aria e il mezzo di montaggio in eccesso. Se necessario, continuare a premere verso i bordi e mantenere una leggera pressione per tutto il tempo.
- Tagliare l'estremità piccola di una pipetta P200 non filtrata e attaccarla alla punta di una pipetta sierologica collegata a un vuoto.
- Seguendo i bordi del vetrino coprioggetti, utilizzare l'aspirapolvere per rimuovere il mezzo di montaggio in eccesso.
- In una nuova scatola per vetrini, stendere orizzontalmente il vetrino in piano e lasciare che si asciughi al buio a temperatura ambiente.
- Ripeti questo processo per ogni diapositiva.
Risultati
È stata eseguita la colorazione con ematossilina ed eosina (H&E), come precedentemente descritto12. Utilizzando il metodo ottimizzato, gli involtini intestinali svizzeri includevano tutti e tre i segmenti dell'intestino tenue e dell'intestino crasso in un unico vetrino. Avere l'intero intestino alloggiato su un vetrino consente ai ricercatori di analizzare i cambiamenti in tutte le parti dell'intestino e consente di risparmiare sui costi di sezionamento e colorazione dei reagenti (Figura 1). Inoltre, l'esposizione simultanea di tutti i segmenti intestinali alle stesse soluzioni durante l'immunocolorazione aiuta a garantire risultati accurati. La micrografia H&E dimostra l'architettura intestinale preservata di tutte le porzioni dell'intestino tenue e dell'intestino crasso (Figura 2). La misurazione dei villi duodenali non ha mostrato differenze significative nell'altezza dei villi nel tessuto intestinale non aperto rispetto a questo metodo Swiss roll, suggerendo che l'apertura dell'intestino non interrompe l'architettura tissutale (Figura 2D). L'immunocolorazione dei rotoli intestinali mostra i vari strati dell'intestino e l'intero asse della cripta villosa. Le immagini fluorescenti mostrano bassi livelli di fondo dovuti alla colorazione degli anticorpi primari e secondari e raffigurano chiaramente le singole cellule presenti nell'epitelio. La Figura 3 mostra la morfologia dei diversi segmenti intestinali e la colorazione delle cellule caliciformi (cellule MUC2 positive)13, della membrana apicale (γ-ACTIN)14, della membrana laterale delle cellule epiteliali (E-CADHERIN)15 e dei nuclei. Questo protocollo è adatto per identificare molti compartimenti cellulari diversi, tra cui le cellule proliferative (PCNA)16, l'interstizio (LAMININA; Figura 4A) 17, il dominio lisosomiale (LAMP1)14 e l'epitelio (β-catenina; Figura 4B) 18.

Figura 1: Flusso di lavoro per la preparazione e la lavorazione dei rotoli intestinali svizzeri. (A) I segmenti intestinali vengono lavati con una siringa contenente PBS e poi lavati in PBS. (B) Il tessuto intestinale umido viene quindi posto su carta da filtro asciutta. (C) L'intestino viene tagliato longitudinalmente su carta da filtro e (D) leggermente allargato. (E) Un pezzo di carta da filtro viene posato sopra l'intestino aperto e l'intestino viene delicatamente inserito tra la carta da filtro e pinzato. I segmenti intestinali vengono fissati durante la notte e (F) viene arrotolato con una pinza. (G) L'intestino viene delicatamente rimosso dalla pinza ad azione inversa e (H) ha un aspetto a rosetta. (I, J) Il tessuto intestinale viene bloccato e posto in una grande cassetta. (K) Tutti e quattro i segmenti intestinali sono collocati nella stessa cassetta per il trattamento e l'inclusione dei tessuti. Clicca qui per visualizzare una versione più grande di questa figura.
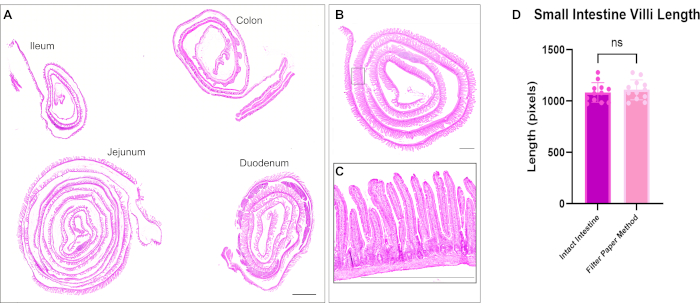
Figura 2: Colorazione con ematossilina ed eosina di tutti e quattro i segmenti dell'intestino. (A) La scansione delle piastrelle dimostra la capacità di visualizzare l'intero intestino in un unico vetrino con singoli rotoli svizzeri del duodeno, del digiuno, dell'ileo e del colon. (B) Micrografia di un rotolo svizzero intestinale e (C) inserto con ingrandimento maggiore per mostrare l'architettura dei villi e della cripta. (D) La quantificazione della lunghezza dei villi dell'intestino tenue non mostra differenze significative tra tessuto arrotolato svizzero e tessuto non aperto. Barre di scala = 1000 μm. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3: Colorazione in immunofluorescenza di tutti e quattro i segmenti dell'intestino. I topi adulti di controllo C57BL/6J sono stati immunocolorati per nuclei (ciano), il marcatore della membrana laterale, E-CADHERIN (verde), cellule caliciformi identificate da MUC2 (giallo) e il marcatore apicale del bordo del pennello, γ-ACTIN, (magenta). Barre di scala = 50 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
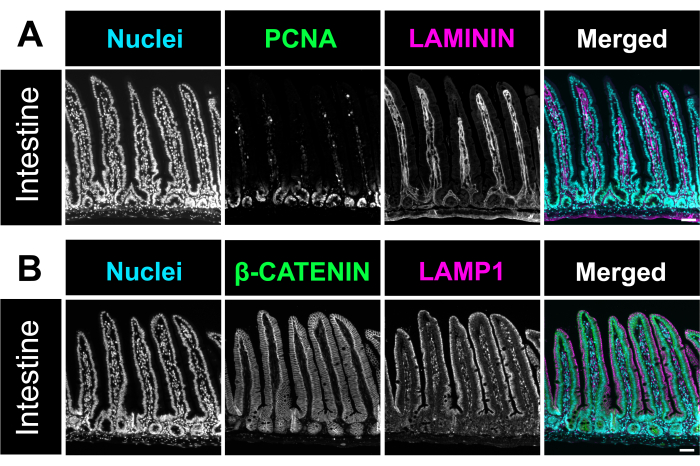
Figura 4. Colorazione in immunofluorescenza dell'intestino. (A) Una micrografia rappresentativa della colorazione in immunofluorescenza dell'intestino di topo evidenzia nuclei (ciano), cellule proliferative, PCNA (verde) e lamina propria, LAMININA (magenta). (B) Immagine di immunofluorescenza che identifica i nuclei (ciano), il marcatore della membrana cellulare β-catenina (verde) e il marcatore lisosomiale LAMP1 (magenta) nell'intestino. Barre di scala = 50 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Qui presentiamo un metodo ottimizzato per la fissazione dei tessuti utilizzando la tecnica del rullo svizzero per preservare l'architettura intestinale e promuovere un'accurata immunocolorazione. Una volta padroneggiata, questa tecnica può essere utilizzata per indagare un'ampia varietà di domande di ricerca che coinvolgono la fisiologia intestinale e la biologia cellulare19. Sono stati pubblicati diversi metodi di laminazione svizzeri ottimizzati che sono molto utili20,21. Un vantaggio di questa tecnica è la facilità di aprire con precisione l'intestino su carta da filtro. Ciò consente di fissare il tessuto in piano, impedendo al tessuto di arricciarsi verso l'interno durante il rotolamento, il che è particolarmente utile quando si analizza il tessuto infiammato con muscolo ispessito. Inoltre, è essenziale evidenziare il ruolo critico del sezionamento tissutale nel raggiungimento di risultati affidabili. Un corretto sezionamento garantisce la conservazione dell'architettura tissutale e facilita l'immunocolorazione accurata, contribuendo in ultima analisi al successo delle analisi a valle11. L'approccio ottimizzato è meno difficile rispetto ad altri protocolli, producendo risultati coerenti tra individui diversi. La tecnica proposta in questo articolo fornisce anche un'architettura tissutale ben conservata, versatilità e immunocolorazione altamente riproducibile utilizzando diversi anticorpi.
Un aspetto critico di questo protocollo è il tempo di fissazione e di elaborazione. La fissazione e l'elaborazione impropria dei tessuti possono compromettere le analisi istochimiche. Il tessuto troppo fissato diventa fragile, mentre il tessuto troppo poco fissato rimane troppo morbido. Sia i tessuti sovra che quelli sottofissati sono difficili da sezionare e compromettono l'immunocolorazione. Una volta sezionato su carta da filtro, il tessuto deve essere immediatamente posto in formalina per ridurre le alterazioni post-mortem22. In questo protocollo, il tessuto murino viene fissato in formalina durante la notte. Diversi studi hanno utilizzato questo tempo di fissazione 20,23,24. Tuttavia, Boenisch et al. hanno dimostrato che l'immunocolorazione è coerente nei tessuti fissati in formalina per un massimo di 4 giorni25. L'ottimizzazione del tempo di fissaggio e del fissativo è necessaria a seconda delle analisi desiderate. Ad esempio, il fissativo di Carnoy è spesso preferito per la colorazione del muco26. La scelta dei fissativi e la durata del tempo di fissazione dovrebbero essere ottimizzate da ciascun ricercatore a seconda del proprio approccio sperimentale. Si consiglia l'uso di un processatore di tessuti automatizzato per garantire tempi di lavorazione accurati e coerenti. Il nostro laboratorio utilizza piccoli perni per tenere in posizione il tessuto intestinale come rotoli. Senza perni, il tessuto può srotolarsi durante la lavorazione. Poiché questi perni sono piuttosto piccoli e affilati, è necessario prendere precauzioni. Si consiglia di utilizzare tronchesi per rimuovere l'estremità affilata del perno prima della lavorazione dei tessuti. Alcuni nuclei istologici non accettano tessuti con perni; Pertanto, è meglio controllare prima dell'uso. Un approccio alternativo consiste nell'utilizzare l'agar per ancorare il tessuto prima della lavorazione27 o le spugne a cassetta potrebbero essere utilizzate nelle cassette per aiutare a mantenere i rotoli.
L'immunocolorazione è un protocollo che richiede l'ottimizzazione per ogni anticorpo. L'uso di anticorpi convalidati knockout è raccomandato quando possibile. Questo metodo per la fissazione e l'elaborazione dei tessuti consente una colorazione chiara, consentendo una facile identificazione del legame con gli anticorpi rispetto al segnale di fondo quando vengono utilizzati anticorpi non convalidati. La scelta del fissativo, il recupero dell'antigene e la diluizione degli anticorpi possono influire sulla specificità dell'anticorpo. Raccomandiamo ai ricercatori di valutare attentamente e ottimizzare il protocollo regolando la fissazione, il recupero dell'antigene e il tempo di incubazione per ciascun anticorpo. Per ottenere i migliori risultati, gli anticorpi devono essere testati a varie diluizioni per determinare la concentrazione ottimale e in diversi tamponi di recupero dell'antigene. Il recupero dell'epitopo migliora l'immunocolorazione rompendo i ponti di metilene che si formano durante la fissazione. In questo protocollo, viene utilizzato il recupero degli epitopi indotto dal calore piuttosto che il recupero degli epitopi indotto dal proteolitico perché è più probabile che la digestione enzimatica interrompa la morfologia dei tessuti28. I tamponi per il recupero degli epitopi indotti dal calore più comuni sono il tampone citrato, il tris-HCl e il tris-EDTA, con il tampone citrato che è il più delicato sulla morfologia dei tessuti29. La scelta del tampone varia e deve essere determinata per ciascun anticorpo. Molti tamponi per il recupero dell'antigene, soluzioni bloccanti e diluenti anticorpali sono disponibili in commercio. Tuttavia, queste soluzioni possono essere estremamente costose e proibitive. Abbiamo fornito ricette di soluzioni comuni per il recupero dell'antigene e soluzioni di diluenti bloccanti e anticorpali per garantire l'efficacia dei costi.
Una limitazione di questo metodo è che la fissazione e l'elaborazione possono alterare i tessuti e mascherare gli epitopi. Un approccio alternativo consiste nell'immunocolorare i tessuti freschi congelati. Il tessuto fresco congelato viene congelato a scatto, consentendo di evitare l'esposizione a fissativi tossici, preservando la struttura proteica e migliorando l'accessibilità di alcuni epitopi. Tuttavia, l'architettura e la morfologia dei tessuti sono più povere di quelle dei tessuti fissati e inclusi in paraffina. Ulteriori sfide del tissue fresco congelato includono i materiali e la logistica necessari per sezionare e stoccare blocchi e vetrini congelati. L'analisi dei rotoli svizzeri rispetto a strisce di tessuto intestinale mostra differenze nell'altezza e nella larghezza dei villi e differenze nelle cellule immunitarie nella lamina propria, come descritto in un precedente rapporto30. Questi risultati suggeriscono che gli involtini intestinali alterano alcune caratteristiche intestinali, che dovrebbero essere prese in considerazione quando si pianificano gli esperimenti. Inoltre, è necessaria la riconvalida degli anticorpi poiché molti anticorpi che si legano specificamente al tessuto incluso nella paraffina fissato in formalina non si colorano bene nel tessuto fresco congelato31.
L'immunocolorazione del tessuto intestinale può essere utilizzata per rispondere a un'ampia varietà di domande riguardanti la biologia e la fisiologia delle cellule gastrointestinali. Questa tecnica è ampiamente utilizzata per identificare le alterazioni epiteliali nel contesto dell'infiammazione intestinale, a seguito di infezione batterica e durante la progressione del cancro. Il metodo qui presentato è ideale per la conservazione del tessuto intestinale perché è economico, non tecnicamente impegnativo e altamente riproducibile. Per garantire i migliori risultati, incoraggiamo l'ottimizzazione delle fasi delineate in questo protocollo in base al disegno sperimentale e all'ipotesi in fase di test.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo studio è stato supportato dalle sovvenzioni K01 DK121869 del National Institutes of Health (NIH) ad ACE e questa pubblicazione è stata supportata in parte da T32 GM132055 (RME), F31 DK139736 (SAD), T32 DK124191 (SAD), TL1 TR001451 (RS), UL1 TR001450 (RS) e dalle sovvenzioni HCS a SAD & RS. Questo lavoro è stato supportato da fondi di avvio della Medical University of South Carolina (MUSC) ad ACE ed è stato supportato dal MUSC Digestive Disease Research Core Center (P30 DK123704) e dal COBRE in Digestive and Liver Disease (P20 GM120475). L'imaging è stato eseguito utilizzando il nucleo di imaging cellulare e molecolare presso MUSC.
Materiali
| Name | Company | Catalog Number | Comments |
| β-CATENIN | GeneTex | GTX101435 | |
| Cellulose filter paper | Cytiva | 10427804 | Thick Whatman paper |
| Charged glass slides | Thermo Fisher Scientific | 23888114 | |
| Coverslip | Epredia | 152440 | |
| Dissecting pins size 00 | Phusis | B082DH4TZF | |
| E-CADHERIN | R&D Systems | AF748 | |
| Freezer gloves | Tempshield | UX-09113-02 | |
| Heating block | Premiere | XH-2001 | Slide Warmer |
| Histo-Clear II | Electron Microscopy Sciences | 64111-04 | Clearing reagent |
| Hoescht | Thermo Fisher Scientific | 62249 | |
| Hydrochloric Acid | Sigma Aldrich | 320331 | |
| Hydrophobic pen | Millipore | 402176 | |
| LAMININ | GeneTex | GTX27463 | |
| LAMP1 | Santa Cruz | SC-19992 | |
| Large cassettes | Tissue-Tek | 4173 | |
| Minutien pins | Fine Science Tools | NC9679721 | |
| Mouse-on-mouse blocking reagent | Vector Laboratories | MKB-2213 | Mouse-on-mouse block |
| MUC2 | GeneTex | GTX100664 | |
| PCNA | Cell Signaling Technology | 2586S | |
| Pressure Cooker | Cuisinart | B000MPA044 | |
| ProLong gold antifade | Thermo Fisher Scientific | P36934 | Mounting medium |
| Reverse action forceps | Dumont | 5748 | |
| Slide Rack | Tissue-Tek | 62543-06 | |
| Slide Staining Set | Tissue-Tek | 62540-01 | Solvent Resistant Dishes and Metal Frame |
| Small cassettes | Fisherbrand | 15-200-403B | |
| Sodium citrate dihydrate | Fisher Bioreagents | BP327-1 | |
| Teleostein Gelatin | Sigma | G7765 | Blocking buffer |
| Triton X-100 | Thermo Fisher Scientific | A16046 | |
| Tween 20 | Thermo Fisher Scientific | J20605-AP | |
| Wipes | KimTech | 34155 | |
| Xylenes | Fisher Chemical | 1330-20-7 | |
| γ-ACTIN | Santa Cruz | SC-65638 |
Riferimenti
- Louvard, D., Kedinger, M., Hauri, H. P. The differentiating intestinal epithelial cell: Establishment and maintenance of functions through interactions between cellular structures. Annu Rev Cell Biol. 8, 157-195 (1992).
- Rieger, J., Pelckmann, L. M., Drewes, B. . Animal models of allergic disease: Methods and protocols. , (2021).
- Webster, J. D., Miller, M. A., Dusold, D., Ramos-Vara, J. Effects of prolonged formalin fixation on the immunohistochemical detection of infectious agents in formalin-fixed, paraffin-embedded tissues. Vet Pathol. 47 (3), 529-535 (2010).
- Hayashi, Y., Koike, M., Matsutani, M., Hoshino, T. Effects of fixation time and enzymatic digestion on immunohistochemical demonstration of bromodeoxyuridine in formalin-fixed, paraffin-embedded tissue. J Histochem Cytochemis. 36 (5), 511-514 (1988).
- Werner, M., Chott, A., Fabiano, A., Battifora, H. Effect of formalin tissue fixation and processing on immunohistochemistry. Am J Surg Pathol. 24 (7), 1016-1019 (2000).
- Scalia, C. R., et al. Antigen masking during fixation and embedding, dissected. J Histochem Cytochem. 65 (1), 5-20 (2017).
- Masood, S., Von Wasielewski, R., Mengel, M., Nolte, M., Werner, M. Influence of fixation, antibody clones, and signal amplification on steroid receptor analysis. Breast J. 4 (1), 33-40 (1998).
- Moolenbeek, C., Ruitenberg, E. J. The "swiss roll": A simple technique for histological studies of the rodent intestine. Lab Anim. 15 (1), 57-59 (1981).
- Casteleyn, C., Rekecki, A., Van Der Aa, A., Simoens, P., Van Den Broeck, W. Surface area assessment of the murine intestinal tract as a prerequisite for oral dose translation from mouse to man. Lab Animals. 44 (3), 176-183 (2010).
- Lunnemann, H. M., et al. Cecum axis (cecax) preservation reveals physiological and pathological gradients in mouse gastrointestinal epithelium. Gut Microbes. 15 (1), 2185029 (2023).
- Qin, C., et al. The cutting and floating method for paraffin-embedded tissue for sectioning. J Vis Exp. (139), e58288 (2018).
- Feldman, A. T., Wolfe, D. . Histopathology: Methods and protocols. , (2014).
- Yang, W. H., et al. Innate mechanism of mucosal barrier erosion in the pathogenesis of acquired colitis. iScience. 26 (10), 107883 (2023).
- Dooley, S. A., et al. Myosin 5b is required for proper localization of the intermicrovillar adhesion complex in the intestinal brush border. Am J Physiol Gastrointest Liver Physiol. 323 (5), G501-G510 (2022).
- Danan, C. H., et al. Intestinal transit amplifying cells require mettl3 for growth factor signaling, kras expression, and cell survival. bioRxiv. , (2023).
- Han, B., Qi, S., Hu, B., Luo, H., Wu, J. Tgf-beta i promotes islet beta-cell function and regeneration. J Immunol. 186 (10), 5833-5844 (2011).
- Chen, L. C., Wang, H. W., Huang, C. C. Modulation of inherent niches in 3d multicellular msc spheroids reconfigures metabolism and enhances therapeutic potential. Cells. 10 (10), 2747 (2021).
- Fang, Y., et al. Cd36 inhibits beta-catenin/c-myc-mediated glycolysis through ubiquitination of gpc4 to repress colorectal tumorigenesis. Nat Commun. 10 (1), 3981 (2019).
- Whittem, C. G., Williams, A. D., Williams, C. S. Murine colitis modeling using dextran sulfate sodium (dss). J Vis Exp. (35), e1652 (2010).
- Bialkowska, A. B., Ghaleb, A. M., Nandan, M. O., Yang, V. W. Improved swiss-rolling technique for intestinal tissue preparation for immunohistochemical and immunofluorescent analyses. J Vis Exp. (113), e54161 (2016).
- Le Naour, J., et al. Improved swiss-rolling method for histological analyses of colon tissue. MethodsX. 9, 101630 (2022).
- Cardiff, R. D., Miller, C. H., Munn, R. J. Mouse tissue fixation. Cold Spring Harb Protoc. 2014 (5), 073403 (2014).
- Pereira E Silva, A., Lourenço, A. L., Marmello, B. O., Bitteti, M., Teixeira, G. a. P. B. Comparison of two techniques for a comprehensive gut histopathological analysis: Swiss roll versus intestine strips. Exp Mol Pathol. 111, 104302 (2019).
- Williams, J. M., Duckworth, C. A., Vowell, K., Burkitt, M. D., Pritchard, D. M. Intestinal preparation techniques for histological analysis in the mouse. Curr Prot Mouse Biol. 6 (2), 148-168 (2016).
- Boenisch, T. Effect of heat-induced antigen retrieval following inconsistent formalin fixation. Appl Immunohistochem Mol Morphol. 13 (3), 283-286 (2005).
- Hasegawa, Y., Mark Welch, J. L., Rossetti, B. J., Borisy, G. G. Preservation of three-dimensional spatial structure in the gut microbiome. PLoS One. 12 (11), e0188257 (2017).
- Garabedian, E. M., Roberts, L. J., Mcnevin, M. S., Gordon, J. I. Examining the role of paneth cells in the small intestine by lineage ablation in transgenic mice. J Biol Chem. 272 (38), 23729-23740 (1997).
- Moshi, J. M., Ummelen, M., Broers, J. L. V., Ramaekers, F. C. S., Hopman, A. H. N. Impact of antigen retrieval protocols on the immunohistochemical detection of epigenetic DNA modifications. Histochem Cell Biol. 159 (6), 513-526 (2023).
- Krenacs, L., Krenacs, T., Stelkovics, E., Raffeld, M. Heat-induced antigen retrieval for immunohistochemical reactions in routinely processed paraffin sections. Methods Mol Biol. 588, 103-119 (2010).
- Pereira, E. S. A., Lourenco, A. L., Marmello, B. O., Bitteti, M., Teixeira, G. Comparison of two techniques for a comprehensive gut histopathological analysis: Swiss roll versus intestine strips. Exp Mol Pathol. 111, 104302 (2019).
- Bolognesi, M. a. O., et al. Antibodies validated for routinely processed tissues stain frozen sections unpredictably. Bio Techniques. 3 (3), 137-148 (2021).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon
Utilizziamo i cookies per migliorare la tua esperienza sul nostro sito web.
Continuando a utilizzare il nostro sito web o cliccando “Continua”, accetti l'utilizzo dei cookies.