Method Article
Hafif Travmatik Beyin Hasarı Olan Bir Fare Modelinde Kan-Beyin Bariyeri Bozulmasının Değerlendirilmesi
Bu Makalede
Özet
Farelere farklı zaman noktalarında iki floresan boya uygulanarak kan-beyin bariyeri (BBB) bozulmasına bağlı boya ekstravazasyonunu görselleştirmek için bir yöntem geliştirilmiştir. Gliserolün kriyoprotektan olarak kullanılması, aynı numune üzerinde immünohistokimyayı kolaylaştırdı.
Özet
Floresan boyalar, kan-beyin bariyeri (BBB) bozulması nedeniyle meydana gelen boya ekstravazasyonunun derecesini belirlemek için kullanılır. Bu boyalarla etiketleme, kandaki boya konsantrasyonu, beyin damarlarının geçirgenliği, boya ekstravazasyon süresi ve bozunma ve difüzyon nedeniyle dokudaki boya konsantrasyonunun azalması gibi çeşitli faktörlerden etkilenen karmaşık bir işlemdir. Hafif travmatik beyin hasarı modelinde, patlamaya bağlı şok dalgalarına (BSW'ler) maruz kalma, sınırlı bir zaman penceresi içinde BBB bozulmasını tetikler. BBB parçalanmasının kesin sırasını belirlemek için, Evans mavisi ve floresein izotiyosiyanat-dekstran, BSW maruziyetine göre çeşitli zaman noktalarında farelere intravasküler ve intrakardiyal olarak enjekte edildi. Boya floresansının beyin dilimlerindeki dağılımı daha sonra kaydedildi. İki boya arasındaki dağılım ve yoğunluktaki farklılıklar, BBB parçalanmasının uzay-zamansal sırasını ortaya çıkardı. Beyin dilimlerinin immün boyanması, astrositik ve mikroglial yanıtların BBB yıkım bölgeleri ile ilişkili olduğunu gösterdi. Bu protokol, farklı BBB arıza modellerini içeren çalışmalarda uygulama için geniş bir potansiyele sahiptir.
Giriş
Kan-beyin bariyeri (BBB) bozulması ve işlev bozukluğuna sistemik inflamasyon, enfeksiyonlar, otoimmün hastalıklar, yaralanmalar ve nörodejeneratif hastalıklar neden olur1. Patlamaya bağlı şok dalgalarına (BSW'ler) maruz kalmaktan kaynaklanan hafif travmatik beyin hasarında (mTBI), BSW'lerin yoğunluğu ile BBB parçalanmasına bağlı floresan boya sızıntısı miktarı arasında önemli bir korelasyon gözlenmiştir 2,3,4. mTBI'da BBB parçalanmasının dikkate değer bir özelliği, BSW'lere maruz kaldıktan hemen sonra veya birkaç saat içinde başlaması ve genellikle gecikmiş, kronik nörolojik bozuklukların ortaya çıkmasından önce yaklaşık bir hafta süren geçici bir süreç olmasıdır 3,5,6,7. Ayrıntılar belirsizliğini korusa da, BBB dökümü uzun süreli patolojik kaskadının bir parçasıdır ve ayrıca mTBI6'da prognostik bir faktör olarak hizmet edebilir. Bu nedenle, beyindeki BBB bozulmasının uzamsal ve zamansal dağılımlarını anlamak önemlidir.
Floresan boyalar, BBB parçalanmasının derecesini belirlemek için kullanılır 3,8. Boyaların kan konsantrasyonu ve BBB parçalanmasının büyüklüğü ve kapsamı zamanla değiştiğinden, boya ekstravazasyonunun görüntülerini yorumlarken dikkatli olunmalıdır. Örneğin, boya ekstravazasyonunun olmaması, mutlaka BBB parçalanmasının olmadığını göstermez. Boyanın kan konsantrasyonundaki bir artıştan önce veya sonra BBB parçalanması tespit edilemez. Boya, BBB arızasının meydana geldiği yerde başarılı bir şekilde birikmiş olsa bile, arıza durduktan sonra zamanla kaybolmuş olabilir. Genel olarak, suda çözünür ve biyolojik olarak inert maddeler idrarlahızla atılır 9. Bu nedenle, BBB parçalanmasının belirli bir zamanda meydana gelip gelmediğini belirlemek için, en güvenilir sonuçlar, hayvanı sabitlemeden hemen önce kısa bir süre için kan dolaşımına bir floresan boya uygulandığında elde edilir. Belirli bir moleküler ağırlığa sahip ticari olarak temin edilebilen floresein izotiyosiyanat (FITC)-dekstran bu şekilde kullanılmalıdır.
Evans mavisi, serum albümini için güçlü bir afiniteye sahip, yaygın olarak tanınan bir mavi azo boyadır. Boya, biyolojik sistemlerde yeşil ışıkla uyarıldığında kırmızı floresan sergiler2. İnert doğası nedeniyle, Evans mavi-serum albümin kompleksi kanda 2 saate kadar kalır, bu da onu en azından bu süre boyunca tehlikeye atılmış bir BBB'ye sahip bölgeleri etiketlemek için yararlı bir 69 kDa izleyici yapar10,11. Bu nedenle, Evans blue9'un farmakokinetiği ve toksisitesini çevreleyen potansiyel belirsizlikleri dikkate almak önemlidir. Bununla birlikte, yakın zamanda yapılan bir araştırma, Evans mavisinin BBB'nin olmadığı veya bozulduğu alanlarda birikmeye devam ettiğini gösterdi7. Bu özellik, Evans Blue'nun BBB arızasının geçmişini kaydetmesini sağlarken, FITC-dextran, BSW maruziyetinden sonra belirli bir zaman noktasında BBB arızasını kaydetmek için kullanıldı. Evans mavisi intravenöz veya intraperitoneal10 uygulanabilmesine rağmen, zamana duyarlı deneyler için intravenöz uygulama tercih edilir. Bu çalışma, BSW'ye maruz kaldıktan sonra BBB bozulmasının uzay-zamansal dağılımını tespit etmek için Evans mavisi ve FITC-dekstran kullanımını göstermeyi amaçladı.
İkinci olarak, çalışma, BBB parçalanmasının floresansını gözlemledikten ve immünohistokimyasal prosedürlere uygun daha ince dilimler hazırladıktan sonra beyin dilimlerini dondurmak için bir teknik sundu. Gliserolün bir montaj ortamı ve kriyoprotektan olarak kullanılması, immünohistokimya sürecini basitleştirir. BBB parçalanmasının görüntüleri immünohistokimyadan elde edilenlerle karşılaştırılarak, BBB parçalanmasının uzay-zamansal dağılımı aynı örneğin doku yanıtı ile ilişkilendirilebilir.
Protokol
Tüm deneyler, Ulusal Savunma Tıp Koleji (Tokorozawa, Japonya) tarafından belirlenen hayvan deneyleri için etik kurallara uygun olarak gerçekleştirildi. Çalışma protokolü, Ulusal Savunma Tıp Koleji'ndeki Hayvan Araştırmaları Komitesi tarafından onaylandı (onay no. 23011-1). Bu çalışmada 8 haftalık ve 19-23 g ağırlığındaki erkek C57BL/6J fareler kullanıldı. Şekil 1'de gösterildiği gibi, tek bir BSW maruziyetine bağlı olarak çeşitli zaman noktalarında tek bir Evans mavisi enjeksiyonu ve FITC-dekstran perfüzyonu gerçekleştirildi. Kullanılan reaktiflerin ve ekipmanın ayrıntıları Malzeme Tablosunda listelenmiştir.
1. Anestezi
NOT: Bu, medetomidin miktarını orijinaline kıyasla 2,5 kat artıran modifiye edilmiş bir protokoldür12. Medetomidin hidroklorür, midazolam ve butorphanol için dozajlar sırasıyla 0.75 mg / kg, 4 mg / kg ve 5 mg / kg idi.
- Fizyolojik tuzlu su içinde medetomidin hidroklorür (75 μg/mL), midazolam (400 μg/mL) ve butorphanol (500 μg/mL) karışımı hazırlayın.
- Fareyi uyuşturmak için karışımı intraperitoneal olarak uygulayın (10 μL / g)13.
- Yaklaşık 5-10 dakika sonra, kuyruk sıkışması ve pedal çekme reflekslerinin olmadığını gözlemleyerek yeterli anesteziyi doğrulayın.
- Anestezinin etkilerinden kurtulana kadar fareyi sıcak tutun.
2. BSW'ye maruz kalma
NOT: Bu çalışmada kurum içi bir şok tüpü kullanılmıştır14.
- Fareyi adım 1'de anlatıldığı gibi uyuşturun.
- Fareyi şok tüpünün çıkış ucundan 5 cm uzağa yerleştirin ve vücut ekseninin tüpün eksenine paralel olduğundan ancak tüpün ekseniyle hizalanmadığından emin olun.
- Kafaya 25 kPa'lık bir tepe aşırı basıncı ile tek bir BSW maruziyeti sağlayın.
NOT: Anestezinin etkilerinden kurtulana kadar fareyi sıcak tutun. Tedavi edilen farenin durumunu düzenli olarak izleyin. Beslenme veya içme güçlüğü, kamburluk veya iyileşme belirtisi olmadan uzun süreli anormal görünüm gibi sıkıntı belirtileri gözlenirse, fareye ötenazi yapın ve deneyi erken sonlandırın. Glial yanıtı potansiyel olarak etkileyebileceğinden analjezik uygulamaktan kaçının.
3. Kuyruk damarına Evans mavisi enjeksiyonu
NOT: Evans mavisi solüsyonu anestezi olmadan intravenöz olarak uygulanmalıdır. Anestezi varlığında, boya genellikle vücuda yeterince nüfuz etmez, muhtemelen kan basıncının ve vücut sıcaklığının düşmesi nedeniyle13. Evans mavisi 100 mg / kg'lık bir dozda uygulandı.
- Evans mavisi solüsyonunu (tuzlu suda %4 w/v) bir mikrotüpte hazırlayın, ardından girdap yapın ve kullanmadan önce karanlıkta saklayın.
- Solüsyonu kuyruk damarına enjekte edin (2,5 μL/g)13.
4. FITC-dekstran çözeltisi ile transkardiyal perfüzyon ve fiksasyon
- 1 U / mL'lik bir konsantrasyon elde etmek için fosfat tamponlu saline (PBS) heparin ekleyin, daha sonra 3 mg / mL'lik bir konsantrasyon elde etmek için heparinize PBS'ye FITC-dekstran ekleyin.
- Kullanmadan önce FITC-dekstran tozunu tamamen çözün. Bunu yapmak için, çözeltiyi 30 dakika veya daha uzun süre hafifçe çalkalayın. Kullanmadan önce, çözünmemiş FITC-dekstran tozu olup olmadığını dikkatlice kontrol edin. Herhangi bir kalıntı varsa, tamamen eriyene kadar çalkalamaya devam edin.
- Fareyi adım 1'de anlatıldığı gibi uyuşturun.
- Peristaltik bir pompa15,16 kullanarak standart perfüzyon fiksasyon protokolüne devam edin. İlk olarak, FITC-dekstran içeren heparinize PBS ile 4.0 mL / dk hızında 2 dakika perfüz. Daha sonra,% 10 formalin nötr tampon çözeltisi veya% 4 paraformaldehit-PBS ile 4.0 mL / dk oranında 2 dakika, ardından 3.5 mL / dk hızında 8 dakika perfüz.
- Cerrahi makas ve cımbız kullanarak beyni dikkatlice çıkarın15,16. Diseksiyondan sonra, beyni gece boyunca aynı fiksatifte (ör.% 10 formalin nötr tampon çözeltisi veya% 4 paraformaldehit-PBS) 4 ° C'de.
- Ertesi gün, sabitleyiciyi PBS ile değiştirin.
5. Beyin dokusu işleme
NOT: Perfüzyon fiksasyonu tamamlansa bile, Evans mavisi ve FITC-dekstran tampona dağılabilir. Bu nedenle, adım 6.8'e kadar olan prosedürler perfüzyon fiksasyonundan sonraki bir hafta içinde tamamlanmalıdır. Ek olarak, numuneyi ışığa maruz bırakmaktan kaçının.
- Her oyukta fosfat tamponunda (PB; pH 7.4) 500 μL% 20 gliserol içeren 24 oyuklu bir plaka hazırlayın.
- Bir beyin dilimleyici kullanarak, beyni koronal olarak her biri 1 mm kalınlığında 12 dilim halinde kesin.
- Her dilimi 24 oyuklu plakanın ilgili kuyucuğuna aktarın ve en az 2 saat boyunca 4 ° C'de saklayın.
- Çözeltiyi %50 gliserol-PB ile değiştirin ve en az 2 saat boyunca 4 ° C'de saklayın.
- Son olarak, çözeltiyi% 100 gliserol ile değiştirin. Anında mikroskobik gözlem için, dilimlerin oda sıcaklığında en az 2 saat bekletilmesine izin verin veya 4 °C'de saklayın. Dilimler şimdi yarı saydam olacak ve mikroskobik gözlem için hazır olacak.
6. Boya ekstravazasyonunun floresan ölçümü
NOT: Floresan etiketleme verimliliği fareden fareye değişir. Bu nedenle, floresan yoğunluğunun normalleştirilmesi gerekir. Floresan değerleri, gigantosellüler retiküler çekirdek (GRN) içindeki değerlere göre ifade edilir, çünkü bu bölge BSW tedavisinden minimum düzeyde etkilenir.
- 35 mm'lik cam tabanlı bir tabağın dibine 500 μL gliserol ekleyin.
- Dilimi gliserol çözeltisine aktarın ve yüzeyini bir örtü camı ile kaplayın.
- Kapak camının kenarındaki fazla gliserol'ü çıkarın.
- Floresan mikroskobu altında dilimin floresan yoğunluğunu ölçün.
- Mikroskobik ölçümden sonra dilimi kuyuya geri koyun.
- 12 dilimin tümü için ölçümü tekrarlayın.
- Her kuyucuğa 500 μL PB ekleyin ve 24 oyuklu plakayı gece boyunca 4 °C'de saklayın; ertesi gün dilimler %50 gliserol-PB ile doyurulacaktır.
- Solüsyonu %30 gliserol-PB ile değiştirin ve en az 2 saat 4 °C'de saklayın.
- 7. adımdaki prosedürleri birkaç hafta içinde gerçekleştirin.
7. Kriyoseksiyon ve immünohistokimya
- Kuyu 1'e 1000 μL eşit hacimlerde doku dondurma ortamı ve% 30 gliserol-PB karışımı ekleyerek 24 oyuklu bir plaka hazırlayın. Daha sonra, kuyu 2'ye 1000 μL doku dondurma ortamı ekleyin.
- Dilimi 1 numaralı kuyuya aktarın ve plakayı 4 °C'de 1 saat çalkalayın.
- Dilimi kuyu 2'ye aktarın ve plakayı 4 °C'de 1 saat çalkalayın.
- Dilimi bükmemeye dikkat ederek kuru buz kullanarak dilimi izopentan ile hızlı bir şekilde dondurun. Dilimleri kriyoseksiyona kadar -80 °C'de saklayın.
- Dilimi 6 μm kalınlığa kadar kriyoseksiyon. Mikroskop lamı üzerinde kuruduktan sonra kesitleri -80 °C'de saklayın.
- Antijen alımı17 için, bölümleri 10 mM sodyum sitrat (pH 6.0) içine daldırın, bir kez 100 °C'ye ısıtın ve ardından 1 saat boyunca 98 °C'de tutun.
- Bölümleri damıtılmış suda iyice yıkayın. Kesitler artık immünohistokimyasal boyama için hazırdır.
Sonuçlar
Şekil 1A , 25 kPa'lık bir tepe aşırı basıncı ile BSW'nin başlangıcına göre boya enjeksiyonunun zaman seyrini göstermektedir. 'Post' protokolünde, Evans blue solüsyonu, BSW maruziyetinden 6 saat, 1 gün, 3 gün ve 7 gün sonra gerçekleştirilen FITC-dekstran perfüzyonundan 2 saat önce intravasküler olarak uygulandı. 'Ön' protokolde, BSW maruziyetinden hemen önce Evans mavisi çözeltisi enjekte edildi. 'Post' protokolünde, Evans mavisi konsantrasyonunun perfüzyon fiksasyonundan yaklaşık 2 saat önce maksimuma ulaşması beklenirken, 'Pre' protokolünde, BSW'ye maruz kalma süresi boyunca maksimuma ulaşması beklenir (Şekil 1B). Beyin-kan damarlarındaki FITC-dekstran konsantrasyonu, perfüzyon sırasında 2 dakika boyunca sabit tutuldu.
Evans mavi etiketlemesi, BBB bozulmasının 6 saat içinde başladığını ve BSW maruziyetinden 7 gün sonrasına kadar devam ettiğini gösterdi (Şekil 2A). Özellikle, 'Pre' protokolünde 3 saatte Evans mavi boya ekstravazasyonu olmadığından, BSW maruziyetinden hemen sonra BBB arızası meydana gelmedi (Şekil 2B). Şaşırtıcı bir şekilde, Evans mavisi ile uzun vadeli etiketleme, 'Ön' protokolündeki kümülatif doğasını gösterdi (Şekil 2B)7.
Her biri 2 saat veya daha uzun aralıklarla sokulan iki farklı boyanın kullanılması, dağılımlarını karşılaştırarak BBB bütünlüğündeki zamansal değişikliklerin incelenmesine izin verdi. Şekil 3 , Evans mavisi ve FITC-dekstran dağılımında önemli bir fark sergileyen dilimlerin floresan görüntülerini göstermektedir.
Çeşitli boyutlarda çok sayıda floresan sıcak noktası gözlendi. Bazı sıcak noktalar piksellerin ilk %0,1'i arasında yer alacak kadar parlak olsa da, birçoğu çevredeki dokulardan yalnızca biraz daha parlaktı. Boyalar arasındaki tutarsızlık, değişikliklerin bu aralıkta meydana geldiğini göstermektedir. Yalnızca Evans mavisi floresansını gösteren sıcak noktalar, Evans mavisi enjeksiyonu sırasında devam eden BBB bozulmasını gösterdi ve bu daha sonra FITC-dekstran enjeksiyonu ile onarıldı. Buna karşılık, sadece FITC-dekstran floresan gösteren sıcak noktalar, iki boya enjeksiyonu arasında BBB bozulmasının meydana geldiğini düşündürdü. Son olarak, her iki boyadan floresan sergileyen sıcak noktalar, tüm enjeksiyon süresi boyunca sürekli BBB bozulmasını gösterdi.
Şekil 4A , Evans mavisi (hem yalnızca Evans mavisi hem de Evans mavisi/FITC-dekstran çift pozitif sıcak noktalar dahil), FITC-dekstran (hem FITC-dekstran hem de Evans mavisi/FITC-dekstran çift pozitif sıcak noktalar dahil) veya her iki boya (yalnızca Evans mavisi/FITC-dekstran çift pozitif sıcak noktalar) için pozitif sıcak noktaların sayısını sunar. 3 saatteki 'Ön' protokolde, yalnızca FITC-dekstran içeren çok sayıda sıcak nokta gözlendi. 'Post' protokolünde 6 saat ve 1 günde, hem Evans'ın yalnızca mavi hem de yalnızca FITC-dekstran sıcak noktaları tespit edildi. Bununla birlikte, 'Post' protokolünde 3 gün ve 7 günde, sıcak noktalar her iki boya için de ağırlıklı olarak pozitifti. Bu bulgular, BBB bozulmasının 3 saatte meydana geldiğini, 1 gün yeniden şekillendiğini ve BSW maruziyetinden 7 gün sonrasına kadar devam ettiğini göstermektedir (Şekil 4B). Daha da önemlisi, BBB dökümünün kapsamı, daha önce de belirtildiği gibi 7 gün azalma eğilimindeydi.
Boya ekstravazasyon deneylerinin tamamlanmasını takiben, dilimlerin immünohistokimyasal boyanması gerçekleştirildi7. İmmünohistokimyasal görüntü taramaları, boya ekstravazasyonlarınınkilerle tutarlı bir şekilde karşılaştırıldı ve floresan maddelerin taşınma etkisinin pratik olarak ihmal edilebilir olduğunu doğruladı7. Şekil 5'te gösterildiği gibi, reaktif astrosit kümeleri BBB parçalanma bölgeleri ile yakından ilişkiliydi. Daha ileri gözlemler, BSW maruziyetinden 3 gün sonra reaktif astrositlerin yanı sıra aktive ve amip mikrogliasının mevcut olduğunu ortaya koydu.

Şekil 1: Deney tasarımı. (A) Deneyin zaman seyri. Evans mavisi solüsyonu, BSW maruziyetinden sonra ('Post' protokol) veya hemen önce ('Pre' protokol) intravenöz olarak enjekte edilirken, FITC-dekstran fiksasyondan 2 dakika önce transkardiyal olarak perfüze edildi. (B) Sırasıyla 'Post' ve 'Pre' protokollerinde kan damarlarında beklenen Evans blue ve FITC-dekstran konsantrasyonları. BSW, patlama kaynaklı şok dalgaları; FITC, floresein izotiyosiyanat. Bu rakam Nishii ve ark.7'den uyarlanmıştır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Beyin dilimlerindeki floresan yoğunluğunun karşılaştırılması. Beyindeki piksellerin en parlak %0,1'inin floresan yoğunluğu 12 dilimin tamamında değerlendirildi ve 'Post' (A) ve 'Pre' (B) koşulları arasında karşılaştırıldı. Farklılıkların değişkenliği ve önemi belirtilmiştir. xxx, p < 0.001'i gösterir; xxxx, p < 0.0001'i gösterir (F-testinden p değerleri). *p < 0.05; p < 0.0001 (Dunnett'in çoklu karşılaştırmaları post hoc testi ile varyans analizi). Bu rakam Nishii ve ark.7'den uyarlanmıştır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
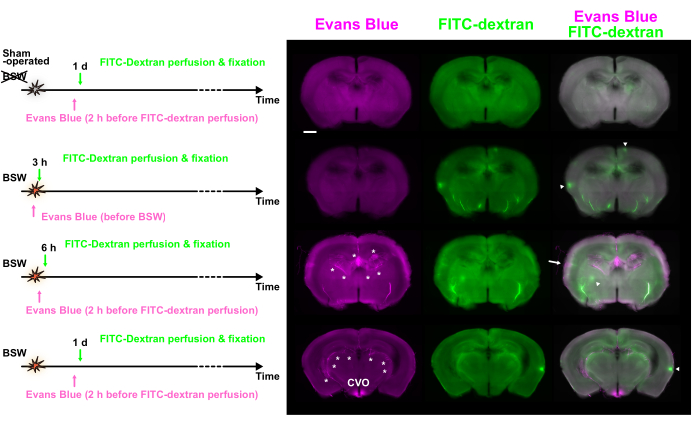
Şekil 3: Evans blue ve FITC-dextran ile çift etiketleme kullanılarak çeşitli zaman noktalarında gözlemlenen BBB dökümü. Evans mavisi (macenta), FITC-dekstran (yeşil) ve birleştirilmiş görüntüler gösterilir. Boya enjeksiyon protokolleri sol tarafta sunulmuştur. Bazı sıcak noktalar, Evans mavisi (ok) veya FITC-dekstran (ok uçları) baskın floresan gösterdi. Yıldız işaretleri koroid pleksus ve ilgili damarları gösterir. BBB, kan-beyin bariyeri; FITC, floresein izotiyosiyanat; CVO, üçüncü ventrikülün çevresel organları. Ölçek çubuğu: 1 mm. Bu rakam Nishii ve ark.7'den uyarlanmıştır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: Floresan sıcak noktalarının miktarının belirlenmesi. (A) Evans mavisi (macenta), FITC-dekstran (yeşil) ve her iki boya (gri) için pozitif sıcak noktaların sayısı. 'Pre' protokolünde 3. saatte elde edilen görüntülerden ve 'Post' protokolünde 6. saat, 1 gün, 3 gün ve 7 günde elde edilen görüntülerden toplanmıştır. 3 saatten 1 güne kadar, floresan sıcak noktalarının önemli bir kısmı boyalar arası bir uyumsuzluk gösterirken, 3 günden 7 güne kadar bu tür bir uyumsuzluk neredeyse hiç gözlenmedi. (B) BBB dağılımının zaman seyrini özetleyen şema. Dikey eksen kavramsal olarak BBB bozulmasından kaynaklanan boya sızıntısının yoğunluğunu temsil eder. 3 saatten 1 güne kadar olan zikzak deseni, bu süre zarfında boya sızıntısının yerinin ve yoğunluğunun kararsız olduğunu gösterir. FITC, floresein izotiyosiyanat; BBB, kan-beyin bariyeri; BSW, patlama kaynaklı şok dalgaları. Bu rakam Nishii ve ark.7'den uyarlanmıştır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
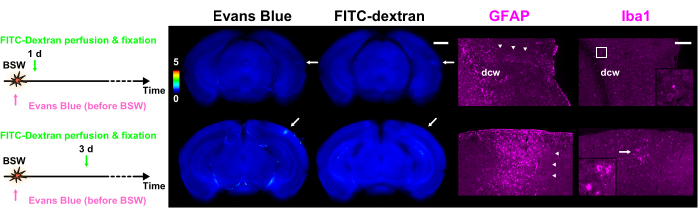
Şekil 5: Sırasıyla astrositler ve mikroglia için belirteçler olarak GFAP ve Iba1'in ekspresyonu. Şeklin her bir sütunu, GFAP veya Iba1 immünohistokimyasal görüntülerin yanı sıra Evans mavisi veya FITC-dekstran ile boya ekstravazasyonunun floresan görüntülerini içerir. Renk çubuğu, GRN içindekileri kullanarak Evans mavisi ve FITC-dekstran'ın normalleştirilmiş floresan yoğunluklarını gösterir. Boya enjeksiyon protokolleri sol tarafta sunulmuştur. 'Pre' protokolündeki 1 günlük dilim hem Evans mavisi hem de FITC-dekstran'ın floresansını gösterirken, 'Pre' protokolündeki 3 günlük dilim sadece Evans mavisinin floresansını (oklar) gösterir. Boya ekstravazasyon görüntülerinde oklarla gösterilen bölgeler immünohistokimyasal görüntülerle aynı hizadadır. Ok uçları reaktif astrosit kümelerini gösterir. Poliklonal GFAP antikoru, beyaz cevherin içinde ve çevresinde ve ayrıca pia materyaline bitişik sinir dokusunda astrositleri işaretledi. Sonuç olarak, dcw içindeki ve yakınındaki astrositler bu şekilde etiketlenmiştir. Iba1 sütunundaki çerçeveye veya oka karşılık gelen büyütülmüş görüntüler iç kısımlarda gösterilir. Ölçek çubukları: Boya ekstravazasyonu ve immünohistokimyasal görüntüler için sırasıyla 1 mm ve 200 μm. GFAP, glial fibriler asidik protein; Iba1, iyonize kalsiyum bağlayıcı adaptör molekülü 1; FITC, floresein izotiyosiyanat; BSW, patlama kaynaklı şok dalgaları; DCW, derin serebral beyaz madde. Bu rakam Nishii ve ark.7'den uyarlanmıştır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Tek bir beyinde BBB parçalanmasının kesin uzay-zamansal dağılımını doğru bir şekilde görselleştirmek için Evans mavisi ve FITC-dekstran kullanan yeni bir çift etiketleme tekniği kullanıldı. Düşük yoğunluklu BSW modelinde, incelenen beyinlerde boya ekstravazasyonunun kapsamı, yeri ve derecesinde gözle görülür değişiklikler gözlenmiştir (Şekil 2 ve Şekil 3). Boyalar arası uyumsuzluklar, BBB bozulmasının BSW maruziyetinden yaklaşık 3 saat sonra başladığını, önemli yeniden şekillenmenin 1. günde meydana geldiğini ve 7. güne kadar devam ettiğini ortaya koydu (Şekil 4). Şiddetli vakalarda, aktif mikroglia, BBB parçalanma bölgelerine alındı ve reaktif astrosit kümeleri bu alanlarla yakından bağlantılıydı (Şekil 5). Boya ekstravazasyon analizi için kullanılan aynı dilimler üzerinde immünohistokimya yapılarak, glial reaksiyonlar ile boya ekstravazasyonu arasında kesin bir korelasyon kuruldu. Daha ayrıntılı veri ve analiz için lütfen Nishii ve ark.7'ye bakın.
FITC-dekstran, perfüzyon fiksasyonundan hemen önce aynı süre boyunca sabit bir konsantrasyonda perfüze edildiğinden, boyanın dağılımı ve yoğunluğu muhtemelen perfüzyon fiksasyonu sırasında BBB parçalanmasının derecesini doğru bir şekilde temsil eder. Bununla birlikte, önceki bir raporda, FITC-dekstran'ın floresansının düşük yoğunluklu bir BSW model7'de zayıf olma eğiliminde olduğu gösterilmiştir. Evans mavisi ile daha uzun süre etiketlemek, BBB dökümündeki daha ince değişiklikleri tespit edebildiği için avantajlıydı (Şekil 2). Bununla birlikte, etiketleme süresinin daha uzun olması nedeniyle, Evans mavisinin floresan görüntülerini yorumlarken dikkatli olunması gerekebilir. Evans mavisinin kan konsantrasyonu enjeksiyondan hemen sonra en yüksekti ve birkaç saat içinde kademeli olarak azaldı (Şekil 1)11. Etiketleme yoğunluğunun, BBB bozulmasının ciddiyeti ve süresi ile Evans mavisinin kan konsantrasyonu ile ilişkili olacağı tahmin edilmektedir; ancak, tamir edildikten sonra katlanarak azalacaktır. Bu faktörlerin tümü zaman zaman ve bir deneyden diğerine değişir. Bu nedenle, tek bir boya ekstravazasyonu görüntüsünden bir sonuç çıkarılmamalıdır ve istatistiksel hususlar her zaman gereklidir.
Deneyin amacına bağlı olarak, moleküler ağırlığın yanı sıra boyaların kombinasyonunu değiştirmek de ilginç olabilir. Bu çalışmada Evans Blue ve FITC-dekstran kombinasyonu kullanılmıştır. Serum albümini ile bağlandıktan sonra, Evans mavisi 69 kDa izleyici gibi davrandı ve bu çalışmada kullanılan 40 kDa FITC-dekstran, Evans mavisi ile benzer bir BBB parçalanması derecesi gösterdi. BBB parçalanmasının uzay-zamansal dağılımı, farklı floresan7 yayan boyaların bir kombinasyonu kullanılarak sistematik olarak araştırıldı. Evans mavisi ve sodyum floresein (376 Da) kombinasyonunu kullanan önceki bir çalışmada, sodyum floresein, daha küçük moleküler ağırlığı nedeniyle, BSW maruziyetinden sonra daha geniş bir BBB parçalanması aralığını etiketleyebilir3. Diğer çalışmalarda, BBB parçalanmasının derecesini karşılaştırmak için Evans mavisi ve daha yüksek moleküler ağırlıklı FITC-dekstran kombinasyonları kullanıldı18,19. Önceki tüm raporlarda Evans blue ve FITC-dekstran neredeyse aynı anda uygulandı. Burada sunulan protokolün benzersiz yönü, iki boyanın farklı zaman noktalarında tanıtılması ve BBB bozulmasının zamansal ilerlemesinin incelenmesine izin vermesidir.
Evans mavisinin kümülatif doğası, farklı BBB arıza modellerinde faydalı olabilir. BBB yıkımının geçmişini kaydettiği için, hastalığın başlangıcının ve ilerlemesinin anlaşılması kolaylaştırılabilir. Araştırmacılar boyaların olumlu ve olumsuz özelliklerinin farkında olmalı ve bunları en üst düzeyde kullanmalıdır9. Bu protokol, çeşitli BBB arıza modelleri için geniş bir uygulama yelpazesine sahiptir.
Açıklamalar
Yazarların ifşa edecek hiçbir şeyi yok.
Teşekkürler
Kriyoseksiyon tekniği için Mayumi Watanabe'ye teşekkür ederiz. Bu çalışma, Japonya Savunma Bakanlığı'ndan Askeri Tıp Üzerine İleri Araştırma hibesi ile desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 10% Formalin Neutral Buffer Solution | FUJIFILM Wako Chemicals | 062-01661 | |
| Anti GFAP, Rabbit | DAKO-Agilent | IR524 | |
| Anti Iba1, Rabbit | FUJIFILM Wako Chemicals | 019-19741 | |
| Chicken anti-Mouse IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 488 | Thermo Fisher Scientific | A-21200 | |
| Cryo Mount | Muto Pure Chemicals | 33351 | tissue freezing medium |
| Domitor | Orion Corporation | medetomidine | |
| Donkey anti-Rabbit IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 546 | Thermo Fisher Scientific | A10040 | |
| Evans Blue | Sigma-Aldrich | E2129 | |
| Falcon 24-well Polystyrene Clear Flat Bottom Not Treated Cell Culture Plate, with Lid, Individually Wrapped, Sterile, 50/Case | CORNING | 351147 | |
| Fluorescein isothiocyanate–dextran average mol wt 40,000 | Sigma-Aldrich | FD40S | FITC-dextran |
| Glass Base Dish 27mm (No.1 Glass) | AGC TECHNO GLASS | 3910-035 | 35 mm glass bottom dish |
| IX83 Inverted Microscope | OLYMPUS | ||
| MAS Hydrophilic Adhesion Microscope Slides | Matsunami Glass | MAS-04 | |
| Matsunami Cover Glass (No.1) 18 x 18mm | Matsunami Glass | C018181 | |
| Midazolam Injection 10mg [SANDOZ] | Sandoz | ||
| Paraformaldehyde EMPROVE ESSENTIAL DAC | Merck Millipore | 1.04005.1000 | |
| Peristaltic Pump | ATTO | SJ-1211 II-H | |
| RODENT BRAIN MATRIX Adult Mouse, 30 g, Coronal | ASI INSTRUMENTS | RBM-2000C | brain slicer |
| Vetorphale | Meiji Animal Health | VETLI5 | butorphanol |
Referanslar
- Sweeney, M. D., Zhao, Z., Montagne, A., Nelson, A. R., Zlokovic, B. V. Blood-brain barrier: From physiology to disease and back. Physiol Rev. 99 (1), 21-78 (2019).
- Kabu, S., et al. Blast-associated shock waves result in increased brain vascular leakage and elevated ros levels in a rat model of traumatic brain injury. PLoS One. 10 (5), e0127971(2015).
- Kuriakose, M., Rama Rao, K. V., Younger, D., Chandra, N. Temporal and spatial effects of blast overpressure on blood-brain barrier permeability in traumatic brain injury. Sci Rep. 8 (1), 8681(2018).
- Yeoh, S., Bell, E. D., Monson, K. L. Distribution of blood-brain barrier disruption in primary blast injury. Ann Biomed Eng. 41 (10), 2206-2214 (2013).
- Readnower, R. D., et al. Increase in blood-brain barrier permeability, oxidative stress, and activated microglia in a rat model of blast-induced traumatic brain injury. J Neurosci Res. 88 (16), 3530-3539 (2010).
- Shetty, A. K., Mishra, V., Kodali, M., Hattiangady, B. Blood-brain barrier dysfunction and delayed neurological deficits in mild traumatic brain injury induced by blast shock waves. Front Cell Neurosci. 8, 232(2014).
- Nishii, K., et al. Evans blue and fluorescein isothiocyanate-dextran double labeling reveals the precise sequence of vascular leakage and glial responses after exposure to mild-level blast-associated shock waves. J Neurotrauma. 40 (11-12), 1228-1242 (2023).
- Hoffmann, A., et al. High and low molecular weight fluorescein isothiocyanate (FITC)-dextrans to assess blood-brain barrier disruption: Technical considerations. Transl Stroke Res. 2 (1), 106-111 (2011).
- Saunders, N. R., Dziegielewska, K. M., Møllgård, K., Habgood, M. D. Markers for blood-brain barrier integrity: How appropriate is Evans blue in the twenty-first century and what are the alternatives. Front Neurosci. 9, 385(2015).
- Manaenko, A., Chen, H., Kammer, J., Zhang, J. H., Tang, J. Comparison Evans blue injection routes: Intravenous versus intraperitoneal, for measurement of blood-brain barrier in a mice hemorrhage model. J Neurosci Methods. 195 (2), 206-210 (2011).
- Yen, L. F., Wei, V. C., Kuo, E. Y., Lai, T. W. Distinct patterns of cerebral extravasation by Evans blue and sodium fluorescein in rats. PLoS One. 8 (7), e68595(2013).
- Kawai, S., Takagi, Y., Kaneko, S., Kurosawa, T. Effect of three types of mixed anesthetic agents alternate to ketamine in mice. Exp Anim. 60 (5), 481-487 (2011).
- Machholz, E., Mulder, G., Ruiz, C., Corning, B. F., Pritchett-Corning, K. R. Manual restraint and common compound administration routes in mice and rats. J Vis Exp. 67, e2771(2012).
- Satoh, Y., et al. Molecular hydrogen prevents social deficits and depression-like behaviors induced by low-intensity blast in mice. J Neuropathol Exp Neurol. 77 (9), 827-836 (2018).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. J Vis Exp. 65, e3564(2012).
- Selever, J., Kong, J. Q., Arenkiel, B. R. A rapid approach to high-resolution fluorescence imaging in semi-thick brain slices. J Vis Exp. 53, e2807(2011).
- Jiao, Y., et al. A simple and sensitive antigen retrieval method for free-floating and slide-mounted tissue sections. J Neurosci Methods. 93 (2), 149-162 (1999).
- Nagaraja, T. N., Keenan, K. A., Fenstermacher, J. D., Knight, R. A. Acute leakage patterns of fluorescent plasma flow markers after transient focal cerebral ischemia suggest large openings in blood-brain barrier. Microcirculation. 15 (1), 1-14 (2010).
- Xu, Y., et al. Quantifying blood-brain-barrier leakage using a combination of Evans blue and high molecular weight fitc-dextran. J Neurosci Methods. 325, 108349(2019).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır