Method Article
Оценка разрушения гематоэнцефалического барьера на мышиной модели легкой черепно-мозговой травмы
В этой статье
Резюме
Был разработан метод визуализации экстравазации красителя из-за разрушения гематоэнцефалического барьера (ГЭБ) путем введения двух флуоресцентных красителей мышам в разные моменты времени. Использование глицерина в качестве криопротектора способствовало иммуногистохимии на том же образце.
Аннотация
Флуоресцентные красители используются для определения степени экстравазации красителя, которая происходит из-за разрушения гематоэнцефалического барьера (ГЭБ). Мечение этими красителями является сложным процессом, на который влияют несколько факторов, таких как концентрация красителей в крови, проницаемость сосудов головного мозга, продолжительность экстравазации красителя и снижение концентрации красителя в ткани из-за деградации и диффузии. В модели легкой черепно-мозговой травмы воздействие ударных волн, вызванных взрывом (BSW), вызывает разрушение BBB в течение ограниченного временного окна. Для определения точной последовательности распада ГЭБ синий Эванса и флуоресцеин изотиоцианат-декстран вводили мышам внутрисосудисто и интракардиально в различные моменты времени относительно воздействия ББО. Затем было зарегистрировано распределение флуоресценции красителя в срезах мозга. Различия в распределении и интенсивности между двумя красителями выявили пространственно-временную последовательность распада ГЭБ. Иммуноокрашивание срезов мозга показало, что астроцитарные и микроглиальные реакции коррелируют с местами распада ГЭБ. Этот протокол имеет широкий потенциал для применения в исследованиях с использованием различных моделей пробоя ГЭБ.
Введение
Разрушение и дисфункция гематоэнцефалического барьера (ГЭБ) вызваны системным воспалением, инфекциями, аутоиммунными заболеваниями, травмами и нейродегенеративными заболеваниями1. При легкой черепно-мозговой травме (ЧМТ), возникшей в результате воздействия ударных волн, вызванных взрывом (ЧМТ), наблюдалась значимая корреляция между интенсивностью ЧМТ и величиной утечки флуоресцентного красителя из-за пробоя ГЭБ 2,3,4. Одной из примечательных особенностей распада ГЭБ при ЧМТ является то, что он начинается сразу или в течение нескольких часов после воздействия ЧМТ и обычно является преходящим процессом, который длится около недели, прежде чем появятся отсроченные хронические неврологические расстройства. Хотя детали остаются неясными, распад ГЭБ является частью длительного патологического каскада и также может служить прогностическим фактором при ЧМТ6. Поэтому важно понимать пространственное и временное распределение распада ГЭБ в мозге.
Флуоресцентные красители используются для определения степени распада ГЭБ 3,8. Поскольку концентрация красителей в крови, а также величина и степень распада ГЭБ изменяются со временем, требуется осторожность при интерпретации изображений экстравазации красителя. Например, отсутствие экстравазации красителя не обязательно указывает на отсутствие распада ГЭБ. Распад ГЭБ не может быть обнаружен ни до, ни после повышения концентрации красителя в крови. Даже если краситель успешно накопился в месте распада BBB, он мог быть потерян со временем после того, как распад прекратился. В целом, водорастворимые и биологически инертные вещества быстро выводятся с мочой9. Поэтому для определения того, происходит ли распад ГЭБ в конкретное время, наиболее достоверные результаты получаются при введении флуоресцентного красителя в кровоток на короткий период непосредственно перед фиксацией животного. Таким образом следует использовать коммерчески доступный флуоресцеин изотиоцианат (ФИТК)-декстран с определенной молекулярной массой.
Evans blue — широко известный синий азокраситель с сильным сродством к сывороточному альбумину. Краситель проявляет красную флуоресценцию при возбуждении зеленым светом в биологических системах2. Из-за своей инертной природы синесывороточный альбуминный комплекс Эванса остается в крови до 2 ч, что делает его полезным индикатором 69 кДа для мечения областей с скомпрометированным ГЭБ в течение как минимум этого времени 10,11. Поэтому важно учитывать потенциальные неопределенности, связанные с фармакокинетикой и токсичностью синегоЭванса 9. Тем не менее, недавнее исследование показало, что синий цвет Эванса продолжает накапливаться в областях, где ГЭБ отсутствует или нарушен7. Эта функция позволила Эвансу Блю записать историю пробоя ГЭБ, в то время как ФИТК-декстран использовался для записи пробоя ГЭБ в определенный момент времени после воздействия ББВ. Хотя Evans blue можно вводить внутривенно или внутрибрюшинно10, внутривенное введение предпочтительно для экспериментов, чувствительных ко времени. Это исследование было направлено на демонстрацию использования синего Эванса и ФИТК-декстрана для обнаружения пространственно-временного распределения распада ГЭБ после воздействия БМВ.
Во-вторых, в исследовании была представлена техника замораживания срезов мозга после наблюдения за флуоресценцией распада ГЭБ и получения более тонких срезов, пригодных для иммуногистохимических процедур. Использование глицерина в качестве монтажной среды и криопротектора упрощает процесс иммуногистохимии. Сравнивая изображения распада ГЭБ с изображениями иммуногистохимии, пространственно-временное распределение распада ГЭБ может быть коррелировано с реакцией тканей того же образца.
протокол
Все эксперименты проводились в соответствии с этическими принципами для экспериментов на животных, установленными Национальным медицинским колледжем обороны (Токорозава, Япония). Протокол исследования был одобрен Комитетом по исследованиям на животных Медицинского колледжа Национальной обороны (одобрение No 23011-1). В исследовании использовались самцы мышей C57BL/6J в возрасте 8 недель и массой 19-23 г. Как показано на рисунке 1, однократная инъекция синего цвета Эванса и перфузия FITC-декстрана выполнялись в различные моменты времени в связи с однократным воздействием BSW. Подробная информация об используемых реагентах и оборудовании приведена в Таблице материалов.
1. Анестезия
ПРИМЕЧАНИЕ: Это модифицированный протокол, который увеличивает количество медетомидина в 2,5 раза по сравнению с исходным12. Дозировки медетомидина гидрохлорида, мидазолама и буторфанола составляли 0,75 мг/кг, 4 мг/кг и 5 мг/кг соответственно.
- Приготовьте смесь медетомидина гидрохлорида (75 мкг/мл), мидазолама (400 мкг/мл) и буторфанола (500 мкг/мл) в физиологическом растворе.
- Вводите смесь внутрибрюшинно для обезболивания мыши (10 мкл/г)13.
- Примерно через 5-10 минут убедитесь в достаточной анестезии, наблюдая за отсутствием рефлексов защемления хвоста и отвода педалей.
- Держите мышь в тепле до тех пор, пока она не оправится от последствий анестезии.
2. Подверженность BSW
ПРИМЕЧАНИЕ: В этом исследовании использовалась электрошоковая трубка собственного производства14.
- Обезболите мышь, как описано в шаге 1.
- Расположите мышь на расстоянии 5 см от выходного конца ударной трубки, убедившись, что ось ее корпуса параллельна, но не выровнена по оси трубки.
- Подайте в голову однократное воздействие BSW с пиковым избыточным давлением 25 кПа.
ПРИМЕЧАНИЕ: Держите мышь в тепле, пока она не оправится от последствий анестезии. Регулярно контролируйте состояние обработанной мыши. Если наблюдаются признаки дистресса, такие как трудности с кормлением или питьем, сгорбливание или длительный аномальный внешний вид без признаков выздоровления, усыпьте мышь и прекратите эксперимент досрочно. Избегайте введения анальгетиков, так как они потенциально могут повлиять на глиальную реакцию.
3. Инъекция Evans blue в хвостовую вену
ПРИМЕЧАНИЕ: Раствор Evans blue следует вводить внутривенно без анестезии. При наличии анестезии краситель часто недостаточно проникает в организм, вероятно, из-за снижения артериального давленияи температуры тела. Эванс синий вводили в дозе 100 мг/кг.
- Приготовьте раствор синего Эванса (4% по весу в физрастворе) в микропробирке, затем смешайте и храните в темноте перед использованием.
- Введите раствор в хвостовую вену (2,5 μл/г)13.
4. Транскардиальная перфузия раствором ФИТК-декстрана и фиксация
- Добавьте гепарин в фосфатно-солевой буфер (PBS) для получения концентрации 1 Ед/мл, затем добавьте FITC-декстран к гепаринизированному PBS для достижения концентрации 3 мг/мл.
- Перед применением полностью растворите порошок ФИТК-декстрана. Для этого нужно аккуратно встряхивать раствор в течение 30 мин или более. Перед использованием тщательно проверьте наличие нерастворенного порошка FITC-декстрана. Если что-то осталось, продолжайте встряхивать до полного его растворения.
- Обезболите мышь, как описано в шаге 1.
- Продолжайте работу по стандартному протоколу перфузионной фиксации с помощью перистальтического насоса15,16. Сначала проводят перфузию гепаринизированным PBS, содержащим FITC-декстран, в течение 2 мин со скоростью 4,0 мл/мин. Затем перфузируют 10% нейтральным буферным раствором формалина или 4% параформальдегидом-PBS в течение 2 мин со скоростью 4,0 мл/мин, а затем 8 мин со скоростью 3,5 мл/мин.
- Аккуратно удалите мозг с помощью хирургических ножниц и пинцета15,16. После вскрытия зафиксируйте мозг на ночь в том же фиксаторе (т.е. 10% нейтральном буферном растворе формалина или 4% параформальдегиде-PBS) при температуре 4 °C.
- На следующий день замените фиксатор на PBS.
5. Обработка тканей мозга
ПРИМЕЧАНИЕ: Даже если фиксация перфузии завершена, синий Эванса и ФИТК-декстран могут дисперсировать в буфере. Таким образом, процедуры, ведущие к шагу 6.8, должны быть завершены в течение недели после перфузионной фиксации. Кроме того, не подвергайте образец воздействию света.
- Приготовьте 24-луночный планшет с 500 мкл 20% глицерина в фосфатном буфере (PB; pH 7,4) в каждой лунке.
- С помощью слайсера для мозга разрежьте мозг коронально на 12 срезов, каждый толщиной 1 мм.
- Переложите каждый ломтик в соответствующую лунку 24-луночного планшета и храните его при температуре 4 °C не менее 2 часов.
- Замените раствор 50% глицерином-PB и храните его при температуре 4 °C не менее 2 часов.
- Наконец, замените раствор на 100% глицерин. Для немедленного микроскопического наблюдения дайте ломтикам постоять не менее 2 часов при комнатной температуре или храните их при температуре 4 °C. Теперь срезы будут полупрозрачными и готовыми к микроскопическому наблюдению.
6. Флуоресцентное измерение экстравазации красителя
ПРИМЕЧАНИЕ: Эффективность флуоресцентного мечения варьируется от мыши к мыши. Поэтому интенсивность флуоресценции необходимо нормализовать. Значения флуоресценции выражаются относительно значений в пределах гигантоцеллюлярного ретикулярного ядра (GRN), поскольку эта область минимально поражается при лечении BSW.
- Добавьте 500 μL глицерина на дно 35-миллиметровой посуды со стеклянным дном.
- Переложите срез в раствор глицерина и накройте его поверхность покровным стеклом.
- Удалите излишки глицерина с края покровного стекла.
- Измерьте интенсивность флуоресценции среза под флуоресцентным микроскопом.
- После микроскопических измерений верните срез в лунку.
- Повторите измерение для всех 12 ломтиков.
- Добавьте 500 μL PB в каждую лунку и храните 24-луночный планшет при температуре 4 °C в течение ночи; на следующий день ломтики будут насыщены 50% глицерином-PB.
- Замените раствор 30% глицерином-PB и храните при температуре 4 °C не менее 2 часов.
- Выполните процедуры, описанные на шаге 7, в течение нескольких недель.
7. Криосекция и иммуногистохимия
- Приготовьте 24-луночный планшет, добавив в лунку 1000 мкл смеси равных объемов тканевой замораживающей среды и 30% глицерина-PB. Затем добавьте 1000 μл тканевой среды для замораживания в лунку 2.
- Переложите ломтик в лунку 1 и встряхивайте тарелку при температуре 4 °C в течение 1 часа.
- Переложите ломтик в лунку 2 и встряхивайте тарелку при температуре 4 °C в течение 1 часа.
- Быстро заморозьте ломтик изопентаном с помощью сухого льда, стараясь не загнуть ломтик. Храните ломтики при температуре -80 °C до криосекции.
- Криосекция среза до толщины 6 мкм. После высыхания на предметном стекле микроскопа храните срезы при температуре -80 °C.
- Для извлечения антигена17 срезы погружают в 10 мМ цитрат натрия (pH 6,0), нагревают до 100 °C один раз, а затем поддерживают при 98 °C в течение 1 ч.
- Тщательно промойте срезы в дистиллированной воде. В настоящее время срезы готовы к иммуногистохимическому окрашиванию.
Результаты
На рисунке 1А показан временной ход введения красителя в зависимости от начала BSW с пиковым избыточным давлением 25 кПа. В протоколе «Post» раствор синего Эванса вводили внутрисосудисто за 2 ч до перфузии FITC-декстрана, которая проводилась через 6 ч, 1 день, 3 дня и 7 дней после контакта с БМС. В протоколе «Pre» раствор синего Эванса вводили непосредственно перед воздействием BSW. В протоколе «Post» ожидается, что концентрация синего Эванса достигнет своего максимума примерно за 2 ч до фиксации перфузии, тогда как в протоколе «Pre» ожидается, что она достигнет своего максимума примерно во время воздействия BSW (рис. 1B). Концентрация ФИТК-декстрана в сосудах головного мозга и крови поддерживалась постоянной в течение 2 мин во время перфузии.
Синяя маркировка Эванса показала, что распад ГЭБ начался в течение 6 ч и продолжался в течение 7 дней после воздействия БМС (рис. 2А). Примечательно, что распад ГЭБ не происходил сразу после воздействия BSW, так как в протоколе «Pre» не наблюдалось экстравазации синего красителя Эванса через 3 ч (Рисунок 2B). Удивительно, но долгосрочная маркировка синим цветом Эванса указывала на его кумулятивный характер в протоколе «Pre» (рис. 2B)7.
Использование двух различных красителей, каждый из которых вводился с интервалом в 2 часа или более, позволило изучить временные изменения целостности ГЭБ путем сравнения их распределения. На рисунке 3 показаны флуоресцентные изображения срезов, которые показали значительную разницу в распределении синего Эванса и ФИТК-декстрана.
Наблюдались многочисленные флуоресцентные горячие точки различных размеров. Хотя некоторые горячие точки были достаточно яркими, чтобы войти в верхние 0,1% пикселей, многие из них были лишь немного ярче, чем окружающие ткани. Несоответствие между красителями позволяет предположить, что изменения произошли в пределах этого интервала. Горячие точки, показывающие только синюю флуоресценцию Эванса, указывали на продолжающийся сбой ГЭБ во время инъекции синего Эванса, который позже был восстановлен с помощью инъекции FITC-декстрана. Напротив, горячие точки, показывающие только флуоресценцию FITC-декстрана, позволяют предположить, что между двумя инъекциями красителя произошло разрушение ГЭБ. Наконец, горячие точки, проявляющие флуоресценцию от обоих красителей, указывали на непрерывный распад ГЭБ в течение всего периода инъекции.
На рисунке 4A представлено количество горячих точек, положительных на синий цвет Эванса (включая только синий Эванс и два положительных хотспота Эванса/FITC-декстран), FITC-декстран (включая только FITC-декстран и синий Эванса/FITC-декстран) или оба красителя (только синий Эванс/FITC-декстран с двойным положительным результатом). В протоколе «Pre» в течение 3 ч наблюдались многочисленные горячие точки, содержащие только FITC-декстран. Через 6 часов и 1 день в протоколе «Post» были обнаружены как синие точки Эванса, так и только FITC-декстраны. Тем не менее, через 3 дня и 7 дней в протоколе «Post» горячие точки были преимущественно положительными для обоих красителей. Эти данные свидетельствуют о том, что распад ГЭБ произошел через 3 ч, был реконструирован через 1 день и сохранялся в течение 7 дней после воздействия БМС (Рисунок 4B). Важно отметить, что степень распада ГЭБ имела тенденцию уменьшаться на 7 дней, как упоминалось ранее.
После завершения экспериментов по экстравазации красителя было проведено иммуногистохимическое окрашивание срезов7. Иммуногистохимические снимки последовательно сравнивались с результатами экстравазации красителя, подтверждая, что эффект переноса флуоресцентных веществ был практически незначительным7. Как показано на рисунке 5, кластеры реакционноспособных астроцитов были тесно связаны с местами распада ГЭБ. Дальнейшие наблюдения показали, что активированная и амебоидная микроглия присутствовала наряду с реактивными астроцитами через 3 дня после воздействия BSW.

Рисунок 1: План эксперимента. (А) Ход эксперимента. Раствор синего Эванса вводили внутривенно после (протокол «Post») или непосредственно перед (протокол «Pre») воздействия BSW, в то время как FITC-декстран транскардиально перфузировали в течение 2 мин до фиксации. (B) Ожидаемые концентрации синего Эванса и ФИТК-декстрана в кровеносных сосудах в протоколах «Post» и «Pre», соответственно. BSW – ударные волны, вызванные взрывом; ФИТК, флуоресцеин изотиоцианат. Этот рисунок адаптирован из Nishii et al.7. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Сравнение интенсивности флуоресценции в срезах мозга. Интенсивность флуоресценции самых ярких 0,1% пикселей в мозге оценивалась по всем 12 срезам и сравнивалась между условиями «Post» (A) и «Pre» (B). Указана вариабельность и значимость различий. xxx обозначает p < 0,001; xxxx обозначает p < 0,0001 (значения p по F-критерию). *p < 0,05; p < 0,0001 (анализ дисперсии с помощью апостериорного теста множественных сравнений Даннетта). Этот рисунок адаптирован из Nishii et al.7. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
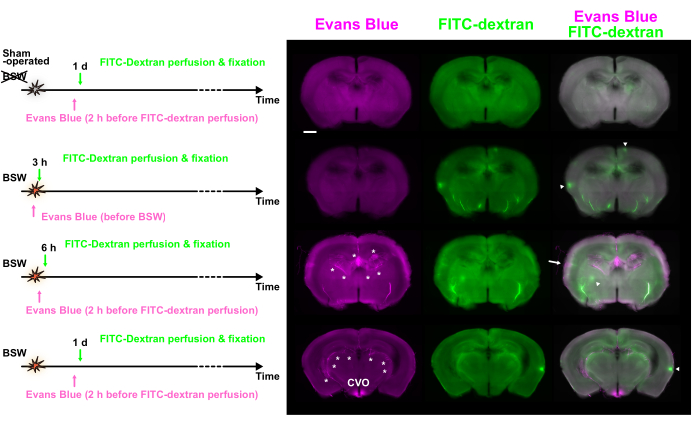
Рисунок 3: Разбивка ГЭБ наблюдается в различные моменты времени с использованием двойного обозначения синим цветом Эванса и ФИТК-декстраном. Отображаются синий цвет Эванса (пурпурный), FITC-декстран (зеленый) и объединенные изображения. Протоколы введения красителя представлены с левой стороны. В некоторых горячих точках наблюдалась преобладающая флуоресценция синего Эванса (стрелка) или FITC-декстрана (стрелки). Звездочками обозначено сосудистое сплетение и связанные с ним сосуды. ГЭБ — гематоэнцефалический барьер; FITC, флуоресцеин изотиоцианат; КВО, околожелудочковые органы третьего желудочка. Масштабная линейка: 1 мм. Этот рисунок адаптирован из Nishii et al.7. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 4: Количественная оценка горячих точек флуоресценции. (A) Количество горячих точек, положительных на синий Эванса (пурпурный), FITC-декстрана (зеленый) и оба красителя (серый). Они были собраны из изображений, полученных через 3 часа в протоколе «Pre», а также из изображений, полученных через 6 часов, 1 день, 3 дня и 7 дней в протоколе «Post». От 3 ч до 1 дня значительная часть флуоресцентных горячих точек показала несоответствие между красителями, тогда как от 3 до 7 дней такое несоответствие практически не наблюдалось. (В) Схема, обобщающая временной ход разбивки ГЭБ. Вертикальная ось концептуально представляет интенсивность утечки красителя из-за пробоя ГЭБ. Зигзагообразная картина от 3 ч до 1 суток свидетельствует о том, что место и интенсивность утечки красителя нестабильны в этот период. FITC, флуоресцеин изотиоцианат; ГЭБ — гематоэнцефалический барьер; BSW, ударные волны, вызванные взрывом. Этот рисунок адаптирован из Nishii et al.7. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
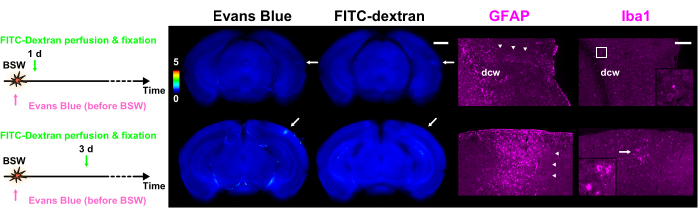
Рисунок 5: Экспрессия GFAP и Iba1 в качестве маркеров астроцитов и микроглии соответственно. Каждый столбец рисунка содержит флуоресцентные изображения экстравазации красителя синим Эванса или FITC-декстраном, а также иммуногистохимические изображения GFAP или Iba1. Цветная полоса показывает нормализованную интенсивность флуоресценции синего Эванса и FITC-декстрана с использованием интенсивностей в пределах GRN. Протоколы введения красителя представлены с левой стороны. Срез 1 дня в протоколе «Pre» показывает флуоресценцию как синего Эванса, так и FITC-декстрана, в то время как срез 3 дня в протоколе «Pre» показывает только флуоресценцию синего Эванса (стрелки). Области, обозначенные стрелками на изображениях экстравазации красителя, совпадают с иммуногистохимическими изображениями. Стрелки указывают на кластеры реактивных астроцитов. Поликлональное антитело GFAP мечет астроциты в белом веществе и вокруг него, а также в нервной ткани, прилегающей к оболочке пиа. В результате, астроциты внутри и рядом с DCW помечены на этом рисунке. Увеличенные изображения, соответствующие рамке или стрелке в столбце Iba1, отображаются на вставках. Масштабные линейки: 1 мм и 200 мкм для экстравазации красителя и иммуногистохимических изображений соответственно. GFAP, глиальный фибриллярный кислый белок; Iba1, ионизированная кальций-связывающая молекула адаптера 1; FITC, флуоресцеин изотиоцианат; BSW – ударные волны, вызванные взрывом; DCW, глубокое белое вещество головного мозга. Этот рисунок адаптирован из Nishii et al.7. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
Новая техника двойного мечения с использованием синего цвета Эванса и FITC-декстрана была использована для точной визуализации точного пространственно-временного распределения распада ГЭБ в одном мозге. В модели низкой интенсивности BSW в исследуемом мозге наблюдались заметные вариации в степени, локализации и степени экстравазации красителя (рис. 2 и рис. 3). Несоответствия между красителями показали, что распад ГЭБ начался примерно через 3 ч после воздействия БМШ, с существенным ремоделированием, происходящим к 1-му дню и продолжающимся до 7-го дня (Рисунок 4). В тяжелых случаях активная микроглия была рекрутирована в места распада ГЭБ, и кластеры реактивных астроцитов были тесно связаны с этими областями (рис. 5). Путем проведения иммуногистохимии на тех же срезах, которые использовались для анализа экстравазации красителя, была установлена точная корреляция между глиальными реакциями и экстравазацией красителя. Для получения более подробных данных и анализа, пожалуйста, обратитесь к Nishii et al.7.
Поскольку ФИТК-декстран перфузировали в постоянной концентрации в течение одинакового времени непосредственно перед перфузионной фиксацией, распределение и интенсивность красителя, вероятно, точно отражают степень распада ГЭБ в момент перфузионной фиксации. Тем не менее, в предыдущем отчете было продемонстрировано, что флуоресценция FITC-декстрана имеет тенденцию быть слабой в модели7 BSW с низкой интенсивностью. Мечение синим цветом Эванса в течение более длительного периода времени было преимуществом, так как оно могло обнаружить более тонкие изменения в разрушении ГЭБ (рис. 2). Однако из-за более длительной продолжительности мечения может потребоваться осторожность при интерпретации флуоресцентных изображений синего цвета Эванса. Концентрация синего Эванса в крови была самой высокой сразу после инъекции и постепенно снижалась в течение нескольких часов (Рисунок 1). Предполагается, что интенсивность мечения будет коррелировать с тяжестью и продолжительностью распада ГЭБ, а также с концентрацией синего цвета Эванса в крови; Однако после ремонта она будет уменьшаться в геометрической прогрессии. Все эти факторы меняются время от времени и от одного эксперимента к другому. Поэтому не следует делать вывод на основании одного изображения экстравазации красителя, а статистические соображения всегда необходимы.
В зависимости от цели эксперимента, может быть интересно изменить молекулярную массу, а также комбинацию красителей. В этом исследовании использовалась комбинация Эванс Блю и ФИТК-декстрана. После связывания с сывороточным альбумином, синий Эванса вел себя как индикатор с 69 кДа, а 40 кДа FITC-декстран, использованный в этом исследовании, показал такую же степень распада ГЭБ, как и синий Эванса. Пространственно-временное распределение распада ГЭБ систематически исследовалось с использованием комбинации красителей, излучающих различную флуоресценцию7. В предыдущем исследовании, в котором использовалась комбинация синего Эванса и флуоресцеина натрия (376 Да), флуоресцеин натрия, благодаря своей меньшей молекулярной массе, мог обозначать более широкий диапазон распада ГЭБпосле воздействия BSW. В других исследованиях для сравнения степени распада ГЭБ18,19 использовались комбинации синего Эванса и более высокомолекулярного FITC-декстрана. Во всех предыдущих отчетах Эванс синий и ФИТК-декстран вводились почти одновременно. Уникальный аспект представленного здесь протокола заключается в том, что два красителя были введены в разные моменты времени, что позволяет изучить временную прогрессию распада ГЭБ.
Кумулятивная природа синего цвета Эванса может оказаться полезной в различных моделях пробоя ГЭБ. Поскольку он записывает историю распада ГЭБ, понимание начала и прогрессирования заболевания может быть облегчено. Исследователи должны знать о положительных и отрицательных характеристиках красителей и использовать их в полной мере9. Этот протокол имеет широкий спектр применения для различных моделей пробоя ГЭБ.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Мы благодарим Маюми Ватанабэ за технику криосекции. Эта работа была поддержана грантом Advanced Research on Military Medicine от Министерства обороны Японии.
Материалы
| Name | Company | Catalog Number | Comments |
| 10% Formalin Neutral Buffer Solution | FUJIFILM Wako Chemicals | 062-01661 | |
| Anti GFAP, Rabbit | DAKO-Agilent | IR524 | |
| Anti Iba1, Rabbit | FUJIFILM Wako Chemicals | 019-19741 | |
| Chicken anti-Mouse IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 488 | Thermo Fisher Scientific | A-21200 | |
| Cryo Mount | Muto Pure Chemicals | 33351 | tissue freezing medium |
| Domitor | Orion Corporation | medetomidine | |
| Donkey anti-Rabbit IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 546 | Thermo Fisher Scientific | A10040 | |
| Evans Blue | Sigma-Aldrich | E2129 | |
| Falcon 24-well Polystyrene Clear Flat Bottom Not Treated Cell Culture Plate, with Lid, Individually Wrapped, Sterile, 50/Case | CORNING | 351147 | |
| Fluorescein isothiocyanate–dextran average mol wt 40,000 | Sigma-Aldrich | FD40S | FITC-dextran |
| Glass Base Dish 27mm (No.1 Glass) | AGC TECHNO GLASS | 3910-035 | 35 mm glass bottom dish |
| IX83 Inverted Microscope | OLYMPUS | ||
| MAS Hydrophilic Adhesion Microscope Slides | Matsunami Glass | MAS-04 | |
| Matsunami Cover Glass (No.1) 18 x 18mm | Matsunami Glass | C018181 | |
| Midazolam Injection 10mg [SANDOZ] | Sandoz | ||
| Paraformaldehyde EMPROVE ESSENTIAL DAC | Merck Millipore | 1.04005.1000 | |
| Peristaltic Pump | ATTO | SJ-1211 II-H | |
| RODENT BRAIN MATRIX Adult Mouse, 30 g, Coronal | ASI INSTRUMENTS | RBM-2000C | brain slicer |
| Vetorphale | Meiji Animal Health | VETLI5 | butorphanol |
Ссылки
- Sweeney, M. D., Zhao, Z., Montagne, A., Nelson, A. R., Zlokovic, B. V. Blood-brain barrier: From physiology to disease and back. Physiol Rev. 99 (1), 21-78 (2019).
- Kabu, S., et al. Blast-associated shock waves result in increased brain vascular leakage and elevated ros levels in a rat model of traumatic brain injury. PLoS One. 10 (5), e0127971(2015).
- Kuriakose, M., Rama Rao, K. V., Younger, D., Chandra, N. Temporal and spatial effects of blast overpressure on blood-brain barrier permeability in traumatic brain injury. Sci Rep. 8 (1), 8681(2018).
- Yeoh, S., Bell, E. D., Monson, K. L. Distribution of blood-brain barrier disruption in primary blast injury. Ann Biomed Eng. 41 (10), 2206-2214 (2013).
- Readnower, R. D., et al. Increase in blood-brain barrier permeability, oxidative stress, and activated microglia in a rat model of blast-induced traumatic brain injury. J Neurosci Res. 88 (16), 3530-3539 (2010).
- Shetty, A. K., Mishra, V., Kodali, M., Hattiangady, B. Blood-brain barrier dysfunction and delayed neurological deficits in mild traumatic brain injury induced by blast shock waves. Front Cell Neurosci. 8, 232(2014).
- Nishii, K., et al. Evans blue and fluorescein isothiocyanate-dextran double labeling reveals the precise sequence of vascular leakage and glial responses after exposure to mild-level blast-associated shock waves. J Neurotrauma. 40 (11-12), 1228-1242 (2023).
- Hoffmann, A., et al. High and low molecular weight fluorescein isothiocyanate (FITC)-dextrans to assess blood-brain barrier disruption: Technical considerations. Transl Stroke Res. 2 (1), 106-111 (2011).
- Saunders, N. R., Dziegielewska, K. M., Møllgård, K., Habgood, M. D. Markers for blood-brain barrier integrity: How appropriate is Evans blue in the twenty-first century and what are the alternatives. Front Neurosci. 9, 385(2015).
- Manaenko, A., Chen, H., Kammer, J., Zhang, J. H., Tang, J. Comparison Evans blue injection routes: Intravenous versus intraperitoneal, for measurement of blood-brain barrier in a mice hemorrhage model. J Neurosci Methods. 195 (2), 206-210 (2011).
- Yen, L. F., Wei, V. C., Kuo, E. Y., Lai, T. W. Distinct patterns of cerebral extravasation by Evans blue and sodium fluorescein in rats. PLoS One. 8 (7), e68595(2013).
- Kawai, S., Takagi, Y., Kaneko, S., Kurosawa, T. Effect of three types of mixed anesthetic agents alternate to ketamine in mice. Exp Anim. 60 (5), 481-487 (2011).
- Machholz, E., Mulder, G., Ruiz, C., Corning, B. F., Pritchett-Corning, K. R. Manual restraint and common compound administration routes in mice and rats. J Vis Exp. 67, e2771(2012).
- Satoh, Y., et al. Molecular hydrogen prevents social deficits and depression-like behaviors induced by low-intensity blast in mice. J Neuropathol Exp Neurol. 77 (9), 827-836 (2018).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. J Vis Exp. 65, e3564(2012).
- Selever, J., Kong, J. Q., Arenkiel, B. R. A rapid approach to high-resolution fluorescence imaging in semi-thick brain slices. J Vis Exp. 53, e2807(2011).
- Jiao, Y., et al. A simple and sensitive antigen retrieval method for free-floating and slide-mounted tissue sections. J Neurosci Methods. 93 (2), 149-162 (1999).
- Nagaraja, T. N., Keenan, K. A., Fenstermacher, J. D., Knight, R. A. Acute leakage patterns of fluorescent plasma flow markers after transient focal cerebral ischemia suggest large openings in blood-brain barrier. Microcirculation. 15 (1), 1-14 (2010).
- Xu, Y., et al. Quantifying blood-brain-barrier leakage using a combination of Evans blue and high molecular weight fitc-dextran. J Neurosci Methods. 325, 108349(2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены