Method Article
Valutazione della rottura della barriera emato-encefalica in un modello murino di lesione cerebrale traumatica lieve
In questo articolo
Riepilogo
È stato sviluppato un metodo per visualizzare lo stravaso di colorante dovuto alla rottura della barriera emato-encefalica (BEE) somministrando due coloranti fluorescenti ai topi in momenti diversi. L'uso del glicerolo come crioprotettore ha facilitato l'immunoistochimica sullo stesso campione.
Abstract
I coloranti fluorescenti vengono utilizzati per determinare l'entità dello stravaso del colorante che si verifica a causa della rottura della barriera emato-encefalica (BEE). La marcatura con questi coloranti è un processo complesso influenzato da diversi fattori, come la concentrazione di coloranti nel sangue, la permeabilità dei vasi cerebrali, la durata dello stravaso del colorante e la riduzione della concentrazione di colorante nel tessuto a causa della degradazione e della diffusione. In un modello di lesione cerebrale traumatica lieve, l'esposizione alle onde d'urto indotte da esplosioni (BSW) innesca la rottura della BBB entro una finestra temporale limitata. Per determinare la sequenza precisa della degradazione della BEE, il blu di Evans e l'isotiocianato-destrano di fluoresceina sono stati iniettati per via intravascolare e intracardica nei topi in vari punti temporali rispetto all'esposizione alla BSW. È stata quindi registrata la distribuzione della fluorescenza del colorante in fette di cervello. Le differenze nella distribuzione e nell'intensità tra i due coloranti hanno rivelato la sequenza spazio-temporale della degradazione della BBB. L'immunocolorazione delle fette cerebrali ha mostrato che le risposte astrocitiche e microgliali erano correlate con i siti di degradazione della BEE. Questo protocollo ha un ampio potenziale di applicazione in studi che coinvolgono diversi modelli di degradazione della BEE.
Introduzione
La rottura e la disfunzione della barriera emato-encefalica (BEE) sono causate da infiammazione sistemica, infezioni, malattie autoimmuni, lesioni e malattie neurodegenerative1. Nella lesione cerebrale traumatica lieve (mTBI) derivante dall'esposizione a onde d'urto indotte da blasti (BSW), è stata osservata una correlazione significativa tra l'intensità delle BSW e la quantità di perdita di colorante fluorescente dovuta alla rottura della BBB 2,3,4. Una caratteristica notevole della degradazione della BBB nell'mTBI è che inizia immediatamente o entro poche ore dall'esposizione ai BSW ed è solitamente un processo transitorio che dura circa una settimana prima che emergano disturbi neurologici cronici ritardati 3,5,6,7. Sebbene i dettagli rimangano poco chiari, la degradazione della BBB fa parte della cascata patologica di lunga durata e può anche fungere da fattore prognostico nel mTBI6. Pertanto, è importante comprendere le distribuzioni spaziali e temporali della degradazione della BBB nel cervello.
I coloranti fluorescenti vengono utilizzati per determinare l'entità della degradazione della BBB 3,8. Poiché la concentrazione ematica dei coloranti e l'entità e l'entità della degradazione della BBB cambiano nel tempo, è necessaria cautela nell'interpretazione delle immagini di stravaso del colorante. Ad esempio, l'assenza di stravaso del colorante non indica necessariamente l'assenza di degradazione della BBB. Nessuna degradazione della BBB può essere rilevata prima o dopo un aumento della concentrazione ematica del colorante. Anche se il colorante si è accumulato con successo dove si è verificata la rottura della BBB, potrebbe essere andato perso nel tempo dopo che la rottura è cessata. In generale, le sostanze idrosolubili e biologicamente inerti vengono rapidamente escrete nelle urine9. Pertanto, per determinare se la degradazione della BBB si verifica in un momento specifico, i risultati più affidabili si ottengono quando un colorante fluorescente viene somministrato nel flusso sanguigno per un breve periodo immediatamente prima di fissare l'animale. In questo modo deve essere utilizzato l'isotiocianato di fluoresceina (FITC)-destrano disponibile in commercio con un peso molecolare specifico.
Il blu di Evans è un colorante azoico blu ampiamente riconosciuto con una forte affinità per l'albumina sierica. Il colorante mostra una fluorescenza rossa quando eccitato dalla luce verde nei sistemi biologici2. A causa della sua natura inerte, il complesso blu-albumina del siero di Evans rimane nel sangue fino a 2 ore, rendendolo un tracciante utile a 69 kDa per marcare regioni con una BBB compromessa per almeno questa durata10,11. Pertanto, è importante considerare le potenziali incertezze che circondano la farmacocinetica e la tossicità di Evans blue9. Tuttavia, uno studio recente ha dimostrato che il blu di Evans continua ad accumularsi nelle aree in cui la BBB è assente o interrotta7. Questa funzione ha permesso a Evans Blue di registrare la cronologia della degradazione della BBB, mentre il destrano FITC è stato utilizzato per registrare la rottura della BBB in un momento specifico dopo l'esposizione alla BSW. Sebbene il blu di Evans possa essere somministrato per via endovenosa o intraperitoneale10, la somministrazione endovenosa è preferibile per gli esperimenti sensibili al tempo. Questo studio mirava a dimostrare l'uso del blu di Evans e del FITC-destrano per rilevare la distribuzione spazio-temporale della degradazione della BBB in seguito all'esposizione a BSW.
In secondo luogo, lo studio ha presentato una tecnica per congelare fette di cervello dopo aver osservato la fluorescenza della degradazione della BBB e aver preparato fette più sottili adatte alle procedure immunoistochimiche. L'uso del glicerolo come mezzo di montaggio e crioprotettore semplifica il processo di immunoistochimica. Confrontando le immagini della degradazione della BBB con quelle dell'immunoistochimica, la distribuzione spazio-temporale della degradazione della BBB può essere correlata con la risposta tissutale dello stesso campione.
Protocollo
Tutti gli esperimenti sono stati condotti in conformità con le linee guida etiche per gli esperimenti sugli animali stabilite dal National Defense Medical College (Tokorozawa, Giappone). Il protocollo di studio è stato approvato dal Comitato per la ricerca sugli animali presso il National Defense Medical College (approvazione n. 23011-1). In questo studio sono stati utilizzati topi maschi C57BL/6J di età pari o superiore a 8 settimane e del peso di 19-23 g. Come illustrato nella Figura 1, una singola iniezione di blu di Evans e la perfusione FITC-destrano sono state eseguite in vari punti temporali in relazione a una singola esposizione a BSW. I dettagli dei reagenti e delle attrezzature utilizzate sono elencati nella Tabella dei materiali.
1. Anestesia
NOTA: Questo è un protocollo modificato che aumenta la quantità di medetomidina di 2,5 volte rispetto a quella originale12. I dosaggi di medetomidina cloridrato, midazolam e butorfanolo erano rispettivamente di 0,75 mg/kg, 4 mg/kg e 5 mg/kg.
- Preparare una miscela di medetomidina cloridrato (75 μg/mL), midazolam (400 μg/mL) e butorfanolo (500 μg/mL) in soluzione fisiologica.
- Somministrare la miscela per via intraperitoneale per anestetizzare il topo (10 μL/g)13.
- Dopo circa 5-10 minuti, verificare una sufficiente anestesia osservando l'assenza di riflessi di pizzicamento della coda e di ritiro del pedale.
- Tenere il mouse al caldo fino a quando non si riprende dagli effetti dell'anestesia.
2. Esposizione BSW
NOTA: In questo studio è stato utilizzato un tubo d'urto interno14.
- Anestetizzare il topo come descritto nel passaggio 1.
- Posizionare il mouse a 5 cm di distanza dall'estremità di uscita del tubo dell'ammortizzatore, assicurandosi che l'asse del corpo sia parallelo ma non allineato con l'asse del tubo.
- Eroga una singola esposizione BSW con una sovrapressione di picco di 25 kPa alla testa.
NOTA: Tenere il mouse al caldo fino a quando non si riprende dagli effetti dell'anestesia. Monitorare regolarmente le condizioni del topo trattato. Se si osservano segni di angoscia, come difficoltà a nutrirsi o bere, curvatura o aspetto anormale prolungato senza segni di recupero, sopprimere il topo e terminare l'esperimento in anticipo. Evitare la somministrazione di analgesici, poiché potrebbero potenzialmente influenzare la risposta gliale.
3. Iniezione di blu di Evans nella vena caudale
NOTA: La soluzione blu di Evans deve essere somministrata per via endovenosa senza anestesia. In presenza di anestesia, il colorante spesso non penetra a sufficienza nel corpo, probabilmente a causa della diminuzione della pressione sanguigna e della temperatura corporea13. Il blu di Evans è stato somministrato alla dose di 100 mg/kg.
- Preparare la soluzione di blu di Evans (4% p/v in soluzione fisiologica) in una microprovetta, quindi agitarla e conservarla al buio prima dell'uso.
- Iniettare la soluzione nella vena caudale (2,5 μL/g)13.
4. Perfusione transcardica con soluzione di FITC-destrano e fissazione
- Aggiungere eparina a soluzione salina tamponata con fosfato (PBS) per ottenere una concentrazione di 1 U/mL, quindi aggiungere FITC-destrano al PBS eparinizzato per ottenere una concentrazione di 3 mg/mL.
- Sciogliere completamente la polvere di FITC-destrano prima dell'uso. Per fare ciò, agitare delicatamente la soluzione per 30 minuti o più. Prima dell'uso, controllare attentamente la presenza di polvere di destrano FITC non disciolta. Se ne rimane, continuare ad agitare fino a quando non si sarà completamente sciolto.
- Anestetizzare il topo come descritto nel passaggio 1.
- Procedere con il protocollo standard di fissazione della perfusione utilizzando una pompa peristaltica 15,16. In primo luogo, perfondere con PBS eparinizzato contenente FITC-destrano per 2 minuti a una velocità di 4,0 ml/min. Quindi, perfondere con una soluzione tampone neutra di formalina al 10% o paraformaldeide-PBS al 4% per 2 minuti a una velocità di 4,0 mL/min, seguiti da 8 minuti a una velocità di 3,5 mL/min.
- Rimuovere con cautela il cervello utilizzando forbici chirurgiche e pinzette 15,16. Dopo la dissezione, post-fissare il cervello per una notte nello stesso fissativo (cioè soluzione tampone neutra di formalina al 10% o paraformaldeide-PBS al 4%) a 4 °C.
- Il giorno successivo, sostituire il fissativo con PBS.
5. Elaborazione del tessuto cerebrale
NOTA: Anche se la fissazione della perfusione è completa, il blu di Evans e il FITC-destrano possono disperdersi nel tampone. Pertanto, le procedure che portano alla fase 6.8 devono essere completate entro una settimana dalla fissazione della perfusione. Inoltre, evitare di esporre il campione alla luce.
- Preparare una piastra a 24 pozzetti con 500 μl di glicerolo al 20% in tampone fosfato (PB; pH 7,4) in ciascun pozzetto.
- Usando un'affettatrice per cervelli, taglia il cervello coronalmente in 12 fette, ciascuna spessa 1 mm.
- Trasferire ogni fetta nell'apposito pozzetto della piastra a 24 pozzetti e conservarla a 4 °C per almeno 2 ore.
- Sostituire la soluzione con glicerolo-PB al 50% e conservarla a 4 °C per almeno 2 ore.
- Infine, sostituire la soluzione con glicerolo al 100%. Per un'osservazione microscopica immediata, lasciare riposare le fette per almeno 2 ore a temperatura ambiente o conservarle a 4 °C. Le fette saranno ora traslucide e pronte per l'osservazione microscopica.
6. Misura della fluorescenza dello stravaso del colorante
NOTA: L'efficienza della marcatura a fluorescenza varia da mouse a topo. Pertanto, l'intensità della fluorescenza deve essere normalizzata. I valori di fluorescenza sono espressi rispetto a quelli all'interno del nucleo reticolare gigantocellulare (GRN) perché questa regione è minimamente influenzata dal trattamento con BSW.
- Aggiungere 500 μl di glicerolo sul fondo di una capsula con fondo di vetro da 35 mm.
- Trasferire la fetta nella soluzione di glicerolo e coprirne la superficie con un vetrino.
- Rimuovere il glicerolo in eccesso dal bordo del vetrino.
- Misurare l'intensità della fluorescenza della fetta al microscopio a fluorescenza.
- Dopo la misurazione microscopica, rimettere la fetta nel pozzo.
- Ripetere la misurazione per tutte e 12 le fette.
- Aggiungere 500 μl di PB in ciascun pozzetto e conservare la piastra a 24 pozzetti a 4 °C per una notte; il giorno successivo, le fette saranno sature con il 50% di glicerolo-PB.
- Sostituire la soluzione con glicerolo-PB al 30% e conservarla a 4 °C per almeno 2 ore.
- Eseguire le procedure del passaggio 7 entro poche settimane.
7. Criosezione e immunoistochimica
- Preparare una piastra a 24 pozzetti aggiungendo 1000 μl di una miscela di volumi uguali di terreno di congelamento tissutale e glicerolo-PB al 30% al pozzetto 1. Quindi, aggiungere 1000 μL di terreno di congelamento tissutale al pozzetto 2.
- Trasferire la fetta alla fontana 1 e agitare la piastra a 4 °C per 1 h.
- Trasferire la fetta nella vasca 2 e agitare la piastra a 4 °C per 1 ora.
- Congelare velocemente la fetta con l'isopentano usando ghiaccio secco, facendo attenzione a non piegare la fetta. Conservare le fette a -80 °C fino alla criosezione.
- Criosezionare la fetta a uno spessore di 6 μm. Dopo l'essiccazione sul vetrino del microscopio, conservare le sezioni a -80 °C.
- Per il recupero dell'antigene17, immergere le sezioni in 10 mM di citrato di sodio (pH 6,0), riscaldare a 100 °C una volta, quindi mantenere a 98 °C per 1 ora.
- Lavare abbondantemente le sezioni in acqua distillata. Le sezioni sono ora pronte per la colorazione immunoistochimica.
Risultati
La Figura 1A mostra l'andamento temporale dell'iniezione del colorante in relazione all'inizio della BSW, con una sovrapressione di picco di 25 kPa. Nel protocollo "Post", la soluzione di blu di Evans è stata somministrata per via intravascolare 2 ore prima della perfusione FITC-destrano, che è stata condotta 6 ore, 1 giorno, 3 giorni e 7 giorni dopo l'esposizione alla BSW. Nel protocollo "Pre", la soluzione di blu di Evans è stata iniettata immediatamente prima dell'esposizione alla BSW. Nel protocollo 'Post', si prevede che la concentrazione di blu di Evans raggiunga il suo massimo circa 2 ore prima della fissazione della perfusione, mentre nel protocollo 'Pre', si prevede che raggiunga il suo massimo intorno al momento dell'esposizione alla BSW (Figura 1B). La concentrazione di FITC-destrano nei vasi sanguigni cerebrali è stata mantenuta costante per 2 minuti durante la perfusione.
L'etichettatura blu di Evans ha mostrato che la degradazione della BBB è iniziata entro 6 ore ed è continuata fino a 7 giorni dopo l'esposizione alla BSW (Figura 2A). In particolare, la degradazione della BBB non si è verificata immediatamente dopo l'esposizione alla BSW, poiché non vi è stata stravaso del colorante blu di Evans a 3 ore nel protocollo "Pre" (Figura 2B). Sorprendentemente, l'etichettatura a lungo termine con il blu di Evans ha indicato la sua natura cumulativa nel protocollo "Pre" (Figura 2B)7.
L'uso di due coloranti distinti, ciascuno introdotto a intervalli di 2 ore o più, ha permesso di esaminare le variazioni temporali dell'integrità della BBB confrontando la loro distribuzione. La Figura 3 mostra le immagini a fluorescenza delle fette che hanno mostrato una differenza significativa nella distribuzione del blu di Evans e del FITC-destrano.
Sono stati osservati numerosi hotspot di fluorescenza di varie dimensioni. Sebbene alcuni hotspot fossero abbastanza luminosi da classificarsi tra i primi 0,1% dei pixel, molti erano solo leggermente più luminosi dei tessuti circostanti. La discrepanza tra i coloranti suggerisce che i cambiamenti si sono verificati all'interno di questo intervallo. Gli hotspot che mostravano solo la fluorescenza del blu di Evans indicavano una rottura della BBB in corso al momento dell'iniezione di blu di Evans, che è stata successivamente riparata dall'iniezione di FITC-destrano. Al contrario, gli hotspot che mostravano solo la fluorescenza FITC-destrano suggerivano che l'interruzione della BBB si verificasse tra le due iniezioni di colorante. Infine, gli hotspot che mostravano fluorescenza da entrambi i coloranti indicavano una continua rottura della BBB durante l'intero periodo di iniezione.
La Figura 4A presenta il numero di hotspot positivi per il blu di Evans (inclusi gli hotspot doppi positivi solo blu di Evans e gli hotspot doppi positivi per il blu di Evans/destrano FITC), il destrano FITC (inclusi gli hotspot doppi positivi solo per il solo destronano e il blu di Evans/destrano FITC) o entrambi i coloranti (solo gli hotspot doppi positivi per il blu di Evans/destrano FITC). Nel protocollo 'Pre' a 3 ore, sono stati osservati numerosi hotspot solo FITC-destrano. A 6 ore e 1 giorno nel protocollo "Post", sono stati rilevati sia gli hotspot solo blu di Evans che quelli solo FITC destron. Tuttavia, a 3 giorni e 7 giorni nel protocollo "Post", gli hotspot erano prevalentemente positivi per entrambi i coloranti. Questi risultati suggeriscono che la degradazione della BBB si è verificata a 3 ore, è stata rimodellata di 1 giorno e persisteva fino a 7 giorni dopo l'esposizione alla BSW (Figura 4B). È importante sottolineare che l'entità del breakdown della BBB tendeva a diminuire di 7 giorni, come accennato in precedenza.
Dopo il completamento degli esperimenti di stravaso del colorante, è stata effettuata la colorazione immunoistochimica delle fette7. Le scansioni di immagini immunoistochimiche sono state costantemente confrontate con quelle degli stravasi di coloranti, confermando che l'effetto di trascinamento delle sostanze fluorescenti era praticamente trascurabile7. Come mostrato nella Figura 5, i cluster di astrociti reattivi erano strettamente associati ai siti di degradazione della BBB. Ulteriori osservazioni hanno rivelato che le microglia attivate e ameboidi erano presenti accanto agli astrociti reattivi 3 giorni dopo l'esposizione alla BSW.

Figura 1: Disegno sperimentale. (A) Andamento temporale dell'esperimento. La soluzione di blu di Evans è stata iniettata per via endovenosa dopo (protocollo 'Post') o immediatamente prima (protocollo 'Pre') dell'esposizione alla BSW, mentre il FITC-destrano è stato perfuso per via transcardica per 2 minuti prima della fissazione. (B) Concentrazioni attese di blu di Evans e FITC-destrano nei vasi sanguigni rispettivamente nei protocolli "Post" e "Pre". BSW, onde d'urto indotte da esplosioni; FITC, isotiocianato di fluoresceina. Questa figura è adattata da Nishii et al.7. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Confronto dell'intensità della fluorescenza nelle fette di cervello. L'intensità della fluorescenza dello 0,1% più luminoso dei pixel nel cervello è stata valutata in tutte le 12 sezioni e confrontata tra le condizioni "Post" (A) e "Pre" (B). Sono indicate la variabilità e la significatività delle differenze. xxx indica p < 0,001; xxxx indica p < 0,0001 (valori p dal test F). *p < 0,05; p < 0,0001 (analisi della varianza con i confronti multipli di Dunnett test post hoc). Questa figura è adattata da Nishii et al.7. Clicca qui per visualizzare una versione più grande di questa figura.
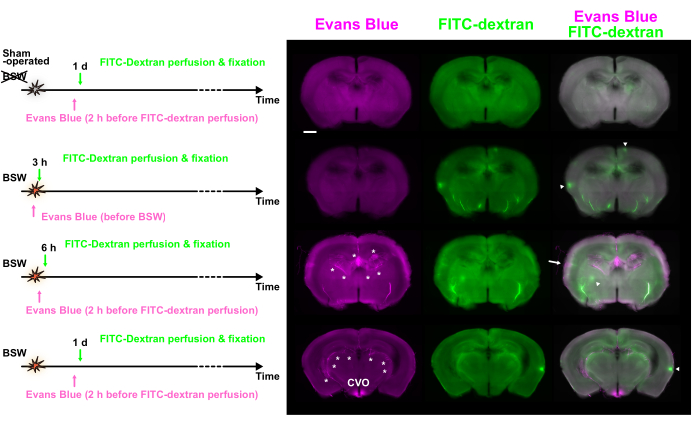
Figura 3: Degradazione della BBB osservata in vari punti temporali utilizzando la doppia marcatura con blu di Evans e FITC-destrano. Vengono mostrate le immagini blu di Evans (magenta), FITC-destrano (verde) e unite. I protocolli di iniezione del colorante sono presentati sul lato sinistro. Alcuni hotspot hanno mostrato una fluorescenza predominante del blu di Evans (freccia) o del FITC-destrano (punte di freccia). Gli asterischi indicano il plesso coroideo e i vasi correlati. BBB, barriera emato-encefalica; FITC, isotiocianato di fluoresceina; CVO, organi circumventricolari del terzo ventricolo. Barra della scala: 1 mm. Questa figura è adattata da Nishii et al.7. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4: Quantificazione degli hotspot di fluorescenza. (A) Numero dei punti caldi positivi per il blu di Evans (magenta), il destrano FITC (verde) ed entrambi i coloranti (grigio). Sono stati raccolti dalle immagini ottenute a 3 ore nel protocollo "Pre" e dalle immagini ottenute a 6 ore, 1 giorno, 3 giorni e 7 giorni nel protocollo "Post". Da 3 ore a 1 giorno, una parte significativa degli hotspot di fluorescenza ha mostrato una discrepanza tra i coloranti, mentre, da 3 giorni a 7 giorni, tale discrepanza è stata difficilmente osservata. (B) Schema che riassume l'andamento temporale della degradazione della BBB. L'asse verticale rappresenta concettualmente l'intensità della perdita di colorante dovuta alla rottura della BBB. Il modello a zigzag da 3 ore a 1 giorno indica che la posizione e l'intensità della perdita di colorante sono instabili durante questo periodo. FITC, isotiocianato di fluoresceina; BBB, barriera emato-encefalica; BSW, onde d'urto indotte da esplosioni. Questa figura è adattata da Nishii et al.7. Clicca qui per visualizzare una versione più grande di questa figura.
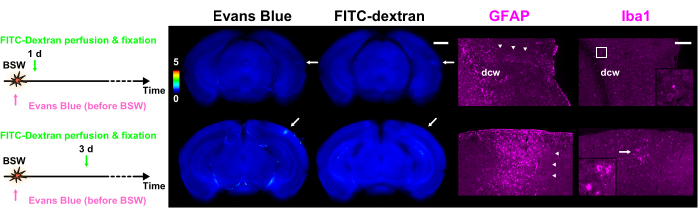
Figura 5: Espressione di GFAP e Iba1 come marcatori rispettivamente per astrociti e microglia. Ogni colonna della figura contiene immagini a fluorescenza dello stravaso di colorante con blu di Evans o FITC-destrano, insieme a immagini immunoistochimiche GFAP o Iba1. La barra dei colori indica le intensità di fluorescenza normalizzate del blu di Evans e del FITC-destrano utilizzando quelle all'interno di GRN. I protocolli di iniezione del colorante sono presentati sul lato sinistro. La fetta di 1 giorno nel protocollo 'Pre' mostra la fluorescenza sia del blu di Evans che del FITC-destrano, mentre la fetta di 3 giorni nel protocollo 'Pre' mostra solo la fluorescenza del blu di Evans (frecce). Le regioni indicate dalle frecce nelle immagini di stravaso del colorante si allineano con le immagini immunoistochimiche. Le punte di freccia indicano gruppi di astrociti reattivi. L'anticorpo policlonale GFAP ha marcato gli astrociti all'interno e intorno alla sostanza bianca, nonché nel tessuto nervoso adiacente alla pia madre. Di conseguenza, gli astrociti all'interno e vicino alla dcw sono marcati in questa figura. Le immagini ingrandite corrispondenti alla cornice o alla freccia nella colonna Iba1 sono rappresentate nei riquadri. Barre di scala: 1 mm e 200 μm rispettivamente per lo stravaso del colorante e le immagini immunoistochimiche. GFAP, proteina acida fibrillare gliale; Iba1, molecola adattatrice ionizzata che lega il calcio 1; FITC, isotiocianato di fluoresceina; BSW, onde d'urto indotte da esplosioni; DCW, sostanza bianca cerebrale profonda. Questa figura è adattata da Nishii et al.7. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Una nuova tecnica di doppia marcatura che utilizza il blu di Evans e il destrano FITC è stata utilizzata per visualizzare con precisione la precisa distribuzione spazio-temporale della degradazione della BBB in un singolo cervello. Nel modello BSW a bassa intensità, sono state osservate notevoli variazioni nell'estensione, nella posizione e nel grado di stravaso del colorante nei cervelli esaminati (Figura 2 e Figura 3). Le discrepanze tra i coloranti hanno rivelato che la degradazione della BBB è iniziata circa 3 ore dopo l'esposizione alla BSW, con un sostanziale rimodellamento che si è verificato entro il giorno 1 e si è protratto fino al giorno 7 (Figura 4). Nei casi più gravi, le microglia attive sono state reclutate nei siti di degradazione della BBB e i cluster di astrociti reattivi sono stati strettamente collegati a queste aree (Figura 5). Eseguendo l'immunoistochimica sulle stesse fette utilizzate per l'analisi dello stravaso del colorante, è stata stabilita una precisa correlazione tra le reazioni gliali e lo stravaso del colorante. Per dati e analisi più dettagliate, fare riferimento a Nishii et al.7.
Poiché il FITC-destrano è stato perfuso a una concentrazione costante per una durata identica immediatamente prima della fissazione della perfusione, la distribuzione e l'intensità del colorante probabilmente rappresentano accuratamente l'entità della degradazione della BBB al momento della fissazione della perfusione. Tuttavia, è stato dimostrato in un precedente rapporto che la fluorescenza del FITC-destrano tende ad essere debole inun modello BSW 7 a bassa intensità. L'etichettatura con il blu di Evans per una durata più lunga è stata vantaggiosa, in quanto è stata in grado di rilevare cambiamenti più sottili nella degradazione della BBB (Figura 2). Tuttavia, a causa della maggiore durata dell'etichettatura, potrebbe essere necessaria cautela quando si interpretano immagini fluorescenti del blu di Evans. La concentrazione ematica di blu di Evans è stata la più alta subito dopo l'iniezione ed è diminuita gradualmente nel corso di alcune ore (Figura 1)11. Si ipotizza che l'intensità dell'etichettatura sia correlata alla gravità e alla durata della degradazione della BBB, nonché alla concentrazione ematica di blu di Evans; Tuttavia, diminuirebbe esponenzialmente una volta riparato. Tutti questi fattori variano di volta in volta e da un esperimento all'altro. Pertanto, non si dovrebbe trarre una conclusione da una singola immagine di stravaso di colorante e le considerazioni statistiche sono sempre necessarie.
A seconda dello scopo dell'esperimento, potrebbe essere interessante modificare il peso molecolare e la combinazione di coloranti. In questo studio è stata utilizzata una combinazione di blu di Evans e destrano FITC. Dopo il legame con l'albumina sierica, il blu di Evans si è comportato come un tracciante da 69 kDa e il destrano FITC-da da 40 kDa utilizzato in questo studio ha mostrato un'entità simile alla degradazione della BBB del blu di Evans. La distribuzione spazio-temporale della degradazione della BBB è stata studiata sistematicamente utilizzando una combinazione di coloranti che emettono una diversa fluorescenza7. In uno studio precedente che ha utilizzato una combinazione di blu di Evans e fluoresceina sodica (376 Da), la fluoresceina sodica, a causa del suo peso molecolare più piccolo, potrebbe etichettare una gamma più ampia di degradazione della BBB dopo l'esposizione a BSW3. In altri studi, sono state utilizzate combinazioni di blu di Evans e FITC-destrano a peso molecolare più elevato per confrontare l'entità della degradazione della BBB 18,19. Tutti i rapporti precedenti hanno somministrato Evans blue e FITC-destrano quasi contemporaneamente. L'aspetto unico del protocollo qui presentato è che i due coloranti sono stati introdotti in momenti diversi, consentendo l'esame della progressione temporale della degradazione della BBB.
La natura cumulativa del blu di Evans può rivelarsi utile in diversi modelli di ripartizione della BBB. Poiché registra la storia della degradazione della BEE, può essere facilitata la comprensione dell'insorgenza e della progressione della malattia. I ricercatori dovrebbero essere consapevoli delle caratteristiche positive e negative dei coloranti e utilizzarle al massimo grado9. Questo protocollo ha un'ampia gamma di applicazioni per vari modelli di ripartizione della BBB.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Ringraziamo Mayumi Watanabe per la tecnica di criosezione. Questo lavoro è stato sostenuto da una sovvenzione per la ricerca avanzata sulla medicina militare del Ministero della Difesa, Giappone.
Materiali
| Name | Company | Catalog Number | Comments |
| 10% Formalin Neutral Buffer Solution | FUJIFILM Wako Chemicals | 062-01661 | |
| Anti GFAP, Rabbit | DAKO-Agilent | IR524 | |
| Anti Iba1, Rabbit | FUJIFILM Wako Chemicals | 019-19741 | |
| Chicken anti-Mouse IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 488 | Thermo Fisher Scientific | A-21200 | |
| Cryo Mount | Muto Pure Chemicals | 33351 | tissue freezing medium |
| Domitor | Orion Corporation | medetomidine | |
| Donkey anti-Rabbit IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 546 | Thermo Fisher Scientific | A10040 | |
| Evans Blue | Sigma-Aldrich | E2129 | |
| Falcon 24-well Polystyrene Clear Flat Bottom Not Treated Cell Culture Plate, with Lid, Individually Wrapped, Sterile, 50/Case | CORNING | 351147 | |
| Fluorescein isothiocyanate–dextran average mol wt 40,000 | Sigma-Aldrich | FD40S | FITC-dextran |
| Glass Base Dish 27mm (No.1 Glass) | AGC TECHNO GLASS | 3910-035 | 35 mm glass bottom dish |
| IX83 Inverted Microscope | OLYMPUS | ||
| MAS Hydrophilic Adhesion Microscope Slides | Matsunami Glass | MAS-04 | |
| Matsunami Cover Glass (No.1) 18 x 18mm | Matsunami Glass | C018181 | |
| Midazolam Injection 10mg [SANDOZ] | Sandoz | ||
| Paraformaldehyde EMPROVE ESSENTIAL DAC | Merck Millipore | 1.04005.1000 | |
| Peristaltic Pump | ATTO | SJ-1211 II-H | |
| RODENT BRAIN MATRIX Adult Mouse, 30 g, Coronal | ASI INSTRUMENTS | RBM-2000C | brain slicer |
| Vetorphale | Meiji Animal Health | VETLI5 | butorphanol |
Riferimenti
- Sweeney, M. D., Zhao, Z., Montagne, A., Nelson, A. R., Zlokovic, B. V. Blood-brain barrier: From physiology to disease and back. Physiol Rev. 99 (1), 21-78 (2019).
- Kabu, S., et al. Blast-associated shock waves result in increased brain vascular leakage and elevated ros levels in a rat model of traumatic brain injury. PLoS One. 10 (5), e0127971(2015).
- Kuriakose, M., Rama Rao, K. V., Younger, D., Chandra, N. Temporal and spatial effects of blast overpressure on blood-brain barrier permeability in traumatic brain injury. Sci Rep. 8 (1), 8681(2018).
- Yeoh, S., Bell, E. D., Monson, K. L. Distribution of blood-brain barrier disruption in primary blast injury. Ann Biomed Eng. 41 (10), 2206-2214 (2013).
- Readnower, R. D., et al. Increase in blood-brain barrier permeability, oxidative stress, and activated microglia in a rat model of blast-induced traumatic brain injury. J Neurosci Res. 88 (16), 3530-3539 (2010).
- Shetty, A. K., Mishra, V., Kodali, M., Hattiangady, B. Blood-brain barrier dysfunction and delayed neurological deficits in mild traumatic brain injury induced by blast shock waves. Front Cell Neurosci. 8, 232(2014).
- Nishii, K., et al. Evans blue and fluorescein isothiocyanate-dextran double labeling reveals the precise sequence of vascular leakage and glial responses after exposure to mild-level blast-associated shock waves. J Neurotrauma. 40 (11-12), 1228-1242 (2023).
- Hoffmann, A., et al. High and low molecular weight fluorescein isothiocyanate (FITC)-dextrans to assess blood-brain barrier disruption: Technical considerations. Transl Stroke Res. 2 (1), 106-111 (2011).
- Saunders, N. R., Dziegielewska, K. M., Møllgård, K., Habgood, M. D. Markers for blood-brain barrier integrity: How appropriate is Evans blue in the twenty-first century and what are the alternatives. Front Neurosci. 9, 385(2015).
- Manaenko, A., Chen, H., Kammer, J., Zhang, J. H., Tang, J. Comparison Evans blue injection routes: Intravenous versus intraperitoneal, for measurement of blood-brain barrier in a mice hemorrhage model. J Neurosci Methods. 195 (2), 206-210 (2011).
- Yen, L. F., Wei, V. C., Kuo, E. Y., Lai, T. W. Distinct patterns of cerebral extravasation by Evans blue and sodium fluorescein in rats. PLoS One. 8 (7), e68595(2013).
- Kawai, S., Takagi, Y., Kaneko, S., Kurosawa, T. Effect of three types of mixed anesthetic agents alternate to ketamine in mice. Exp Anim. 60 (5), 481-487 (2011).
- Machholz, E., Mulder, G., Ruiz, C., Corning, B. F., Pritchett-Corning, K. R. Manual restraint and common compound administration routes in mice and rats. J Vis Exp. 67, e2771(2012).
- Satoh, Y., et al. Molecular hydrogen prevents social deficits and depression-like behaviors induced by low-intensity blast in mice. J Neuropathol Exp Neurol. 77 (9), 827-836 (2018).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. J Vis Exp. 65, e3564(2012).
- Selever, J., Kong, J. Q., Arenkiel, B. R. A rapid approach to high-resolution fluorescence imaging in semi-thick brain slices. J Vis Exp. 53, e2807(2011).
- Jiao, Y., et al. A simple and sensitive antigen retrieval method for free-floating and slide-mounted tissue sections. J Neurosci Methods. 93 (2), 149-162 (1999).
- Nagaraja, T. N., Keenan, K. A., Fenstermacher, J. D., Knight, R. A. Acute leakage patterns of fluorescent plasma flow markers after transient focal cerebral ischemia suggest large openings in blood-brain barrier. Microcirculation. 15 (1), 1-14 (2010).
- Xu, Y., et al. Quantifying blood-brain-barrier leakage using a combination of Evans blue and high molecular weight fitc-dextran. J Neurosci Methods. 325, 108349(2019).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon