Method Article
Évaluation de la rupture de la barrière hémato-encéphalique dans un modèle murin de lésion cérébrale traumatique légère
Dans cet article
Résumé
Une méthode a été mise au point pour visualiser l’extravasation du colorant due à la rupture de la barrière hémato-encéphalique (BHE) en administrant deux colorants fluorescents à des souris à différents moments dans le temps. L’utilisation du glycérol comme cryoprotecteur a facilité l’immunohistochimie sur le même échantillon.
Résumé
Les colorants fluorescents sont utilisés pour déterminer l’étendue de l’extravasation de colorant qui se produit en raison de la rupture de la barrière hémato-encéphalique (BHE). Le marquage avec ces colorants est un processus complexe influencé par plusieurs facteurs, tels que la concentration des colorants dans le sang, la perméabilité des vaisseaux cérébraux, la durée de l’extravasation du colorant et la réduction de la concentration du colorant dans les tissus en raison de la dégradation et de la diffusion. Dans un modèle de lésion cérébrale traumatique légère, l’exposition aux ondes de choc induites par l’explosion déclenche la dégradation de la BHE dans une fenêtre de temps limitée. Pour déterminer la séquence précise de la dégradation de la BHE, le bleu d’Evans et l’isothiocyanate-dextran de fluorescéine ont été injectés par voie intravasculaire et intracardiale à des souris à divers moments par rapport à l’exposition à l’BSW. La distribution de la fluorescence du colorant dans les tranches de cerveau a ensuite été enregistrée. Les différences de distribution et d’intensité entre les deux colorants ont révélé la séquence spatio-temporelle de la dégradation de la BHE. L’immunomarquage des tranches de cerveau a montré que les réponses astrocytaires et microgliales étaient corrélées avec les sites de dégradation de la BHE. Ce protocole a un large potentiel d’application dans des études impliquant différents modèles de dégradation de la BHE.
Introduction
La rupture et le dysfonctionnement de la barrière hémato-encéphalique (BHE) sont causés par une inflammation systémique, des infections, des maladies auto-immunes, des blessures et des maladies neurodégénératives1. Dans les lésions cérébrales traumatiques légères (TCLm) résultant d’une exposition à des ondes de choc induites par une explosion, une corrélation significative a été observée entre l’intensité des TCS et la quantité de fuite de colorant fluorescent due à la dégradation de la BHE 2,3,4. Une caractéristique notable de la dégradation de la BHE dans le TCL est qu’elle commence immédiatement ou dans les heures qui suivent l’exposition aux TCS et qu’il s’agit généralement d’un processus transitoire qui dure environ une semaine avant l’apparition de troubles neurologiques chroniques retardés 3,5,6,7. Bien que les détails restent incertains, la dégradation de la BHE fait partie de la cascade pathologique de longue durée et peut également servir de facteur pronostique dans le TCL6. Par conséquent, il est important de comprendre les distributions spatiales et temporelles de la dégradation de la BHE dans le cerveau.
Des colorants fluorescents sont utilisés pour déterminer l’étendue de la dégradation de la BHE 3,8. Étant donné que la concentration sanguine des colorants ainsi que l’ampleur et l’étendue de la dégradation de la BHE changent au fil du temps, il faut faire preuve de prudence lors de l’interprétation d’images d’extravasation de colorant. Par exemple, l’absence d’extravasation de colorant n’indique pas nécessairement l’absence de dégradation de la BHE. Aucune dégradation de la BHE ne peut être détectée avant ou après une augmentation de la concentration sanguine du colorant. Même si le colorant a réussi à s’accumuler là où la dégradation de la BHE s’est produite, il peut avoir été perdu au fil du temps après la fin de la décomposition. En général, les substances hydrosolubles et biologiquement inertes sont rapidement excrétées dans l’urine9. Par conséquent, pour déterminer si la dégradation de la BHE se produit à un moment précis, les résultats les plus fiables sont obtenus lorsqu’un colorant fluorescent est administré dans la circulation sanguine pendant une courte période immédiatement avant de fixer l’animal. L’isothiocyanate de fluorescéine (FITC)-dextran disponible dans le commerce avec un poids moléculaire spécifique doit être utilisé de cette manière.
Le bleu d’Evans est un colorant azoïque bleu largement reconnu avec une forte affinité pour l’albumine sérique. Le colorant présente une fluorescence rouge lorsqu’il est excité par la lumière verte dans les systèmes biologiques2. En raison de sa nature inerte, le complexe d’albumine sérique bleue d’Evans reste dans le sang jusqu’à 2 h, ce qui en fait un traceur utile de 69 kDa pour le marquage des régions avec une BHE compromise pendant au moins cette durée10,11. Par conséquent, il est important de tenir compte des incertitudes potentielles entourant la pharmacocinétique et la toxicité d’Evans blue9. Cependant, une étude récente a montré que le bleu d’Evans continue de s’accumuler dans les zones où la BHE est absente ou perturbée7. Cette fonction a permis à Evans Blue d’enregistrer l’historique de la panne de la BROCHE, tandis que FITC-dextran a été utilisé pour enregistrer la panne de la BHE à un moment précis après l’exposition à la BSW. Bien qu’Evans blue puisse être administré par voie intraveineuse ou intrapéritonéale10, l’administration intraveineuse est préférée pour les expériences sensibles au temps. Cette étude visait à démontrer l’utilisation du bleu d’Evans et du FITC-dextran pour détecter la distribution spatio-temporelle de la dégradation de la BHE après une exposition à la BSW.
Deuxièmement, l’étude a présenté une technique pour congeler des tranches de cerveau après avoir observé la fluorescence de la dégradation de la BHE et préparé des tranches plus minces adaptées aux procédures immunohistochimiques. L’utilisation du glycérol comme milieu de montage et cryoprotecteur simplifie le processus d’immunohistochimie. En comparant les images de la dégradation de la BHE avec celles de l’immunohistochimie, la distribution spatio-temporelle de la dégradation de la BHE peut être corrélée avec la réponse tissulaire du même échantillon.
Protocole
Toutes les expériences ont été menées conformément aux directives éthiques pour les expériences sur les animaux établies par le National Defense Medical College (Tokorozawa, Japon). Le protocole d’étude a été approuvé par le Comité de recherche animale du National Defense Medical College (approbation n° 23011-1). Des souris C57BL/6J mâles âgées de 8 semaines et pesant de 19 à 23 g ont été utilisées dans cette étude. Comme l’illustre la figure 1, une seule injection de bleu d’Evans et une perfusion de FITC-dextran ont été effectuées à divers moments en relation avec une seule exposition à l’ASB. Les détails des réactifs et de l’équipement utilisés sont répertoriés dans la table des matériaux.
1. Anesthésie
REMARQUE : Il s’agit d’un protocole modifié qui augmente la quantité de médétomidine de 2,5 fois par rapport à l’original12. Les doses de chlorhydrate de médétomidine, de midazolam et de butorphanol étaient respectivement de 0,75 mg/kg, 4 mg/kg et 5 mg/kg.
- Préparez un mélange de chlorhydrate de médétomidine (75 μg/mL), de midazolam (400 μg/mL) et de butorphanol (500 μg/mL) dans une solution saline physiologique.
- Administrer le mélange par voie intrapéritonéale pour anesthésier la souris (10 μL/g)13.
- Après environ 5 à 10 minutes, vérifiez une anesthésie suffisante en observant l’absence de pincement de la queue et de réflexes de retrait de la pédale.
- Gardez la souris au chaud jusqu’à ce qu’elle se remette des effets de l’anesthésie.
2. Exposition à l’ASB
REMARQUE : Un tube de choc interne a été utilisé dans cette étude14.
- Anesthésie la souris comme décrit à l’étape 1.
- Placez la souris à 5 cm de l’extrémité de sortie du tube d’amortisseur, en vous assurant que l’axe de son corps est parallèle à l’axe du tube, mais qu’il n’est pas aligné avec celui-ci.
- Délivrer une seule exposition BSW avec une surpression maximale de 25 kPa à la tête.
REMARQUE : Gardez la souris au chaud jusqu’à ce qu’elle se remette des effets de l’anesthésie. Surveillez régulièrement l’état de la souris traitée. Si des signes de détresse, tels que des difficultés à s’alimenter ou à boire, une courbure ou une apparence anormale prolongée sans signes de récupération, sont observés, euthanasier la souris et mettre fin à l’expérience plus tôt. Évitez d’administrer des analgésiques, car ils peuvent potentiellement affecter la réponse gliale.
3. Injection de bleu Evans dans la veine de la queue
REMARQUE : La solution bleue d’Evans doit être administrée par voie intraveineuse sans anesthésie. En présence d’une anesthésie, le colorant ne pénètre souvent pas suffisamment dans le corps, probablement en raison d’une diminution de la pression artérielle et de la température corporelle13. Evans blue a été administré à une dose de 100 mg / kg.
- Préparez la solution bleue Evans (4 % p/v dans une solution saline) dans un microtube, puis vortex et stockez-la dans l’obscurité avant utilisation.
- Injecter la solution dans la veine de la queue (2,5 μL/g)13.
4. Perfusion transcardique avec solution de FITC-dextran et fixation
- Ajoutez de l’héparine à une solution saline tamponnée au phosphate (PBS) pour obtenir une concentration de 1 U/mL, puis ajoutez du FITC-dextran au PBS hépariné pour obtenir une concentration de 3 mg/mL.
- Dissoudre complètement la poudre FITC-dextran avant utilisation. Pour ce faire, agitez doucement la solution pendant 30 minutes ou plus. Avant utilisation, vérifiez soigneusement qu’il n’y a pas de poudre FITC-dextran non dissoute. S’il en reste, continuez à agiter jusqu’à ce qu’il soit complètement dissous.
- Anesthésie la souris comme décrit à l’étape 1.
- Procéder avec le protocole standard de fixation de perfusionà l’aide d’une pompe péristaltique 15,16. Tout d’abord, perfuser avec du PBS hépariné contenant du FITC-dextran pendant 2 min à un débit de 4,0 mL/min. Ensuite, perfuser avec une solution tampon neutre de formol à 10 % ou de paraformaldéhyde-PBS à 4 % pendant 2 min à un débit de 4,0 mL/min, suivi de 8 min à un taux de 3,5 mL/min.
- Retirez soigneusement le cerveau à l’aide de ciseaux chirurgicaux et d’une pince à épiler15,16. Après la dissection, post-fixer le cerveau pendant la nuit dans le même fixateur (c’est-à-dire une solution tampon neutre de formol à 10 % ou de paraformaldéhyde-PBS à 4 %) à 4 °C.
- Le lendemain, remplacez le fixateur par du PBS.
5. Traitement des tissus cérébraux
REMARQUE : Même si la fixation de la perfusion est complète, le bleu Evans et le FITC-dextran peuvent se disperser dans le tampon. Par conséquent, les procédures menant à l’étape 6.8 doivent être terminées dans la semaine suivant la fixation de la perfusion. De plus, évitez d’exposer l’échantillon à la lumière.
- Préparez une plaque de 24 puits avec 500 μL de glycérol à 20 % dans un tampon phosphate (PB ; pH 7,4) dans chaque puits.
- À l’aide d’un coupe-cerveau, coupez le cerveau en 12 tranches de 1 mm d’épaisseur chacune.
- Transférez chaque tranche dans le puits correspondant de la plaque à 24 puits et conservez-la à 4 °C pendant au moins 2 h.
- Remplacez la solution par du glycérol-PB à 50 % et conservez-la à 4 °C pendant au moins 2 h.
- Enfin, remplacez la solution par du glycérol à 100 %. Pour une observation microscopique immédiate, laissez reposer les tranches pendant au moins 2 h à température ambiante ou conservez-les à 4 °C. Les tranches seront maintenant translucides et prêtes pour l’observation microscopique.
6. Mesure de fluorescence de l’extravasation du colorant
REMARQUE : L’efficacité du marquage par fluorescence varie d’une souris à l’autre. Par conséquent, l’intensité de la fluorescence doit être normalisée. Les valeurs de fluorescence sont exprimées par rapport à celles du noyau réticulaire gigantocellulaire (GRN), car cette région est peu affectée par le traitement par BSW.
- Ajoutez 500 μL de glycérol au fond d’un plat à fond de verre de 35 mm.
- Transférez la tranche dans la solution de glycérol et couvrez sa surface avec un couvre-verre.
- Retirez l’excès de glycérol du bord du couvre-glace.
- Mesurez l’intensité de fluorescence de la tranche à l’aide d’un microscope à fluorescence.
- Après la mesure microscopique, remettez la tranche dans le puits.
- Répétez la mesure pour les 12 tranches.
- Ajouter 500 μL de PB dans chaque puits et conserver la plaque à 24 puits à 4 °C pendant la nuit ; le lendemain, les tranches seront saturées de 50 % de glycérol-PB.
- Remplacer la solution par du glycérol-PB à 30 % et la conserver à 4 °C pendant au moins 2 h.
- Effectuez les procédures de l’étape 7 en quelques semaines.
7. Cryosectionnement et immunohistochimie
- Préparez une plaque à 24 puits en ajoutant 1000 μL d’un mélange de volumes égaux de milieu de congélation tissulaire et de 30 % de glycérol-PB au puits 1. Ensuite, ajoutez 1000 μL de fluide de congélation de tissu au puits 2.
- Transférez la tranche dans le puits 1 et secouez l’assiette à 4 °C pendant 1 h.
- Transférez la tranche dans le puits 2 et secouez la plaque à 4 °C pendant 1 h.
- Congelez rapidement la tranche avec de l’isopentane à l’aide de glace sèche en prenant soin de ne pas plier la tranche. Conservez les tranches à -80 °C jusqu’à la cryosection.
- Cryosection de la tranche à une épaisseur de 6 μm. Après séchage sur la lame de microscope, stockez les coupes à -80 °C.
- Pour le prélèvement d’antigène17, immerger les sections dans 10 mM de citrate de sodium (pH 6,0), chauffer une fois à 100 °C, puis maintenir à 98 °C pendant 1 h.
- Lavez abondamment les sections à l’eau distillée. Les coupes sont maintenant prêtes pour la coloration immunohistochimique.
Résultats
La figure 1A montre l’évolution temporelle de l’injection du colorant par rapport au début de l’injection de colorant, avec un pic de surpression de 25 kPa. Dans le protocole « Post », la solution bleue d’Evans a été administrée par voie intravasculaire 2 h avant la perfusion FITC-dextran, qui a été réalisée 6 h, 1 jour, 3 jours et 7 jours après l’exposition à l’BSW. Dans le protocole « Pré », la solution bleue d’Evans a été injectée immédiatement avant l’exposition à l’ASB. Dans le protocole « Post », la concentration d’Evans blue devrait atteindre son maximum environ 2 heures avant la fixation de la perfusion, tandis que dans le protocole « Pré », elle devrait atteindre son maximum au moment de l’exposition à la BSW (figure 1B). La concentration de FITC-dextran dans les vaisseaux sanguins du cerveau a été maintenue constante pendant 2 minutes pendant la perfusion.
L’étiquetage bleu d’Evans a montré que la dégradation de la BHE commençait dans les 6 heures et se poursuivait jusqu’à 7 jours après l’exposition à la BSW (figure 2A). Notamment, la dégradation de la BHE ne s’est pas produite immédiatement après l’exposition à l’BSW, car il n’y a pas eu d’extravasation du colorant bleu d’Evans à 3 h dans le protocole « pré » (figure 2B). Étonnamment, l’étiquetage à long terme avec le bleu d’Evans a indiqué son caractère cumulatif dans le protocole « Pré » (Figure 2B)7.
L’utilisation de deux colorants distincts, chacun introduit à des intervalles de 2 h ou plus, a permis d’examiner les changements temporels de l’intégrité de la BHE en comparant leur distribution. La figure 3 montre des images de fluorescence des coupes qui ont montré une différence significative dans la distribution du bleu d’Evans et du FITC-dextran.
De nombreux points chauds de fluorescence de différentes tailles ont été observés. Bien que certains points chauds soient suffisamment brillants pour se classer parmi les 0,1 % de pixels les plus élevés, beaucoup n’étaient que légèrement plus brillants que les tissus environnants. L’écart entre les colorants suggère que des changements se sont produits au cours de cet intervalle. Les points chauds ne présentant que la fluorescence du bleu d’Evans indiquaient une dégradation continue de la BHE au moment de l’injection de bleu d’Evans, qui a ensuite été réparée par l’injection de FITC-dextran. En revanche, les points chauds ne montrant que la fluorescence FITC-dextran suggèrent qu’une perturbation de la BHE s’est produite entre les deux injections de colorant. Enfin, les points chauds présentant une fluorescence des deux colorants indiquaient une dégradation continue de la BHE pendant toute la période d’injection.
La figure 4A présente le nombre de points chauds positifs pour Evans bleu (y compris les points chauds Evans bleu uniquement et Evans bleu/FITC-dextran doublement positif), FITC-dextran (y compris les points chauds FITC-dextran uniquement et Evans bleu/FITC-dextran doublement positifs), ou les deux colorants (uniquement les points chauds Evans bleu/FITC-dextran doublement positifs). Dans le protocole 'Pre' à 3 h, de nombreux points chauds de FITC-dextran uniquement ont été observés. À 6 h et 1 jour dans le protocole 'Post', les points chauds Evans bleu uniquement et FITC-dextran uniquement ont été détectés. Cependant, à 3 jours et 7 jours dans le protocole « Post », les points chauds étaient principalement positifs pour les deux colorants. Ces résultats suggèrent que la dégradation de la BHE s’est produite au bout de 3 heures, qu’elle a été remodelée d’un jour et qu’elle a persisté jusqu’à 7 jours après l’exposition à l’ASB (figure 4B). Il est important de noter que l’étendue de la dégradation de la BHE a eu tendance à diminuer de 7 jours, comme mentionné précédemment.
Suite à la réalisation des expériences d’extravasation du colorant, une coloration immunohistochimique des tranches a été effectuée7. Les images immunohistochimiques ont été comparées de manière cohérente à celles des extravasations de colorants, confirmant que l’effet de transfert des substances fluorescentes était pratiquement négligeable7. Comme le montre la figure 5, des amas d’astrocytes réactifs étaient étroitement associés aux sites de dégradation de la BHE. D’autres observations ont révélé que des microglies activées et amiboïdes étaient présentes aux côtés d’astrocytes réactifs 3 jours après l’exposition à l’ASB.

Figure 1 : Plan d’expérience. (A) Déroulement de l’expérience. La solution de bleu d’Evans a été injectée par voie intraveineuse après l’exposition à l’ASB (protocole « Post ») ou immédiatement avant (protocole « avant »), tandis que le FITC-dextran a été perfusé par voie transcardiale pendant 2 minutes avant la fixation. (B) Concentrations attendues de bleu d’Evans et de FITC-dextran dans les vaisseaux sanguins dans les protocoles « Post » et « Pré », respectivement. BSW, ondes de choc induites par l’explosion ; FITC, isothiocyanate de fluorescéine. Cette figure est adaptée de Nishii et al.7. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Comparaison de l’intensité de la fluorescence dans des tranches de cerveau. L’intensité de fluorescence des 0,1 % des pixels les plus brillants du cerveau a été évaluée sur les 12 coupes et comparée entre les conditions « Post » (A) et « Pre » (B). La variabilité et l’importance des différences sont indiquées. xxx désigne p < 0,001 ; xxxx désigne p < 0,0001 (valeurs p du test F). *p < 0,05 ; p < 0,0001 (analyse de la variance avec le test post hoc des comparaisons multiples de Dunnett). Cette figure est adaptée de Nishii et al.7. Veuillez cliquer ici pour voir une version agrandie de cette figure.
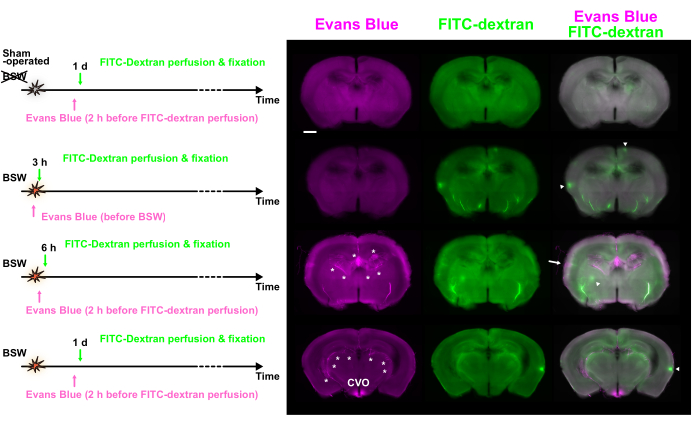
Figure 3 : Dégradation de la BHE observée à divers points temporels à l’aide d’un double marquage au bleu d’Evans et au FITC-dextran. Les images Evans bleu (magenta), FITC-dextran (vert) et fusionnées sont affichées. Les protocoles d’injection de colorant sont présentés sur le côté gauche. Certains points chauds ont montré une fluorescence prédominante du bleu d’Evans (flèche) ou du FITC-dextran (pointes de flèches). Les astérisques indiquent le plexus choroïde et les vaisseaux associés. BHE, barrière hémato-encéphalique ; FITC, isothiocyanate de fluorescéine ; CVO, organes circumventriculaires du troisième ventricule. Barre d’échelle : 1 mm. Cette figure est adaptée de Nishii et al.7. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Quantification des points chauds de fluorescence. (A) Nombre de points chauds positifs pour le bleu Evans (magenta), le FITC-dextran (vert) et les deux colorants (gris). Elles ont été recueillies à partir des images obtenues à 3 h dans le protocole 'Pre' ainsi qu’à partir des images obtenues à 6 h, 1 jour, 3 jours et 7 jours dans le protocole 'Post'. De 3 h à 1 jour, une partie significative des points chauds de fluorescence a montré une discordance entre les colorants, alors que, de 3 jours à 7 jours, une telle discordance a été à peine observée. (B) Schéma résumant l’évolution temporelle de la panne de la BBB. L’axe vertical représente conceptuellement l’intensité des fuites de colorant dues à la dégradation de la BHE. Le motif en zigzag de 3 h à 1 jour indique que l’emplacement et l’intensité des fuites de colorant sont instables pendant cette période. FITC, isothiocyanate de fluorescéine ; BHE, barrière hémato-encéphalique ; BSW, ondes de choc induites par les explosions. Cette figure est adaptée de Nishii et al.7. Veuillez cliquer ici pour voir une version agrandie de cette figure.
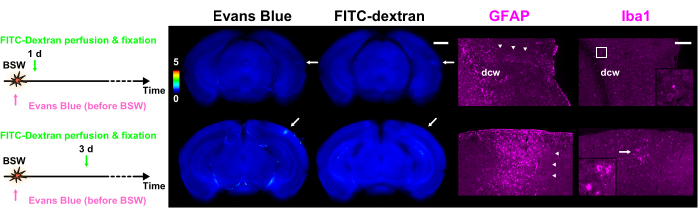
Figure 5 : Expression de GFAP et d’Iba1 en tant que marqueurs pour les astrocytes et la microglie, respectivement. Chaque colonne de la figure contient des images de fluorescence de l’extravasation du colorant avec du bleu d’Evans ou du FITC-dextran, ainsi que des images immunohistochimiques GFAP ou Iba1. La barre de couleur indique les intensités de fluorescence normalisées du bleu d’Evans et du FITC-dextran en utilisant celles de GRN. Les protocoles d’injection de colorant sont présentés sur le côté gauche. La tranche de 1 jour dans le protocole 'Pre' montre la fluorescence du bleu d’Evans et du FITC-dextran, tandis que la tranche de 3 jours dans le protocole 'Pre' ne montre que la fluorescence du bleu d’Evans (flèches). Les régions indiquées par les flèches dans les images d’extravasation de colorant s’alignent sur les images immunohistochimiques. Les pointes de flèches indiquent des amas d’astrocytes réactifs. L’anticorps polyclonal GFAP a marqué les astrocytes dans et autour de la substance blanche ainsi que dans le tissu nerveux adjacent à la pie-mère. En conséquence, les astrocytes à l’intérieur et à proximité du dcw sont étiquetés sur cette figure. Les images agrandies correspondant au cadre ou à la flèche dans la colonne Iba1 sont représentées dans les encarts. Barres d’échelle : 1 mm et 200 μm pour l’extravasation du colorant et les images immunohistochimiques, respectivement. GFAP, protéine acide fibrillaire gliale ; Iba1, molécule adaptatrice ionisée de liaison au calcium 1 ; FITC, isothiocyanate de fluorescéine ; BSW, ondes de choc induites par l’explosion ; DCW, substance blanche cérébrale profonde. Cette figure est adaptée de Nishii et al.7. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Une nouvelle technique de double marquage utilisant le bleu d’Evans et le FITC-dextran a été utilisée pour visualiser avec précision la distribution spatio-temporelle précise de la dégradation de la BHE dans un seul cerveau. Dans le modèle de BSW de faible intensité, des variations notables dans l’étendue, l’emplacement et le degré d’extravasation du colorant ont été observées dans les cerveaux examinés (figure 2 et figure 3). Les désappariements entre les colorants ont révélé que la dégradation de la BHE a commencé environ 3 heures après l’exposition à l’BSW, avec un remodelage important se produisant au jour 1 et se poursuivant jusqu’au jour 7 (figure 4). Dans les cas graves, des microglies actives ont été recrutées sur les sites de dégradation de la BHE, et des amas d’astrocytes réactifs étaient étroitement liés à ces zones (Figure 5). En effectuant une immunohistochimie sur les mêmes coupes que celles utilisées pour l’analyse de l’extravasation du colorant, une corrélation précise a été établie entre les réactions gliales et l’extravasation du colorant. Pour des données et une analyse plus détaillées, veuillez consulter Nishii et al.7.
Étant donné que le FITC-dextran a été perfusé à une concentration constante pendant une durée identique immédiatement avant la fixation par perfusion, la distribution et l’intensité du colorant représentent probablement avec précision l’étendue de la dégradation de la BHE au moment de la fixation par perfusion. Cependant, il a été démontré dans un rapport précédent que la fluorescence du FITC-dextran a tendance à être faible dans un modèle BSW de faible intensité7. L’étiquetage avec du bleu d’Evans pendant une durée plus longue était avantageux, car il pouvait détecter des changements plus subtils dans la dégradation de la BHE (Figure 2). Cependant, en raison de la durée plus longue de l’étiquetage, il peut être nécessaire d’être prudent lors de l’interprétation des images fluorescentes du bleu d’Evans. La concentration sanguine d’Evans blue était la plus élevée immédiatement après l’injection et a progressivement diminué en quelques heures (Figure 1)11. On suppose que l’intensité de l’étiquetage serait corrélée à la gravité et à la durée de la dégradation de la BHE ainsi qu’à la concentration sanguine du bleu d’Evans ; Cependant, il diminuerait de façon exponentielle une fois réparé. Tous ces facteurs varient de temps en temps et d’une expérience à l’autre. Par conséquent, il ne faut pas tirer de conclusion à partir d’une seule image d’extravasation de colorant, et des considérations statistiques sont toujours nécessaires.
Selon le but de l’expérience, il peut être intéressant de modifier le poids moléculaire ainsi que la combinaison de colorants. Dans cette étude, une combinaison d’Evans Blue et de FITC-dextran a été utilisée. Après s’être lié à l’albumine sérique, le bleu d’Evans s’est comporté comme un traceur de 69 kDa, et le FITC-dextran de 40 kDa utilisé dans cette étude a montré une étendue similaire de dégradation de la BHE que le bleu d’Evans. La distribution spatio-temporelle de la dégradation de la BHE a été systématiquement étudiée à l’aide d’une combinaison de colorants qui émettent différentes fluorescences7. Dans une étude antérieure qui a utilisé une combinaison de bleu d’Evans et de fluorescéine sodique (376 Da), la fluorescéine sodique, en raison de son poids moléculaire plus petit, a pu marquer une gamme plus large de dégradation de la BHE après une exposition à la BSW3. Dans d’autres études, des combinaisons de bleu d’Evans et de FITC-dextran de poids moléculaire supérieur ont été utilisées pour comparer l’étendue de la dégradation de la BHE18,19. Tous les rapports précédents ont administré Evans blue et FITC-dextran presque simultanément. L’aspect unique du protocole présenté ici est que les deux colorants ont été introduits à des moments différents, ce qui permet d’examiner la progression temporelle de la dégradation de la BHE.
La nature cumulative du bleu d’Evans peut s’avérer bénéfique dans différents modèles de répartition de la BBB. Parce qu’il enregistre l’histoire de la dégradation de la BHE, une compréhension de l’apparition et de la progression de la maladie peut être facilitée. Les chercheurs doivent être conscients des caractéristiques positives et négatives des colorants et les utiliser au maximum9. Ce protocole a un large éventail d’applications pour divers modèles de claquage BBB.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Nous remercions Mayumi Watanabe pour la technique de cryosection. Ce travail a été soutenu par une subvention de recherche avancée en médecine militaire du ministère de la Défense du Japon.
matériels
| Name | Company | Catalog Number | Comments |
| 10% Formalin Neutral Buffer Solution | FUJIFILM Wako Chemicals | 062-01661 | |
| Anti GFAP, Rabbit | DAKO-Agilent | IR524 | |
| Anti Iba1, Rabbit | FUJIFILM Wako Chemicals | 019-19741 | |
| Chicken anti-Mouse IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 488 | Thermo Fisher Scientific | A-21200 | |
| Cryo Mount | Muto Pure Chemicals | 33351 | tissue freezing medium |
| Domitor | Orion Corporation | medetomidine | |
| Donkey anti-Rabbit IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 546 | Thermo Fisher Scientific | A10040 | |
| Evans Blue | Sigma-Aldrich | E2129 | |
| Falcon 24-well Polystyrene Clear Flat Bottom Not Treated Cell Culture Plate, with Lid, Individually Wrapped, Sterile, 50/Case | CORNING | 351147 | |
| Fluorescein isothiocyanate–dextran average mol wt 40,000 | Sigma-Aldrich | FD40S | FITC-dextran |
| Glass Base Dish 27mm (No.1 Glass) | AGC TECHNO GLASS | 3910-035 | 35 mm glass bottom dish |
| IX83 Inverted Microscope | OLYMPUS | ||
| MAS Hydrophilic Adhesion Microscope Slides | Matsunami Glass | MAS-04 | |
| Matsunami Cover Glass (No.1) 18 x 18mm | Matsunami Glass | C018181 | |
| Midazolam Injection 10mg [SANDOZ] | Sandoz | ||
| Paraformaldehyde EMPROVE ESSENTIAL DAC | Merck Millipore | 1.04005.1000 | |
| Peristaltic Pump | ATTO | SJ-1211 II-H | |
| RODENT BRAIN MATRIX Adult Mouse, 30 g, Coronal | ASI INSTRUMENTS | RBM-2000C | brain slicer |
| Vetorphale | Meiji Animal Health | VETLI5 | butorphanol |
Références
- Sweeney, M. D., Zhao, Z., Montagne, A., Nelson, A. R., Zlokovic, B. V. Blood-brain barrier: From physiology to disease and back. Physiol Rev. 99 (1), 21-78 (2019).
- Kabu, S., et al. Blast-associated shock waves result in increased brain vascular leakage and elevated ros levels in a rat model of traumatic brain injury. PLoS One. 10 (5), e0127971(2015).
- Kuriakose, M., Rama Rao, K. V., Younger, D., Chandra, N. Temporal and spatial effects of blast overpressure on blood-brain barrier permeability in traumatic brain injury. Sci Rep. 8 (1), 8681(2018).
- Yeoh, S., Bell, E. D., Monson, K. L. Distribution of blood-brain barrier disruption in primary blast injury. Ann Biomed Eng. 41 (10), 2206-2214 (2013).
- Readnower, R. D., et al. Increase in blood-brain barrier permeability, oxidative stress, and activated microglia in a rat model of blast-induced traumatic brain injury. J Neurosci Res. 88 (16), 3530-3539 (2010).
- Shetty, A. K., Mishra, V., Kodali, M., Hattiangady, B. Blood-brain barrier dysfunction and delayed neurological deficits in mild traumatic brain injury induced by blast shock waves. Front Cell Neurosci. 8, 232(2014).
- Nishii, K., et al. Evans blue and fluorescein isothiocyanate-dextran double labeling reveals the precise sequence of vascular leakage and glial responses after exposure to mild-level blast-associated shock waves. J Neurotrauma. 40 (11-12), 1228-1242 (2023).
- Hoffmann, A., et al. High and low molecular weight fluorescein isothiocyanate (FITC)-dextrans to assess blood-brain barrier disruption: Technical considerations. Transl Stroke Res. 2 (1), 106-111 (2011).
- Saunders, N. R., Dziegielewska, K. M., Møllgård, K., Habgood, M. D. Markers for blood-brain barrier integrity: How appropriate is Evans blue in the twenty-first century and what are the alternatives. Front Neurosci. 9, 385(2015).
- Manaenko, A., Chen, H., Kammer, J., Zhang, J. H., Tang, J. Comparison Evans blue injection routes: Intravenous versus intraperitoneal, for measurement of blood-brain barrier in a mice hemorrhage model. J Neurosci Methods. 195 (2), 206-210 (2011).
- Yen, L. F., Wei, V. C., Kuo, E. Y., Lai, T. W. Distinct patterns of cerebral extravasation by Evans blue and sodium fluorescein in rats. PLoS One. 8 (7), e68595(2013).
- Kawai, S., Takagi, Y., Kaneko, S., Kurosawa, T. Effect of three types of mixed anesthetic agents alternate to ketamine in mice. Exp Anim. 60 (5), 481-487 (2011).
- Machholz, E., Mulder, G., Ruiz, C., Corning, B. F., Pritchett-Corning, K. R. Manual restraint and common compound administration routes in mice and rats. J Vis Exp. 67, e2771(2012).
- Satoh, Y., et al. Molecular hydrogen prevents social deficits and depression-like behaviors induced by low-intensity blast in mice. J Neuropathol Exp Neurol. 77 (9), 827-836 (2018).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. J Vis Exp. 65, e3564(2012).
- Selever, J., Kong, J. Q., Arenkiel, B. R. A rapid approach to high-resolution fluorescence imaging in semi-thick brain slices. J Vis Exp. 53, e2807(2011).
- Jiao, Y., et al. A simple and sensitive antigen retrieval method for free-floating and slide-mounted tissue sections. J Neurosci Methods. 93 (2), 149-162 (1999).
- Nagaraja, T. N., Keenan, K. A., Fenstermacher, J. D., Knight, R. A. Acute leakage patterns of fluorescent plasma flow markers after transient focal cerebral ischemia suggest large openings in blood-brain barrier. Microcirculation. 15 (1), 1-14 (2010).
- Xu, Y., et al. Quantifying blood-brain-barrier leakage using a combination of Evans blue and high molecular weight fitc-dextran. J Neurosci Methods. 325, 108349(2019).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon