Method Article
تقييم انهيار الحاجز الدموي الدماغي في نموذج فأر لإصابات الدماغ الرضحية الخفيفة
In This Article
Summary
تم تطوير طريقة لتصور تسرب الصبغة بسبب انهيار الحاجز الدموي الدماغي (BBB) عن طريق إعطاء صبغتين فلوريتين للفئران في نقاط زمنية مختلفة. سهل استخدام الجلسرين كمادة حاصلة بالتبريد الكيمياء المناعية على نفس العينة.
Abstract
تستخدم الأصباغ الفلورية لتحديد مدى تسرب الصبغة الذي يحدث بسبب انهيار الحاجز الدموي الدماغي (BBB). يعد وضع العلامات بهذه الأصباغ عملية معقدة تتأثر بعدة عوامل ، مثل تركيز الأصباغ في الدم ، ونفاذية أوعية الدماغ ، ومدة تسرب الصبغة ، وانخفاض تركيز الصبغة في الأنسجة بسبب التحلل والانتشار. في نموذج إصابات الدماغ الرضحية الخفيفة ، يؤدي التعرض لموجات الصدمة الناجمة عن الانفجار (BSWs) إلى انهيار BBB خلال فترة زمنية محدودة. لتحديد التسلسل الدقيق لانهيار BBB ، تم حقن إيفانز الأزرق والفلوريسين إيزوثيوسيانات ديكستران داخل الأوعية الدموية وداخل القلب في الفئران في نقاط زمنية مختلفة بالنسبة للتعرض ل BSW. ثم تم تسجيل توزيع مضان الصبغة في شرائح الدماغ. كشفت الاختلافات في التوزيع والشدة بين الصبغتين عن التسلسل الزماني المكاني لانهيار BBB. أظهر التلوين المناعي لشرائح الدماغ أن الاستجابات النجمية والخلايا الدبقية الصغيرة مرتبطة بمواقع انهيار BBB. يتمتع هذا البروتوكول بإمكانيات واسعة للتطبيق في الدراسات التي تتضمن نماذج مختلفة لتقسيم BBB.
Introduction
يحدث انهيار الحاجز الدموي الدماغي (BBB) والخلل الوظيفي بسبب الالتهاب الجهازي والالتهابات وأمراض المناعة الذاتية والإصابات والأمراض التنكسيةالعصبية 1. في إصابات الدماغ الرضحية الخفيفة (mTBI) الناتجة عن التعرض لموجات الصدمة الناجمة عن الانفجار (BSWs) ، لوحظ وجود علاقة كبيرة بين شدة BSWs وكمية تسرب صبغة الفلورسنت بسبب انهيار BBB2،3،4. تتمثل إحدى السمات البارزة لانهيار BBB في mTBI في أنه يبدأ على الفور أو في غضون ساعات قليلة بعد التعرض ل BSW وعادة ما تكون عملية عابرة تستمر لمدة أسبوع تقريبا قبل ظهور اضطرابات عصبية مزمنة متأخرة3،5،6،7. على الرغم من أن التفاصيل لا تزال غير واضحة ، إلا أن انهيار BBB هو جزء من سلسلة مرضية طويلة الأمد وقد يكون أيضا عاملا تنبؤيا في mTBI6. لذلك ، من المهم فهم التوزيعات المكانية والزمانية لانهيار BBB في الدماغ.
تستخدم الأصباغ الفلورية لتحديد مدى انهيار BBB 3,8. نظرا لأن تركيز الأصباغ في الدم وحجم ومدى انهيار BBB يتغير بمرور الوقت ، يلزم توخي الحذر عند تفسير صور تسرب الصبغة. على سبيل المثال ، لا يشير عدم وجود تسرب الصبغة بالضرورة إلى عدم وجود انهيار BBB. قد لا يتم الكشف عن انهيار BBB قبل أو بعد زيادة تركيز الصبغة في الدم. حتى لو تراكمت الصبغة بنجاح حيث حدث انهيار BBB ، فقد تكون قد فقدت بمرور الوقت بعد توقف الانهيار. بشكل عام ، تفرز المواد القابلة للذوبان في الماء والخاملة بيولوجيا بسرعة في البول9. لذلك ، لتحديد ما إذا كان انهيار BBB يحدث في وقت محدد ، يتم الحصول على النتائج الأكثر موثوقية عندما يتم إعطاء صبغة فلورية في مجرى الدم لفترة قصيرة مباشرة قبل تثبيت. يجب استخدام الفلورسينات إيزوثيوسيانات (FITC) - ديكستران المتاح تجاريا بوزن جزيئي محدد بهذه الطريقة.
إيفانز الأزرق هو صبغة آزو زرقاء معترف بها على نطاق واسع مع تقارب قوي مع ألبومين المصل. تظهر الصبغة مضان أحمر عندما تثيرها الضوء الأخضر في الأنظمةالبيولوجية 2. نظرا لطبيعته الخاملة ، يظل مركب ألبومين مصل إيفانز الأزرق في الدم لمدة تصل إلى ساعتين ، مما يجعله متتبعا مفيدا بقدرة 69 كيلو دالتون لوضع العلامات على المناطق ذات BBB المخترق لهذه المدةعلى الأقل 10،11. لذلك ، من المهم مراعاة أوجه عدم اليقين المحتملة المحيطة بالحركية الدوائية وسمية Evans blue9. ومع ذلك ، أظهرت دراسة حديثة أن إيفانز الأزرق يستمر في التراكم في المناطق التي يكون فيها BBB غائبا أو معطلا7. مكنت هذه الميزة Evans Blue من تسجيل تاريخ انهيار BBB ، بينما تم استخدام FITC-dextran لتسجيل انهيار BBB في نقطة زمنية محددة بعد تعرض BSW. على الرغم من أنه يمكن إعطاء إيفانز الأزرق عن طريق الوريد أو داخل الصفاق10 ، إلا أنه يفضل تناوله عن طريق الوريد للتجارب الحساسة للوقت. تهدف هذه الدراسة إلى إثبات استخدام إيفانز الأزرق و FITC-dextern للكشف عن التوزيع الزماني المكاني لانهيار BBB بعد التعرض ل BSW.
ثانيا ، قدمت الدراسة تقنية لتجميد شرائح الدماغ بعد ملاحظة تألق انهيار BBB وإعداد شرائح أرق مناسبة للإجراءات الكيميائية المناعية. يعمل استخدام الجلسرين كوسيط تركيب ومحلول تجميد على تبسيط عملية الكيمياء المناعية. من خلال مقارنة صور انهيار BBB مع تلك الموجودة في الكيمياء المناعية ، يمكن ربط التوزيع الزماني المكاني لانهيار BBB باستجابة الأنسجة لنفس العينة.
Protocol
أجريت جميع التجارب وفقا للمبادئ التوجيهية الأخلاقية للتجارب على التي وضعتها كلية طب الدفاع الوطني (توكوروزاوا ، اليابان). تمت الموافقة على بروتوكول الدراسة من قبل لجنة البحوث الحيوانية في كلية طب الدفاع الوطني (الموافقة رقم 23011-1). تم استخدام ذكور الفئران C57BL / 6J الذين تتراوح أعمارهم بين 8 أسابيع ووزنهم 19-23 جم في هذه الدراسة. كما هو موضح في الشكل 1 ، تم إجراء حقنة إيفانز الزرقاء الواحدة وتروية FITC-dextrann في نقاط زمنية مختلفة فيما يتعلق بالتعرض الفردي ل BSW. تفاصيل الكواشف والمعدات المستخدمة مدرجة في جدول المواد.
1. التخدير
ملاحظة: هذا بروتوكول معدل يزيد من كمية الميديتوميدين بمقدار 2.5 مرة مقارنة بالبروتوكول الأصلي12. كانت جرعات ميديتوميدين هيدروكلوريد وميدازولام وبوتورفانول 0.75 مجم / كجم و 4 مجم / كجم و 5 مجم / كجم على التوالي.
- تحضير خليط من هيدروكلوريد ميديتوميدين (75 ميكروغرام / مل) وميدازولام (400 ميكروغرام / مل) وبوتورفانول (500 ميكروغرام / مل) في محلول ملحي فسيولوجي.
- يتم تطبيق الخليط داخل الصفاق لتخدير الفأر (10 ميكرولتر / جم)13.
- بعد حوالي 5-10 دقائق ، تحقق من التخدير الكافي من خلال ملاحظة عدم وجود قرص الذيل وردود أفعال سحب الدواسة.
- حافظ على دفء الماوس حتى يتعافى من آثار التخدير.
2. التعرض BSW
ملاحظة: تم استخدام أنبوب صدمة داخلي في هذه الدراسة14.
- قم بتخدير الماوس كما هو موضح في الخطوة 1.
- ضع الماوس على بعد 5 سم من طرف مخرج أنبوب الصدمة ، وتأكد من أن محور جسمه مواز لمحور الأنبوب ولكن لا يتماشى معه.
- قم بتوصيل تعريض BSW واحد مع ذروة ضغط زائد تبلغ 25 كيلو باسكال على الرأس.
ملاحظة: حافظ على دفء الماوس حتى يتعافى من آثار التخدير. راقب بانتظام حالة الماوس المعالج. إذا لوحظت علامات الضيق ، مثل صعوبة الرضاعة أو الشرب أو الانحناء أو المظهر غير الطبيعي لفترات طويلة دون علامات التعافي ، فقم بالقتل الرحيم للفأر وإنهاء التجربة مبكرا. تجنب إعطاء المسكنات، لأنها قد تؤثر على الاستجابة الدبقية.
3. حقن إيفانز الأزرق في وريد الذيل
ملاحظة: يجب إعطاء محلول إيفانز الأزرق عن طريق الوريد دون تخدير. في حالة وجود التخدير ، غالبا ما لا تخترق الصبغة الجسم بشكل كاف ، ويرجع ذلك على الأرجح إلى انخفاض ضغط الدم ودرجة حرارةالجسم 13. تم إعطاء إيفانز الأزرق بجرعة 100 مجم / كجم.
- تحضير محلول إيفانز الأزرق (4٪ وزن / حجم في محلول ملحي) في أنبوب دقيق ، ثم دوامة وتخزينه في الظلام قبل الاستخدام.
- حقن المحلول في الوريد الذيل (2.5 ميكرولتر / جم)13.
4. نضح عبر القلب مع محلول FITC-dextran والتثبيت
- أضف الهيبارين إلى محلول ملحي مخزن بالفوسفات (PBS) للحصول على تركيز 1 U / مل ، ثم أضف FITC-dextran إلى PBS الهيباريني لتحقيق تركيز 3 مجم / مل.
- قم بإذابة مسحوق FITC-dextaren تماما قبل الاستخدام. للقيام بذلك ، رج المحلول برفق لمدة 30 دقيقة أو أكثر. قبل الاستخدام ، تحقق بعناية من وجود أي مسحوق FITC-dextern غير مذاب. إذا بقي أي منها ، استمر في الرج حتى يذوب تماما.
- قم بتخدير الماوس كما هو موضح في الخطوة 1.
- تابع بروتوكول تثبيت التروية القياسي باستخدام مضخة تمعجية15،16. أولا ، النفخ مع PBS الهيبارين المحتوي على FITC-dextran لمدة دقيقتين بمعدل 4.0 مل / دقيقة. ثم قم بتفريغ محلول عازلة محايد من الفورمالين بنسبة 10٪ أو 4٪ بارافورمالدهايد - PBS لمدة دقيقتين بمعدل 4.0 مل / دقيقة ، متبوعا ب 8 دقائق بمعدل 3.5 مل / دقيقة.
- قم بإزالة الدماغ بعناية باستخدام المقص الجراحي والملاقط15،16. بعد التشريح ، قم بإصلاح الدماغ بعد ذلك طوال الليل في نفس المثبت (أي 10٪ محلول عازلة محايد من الفورمالين أو 4٪ بارافورمالدهايد PBS) عند 4 درجات مئوية.
- في اليوم التالي ، استبدل المثبت ب PBS.
5. معالجة أنسجة المخ
ملاحظة: حتى إذا اكتمل تثبيت التروية ، فقد يتشتت Evans blue و FITC-dextran في المخزن المؤقت. لذلك ، يجب إكمال الإجراءات المؤدية إلى الخطوة 6.8 في غضون أسبوع بعد تثبيت التروية. بالإضافة إلى ذلك ، تجنب تعريض العينة للضوء.
- قم بإعداد صفيحة من 24 بئرا تحتوي على 500 ميكرولتر من 20٪ من الجلسرين في مخزن الفوسفات (PB ؛ الرقم الهيدروجيني 7.4) في كل بئر.
- باستخدام قطاعة الدماغ ، قم بتقطيع الدماغ إلى 12 شريحة ، كل منها بسمك 1 مم.
- انقل كل شريحة إلى البئر المقابل للوحة 24 بئرا واحفظها على حرارة 4 درجات مئوية لمدة ساعتين على الأقل.
- استبدل المحلول بنسبة 50٪ من الجلسرين-PB وقم بتخزينه في درجة حرارة 4 درجات مئوية لمدة ساعتين على الأقل.
- أخيرا ، استبدل المحلول بالجلسرين بنسبة 100٪. للمراقبة المجهرية الفورية ، اترك الشرائح تقف لمدة ساعتين على الأقل في درجة حرارة الغرفة أو قم بتخزينها عند 4 درجات مئوية. ستكون الشرائح الآن شفافة وجاهزة للمراقبة المجهرية.
6. قياس التألق لتسرب الصبغة
ملاحظة: تختلف كفاءة وضع العلامات الفلورية من ماوس إلى آخر. لذلك ، يجب تطبيع شدة الفلورة. يتم التعبير عن قيم التألق بالنسبة لتلك الموجودة داخل النواة الشبكية العملاقة (GRN) لأن هذه المنطقة تتأثر بشكل ضئيل بعلاج BSW.
- أضف 500 ميكرولتر من الجلسرين إلى قاع طبق زجاجي مقاس 35 مم.
- انقل الشريحة إلى محلول الجلسرين وقم بتغطية سطحها بغطاء زجاجي.
- قم بإزالة الجلسرين الزائد من حافة الغطاء.
- قم بقياس شدة التألق للشريحة تحت المجهر الفلوري.
- بعد القياس المجهري ، أعد الشريحة إلى البئر.
- كرر القياس لجميع الشرائح ال 12.
- أضف 500 ميكرولتر من PB إلى كل بئر وقم بتخزين اللوحة المكونة من 24 بئرا عند 4 درجات مئوية طوال الليل ؛ في اليوم التالي ، ستكون الشرائح مشبعة بنسبة 50٪ من الجلسرين-PB.
- استبدل المحلول بنسبة 30٪ من الجلسرين PB وقم بتخزينه في درجة حرارة 4 درجات مئوية لمدة ساعتين على الأقل.
- قم بتنفيذ الإجراءات الواردة في الخطوة 7 في غضون أسابيع قليلة.
7. التشريح بالتبريد والكيمياء المناعية
- قم بإعداد طبق مكون من 24 بئرا عن طريق إضافة 1000 ميكرولتر من خليط بكميات متساوية من وسط تجميد الأنسجة و 30٪ جلسرين PB إلى البئر 1. ثم أضف 1000 ميكرولتر من وسط تجميد الأنسجة إلى البئر 2.
- انقل الشريحة إلى بئر 1 ورج الطبق على حرارة 4 درجات مئوية لمدة 1 ساعة.
- انقل الشريحة إلى بئر 2 ورج الطبق على حرارة 4 درجات مئوية لمدة 1 ساعة.
- قم بتجميد الشريحة بسرعة باستخدام الأيزوبنتان باستخدام الثلج الجاف ، مع الحرص على عدم ثني الشريحة. قم بتخزين الشرائح عند -80 درجة مئوية حتى التقطيع بالتبريد.
- قم بتقطيع الشريحة بالتبريد بسمك 6 ميكرومتر. بعد التجفيف على شريحة المجهر ، قم بتخزين الأقسام عند -80 درجة مئوية.
- لاسترجاع المستضد17 ، اغمر الأقسام في سترات الصوديوم 10 ملي مولار (درجة الحموضة 6.0) ، وقم بالتسخين إلى 100 درجة مئوية مرة واحدة ، ثم حافظ على 98 درجة مئوية لمدة ساعة.
- اغسل الأقسام على نطاق واسع بالماء المقطر. الأقسام جاهزة الآن للتلوين الكيميائي المناعي.
النتائج
يوضح الشكل 1 أ المسار الزمني لحقن الصبغة فيما يتعلق ببداية BSW ، مع ذروة ضغط زائد تبلغ 25 كيلو باسكال. في بروتوكول "Post" ، تم إعطاء محلول إيفانز الأزرق داخل الأوعية الدموية قبل ساعتين من تروية FITC-dextran ، والتي تم إجراؤها بعد 6 ساعات ، و 1 يوم ، و 3 أيام ، و 7 أيام بعد التعرض ل BSW. في بروتوكول "Pre" ، تم حقن محلول إيفانز الأزرق مباشرة قبل التعرض ل BSW. في بروتوكول "Post" ، من المتوقع أن يصل تركيز إيفانز الأزرق إلى الحد الأقصى قبل حوالي ساعتين من تثبيت التروية ، بينما في بروتوكول "Pre" ، من المتوقع أن يصل إلى الحد الأقصى في وقت قريب من التعرض ل BSW (الشكل 1 ب). تم الحفاظ على تركيز FITC-dextern في الأوعية الدموية الدماغية ثابتا لمدة دقيقتين أثناء التروية.
أظهر وضع العلامات الزرقاء على إيفانز أن انهيار BBB بدأ في غضون 6 ساعات واستمر حتى 7 أيام بعد التعرض ل BSW (الشكل 2 أ). والجدير بالذكر أن انهيار BBB لم يحدث مباشرة بعد التعرض ل BSW ، حيث لم يكن هناك تسرب لصبغة إيفانز الزرقاء في 3 ساعات في بروتوكول "Pre" (الشكل 2 ب). من المثير للدهشة أن وضع العلامات طويلة المدى باللون الأزرق على إيفانز يشير إلى طبيعته التراكمية في بروتوكول "Pre" (الشكل 2 ب) 7.
سمح استخدام صبغتين متميزتين ، يتم إدخال كل منهما على فترات 2 ساعة أو أكثر ، بفحص التغيرات الزمنية في سلامة BBB من خلال مقارنة توزيعها. يوضح الشكل 3 صور مضان للشرائح التي أظهرت اختلافا كبيرا في توزيع إيفانز الأزرق و FITC-dextran.
لوحظ العديد من النقاط الساخنة الفلورية بأحجام مختلفة. على الرغم من أن بعض النقاط الساخنة كانت ساطعة بما يكفي لتحتل المرتبة بين أعلى 0.1٪ من وحدات البكسل ، إلا أن العديد منها كان أكثر إشراقا قليلا من الأنسجة المحيطة. يشير التناقض بين الأصباغ إلى حدوث تغييرات خلال هذه الفترة. أشارت النقاط الساخنة التي تعرض مضان إيفانز الأزرق فقط إلى انهيار BBB المستمر في وقت حقن إيفانز الأزرق ، والذي تم إصلاحه لاحقا عن طريق حقن FITC-dextran. في المقابل ، تشير النقاط الساخنة التي تظهر مضان FITC-dextran فقط إلى حدوث اضطراب BBB بين حقن الصبغة. أخيرا ، أشارت النقاط الساخنة التي تظهر مضان من كلتا الصبغتين إلى انهيار BBB المستمر خلال فترة الحقن بأكملها.
يعرض الشكل 4 أ عدد النقاط الساخنة الإيجابية لإيفانز الأزرق (بما في ذلك كل من النقاط الساخنة الإيجابية المزدوجة الإيجابية لإيفانز الأزرق فقط وإيفانز الأزرق / FITC-dextran) ، FITC-dextern (بما في ذلك كل من FITC-dextran-only و Evans blue / FITC-dextern النقاط الساخنة الإيجابية المزدوجة) ، أو كلا الأصباغ (فقط النقاط الساخنة الإيجابية المزدوجة Evans blue / FITC-dextran). في بروتوكول "Pre" في 3 ساعات ، لوحظت العديد من النقاط الساخنة FITC-dextran فقط. في 6 ساعات و 1 يوم في بروتوكول "Post" ، تم اكتشاف كل من نقاط اتصال Evans الأزرق فقط و FITC-dextern فقط. ومع ذلك ، في 3 أيام و 7 أيام في بروتوكول "Post" ، كانت النقاط الساخنة إيجابية في الغالب لكلتا الصبغتين. تشير هذه النتائج إلى أن انهيار BBB حدث في 3 ساعات ، وأعيد تشكيله بمقدار يوم واحد ، واستمر حتى 7 أيام بعد التعرض ل BSW (الشكل 4 ب). الأهم من ذلك ، أن مدى انهيار BBB يميل إلى الانخفاض بمقدار 7 أيام ، كما ذكرنا سابقا.
بعد الانتهاء من تجارب تسرب الصبغة ، تم إجراء تلطيخ كيميائي مناعي للشرائح7. تمت مقارنة عمليات مسح الصور الكيميائية المناعية باستمرار مع تلك الخاصة بتسرب الصبغة ، مما يؤكد أن التأثير المرحلي للمواد الفلورية كان ضئيلا عمليا7. كما هو موضح في الشكل 5 ، ارتبطت مجموعات الخلايا النجمية التفاعلية ارتباطا وثيقا بمواقع انهيار BBB. كشفت المزيد من الملاحظات أن الخلايا الدبقية الصغيرة المنشطة والأميبويدية كانت موجودة جنبا إلى جنب مع الخلايا النجمية التفاعلية بعد 3 أيام من التعرض ل BSW.

الشكل 1: التصميم التجريبي. (أ) المسار الزمني للتجربة. تم حقن محلول إيفانز الأزرق عن طريق الوريد بعد (بروتوكول "Post") أو مباشرة قبل (بروتوكول "Pre") التعرض ل BSW ، بينما تم ترشيح FITC-dextern عبر القلب لمدة دقيقتين قبل التثبيت. (ب) التركيزات المتوقعة من إيفانز الأزرق و FITC-dexterrn في الأوعية الدموية في بروتوكولي "Post" و "Pre" ، على التوالي. BSW ، موجات الصدمة الناجمة عن الانفجار ؛ FITC ، فلورسين إيزوثيوسيانات. هذا الشكل مقتبس من Nishii et al.7. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: مقارنة شدة التألق في شرائح الدماغ. تم تقييم شدة التألق لألمع 0.1٪ من وحدات البكسل في الدماغ عبر جميع الشرائح ال 12 ومقارنتها بين ظروف "اللاحق" (A) و "Pre" (B). يشار إلى تباين وأهمية الاختلافات. xxx يدل على p < 0.001 ؛ يشير xxxx إلى p < 0.0001 (قيم p من F-test). * ص < 0.05 ؛ ص < 0.0001 (تحليل التباين مع اختبار Dunnett's المقارنات المتعددة اللاحق). هذا الشكل مقتبس من Nishii et al.7. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
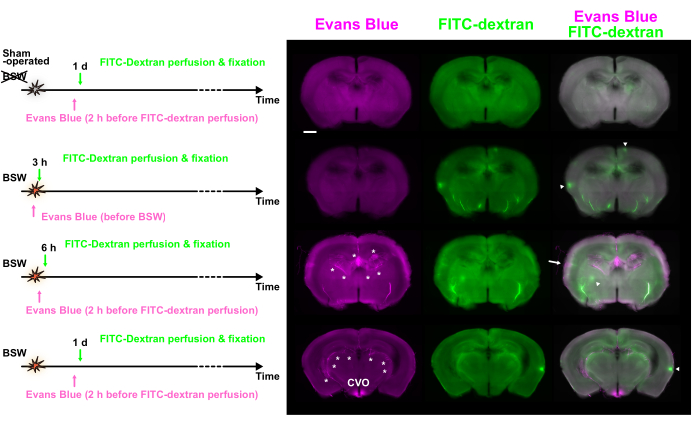
الشكل 3: لوحظ انهيار BBB في نقاط زمنية مختلفة باستخدام وضع العلامات المزدوجة مع إيفانز الأزرق و FITC-dextran. يتم عرض إيفانز الأزرق (الأرجواني) و FITC-dextran (الأخضر) والصور المدمجة. يتم تقديم بروتوكولات حقن الصبغة على الجانب الأيسر. أظهرت بعض النقاط الساخنة التألق السائد لإيفانز الأزرق (السهم) أو FITC-dextern (رؤوس الأسهم). تشير العلامات النجمية إلى الضفيرة المشيمية والأوعية ذات الصلة. BBB ، حاجز الدم الدماغي ؛ FITC ، فلورسين إيزوثيوسيانات. CVO ، الأعضاء المحيطة بالبطين الثالث. شريط المقياس: 1 مم. هذا الشكل مقتبس من Nishii et al.7. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: القياس الكمي للنقاط الساخنة الفلورية. (أ) أعداد النقاط الساخنة الإيجابية لإيفانز الأزرق (الأرجواني) ، FITC-dextern (الأخضر) ، وكلا الأصباغ (الرمادي). تم جمعها من الصور التي تم الحصول عليها في 3 ساعات في بروتوكول "ما قبل "وكذلك من الصور التي تم الحصول عليها في 6 ساعات ، 1 يوم ، 3 أيام ، و 7 أيام في بروتوكول "البعد". من 3 ساعات إلى يوم واحد ، أظهر جزء كبير من النقاط الساخنة الفلورية عدم تطابق بين الصبغة ، بينما من 3 أيام إلى 7 أيام ، بالكاد لوحظ عدم التطابق هذا. (ب) مخطط يلخص المسار الزمني لتوزيع BBB. يمثل المحور الرأسي من الناحية المفاهيمية شدة تسرب الصبغة بسبب انهيار BBB. يشير النمط المتعرج من 3 ساعات إلى يوم واحد إلى أن موقع وشدة تسرب الصبغة غير مستقر خلال هذه الفترة. FITC ، فلورسين إيزوثيوسيانات. BBB ، حاجز الدم الدماغي ؛ BSW ، موجات الصدمة الناجمة عن الانفجار. هذا الشكل مقتبس من Nishii et al.7. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
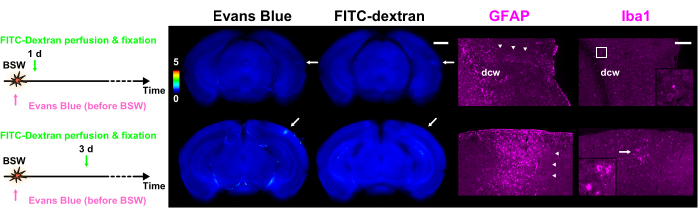
الشكل 5: التعبير عن GFAP و Iba1 كعلامات للخلايا النجمية والخلايا الدبقية الصغيرة ، على التوالي. يحتوي كل عمود من الشكل على صور مضان لتسرب الصبغة باستخدام إيفانز الأزرق أو FITC-dextrain ، جنبا إلى جنب مع صور GFAP أو Iba1 الكيميائية المناعية. يشير شريط الألوان إلى شدة التألق الطبيعية لإيفانز الأزرق و FITC-dextern باستخدام تلك الموجودة داخل GRN. يتم تقديم بروتوكولات حقن الصبغة على الجانب الأيسر. تظهر شريحة اليوم الواحد في بروتوكول "Pre" مضان كل من Evans blue و FITC-dextaren ، في حين أن شريحة 3 أيام في بروتوكول "Pre" تظهر فقط مضان إيفانز الأزرق (الأسهم). تتماشى المناطق المشار إليها بالأسهم الموجودة في صور تسرب الصبغة مع الصور الكيميائية المناعية. تشير رؤوس الأسهم إلى مجموعات من الخلايا النجمية التفاعلية. قام الجسم المضاد GFAP متعدد النسيلة بتسمية الخلايا النجمية داخل المادة البيضاء وحولها وكذلك في الأنسجة العصبية المجاورة للأم الصغيرة. نتيجة لذلك ، يتم تصنيف الخلايا النجمية داخل وبالقرب من dcw في هذا الشكل. يتم تصوير الصور المكبرة المقابلة للإطار أو السهم في عمود Iba1 في المجموعات. قضبان المقياس: 1 مم و 200 ميكرومتر لتسرب الصبغة والصور الكيميائية المناعية ، على التوالي. GFAP ، البروتين الحمضي الليفي الدبقي ؛ Iba1 ، جزيء محول ربط الكالسيوم المتأين 1 ؛ FITC ، فلورسين إيزوثيوسيانات. BSW ، موجات الصدمة الناجمة عن الانفجار ؛ DCW ، مادة بيضاء دماغية عميقة. هذا الشكل مقتبس من Nishii et al.7. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
تم استخدام تقنية جديدة للوضع المزدوج باستخدام إيفانز الأزرق و FITC-dextern لتصور التوزيع المكاني الزمني الدقيق لانهيار BBB في دماغ واحد بدقة. في نموذج BSW منخفض الكثافة ، لوحظت اختلافات ملحوظة في مدى وموقع ودرجة تسرب الصبغة في الأدمغة التي تم فحصها (الشكل 2 والشكل 3). كشفت حالات عدم التطابق بين الصبغة أن انهيار BBB بدأ بعد حوالي 3 ساعات من التعرض ل BSW ، مع حدوث إعادة تشكيل كبيرة بحلول اليوم الأول واستمرت حتى اليوم 7 (الشكل 4). في الحالات الشديدة ، تم تجنيد الخلايا الدبقية الصغيرة النشطة في مواقع انهيار BBB ، وكانت مجموعات الخلايا النجمية التفاعلية مرتبطة ارتباطا وثيقا بهذه المناطق (الشكل 5). من خلال إجراء الكيمياء النسيجية المناعية على نفس الشرائح المستخدمة في تحليل تسرب الصبغة ، تم إنشاء علاقة دقيقة بين التفاعلات الدبقية وتسرب الصبغة. لمزيد من البيانات والتحليلات التفصيلية ، يرجى الرجوع إلى Nishii et al.7.
نظرا لأن FITC-dextran كان ممتلئا بتركيز ثابت لمدة متطابقة مباشرة قبل تثبيت التروية ، فمن المحتمل أن يمثل توزيع وشدة الصبغة بدقة مدى انهيار BBB في وقت تثبيت التروية. ومع ذلك ، فقد ثبت في تقرير سابق أن تألق FITC-dexterrn يميل إلى أن يكون ضعيفا في نموذج BSWمنخفض الكثافة 7. كان وضع العلامات باستخدام إيفانز الأزرق لفترة أطول مفيدا ، حيث يمكنه اكتشاف تغييرات أكثر دقة في انهيار BBB (الشكل 2). ومع ذلك ، نظرا لطول مدة وضع العلامات ، قد يلزم توخي الحذر عند تفسير صور الفلورسنت لإيفانز باللون الأزرق. كان تركيز دم إيفانز الأزرق هو الأعلى مباشرة بعد الحقن وانخفض تدريجيا على مدى بضع ساعات (الشكل 1) 11. من المتوقع أن ترتبط شدة وضع العلامات مع شدة ومدة انهيار BBB بالإضافة إلى تركيز دم إيفانز الأزرق. ومع ذلك ، فإنه سينخفض بشكل كبير بمجرد إصلاحه. كل هذه العوامل تختلف من وقت لآخر ومن تجربة إلى أخرى. لذلك ، لا ينبغي استخلاص استنتاج من صورة واحدة لتسرب الصبغة ، والاعتبارات الإحصائية ضرورية دائما.
اعتمادا على الغرض من التجربة ، قد يكون من المثير للاهتمام تغيير الوزن الجزيئي بالإضافة إلى مزيج الأصباغ. في هذه الدراسة ، تم استخدام مزيج من Evans Blue و FITC-dextran. بعد الارتباط بألبومين المصل ، تصرف إيفانز الأزرق كمتتبع 69 كيلو دالتون ، وأظهر 40 كيلو دالتون FITC-dextران المستخدم في هذه الدراسة مدى مماثل لانهيار BBB مثل إيفانز الأزرق. تم التحقيق في التوزيع الزماني المكاني لانهيار BBB بشكل منهجي باستخدام مجموعة من الأصباغ التي تنبعث منها مضان مختلف7. في دراسة سابقة استخدمت مزيجا من فلوريسين إيفانز الأزرق والصوديوم (376 دال) ، يمكن لفلورسين الصوديوم ، نظرا لوزنه الجزيئي الأصغر ، أن يضع على نطاق أوسع من انهيار BBB بعد التعرض ل BSW3. في دراسات أخرى ، تم استخدام مجموعات من إيفانز الأزرق والوزن الجزيئي العالي FITC-dextran، لمقارنة مدى انهيار BBB18،19. أدارت جميع التقارير السابقة إيفانز الأزرق و FITC-dextern في وقت واحد تقريبا. الجانب الفريد للبروتوكول المقدم هنا هو أن الصبغتين تم إدخالهما في نقاط زمنية مختلفة ، مما يسمح بفحص التقدم الزمني لانهيار BBB.
قد تكون الطبيعة التراكمية لإيفانز الأزرق مفيدة في نماذج انهيار BBB المختلفة. نظرا لأنه يسجل تاريخ انهيار BBB ، فقد يتم تسهيل فهم ظهور المرض وتطوره. يجب أن يكون الباحثون على دراية بالخصائص الإيجابية والسلبية للأصباغ والاستفادة منها إلى أقصى حد9. يحتوي هذا البروتوكول على مجموعة واسعة من التطبيقات لنماذج انهيار BBB المختلفة.
Disclosures
المؤلفون ليس لديهم ما يكشفون عنه.
Acknowledgements
نشكر Mayumi Watanabe على تقنية التقطيع بالتبريد. تم دعم هذا العمل من خلال منحة أبحاث متقدمة في الطب العسكري من وزارة الدفاع اليابانية.
Materials
| Name | Company | Catalog Number | Comments |
| 10% Formalin Neutral Buffer Solution | FUJIFILM Wako Chemicals | 062-01661 | |
| Anti GFAP, Rabbit | DAKO-Agilent | IR524 | |
| Anti Iba1, Rabbit | FUJIFILM Wako Chemicals | 019-19741 | |
| Chicken anti-Mouse IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 488 | Thermo Fisher Scientific | A-21200 | |
| Cryo Mount | Muto Pure Chemicals | 33351 | tissue freezing medium |
| Domitor | Orion Corporation | medetomidine | |
| Donkey anti-Rabbit IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 546 | Thermo Fisher Scientific | A10040 | |
| Evans Blue | Sigma-Aldrich | E2129 | |
| Falcon 24-well Polystyrene Clear Flat Bottom Not Treated Cell Culture Plate, with Lid, Individually Wrapped, Sterile, 50/Case | CORNING | 351147 | |
| Fluorescein isothiocyanate–dextran average mol wt 40,000 | Sigma-Aldrich | FD40S | FITC-dextran |
| Glass Base Dish 27mm (No.1 Glass) | AGC TECHNO GLASS | 3910-035 | 35 mm glass bottom dish |
| IX83 Inverted Microscope | OLYMPUS | ||
| MAS Hydrophilic Adhesion Microscope Slides | Matsunami Glass | MAS-04 | |
| Matsunami Cover Glass (No.1) 18 x 18mm | Matsunami Glass | C018181 | |
| Midazolam Injection 10mg [SANDOZ] | Sandoz | ||
| Paraformaldehyde EMPROVE ESSENTIAL DAC | Merck Millipore | 1.04005.1000 | |
| Peristaltic Pump | ATTO | SJ-1211 II-H | |
| RODENT BRAIN MATRIX Adult Mouse, 30 g, Coronal | ASI INSTRUMENTS | RBM-2000C | brain slicer |
| Vetorphale | Meiji Animal Health | VETLI5 | butorphanol |
References
- Sweeney, M. D., Zhao, Z., Montagne, A., Nelson, A. R., Zlokovic, B. V. Blood-brain barrier: From physiology to disease and back. Physiol Rev. 99 (1), 21-78 (2019).
- Kabu, S., et al. Blast-associated shock waves result in increased brain vascular leakage and elevated ros levels in a rat model of traumatic brain injury. PLoS One. 10 (5), e0127971(2015).
- Kuriakose, M., Rama Rao, K. V., Younger, D., Chandra, N. Temporal and spatial effects of blast overpressure on blood-brain barrier permeability in traumatic brain injury. Sci Rep. 8 (1), 8681(2018).
- Yeoh, S., Bell, E. D., Monson, K. L. Distribution of blood-brain barrier disruption in primary blast injury. Ann Biomed Eng. 41 (10), 2206-2214 (2013).
- Readnower, R. D., et al. Increase in blood-brain barrier permeability, oxidative stress, and activated microglia in a rat model of blast-induced traumatic brain injury. J Neurosci Res. 88 (16), 3530-3539 (2010).
- Shetty, A. K., Mishra, V., Kodali, M., Hattiangady, B. Blood-brain barrier dysfunction and delayed neurological deficits in mild traumatic brain injury induced by blast shock waves. Front Cell Neurosci. 8, 232(2014).
- Nishii, K., et al. Evans blue and fluorescein isothiocyanate-dextran double labeling reveals the precise sequence of vascular leakage and glial responses after exposure to mild-level blast-associated shock waves. J Neurotrauma. 40 (11-12), 1228-1242 (2023).
- Hoffmann, A., et al. High and low molecular weight fluorescein isothiocyanate (FITC)-dextrans to assess blood-brain barrier disruption: Technical considerations. Transl Stroke Res. 2 (1), 106-111 (2011).
- Saunders, N. R., Dziegielewska, K. M., Møllgård, K., Habgood, M. D. Markers for blood-brain barrier integrity: How appropriate is Evans blue in the twenty-first century and what are the alternatives. Front Neurosci. 9, 385(2015).
- Manaenko, A., Chen, H., Kammer, J., Zhang, J. H., Tang, J. Comparison Evans blue injection routes: Intravenous versus intraperitoneal, for measurement of blood-brain barrier in a mice hemorrhage model. J Neurosci Methods. 195 (2), 206-210 (2011).
- Yen, L. F., Wei, V. C., Kuo, E. Y., Lai, T. W. Distinct patterns of cerebral extravasation by Evans blue and sodium fluorescein in rats. PLoS One. 8 (7), e68595(2013).
- Kawai, S., Takagi, Y., Kaneko, S., Kurosawa, T. Effect of three types of mixed anesthetic agents alternate to ketamine in mice. Exp Anim. 60 (5), 481-487 (2011).
- Machholz, E., Mulder, G., Ruiz, C., Corning, B. F., Pritchett-Corning, K. R. Manual restraint and common compound administration routes in mice and rats. J Vis Exp. 67, e2771(2012).
- Satoh, Y., et al. Molecular hydrogen prevents social deficits and depression-like behaviors induced by low-intensity blast in mice. J Neuropathol Exp Neurol. 77 (9), 827-836 (2018).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. J Vis Exp. 65, e3564(2012).
- Selever, J., Kong, J. Q., Arenkiel, B. R. A rapid approach to high-resolution fluorescence imaging in semi-thick brain slices. J Vis Exp. 53, e2807(2011).
- Jiao, Y., et al. A simple and sensitive antigen retrieval method for free-floating and slide-mounted tissue sections. J Neurosci Methods. 93 (2), 149-162 (1999).
- Nagaraja, T. N., Keenan, K. A., Fenstermacher, J. D., Knight, R. A. Acute leakage patterns of fluorescent plasma flow markers after transient focal cerebral ischemia suggest large openings in blood-brain barrier. Microcirculation. 15 (1), 1-14 (2010).
- Xu, Y., et al. Quantifying blood-brain-barrier leakage using a combination of Evans blue and high molecular weight fitc-dextran. J Neurosci Methods. 325, 108349(2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved