Method Article
경미한 외상성 뇌 손상의 마우스 모델에서 혈액-뇌 장벽 파괴 평가
요약
서로 다른 시점의 마우스에 두 개의 형광 염료를 투여하여 혈액뇌장벽(BBB) 파괴로 인한 염료 유출을 시각화하는 방법이 개발되었습니다. 동결 보호제로서 글리세롤을 사용함으로써 동일한 샘플에 대한 면역조직화학이 촉진되었습니다.
초록
형광 염료는 혈액뇌장벽(BBB) 파괴로 인해 발생하는 염료 유출의 정도를 결정하는 데 사용됩니다. 이러한 염료를 사용한 라벨링은 혈액 내 염료의 농도, 뇌 혈관의 투과성, 염료 유출 기간, 분해 및 확산으로 인한 조직의 염료 농도 감소와 같은 여러 요인의 영향을 받는 복잡한 과정입니다. 경미한 외상성 뇌 손상 모델에서 폭발 유도 충격파(BSW)에 노출되면 제한된 시간 내에 BBB 파괴가 유발됩니다. BBB 분해의 정확한 순서를 결정하기 위해 Evans blue 및 fluorescein isothiocyanate-dextran을 BSW 노출과 관련된 다양한 시점에서 마우스에 혈관 내 및 심내 주사했습니다. 그런 다음 뇌 절편에서 염료 형광의 분포를 기록했습니다. 두 염료 사이의 분포와 강도의 차이는 BBB 파괴의 시공간 순서를 밝혔습니다. 뇌 절편의 면역 염색은 성상세포 및 미세아교세포 반응이 BBB 파괴 부위와 상관관계가 있음을 보여주었습니다. 이 프로토콜은 다양한 BBB 분해 모델과 관련된 연구에 적용할 수 있는 광범위한 잠재력을 가지고 있습니다.
서문
혈액뇌장벽(BBB) 파괴 및 기능 장애는 전신 염증, 감염, 자가면역 질환, 부상 및 신경 퇴행성 질환으로 인해 발생합니다1. 폭발 유도 충격파(BSW)에 대한 노출로 인한 경미한 외상성 뇌 손상(mTBI)에서 BSW의 강도와 BBB 파괴로 인한 형광 염료 누출 양 사이에 상당한 상관관계가 관찰되었습니다 2,3,4. mTBI에서 BBB 분해의 한 가지 주목할 만한 특징은 BSW에 노출된 직후 또는 몇 시간 이내에 시작되며, 일반적으로 지연된 만성 신경 질환이 나타나기 전에 약 일주일 동안 지속되는 일시적인 과정이라는 것입니다 3,5,6,7. 세부 사항은 불분명하지만, BBB 파괴는 오래 지속되는 병리학적 연쇄 반응의 일부이며 mTBI6의 예후 인자로 작용할 수도 있습니다. 따라서 뇌에서 BBB 분해의 공간적, 시간적 분포를 이해하는 것이 중요합니다.
BBB 파괴 정도를 측정하기 위해 형광 염료가 사용됩니다 3,8. 염료의 혈중 농도와 BBB 분해의 크기 및 정도는 시간이 지남에 따라 변하기 때문에 염료 유출 이미지를 해석할 때 주의가 필요합니다. 예를 들어, 염료 유출이 없다고 해서 반드시 BBB 파괴가 없음을 나타내는 것은 아닙니다. 염료의 혈중 농도가 증가하기 전이나 후에 BBB 분해가 감지되지 않을 수 있습니다. BBB 분해가 발생한 곳에서 염료가 성공적으로 축적되었다 하더라도 분해가 중단된 후 시간이 지남에 따라 손실되었을 수 있습니다. 일반적으로 수용성 및 생물학적으로 불활성인 물질은 소변을 통해 빠르게 배설된다9. 따라서 BBB 분해가 특정 시간에 발생하는지 여부를 확인하기 위해 동물을 고정하기 직전 짧은 기간 동안 형광 염료를 혈류에 투여할 때 가장 신뢰할 수 있는 결과를 얻을 수 있습니다. 시판되는 특정 분자량을 가진 시판되는 플루오레세인 이소티오시아네이트(FITC)-덱스트란을 이러한 방식으로 사용해야 합니다.
Evans blue는 혈청 알부민에 대한 친화력이 강한 널리 알려진 파란색 아조 염료입니다. 염료는 생물학적 시스템에서 녹색 빛에 의해 여기될 때 적색 형광을 나타냅니다2. 불활성 특성으로 인해 Evans 블루 세럼 알부민 복합체는 최대 2시간 동안 혈액에 남아 있어 적어도 이 기간 동안 손상된 BBB가 있는 영역을 표지하는 데 유용한 69kDa 추적자가 됩니다10,11. 따라서 Evans blue9의 약동학 및 독성을 둘러싼 잠재적인 불확실성을 고려하는 것이 중요합니다. 그러나 최근 연구에 따르면 에반스 블루는 BBB가 없거나 방해받은 영역에서 계속 축적되는 것으로 나타났습니다7. 이 기능을 통해 Evans Blue는 BBB 붕괴 이력을 기록할 수 있었고, FITC-dextran은 BSW 노출 후 특정 시점의 BBB 붕괴를 기록하는 데 사용되었습니다. Evans blue는 정맥 투여 또는 복강 내 투여가 가능하지만10, 시간에 민감한 실험에는 정맥 투여가 선호됩니다. 이 연구는 BSW 노출 후 BBB 파괴의 시공간 분포를 감지하기 위해 Evans blue와 FITC-dextran을 사용하는 것을 입증하는 것을 목표로 했습니다.
둘째, 본 연구는 BBB 분해의 형광을 관찰한 후 뇌 절편을 동결하고 면역조직화학 시술에 적합한 더 얇은 절편을 준비하는 기술을 제시했다. 글리세롤을 장착 매체 및 동결 보호제로 사용하면 면역조직화학 과정이 단순화됩니다. BBB 분해 이미지를 면역조직화학의 이미지와 비교함으로써 BBB 분해의 시공간 분포를 동일한 샘플의 조직 반응과 상관시킬 수 있습니다.
프로토콜
모든 실험은 국방의과대학(일본 도코로자와)에서 제정한 동물실험 윤리 지침에 따라 수행되었습니다. 이 연구 프로토콜은 국방의과대학 동물연구위원회(Committee for Animal Research)의 승인을 받았다(승인번호 23011-1). 이 연구에는 8주령, 체중 19-23g의 수컷 C57BL/6J 마우스가 사용되었습니다. 그림 1에서 볼 수 있듯이, 단일 Evans 블루 주입 및 FITC-덱스트란 관류는 단일 BSW 노출과 관련하여 다양한 시점에서 수행되었습니다. 사용된 시약 및 장비에 대한 자세한 내용은 재료 표에 나열되어 있습니다.
1. 마취
참고: 이것은 원래12에 비해 메데토미딘의 양을 2.5배 증가시키는 수정된 프로토콜입니다. 메데토미딘 염산염, 미다졸람, 부토르파놀의 투여량은 각각 0.75mg/kg, 4mg/kg, 5mg/kg이었다.
- 메데토미딘 염산염(75μg/mL), 미다졸람(400μg/mL) 및 부토르파놀(500μg/mL)의 혼합물을 생리식염수에 준비합니다.
- 혼합물을 복강내로 투여하여 마우스(10μL/g)를 마취합니다.13.
- 약 5-10분 후, 꼬리 꼬집음 및 페달 철수 반사가 없는지 관찰하여 충분한 마취를 확인합니다.
- 마취 효과에서 회복될 때까지 마우스를 따뜻하게 유지하십시오.
2. BSW 노출
참고: 이 연구에서는 사내 충격관이 사용되었다14.
- 1단계에서 설명한 대로 마우스를 마취합니다.
- 마우스를 쇼크 튜브의 출구 끝에서 5cm 떨어진 곳에 배치하고 본체 축이 튜브의 축과 평행하지만 정렬되지 않도록 합니다.
- 머리에 25kPa의 최대 과압으로 단일 BSW 노출을 제공합니다.
알림: 마취 효과에서 회복될 때까지 마우스를 따뜻하게 유지하십시오. 치료된 마우스의 상태를 정기적으로 모니터링하십시오. 섭식 또는 음주 곤란, 구부정 또는 회복의 징후 없이 장기간 비정상적인 모습과 같은 고통의 징후가 관찰되면 마우스를 안락사시키고 실험을 조기에 종료합니다. 진통제는 잠재적으로 신경교 반응에 영향을 미칠 수 있으므로 복용을 피하십시오.
3. 꼬리 정맥에 Evans 파란색 주입
참고: Evans 블루 용액은 마취 없이 정맥 주사해야 합니다. 마취가 있는 상태에서 염료가 신체에 충분히 침투하지 못하는 경우가 많은데, 이는 혈압과 체온 저하로 인한 것으로 보인다13. 에반스 블루는 100 mg/kg의 용량으로 투여되었다.
- 마이크로튜브에 Evans 블루 용액(식염수 4% w/v)을 준비한 다음 소용돌이치고 사용하기 전에 어두운 곳에 보관하십시오.
- 용액을 꼬리 정맥(2.5μL/g)에 주입합니다.13.
4. FITC-dextran 용액 및 고정을 사용한 경심 관류
- 인산염 완충 식염수(PBS)에 헤파린을 첨가하여 1 U/mL의 농도를 얻은 다음 헤파린 처리된 PBS에 FITC-덱스트란을 첨가하여 3 mg/mL의 농도를 얻습니다.
- 사용하기 전에 FITC-dextran 분말을 완전히 녹입니다. 이렇게하려면 용액을 30 분 이상 부드럽게 흔듭니다. 사용하기 전에 용해되지 않은 FITC-덱스트란 분말이 있는지 주의 깊게 확인하십시오. 남아 있으면 완전히 녹을 때까지 계속 흔듭니다.
- 1단계에서 설명한 대로 마우스를 마취합니다.
- 연동 펌프15,16을 사용하여 표준 관류 고정 프로토콜을 진행합니다. 먼저 FITC-dextran을 함유한 헤파린 처리된 PBS를 4.0mL/분의 속도로 2분 동안 관류합니다. 그런 다음 10% 포르말린 중성 완충액 용액 또는 4% 파라포름알데히드-PBS를 4.0mL/분의 속도로 2분 동안 관류한 다음 3.5mL/분의 속도로 8분 동안 관류합니다.
- 수술용 가위와 핀셋을 사용하여 조심스럽게 뇌를 제거한다 15,16. 해부 후 4°C에서 동일한 고정액(즉, 10% 포르말린 중성 완충 용액 또는 4% 파라포름알데히드-PBS)에 하룻밤 동안 뇌를 고정합니다.
- 다음 날에는 정착액을 PBS로 교체하십시오.
5. 뇌 조직 처리
참고: 관류 고정이 완료되더라도 Evans blue 및 FITC-dextran은 완충액으로 분산될 수 있습니다. 따라서 6.8단계까지 이어지는 절차는 관류 고정 후 일주일 이내에 완료해야 합니다. 또한 샘플을 빛에 노출시키지 마십시오.
- 각 웰의 인산염 완충액(PB, pH 7.4)에 20% 글리세롤 500μL가 포함된 24웰 플레이트를 준비합니다.
- 뇌 슬라이서를 사용하여 뇌를 각각 1mm 두께의 12개 조각으로 자릅니다.
- 각 슬라이스를 24웰 플레이트의 해당 웰로 옮기고 4°C에서 최소 2시간 동안 보관합니다.
- 용액을 50% 글리세롤-PB로 교체하고 4°C에서 최소 2시간 동안 보관합니다.
- 마지막으로 용액을 100% 글리세롤로 교체합니다. 즉각적인 현미경 관찰을 위해 슬라이스를 실온에서 최소 2시간 동안 방치하거나 4°C에서 보관하십시오. 이제 조각이 반투명하여 현미경으로 관찰할 수 있습니다.
6. 염료 유출의 형광 측정
참고: 형광 라벨링 효율은 마우스마다 다릅니다. 따라서 형광 강도를 정규화해야 합니다. 형광 값은 거대세포 망상핵(GRN) 내의 값에 비해 상대적으로 표현되는데, 이 영역은 BSW 처리의 영향을 최소화하기 때문입니다.
- 35mm 유리 바닥 접시 바닥에 글리세롤 500μL를 추가합니다.
- 슬라이스를 글리세롤 용액에 옮기고 표면을 커버 유리로 덮습니다.
- 커버 글라스 가장자리에서 과도한 글리세롤을 제거합니다.
- 형광 현미경으로 슬라이스의 형광 강도를 측정합니다.
- 현미경 측정 후 슬라이스를 우물로 되돌립니다.
- 12개 슬라이스 모두에 대해 측정을 반복합니다.
- 각 웰에 500μL의 PB를 추가하고 24웰 플레이트를 4°C에서 밤새 보관합니다. 다음 날, 슬라이스는 50% 글리세롤-PB로 포화됩니다.
- 용액을 30% 글리세롤-PB로 교체하고 4°C에서 최소 2시간 동안 보관합니다.
- 몇 주 내에 7단계의 절차를 수행합니다.
7. 냉동 절편 및 면역 조직 화학
- 웰 1에 동일한 부피의 조직 동결 매체와 30% 글리세롤-PB의 혼합물 1000μL를 추가하여 24웰 플레이트를 준비합니다. 그런 다음 1000μL의 조직 동결 배지를 well 2에 추가합니다.
- 슬라이스를 웰 1로 옮기고 4°C에서 1시간 동안 플레이트를 흔듭니다.
- 슬라이스를 웰 2로 옮기고 4°C에서 1시간 동안 플레이트를 흔듭니다.
- 드라이 아이스를 사용하여 이소펜탄으로 슬라이스를 빠르게 동결하고 슬라이스가 구부러지지 않도록 주의하십시오. 동결 절편까지 슬라이스를 -80 °C에서 보관하십시오.
- 슬라이스를 6μm 두께로 극저온 절편합니다. 현미경 슬라이드를 건조시킨 후 -80 °C에서 섹션을 보관하십시오.
- 항원 회수17의 경우, 절편을 10mM 구연산나트륨(pH 6.0)에 담그고 100°C로 한 번 가열한 다음 98°C에서 1시간 동안 유지합니다.
- 증류수로 섹션을 광범위하게 씻으십시오. 이제 절편은 면역조직화학 염색을 위한 준비가 되었습니다.
결과
그림 1A 는 BSW의 시작과 관련된 염료 주입의 시간 경과를 보여주며, 최대 과압은 25kPa입니다. 'Post' 프로토콜에서 Evans blue solution은 FITC-dextran 관류 2시간 전에 혈관 내 투여되었으며, 이는 BSW 노출 후 6시간, 1일, 3일 및 7일 후에 수행되었습니다. 'Pre' 프로토콜에서 Evans 블루 용액은 BSW 노출 직전에 주입되었습니다. 'Post' 프로토콜에서 Evans blue의 농도는 관류 고정 약 2시간 전에 최대에 도달할 것으로 예상되는 반면, 'Pre' 프로토콜에서는 BSW 노출 시점 즈음에 최대에 도달할 것으로 예상됩니다(그림 1B). 뇌혈관 내 FITC-dextran의 농도는 관류 중 2분 동안 일정하게 유지되었습니다.
Evans 파란색 라벨링은 BBB 분해가 6시간 이내에 시작되어 BSW 노출 후 7일까지 계속되었음을 보여주었습니다(그림 2A). 특히, 'Pre' 프로토콜에서 3시간에 Evans 청색 염료 유출이 없었기 때문에 BSW 노출 직후 BBB 파괴가 발생하지 않았습니다(그림 2B). 놀랍게도, Evans blue를 사용한 장기 라벨링은 'Pre' 프로토콜에서 누적 특성을 나타냅니다(그림 2B)7.
각각 2시간 이상의 간격으로 도입된 두 가지 별개의 염료를 사용하여 분포를 비교하여 BBB 무결성의 시간적 변화를 조사할 수 있었습니다. 그림 3 은 Evans blue와 FITC-dextran의 분포에서 유의한 차이를 보인 절편의 형광 이미지를 보여줍니다.
다양한 크기의 수많은 형광 핫스팟이 관찰되었습니다. 일부 핫스팟은 픽셀의 상위 0.1%에 속할 만큼 충분히 밝았지만 대부분은 주변 조직보다 약간 더 밝았습니다. 염료 간의 불일치는 이 간격 내에서 변화가 발생했음을 시사합니다. Evans blue 형광만 표시하는 핫스팟은 Evans blue 주입 시 BBB 파괴가 진행 중임을 나타냈으며, 이는 나중에 FITC-dextran 주입으로 복구되었습니다. 대조적으로, FITC-dextran 형광만 보이는 핫스팟은 두 염료 주입 사이에 BBB 파괴가 발생했음을 시사합니다. 마지막으로, 두 염료에서 형광을 나타내는 핫스팟은 전체 주입 기간 동안 지속적인 BBB 파괴를 나타냈습니다.
그림 4A 는 Evans blue(Evans blue-only 및 Evans blue/FITC-dextran 이중 양성 핫스팟 모두 포함), FITC-dextran(FITC-dextran-only 및 Evans blue/FITC-dextran 이중 양성 핫스팟 모두 포함) 또는 두 염료(Evans blue/FITC-dextran 이중 양성 핫스팟만 포함)에 대해 양성인 핫스팟의 수를 나타냅니다. 3시간 시점의 'Pre' 프로토콜에서 수많은 FITC-덱스트란 전용 핫스팟이 관찰되었습니다. 'Post' 프로토콜에서 6시간 및 1일째에 Evans 블루 전용 및 FITC-덱스트란 전용 핫스팟이 모두 검출되었습니다. 그러나 'Post' 프로토콜에서 3일과 7일째에 핫스팟은 두 염료 모두에 대해 주로 양성이었습니다. 이러한 결과는 BBB 파괴가 3시간에 발생하고, 1일 후에 리모델링되었으며, BSW 노출 후 7일까지 지속되었음을 시사합니다(그림 4B). 중요한 것은 앞서 언급한 바와 같이 BBB 분해 정도가 7일 감소하는 경향이 있었다는 것입니다.
염료 유출 실험이 완료된 후, 슬라이스의 면역조직화학적 염색을 수행했습니다7. 면역조직화학 물질 이미지 스캔은 염료 유출의 이미지 스캔과 일관되게 비교되었으며, 형광 물질의 캐리오버 효과가 실질적으로 무시할 수 있는 수준임을 확인했습니다7. 그림 5에서 볼 수 있듯이, 반응성 성상세포의 클러스터는 BBB 파괴 부위와 밀접한 관련이 있었습니다. 추가 관찰에서는 활성화된 아메보이드 미세아교세포가 BSW 노출 3일 후 반응성 성상세포와 함께 존재한다는 사실이 밝혀졌습니다.

그림 1: 실험 설계. (A) 실험의 시간 경과. Evans 블루 용액은 BSW 노출 후('Post' 프로토콜) 또는 직전('Pre' 프로토콜)에 정맥 주사한 반면, FITC-dextran은 고정 전 2분 동안 경심 관류했습니다. (B) 각각 'Post' 및 'Pre' 프로토콜에서 혈관 내 Evans blue 및 FITC-dextran의 예상 농도. BSW, 폭발 유도 충격파; FITC의 플루오레세인 이소티오시아네이트. 이 그림은 Nishii et al.7에서 발췌한 것입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 뇌 절편의 형광 강도 비교. 뇌에서 가장 밝은 0.1%의 픽셀의 형광 강도를 12개 슬라이스 모두에 걸쳐 평가하고 '사후'(A)와 '사전'(B) 조건을 비교했습니다. 차이의 가변성과 중요성이 표시됩니다. XXX는 P < 0.001을 나타냅니다. xxxx는 p < 0.0001(F-test의 p 값)을 나타냅니다. *P < 0.05; p < 0.0001 (Dunnett의 다중 비교 사후 검정을 사용한 분산 분석). 이 그림은 Nishii et al.7에서 발췌한 것입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
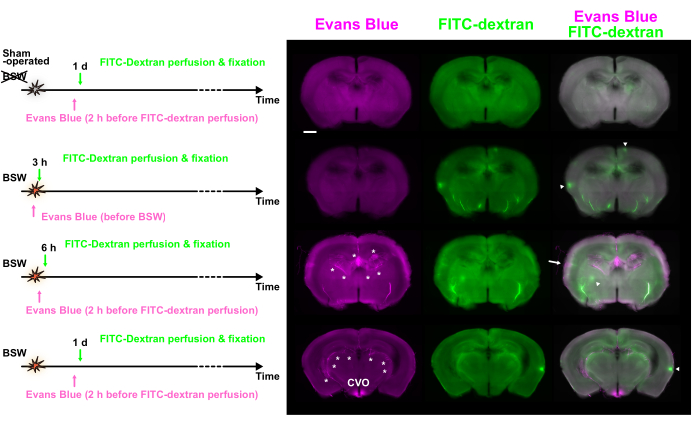
그림 3: Evans blue 및 FITC-dextran을 사용한 이중 라벨링을 사용하여 다양한 시점에서 관찰된 BBB 분석. Evans 파란색(자홍색), FITC-dextran(녹색) 및 병합된 이미지가 표시됩니다. 염료 주입 프로토콜은 왼쪽에 표시되어 있습니다. 일부 핫스팟은 Evans blue(화살표) 또는 FITC-dextran(화살촉)의 우세한 형광을 보였습니다. 별표는 맥락막신경총(choroid plexus) 및 관련 혈관을 나타냅니다. BBB, 혈액-뇌 장벽; FITC, 플루오레세인 이소티오시아네이트; CVO, 제3뇌실의 심실 주위 기관. 눈금 막대: 1mm. 이 그림은 Nishii et al.7에서 발췌한 것입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 형광 핫스팟의 정량화. (A) Evans blue(자홍색), FITC-dextran(녹색) 및 두 염료(회색)에 대해 양성인 핫스팟 수. 'Pre' 프로토콜에서 3시간에 얻은 이미지와 'Post' 프로토콜에서 6시간, 1일, 3일 및 7일에 얻은 이미지로부터 수집되었습니다. 3시간에서 1일까지는 형광 핫스팟의 상당 부분이 염료 간 불일치를 보인 반면, 3일에서 7일까지는 이러한 불일치가 거의 관찰되지 않았습니다. (B) BBB 고장의 시간 경과를 요약한 계획. 세로축은 BBB 파괴로 인한 염료 누출의 강도를 개념적으로 나타냅니다. 3 시간에서 1 일까지의 지그재그 패턴은이 기간 동안 염료 누출의 위치와 강도가 불안정하다는 것을 나타냅니다. FITC, 플루오레세인 이소티오시아네이트; BBB, 혈액-뇌 장벽; BSW, 폭발로 인한 충격파. 이 그림은 Nishii et al.7에서 발췌한 것입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
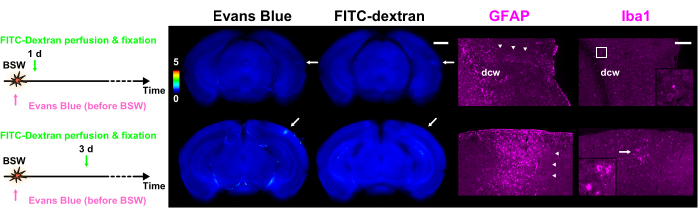
그림 5: GFAP와 Iba1이 각각 성상세포와 미세아교세포에 대한 마커로 발현. 그림의 각 열에는 GFAP 또는 Iba1 면역조직화학 이미지와 함께 Evans blue 또는 FITC-dextran을 사용한 염료 유출의 형광 이미지가 포함되어 있습니다. 색상 막대는 GRN 내의 형광 강도를 사용하여 Evans blue 및 FITC-dextran의 정규화된 형광 강도를 나타냅니다. 염료 주입 프로토콜은 왼쪽에 표시되어 있습니다. 'Pre' 프로토콜의 1일 슬라이스는 Evans blue와 FITC-dextran의 형광을 모두 보여주는 반면, 'Pre' 프로토콜의 3일 slice는 Evans blue(화살표)의 형광만 보여줍니다. 염료 유출 이미지에서 화살표로 표시된 영역은 면역조직화학 이미지와 일치합니다. 화살촉은 반응성 성상세포의 클러스터를 나타냅니다. 다클론 GFAP 항체는 백질 안팎뿐만 아니라 pia mater에 인접한 신경 조직에서도 성상세포를 표지했습니다. 결과적으로, dcw 내부 및 dcw에 가까운 성상세포가 이 그림에서 표지되어 있습니다. Iba1 열의 프레임 또는 화살표에 해당하는 확대된 이미지가 삽입에 표시됩니다. 스케일 바: 염료 유출 및 면역조직화학 이미지를 위한 각각 1mm 및 200μm. GFAP, 신경교섬유산성 단백질; Iba1, 이온화된 칼슘 결합 어댑터 분자 1; FITC, 플루오레세인 이소티오시아네이트; BSW, 폭발 유도 충격파; DCW, 깊은 대뇌 백질. 이 그림은 Nishii et al.7에서 발췌한 것입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
Evans blue와 FITC-dextran을 사용하는 새로운 이중 라벨링 기술을 사용하여 단일 뇌에서 BBB 파괴의 정확한 시공간 분포를 정확하게 시각화했습니다. 저강도 BSW 모델에서는 검사된 뇌에서 염료 유출의 범위, 위치 및 정도에서 눈에 띄는 변화가 관찰되었습니다(그림 2 및 그림 3). 염료 간 불일치는 BSW 노출 후 약 3시간 후에 BBB 분해가 시작되었으며, 1일차까지 상당한 리모델링이 발생하여 7일차까지 계속되는 것으로 나타났습니다(그림 4). 심한 경우, 활동성 미세아교세포(active microglia)가 BBB 분해 부위에 동원되었고, 반응성 성상세포(reactive astrocyte)의 클러스터가 이 부위에 밀접하게 연결되어 있었습니다(그림 5). 염료 유출 분석에 사용된 것과 동일한 슬라이스에 대해 면역조직화학을 수행함으로써 신경교세포 반응과 염료 유출 사이에 정확한 상관관계가 확립되었습니다. 자세한 데이터 및 분석은 Nishii et al.7을 참조하십시오.
FITC-dextran은 관류 고정 직전에 동일한 기간 동안 일정한 농도로 관류되었기 때문에 염료의 분포와 강도는 관류 고정 시점의 BBB 분해 정도를 정확하게 나타낼 수 있습니다. 그러나, 이전 보고서에서 FITC-dextran의 형광이 저강도 BSW 모델7에서 약한 경향이 있음이 입증되었습니다. Evans blue로 더 오래 라벨링하면 BBB 파괴에서 더 미묘한 변화를 감지할 수 있으므로 유리했습니다(그림 2). 그러나 라벨링 기간이 길기 때문에 Evans blue의 형광 이미지를 해석할 때 주의가 필요할 수 있습니다. Evans blue의 혈중 농도는 주사 직후 가장 높았으며 몇 시간에 걸쳐 점차 감소했습니다(그림 1)11. 라벨링의 강도는 BBB 분해의 심각성 및 지속 기간, Evans blue의 혈중 농도와 상관 관계가 있을 것으로 추측됩니다. 그러나 일단 수리하면 기하급수적으로 감소합니다. 이러한 모든 요인은 때때로, 그리고 실험마다 다릅니다. 따라서 염료 유출에 대한 단일 이미지에서 결론을 도출해서는 안 되며 항상 통계적 고려가 필요합니다.
실험의 목적에 따라 염료의 조합뿐만 아니라 분자량을 변경하는 것도 흥미로울 수 있습니다. 본 연구에서는 에반스 블루(Evans Blue)와 FITC-덱스트란(FITC-dextran)의 조합을 사용하였다. 혈청 알부민과 결합한 후 Evans blue는 69-kDa 추적자로 작용했으며, 이 연구에 사용된 40-kDa FITC-dextran은 Evans blue와 유사한 BBB 분해 정도를 보여주었습니다. BBB 파괴의 시공간 분포는 서로 다른 형광을 방출하는 염료의 조합을 사용하여 체계적으로 조사되었습니다7. 에반스 블루(Evans blue)와 플루오레세인나트륨(sodium fluorescein, 376 Da)의 조합을 활용한 이전 연구에서, 플루오레세인나트륨(sodium fluorescein)은 분자량이 작기 때문에 BSW 노출 후 더 넓은 범위의 BBB 분해를 표시할 수 있었다3. 다른 연구에서는 BBB 분해 정도를 비교하기 위해 Evans blue와 고분자량 FITC-dextran의 조합을 사용했습니다18,19. 이전의 모든 보고에서는 Evans blue와 FITC-dextran을 거의 동시에 투여했습니다. 여기에 제시된 프로토콜의 독특한 측면은 두 염료가 서로 다른 시점에 도입되어 BBB 분해의 시간적 진행을 조사할 수 있다는 것입니다.
Evans blue의 누적 특성은 다양한 BBB 고장 모델에서 유익할 수 있습니다. BBB 분해의 병력을 기록하기 때문에 질병의 발병과 진행에 대한 이해가 용이할 수 있습니다. 연구자는 염료의 긍정적 및 부정적 특성을 인식하고 이를 최대한 활용해야 한다9. 이 프로토콜은 다양한 BBB 고장 모델에 대한 광범위한 응용 프로그램을 가지고 있습니다.
공개
저자는 공개할 내용이 없습니다.
감사의 말
냉동 절제 기술에 대해 Mayumi Watanabe에게 감사드립니다. 이 연구는 일본 방위성의 Advanced Research on Military Medicine 보조금의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| 10% Formalin Neutral Buffer Solution | FUJIFILM Wako Chemicals | 062-01661 | |
| Anti GFAP, Rabbit | DAKO-Agilent | IR524 | |
| Anti Iba1, Rabbit | FUJIFILM Wako Chemicals | 019-19741 | |
| Chicken anti-Mouse IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 488 | Thermo Fisher Scientific | A-21200 | |
| Cryo Mount | Muto Pure Chemicals | 33351 | tissue freezing medium |
| Domitor | Orion Corporation | medetomidine | |
| Donkey anti-Rabbit IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 546 | Thermo Fisher Scientific | A10040 | |
| Evans Blue | Sigma-Aldrich | E2129 | |
| Falcon 24-well Polystyrene Clear Flat Bottom Not Treated Cell Culture Plate, with Lid, Individually Wrapped, Sterile, 50/Case | CORNING | 351147 | |
| Fluorescein isothiocyanate–dextran average mol wt 40,000 | Sigma-Aldrich | FD40S | FITC-dextran |
| Glass Base Dish 27mm (No.1 Glass) | AGC TECHNO GLASS | 3910-035 | 35 mm glass bottom dish |
| IX83 Inverted Microscope | OLYMPUS | ||
| MAS Hydrophilic Adhesion Microscope Slides | Matsunami Glass | MAS-04 | |
| Matsunami Cover Glass (No.1) 18 x 18mm | Matsunami Glass | C018181 | |
| Midazolam Injection 10mg [SANDOZ] | Sandoz | ||
| Paraformaldehyde EMPROVE ESSENTIAL DAC | Merck Millipore | 1.04005.1000 | |
| Peristaltic Pump | ATTO | SJ-1211 II-H | |
| RODENT BRAIN MATRIX Adult Mouse, 30 g, Coronal | ASI INSTRUMENTS | RBM-2000C | brain slicer |
| Vetorphale | Meiji Animal Health | VETLI5 | butorphanol |
참고문헌
- Sweeney, M. D., Zhao, Z., Montagne, A., Nelson, A. R., Zlokovic, B. V. Blood-brain barrier: From physiology to disease and back. Physiol Rev. 99 (1), 21-78 (2019).
- Kabu, S., et al. Blast-associated shock waves result in increased brain vascular leakage and elevated ros levels in a rat model of traumatic brain injury. PLoS One. 10 (5), e0127971(2015).
- Kuriakose, M., Rama Rao, K. V., Younger, D., Chandra, N. Temporal and spatial effects of blast overpressure on blood-brain barrier permeability in traumatic brain injury. Sci Rep. 8 (1), 8681(2018).
- Yeoh, S., Bell, E. D., Monson, K. L. Distribution of blood-brain barrier disruption in primary blast injury. Ann Biomed Eng. 41 (10), 2206-2214 (2013).
- Readnower, R. D., et al. Increase in blood-brain barrier permeability, oxidative stress, and activated microglia in a rat model of blast-induced traumatic brain injury. J Neurosci Res. 88 (16), 3530-3539 (2010).
- Shetty, A. K., Mishra, V., Kodali, M., Hattiangady, B. Blood-brain barrier dysfunction and delayed neurological deficits in mild traumatic brain injury induced by blast shock waves. Front Cell Neurosci. 8, 232(2014).
- Nishii, K., et al. Evans blue and fluorescein isothiocyanate-dextran double labeling reveals the precise sequence of vascular leakage and glial responses after exposure to mild-level blast-associated shock waves. J Neurotrauma. 40 (11-12), 1228-1242 (2023).
- Hoffmann, A., et al. High and low molecular weight fluorescein isothiocyanate (FITC)-dextrans to assess blood-brain barrier disruption: Technical considerations. Transl Stroke Res. 2 (1), 106-111 (2011).
- Saunders, N. R., Dziegielewska, K. M., Møllgård, K., Habgood, M. D. Markers for blood-brain barrier integrity: How appropriate is Evans blue in the twenty-first century and what are the alternatives. Front Neurosci. 9, 385(2015).
- Manaenko, A., Chen, H., Kammer, J., Zhang, J. H., Tang, J. Comparison Evans blue injection routes: Intravenous versus intraperitoneal, for measurement of blood-brain barrier in a mice hemorrhage model. J Neurosci Methods. 195 (2), 206-210 (2011).
- Yen, L. F., Wei, V. C., Kuo, E. Y., Lai, T. W. Distinct patterns of cerebral extravasation by Evans blue and sodium fluorescein in rats. PLoS One. 8 (7), e68595(2013).
- Kawai, S., Takagi, Y., Kaneko, S., Kurosawa, T. Effect of three types of mixed anesthetic agents alternate to ketamine in mice. Exp Anim. 60 (5), 481-487 (2011).
- Machholz, E., Mulder, G., Ruiz, C., Corning, B. F., Pritchett-Corning, K. R. Manual restraint and common compound administration routes in mice and rats. J Vis Exp. 67, e2771(2012).
- Satoh, Y., et al. Molecular hydrogen prevents social deficits and depression-like behaviors induced by low-intensity blast in mice. J Neuropathol Exp Neurol. 77 (9), 827-836 (2018).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. J Vis Exp. 65, e3564(2012).
- Selever, J., Kong, J. Q., Arenkiel, B. R. A rapid approach to high-resolution fluorescence imaging in semi-thick brain slices. J Vis Exp. 53, e2807(2011).
- Jiao, Y., et al. A simple and sensitive antigen retrieval method for free-floating and slide-mounted tissue sections. J Neurosci Methods. 93 (2), 149-162 (1999).
- Nagaraja, T. N., Keenan, K. A., Fenstermacher, J. D., Knight, R. A. Acute leakage patterns of fluorescent plasma flow markers after transient focal cerebral ischemia suggest large openings in blood-brain barrier. Microcirculation. 15 (1), 1-14 (2010).
- Xu, Y., et al. Quantifying blood-brain-barrier leakage using a combination of Evans blue and high molecular weight fitc-dextran. J Neurosci Methods. 325, 108349(2019).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유