Method Article
Sıçanlardan Türetilen Decellularized Spleen Matrix'in İmalatı
Bu Makalede
Özet
Hücrelerden arındırılmış dalak matrisi (DSM), karaciğer doku mühendisliği alanında umut verici uygulamalara sahiptir. Bu protokol, sıçan dalaklarının hasat edilmesini, perfüzyon yoluyla hücrelerden arındırılmasını ve özelliklerini doğrulamak için elde edilen DSM'nin değerlendirilmesini içeren sıçan DSM'si hazırlama prosedürünü ana hatlarıyla belirtir.
Özet
Karaciğer nakli, son dönem karaciğer hastalığının birincil tedavisidir. Bununla birlikte, donör organların azlığı ve yetersiz kalitesi, alternatif tedavilerin geliştirilmesini zorunlu kılmaktadır. Deselüler karaciğer matriksi (DLM) kullanan biyoyapay karaciğerler (BAL'lar) umut verici çözümler olarak ortaya çıkmıştır. Bununla birlikte, uygun DLM'leri tedarik etmek zor olmaya devam etmektedir. Hücreden arındırılmış dalak matrisinin (DSM) kullanımı, BAL'lar için bir temel olarak araştırılmıştır ve hazır bir alternatif sunar. Bu çalışmada, sıçan dalakları, donma-çözülme döngüleri ve hücre giderme reaktifleri ile perfüzyonun bir kombinasyonu kullanılarak hasat edildi ve hücrelerden arındırıldı. Protokol, DSM içindeki hücre dışı matrisin (ECM) mikro yapılarını ve bileşenlerini korudu. Tam hücre çözme işlemi yaklaşık 11 saat sürdü ve bu da DSM içinde sağlam bir ECM ile sonuçlandı. Histolojik analiz, ECM'nin yapısını ve bileşimini korurken hücresel bileşenlerin çıkarıldığını doğruladı. Sunulan protokol, karaciğer dokusu mühendisliği ve hücre tedavisinde potansiyel uygulamalar sunan DSM elde etmek için kapsamlı bir yöntem sağlar. Bu bulgular son dönem karaciğer hastalığının tedavisi için alternatif yaklaşımların geliştirilmesine katkıda bulunmaktadır.
Giriş
Karaciğer nakli, son dönem karaciğer hastalığı için tek kesin tedavi olmaya devam etmektedir 1,2,3. Bununla birlikte, donör organların kritik kıtlığı ve azalan kalitesi, alternatif tedavilere olan ihtiyacı artırmıştır4. Rejeneratif tıp alanında, hücreden arındırılmış karaciğer matrisi (DLM) kullanan biyoyapay karaciğerler (BAL'ler) umut verici çözümler olarak ortaya çıkmıştır 5,6,7. DLM, karmaşık mikrovasküler ağı ve ECM'nin bileşenleri de dahil olmak üzere orijinal karaciğer yapısını koruyarak, karaciğer hastalıklarını potansiyel olarak hafifletebilecek nakledilebilir BAL'lar oluşturmak için bir iskele sunar.
Verilen söze rağmen, bu teknolojinin benimsenmesi, özellikle uygun DLM'lerin tedarik edilmesinde zorluklarla karşı karşıyadır. İnsan kaynaklı DLM'ler yetersizdir, hayvan kaynaklı DLM'ler ise hastalık bulaşma ve bağışıklık reddi riskleri taşır. Yenilikçi bir yaklaşımla, araştırmamız BALs 8,9,10,11 için bir temel olarak hücreden arındırılmış bir dalak matrisinin (DSM) kullanımını araştırdı. Dalaklar, portal hipertansiyon, travmatik rüptür, idiyopatik trombositopenik purpura ve kardiyak ölüm sonrası bağış gibi çeşitli tıbbi durumlarda daha kolay bulunur. Bu nedenle dalaklar, araştırma amaçlı karaciğerlerden daha yaygın olarak bulunur. Splenektomi geçiren hastalar ciddi durumlardan muzdarip değildir, bu da dalağın dağıtılabilirliğini daha da doğrular. Dalağın mikro çevresi, özellikle hücre dışı matriks ve sinüzoidler, karaciğerinkine benzer. Bu, dalağı hepatosit nakli araştırmalarında hücre yapışması ve çoğalması için uygun bir organ haline getirir. Bu bulgulara dayanarak, önceki araştırmalarımız DSM'lerin DLM'lerle karşılaştırılabilir mikro yapıları ve bileşenleri paylaştığını ve albümin ve üre üretimi dahil olmak üzere hepatositlerin hayatta kalmasını ve işlevini destekleyebileceğini göstermiştir. Ayrıca, DSM'lerin kemik iliği mezenkimal kök hücrelerinin hepatik farklılaşmasını arttırdığı, bunun da gelişmiş ve tutarlı işlevsellik sağladığı gösterilmiştir.
Heparin ile tedavi edilen DSM'leri kullanarak, etkili kısa süreli antikoagülasyon ve kısmi karaciğer fonksiyon kompanzasyonu gösterebilen fonksiyonel BAL'lar tasarladık11. Sonuç olarak, bu üç boyutlu DSM, karaciğer dokusu mühendisliği ve hücre tedavisinin ilerlemesi için önemli bir umut vaat ediyor. Bu çalışmada, ECM'nin mikro yapılarını ve bileşenlerini koruyan sıçan dalaklarının toplanması ve DSM'nin hazırlanmasının ayrıntılı yöntemlerini sunuyoruz.
Protokol
Bu çalışma, Xi'an Jiaotong Üniversitesi Hayvan Deneyleri Etiği Komitesi tarafından onaylanmıştır ve Laboratuvar Hayvanlarının Bakımı ve Kullanımı yönergelerine uygun olarak yürütülmüştür.
1. Dalak toplama
- 250-280 g ağırlığındaki erkek Sprague Dawley sıçanlarını kullanın. Fareleri kontrollü sıcaklık ve neme sahip odalarda barındırın ve ameliyattan önce oruç tutmak dışında onlara yiyecek ve su ad libitum sağlayın.
- Ameliyattan 1 saat önce deri altına buprenorfin (0.05 mL / kg) analjezik olarak enjekte edin. İzofluran inhalasyonu ile sıçanı uyuşturun. Bir pleksiglas kutuda indüksiyon anestezisi için 1.5 L / dak% 5 izofluran akış hızı kullanın ve anesteziyi bir maske aracılığıyla 0.6-0.8 L / dak% 2 izofluran akış hızı ile koruyun. Ayak parmaklarını sıkıştırarak anestezi derinliğini onaylayın.
- Tüm karın bölgesindeki cildi tıraş etmek için elektrikli tıraş makinesi kullanın. Fareyi ameliyat masasında sırtüstü pozisyonda sabitleyin. Sistemik antikoagülasyon elde etmek için penil dorsal ven yoluyla 2 mL heparinize salin (1.000 U heparin) enjekte edin. Tıraşlı cildi bir povidon-iyot solüsyonu ile dezenfekte edin ve steril bir örtü bezi ile örtün.
- Karında cerrahi makas kullanarak haç şeklinde bir kesi yapın, hemostatik forseps ile gererek karın boşluğunu ortaya çıkarın ve karaciğeri diyaframa doğru çevirin. Gastrointestinal sistemi karnın sağ tarafına dışlayın ve nemli gazlı bezle örtün.
- Dalak hilusunu ortaya çıkarmak için splenogastrik ligamenti dikkatlice ayırın ve kesin.
NOT: Yaklaşık 3,0 cm x 0,6 cm x 0,6 cm boyutlarında, kırmızımsı uzun bir yapı olarak görünen dalak, sol karın bölgesinde tanımlanabilir. - Ortak hepatik arteri, gastroduodenal arteri ve splenik arteri splenik hilum boyunca diseksiyon yaparak kademeli olarak ayırın ve ortaya çıkarın. Gastroduodenal arteri ve ortak hepatik arteri bağlayın ve kesin, aynı zamanda çevredeki dokuyu aşamalı olarak ayırın.
- Abdominal aortu ortaya çıkarmak için dalağı sağ tarafa doğru çevirin. Nazikçe künt diseksiyon yapın ve pamuklu çubuklar kullanarak abdominal aort ve çölyak gövdesini açığa çıkarın. Çölyak gövdesinin dallarının üstüne ve altına yaklaşık 3 cm uzunluğunda 3-0 ipek sütür yerleştirin ve çölyak gövdesinin dalına yaklaşık 10 cm uzunluğunda 6-0 ipek sütür yerleştirin.
- Çölyak gövdesinin dallarının altında ve üstünde abdominal aortu ligatür. Arteriyel dalda küçük bir kesi yapın. 6-0 ipek sütürü nazikçe kaldırın, çölyak gövdesi boyunca splenik artere 24 G'lik bir venöz kateter yerleştirin ve bağlayın ve sabitleyin.
- 4 mL / dak hızında bir şırınga pompası kullanarak, 50 mL'lik bir hacimde heparinize normal salin (25 U / mL) infüze edin. Aynı zamanda, infüze edilen sıvının dalaktan dışarı akmasına izin vermek için portal veni bir çıkış kanalı olarak kesin. Hayvan kan kaybı ile ötenazi yapılır.
- Dalağın çevresindeki dokuyu dikkatlice inceleyin, pankreasa zarar vermekten kaçının ve ana aksesuar damarları koruyun.
- Dalak çevresinde herhangi bir sızıntı olup olmadığını kontrol edin, ardından dalağı ve pankreası çıkarın ve normal tuzlu suyla durulayın.
NOT: Sıçanların dalağı ve pankreası, pankreasın splenik arterin etrafına sarılmasıyla yakından bağlantılıdır. Dalak ayrı ayrı çıkarılırsa, çok sayıda küçük kan damarını bağlamak zor olabilir. Bu işlemde dalak pankreas ile birlikte çıkarılır. Decellularizasyondan sonra, dalak ve pankreas şeffaf hale gelir ve mikro damar sistemi görünür hale gelir, bu da dalağın sağlam kan damarları ile korunmasını kolaylaştırır. - Dalağı normal tuzlu su ile doldurulmuş 50 mL'lik bir santrifüj tüpüne aktarın ve -80 ° C'lik bir dondurucuda saklayın.
NOT: Dalak arterine yerleştirilen dalak ve venöz kateter, perfüzyon deneyleri sırasında uygun bağlantı için birlikte dondurularak saklanacaktır.
2. Dalak hücre deselizasyonu
- Dalak hücrelerini parçalamak için steril bir kapta donma-çözülme döngüsünü 3 kez tekrarlayın.
NOT: Donma-çözülme döngüsü, iskele hücreden arındırma için kullanılan fiziksel bir yöntemdir. Dalak dokusu dondurulması için gece boyunca -80 °C'lik bir dondurucuya yerleştirilir, daha sonra düşük sıcaklıktaki ortamdan çıkarılır ve çözülmesi için oda sıcaklığında veya 37 °C su banyosuna yerleştirilir. Bu dondurma ve çözme işlemi 3-6 kez tekrarlanır, bu da hücre zarlarını bozar ve hücre lizizine yol açar. - Bir peristaltik pompa, 2 L'lik bir rezervuar, iç çapı 2.4 mm olan bir silikon tüp ve bir baloncuk tutucudan oluşan temiz bir tezgah içinde bir perfüzyon sistemi kurun (Şekil 1).
- Perfüzyon sistemini deiyonize su (ddH2O) ile doldurun ve 10 dakika boyunca çalışır durumda tutun.
- Hasat edilen dalağı dikkatlice ddH2O dolu kaba aktarın.
- Silikon tüpü splenik artere yerleştirilen venöz katetere bağlayın.
- 30 dakika boyunca 2 mL / dk oranında ddH2O ile perfüzyona başlayın.
- 30 dakika boyunca 4 mL / dk oranında ddH2O ile perfüzyona devam edin.
- 4 saat boyunca% 0.1 (a / h) SDS çözeltisi ile perfüz.
- 2 saat boyunca% 1 (h / h) Triton X-100 çözeltisi ile perfuse.
- DSM'yi yıkamak için 4 saat boyunca 4 mL / dak hızında PBS ile perfüz.
NOT: Tüm sıvıların tek yönlü perfüzyonu için peristaltik pompanın kullanılması. - Perfüzyon tamamlandıktan sonra, pankreas ve dalak arasındaki vasküler dalları bağlayın ve kesin ve ardından pankreası çıkarın. DSM'yi, gelecekteki deneyler için kullanıma hazır olana kadar -20 °C'de% 10 penisilin-streptomisin içeren PBS'ye batırılmış temiz ve sızdırmaz 50 mL'lik bir santrifüj tüpünde saklayın.
Sonuçlar
Bu protokol, sıçan dalağının hücreden arındırılması için tekrarlanan donma-çözülme döngüleri ve hücre giderme reaktifleri ile perfüzyonun bir kombinasyonunu kullandı. Dalağın tamamen hücreden arındırılması yaklaşık 11 saat içinde sağlandı (Şekil 2A). Hücreden arındırma işlemi boyunca, dalağın rengi yavaş yavaş koyu kırmızıdan benekli, açık kırmızıya ve nihayetinde beyaz yarı saydam bir görünüme geçiş yaptı (Şekil 2B). Genel morfoloji, görünür vasküler yapılarla nispeten sağlam kalmıştır (Şekil 2B).
Hematoksilen-eozin boyama, hücresel bileşenlerin çıkarılmasını doğruladı ve DSM içinde sağlam bir ECM'yi ortaya çıkardı. Bu, hücresel çekirdeklerin ve sitoplazmik elementlerin görülebildiği Şekil 3A'da gösterildiği gibi, doğal dalağın tam tersidir. Hücrelerin yokluğu, 4', 6-diamidino-2-fenilindol (DAPI) boyama ve kalıntı DNA ölçümü ile daha da doğrulandı (DSM: 10.1 ± 4 ng / mg kuru ağırlık, doğal dalak: 6.200 ± 300 ng / mg kuru ağırlık). Taramalı elektron mikroskobik görüntüler, lenfositlerin dalaktan tamamen çıkarılmasından sonra bir bal peteği yapısı gösteren DSM'nin ultrastrüktürel karakterizasyonunu ortaya çıkardı (Şekil 3C). Bu, dalağın hücre dışı hale getirilmesinin normal dalağın üst yapısını ve mimarisini koruduğunu gösterdi. DSM içinde bulunan önemli ECM proteinlerinin daha kapsamlı bir değerlendirmesi için Masson trikrom (Şekil 3B) ve immünofloresan boyama kullanıldı. Spesifik olarak, kollajen I (Şekil 3D) ve fibronektin (Şekil 3E) analiz için hedeflendi. Sonuçlar, ECM'nin hem yapısal hem de bazal membran bileşenlerinin doğal dalağa benzer şekilde korunduğunu gösterdi.

Şekil 1: Deney düzeneği. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
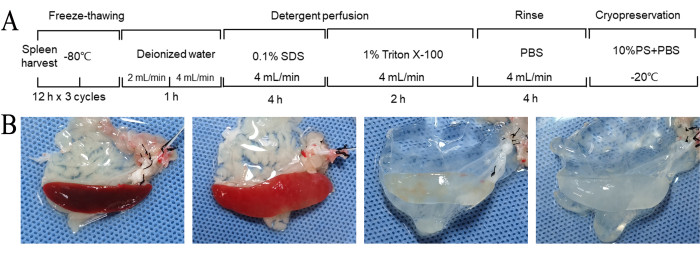
Şekil 2: Hücreden arındırma ve brüt morfolojik değişikliklerin iş akışı. (A) Hücreden arındırılmış dalak matrisi hazırlama iş akışı. Dalağın tamamen hücreden arındırılması yaklaşık 11 saat içinde sağlandı. (B) DSM'nin hazırlanması sırasında dalağın brüt morfolojik değişiklikleri. Bu işlem sırasında, dalağın rengi yavaş yavaş koyu kırmızıdan benekli, açık kırmızıya ve sonunda beyaz yarı saydam bir görünüme geçiş yaptı. (B) 1. Tekrarlanan donma-çözülme döngülerinden sonra ve hücresellikten arındırmadan önce. 2. Deiyonize su ile 1 saat duruladıktan sonra, 3. SDS ile perfüzyondan sonra 4 saat. Triton ile 2 saat perfüzyondan sonra. Kısaltmalar: DSM = hücreden arındırılmış dalak matrisi; SDS = sodyum dodesil sülfat; PBS = fosfat tamponlu salin; PS = penisilin-streptomisin. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Hücreden arındırılmış dalak matrisinin morfolojik gözlemleri. (A) H & E boyama; (B) Masson trikrom boyama; (C) SEM; (D,E) Kollajen I ve fibronektinin immünofloresan boyanması; (F) DAPI boyama. Ölçek çubukları = 50 μm (A, B, D-F), 5 μm (C). Kısaltmalar: DSM = hücreden arındırılmış dalak matrisi; H&E = hematoksilen-eozin; SEM = taramalı elektron mikroskobu; DAPI = 4',6-diamidino-2-fenilindol. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
BAL'lar, özellikle karaciğer naklinin mevcut donör organ eksikliği nedeniyle engellendiği durumlarda, son dönem karaciğer hastalığının tedavisi için etkili bir yaklaşımı temsil etmektedir6. BAL'lar oluşturmak için umut verici bir seçenek, doğal karaciğerin doğal ECM'sini ve vasküler yapısını koruyan DLM'nin kullanılmasıdır. Bununla birlikte, insan DLM'sinin kıtlığı ve hayvan DLM'si ile ilişkili potansiyel enfeksiyon ve immünojenisite riskleri önemli sınırlamalar oluşturmaktadır. Bu zorluğun üstesinden gelmek için, BAL 8,9,10,11 için alternatif bir iskele olarak hücreden arındırılmış bir dalak matrisi (DSM) kullanmayı içeren yeni bir strateji öneriyoruz. Dalaklar çeşitli klinik senaryolarda daha kolay erişilebilir durumdadır ve karaciğerlere benzer özellikler gösterir. Bu çalışmada, ECM'nin mikro yapılarını ve bileşenlerini koruyan sıçan dalaklarının toplanması ve DSM'nin hazırlanması için ayrıntılı yöntemler sunuyoruz.
İdeal bir hücre giderme yöntemi, ECM12,13,14'ün orijinal yapısını, bileşimini ve mekanik özelliklerini korurken hücresel bileşenleri ortadan kaldıracaktır. Hücreden arındırma yöntemleri, her biri kendine özgü avantajları ve dezavantajları olan fiziksel, kimyasal ve enzimatik tedavileri kapsar15. Bu yöntemler hücresel bileşenleri kısmen çıkarabilirken, kalan ECM'nin bileşimini, yapısını ve işlevselliğini de tehlikeye atabilir. Hücreden arındırma kalitesi, farklı doku kaynakları arasında hücre yoğunluğu, matris kalınlığı ve doku morfolojisindeki değişikliklerden etkilenebilir.
Bugüne kadar, hücreden arındırma süreci için altın bir standart yoktur. Tipik olarak, bu yöntemlerden herhangi birini basitçe kullanmak, ECM üzerindeki olumsuz etkileri en aza indirmek ve hücresel içeriğin uzaklaştırılmasını en üst düzeye çıkarmak için yetersizdir. Sonuç olarak, en etkili yaklaşım doku özelliklerine dayanır ve bu yöntemlerin bir kombinasyonunu gerektirir. Bu çalışmada, sıçan dalaklarını hücreden arındırmak için fiziksel yöntemleri (donma-çözülme döngüleri ve perfüzyon) kimyasal yöntemlerle (SDS ve TritonX-100) birleştiren bir protokol kullandık.
Donma-çözülme döngüleri, hücre parçalanmasını ve hücrelerin ECM16'dan hızlı bir şekilde ayrılmasını teşvik eder. Eşzamanlı olarak, doğal vaskülatür yoluyla perfüzyon, hücre deselülozizasyon verimliliğini önemli ölçüde artırır ve orijinal vasküler ağıkorur 17. İyonik bir deterjan olarak işlev gören sodyum dodesil sülfat (SDS), hem hücre hem de nükleer zarları ustaca çözerek sitoplazmik ve nükleer bileşenlerin daha kapsamlı bir şekilde uzaklaştırılmasına yol açar. Bununla birlikte, bu işlem aynı zamanda glikozaminoglikanların (GAG'ler) ve kollajenin tükenmesi nedeniyle ECM üst yapısına da zarar verir.
Yüksek SDS konsantrasyonları, azalan kalıntı DNA içeriği ve ECM iskelesi içindeki azalmış mekanik mukavemet ile ilişkilidir. Tersine, daha düşük SDS konsantrasyonları daha fazla miktarda kollajeni korudu ve ECM proteinlerinin daha az denatürasyonuna neden oldu. Buna karşılık, iyonik olmayan bir deterjan görevi gören Triton X-100, lipid-lipid, lipid-protein ve DNA-protein etkileşimlerini etkili bir şekilde bozarak hücre zarı çözünmesine daha hafif bir yaklaşım sunar. Bununla birlikte, hücre çekirdeğinin ve DNA'nın tamamen çıkarılması için yetersiz kalmaktadır. Bu nedenle, ECM'nin orijinal yapısını, bileşimini ve performansını korurken hücresel bileşenlerin tamamen uzaklaştırılmasını sağlamak için düşük konsantrasyonlarda SDS ve fiziksel işlemlerle birleştirilmesi gerekir. Artık deterjanların belirli bir sitotoksisiteye sahip olabileceğine dikkat etmek önemlidir, bu nedenle depolamadan önce steril PBS veya damıtılmış su ile işlem sonrası durulama gereklidir.
Bu protokolün bir sınırlaması, artık SDS ve Triton X-100 için miktar tayininin olmamasıdır. Bu karar, hem ekibimizin deneyimi hem de bu maddeleri etkili bir şekilde uzaklaştırmak için 4 saatlik bir PBS yıkamanın yeterli olduğunu gösteren destekleyici raporlarla bilgilendirilmiştir. Ayrıca, bu protokolü kullanan önceki hücre kültürü deneylerimiz herhangi bir sitotoksisite belirtisi göstermemiştir. Protokolün masraflarını en aza indirmek için, artık deterjanların miktarının belirlenmesinden vazgeçmek için kasıtlı bir seçim yapıldı.
Sonuç olarak, bu protokol DSM'lerin hazırlanması için verimlilik, stabilite ve minimum invazivlik gösteren uygun bir yöntem sunar. Bu protokol kullanılarak hazırlanan DSM'ler, dalağın doğal mimarisini, bileşimini ve doğal vasküler ağını korur. Ayrıca, hücre implantasyonu ve üç boyutlu dinamik kültür için bir iskele sunar, böylece doku mühendisliği yapılmış karaciğerde araştırmaları ilerletmek için bir temel oluşturur.
Açıklamalar
Yazarlar herhangi bir çıkar çatışması beyan etmemişlerdir.
Teşekkürler
Bu çalışma, Çin Ulusal Doğa Bilimleri Vakfı (82000624), Shaanxi Doğa Bilimleri Temel Araştırma Programı (2022JQ-899 ve 2021JM-268), Shaanxi Eyaleti İnovasyon Yeteneği Destek Programı (2023KJXX-030), Shaanxi Eyaleti Anahtar Ar-Ge Planı Üniversitesi Ortak Proje-Anahtar Projesi (2021GXLH-Z-047), Xi'an Jiaotong Üniversitesi İlk Bağlı Hastanesinin Kurumsal Vakfı (2021HL-42 ve 2021HL-21) tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Anesthesia Machine | Harvard Apparatus | tabletop | animal anesthesia |
| bubble trap | Shandong Weigao Group Medical Polymer Co., Ltd. | pore diameter: 5 μm | prevent air bubbles |
| Buprenorphine | TIPR Pharmaceutical Responsible Co.,Ltd | an analgesic | |
| Hemostatic Forceps | Shanghai Medical Instruments Co., Ltd | J31020 | surgical tool |
| Heparinized Saline | SPH No.1 Biochemical & Pharmaceutical Co., LTD | prevent the formation of thrombosis | |
| Isoflurane | RWD life Science Co. | anesthetic:for the induction and maintenanceof anesthesia | |
| Penicillin-Streptomycin | Beyotime Biotechnology Co., Ltd. | C0222 | antibiotics in vitro to prevent microbial contamination |
| Peristaltic Pump | Baoding Longer Precision Pump Co., Ltd. | BT100-1L | |
| Phosphate-Buffered Saline | Shanghai Titan Scientific Co., Ltd. | 4481228 | phosphoric acid buffer salt solution |
| Silicone Tube | Baoding Longer Precision Pump Co., Ltd. | 2.4×0.8mm | |
| Silk Suture | Yangzhou Jinhuan Medical Instrument Factory | 6-0 and 3-0 | ligate blood vessels |
| Sodium Dodecyl Sulfate | Shanghai Titan Scientific Co., Ltd. | 151-21-3 | ionic detergent, dissolves both cell and nuclear membranes |
| Syringe Pump | Shenzhen Mindray Bio-Medical Electronics Co., Ltd | BeneFusion SP5 | intravenous infusion |
| Triton X-100 | Shanghai Titan Scientific Co., Ltd. | 9002-93-1 | non-ionic detergent, disrupts lipid-lipid, lipid-protein, and DNA-protein interactions |
| Venous Catheter | B. Braun Company | 24G | inserting the spleen artery |
Referanslar
- Xu, X. State of the art and perspectives in liver transplantation. Hepatobiliary Pancreat Dis Int. 22 (1), 1-3 (2023).
- Hautz, T., et al. Immune cell dynamics deconvoluted by single-cell RNA sequencing in normothermic machine perfusion of the liver. Nat Commun. 14 (1), 2285(2023).
- Cardini, B., et al. Live confocal imaging as a novel tool to assess liver quality: insights from a murine model. Transplantation. 104 (12), 2528-2537 (2020).
- Ding, Y., et al. Mesenchymal stem cell-derived exosomes: a promising therapeutic agent for the treatment of liver diseases. Int J Mol Sci. 23 (18), 10972(2022).
- Yaghoubi, A., et al. Prednisolone and mesenchymal stem cell preloading protect liver cell migration and mitigate extracellular matrix modification in transplanted decellularized rat liver. Stem Cell Res Ther. 13 (1), 36(2022).
- Uygun, B. E., et al. Organ reengineering through development of a transplantable recellularized liver graft using decellularized liver matrix. Nat Med. 16 (7), 814-820 (2010).
- Xiang, J., et al. The effect of riboflavin/UVA cross-linking on anti-degeneration and promoting angiogenic capability of decellularized liver matrix. J Biomed Mater Res A. 105 (10), 2662-2669 (2017).
- Liu, P., et al. Implantation strategy of tissue-engineered liver based on decellularized spleen matrix in rats. J South Med Univ. 38 (6), 698-703 (2018).
- Xiang, J., et al. Decellularized spleen matrix for reengineering functional hepatic-like tissue based on bone marrow mesenchymal stem cells. Organogenesis. 12 (3), 128-142 (2016).
- Gao, R., et al. Hepatocyte culture in autologous decellularized spleen matrix. Organogenesis. 11 (1), 16-29 (2015).
- Liu, P., et al. Hemocompatibility improvement of decellularized spleen matrix for constructing transplantable bioartificial liver. Biomed Mater. 14 (2), 25003(2019).
- Somuncu, Ö Decellularization concept in regenerative medicine. Adv Exp Med Biol. 1212, 71-85 (2020).
- Neishabouri, A., Soltani, K. A., Daghigh, F., Kajbafzadeh, A. M., Majidi, Z. M. Decellularization in tissue engineering and regenerative medicine: evaluation, modification, and application methods. Front Bioeng Biotech. 10, 805299(2022).
- Brown, M., Li, J., Moraes, C., Tabrizian, M., Li-Jessen, N. Decellularized extracellular matrix: New promising and challenging biomaterials for regenerative medicine. Biomaterials. 289, 121786(2022).
- Gui, L., Muto, A., Chan, S. A., Breuer, C. K., Niklason, L. E. Development of decellularized human umbilical arteries as small-diameter vascular grafts. Tissue Eng Pt A. 15 (9), 2665-2676 (2009).
- Li, T., Javed, R., Ao, Q. Xenogeneic decellularized extracellular matrix-based biomaterials For peripheral nerve repair and regeneration. Curr Neuropharmacol. 19 (12), 2152-2163 (2021).
- Crapo, P. M., Gilbert, T. W., Badylak, S. F. An overview of tissue and whole organ decellularization processes. Biomaterials. 32 (12), 3233-3243 (2011).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır