Method Article
Fabricação de matriz de baço descelularizada derivada de ratos
Neste Artigo
Resumo
A matriz descelularizada do baço (DSM) tem aplicações promissoras no campo da engenharia de tecidos hepáticos. Este protocolo descreve o procedimento para preparar o DSM de ratos, que inclui a coleta de baços de ratos, descelularizando-os por meio de perfusão e avaliando o DSM resultante para confirmar suas características.
Resumo
O transplante de fígado é o tratamento primário para a doença hepática em estágio terminal. No entanto, a escassez e a qualidade inadequada dos órgãos dos dadores exigem o desenvolvimento de terapias alternativas. Fígados bioartificiais (BALs) utilizando matriz hepática descelularizada (DLM) surgiram como soluções promissoras. No entanto, o fornecimento de DLMs adequados continua sendo um desafio. O uso de uma matriz esplênica descelularizada (DSM) tem sido explorado como base para LBAs, oferecendo uma alternativa prontamente disponível. Neste estudo, os baços de ratos foram colhidos e descelularizados usando uma combinação de ciclos de congelamento e descongelamento e perfusão com reagentes de descelularização. O protocolo preservou as microestruturas e componentes da matriz extracelular (MEC) dentro do DSM. O processo completo de descelularização levou aproximadamente 11 h, resultando em uma ECM intacta dentro do DSM. A análise histológica confirmou a remoção de componentes celulares, mantendo a estrutura e composição da MEC. O protocolo apresentado fornece um método abrangente para a obtenção do DSM, oferecendo aplicações potenciais em engenharia de tecidos hepáticos e terapia celular. Esses achados contribuem para o desenvolvimento de abordagens alternativas para o tratamento da doença hepática terminal.
Introdução
O transplante de fígado continua sendo o único tratamento definitivo para a doença hepática terminal 1,2,3. No entanto, a escassez crítica e o declínio da qualidade dos órgãos dos doadores aumentaram a necessidade de tratamentos alternativos4. No campo da medicina regenerativa, fígados bioartificiais (BALs) utilizando matriz hepática descelularizada (DLM) surgiram como soluções promissoras 5,6,7. O DLM preserva a estrutura original do fígado, incluindo sua intrincada rede microvascular e componentes da MEC, oferecendo um andaime para a criação de BALs transplantáveis que poderiam potencialmente aliviar doenças hepáticas.
Apesar da promessa, a adoção dessa tecnologia enfrenta desafios, principalmente no fornecimento de DLMs adequados. Os DLMs derivados de humanos são escassos, enquanto os de origem animal apresentam riscos de transmissão de doenças e rejeição imunológica. Em uma abordagem inovadora, nossa pesquisa explorou o uso de uma matriz de baço descelularizada (DSM) como base para LBAs 8,9,10,11. Os baços estão mais prontamente disponíveis em várias situações médicas, como hipertensão portal, ruptura traumática, púrpura trombocitopênica idiopática e doação após morte cardíaca. Portanto, os baços estão mais amplamente disponíveis do que os fígados para fins de pesquisa. Os pacientes submetidos a esplenectomias não sofrem de condições graves, confirmando ainda mais a dispensabilidade do baço. O microambiente do baço, particularmente a matriz extracelular e os sinusóides, é semelhante ao do fígado. Isso torna o baço um órgão adequado para adesão e proliferação celular na pesquisa de transplante de hepatócitos. Com base nessas descobertas, nossas investigações anteriores demonstraram que os DSMs compartilham microestruturas e componentes comparáveis com os DLMs e podem apoiar a sobrevivência e a função dos hepatócitos, incluindo a produção de albumina e ureia. Além disso, os DSMs demonstraram aumentar a diferenciação hepática das células-tronco mesenquimais da medula óssea, levando a uma funcionalidade aprimorada e consistente.
Ao empregar DSMs tratados com heparina, projetamos LBAs funcionais capazes de demonstrar anticoagulação eficaz em curto prazo e compensação parcial da função hepática11. Consequentemente, este DSM tridimensional é uma promessa significativa para o avanço da engenharia de tecidos hepáticos e terapia celular. Neste trabalho, apresentamos os métodos detalhados de coleta de baços de ratos e preparação de DSM que preservam as microestruturas e componentes da MEC.
Protocolo
Este estudo foi aprovado pelo Comitê de Ética em Experimentos com Animais da Universidade Xi'an Jiaotong e realizado de acordo com as diretrizes para o Cuidado e Uso de Animais de Laboratório.
1. Colheita do baço
- Use ratos Sprague Dawley machos pesando 250-280 g. Aloje os ratos em salas com temperatura e umidade controladas e forneça-lhes comida e água ad libitum, exceto em jejum antes da cirurgia.
- Injete buprenorfina (0,05 mL/kg) por via subcutânea como analgésico 1 h antes da operação. Anestesiar o rato por inalação de isoflurano. Use uma taxa de fluxo de 1,5 L/min de isoflurano a 5% para anestesia de indução em uma caixa de plexiglass e mantenha a anestesia com uma taxa de fluxo de 0,6-0,8 L/min de isoflurano a 2% através de uma máscara. Confirme a profundidade da anestesia beliscando os dedos dos pés.
- Use um barbeador elétrico para raspar a pele em todo o abdômen. Prenda o rato em decúbito dorsal na mesa cirúrgica. Injete 2 mL de solução salina heparinizada (1.000 U de heparina) através da veia dorsal peniana para obter anticoagulação sistêmica. Desinfete a pele raspada com uma solução de iodopovidona e cubra com um pano esterilizado.
- Faça uma incisão cruciforme usando uma tesoura cirúrgica no abdômen, exponha a cavidade abdominal alongando com a pinça hemostática e vire o fígado em direção ao diafragma. Exteriorize o trato gastrointestinal para o lado direito do abdômen e cubra-o com gaze úmida.
- Separe e corte cuidadosamente o ligamento esplenogástrico para expor o hilo esplênico.
NOTA: O baço, que aparece como uma estrutura alongada avermelhada, com aproximadamente 3,0 cm x 0,6 cm x 0,6 cm de tamanho, pode ser identificado no abdome esquerdo. - Separe e exponha gradualmente a artéria hepática comum, a artéria gastroduodenal e a artéria esplênica dissecando ao longo do hilo esplênico. Ligue e corte a artéria gastroduodenal e a artéria hepática comum enquanto dissocia progressivamente o tecido circundante.
- Vire o baço para o lado direito para expor a aorta abdominal. Realize suavemente a dissecção romba e exponha a aorta abdominal e o tronco celíaco usando cotonetes. Coloque uma sutura de seda 3-0, com aproximadamente 3 cm de comprimento, acima e abaixo dos ramos do tronco celíaco, e coloque uma sutura de seda 6-0, com aproximadamente 10 cm de comprimento, no ramo do tronco celíaco.
- Ligadura a aorta abdominal abaixo e acima dos ramos do tronco celíaco. Faça uma pequena incisão no ramo arterial. Levante suavemente a sutura de seda 6-0, insira um cateter venoso 24 G na artéria esplênica ao longo do tronco celíaco e ligue e prenda-o.
- Usando uma bomba de seringa a uma taxa de 4 mL / min, infundir solução salina normal heparinizada (25 U / mL) a um volume de 50 mL. Ao mesmo tempo, corte a veia porta como um canal de saída para permitir que o fluido infundido flua para fora do baço. O animal é sacrificado por exsanguinação.
- Disseque cuidadosamente o tecido circundante do baço, evitando danos ao pâncreas, preservando os principais vasos acessórios.
- Verifique se há vazamento ao redor do baço, remova o baço e o pâncreas e enxágue-os com solução salina normal.
NOTA: O baço e o pâncreas dos ratos estão intimamente ligados, com o pâncreas envolvendo a artéria esplênica. Se o baço for removido separadamente, pode ser um desafio ligar vários pequenos vasos sanguíneos. Neste procedimento, o baço é removido junto com o pâncreas. Após a descelularização, o baço e o pâncreas tornam-se transparentes e a microvasculatura é visível, o que facilita a preservação do baço com vasos sanguíneos íntegros. - Transfira o baço para um tubo de centrífuga de 50 mL cheio de solução salina normal e armazene-o em um freezer a -80 ° C.
NOTA: O baço e o cateter venoso inseridos na artéria esplênica serão criopreservados juntos para uma conexão conveniente durante os experimentos de perfusão.
2. Descelularização do baço
- Repita o ciclo de congelamento e descongelamento 3x em um recipiente estéril para lisar as células do baço.
NOTA: O ciclo de congelamento e descongelamento é um método físico usado para descelularização do andaime. O tecido do baço é colocado em um freezer a -80 °C durante a noite para congelamento, depois removido do ambiente de baixa temperatura e colocado em banho-maria em temperatura ambiente ou 37 °C para descongelamento. Este processo de congelamento e descongelamento é repetido 3-6 vezes, o que rompe as membranas celulares e leva à lise celular. - Montar um sistema de perfusão dentro de uma bancada limpa composta por uma bomba peristáltica, um reservatório de 2 L, um tubo de silicone com diâmetro interno de 2,4 mm e um coletor de bolhas (Figura 1).
- Encha o sistema de perfusão com água deionizada (ddH2O) e mantenha-o funcionando por 10 min.
- Transfira cuidadosamente o baço colhido para o recipiente cheio de ddH2O.
- Conecte o tubo de silicone ao cateter venoso que foi inserido na artéria esplênica.
- Inicie a perfusão com ddH2O a uma taxa de 2 mL/min por 30 min.
- Continue a perfusão com ddH2O a uma taxa de 4 mL / min por 30 min.
- Perfundir com solução SDS a 0,1% (p/v) por 4 h.
- Perfundir com solução Triton X-100 a 1% (v/v) por 2 h.
- Perfunda com PBS a uma taxa de 4 mL/min por 4 h para lavar o DSM.
NOTA: Usando a bomba peristáltica para perfusão unidirecional de todos os líquidos. - Após a conclusão da perfusão, ligue e corte os ramos vasculares entre o pâncreas e o baço e, em seguida, remova o pâncreas. Armazene o DSM em um tubo de centrífuga limpo e selado de 50 mL embebido em PBS contendo 10% de penicilina-estreptomicina a -20 ° C até que esteja pronto para uso em experimentos futuros.
Resultados
Este protocolo utilizou uma combinação de ciclos repetidos de congelamento e descongelamento e perfusão com reagentes de descelularização para a descelularização do baço de rato. A descelularização completa do baço foi alcançada em aproximadamente 11 h (Figura 2A). Ao longo do processo de descelularização, a cor do baço mudou gradualmente de vermelho escuro para um vermelho claro manchado e, eventualmente, uma aparência branca translúcida (Figura 2B). A morfologia geral permaneceu relativamente intacta, com estruturas vasculares visíveis (Figura 2B).
A coloração com hematoxilina-eosina confirmou a remoção de componentes celulares, revelando uma MEC intacta dentro do DSM. Isso contrasta fortemente com o baço nativo, conforme ilustrado na Figura 3A, onde os núcleos celulares e os elementos citoplasmáticos são visíveis. A ausência de células foi confirmada por meio da coloração de 4',6-diamidino-2-fenilindol (DAPI) e medição do DNA residual (DSM: 10,1 ± 4 ng/mg de peso seco, baço nativo: 6.200 ± 300 ng/mg de peso seco). Imagens de microscopia eletrônica de varredura revelaram a caracterização ultraestrutural do DSM, que mostrou uma estrutura em favo de mel após a remoção completa dos linfócitos do baço (Figura 3C). Isso indicou que a descelularização do baço preservou a ultraestrutura e a arquitetura normais do baço. Para uma avaliação mais abrangente das proteínas ECM cruciais presentes no DSM, foram empregados tricrômico de Masson (Figura 3B) e coloração por imunofluorescência. Especificamente, o colágeno I (Figura 3D) e a fibronectina (Figura 3E) foram direcionados para análise. Os resultados indicaram que os componentes estruturais e da membrana basal da MEC foram retidos de forma semelhante ao baço nativo.

Figura 1: A configuração experimental. Clique aqui para ver uma versão maior desta figura.
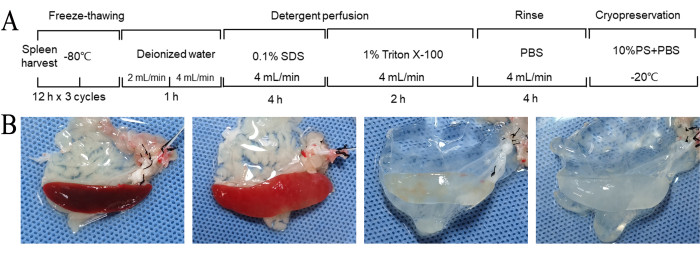
Figura 2: O fluxo de trabalho de descelularização e mudanças morfológicas grosseiras. (A) O fluxo de trabalho de preparação da matriz do baço descelularizado. A descelularização completa do baço foi alcançada em aproximadamente 11 h. (B) Alterações morfológicas macroscópicas do baço durante a preparação do DSM. Durante esse processo, a cor do baço mudou gradualmente de vermelho escuro para um vermelho claro manchado e, eventualmente, uma aparência branca translúcida. (B) 1. Após repetidos ciclos de congelamento e descongelamento e antes da descelularização. 2. Após enxaguar com água deionizada por 1 h. 3. Após perfusão com SDS por 4 h. 4. Após perfusão com Tritão por 2 h. Abreviaturas: DSM = matriz do baço descelularizada; SDS = dodecil sulfato de sódio; PBS = solução salina tamponada com fosfato; PS = penicilina-estreptomicina. Clique aqui para ver uma versão maior desta figura.

Figura 3: Observações morfológicas da matriz descelularizada do baço. (A) Coloração H&E; (B) Coloração tricrômica de Masson; (C) SEM; (D, E) Coloração por imunofluorescência de colágeno I e fibronectina; (F) Coloração DAPI. Barras de escala = 50 μm (A, B, D-F), 5 μm (C). Abreviaturas: DSM = matriz do baço descelularizada; H&E = hematoxilina-eosina; MEV = microscopia eletrônica de varredura; DAPI = 4',6-diamidino-2-fenilindo. Clique aqui para ver uma versão maior desta figura.
Discussão
Os LBAs representam uma abordagem eficaz para o tratamento da doença hepática terminal, particularmente nos casos em que o transplante de fígado é dificultado pela atual escassez de órgãos de doadores6. Uma opção promissora para a criação de LBAs é a utilização de DLM, que preserva a ECM natural e a estrutura vascular do fígado nativo. No entanto, a escassez de DLM humano e os riscos potenciais de infecção e imunogenicidade associados ao DLM animal apresentam limitações significativas. Para enfrentar esse desafio, propomos uma nova estratégia que envolve o emprego de uma matriz de baço descelularizada (DSM) como um andaime alternativo para BALs 8,9,10,11. Os baços são mais facilmente acessíveis em vários cenários clínicos e exibem características semelhantes aos fígados. Neste trabalho, apresentamos métodos detalhados de coleta de baços de ratos e preparação de DSM que preservam as microestruturas e componentes da MEC.
Um método ideal de descelularização removeria os componentes celulares, mantendo a estrutura, composição e propriedades mecânicas originais da MEC 12,13,14. Os métodos de descelularização englobam tratamentos físicos, químicos e enzimáticos, cada um com suas vantagens e desvantagens distintas15. Embora esses métodos possam remover parcialmente os componentes celulares, eles também podem comprometer a composição, a estrutura e a funcionalidade da ECM restante. A qualidade da descelularização pode ser influenciada por variações na densidade celular, espessura da matriz e morfologia do tecido em diferentes fontes de tecido.
Até o momento, não existe um padrão-ouro para o processo de descelularização. Normalmente, o simples emprego de qualquer um desses métodos é inadequado para minimizar os efeitos adversos na ECM e maximizar a remoção do conteúdo celular. Consequentemente, a abordagem mais eficaz depende das características do tecido, necessitando de uma combinação desses métodos. Neste estudo, utilizamos um protocolo que combinou métodos físicos (ciclos de congelamento e descongelamento e perfusão) com métodos químicos (SDS e TritonX-100) para descelularizar baços de ratos.
Os ciclos de congelamento e descongelamento promovem a lise celular e o rápido desprendimento das células da MEC16. Simultaneamente, a perfusão através da vasculatura nativa aumenta significativamente a eficiência da descelularização e preserva a rede vascular original17. O dodecil sulfato de sódio (SDS), funcionando como um detergente iônico, dissolve com proficiência as membranas celular e nuclear, levando a uma remoção mais abrangente dos componentes citoplasmáticos e nucleares. No entanto, esse processo também inflige danos à ultraestrutura da MEC devido à depleção de glicosaminoglicanos (GAGs) e colágeno.
Concentrações elevadas de SDS correlacionaram-se com diminuição do conteúdo residual de DNA e resistência mecânica reduzida dentro do andaime ECM. Por outro lado, concentrações mais baixas de SDS preservaram uma maior quantidade de colágeno e induziram menos desnaturação das proteínas da MEC. Em contraste, o Triton X-100, servindo como um detergente não iônico, interrompe efetivamente as interações lipídio-lipídio, lipídio-proteína e DNA-proteína, oferecendo uma abordagem mais suave para a dissolução da membrana celular. No entanto, mostra-se inadequado para a remoção completa dos núcleos celulares e do DNA. Portanto, ele precisa ser combinado com baixas concentrações de SDS e tratamentos físicos para garantir a remoção completa dos componentes celulares, preservando a estrutura, composição e desempenho originais da MEC. É importante observar que os detergentes residuais podem ter certa citotoxicidade, portanto, é necessário enxaguar após o tratamento com PBS estéril ou água destilada antes do armazenamento.
Uma limitação deste protocolo é a ausência de quantificação para SDS residual e Triton X-100. Essa decisão é informada tanto pela experiência de nossa equipe quanto por relatórios corroborantes, que sugerem que uma lavagem de PBS de 4 h é suficiente para remover essas substâncias de forma eficaz. Além disso, nossos experimentos anteriores de cultura de células empregando este protocolo não demonstraram nenhum sinal de citotoxicidade. Para minimizar os gastos do protocolo, optou-se deliberadamente por renunciar à quantificação de detergentes residuais.
Em conclusão, este protocolo apresenta um método viável para a elaboração de DSMs, demonstrando eficiência, estabilidade e mínima invasividade. Os DSMs preparados usando este protocolo mantêm a arquitetura, composição e rede vascular natural inerentes ao baço. Além disso, oferece um andaime para implantação celular e cultura dinâmica tridimensional, estabelecendo assim uma base para o avanço das investigações em fígado de engenharia de tecidos.
Divulgações
Os autores declararam não haver conflitos de interesse.
Agradecimentos
Este trabalho foi apoiado pela Fundação Nacional de Ciências Naturais da China (82000624), Programa de Pesquisa Básica em Ciências Naturais de Shaanxi (2022JQ-899 e 2021JM-268), Programa de Apoio à Capacidade de Inovação da Província de Shaanxi (2023KJXX-030), Plano de P&D da Província de Shaanxi Projeto Conjunto da Universidade - Projeto Chave (2021GXLH-Z-047), Fundação Institucional do Primeiro Hospital Afiliado da Universidade Xi'an Jiaotong (2021HL-42 e 2021HL-21).
Materiais
| Name | Company | Catalog Number | Comments |
| Anesthesia Machine | Harvard Apparatus | tabletop | animal anesthesia |
| bubble trap | Shandong Weigao Group Medical Polymer Co., Ltd. | pore diameter: 5 μm | prevent air bubbles |
| Buprenorphine | TIPR Pharmaceutical Responsible Co.,Ltd | an analgesic | |
| Hemostatic Forceps | Shanghai Medical Instruments Co., Ltd | J31020 | surgical tool |
| Heparinized Saline | SPH No.1 Biochemical & Pharmaceutical Co., LTD | prevent the formation of thrombosis | |
| Isoflurane | RWD life Science Co. | anesthetic:for the induction and maintenanceof anesthesia | |
| Penicillin-Streptomycin | Beyotime Biotechnology Co., Ltd. | C0222 | antibiotics in vitro to prevent microbial contamination |
| Peristaltic Pump | Baoding Longer Precision Pump Co., Ltd. | BT100-1L | |
| Phosphate-Buffered Saline | Shanghai Titan Scientific Co., Ltd. | 4481228 | phosphoric acid buffer salt solution |
| Silicone Tube | Baoding Longer Precision Pump Co., Ltd. | 2.4×0.8mm | |
| Silk Suture | Yangzhou Jinhuan Medical Instrument Factory | 6-0 and 3-0 | ligate blood vessels |
| Sodium Dodecyl Sulfate | Shanghai Titan Scientific Co., Ltd. | 151-21-3 | ionic detergent, dissolves both cell and nuclear membranes |
| Syringe Pump | Shenzhen Mindray Bio-Medical Electronics Co., Ltd | BeneFusion SP5 | intravenous infusion |
| Triton X-100 | Shanghai Titan Scientific Co., Ltd. | 9002-93-1 | non-ionic detergent, disrupts lipid-lipid, lipid-protein, and DNA-protein interactions |
| Venous Catheter | B. Braun Company | 24G | inserting the spleen artery |
Referências
- Xu, X. State of the art and perspectives in liver transplantation. Hepatobiliary Pancreat Dis Int. 22 (1), 1-3 (2023).
- Hautz, T., et al. Immune cell dynamics deconvoluted by single-cell RNA sequencing in normothermic machine perfusion of the liver. Nat Commun. 14 (1), 2285(2023).
- Cardini, B., et al. Live confocal imaging as a novel tool to assess liver quality: insights from a murine model. Transplantation. 104 (12), 2528-2537 (2020).
- Ding, Y., et al. Mesenchymal stem cell-derived exosomes: a promising therapeutic agent for the treatment of liver diseases. Int J Mol Sci. 23 (18), 10972(2022).
- Yaghoubi, A., et al. Prednisolone and mesenchymal stem cell preloading protect liver cell migration and mitigate extracellular matrix modification in transplanted decellularized rat liver. Stem Cell Res Ther. 13 (1), 36(2022).
- Uygun, B. E., et al. Organ reengineering through development of a transplantable recellularized liver graft using decellularized liver matrix. Nat Med. 16 (7), 814-820 (2010).
- Xiang, J., et al. The effect of riboflavin/UVA cross-linking on anti-degeneration and promoting angiogenic capability of decellularized liver matrix. J Biomed Mater Res A. 105 (10), 2662-2669 (2017).
- Liu, P., et al. Implantation strategy of tissue-engineered liver based on decellularized spleen matrix in rats. J South Med Univ. 38 (6), 698-703 (2018).
- Xiang, J., et al. Decellularized spleen matrix for reengineering functional hepatic-like tissue based on bone marrow mesenchymal stem cells. Organogenesis. 12 (3), 128-142 (2016).
- Gao, R., et al. Hepatocyte culture in autologous decellularized spleen matrix. Organogenesis. 11 (1), 16-29 (2015).
- Liu, P., et al. Hemocompatibility improvement of decellularized spleen matrix for constructing transplantable bioartificial liver. Biomed Mater. 14 (2), 25003(2019).
- Somuncu, Ö Decellularization concept in regenerative medicine. Adv Exp Med Biol. 1212, 71-85 (2020).
- Neishabouri, A., Soltani, K. A., Daghigh, F., Kajbafzadeh, A. M., Majidi, Z. M. Decellularization in tissue engineering and regenerative medicine: evaluation, modification, and application methods. Front Bioeng Biotech. 10, 805299(2022).
- Brown, M., Li, J., Moraes, C., Tabrizian, M., Li-Jessen, N. Decellularized extracellular matrix: New promising and challenging biomaterials for regenerative medicine. Biomaterials. 289, 121786(2022).
- Gui, L., Muto, A., Chan, S. A., Breuer, C. K., Niklason, L. E. Development of decellularized human umbilical arteries as small-diameter vascular grafts. Tissue Eng Pt A. 15 (9), 2665-2676 (2009).
- Li, T., Javed, R., Ao, Q. Xenogeneic decellularized extracellular matrix-based biomaterials For peripheral nerve repair and regeneration. Curr Neuropharmacol. 19 (12), 2152-2163 (2021).
- Crapo, P. M., Gilbert, T. W., Badylak, S. F. An overview of tissue and whole organ decellularization processes. Biomaterials. 32 (12), 3233-3243 (2011).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados