Method Article
来源于大鼠的脱细胞脾基质的制备
摘要
脱细胞脾基质(DSM)在肝组织工程领域具有广阔的应用前景。该方案概述了制备大鼠DSM的程序,其中包括收获大鼠脾脏,通过灌注使它们脱细胞,并评估所得的DSM以确认其特性。
摘要
肝移植是终末期肝病的主要治疗方法。然而,供体器官的短缺和质量不足需要开发替代疗法。利用脱细胞肝基质 (DLM) 的生物人工肝 (BAL) 已成为有前途的解决方案。然而,寻找合适的 DLM 仍然具有挑战性。已经探索使用脱细胞脾基质 (DSM) 作为 BAL 的基础,提供了一种现成的替代方案。在这项研究中,使用冻融循环和去细胞试剂灌注相结合的方式收获大鼠脾脏并进行脱细胞。该协议保留了 DSM 内细胞外基质 (ECM) 的微观结构和成分。完整的脱细胞过程大约需要 11 小时,从而在 DSM 内产生完整的 ECM。组织学分析证实了细胞成分的去除,同时保留了 ECM 的结构和组成。所提出的方案提供了一种获得 DSM 的综合方法,在肝组织工程和细胞治疗中提供了潜在的应用。这些发现有助于开发治疗终末期肝病的替代方法。
引言
肝移植仍然是终末期肝病的唯一确定性治疗方法1,2,3。然而,供体器官的严重短缺和质量下降增加了对替代疗法的需求4.在再生医学领域,利用脱细胞肝基质 (DLM) 的生物人工肝 (BAL) 已成为有前途的解决方案5,6,7。DLM 保留了原始的肝脏结构,包括其错综复杂的微血管网络和 ECM 的组成部分,为创建可移植的 BAL 提供了支架,这可能会缓解肝脏疾病。
尽管前景广阔,但这项技术的采用仍面临挑战,特别是在寻找合适的DLM方面。 人源性DLMs供不应求,而来自动物源的DLMs则存在疾病传播和免疫排斥的风险。在一种创新的方法中,我们的研究探索了使用脱细胞脾基质 (DSM) 作为 BAL的基础 8,9,10,11。脾脏在各种医疗情况下更容易获得,例如门静脉高压、创伤性破裂、特发性血小板减少性紫癜和心源性死亡后的捐献。因此,出于研究目的,脾脏比肝脏更广泛地可用。接受过脾切除术的患者不会患有严重的疾病,这进一步证实了脾脏的可有可无性。脾脏的微环境,特别是细胞外基质和鼻窦,与肝脏的微环境相似。这使得脾脏成为肝细胞移植研究中细胞粘附和增殖的合适器官。基于这些发现,我们之前的研究表明,DSMs与DLMs具有相当的微观结构和成分,可以支持肝细胞的存活和功能,包括白蛋白和尿素的产生。此外,DSM已被证明可以增强骨髓间充质干细胞的肝脏分化,从而改善和一致的功能。
通过使用用肝素治疗的 DSM,我们设计了能够证明有效的短期抗凝和部分肝功能补偿的功能性 BAL11。因此,这种三维DSM对于肝组织工程和细胞疗法的发展具有重要的前景。在这项工作中,我们介绍了收获大鼠脾脏和制备 DSM 的详细方法,这些方法保留了 ECM 的微观结构和成分。
研究方案
本研究经习交通大学动物实验伦理委员会批准,按照《实验动物护理与使用指南》开展。
1.脾脏采摘
- 使用体重250-280g的雄性Sprague Dawley大鼠。将大鼠安置在温度和湿度受控的房间中,并 随意为它们提供食物和水,手术前禁食除外。
- 术前 1 小时皮下注射丁丙诺啡 (0.05 mL/kg) 作为镇痛剂。通过异氟烷吸入麻醉大鼠。在有机玻璃盒中使用1.5 L/min的流速的5%异氟烷进行诱导麻醉,并通过面罩以0.6-0.8 L/min的流速保持麻醉2%异氟烷。通过捏住脚趾来确认麻醉的深度。
- 使用电动剃须刀刮除整个腹部的皮肤。将大鼠仰卧在手术台上。通过背静脉注射 2 mL 肝素化盐水(1,000 U 肝素)以达到全身抗凝。用聚维酮碘溶液对剃光的皮肤进行消毒,并用无菌布覆盖。
- 用手术剪刀在腹部做一个十字形切口,用止血钳拉伸暴露腹腔,然后将肝脏朝向横膈膜翻转。将胃肠道外侧置于腹部右侧,并用湿纱布覆盖。
- 小心地分离并切断脾胃韧带,露出脾门。
注意:脾脏呈淡红色细长结构,大小约为 3.0 cm x 0.6 cm x 0.6 cm,可在左腹部识别。 - 沿脾门解剖,逐渐分离并暴露肝总动脉、胃十二指肠动脉和脾动脉。结扎并切断胃十二指肠动脉和肝总动脉,同时逐渐解离周围组织。
- 将脾脏向右侧翻转,露出腹主动脉。轻轻进行钝性解剖,用棉签露出腹主动脉和腹腔干。在乳糜泻干的枝条上方和下方放置一条长约 3 厘米的 3-0 丝缝线,并在乳糜泻干的枝条上放置一条长约 10 厘米的 6-0 丝缝线。
- 将腹主动脉结扎在腹腔主动脉的下方和上方,位于腹腔干的分支上方。在动脉分支处做一个小切口。轻轻提起 6-0 丝线缝合线,将 24 G 静脉导管沿腹腔干插入脾动脉,然后结扎并固定。
- 使用注射泵以 4 mL/min 的速率输注肝素化的生理盐水 (25 U/mL),体积为 50 mL。同时,切断门静脉作为流出通道,让输液从脾脏流出。动物通过放血被安乐死。
- 小心解剖脾脏周围的组织,避免对胰腺造成损伤,同时保留主要的附属血管。
- 检查脾脏周围是否有渗漏,然后切除脾脏和胰腺,并用生理盐水冲洗。
注意:大鼠的脾脏和胰腺紧密相连,胰腺包裹着脾动脉。如果单独切除脾脏,结扎许多小血管可能会很困难。在这个过程中,脾脏和胰腺一起被切除。脱细胞后,脾脏和胰腺变得透明,微血管系统可见,有利于保存具有完整血管的脾脏。 - 将脾脏转移到装有生理盐水的50mL离心管中,并将其储存在-80°C冰箱中。
注意:插入脾动脉的脾脏和静脉导管将一起冷冻保存,以便在灌注实验期间方便连接。
2.脾脏脱细胞
- 在无菌容器中重复冻融循环 3 次以裂解脾细胞。
注意:冻融循环是一种用于支架脱细胞的物理方法。将脾组织置于-80°C冰箱中冷冻过夜,然后从低温环境中取出,置于室温或37°C水浴中解冻。这种冻融过程重复 3-6 次,会破坏细胞膜并导致细胞裂解。 - 在洁净工作台内设置灌注系统,包括蠕动泵、2 L 储液罐、内径为 2.4 mm 的硅胶管和气泡收集器(图 1)。
- 用去离子水(ddH2O)填充灌注系统,并保持其运行10分钟。
- 小心地将收获的脾脏转移到 ddH2O 填充的容器中。
- 将硅胶管连接到已插入脾动脉的静脉导管。
- 以 2 mL/min 的速率开始用 ddH2O 灌注 30 分钟。
- 继续以 4 mL/min 的速率用 ddH2O 灌注 30 分钟。
- 用0.1%(w / v)SDS溶液灌注4小时。
- 用1%(v / v)Triton X-100溶液灌注2小时。
- 以 4 mL/min 的速率用 PBS 灌注 4 小时以洗涤 DSM。
注意: 使用蠕动泵单向灌注所有液体。 - 灌注完成后,将胰腺和脾脏之间的血管分支结扎并横断,然后切除胰腺。将DSM储存在清洁密封的50mL离心管中,该离心管浸泡在含有10%青霉素 - 链霉素的PBS中,温度为-20°C,直至准备用于未来的实验。
结果
该方案利用重复冻融循环和与脱细胞试剂灌注的组合来使大鼠脾脏脱细胞。脾脏的完全脱细胞在大约11小时内实现(图2A)。在整个脱细胞过程中,脾脏的颜色逐渐从深红色转变为斑驳的浅红色,最终呈现白色半透明外观(图2B)。整体形态保持相对完整,具有可见的血管结构(图2B)。
苏木精-伊红染色证实了细胞成分的去除,揭示了 DSM 内完整的 ECM。这与 图3A所示的天然脾脏形成鲜明对比,在天然脾脏中,细胞核和细胞质元件是可见的。通过 4',6-二脒基-2-苯基吲哚 (DAPI) 染色和残留 DNA 的测量进一步确认了细胞的缺失 (DSM:10.1 ± 4 ng/mg 干重,天然脾脏:6,200 ± 300 ng/mg 干重)。扫描电子显微镜图像揭示了DSM的超微结构表征,在从脾脏完全去除淋巴细胞后显示出蜂窝状结构(图3C)。这表明脾脏的脱细胞保留了正常脾脏的超微结构和结构。为了更全面地评估 DSM 中存在的关键 ECM 蛋白,采用了 Masson trichrome(图 3B)和免疫荧光染色。具体来说,胶原蛋白I(图3D)和纤连蛋白(图3E)是分析的靶标。结果表明,ECM的结构膜和基底膜成分都保留了与自体脾脏相似的特性。

图 1: 实验装置。 请点击这里查看此图的较大版本.
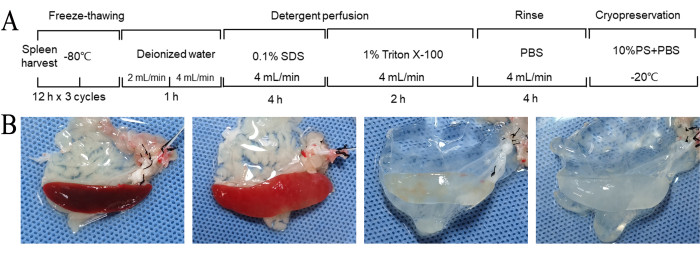
图 2:脱细胞和大体形态变化的工作流程。 (A) 脱细胞脾基质制备工作流程。脾脏的完全脱细胞在大约11小时内实现。 (B)在DSM制备过程中脾脏的粗体形态变化。在这个过程中,脾脏的颜色逐渐从深红色转变为斑驳的浅红色,最后变成白色的半透明外观。(二) 1.在反复冻融循环之后和脱细胞之前。2. 用去离子水冲洗 1 小时后。用 SDS 灌注 4 小时后。用Triton灌注2小时后。缩写:DSM = 脱细胞脾基质;SDS = 十二烷基硫酸钠;PBS = 磷酸盐缓冲盐水;PS = 青霉素-链霉素。 请点击这里查看此图的较大版本.

图3:脱细胞脾基质的形态学观察。 (A) H&E染色;(B)Masson三色染色;(C) 扫描电镜;(D,E)I型胶原和纤连蛋白的免疫荧光染色;(F)DAPI染色。比例尺 = 50 μm (A, B, D-F), 5 μm (C)。缩写:DSM = 脱细胞脾基质;H&E = 苏木精-伊红;SEM = 扫描电子显微镜;DAPI = 4',6-二脒基-2-苯基吲哚。请点击这里查看此图的较大版本.
讨论
BALs代表了治疗终末期肝病的有效方法,特别是在肝移植因目前供体器官短缺而受到阻碍的情况下6。制造 BAL 的一个有前途的选择是利用 DLM,它保留了天然肝脏的天然 ECM 和血管结构。然而,人类DLM的稀缺性以及与动物DLM相关的感染和免疫原性的潜在风险构成了重大限制。为了应对这一挑战,我们提出了一种新的策略,涉及采用脱细胞脾基质 (DSM) 作为BAL、9、10、11 的替代支架。脾脏在各种临床情况下更容易获得,并表现出与肝脏相似的特征。在这项工作中,我们介绍了收获大鼠脾脏和制备 DSM 的详细方法,这些方法保留了 ECM 的微观结构和成分。
理想的脱细胞方法是在保持 ECM 的原始结构、组成和机械性能的同时去除细胞成分 12,13,14。脱细胞方法包括物理、化学和酶处理,每种方法都有其独特的优点和缺点15.虽然这些方法可以部分去除细胞成分,但它们也可能损害剩余 ECM 的组成、结构和功能。脱细胞的质量可能受到不同组织来源的细胞密度、基质厚度和组织形态变化的影响。
迄今为止,脱细胞过程还没有黄金标准。通常,简单地采用这些方法中的任何一种都不足以最大限度地减少对 ECM 的不利影响并最大限度地去除细胞含量。因此,最有效的方法依赖于组织特性,因此需要结合这些方法。在这项研究中,我们利用了一种将物理方法(冻融循环和灌注)与化学方法(SDS 和 TritonX-100)相结合的方案来使大鼠脾脏脱细胞。
冻融循环促进细胞裂解和细胞从 ECM16 中快速分离。同时,通过天然脉管系统的灌注显着提高了脱细胞效率并保留了原始的血管网络17。十二烷基硫酸钠 (SDS) 作为离子洗涤剂,可熟练溶解细胞膜和核膜,从而更全面地去除细胞质和细胞核成分。然而,由于糖胺聚糖 (GAG) 和胶原蛋白的消耗,该过程也会对 ECM 超微结构造成损害。
SDS 浓度升高与 ECM 支架内残留 DNA 含量减少和机械强度降低相关。相反,较低浓度的 SDS 保留了更多的胶原蛋白,并诱导了较少的 ECM 蛋白变性。相比之下,Triton X-100 作为一种非离子去污剂,可有效破坏脂质-脂质、脂质-蛋白质和 DNA-蛋白质的相互作用,为细胞膜溶解提供了一种更温和的方法。然而,它被证明不足以完全去除细胞核和DNA。因此,它需要与低浓度的SDS和物理处理相结合,以确保细胞成分的完全去除,同时保留ECM的原始结构、组成和性能。需要注意的是,残留的洗涤剂可能具有一定的细胞毒性,因此在储存前必须用无菌 PBS 或蒸馏水进行处理后冲洗。
该协议的一个局限性是缺乏对残留 SDS 和 Triton X-100 的量化。这一决定是基于我们团队的经验和确凿的报告,这些报告表明,4 小时的 PBS 清洗足以有效去除这些物质。此外,我们之前采用该方案的细胞培养实验尚未证明任何细胞毒性迹象。为了最大限度地降低协议的费用,我们深思熟虑地选择放弃对残留洗涤剂的量化。
综上所述,该协议提供了一种可行的DSMs制备方法,展示了效率,稳定性和最小的侵入性。使用该方案制备的 DSM 保持脾脏的固有结构、组成和自然血管网络。此外,它还为细胞植入和三维动态培养提供了支架,从而为推进组织工程肝脏的研究奠定了基础。
披露声明
提交人未声明存在任何利益冲突。
致谢
这项工作得到了国家自然科学基金(82000624)、陕西省自然科学基础研究计划(2022JQ-899和2021JM-268)、陕西省创新能力支持计划(2023KJXX-030)、陕西省重点研发计划大学联合项目-重点项目(2021GXLH-Z-047)、习安交通大学第一附属医院机构基金(2021HL-42和2021HL-21)的支持。
材料
| Name | Company | Catalog Number | Comments |
| Anesthesia Machine | Harvard Apparatus | tabletop | animal anesthesia |
| bubble trap | Shandong Weigao Group Medical Polymer Co., Ltd. | pore diameter: 5 μm | prevent air bubbles |
| Buprenorphine | TIPR Pharmaceutical Responsible Co.,Ltd | an analgesic | |
| Hemostatic Forceps | Shanghai Medical Instruments Co., Ltd | J31020 | surgical tool |
| Heparinized Saline | SPH No.1 Biochemical & Pharmaceutical Co., LTD | prevent the formation of thrombosis | |
| Isoflurane | RWD life Science Co. | anesthetic:for the induction and maintenanceof anesthesia | |
| Penicillin-Streptomycin | Beyotime Biotechnology Co., Ltd. | C0222 | antibiotics in vitro to prevent microbial contamination |
| Peristaltic Pump | Baoding Longer Precision Pump Co., Ltd. | BT100-1L | |
| Phosphate-Buffered Saline | Shanghai Titan Scientific Co., Ltd. | 4481228 | phosphoric acid buffer salt solution |
| Silicone Tube | Baoding Longer Precision Pump Co., Ltd. | 2.4×0.8mm | |
| Silk Suture | Yangzhou Jinhuan Medical Instrument Factory | 6-0 and 3-0 | ligate blood vessels |
| Sodium Dodecyl Sulfate | Shanghai Titan Scientific Co., Ltd. | 151-21-3 | ionic detergent, dissolves both cell and nuclear membranes |
| Syringe Pump | Shenzhen Mindray Bio-Medical Electronics Co., Ltd | BeneFusion SP5 | intravenous infusion |
| Triton X-100 | Shanghai Titan Scientific Co., Ltd. | 9002-93-1 | non-ionic detergent, disrupts lipid-lipid, lipid-protein, and DNA-protein interactions |
| Venous Catheter | B. Braun Company | 24G | inserting the spleen artery |
参考文献
- Xu, X. State of the art and perspectives in liver transplantation. Hepatobiliary Pancreat Dis Int. 22 (1), 1-3 (2023).
- Hautz, T., et al. Immune cell dynamics deconvoluted by single-cell RNA sequencing in normothermic machine perfusion of the liver. Nat Commun. 14 (1), 2285 (2023).
- Cardini, B., et al. Live confocal imaging as a novel tool to assess liver quality: insights from a murine model. Transplantation. 104 (12), 2528-2537 (2020).
- Ding, Y., et al. Mesenchymal stem cell-derived exosomes: a promising therapeutic agent for the treatment of liver diseases. Int J Mol Sci. 23 (18), 10972 (2022).
- Yaghoubi, A., et al. Prednisolone and mesenchymal stem cell preloading protect liver cell migration and mitigate extracellular matrix modification in transplanted decellularized rat liver. Stem Cell Res Ther. 13 (1), 36 (2022).
- Uygun, B. E., et al. Organ reengineering through development of a transplantable recellularized liver graft using decellularized liver matrix. Nat Med. 16 (7), 814-820 (2010).
- Xiang, J., et al. The effect of riboflavin/UVA cross-linking on anti-degeneration and promoting angiogenic capability of decellularized liver matrix. J Biomed Mater Res A. 105 (10), 2662-2669 (2017).
- Liu, P., et al. Implantation strategy of tissue-engineered liver based on decellularized spleen matrix in rats. J South Med Univ. 38 (6), 698-703 (2018).
- Xiang, J., et al. Decellularized spleen matrix for reengineering functional hepatic-like tissue based on bone marrow mesenchymal stem cells. Organogenesis. 12 (3), 128-142 (2016).
- Gao, R., et al. Hepatocyte culture in autologous decellularized spleen matrix. Organogenesis. 11 (1), 16-29 (2015).
- Liu, P., et al. Hemocompatibility improvement of decellularized spleen matrix for constructing transplantable bioartificial liver. Biomed Mater. 14 (2), 25003 (2019).
- Somuncu, &. #. 2. 1. 4. ;. Decellularization concept in regenerative medicine. Adv Exp Med Biol. 1212, 71-85 (2020).
- Neishabouri, A., Soltani, K. A., Daghigh, F., Kajbafzadeh, A. M., Majidi, Z. M. Decellularization in tissue engineering and regenerative medicine: evaluation, modification, and application methods. Front Bioeng Biotech. 10, 805299 (2022).
- Brown, M., Li, J., Moraes, C., Tabrizian, M., Li-Jessen, N. Decellularized extracellular matrix: New promising and challenging biomaterials for regenerative medicine. Biomaterials. 289, 121786 (2022).
- Gui, L., Muto, A., Chan, S. A., Breuer, C. K., Niklason, L. E. Development of decellularized human umbilical arteries as small-diameter vascular grafts. Tissue Eng Pt A. 15 (9), 2665-2676 (2009).
- Li, T., Javed, R., Ao, Q. Xenogeneic decellularized extracellular matrix-based biomaterials For peripheral nerve repair and regeneration. Curr Neuropharmacol. 19 (12), 2152-2163 (2021).
- Crapo, P. M., Gilbert, T. W., Badylak, S. F. An overview of tissue and whole organ decellularization processes. Biomaterials. 32 (12), 3233-3243 (2011).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。