Method Article
Изготовление децеллюляризованной матрицы селезенки, полученной из крыс
В этой статье
Резюме
Децеллюляризованный матрикс селезенки (DSM) имеет многообещающее применение в области тканевой инженерии печени. В этом протоколе описана процедура подготовки DSM крысы, которая включает в себя сбор селезенки крысы, децеллюляризацию их с помощью перфузии и оценку полученного DSM для подтверждения его характеристик.
Аннотация
Трансплантация печени является основным методом лечения терминальной стадии заболевания печени. Однако нехватка и недостаточное качество донорских органов обусловливают необходимость разработки альтернативных методов лечения. Биоискусственная печень (БАЛ), использующая децеллюляризованный матрикс печени (DLM), стала многообещающим решением. Однако поиск подходящих DLM остается сложной задачей. Использование децеллюляризованной матрицы селезенки (DSM) было изучено в качестве основы для БАЛ, предлагая легкодоступную альтернативу. В этом исследовании селезенка крыс была собрана и децеллюляризирована с использованием комбинации циклов замораживания-оттаивания и перфузии с реагентами децеллюляризации. Протокол сохранил микроструктуры и компоненты внеклеточного матрикса (ECM) в DSM. Полный процесс децеллюляризации занял около 11 часов, в результате чего в DSM образовалась неповрежденная ВКМ. Гистологический анализ подтвердил удаление клеточных компонентов при сохранении структуры и состава ВКМ. Представленный протокол обеспечивает комплексный метод получения DSM, предлагая потенциальные приложения в тканевой инженерии печени и клеточной терапии. Эти результаты способствуют разработке альтернативных подходов к лечению терминальной стадии заболевания печени.
Введение
Трансплантация печени остается единственным окончательным методом лечения терминальной стадии заболевания печени 1,2,3. Однако критическая нехватка и снижение качества донорских органов повысили потребность в альтернативных методах лечения4. В области регенеративной медицины биоискусственная печень (БАЛ) с использованием децеллюляризованного матрикса печени (ДЛМ) стала многообещающим решением 5,6,7. DLM сохраняет исходную структуру печени, включая ее сложную микрососудистую сеть и компоненты ECM, предлагая каркас для создания трансплантируемых БАЛ, которые потенциально могут облегчить заболевания печени.
Несмотря на перспективы, внедрение этой технологии сталкивается с проблемами, особенно в поиске подходящих DLM. DLM человеческого происхождения в дефиците, в то время как те, что получены из животных источников, несут риск передачи заболеваний и иммунного отторжения. В рамках инновационного подхода в нашем исследовании изучалось использование децеллюляризованного матрикса селезенки (DSM) в качестве основы для БАЛ 8,9,10,11. Селезенка более доступна в различных медицинских ситуациях, таких как портальная гипертензия, травматический разрыв, идиопатическая тромбоцитопеническая пурпура и донорство после сердечной смерти. Поэтому селезенка более доступна, чем печень, для исследовательских целей. Пациенты, перенесшие спленэктомию, не страдают тяжелыми состояниями, что еще раз подтверждает незаменимость селезенки. Микроокружение селезенки, особенно внеклеточный матрикс и синусоиды, похоже на микроокружение печени. Это делает селезенку подходящим органом для клеточной адгезии и пролиферации в исследованиях трансплантации гепатоцитов. Основываясь на этих результатах, наши предыдущие исследования продемонстрировали, что DSM имеют схожие микроструктуры и компоненты с DLM и могут поддерживать выживание и функцию гепатоцитов, включая выработку альбумина и мочевины. Кроме того, было показано, что DSM усиливают печеночную дифференцировку мезенхимальных стволовых клеток костного мозга, что приводит к улучшению и стабильности функциональности.
Используя DSM, обработанные гепарином, мы разработали функциональные БАЛ, способные демонстрировать эффективную краткосрочную антикоагулянтную терапию и частичную компенсацию функции печени11. Следовательно, эта трехмерная DSM имеет значительные перспективы для развития тканевой инженерии печени и клеточной терапии. В данной работе мы подробно представляем методы забора селезенки крыс и приготовления ДСМ, сохраняющие микроструктуры и компоненты ВКМ.
протокол
Это исследование было одобрено Комитетом по этике экспериментов на животных Сианьского университета Цзяотун и проведено в соответствии с руководящими принципами по уходу за лабораторными животными и их использованию.
1. Забор селезенки
- Используют самцов крыс Спрэг Доули весом 250-280 г. Поместите крыс в комнаты с контролируемой температурой и влажностью и обеспечьте их едой и водой в неограниченном количестве, за исключением голодания перед операцией.
- Подкожно ввести бупренорфин (0,05 мл/кг) в качестве анальгетика за 1 ч до операции. Обезболить крысу ингаляцией изофлурана. Используйте скорость потока 1,5 л/мин 5% изофлурана для индукционной анестезии в коробке из оргстекла и поддерживайте анестезию со скоростью потока 0,6-0,8 л/мин 2% изофлурана через маску. Подтвердите глубину анестезии, зажав пальцы ног.
- Используйте электробритву, чтобы сбрить кожу по всему животу. Закрепите крысу в положении лежа на хирургическом столе. Введите 2 мл гепаринизированного физиологического раствора (1000 ЕД гепарина) через дорсальную вену полового члена для достижения системной антикоагуляции. Продезинфицируйте выбритую кожу раствором повидон-йода и накройте стерильной салфеткой.
- Сделайте крестообразный разрез хирургическими ножницами в брюшной полости, обнажите брюшную полость, растягивая кровоостанавливающими щипцами, и переверните печень к диафрагме. Вынесите желудочно-кишечный тракт наружу на правую сторону живота и накройте его влажной марлей.
- Осторожно отделите и разрежьте связку селезенки, чтобы обнажить верх селезенки.
ПРИМЕЧАНИЕ: Селезенка, которая выглядит как красноватая удлиненная структура, размером примерно 3,0 см x 0,6 см x 0,6 см, может быть идентифицирована в левой брюшной полости. - Постепенно отделите и обнажите общую печеночную артерию, гастродуоденальную артерию и селезеночную артерию, рассекая вдоль селезеночной кости. Перевязать и перерезать гастродуоденальную артерию и общую печеночную артерию, постепенно диссоциируя окружающие ткани.
- Переверните селезенку в правую сторону, чтобы обнажить брюшную аорту. Аккуратно выполните тупое рассечение и обнажите брюшную аорту и чревное туловище ватными палочками. Наложите шелковый шов 3-0, примерно 3 см в длину, над и под ветвями чревного ствола, а шелковый шов 6-0, примерно 10 см в длину, на ветвь чревного ствола.
- Перевязывают брюшную аорту ниже и выше ветвей чревного ствола. Сделайте небольшой разрез на артериальной ветви. Аккуратно поднимите шелковый шов 6-0, вставьте венозный катетер 24 G в селезеночную артерию вдоль чревного ствола, перевяжите и закрепите его.
- С помощью шприцевого насоса со скоростью 4 мл/мин ввести гепаринизированный нормальный физиологический раствор (25 ЕД/мл) в объеме 50 мл. В то же время разрежьте воротную вену в качестве канала оттока, чтобы введенная жидкость могла вытекать из селезенки. Животное усыпляют путем обескровливания.
- Тщательно рассекайте окружающие ткани селезенки, избегая повреждения поджелудочной железы, сохраняя при этом крупные добавочные сосуды.
- Проверьте, нет ли подтекания вокруг селезенки, затем удалите селезенку и поджелудочную железу и промойте их обычным физиологическим раствором.
ПРИМЕЧАНИЕ: Селезенка и поджелудочная железа крыс тесно связаны, при этом поджелудочная железа огибает селезеночную артерию. Если селезенка удаляется отдельно, может быть сложно перевязать многочисленные мелкие кровеносные сосуды. При этой процедуре селезенка удаляется вместе с поджелудочной железой. После децеллюляризации селезенка и поджелудочная железа становятся прозрачными и виден микроциркуляторный русль, что способствует сохранению селезенки с неповрежденными кровеносными сосудами. - Переложите селезенку в центрифужную пробирку объемом 50 мл, заполненную физиологическим раствором, и храните ее в морозильной камере при температуре -80 °C.
ПРИМЕЧАНИЕ: Селезенка и венозный катетер, вставленные в селезеночную артерию, будут криоконсервированы вместе для удобного соединения во время экспериментов по перфузии.
2. Децеллюляризация селезенки
- Повторите цикл замораживания-размораживания 3 раза в стерильном контейнере, чтобы лизировать клетки селезенки.
ПРИМЕЧАНИЕ: Цикл замораживания-оттаивания — это физический метод, используемый для децеллюляризации каркаса. Ткань селезенки помещают в морозильную камеру при температуре -80 °C на ночь для замораживания, затем вынимают из низкотемпературной среды и помещают на водяную баню комнатной температуры или 37 °C для размораживания. Этот процесс замораживания и размораживания повторяется 3-6 раз, что разрушает клеточные мембраны и приводит к лизису клеток. - Установите систему перфузии на чистом столе, состоящем из перистальтического насоса, резервуара объемом 2 л, силиконовой трубки с внутренним диаметром 2,4 мм и пузырьковой ловушки (рис. 1).
- Заполните систему перфузии деионизированной водой (ddH2O) и держите ее включенной в течение 10 минут.
- Осторожно переложите собранную селезенку в контейнер, заполненный ddH2O.
- Подсоедините силиконовую трубку к венозному катетеру, который был введен в селезеночную артерию.
- Начинают перфузию с ddH2O со скоростью 2 мл/мин в течение 30 мин.
- Продолжайте перфузию с ddH2O со скоростью 4 мл/мин в течение 30 мин.
- Перфузируйте 0,1% (мас./об.) раствором SDS в течение 4 ч.
- Перфузируйте 1% (v/v) раствором Triton X-100 в течение 2 ч.
- Перфузируйте PBS со скоростью 4 мл/мин в течение 4 ч, чтобы промыть DSM.
ПРИМЕЧАНИЕ: Использование перистальтического насоса для однонаправленной перфузии всех жидкостей. - После завершения перфузии перевязать и пересечь сосудистые ветви между поджелудочной железой и селезенкой, а затем удалить поджелудочную железу. Храните DSM в чистой и герметичной центрифужной пробирке объемом 50 мл, пропитанной PBS, содержащей 10% пенициллин-стрептомицин, при -20 °C до тех пор, пока не будет готова к использованию в будущих экспериментах.
Результаты
В этом протоколе использовалась комбинация повторяющихся циклов замораживания-оттаивания и перфузии с децеллюляризирующими реагентами для децеллюляризации селезенки крыс. Полная децеллюляризация селезенки была достигнута примерно через 11 ч (рис. 2A). На протяжении всего процесса децеллюляризации цвет селезенки постепенно переходил от темно-красного к пятнистой, светло-красной и, в конечном итоге, к белому полупрозрачному виду (рис. Общая морфология оставалась относительно нетронутой, с видимыми сосудистыми структурами (Рисунок 2B).
Окрашивание гематоксилин-эозином подтвердило удаление клеточных компонентов, выявив неповрежденный ВКМ в DSM. Это резко контрастирует с нативной селезенкой, как показано на рисунке 3А, где видны клеточные ядра и цитоплазматические элементы. Отсутствие клеток было дополнительно подтверждено с помощью окрашивания 4',6-диамидино-2-фенилиндола (DAPI) и измерения остаточной ДНК (DSM: 10,1 ± 4 нг/мг сухого веса, нативная селезенка: 6200 ± 300 нг/мг сухого веса). Сканирующие электронно-микроскопические изображения выявили ультраструктурную характеристику DSM, которая показала сотовую структуру после полного удаления лимфоцитов из селезенки (рис. 3C). Это указывало на то, что децеллюляризация селезенки сохранила нормальную ультраструктуру и архитектуру селезенки. Для более полной оценки важнейших белков ECM, присутствующих в DSM, использовали трихром Массона (рис. 3B) и иммунофлуоресцентное окрашивание. В частности, для анализа были выбраны коллаген I (рисунок 3D) и фибронектин (рисунок 3E). Результаты показали, что как структурные, так и базальные мембранные компоненты ECM были сохранены аналогично нативной селезенке.

Рисунок 1: Экспериментальная установка. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
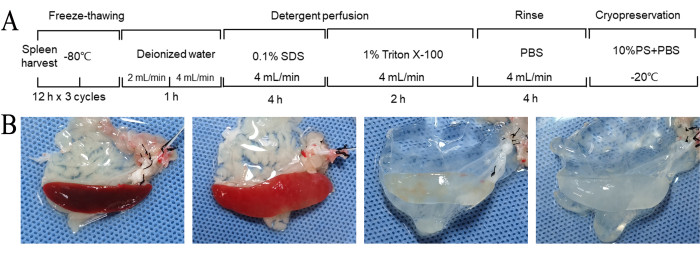
Рисунок 2: Рабочий процесс децеллюляризации и грубых морфологических изменений. (A) Рабочий процесс подготовки децеллюляризованного матрикса селезенки. Полная децеллюляризация селезенки достигалась примерно через 11 ч. (В) Грубые морфологические изменения селезенки во время подготовки ДСМ. Во время этого процесса цвет селезенки постепенно переходил от темно-красного к пестрому, светло-красному и, в конечном итоге, к белому полупрозрачному виду. (В) 1. После повторных циклов замораживания-оттаивания и перед децеллюляризацией. 2. После промывки деионизированной водой в течение 1 ч. 3. После перфузии с СДС в течение 4 ч. 4. После перфузии Тритоном в течение 2 ч. Сокращения: DSM = децеллюляризованная матрица селезенки; SDS = додецилсульфат натрия; PBS = фосфатно-солевой буфер; PS = пенициллин-стрептомицин. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3: Морфологические наблюдения децеллюляризованной матрицы селезенки. (A) Окрашивание H&E; (Б) трихромное окрашивание Массона; (C) SEM; (Д,Д) Иммунофлуоресцентное окрашивание коллагена I и фибронектина; (F) Окрашивание DAPI. Масштабные линейки = 50 μм (A, B, D-F), 5 μм (C). Сокращения: DSM = децеллюляризованная матрица селезенки; H&E = гематоксилин-эозин; SEM = сканирующая электронная микроскопия; DAPI = 4',6-диамидино-2-фенилиндол. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
БАЛ представляют собой эффективный подход к лечению терминальной стадии заболевания печени, особенно в тех случаях, когда трансплантация печени затруднена из-за текущей нехватки донорских органов6. Многообещающим вариантом создания БАЛ является использование ДЛМ, который сохраняет естественную ВКМ и сосудистую структуру нативной печени. Однако дефицит ДЛМ у человека и потенциальные риски инфекции и иммуногенности, связанные с ДЛМ у животных, создают значительные ограничения. Для решения этой проблемы мы предлагаем новую стратегию, которая включает в себя использование децеллюляризованной матрицы селезенки (DSM) в качестве альтернативного каркаса для БАЛ 8,9,10,11. Селезенка более доступна в различных клинических сценариях и демонстрирует схожие характеристики с печенью. В данной работе представлены подробные методы забора селезенки крыс и приготовления ДСМ, сохраняющие микроструктуры и компоненты ВКМ.
Идеальный метод децеллюляризации должен был бы удалить клеточные компоненты, сохранив при этом первоначальную структуру, состав и механические свойства ECM 12,13,14. Методы децеллюляризации охватывают физическую, химическую и ферментативную обработку, каждая из которых имеет свои преимущества инедостатки. Хотя эти методы могут частично удалять клеточные компоненты, они также могут поставить под угрозу состав, структуру и функциональность оставшейся ВКМ. На качество децеллюляризации могут влиять вариации плотности клеток, толщины матрикса и морфологии тканей в различных тканевых источниках.
На сегодняшний день не существует золотого стандарта для процесса децеллюляризации. Как правило, простого использования любого из этих методов недостаточно для минимизации неблагоприятного воздействия на ВКМ и максимального удаления клеточного содержимого. Следовательно, наиболее эффективный подход опирается на характеристики ткани, что требует комбинации этих методов. В этом исследовании мы использовали протокол, который сочетал физические методы (циклы замораживания-размораживания и перфузии) с химическими методами (SDS и TritonX-100) для децеллюляризации селезенки крыс.
Циклы замораживания-оттаивания способствуют лизису клеток и быстрому отделению клеток от ECM16. В то же время перфузия через нативную сосудистую сеть значительно повышает эффективность децеллюляризации и сохраняет исходную сосудистую сеть17. Додецилсульфат натрия (SDS), функционирующий как ионное детергентное средство, эффективно растворяет как клеточные, так и ядерные мембраны, что приводит к более полному удалению цитоплазматических и ядерных компонентов. Однако этот процесс также наносит ущерб ультраструктуре ВКМ из-за истощения гликозаминогликанов (ГАГ) и коллагена.
Повышенные концентрации SDS коррелировали с уменьшением остаточного содержания ДНК и снижением механической прочности в каркасе ECM. И наоборот, более низкие концентрации SDS сохраняли большее количество коллагена и индуцировали меньшую денатурацию белков ECM. Напротив, Triton X-100, выступая в качестве неионогенного детергента, эффективно разрушает липид-липидные, липид-белковые и ДНК-белковые взаимодействия, предлагая более мягкий подход к растворению клеточной мембраны. Тем не менее, он оказывается недостаточным для полного удаления клеточных ядер и ДНК. Поэтому его необходимо сочетать с низкими концентрациями SDS и физическими обработками, чтобы обеспечить полное удаление клеточных компонентов при сохранении первоначальной структуры, состава и производительности ECM. Важно отметить, что остаточные моющие средства могут обладать определенной цитотоксичностью, поэтому перед хранением необходимо промыть стерильным PBS или дистиллированной водой.
Одним из ограничений этого протокола является отсутствие количественной оценки остаточного SDS и Triton X-100. Это решение основано как на опыте нашей команды, так и на подтверждающих отчетах, которые свидетельствуют о том, что для эффективного удаления этих веществ достаточно 4-часовой мойки PBS. Кроме того, наши предыдущие эксперименты на клеточных культурах с использованием этого протокола не продемонстрировали каких-либо признаков цитотоксичности. Чтобы свести к минимуму расходы на протокол, был сделан сознательный выбор отказаться от количественного определения остаточных моющих средств.
В заключение, этот протокол представляет собой осуществимый метод подготовки ДСМ, демонстрирующий эффективность, стабильность и минимальную инвазивность. ДСМ, подготовленные с использованием этого протокола, сохраняют присущую селезенке архитектуру, состав и естественную сосудистую сеть. Кроме того, он предлагает каркас для имплантации клеток и трехмерной динамической культуры, тем самым создавая основу для продвижения исследований в тканеинженерной печени.
Раскрытие информации
Авторы заявили об отсутствии конфликта интересов.
Благодарности
Эта работа была поддержана Национальным фондом естественных наук Китая (82000624), Программой фундаментальных исследований в области естественных наук провинции Шэньси (2022JQ-899 и 2021JM-268), Программой поддержки инновационного потенциала провинции Шэньси (2023KJXX-030), Совместным проектом Университета ключевых исследований и разработок провинции Шэньси (2021GXLH-Z-047), Институциональным фондом Первой аффилированной больницы Сианьского университета Цзяотун (2021HL-42 & 2021HL-21).
Материалы
| Name | Company | Catalog Number | Comments |
| Anesthesia Machine | Harvard Apparatus | tabletop | animal anesthesia |
| bubble trap | Shandong Weigao Group Medical Polymer Co., Ltd. | pore diameter: 5 μm | prevent air bubbles |
| Buprenorphine | TIPR Pharmaceutical Responsible Co.,Ltd | an analgesic | |
| Hemostatic Forceps | Shanghai Medical Instruments Co., Ltd | J31020 | surgical tool |
| Heparinized Saline | SPH No.1 Biochemical & Pharmaceutical Co., LTD | prevent the formation of thrombosis | |
| Isoflurane | RWD life Science Co. | anesthetic:for the induction and maintenanceof anesthesia | |
| Penicillin-Streptomycin | Beyotime Biotechnology Co., Ltd. | C0222 | antibiotics in vitro to prevent microbial contamination |
| Peristaltic Pump | Baoding Longer Precision Pump Co., Ltd. | BT100-1L | |
| Phosphate-Buffered Saline | Shanghai Titan Scientific Co., Ltd. | 4481228 | phosphoric acid buffer salt solution |
| Silicone Tube | Baoding Longer Precision Pump Co., Ltd. | 2.4×0.8mm | |
| Silk Suture | Yangzhou Jinhuan Medical Instrument Factory | 6-0 and 3-0 | ligate blood vessels |
| Sodium Dodecyl Sulfate | Shanghai Titan Scientific Co., Ltd. | 151-21-3 | ionic detergent, dissolves both cell and nuclear membranes |
| Syringe Pump | Shenzhen Mindray Bio-Medical Electronics Co., Ltd | BeneFusion SP5 | intravenous infusion |
| Triton X-100 | Shanghai Titan Scientific Co., Ltd. | 9002-93-1 | non-ionic detergent, disrupts lipid-lipid, lipid-protein, and DNA-protein interactions |
| Venous Catheter | B. Braun Company | 24G | inserting the spleen artery |
Ссылки
- Xu, X. State of the art and perspectives in liver transplantation. Hepatobiliary Pancreat Dis Int. 22 (1), 1-3 (2023).
- Hautz, T., et al. Immune cell dynamics deconvoluted by single-cell RNA sequencing in normothermic machine perfusion of the liver. Nat Commun. 14 (1), 2285(2023).
- Cardini, B., et al. Live confocal imaging as a novel tool to assess liver quality: insights from a murine model. Transplantation. 104 (12), 2528-2537 (2020).
- Ding, Y., et al. Mesenchymal stem cell-derived exosomes: a promising therapeutic agent for the treatment of liver diseases. Int J Mol Sci. 23 (18), 10972(2022).
- Yaghoubi, A., et al. Prednisolone and mesenchymal stem cell preloading protect liver cell migration and mitigate extracellular matrix modification in transplanted decellularized rat liver. Stem Cell Res Ther. 13 (1), 36(2022).
- Uygun, B. E., et al. Organ reengineering through development of a transplantable recellularized liver graft using decellularized liver matrix. Nat Med. 16 (7), 814-820 (2010).
- Xiang, J., et al. The effect of riboflavin/UVA cross-linking on anti-degeneration and promoting angiogenic capability of decellularized liver matrix. J Biomed Mater Res A. 105 (10), 2662-2669 (2017).
- Liu, P., et al. Implantation strategy of tissue-engineered liver based on decellularized spleen matrix in rats. J South Med Univ. 38 (6), 698-703 (2018).
- Xiang, J., et al. Decellularized spleen matrix for reengineering functional hepatic-like tissue based on bone marrow mesenchymal stem cells. Organogenesis. 12 (3), 128-142 (2016).
- Gao, R., et al. Hepatocyte culture in autologous decellularized spleen matrix. Organogenesis. 11 (1), 16-29 (2015).
- Liu, P., et al. Hemocompatibility improvement of decellularized spleen matrix for constructing transplantable bioartificial liver. Biomed Mater. 14 (2), 25003(2019).
- Somuncu, Ö Decellularization concept in regenerative medicine. Adv Exp Med Biol. 1212, 71-85 (2020).
- Neishabouri, A., Soltani, K. A., Daghigh, F., Kajbafzadeh, A. M., Majidi, Z. M. Decellularization in tissue engineering and regenerative medicine: evaluation, modification, and application methods. Front Bioeng Biotech. 10, 805299(2022).
- Brown, M., Li, J., Moraes, C., Tabrizian, M., Li-Jessen, N. Decellularized extracellular matrix: New promising and challenging biomaterials for regenerative medicine. Biomaterials. 289, 121786(2022).
- Gui, L., Muto, A., Chan, S. A., Breuer, C. K., Niklason, L. E. Development of decellularized human umbilical arteries as small-diameter vascular grafts. Tissue Eng Pt A. 15 (9), 2665-2676 (2009).
- Li, T., Javed, R., Ao, Q. Xenogeneic decellularized extracellular matrix-based biomaterials For peripheral nerve repair and regeneration. Curr Neuropharmacol. 19 (12), 2152-2163 (2021).
- Crapo, P. M., Gilbert, T. W., Badylak, S. F. An overview of tissue and whole organ decellularization processes. Biomaterials. 32 (12), 3233-3243 (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены