Method Article
Burada: Planta Moso Bambu Yapraklarında Gen İfadesi ve Gen Düzenleme
Bu Makalede
Özet
Bu çalışmada, bambuda Agrobacterium'un aracılık ettiği planta gen ekspresyonu ve gen düzenleme yönteminde yeni bir yöntem geliştirilmiştir. Bu yöntem, bambu ıslah sürecini hızlandırmak için önemli etkileri olan bambuda gen fonksiyon doğrulamasının verimliliğini büyük ölçüde artırdı.
Özet
Bambu için, zaman alıcı ve emek yoğun kallus indüksiyonu ve rejenerasyon işlemlerine olan ihtiyacı ortadan kaldıran yeni bir planta gen dönüşüm yöntemi geliştirilmiştir. Bu yöntem, bambu fideleri için yaralama ve vakum yoluyla Agrobacterium aracılı gen ekspresyonunu içerir. Bambu yapraklarında RUBY raportörü ve Cas9 geni gibi eksojen genlerin ekspresyonunu başarıyla gösterdi. RUBY fidelerinde betalain birikimi için en yüksek dönüşüm verimliliği, enfeksiyondan sonra% 85.2'lik bir yüzde ile GV3101 suşu kullanılarak elde edildi. Yabancı DNA, bambu genomuna entegre olmamasına rağmen, yöntem eksojen genleri ifade etmede etkiliydi. Ayrıca, bu yöntem kullanılarak doğal bir raportör ile bir gen düzenleme sistemi de geliştirilmiştir ve bundan, bambu yapraklarında düzenlenmiş bambu violaksantin de-epoksidaz geni (PeVDE) tarafından üretilen ve %17.33'lük bir mutasyon oranına sahip bir in situ mutant elde edilmiştir. PeVDE'nin mutasyonu, bir florometre ile doğru bir şekilde tespit edilebilen, yüksek ışık altında fotokimyasal olmayan söndürme (NPQ) değerlerinin azalmasına neden oldu. Bu, düzenlenmiş PeVDE'yi bambudaki hem eksojen hem de endojen genler için potansiyel bir yerli raportör yapar. PeVDE raportörü ile bir sinnamoil-CoA redüktaz geni, %8.3'lük bir mutasyon oranıyla başarılı bir şekilde düzenlendi. Bu işlem, bambuda eksojen genleri ve endojen gen düzenlemesini eksprese etmek için hızlı ve verimli olan doku kültürü veya kallus indüksiyonu sürecini önler. Bu yöntem, gen fonksiyon doğrulamasının verimliliğini artırabilir ve bambudaki temel metabolik yolların moleküler mekanizmalarını ortaya çıkarmaya yardımcı olacaktır.
Giriş
Bambudaki gen fonksiyonunun araştırılması, bambunun ileri düzeyde anlaşılması ve genetik modifikasyon potansiyelinin ortaya çıkarılması için büyük umut vaat ediyor. Bunun etkili bir yolu, bambu yapraklarında Agrobacterium aracılı enfeksiyon süreci ile elde edilebilir, bu sayede eksojen genleri içeren T-DNA fragmanı hücrelere sokulur ve daha sonra yaprak hücreleri içindeki genlerin ekspresyonuna yol açar.
Bambu, imalat, sanat ve araştırmada geniş bir uygulama yelpazesine sahip değerli ve yenilenebilir bir kaynaktır. Bambu, yüksek mekanik mukavemet, tokluk, orta sertlik ve esneklik 1 gibi mükemmel ahşap özelliklerine sahiptir ve şu anda diş fırçaları, pipetler, düğmeler, tek kullanımlık sofra takımları, yeraltı boru hatları ve termal enerji üretimi için soğutma kulesi dolguları dahil olmak üzere çeşitli evve endüstriyel malzemelerde yaygın olarak kullanılmaktadır. Bu nedenle, bambu yetiştiriciliği, plastiklerin yerini almak ve plastik kullanımını azaltmak, çevreyi korumak ve iklim değişikliğiyle mücadele etmek için mükemmel ahşap özelliklere sahip bambu çeşitlerinin elde edilmesinde ve ayrıca önemli ekonomik değer yaratmada çok önemli bir rol oynamaktadır.
Bununla birlikte, geleneksel bambu yetiştiriciliği, uzun vejetatif büyüme aşaması ve belirsiz çiçeklenme dönemi nedeniyle zorluklarla karşı karşıyadır. Moleküler ıslah teknikleri geliştirilmiş ve bambu ıslahına uygulanmış olsa da, bambu gen dönüşümü süreci, kallus indüksiyonu ve rejenerasyon süreçlerinedeniyle zaman alıcı, emek yoğun ve karmaşıktır 2,3,4,5. Stabil genetik dönüşüm genellikle kallus indüksiyonu ve rejenerasyonu gibi doku kültürü süreçlerini içeren Agrobacterium aracılı yöntemler gerektirir. Bununla birlikte, bambu, kallus rejenerasyonu için düşük bir yeteneğe sahiptir ve bambuda kararlı genetik dönüşümün uygulanmasını büyük ölçüde sınırlar. Agrobacterium bitki hücrelerini enfekte ettikten sonra, T-DNA fragmanı bitki hücrelerine girer ve T-DNA fragmanlarının çoğu hücrelere entegre olmadan kalır ve bu da geçici ekspresyona neden olur. T-DNA fragmanlarının sadece küçük bir kısmı rastgele kromozomuna entegre olur ve bu da kararlı ekspresyona yol açar. Geçici ekspresyon seviyeleri, Agrobacterium tarafından verilen bir T-DNA'dan eksprese edilen her gen için değişebilen bir birikim eğrisi gösterir. Çoğu durumda, en yüksek ekspresyon seviyeleri infiltrasyondan 3-4 gün sonra ortaya çıkar ve 5-6 gün sonra hızla azalır 6,7. Önceki çalışmalar, direnç için seleksiyon baskısı olmadan elde edilen gen düzenlenmiş bitkilerdeki mutasyonların 1/3'ünden fazlasının CRISPR/Cas9'un geçici ekspresyonundan geldiğini, geri kalan 2/3'ünden daha azının ise DNA'nın genom8'e entegrasyonundan sonra kararlı ekspresyondan geldiğini göstermiştir. Bu, gen düzenleme için T-DNA'nın bitki genomuna entegrasyonunun gerekli olmadığını gösterir. Ayrıca, direnç için seleksiyon baskısı, enfekte eksplantların rejenerasyon sürecini doğrudan etkileyen, transgenik olmayan hücrelerin büyümesini önemli ölçüde inhibe eder. Bu nedenle, bambuda direnç için seleksiyon baskısı olmadan geçici ekspresyon kullanarak, eksojen genlerin entegre olmayan ekspresyonunu elde etmek ve gen fonksiyonunu doğrudan bitki organlarında incelemek mümkündür. Bu nedenle, bambu9'da eksojen gen ekspresyonu ve düzenlenmesi için kolay ve zaman kazandıran bir yöntem geliştirilebilir.
Geliştirilen eksojen gen ekspresyonu ve gen düzenleme yöntemi, basitliği, maliyet etkinliği ve pahalı ekipman veya karmaşık prosedürlerin olmaması ile karakterize edilir9. Bu yöntemde, bambu endojen violaksantin de-epoksidaz geni (PeVDE), seleksiyon baskısı olmaksızın eksojen gen ekspresyonu için raportör olarak kullanıldı. Bunun nedeni, bambu yapraklarındaki düzenlenmiş PeVDE'nin yüksek ışık altında foto koruma yeteneğini azaltması ve klorofil floresan görüntüleme ile tespit edilebilen fotokimyasal olmayan söndürme (NPQ) değerinde bir azalma göstermesidir. Bu yöntemin etkinliğini göstermek için, başka bir bambu endojen geni olan sinnamoil-CoA redüktaz geni (PeCCR5)9, bu sistem kullanılarak nakavt edildi ve bu genin mutantlarını başarıyla üretti. Bu teknik, bambu yapraklarında işlevleri olan genlerin fonksiyonel karakterizasyonu için kullanılabilir. Bu genleri bambu yapraklarında geçici olarak aşırı eksprese ederek, ekspresyon seviyeleri arttırılabilir veya gen düzenleme ile ekspresyonları düşürülebilir, bu da aşağı akış gen ekspresyon seviyelerinin, yaprak fenotiplerinin ve ürün içeriklerinin incelenmesine izin verir. Bu, bambuda gen fonksiyonu araştırması için daha verimli ve uygulanabilir bir yaklaşım sağlar. Bu teknik, bambu yapraklarında işlev gören genlerin fonksiyonel karakterizasyonuna uygulanabilir. Bu genleri bambu yapraklarında geçici olarak aşırı eksprese ederek, ekspresyon seviyeleri arttırılabilir veya gen düzenleme ile ekspresyonları düşürülebilir, bu da aşağı akış gen ekspresyon seviyelerinin, yaprak fenotiplerinin ve ürün içeriklerinin incelenmesine izin verir. Ek olarak, kapsamlı poliploidizasyon nedeniyle, bambu genomlarındaki ticari açıdan önemli genlerin çoğunun birden fazla kopyada bulunduğunu ve bunun da genetik fazlalığa neden olduğunu belirtmek önemlidir. Bu, bambuda multipleks genom düzenlemesi yapmak için bir zorluk teşkil ediyor. Kararlı genetik transformasyon veya gen düzenleme tekniklerinin uygulanmasından önce, gen fonksiyonlarını hızlı bir şekilde doğrulamak çok önemlidir. Çoklu gen kopyaları konusunu ele alırken, bir yaklaşım, belirli aşamalarda aktif olarak eksprese edilen genleri tanımlamak için transkriptom ekspresyon profillerini analiz etmektir. Ayrıca, bu gen kopyalarının korunmuş fonksiyonel alanlarını hedeflemek, ortak hedef dizilerin tasarımına veya birden fazla hedef bölgenin aynı CRISPR / Cas9 vektörüne dahil edilmesine izin vererek, bu genlerin aynı anda nakavt edilmesini sağlar. Bu, bambuda gen fonksiyonu araştırması için daha verimli ve uygulanabilir bir yaklaşım sağlar.
Protokol
1. Bambu fidelerinin hazırlanması
- Guilin, Guangxi, Çin'de hasat edilen tohumları kullanarak moso bambu (Phyllostachys edulis) fideleri hazırlayın. Tohumları 2-3 gün suda bekleterek başlayın, suyu günlük olarak değiştirdiğinizden emin olun. Ardından, toprak ve vermiküliti 3:1 oranında karıştırarak bir alt tabaka oluşturun.
- Islatılmış tohumları çimlenme için alt tabakaya ekin. Fideleri laboratuvar koşullarında, sıcaklığı 18-25 °C arasında tutarak muhafaza edin. Işık fazı sırasında 250-350 μmol/m2/s ışık yoğunluğuna sahip 16 saat ışık/8 saat karanlık fotoperiyot sağlayın.
- Bağıl nemi yaklaşık% 60 oranında koruyun. Agrobacterium enfeksiyonu için, dönüşüm için en iyi aşama olan 15 günlük ve 2-10 cm yüksekliğe sahip fideler kullanın.
NOT: Bambu çiçeklenmesi tahmin edilemez olduğundan, tohumlar her yıl mevcut değildir. Tohumlar genellikle kuru bir ortamda 4 °C'de 2-3 yıl saklanır ve yine de %20'nin üzerinde bir canlılığı koruyabilir.
2. Plazmitlerin ve Agrobacterium'un hazırlanması
- Plazmitler: Geçici ekspresyon etkisini doğrulamak için, CaMV 35S promotörü10 tarafından yönlendirilen görünür bir raportör geni içeren pHDE-35S::RUBY yapısını kullanın. Gen düzenleme için, mısır Ubi promotörü11 tarafından yönlendirilen Cas9 genini taşıyan pCambia1300-Ubi::Cas9 yapısını kullanın. PeVDE ve diğer hedef genlerin sgRNA kılavuz dizilerini pCambia1300-Ubi::Cas9 yapı9'daki iki AarI bölgesi arasına yerleştirin.
- CRISPR/Cas9 kılavuz RNA dizilerini, PeVDE ve PeCCR5 hedef genleri dahil olmak üzere pCambia1300-Ubi::Cas9 yapısının iki AarI kısıtlama endonükleaz bölgesi arasına yerleştirin.
- 20 nükleotid dizisinin 5' ucuna GGCA ekleyin ve tek sarmallı bir DNA dizisi sentezleyin. 20 nükleotid dizisini ters tamamlayın ve 5' ucuna AAAC ekleyin, ardından başka bir tek sarmallı DNA dizisi sentezleyin.
- Her iki tek sarmallı DNA dizisini seyreltilmiş suda 10 nM/L konsantrasyona seyreltin, iyice karıştırın ve 95 °C'de 5 dakika ısıtın. Karışımın oda sıcaklığına soğumasını bekleyin, bu da çift telli adaptörlerin oluşmasına neden olur.
- Adaptörleri, T4 DNA ligaz kullanılarak AarI endonükleaz tarafından sindirilen doğrusal pCambia1300-Ubi::Cas9 fragmanına bağlayın ve istenen gen hedefleme yapısını elde etmek için yapılandırılmış CRISPR/Cas9 vektörünü sıralayın.
- Plazmitleri Agrobacterium'a dönüştürmek için donma-çözülme yöntemini aşağıdaki gibi kullanın: 1 μL plazmitleri (konsantrasyon: 10 - 1.000 ng/μL) 100 μL Agrobacterium-yetkin hücrelerle (translasyon verimliliği: > 1 x 10 4 koloni oluşturan birim/μg) karıştırın ve hafifçe karıştırın. Karışımı 5 dakika buz üzerine koyun. Karışımı 5 dakika boyunca sıvı nitrojene aktarın.
- Karışımı 37 °C'lik bir su banyosunda 5 dakika çözdürün. Karışıma 500 μL Luria-Bertani (LB) ortamı ekleyin ve 28 ° C'de 200 rpm'de 2-3 saat çalkalayan bir inkübatörde inkübe edin. pHDE-35S::RUBY plazmitleri için, bunları Agrobacterium tumefaciens'in (A. tumefaciens)12 AGL1, GV3101, LBA4044 ve EHA105 suşlarına ayrı ayrı sokun. CRISPR/Cas9 plazmitleri için, bunları A. tumefaciens'in GV3101 suşuna sokun.
- Agrobacterium'u maya özü pepton (YEP) ortamında (10 g sığır eti özü, 10 g maya özü ve L başına 5 g NaCl) karşılık gelen antibiyotiklerle (35S için spektinomisin::RUBY ve CRISPR/Cas9 için kanamisin) 28 °C'de büyütün. Tek koloniler ekimden 36-48 saat sonra gözlendi.
- Daha fazla büyüme için kolonileri seçin ve sıvı YEP ortamına (karşılık gelen antibiyotiklerle birlikte) aktarın. 24-36 saat sonra, plazmitlerin Agrobacterium'a başarılı bir şekilde aktarıldığını doğrulamak için PCR gerçekleştirmek için RUBY-F ve RUBY-R (Tablo 1) primerlerini kullanın.
- Başarılı bir şekilde dönüştürülmüş Agrobacterium'un 1 mL'sini 100 mL taze sıvı YEP ortamına (karşılık gelen antibiyotiklerle birlikte) aktarın ve daha sonra gece boyunca 28 ° C'de 0.8'lik bir OD600'e büyütün.
- Bakteriyel süspansiyonu 4.000 x g'da 4 °C'de 5 dakika santrifüjleyin, bakteri peletini süspansiyon infiltrasyon ortamıyla (10 mM MgCl2 ve 10 mM MES-KOH [pH 5.6]) bir kez yıkayın ve ardından tekrar santrifüjleyin. Bambu dönüşümü için bir süspansiyon infiltrasyon ortamında bakteri peletini 0.6'lık bir OD600'e yeniden süspanse edin.
3. Bitki dönüşüm sisteminde agrobakteri aracılı
- Dönüşüme hazırlanın; Kökleri toprağa bağlı olan fideleri alt tabakadan dikkatlice çıkarın ve köklerin sağlam kalmasını sağlayın. Nemi korumak ve toprağın ayrılmasını önlemek için fideleri kalay folyo ile sarın (Şekil 1A).
- Sarılmış fideleri 2 saat süreyle daha yüksek nemli (bağıl hava nemi %>90) ve daha düşük aydınlatmalı (yoğunluğu 50 μmol/m2/s'den az yoğunluk) bir ortama aktarın.
- Bir şırıngadan keskin bir iğne kullanarak, bambu fidelerinin kıvrılmış olgunlaşmamış yapraklarının üst kısmını (üstten yaklaşık 1-2 cm) bir veya iki kez sarın ( Şekil 1A'daki kırmızı üçgenlerle gösterildiği gibi).
- Daha sonra, fidelerin yaralı üst kısmını Agrobacterium süspansiyonlarına batırın. Taze yara aşılama verimliliğini artıracağından, yaralamadan Agrobacterium'a daldırmaya kadar tüm süreci hızlı bir şekilde gerçekleştirin.
- Fideleri hemen 2 dakika boyunca 25-27 mmHg basınçla bir vakum odasına aktarın (Şekil 1B).
- Vakumladıktan sonra, fideleri dikkatlice açın ve alt tabakaya tekrar dikin. Fideleri 2 gün boyunca oda sıcaklığında (18-25 °C) loş ışıkta veya karanlıkta (<50 μmol/m2/s) yüksek nemli (RH>%90) yere yerleştirin. Daha sonra, fideleri normal büyüme koşulları altında kültürleyin ve her 5-7 günde bir sulayın. Sonraki deneyler için materyal sağlamak için fenotiplerini gözlemleyin.
4. Gen düzenleme için tek kılavuzlu RNA'ların (sgRNA'lar) tasarlanması
- Hedef gen dizisinin belirli ve korunmuş bir alanının yakınında bulunan bir protospacer bitişik motif (PAM) bölgesini tanımlayın. Bu CRISPR/Cas9 sisteminde belirli PAM dizisinin NGG olduğundan emin olun. Bambu genom veritabanında bir BlastN araması gerçekleştirerek seçilen dizinin hedef üzerindeki özgüllüğünü doğrulayın. sgRNA'nın özellikle yukarı akış bölgesinde ve PAM 9,11'e yakın benzersiz olduğundan emin olun.
NOT: Bu karşılaştırma, gen düzenleme sürecinden etkilenen genomdaki potansiyel hedef dışı bölgeleri etkili bir şekilde azaltacaktır. - PeVDE geni13'ün ilk ekzonu üzerinde iki sgRNA (sgRNA-1 ve sgRNA-2) tasarlayın. sgRNA-1'de PAM'ın yukarısındaki YaşI kısıtlama bölgelerini ve sgRNA-2'de PAM'ın yukarısındaki XbaI kısıtlama bölgelerini dahil edin. KNWYCYGK'nin korunmuş motifini kodlayan PeCCR5 geninin dördüncü ekzonu üzerinde bir sgRNA tasarlayın. Bu motif, CCR'lerin14'ün katalizi için kritik öneme sahiptir.
- PAM bölgesine bitişik bir 20 nükleotid ara dizisi tasarlayın. Bu ara parça dizisi, Cas9 enzimini DNA bölünmesi ve ardından gen düzenlemesi için hedef bölgeye yönlendirecektir.
NOT: PAM bölgesi içinde endonükleaz enzim bölünme bölgesinin yukarısında bir hedef bölge seçilmesi tavsiye edilir. Bu, gen düzenleme verimliliğinin doğrulanmasını kolaylaştıracaktır.
5. Astar tasarımı ve PCR
- PeVDE ve PeCCR5 fragmanlarının amplifikasyonu için özel primerleri manuel olarak tasarlayın. Elektroforez sırasında farklı bant ayrımına izin vermek için yukarı ve aşağı akış primerlerini, hedef bölgenin en az 100 bp dışına yerleştirilecek ve 100 bp'nin üzerinde bir uzunluk farkı olacak şekilde tasarlayın. Genin ilk 500 bp'si içinde RUBY'nin amplifikasyonu için primerler tasarlayın. Kullanılan tüm primerlerin bir listesi Tablo 1'de verilmiştir.
- PCR için yüksek kaliteli bir DNA polimeraz kullanın. Bu durumda, gen klonlamada yüksek sadakat ve verimli amplifikasyona sahip DNA polimeraz kullanın.
- PCR reaksiyon karışımını aşağıdaki gibi hazırlayın: 5x tampon (Mg2+ Plus): 4 μL; dNTP karışımı (her biri 2,5 mM): 1,6 μL; İleri ve geri primerler (her biri 10 pmol): her biri 1 μL; bambu genom DNA'sı (yaklaşık 50 ng); DNA Polimeraz (2.5 U/μL): 0.2 μL; Suyu toplam 20 μL hacme kadar seyreltin.
- PCR çalışma koşullarını takip edin: 98 °C'de 5 dakika boyunca ilk denatürasyon; 98 °C'de 10 saniye denatürasyon; 56 °C'de 5 sn tavlama; 72 °C'de 30 sn uzatma; 32 döngü boyunca denatürasyonu uzatmaya tekrarlayın; 72 °C'de 5 dakika son uzatma; 4 °C'de süresiz olarak tutun.
NOT: PCR koşulları örnek olarak verilmiştir ve belirli uygulamalar veya hedefler için optimize edilmesi gerekebilir.
6. DNA ekstraksiyonu, endonükleaz enzim sindirimi ve dizilimi
- Görüntüleme-PAM florometresi ile tanımlandığı gibi, makas kullanarak taze bambu yaprağı bıçaklarından daha düşük NPQ değerlerine sahip bölgeyi ayırın (bkz. adım 7.4). Yaprak numunelerini sıvı nitrojen ile dondurun ve donmuş yaprak numunelerini bir havanda aktarın. Numuneleri bir havaneli kullanarak ince bir toz haline getirin ve öğütme işlemi sırasında yeterli sıvı nitrojen ekleyin. Bu adım, DNA da dahil olmak üzere hücresel içeriğin serbest bırakılmasına yardımcı olur.
- Setiltrimetilamonyum Amonyum Bromür (CTAB) yöntemini kullanarak toz haline getirilmiş yapraktan genomik DNA'yı çıkarın. 800 μL'lik %2'lik bir CTAB çözeltisine 50 mg yaprak tozu numunesi ekleyin. Numuneyi iyice karıştırın ve her 5 dakikada bir hafifçe çalkalayarak 65 °C'de 30 dakika inkübe edin.
- Eşit hacimde kloroform/izoamil alkol (24:1, h/v) ekleyin ve karışımı kuvvetlice çalkalayın. 8.000 g'da 8 dakika santrifüjlendikten sonra, süpernatanı yeni bir tüpe aktarın.
- Eşit hacimde kloroform/izoamil alkol ekleyin ve adım 6.3'ü tekrarlayın. Eşit hacimde buz gibi soğuk izopropanol ekleyin ve 30 dakika boyunca -20 ° C'ye yerleştirilmeden önce tüpü birkaç kez ters çevirin. 5 dakika boyunca 8.000 x g'da santrifüjlemeden sonra, süpernatanı atın.
- DNA peletini 2x %75 etanol ile 4 °C'de yıkayın, ardından 50 μL suda çözün.
- Hem yabani tip hem de Agrobacterium ile enfekte olmuş bambu yapraklarından hedef genlerin hedef bölgesini içeren genomik DNA'yı adım 5.4'teki protokolle çoğaltın.
- PCR ürünlerinin endonükleaz enzim sindirimini gerçekleştirin. Amplifiye edilmiş DNA fragmanları içinde istenen kısıtlama bölgelerini tanıyan spesifik bir enzim seçin. Sindirim için AgeI ve XbaI endonükleazlarını kullanın.
- YaşI veya XbaI (20 birim/μL)- 1 μL, 1 μg PCR ürünleri, 10x tampon- 5 μL'den oluşan bir reaksiyon karışımı hazırlayın ve toplam 50 μL hacme su ekleyin. 37 °C'de 1 saat inkübe edin.
- Jel elektroforezi kullanarak sindirilmiş DNA parçalarının oranını analiz edin. Gen düzenleme verimliliğini değerlendirmek için vahşi tip ve Agrobacterium ile enfekte olmuş örneklerden sindirilmiş parçaları karşılaştırın.
- PeVDE ve PeCCR5 fragmanlarının 9,15 amplifikasyonu için transpozaz adaptörü TCGTCGGCAGCGTCAGATGTGTATAAGAGACAG ve GTCTCGTGGGCTCGGAGATGTGTATAAGAGACAG dizilerini sırasıyla ileri ve geri primerlerin 5' ucuna etiketleyin. Amplifikasyon için adım 5.4'te açıklanan protokolü kullanın. PCR ürünlerini (sindirimden önce) derin dizileme için hazırlayın.
7. Yapraklarda NPQ değerlerinin klorofil floresansının ölçülmesi
- Ölçümlerden önce, bambu fidelerini 2 saat boyunca 1200 μmol/m2/s'lik yüksek ışık yoğunluğu koşullarına maruz bırakın. Bu maruziyet, emilen ışık miktarını arttırır ve yapraklardaki fotokoruma sistemini harekete geçirir.
- Bambu yapraklarının in vivo PS II klorofil floresansını ölçmek için bir görüntüleme-PAM florometresi kullanın. 800 dakikalık floresan ölçümleri için aktinik ışık yoğunluğunu 2 μmol/m6/s'ye ayarlayın. Bu süre zarfında, klorofil floresan eğrileri elde etmek için her 30 saniyede bir doyurucu bir darbe uygulayın. Eğrilerin kararlı değerleri hesaplamalar için kullanılacaktır13.
- Aşağıdaki formülü kullanarak fotokimyasal olmayan söndürmeyi (NPQ) hesaplayın:
NPQ = (F m - F m') / F m'
burada F m, karanlığa uyarlanmış durumda maksimum floresansı temsil eder ve Fm', ışığa uyarlanmış herhangi bir durumda maksimum floresansı temsil eder. - NPQ değerlerini görüntüleme yazılımının görsel arayüzünden izleyin. Yazılım, NPQ değerleri de dahil olmak üzere floresan verilerinin gerçek zamanlı analizine ve görüntülenmesine izin verir.
Sonuçlar
Bambu yapraklarında planta gen ekspresyonunda agrobakteri aracılı
RUBY raportör geninin, tirozin10'dan canlı kırmızı betalain üretme kabiliyeti nedeniyle geçici gen ekspresyonunu görselleştirmede etkili olduğu gösterilmiştir. Bu çalışmada, bambu yapraklarında eksojen RUBY genini geçici olarak eksprese etmek için Agrobacterium aracılı transformasyon kullanılmıştır (Şekil 1). Enfeksiyondan sonraki 3. günlerde, olgunlaşmamış katlanmış yapraklarda kırmızı renklenme gözlendi ve yapraklar açıldıktan sonra 5. günde daha canlı hale geldi (mavi üçgen, Şekil 1C). Bu sonuçlar, Agrobacterium'un bambu yapraklarında eksojen RUBY geninin ekspresyonuna başarılı bir şekilde aracılık ettiğini ve betalain sentezinin gerçekleştiğini göstermektedir.
Ayrıca, dört Agrobacterium suşu (AGL1, LBA4404, EHA105 ve GV3101) karşılaştırıldı ve GV3101 suşunun enfekte bambu yapraklarında en önemli betalain birikimine neden olduğunu, fidelerin en yüksek yüzdesinin %85.2'sinin enfekte olduktan sonra betalain biriktirdiğini, ardından AGL1 (%76.9) ve ardından EHA105 (%49.1) ve LBA4404 (%31.3; Şekil 1D). Bu, GV3101'in bu amaç için en uygun tür olduğunu göstermektedir. Agrobacterium aracılı T-DNA fragmanının bambu kromozomuna entegre olup olmadığını tespit etmek için yüksek kaliteli PCR yapıldı. 40 PCR döngüsünden sonra, RUBY geninin hiçbir bandı tespit edilmedi, bu da T-DNA fragmanının entegre olmadığını veya tespit edilemeyecek kadar düşük bir sayıda entegre edildiğini gösteriyor. Bu nedenle, bu sonuçlar bu gen ekspresyonunun geçici olduğu sonucuna varmaktadır.
Genel olarak, bu bulgular, RUBY raportör geni kullanılarak bambudaki planta gen ekspresyonunda Agrobacterium aracılı geçici maddenin fizibilitesini göstermektedir. Bununla birlikte, kırmızı betalain renginin kararsız olduğu ve 3 aylık enfeksiyondan sonra kaybolduğu bulundu, bu da geçici ekspresyon sisteminin uzun süreli gözlem için kararlı olmadığını gösteriyor.
Bambu viyolaksantin de-epoksidaz geninin (PeVDE) planta gen düzenlemesinde
Planta gen ekspresyonunda agrobakteri aracılı, bambuda geçici bir gen ekspresyonu yöntemidir. Geçici bir CRISPR / Cas9 sisteminin bambu yapraklarında gen düzenlemeyi başarıp başaramayacağını araştırmak için, bambunun ksantofil döngüsündeki anahtar enzim olan vimaksantin de-epoksidaz (PeVDE), deneme gen düzenlemesi için bir hedef olarak seçildi. Tek kılavuz RNA'lar (sgRNA'lar), gen düzenleme doğrulamasını kolaylaştırmak için protospacer bitişik motifinin (PAM) yukarı akışında YaşI'in kısıtlama bölgelerini içeren PeVDE geninin (sgRNA-1) ilk ekzonu üzerinde tasarlanmıştır (Şekil 2A).
sgRNA-1 taşıyan CRISPR/Cas9 yapısı, bambu yapraklarını dönüştürmek için Agrobacterium'a dönüştürüldü. 5 gün boyunca sgRNA-1 taşıyan CRISPR/Cas9 yapılarını içeren Agrobacterium'un enfeksiyonundan sonra, bambu fideleri yüksek ışık işlemine tabi tutuldu ve ardından klorofil floresan parametre tespiti yapıldı. Yaprak bıçaklarının belirli alanlarının daha düşük fotokimyasal olmayan söndürme (NPQ) değerlerine sahip olduğu bulunmuştur (Şekil 2B), bu alanların yoğun ışık altında foto koruma yeteneğinin azaldığını göstermektedir. PeVDE geni, aşırı emilen ışık enerjisinidağıtma kapasitesine sahip olduğundan 13, daha düşük NPQ değerlerine sahip bu alanların PeVDE geninin düzenlendiği bölgeler olması muhtemeldir. Daha sonra yaprak yapraklarının bu bölgelerindeki PeVDE gen fragmanının enzim sindirimi ve dizileme analizi yapıldı (Şekil 2C-D) ve sgRNA-1'in mutasyon oranının %17.33 olduğu bulundu, bu da gen düzenlemesinin PeVDE geninin bu alanlarında başarılı olduğunu gösteriyor.
Ek olarak, bir XbaI kısıtlama bölgesi içeren başka bir sgRNA hedefleme bölgesi olan sgRNA-2, PeVDE'nin ilk ekzonu üzerinde tasarlanmıştır. İkili sgRNA hedeflemesi ile uzun fragman delesyonu olasılığını araştırmak için, her iki hedef bölgede de gen düzenlemesi yapıldı ve bu da uzun fragman delesyonu ile sonuçlandı (Şekil 2E).
Geçici gen düzenleme sisteminde raportör olarak kullanılan düzenlenmiş PeVDE mutantı
PeVDE sgRNA'nın geçici gen düzenleme sisteminde bir raportör olarak hizmet edip edemeyeceği araştırıldı. Cinnamoil-CoA redüktaz (PeCCR5) geni (Gen Kimliği: PH02Gene42984.t1), PeVDE raportörünü değerlendirmek için rastgele seçildi. PeCCR5 için bir sgRNA hedefi, dördüncü ekzon üzerindeki korunmuş motifinde tasarlandı. Hem sgRNA'ları, PeVDE'yi hem de PeCCR5'i taşıyan CRISPR/Cas9 yapısı, bambu yapraklarına dönüştürüldü (Şekil 3A).
30 gün boyunca Agrobacterium enfeksiyonundan sonra, fideler 20 dakika boyunca yüksek yoğunluklu ışıkla muamele edildi. Sadece PeCCR5 geni için düzenlenen yaprak alanlarının NPQ değerleri üzerinde hiçbir etkisi olmadığı, hem PeVDE hem de PeCCR5'in sgRNA'ları tarafından transfekte edilen yaprak alanlarının daha düşük NPQ değerleri sergilediği gözlenmiştir (Şekil 3B).
Daha sonra, daha düşük NPQ değerlerine sahip yaprak alanlarından PeCCR5 fragmanı amplifiye edildi ve dizilendi ve derin dizileme kullanılarak %8.3'lük bir mutasyon etkinliği bulundu. Bu nedenle, PeVDE raporlayıcısı başarılı bir şekilde geçici bir gen düzenleme raportörü olarak görev yaptı ve diğer endojen bambu genlerinin gen düzenlemesini taramak için kullanılabilir.
Genel olarak, bu sonuçlar bambuda CRISPR / Cas9 kullanarak bambu gen düzenlemesinin fizibilitesini göstermektedir.
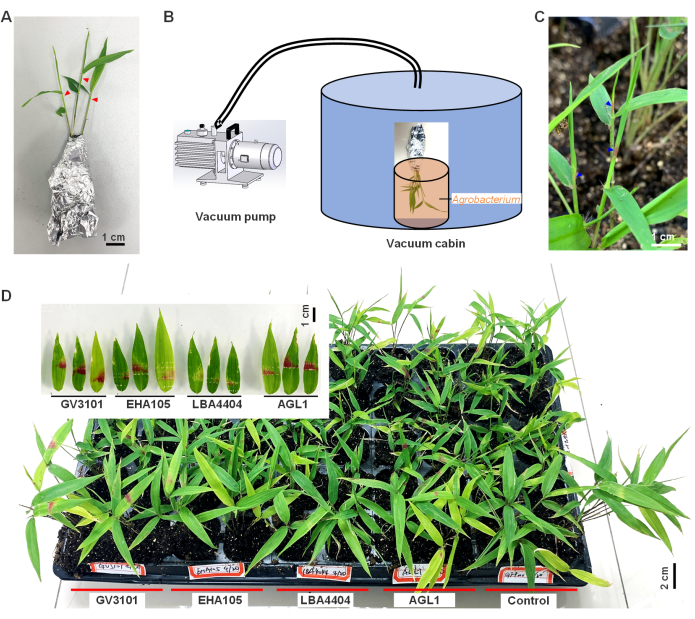
Şekil 1: RUBY geninin planta ekspresyonunda ve moso bambu yapraklarında betalain birikimi. (A) Kalay folyoya sarılmış ve Agrobacterium enfeksiyonuna hazır, bir şırıngadan keskin bir iğne ile yaralanmış pozisyonları gösteren kırmızı üçgenler ile Moso bambu fideleri. (B) Bambu fidelerinin vakumlu sızma işlemi. (C) Fenotipik değişikliklerle gözlenen 3 günlük enfeksiyondan sonra bambu yapraklarında betalain birikimi. (D) Burada, bambu yapraklarında dört Agrobacterium suşu, AGL1, LBA4404, EHA105 ve GV3101 aracılı RUBY gen dönüşümü gerçekleştirildi. GFP yapısını barındıran GV3101 negatif kontrol olarak kullanılmıştır. Bu rakam9'dan değiştirildi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Bambu yapraklarında PeVDE geninin planta ekspresyonu ve gen düzenlemesinde. (A) PeVDE genindeki sgRNA'nın yeri ve hedef dizi bilgisi. Kırmızı üçgenler, fragman amplifikasyonu için ileri ve geri primerlerin konumlarını gösterir. (B) NPQ ve enfeksiyondan sonra bambu yapraklarının ham görüntülenmesi. NPQ görüntüsündeki sayılar, görüntüleme yazılımı monitöründeki NPQ değerlerini temsil eder. (C) YaşI sindiriminden önce ve sonra PeVDE fragmanının elektroforez sonuçları. WT, yabani tip enfekte olmayan yaprakları belirtir ve + ve - sırasıyla YaşI sindirimi olan veya olmayan PeVDE fragmanlarını temsil eder. (D) Daha düşük NPQ değeri yapraklarında PeVDE fragmanının derin dizileme sonuçları. Dizilerdeki kırmızı, mavi ve gri yazı tipleri sırasıyla hedef siteleri, PAM'yi ve eklemeleri temsil eder. Kırmızı çizgiler silinmiş nükleotidleri gösterir. (E) Hem sgRNA-1 hem de sgRNA-2 tarafından düzenlendikten sonra PeVDE fragmanının Sanger dizileme sonuçları. Bu rakam9'dan değiştirildi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: PeCCR5'in gen düzenlemesini taramak için bir raportör olarak PeVDE sgRNA. (A) PeVDE ve PeCCR5 sgRNA'ları içeren CRISPR/Cas9 yapılarının şematik gösterimi. (B) NPQ ve (A)'daki yapılarla enfeksiyondan sonra bambu yapraklarının ham görüntüleri. Beyaz üçgenler, daha düşük NPQ değerlerine sahip alanları gösterir. Gökkuşağı rengi, kırmızının minimum değere ve morun 1'e karşılık geldiği NPQ/4 değerini temsil eder. (C) Dizilerdeki kırmızı, mavi ve gri yazı tipleri sırasıyla hedef siteleri, PAM'yi ve eklemeleri temsil eder. Kırmızı çizgiler silinmiş nükleotidleri gösterir. Bu rakam9'dan değiştirildi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Gen adı | Astar dizisi (5'-3') | Uygulama | ||
| YAKUT | F: ATGGATCATGCGACCCTCG | Enfekte bambu yapraklarında PCR amplifikasyonu için | ||
| R: GTACTCGTAGAGCTGCTGCAC | ||||
| PeVDE (Cesaret) | F: TGTGGCTTCTAAAGCTCTGCAATCT | Gen klonlama ve dizileme için | ||
| R: TGTCAATGCTACAAGTCCTGGCA | ||||
| PeVDE-Hedef1 | F: GGCATAGCCCTCACGCAGCACCGG | PeVDE sgRNA-1 hedefini tasarlamak için | ||
| R: AAACCCGGTGCTGCGTGAGGGCTA | ||||
| PeVDE-Hedef2 | F: GGCACTCCACGGTCCCAAATCTAG | PeVDE sgRNA-2 hedefini tasarlamak için | ||
| R: AAACCTAGATTTGGGACCGTGGAG | ||||
| PeCCR5-Hedef | F: GGCACTGGTACTGCTACGCTAAGA | PeCCR5 sgRNA hedefini tasarlamak için | ||
| R: AAACTCTTAGCGTAGCAGTACCAG | ||||
Tablo 1: Primerlerin sıra bilgileri.
Tartışmalar
Bu yöntem, tipik olarak 1-2 yıl süren geleneksel genetik transformasyon yöntemlerine kıyasla gereken süreyi önemli ölçüde azaltır ve 5 gün içinde eksojen genlerin geçici ekspresyonunu ve endojen genlerin gen düzenlemesini sağlar. Bununla birlikte, bu yöntemin sınırlamaları vardır, çünkü hücrelerin yalnızca küçük bir kısmını dönüştürebilir ve gen düzenlenmiş yapraklar kimeriktir ve tam bitkilere dönüşme yeteneğinden yoksundur. Bununla birlikte, planta gen ekspresyonu ve gen düzenleme teknolojisindeki bu, endojen bambu genlerinin fonksiyonel olarak doğrulanması için güçlü bir yaklaşım sağlar.
Şu anda, planta'da gen ekspresyonu ve gen düzenleme teknolojisi, olgun yapraklarda değil, sadece olgunlaşmamış (kıvrılmış) yapraklarda gerçekleştirilebilir. Yapraklar açılıp büyüdükçe, bölünmeye uğrayan gen düzenlenmiş hücrelerin sayısı artar ve belirli yaprak bölgelerinde gen düzenlemesine izin verir. Bununla birlikte, kullanılan Agrobacterium aracılı transformasyon yöntemi, eksojen T-DNA'nın bambu kromozomuna eklenmesiyle sonuçlanmaz, bu da bambu 6,9'da kararlı işaretleyici genlerin kullanılmasını zorlaştırır. Bu nedenle, bu bölgelerin tam yerlerini belirlemek zordur. Bunu ele almak için, PeVDE geni düzenlendi ve düzenlenen alan, bir klorofil florometre görüntüleme-PAM kullanılarak kolayca tespit edilebilen daha düşük NPQ değerleri ile gösterildiği gibi, yüksek ışık tedavisi altında azalmış bir foto koruma yeteneği sergiledi. Bu nedenle, PeVDE, eksojen gen ekspresyonu ve gen düzenlemesinin oluşumunu tespit etmek için bambuda bir belirteç olarak geliştirilmiştir. Bu genin farklı türler arasında yüksek korunması nedeniyle 13, diğer bitkilere de yaygın olarak uygulanabilir.
Bambu yapraklarının epidermisi üzerinde kütiküler bir balmumu tabakasının birikmesi nedeniyle, olgunlaşmamış yaprakların karakteristik kıvrılmış ve sıkıca sarılmış morfolojisi ile birleştiğinde, Agrobacterium'un yaprak hücrelerine erişilebilirliği önemli ölçüde engellenir. Agrobacterium enfeksiyonunun etkinliğini artırmak için, Agrobacterium'un kapalı kıvrılmış bambu yapraklarına girmesini teşvik etmek için yara ve vakum infiltrasyonu dahil olmak üzere fiziksel yaklaşımlar kullanılmıştır. Bu işlem, Agrobacterium ve yaprak hücreleri arasında yakınlık sağlar, böylece genetik dönüşümün verimliliğini arttırır. Bu arada, bu gen düzenleme sistemi şimdiye kadar bambu yapraklarıyla sınırlıydı ve gelecek nesiller tarafından miras alınabilecek tohumlar ve yan tomurcuklar gibi üreme kabiliyetine sahip organlarda ifade edilemiyor. Tekniğin gelecekteki uygulamaları, istikrarlı bir şekilde kalıtsal rejenere bitkiler elde etmeyi amaçlayan, üreme kabiliyetine sahip organlarda planta gen ekspresyonu ve gen düzenleme teknolojisi elde etmek için optimize edilecektir.
Açıklamalar
Yazarlar herhangi bir çıkar çatışması olmadığını beyan ederler.
Teşekkürler
Yazarlar, mali destek için Çin Ulusal Anahtar Araştırma ve Geliştirme Programına (Hibe No. 2021YFD2200502), Çin Ulusal Doğa Bilimleri Vakfı'na (Hibe No. 31971736) teşekkür eder.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 35S::RUBY | Addgene, United States | 160908 | Plamid construct |
| Agrobacterium competent cells of GV3101, EHA105,LBA4404, and AGL1 | Biomed, China | BC304-01, BC303-01, BC301-01, and BC302-01 | For Agrobacterium infection |
| CTAB | Sigma-Aldrich, United States | 57-09-0 | DNA extraction |
| Imaging-PAM fluorometer | Walz, Effeltrich, Germany | Detect chlorophyll fluorescence of bamboo leaves | |
| ImagingWin | Walz, Effeltrich, Germany | Software for Imaging-PAM fluorometer | |
| Paq CI or Aar I | NEB, United States | R0745S | Incorporate the target sequence onto the CRISPR/Cas9 vector. |
| PrimeSTAR Max DNA polymerase | Takara, Japan | R045Q | For gene cloning |
| T4 DNA ligase | NEB, United States | M0202V | Incorporate the target sequence onto the CRISPR/Cas9 vector. |
Referanslar
- Jiang, Z. H. World Bamboo and Rattan (in Chinese). , Liaoning Science and Technology Publishing House. Shenyang, China. (2002).
- Ye, S., et al. An efficient plant regeneration and transformation system of ma bamboo (Dendrocalamus latiflorus Munro) started from young shoot as explant. Frontiers in Plant Science. 8, 1298(2017).
- Ye, S., et al. Robust CRISPR/Cas9 mediated genome editing and its application in manipulating plant height in the first generation of hexaploid Ma bamboo (Dendrocalamus latiflorus Munro). Plant Biotechnology Journal. 18 (7), 1501-1503 (2020).
- Xiang, M., et al. Production of purple Ma bamboo (Dendrocalamus latiflorus Munro) with enhanced drought and cold stress tolerance by engineering anthocyanin biosynthesis. Planta. 254 (3), 50(2021).
- Huang, B., et al. An efficient genetic transformation and CRISPR/Cas9-based genome editing system for moso bamboo (Phyllostachys edulis). Frontiers in Plant Science. 13, 822022(2022).
- Lee, M. W., Yang, Y. Transient expression assay by agroinfiltration of leaves. Methods in Molecular Biology. 323, 225-229 (2006).
- Canto, T. Transient expression systems in plants: potentialities and constraints. Advances in Experimental Medicine and Biology. 896, 287-301 (2016).
- Chen, L., et al. A method for the production and expedient screening of CRISPR/Cas9-mediated non-transgenic mutant plants. Horticulture Research. 5, 13(2018).
- Sun, H., et al. A new biotechnology for in-planta gene editing and its application in promoting flavonoid biosynthesis in bamboo leaves. Plant Methods. 19 (1), 20(2023).
- He, Y., Zhang, T., Sun, H., Zhan, H., Zhao, Y. A reporter for noninvasively monitoring gene expression and plant transformation. Horticulture Research. 7 (1), 152(2020).
- Wang, C., Shen, L., Fu, Y., Yan, C., Wang, K. A simple CRISPR/Cas9 system for multiplex genome editing in rice. Journal of Genetics and Genomics. 42 (12), 703-706 (2015).
- McCormick, S., et al. Leaf disc transformation of cultivated tomato (L. esculentum) using Agrobacterium tumefaciens. Plant Cell Reports. 5 (2), 81-84 (1986).
- Lou, Y., et al. a violaxanthin de-epoxidase gene from moso bamboo, confers photoprotection ability in transgenic Arabidopsis under high light. Frontiers in Plant Science. 13, 927949(2022).
- Zhou, R., et al. Distinct cinnamoyl CoA reductases involved in parallel routes to lignin in Medicago truncatula. Proceedings of the National Academy of Sciences of the United States of America. 107 (41), 17803-17808 (2010).
- De Roeck, A., et al. Deleterious ABCA7 mutations and transcript rescue mechanisms in early onset Alzheimer's disease. Acta Neuropathologica. 134 (3), 475-487 (2017).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır